Генетика, 2020, T. 56, № 5, стр. 592-601
Влияние нокаута гена THBS1 на формирование радиационно-индуцированного клеточного ответа в модельной системе in vitro
Р. Р. Савченко 1, *, С. А. Васильев 1, В. С. Фишман 2, Е. С. Сухих 3, 4, Л. Г. Сухих 4, А. А. Мурашкина 5, И. Н. Лебедев 1
1 Научно-исследовательский институт медицинской генетики, Томский национальный исследовательский медицинский центр Российской академии наук
634050 Томск, Россия
2 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
3 Томский областной онкологический диспансер
634050 Томск, Россия
4 Национальный исследовательский Томский политехнический университет
634050 Томск, Россия
5 Национальный исследовательский Томский государственный университет
634050 Томск, Россия
* E-mail: renata.savchenko@medgenetics.ru
Поступила в редакцию 06.05.2019
После доработки 25.07.2019
Принята к публикации 30.07.2019
Аннотация
Проведен анализ влияния нокаута гена THBS1 на выживаемость опухолевых клеток человека, частоту спонтанных и радиационно-индуцированных микроядер, а также на профиль экспрессии генов в модельной системе in vitro. Показано, что клеточная линия HeLa, нокаутная по гену THBS1, характеризуется снижением способности к образованию колоний до и после облучения (в 1.4 раза, p = 0.0002 и в 1.7 раз, p = 0.00009 соответственно), повышением частоты спонтанных и радиационно-индуцированных микроядер (в 1.9 раз, p = 0.02 и в 2.5 раза, p = 0.01 соответственно) и дифференциальной экспрессией генов, участвующих в процессах апоптоза, репарации ДНК и контроле клеточного цикла на стадии G2/M. Таким образом, нокаут гена THBS1 приводит к повышению радиочувствительности клеток HeLa в модельной системе in vitro, что свидетельствует о возможной роли данного гена в регуляции радиационно-индуцированного клеточного ответа.
Воздействие ионизирующего излучения на клетки человека вызывает значительные повреждения генетического материала, приводящие к гибели клеток и индукции мутаций. Способность клеток восстанавливать поврежденные молекулы ДНК, обеспечивать нормальное функционирование сигнальных путей, контрольных точек клеточного цикла и запуск программы апоптоза варьирует на уровне различных типов клеток, тканей и целых организмов, составляя феномен индивидуальной радиочувствительности. Известно, что в основе данного феномена лежат генетические причины, такие как вариации на уровне последовательности ДНК или экспрессии генов репарации ДНК, а также метаболизма ксенобиотиков и антиоксидантной защиты [1]. Известно, что клетки, нокаутные по генам, продукты которых участвуют в процессах репарации ДНК, характеризуются повышенной радиочувствительностью [2], однако нарушение работы данных генов значительно снижает жизнеспособность организма и приводит к гибели или формированию наследственных синдромов, в частности синдрома Ниймегена, пигментной ксеродермы, атаксии-телеангиэктазии и ряда других [3, 4]. Поэтому, вероятно индивидуальную радиочувствительность здоровых индивидов определяют гены с менее выраженным влиянием на жизнеспособность, например косвенные участники радиационно-индуцированного ответа, преимущественно обеспечивающие сигнальные функции.
Проведенные нами ранее эксперименты позволили выявить связь дифференциальной экспрессии гена THBS1 у индивидов с различным спонтанным уровнем фокусов белков репарации γH2AX и частотой радиационно-индуцированных микроядер в лимфоцитах периферической крови человека [5]. Ген THBS1 кодирует тромбоспондин-1 – гомотримерный гликопротеин внеклеточного матрикса, С-терминальный домен которого обеспечивает связывание с рецептором CD47 [6]. По данным базы The Human Protein Atlas (https://www.proteinatlas.org/), THBS1 экспрессируется практически во всех тканях организма, включая опухолевые клетки различного происхождения, а кодируемый им белок участвует в реализации сигнальных путей, таких как пути TGFβ [7–11], VEGF [12, 13], NO-сигнальный путь [14, 15] и некоторые другие. Так, взаимодействуя с рецепторами CD47 и CD36, тромбоспондин-1 выступает эндогенным ингибитором ангиогенеза через негативную регуляцию NO-опосредованной передачи сигналов в эндотелиальных клетках, гладкомышечных клетках кровеносных сосудов и тромбоцитах [16–19]. Кроме того, связывание тромбоспондина-1 с рецептором CD47 может ингибировать как ранние активирующие сигналы эндотелиальной синтазы оксида азота, так и независимую от оксида азота передачу сигналов через рецептор фактора роста эндотелия сосудов 2 (VEGFR2), что также приводит к подавлению ангиогенеза [12, 13]. Помимо эффектов, реализуемых через взаимодействия с CD47, центральная область тромбоспондина-1, называемая 3TSR, может связываться с мембранным рецептором CD36, что также влечет за собой ингибирование ангиогенеза [20].
Кроме влияния на ангиогенез, тромбоспондин-1 регулирует ряд процессов, связанных с поведением и устойчивостью опухолевых клеток к терапии. Среди них адгезия [21] и пролиферация опухолевых клеток [22], выживание или апоптоз [23–25], опухолевая инвазия и метастазирование [26, 27], воспаление, иммунный ответ [28] и ответ опухоли на терапию [21, 29]. Влияние тромбоспондина-1 на эти процессы является многогранным и часто противоположным в зависимости от его концентрации, происхождения опухоли, а также молекулярного и клеточного состава ее микроокружения. Так например было показано, что связывание тромбоспондина-1 с рецептором CD47 вызывает гибель опухолевых клеток при раке молочной железы [23], но блокирует апоптоз и способствует развитию лекарственной устойчивости клеток карциномы щитовидной железы [25]. Кроме того, описано селективное действие тромбоспондина-1 на здоровые и опухолевые ткани. В исследовании J.S. Isenberg с соавт. отмечалось, что мыши с нокаутом гена Thbs1, сохраняли радиочувствительность опухолевых тканей, демонстрируя при этом снижение гибели мышечных клеток и клеток костного мозга через 12 часов после облучения, а также минимальные радиационные повреждения кожных покровов и мышц через два месяца после воздействия радиацией [30]. Схожие эффекты были характерны и для мышей, лишенных рецептора CD47 [30]. В связи с этим, целью настоящего исследования был анализ влияния нокаута гена THBS1 на выживаемость, частоту спонтанных и радиационно-индуцированных микроядер, а также полнотранскриптомный профиль экспрессии генов в модельной системе in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Создание нокаутной клеточной линии
Клеточная линия с нокаутом гена THBS1 была получена на основании исходной линии HeLa, любезно предоставленной к.б.н. М.А. Булдаковым (НИИ онкологии Томского НИМЦ РАН). Нокаутная клеточная линия была создана с помощью технологии редактирования генома CRISPR/Cas9 путем введения в последовательность гена THBS1 мутации, приводящей к отсутствию нормального продукта транскрипции. Олигонуклеотиды, содержащие целевую последовательность sgRNA и липкие концы для встраивания в плазмиду, были синтезированы в ООО “Биоссет” (г. Новосибирск). Подбор последовательностей sgRNA производился с помощью биоинформационного ресурса sgRNAScorer (https://crispr.med.harvard.edu/ sgRNAScorer/). Для повышения эффективности введения мутаций были одновременно использованы две последовательности sgRNA, представленные в табл. 1. В качестве вектора для клонирования был использован gRNA cloning vector BsmBI.
Таблица 1.
Олигонуклеотиды, использованные для создания и анализа клеточной линии с нокаутом гена THBS1
| Наименование | Последовательность |
|---|---|
| THBS1_gRNA1_F | 5'-CACCGTGACATCTTTGAACTCACCGGTT-3' |
| THBS1_gRNA1_R | 5'-CTAAAACCGGTGAGTTCAAAGATGTCAC-3' |
| THBS1_gRNA2_F | 5'-CACCGTCTGGGCGCCGACTGGTGAAGTT-3' |
| THBS1_gRNA2_R | 5'-CTAAAACTTCACCAGTCGGCGCCCAGACC-3' |
| THBS1_F | 5'-ACTTTGTGTTCTCTCCTGTCTAA-3' |
| THBS1_R | 5'-GCATCCTCGATGCGGAAA-3' |
| THBS1_exp_F | 5'-CCAATGCCACAGTTCCTGA-3' |
| THBS1_exp_R | 5'-TTGCCACAGCTCGTAGAACA-3' |
| ACTB_F | 5'-GAGAAGATGACCCAGATCATGTT-3' |
| ACTB_R | 5'-ATAGCACAGCCTGGATAGCAA-3' |
| GAPDH_F | 5'-GCCAGCCGAGCCACATC-3' |
| GAPDH_R | 5'-GGCAACAATATCCACTTTACCAGA-3' |
Примечание. THBS1_gRNA – последовательности sgRNA прямой и обратной цепи (два варианта), полужирным шрифтом выделены последовательности sgRNA; THBS1_F(R) – праймеры, фланкирующие сайты редактирования, использованные для таргетного массового параллельного секвенирования; THBS1_exp_F(R), ACTB_F(R) и GAPDH_F(R) – праймеры для оценки экспрессии гена THBS1 и референсных генов ACTB и GAPDH в нокаутной клеточной линии с помощью количественной ПЦР в реальном времени.
Последовательность фрагментов гена, содержащих мутации, была установлена с помощью таргетного секвенирования нового поколения на секвенаторе MiSeq с использованием олигонуклеотидных праймеров (табл. 1) и набора секвенирующих реагентов MiSeq Nano v2 (Illumina, США). Полученные риды картировались на исходную последовательность ампликонов на базе геномной сборки hg38.
Воздействие ионизирующим излучением
Воздействие γ-излучением проводилось с мощностью дозы 1 Гр/мин при комнатной температуре в дозах 2, 4, 6 и 8 Гр для оценки способности клеток к образованию колоний, а также в дозе 2 Гр для оценки частоты микроядер и уровня экспрессии генов. Облучение проводили на базе Областного онкологического диспансера (г. Томск) на гамма-терапевтическом аппарате Theratron Equinox (Best Theratronics, Канада). Транспортировка клеток осуществлялась на льду.
Анализ способности клеток к образованию колоний
Клеточную линию HeLa и линию с нокаутом гена THBS1 культивировали в питательной среде DMEM (ПанЭко, Россия) с добавлением 10%-ной эмбриональной телячьей сыворотки (FBS) (Gibco, Thermo Fisher Scientific, США) при 37°С в условиях 5%-ного CO2. Для оценки способности клеток к образованию колоний клеточные культуры растили во флаконах Т-25 (TPP, Швейцария) в течение двух пассажей до 70% площади покрытия, после чего производили пересев в шестилуночные планшеты (TPP, Швейцария) в количестве 0.6 × 106 клеток/мл. Затем клетки подвергали воздействию γ-излучения, после которого клетки снимались трипсином с последующим подсчетом и посевом в новые шести-луночные планшеты. Далее клеточные линии культивировали в CO2-инкубаторе (Panasonic, Япония) при 37°С со сменой среды каждые трое суток. По истечении двух недель колонии фиксировались метанол-уксусной кислотой (3 : 1) с последующей инкубацией с красителем Гимза (ПанЭко, Россия). Число колоний оценивалось визуально, после чего по следующей формуле вычислялась эффективность посева (ЭП):
Анализ частоты микроядер
Для оценки частоты микроядер для каждой клеточной линии было подготовлено по два флакона T‑25 (TPP, Швейцария), содержащих 1 × 106 клеток. После облучения была проведена смена питательной среды, после чего флаконы с клеточными культурами были перенесены в CO2-инкубатор на 24 ч при 37°С. По истечении 24 ч клетки фиксировались с использованием метанол-уксусной кислоты (3 : 1).
Препараты микроядер были изготовлены путем раскапывания на предметные стекла 20 мкл полученной клеточной суспензии с последующим заключением в среду Vectashield, содержащую краситель DAPI (VectorLab, США), под покровные стекла. Частота микроядер оценивалась с помощью микроскопа Axio Imager Z2 (Zeiss, Германия) с автоматической системой регистрации препаратов Metafer (Metasystems, Германия) при увеличении 630×. Для каждой клеточной линии была оценена частота микроядер в 1000 облученных и 2000 необлученных клеток.
Анализ экспрессии генов
Культивирование клеточных линий для эксперимента по оценке экспрессии генов было проведено в тех же условиях, что и в описанных выше экспериментах. После облучения клеточные линии помещали в CO2-инкубатор на 30 мин при 37°С. По истечении 30 мин из флаконов с клеточными линиями удаляли среду для культивирования, проводили отмывку в фосфатном буфере (1× PBS), лизировали клетки с помощью реагента “Лира” (Биолабмикс, Россия) и проводили выделение РНК по протоколу, рекомендованному производителем. После выделения образцы РНК были очищены с помощью набора RNeasy Mini Kit (Qiagen, Германия) с последующей оценкой качества на биоанализаторе Agilent 2100 Bioanalyzer (Agilent Technologies, США).
Полученная РНК была использована для оценки экспрессии генов в исходной клеточной линии HeLa и в линии с нокаутом гена THBS1 до облучения и через 30 мин после воздействия γ-излучения в дозе 2 Гр. Мечение и гибридизация на экспрессионных микрочипах SurePrint G3 Human Gene Expression v2 8 × 60 K (Agilent Technologies, США) были проведены по протоколу, рекомендованному производителем (версия 6.9.1 от декабря 2015 г.).
Для анализа экспрессии гена THBS1 в нокаутной клеточной линии HeLa с помощью ПЦР в реальном времени была проведена обратная транскрипция с использованием набора реактивов ОТ-M-MuLV-RH (Биолабмикс, Россия) по протоколу, рекомендованному производителем. Реакция ПЦР в реальном времени проводилась на амплификаторе AriaMx (Agilent Technologies, США) с использованием синтезированных праймеров (табл. 1) и буфера для проведения количественной ПЦР в реальном времени БиоМастер HS-qPCR SYBR Blue (Биолабмикс, Россия) по протоколу производителя. В качестве референсных генов были использованы гены домашнего хозяйства ACTB и GAPDH (табл. 1).
Исследование было выполнено на базе Центра коллективного пользования “Медицинская геномика” НИИ медицинской генетики Томского НИМЦ.
Статистическая обработка
Статистический анализ данных, полученных в экспериментах по оценке способности клеток к формированию колоний и частоты микроядер, был проведен с помощью t-критерия Стьюдента в программном пакете Statistica 10 (Statsoft). Статистическая обработка результатов полнотранскриптомного экспрессионного анализа была проведена с помощью программной среды R для статистического анализа с использованием программы Limma от Bioconductor на log2-трансформированных данных при условии фоновой коррекции необработанных данных чипов и межчиповой квантильной нормализации. Статистический анализ различий уровня экспрессии в каждой группе сравнения был проведен с помощью модифицированного t-критерия Стьюдента с оценкой значений доли ложноположительного предсказания (False Discovery Rate – FDR) и поправкой на множественность сравнения по методу Бенджамини–Хохберга. Были сформированы списки генов, экспрессия которых статистически значимо (p ≤ 0.05) изменялась более чем в два раза по сравнению с исходной линией HeLa, а также два списка, полученных после применения поправки на множественность сравнения Бенджамини–Хохберга (FDR < 0.4 и FDR < 0.05). Кроме того, с помощью инструмента STRING (https://string-db.org/) для дифференциально экспрессирующихся генов были построены сети функциональных взаимодействий на уровне белков.
РЕЗУЛЬТАТЫ
В настоящем исследовании была получена клеточная линия HeLa с нокаутом гена THBS1. Применение таргетного секвенирования нового поколения позволило установить характер мутаций, внесенных в ген THBS1 с помощью технологии редактирования генома CRISPR/Cas9. Было установлено, что полученная клеточная линия HeLa является компаундной гетерозиготой по различным мутациям в экзоне 3 гена THBS1 (рис. 1,а). Так, один из аллелей характеризовался делецией нуклеотида, приводящей к сдвигу рамки считывания на протяжении 37 пн, после чего инсерция другого нуклеотида выравнивала рамку считывания (49.3% прочтений, среднее покрытие – 73 прочтения на нуклеотид). В результате внесения данных мутаций была изменена последовательность из 13 аминокислотных остатков (37–49). Второй аллель характеризовался делецией 39 пн, что приводило к потере тех же 13 аминокислотных остатков в конечном белковом продукте (45.2% прочтений). Полногеномное секвенирование с целью поиска нецелевых мутаций не проводилось, что оставляет потенциальную возможность введения дополнительных неохарактеризованных мутаций.
Рис. 1.
Нокаут THBS1 и его влияние на способность клеток к формированию колоний и частоту радиационно-индуцированных микроядер в клеточной линии HeLa. а – последовательность мутаций, введенных в ген THBS1, wt – референсная последовательность, красным шрифтом выделены направляющие РНК, подчеркнуты участки мотива смежного с протоспейсером (protospacer adjacent motif, PAM); б – экспрессия гена THBS1 в исходной и нокаутной клеточной линии HeLa; в – частота микроядер в клеточной линии с нокаутом гена THBS1 по сравнению с исходной клеточной линией HeLa до и после облучения, p < 0.05; г – эффективность посева в клеточной линии с нокаутом THBS1 по сравнению с исходной клеточной линией HeLa до и после облучения, p < 0.01.
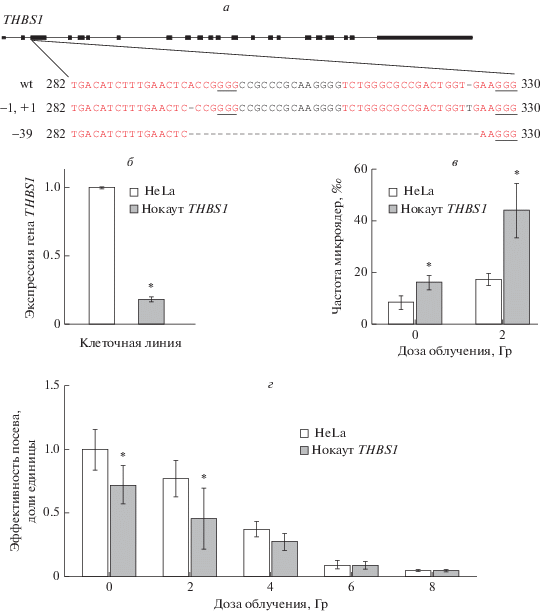
Анализ мутаций в гене THBS1 с помощью ресурса MutationTaster (http://www.mutationtaster.org/) показал прогнозируемую потерю домена, связывающего гепарин, а также возможную потерю функций остальных доменов вследствие изменения сайта сплайсинга. Таким образом, мутации в гене THBS1 в нокаутной клеточной линии HeLa вероятно приводят к существенным изменениям функции кодируемого белка. Кроме того, с помощью ПЦР в реальном времени было показано, что полученная нокаутная клеточная линия характеризуется снижением экспрессии гена THBS1 в 5.6 раз (p = 0.000002) по сравнению с исходной клеточной линией HeLa (рис. 1,б).
Эффективность посева, характеризующая способность клеток к формированию колоний, в необлученных клетках с нокаутом гена THBS1 была снижена в 1.4 раза (p = 0.0002) по сравнению с интактной линией HeLa и в 1.7 раз (p = 0.00009) после облучения в дозе 2 Гр, но не отличалась от эффективности посева в контроле при облучении более высокими дозами (рис. 1,г).
Частота спонтанных микроядер в нокаутной клеточной линии была в 1.9 раз (p = 0.02) выше, чем в интактной линии HeLa. Кроме того, после облучения в дозе 2 Гр в линии с нокаутом гена THBS1 частота радиационно-индуцированных микроядер в 2.5 раза превышала таковую в интактной клеточной линии HeLa (p = 0.01) (рис. 1,в).
Анализ транскрипционного профиля позволил зарегистрировать в нокаутной клеточной линии значимые изменения экспрессии 43 генов до облучения (23 гена повышали и 20 генов снижали уровень экспрессии), и 69 генов после облучения в дозе 2 Гр (36 гена повышали и 33 гена снижали уровень экспрессии) по сравнению с исходной клеточной линией HeLa (p < 0.05). После применения поправки на множественность сравнения оба списка были сокращены до семи генов (FDR < 0.40) (табл. 2).
Таблица 2.
Дифференциально экспрессирующиеся гены в клеточной линии с нокаутом гена THBS1 по сравнению с исходной клеточной линией HeLa
| 0 Гр | 2 Гр | ||
|---|---|---|---|
| повышение экспрессии (FDR < 0.4) |
снижение экспрессии (FDR < 0.4) |
повышение экспрессии (FDR < 0.4) | снижение экспрессии (FDR < 0.4) |
| SEPP1 | lnc-MRPL39-4 | LOC100506178 | FAM124A |
| TESC | FAM124A | LIF* | ENST00000549261* |
| LIF* | ENST00000549261* | TESC | EPB41L3 |
| GAGE7* | GAGE7* | ||
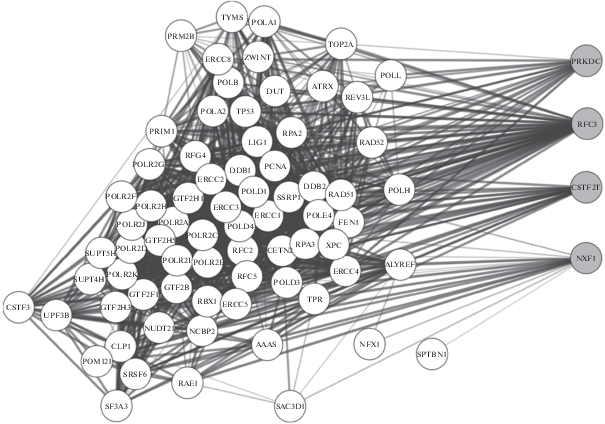
Для генов, дифференциально экспрессирующихся в клеточной линии с нокаутом THBS1 (отличия более чем в 2 раза, p < 0.05) с помощью инструмента STRING был проведен анализ значимых функциональных взаимодействий (score > 0.9) с генами, участвующими в процессах репарации ДНК, апоптоза и в работе G2/M контрольной точки клеточного цикла (база данных Molecular Signatures Database v6.2, http://software.broadinstitute.org/gsea/msigdb/index.jsp). Было показано, что ряд генов, дифференциально экспрессирующихся при нокауте гена THBS1, имеют значимые связи с данными процессами на уровне белков (табл. 3, рис. 2).
Таблица 3.
Дифференциально экспрессирующиеся гены в клеточной линии с нокаутом гена THBS1, связанные с процессами репарации ДНК, апоптозом и работой контрольной точки клеточного цикла на стадии G2/M
| Апоптоз | Репарация ДНК | Контрольная точка G2/M | |||
|---|---|---|---|---|---|
| 0 Гр | 2 Гр | 0 Гр | 2 Гр | 0 Гр | 2 Гр |
| CDK14 ↓ | CDK14 ↓ | CEP83 ↑ | CSTF2T ↓ | CDK14 ↓ | CDK14 ↓ |
| ESR2 ↓ | COG5 ↓ | CSTF2T ↓ | NXF1 ↓ | CSTF2T ↓ | CSTF2T↓ |
| HBS1L ↓ | HLA-DPA1 ↓ | HIF3A ↑ | PRKDC ↓ | HBS1L ↓ | NXF1 ↓ |
| HIF3A ↑ | HLA-DPB1 ↓ | HLA-DPA1 ↓ | RFC3 ↓ | HIF3A ↑ | PRKDC ↓ |
| HLA-DPA1↓ | HLA-DQB1 ↓ | HLA-DPB1 ↓ | RFC3 ↓ | ||
| HLA-DRA ↓ | HLA-DRA ↓ | HLA-DQB1 ↓ | |||
| NCALD ↑ | IFI44L ↓ | HLA-DRA ↓ | |||
| NGEF ↑ | NGEF ↑ | RNASET2 ↑ | |||
| SEPP1 ↑ | NXF1 ↓ | ||||
| PRKDC ↓ | |||||
| RFC3 ↓ | |||||
| SEPP1 ↑ | |||||
| SPTBN1 ↓ | |||||
Рис. 2.
Связи продуктов генов, изменяющих экспрессию в клеточной линии с нокаутом гена THBS1, с кластером белков репарации ДНК. Толщина линий пропорциональна силе связи. Серой заливкой обозначены продукты генов, дифференциально экспрессирующиеся в клеточной линии с нокаутом THBS1; белой заливкой обозначены белки, участвующие в процессах репарации ДНК.
ОБСУЖДЕНИЕ
Снижение эффективности посева в линии с нокаутом гена THBS1, наблюдаемое нами до облучения и после воздействия γ-излучения только в дозе 2 Гр, свидетельствует о влиянии нокаута данного гена на способность клеток к образованию колоний. Однако остается неясным, реализуется ли этот эффект через механизмы клеточной гибели или через нарушение процесса клеточного деления.
Среди генов, повышающих экспрессию при нокауте гена THBS1, были SEPP1, LIF и TESC (табл. 2), потенциально связанные с радиочувствительностью и выживаемостью клеток. Ген SEPP1 кодирует селенопротеин – антиоксидантный белок, активирующийся в ответ на воздействие радиации. Было показано, что нокдаун SEPP1 приводит к окислительному стрессу и снижению жизнеспособности миофибробластов, в то время как сверхэкспрессия данного гена влечет за собой снижение уровня поздних активных форм кислорода [31]. Повышенная экспрессия гена LIF, кодирующего цитокин из семейства ИЛ-6, способствовала росту и развитию радиорезистентности опухолевых клеток карциномы носоглотки in vitro [32]. Ген TESС, высоко экспрессирующийся в некоторых опухолевых клетках, кодирует Ca2+-связывающий белок, участвующий в процессах клеточного роста и дифференцировки [33]. Ген GAGE7, характеризующийся снижением экспрессии в нокаутной клеточной линии в нашем исследовании, кодирует опухолевый антиген 7. Повышенная экспрессия данного гена в клетках HeLa вызывает устойчивость к апоптозу, индуцированному fas-лигандом [34].
Нокаут гена THBS1 приводил не только к снижению способности клеток к образованию колоний, но и к повышению частоты спонтанных и радиационно-индуцированных микроядер по сравнению с исходной клеточной линией HeLa. Наблюдаемый фенотип может быть обусловлен нарушением процессов репарации ДНК или нарушением работы G2/M контрольной точки клеточного цикла в нокаутной клеточной линии. Так например ген PRKDC, снижающий экспрессию в линии с нокаутом THBS1 в нашем исследовании, кодирует каталитическую субъединицу ДНК-зависимой протеинкиназы – фермента, играющего ключевую роль в процессах репарации двунитевых разрывов ДНК и регуляции клеточной радиочувствительности [35]. Согласно литературным данным, нокдаун гена PRKDC приводит к нарушению функции ДНК-зависимой протеинкиназы и фенотипу, характерному для клеточного старения после облучения опухолевых клеток человека [36]. Кроме того, мутации данного гена были обнаружены у пациентов с нарушениями репарации двухцепочечных разрывов ДНК и процессов рекомбинации [37]. Обращают на себя внимание также гены NXF1, RFC3, CDK14 и ESR2, характеризующиеся сниженной экспрессией при нокауте THBS1. Так продукт гена NXF1 участвует в процессе экспорта зрелой мРНК из ядра в цитоплазму [38], ген RFC3 – кодирует субъединицу фактора репликации С, нокдаун данного гена ингибирует пролиферацию опухолевых клеток при аденокарциноме пищевода [39]. CDK14 кодирует белок из семейства циклин-зависимых киназ, участвующих в регуляции клеточного цикла [40], а через активацию рецептора эстрогена 2, кодируемого геном ESR2, реализуется антиапоптотическое действие в клетках медуллобластомы [41, 42].
Таким образом, тромбоспондин-1 является важным компонентом клеточного микроокружения. На основании полученных нами данных, можно предположить, что данный белок играет роль в формировании радиационно-индуцированного клеточного ответа, участвуя в процессах, приводящих к изменению эффективности репарации повреждений ДНК, нарушениям в контроле клеточного цикла на стадии G2/M и запуску программы апоптоза.
Исследование выполнено при поддержке гранта Президента Российской Федерации МК-5944.2018.4.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Andreassen C.N. Searching for genetic determinants of normal tissue radiosensitivity – are we on the right track? // Radiotherapy and Oncol. 2010. V. 97. № 1. P. 1–8. https://doi.org/10.1016/j.radonc.2010.07.018
Guo Z., Shu Y., Zhou H. et al. Radiogenomics helps to achieve personalized therapy by evaluating patient responses to radiation treatment // Carcinogenesis. 2015. V. 36. № 3. P. 307–317. https://doi.org/10.1093/carcin/bgv007
Surrallés J., Jackson S.P., Jasin M. et al. Molecular cross-talk among chromosome fragility syndromes // Genes & Development. 2004. V. 18. № 12. P. 1359–1370. https://doi.org/10.1101/gad.1216304
Chrzanowska K.H., Gregorek H., Dembowska-Bagińska B. et al. Nijmegen breakage syndrome (NBS) // Orphanet J. Rare Diseases. 2012. V. 7. № 1. P. 13. https://doi.org/10.1186/1750-1172-7-13
Васильев С.А. Особенности спонтанного и индуцированного мутагенеза в соматических клетках человека с различным эпигенетическим фоном: Дис. … д-ра биол. наук. Томск: ФГБНУ “Томский национальный исследовательский медицинский центр Российской академии наук”, 2018. 332 с.
Isenberg J.S., Annis D.S., Pendrak M.L. et al. Differential interactions of thrombospondin-1, -2, and -4 with CD47 and effects on cGMP signaling and ischemic injury responses // J. Biol. Chem. 2009. V. 284. № 2. P. 1116–1125. https://doi.org/10.1074/jbc.M804860200
Murphy-Ullrich J.E., Poczatek M. Activation of latent TGF-β by thrombospondin-1: mechanisms and physiology // Cytokine & Growth Factor Rev. 2000. V. 11. № 1–2. P. 59–69.
Daniel C., Wiede J., Krutzsch H.C. et al. Thrombospondin-1 is a major activator of TGF-β in fibrotic renal disease in the rat in vivo // Kidney International. 2004. V. 65. № 2. P. 459–468.
Nör J.E., DiPietro L., Murphy-Ullrich J.E. et al. Activation of latent TGF-β1 by Thrombospondin-1 is a major component of wound repair // Oral Biosci. & Med.: OBM. 2005. V. 2. № 2. P. 153.
Sweetwyne M.T., Murphy-Ullrich J.E. Thrombospondin-1 in tissue repair and fibrosis: TGF-β-dependent and independent mechanisms // Matrix Biol. 2012. V. 31. № 3. P. 178–186. https://doi.org/10.1016/j.matbio
Daubon T., Léon C., Clarke K. et al. Deciphering the complex role of thrombospondin-1 in glioblastoma development // Nature Communications. 2019. V. 10. № 1. P. 1146. https://doi.org/10.1038/s41467-019-08480-y
Kaur S., Martin-Manso G., Pendrak M.L. et al. Thrombospondin-1 inhibits VEGF receptor-2 signaling by disrupting its association with CD47 // J. Biol. Chem. 2010. V. 285. № 50. P. 38923–38932. https://doi.org/10.1074/jbc.M110.172304
Soto-Pantoja D.R., Kaur S., Roberts D.D. CD47 signaling pathways controlling cellular differentiation and responses to stress // Critical Rev. Biochem. Mol. Biol. 2015. V. 50. № 3. P. 212–230. https://doi.org/10.3109/10409238.2015.1014024
Zhao H., Han Z., Ji X. et al. Epigenetic regulation of oxidative stress in ischemic stroke // Aging Disease. 2016. V. 7. № 3. P. 295. https://doi.org/10.14336/AD.2015.1009
Roberts D.D., Kaur S., Isenberg J.S. Regulation of cellular redox signaling by matricellular proteins in vascular biology, immunology, and cancer // Antioxidants & Redox Signaling. 2017. V. 27. № 12. P. 874–911. https://doi.org/0.1089/ars.2017.7140
Isenberg J.S., Frazier W.A., Roberts D.D. Thrombospondin-1: a physiological regulator of nitric oxide signaling // Cell Mol. Life Sci. 2008. V. 65. № 5. P. 728–742. https://doi.org/10.1007/s00018-007-7488-x
Isenberg J.S., Martin-Manso G., Maxhimer J.B. et al. Regulation of nitric oxide signalling by thrombospondin-1: Implications for anti-angiogenic therapies // Nat. Rev. Cancer. 2009. V. 9. № 3. P. 182. https://doi.org/10.1038/nrc2561
Isenberg J.S., Shiva S., Gladwin M. Thrombospondin-1–CD47 blockade and exogenous nitrite enhance ischemic tissue survival, blood flow and angiogenesis via coupled NO–cGMP pathway activation // Nitric Oxide. 2009. V. 21. № 1. P. 52–62. https://doi.org/10.1016/j.niox.2009.05.005
Zhang X., Kazerounian S., Duquette M. et al. Thrombospondin-1 modulates vascular endothelial growth factor activity at the receptor level // The FASEB Journal. 2009. V. 23. № 10. P. 3368–3376. https://doi.org/10.1096/fj.09-131649
Jeanne A., Schneider C., Martiny L. et al. Original insights on thrombospondin-1-related antireceptor strategies in cancer // Frontiers in Pharmacology. 2015. V. 6. P. 252. https://doi.org/10.3389/fphar.2015.00252
Li S.S., Liu Z., Uzunel M. et al. Endogenous thrombospondin-1 is a cell-surface ligand for regulation of integrin-dependent T-lymphocyte adhesion // Blood. 2006. V. 108. № 9. P. 3112–3120. https://doi.org/10.1182/blood-2006-04-016832
Sick E., Jeanne A., Schneider C. et al. CD47 update: a multifaceted actor in the tumour microenvironment of potential therapeutic interest // Brit. J. Pharmacol. 2012. V. 167. № 7. P. 1415–1430. https://doi.org/10.1111/j.1476-5381.2012.02099.x
Manna P.P., Dimitry J., Oldenborg P.A., Frazier W.A. CD47 augments Fas/CD95-mediated apoptosis // J. Biol. Chem. 2005. V. 280. № 33. P. 29637–29644. https://doi.org/10.1074/jbc.M500922200
Saumet A., Slimane M.B., Lanotte M. et al. Type 3 repeat/C-terminal domain of thrombospondin-1 triggers caspase-independent cell death through CD47/αvβ3 in promyelocytic leukemia NB4 cells // Blood. 2005. V. 106. № 2. P. 658–667. https://doi.org/10.1182/blood-2004-09-3585
Rath G.M., Schneider C., Dedieu S. et al. The C-terminal CD47/IAP-binding domain of thrombospondin-1 prevents camptothecin-and doxorubicin-induced apoptosis in human thyroid carcinoma cells // Biochim. Biophys. Acta (BBA)-Mol. Cell Res. 2006. V. 1763. № 10. P. 1125–1134. https://doi.org/10.1016/j.bbamcr.2006.08.001
Jayachandran A., Anaka M., Prithviraj P. et al. Thrombospondin-1 promotes an aggressive phenotype through epithelial-to-mesenchymal transition in human melanoma // Oncotarget. 2014. V. 5. № 14. P. 5782. https://doi.org/10.18632/oncotarget.2164
Borsotti P., Ghilardi C., Ostano P. et al. Thrombospondin-1 is part of a Slug-independent motility and metastatic program in cutaneous melanoma, in association with VEGFR-1 and FGF-2 // Pigment Cell & Melanoma Res. 2015. V. 28. № 1. P. 73–81. https://doi.org/10.1111/pcmr.12319
Grimbert P., Bouguermouh S., Baba N. et al. Thrombospondin/CD47 interaction: A pathway to generate regulatory T cells from human CD4+ CD25− T cells in response to inflammation // J. Immunol. 2006. V. 177. № 6. P. 3534–3541.
Bi J., Bai Z., Ma X. et al. Txr1: An important factor in oxaliplatin resistance in gastric cancer // Med. Oncol. 2014. V. 31. № 2. P. 807. https://doi.org/10.1007/s12032-013-0807-1
Isenberg J.S., Maxhimer J.B., Hyodo F. et al. Thrombospondin-1 and CD47 limit cell and tissue survival of radiation injury // Am. J. Pathol. 2008. V. 173. № 4. P. 1100–1112. https://doi.org/10.2353/ajpath.2008.080237
Eckers J.C., Kalen A.L., Xiao W. et al. Selenoprotein P inhibits radiation-induced late reactive oxygen species accumulation and normal cell injury // Inter. J. Rad. Oncol.* Biol.* Physics. 2013. V. 87. № 3. P. 619–625. https://doi.org/0.1016/j.ijrobp.2013.06.2063
Liu S.C., Tsang N.M., Chiang W.C. et al. Leukemia inhibitory factor promotes nasopharyngeal carcinoma progression and radioresistance // J. Clin. Investig. 2013. V. 123. № 12. P. 5269–5283. https://doi.org/10.1172/JCI63428
Kolobynina K.G., Solovyova V.V., Levay K. et al. Emerging roles of the single EF-hand Ca2+ sensor tescalcin in the regulation of gene expression, cell growth and differentiation // J. Cell Sci. 2016. V. 129. № 19. P. 3533–3540. https://doi.org/10.1242/jcs.191486
Cilensek Z.M., Yehiely F., Kular R.K., Deiss, L.P. A Member of the GAGE Family of Tumor Antigens is an Anti-Apoptotic Gene that Confers Resistance to Fas/CD95/APO-1, Interferon-g, Taxol and g-irradiation // Cancer Biol. & Therapy. 2002. V. 1. № 4. P. 379–386. https://doi.org/10.4161/cbt.1.4.11
Ihara M., Ashizawa K., Shichijo K., Kudo T. Expression of the DNA-dependent protein kinase catalytic subunit is associated with the radiosensitivity of human thyroid cancer cell lines // J. Rad. Res. 2018. V. 60. № 2. P. 171–177. https://doi.org/10.1093/jrr/rry097
Azad A., Jackson S., Cullinane C. et al. Inhibition of DNA-dependent protein kinase induces accelerated senescence in irradiated human cancer cells // Mol. Cancer Res. 2011. V. 9. № 12. P. 1696–1707. https://doi.org/10.1158/1541-7786.MCR-11-0312
Mathieu A.L., Verronese E., Rice G.I. et al. PRKDC mutations associated with immunodeficiency, granuloma, and autoimmune regulator-dependent autoimmunity // J. Allergy Clin. Immunol. 2015. V. 135. № 6. P. 1578–1588. https://doi.org/10.1016/j.jaci.2015.01.040
Heath C.G., Viphakone N., Wilson S.A. The role of TREX in gene expression and disease // Biochem. J. 2016. V. 473. № 19. P. 2911–2935. https://doi.org/10.1042/BCJ20160010
Lockwood W.W., Thu K.L., Lin L. et al. Integrative genomics identified RFC3 as an amplified candidate oncogene in esophageal adenocarcinoma // Clin. Cancer Res. 2012. V. 18. № 7. P. 1936–1946. https://doi.org/10.1158/1078-0432.CCR-11-1431
Malumbres M. Cyclin-dependent kinases // Genome Biol. 2014. V. 15. № 6. P. 122.
Wen Y., Perez E.J., Green P.S. et al. nNOS is involved in estrogen mediated neuroprotection in neuroblastoma cells // Neuroreport. 2004. V. 15. № 9. P. 1515–1518.
Cookman C.J., Belcher S.M. Estrogen receptor-β up-regulates IGF1R expression and activity to inhibit apoptosis and increase growth of medulloblastoma // Endocrinology. 2015. V. 156. № 7. P. 2395–2408. https://doi.org/10.1210/en.2015-1141
Дополнительные материалы отсутствуют.


