Генетика, 2020, T. 56, № 7, стр. 792-804
Генетическая дифференциация и филогенетические отношения Glycyrrhiza glabra L., G. uralensis Fisch. и G. korshinskyi Grig. по данным анализа изменчивости маркеров хлоропластной ДНК
Е. В. Хантемирова 1, *, А. Ю. Беляев 1, О. С. Корчагина 2, И. А. Лалетина 1
1 Институт экологии растений и животных Уральского отделения Российской академии наук
620144 Екатеринбург, Россия
2 Сахалинский филиал Ботанического сада-института Дальневосточного отделения
Российской академии наук
693023 Южно-Сахалинск, Россия
* E-mail: hantemirova@ipae.uran.ru
Поступила в редакцию 09.07.2019
После доработки 14.11.2019
Принята к публикации 20.01.2020
Аннотация
Проведено исследование изменчивости хлоропластной ДНК трех видов солодки Glycyrrhiza glabra L., G. uralensis Fisch. и G. korshinskyi Grig. в основной части ареала в Северной Евразии с использованием межгенных спейсеров 16S–trnA, trnS–trnG, atpH–atpI и trnH–psbA. В результате у 212 растений солодки в 40 популяциях и отдельных местонахождениях выявлено 14 гаплотипов. Обнаружены две основные генетические линии (западная и восточная) и значительная генетическая дифференциация между Glycyrrhiza glabra и G. uralensis (FST = 84%). В то же время полученные данные свидетельствуют об интрогрессивной гибридизации этих видов солодки в прошлом и в современных популяциях, находящихся в зонах контакта разных видов, на Южном Урале и в Зауралье. С этим процессом связано происхождение третьего вида солодки – G. korshinskyi. Результаты нашей работы показывают возможность использования исследованных регионов хпДНК в комбинации с другими молекулярными маркерами и морфологическими характеристиками растений для идентификации разных видов и гибридов солодки.
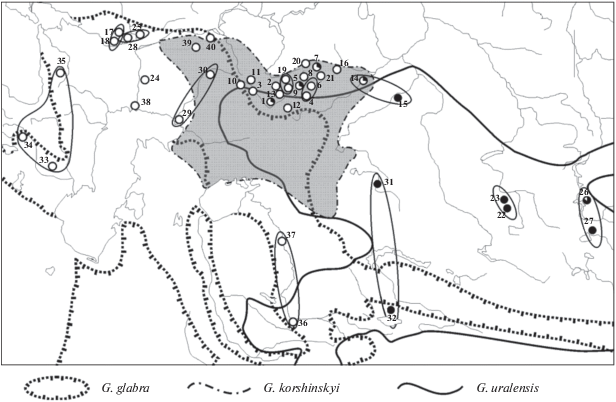
Солодка (Glycyrrhiza L.) с XIX в. и по настоящее время вызывает большой интерес исследователей и практиков разных специальностей. Это связано прежде всего с высокой ценностью и широкими возможностями использования некоторых видов солодки как лекарственно-технических растений. Наиболее известны среди них три вида: солодка голая (Glycyrrhiza glabra L.), солодка уральская (G. uralensis Fisch.) и солодка Коржинского (G. korshinskyi Grig.) [1]. Данные виды солодки имеют одинаковый диплоидный набор хромосом (2n = 16) [2]. Это длиннокорневищно-стержнекорневые поликарпики [3] с выраженной клоновой структурой популяций [4]. Их лекарственное сырье (корни и корневища) характеризуется сходными свойствами [5]. Первые два вида, включенные в государственные фармакопеи многих стран, в том числе и России [6], имеют обширные естественные ареалы в Евразии. Однако ненормированные заготовки сырья приводят к сокращению популяционных ареалов этих видов во многих регионах Северной Евразии. В некоторых регионах Российской Федерации, где находятся краевые части ареала солодки (в частности, на Урале и сопредельных территориях), G. glabra, G. uralensis, G. korshinskyi были отнесены к числу редких растений и включены в региональные Красные книги [7]. Ареалы G. glabra и G. uralensis охватывают значительную часть степного и пустынного биомов Евразии. Они включают также интразональные ландшафты речных пойм и приозерных ложбин, пояса степной и лесостепной растительности в горных системах Европы (Кавказ) и Азии (Памиро-Алай, Тянь-Шань и др.) [5, 8]. Ареал солодки Коржинского как бы вклинивается между ареалами двух других видов (рис. 1), и на пространстве от среднего течения Волги до Аральского моря и верховьев Ишима имеются зоны контактов и перекрывания ареалов указанных видов солодки [8].
Рис. 1.
Схема ареалов Glycyrrhiza glabra, G. uralensis и G. korshinskyi в Евразии. Серым цветом выделен ареал G. korshinskyi. 1–40 – номера популяций и отдельных образцов (см. табл. 1). Объединенные выборки обозначены овалами. В выборке доля гаплотипов, принадлежащая западной линии, обозначена белым цветом, а доля гаплотипов восточной линии – черным.
Солодка Коржинского (G. korshinskyi Grig.) в статусе вида была выделена из G. uralensis и описана Ю.С. Григорьевым по образцам из Западного Казахстана [9]. Как в плане ареалогии, так и по морфологическим признакам этот вид занял промежуточное положение между G. glabra и G. uralensis, и автор таксона выдвинул предположение о его гибридном происхождении (G. glabra L. × G. uralensis Fisch.).
Используемая нами в данной работе трактовка видов G. glabra и G. uralensis соответствует их пониманию в широком смысле (по Е.А. Кругановой) [10] и принята во многих современных флористических сводках [2, 11]. Однако существует иная, более дробная, таксономическая система рода Glycyrrhiza, в которой указанные выше G. glabra и G. uralensis представлены группами таксонов видового ранга [12]. Следует признать явно недостаточным преимущественное использование морфологического критерия для таксономических построений в отношении представителей рода Glycyrrhiza. Очевидно, что для выявления объективно существующей дифференциации солодок необходимы прямые доказательства генетических связей и эволюционных взаимоотношений выделяемых таксонов. Они могут быть получены с использованием молекулярно-генетических методов. Знание популяционно-генетической структуры видов солодки позволит отбирать для испытания в культуре наиболее разнообразный в генетическом отношении материал, организовать сохранение и рациональное использование генофонда солодки.
В отношении видов рода Glycyrrhiza L., как особо ценных лекарственных растений, проведение молекулярных исследований в значительной мере было обусловлено необходимостью их четкого разграничения. Так, на основе данных о содержании сапонинов и секвенировании последовательности rbcL [13, 14], а также в работах с использованием анализа ITS2 [15] установлено, что виды солодки, накапливающие глицирризин (G. glabra, G. uralensis, G. inflata), в генетическом отношении близки между собой, то есть могут рассматриваться как близкородственные. Использование маркера rbcL, кроме того, показало, что китайский вид G. inflata ближе к G. uralensis, чем к G. glabra [14]. В то же время в работе с применением большего числа маркеров, как ядерных, так и пластидных (ITS, rbcL matK, trnH–psbA), этот же вид оказался более тесно связан с G. glabra. При этом несколько образцов не получили точной оценки видовой принадлежности, а в исследованном материале были выявлены межвидовые гибриды солодки [16]. В недавней работе корейских исследователей G. uralensis и G. glabra хорошо разделились на филогенетическом дереве, построенном на основе анализа CAPS и HRA, однако некоторые образцы G. glabra оказались в одном кластере с G. uralensis [17]. Таким образом, точно определить видовую принадлежность ряда образцов солодки не удается. В чем причина таких разночтений, в явлении гибридизации или разном географическом происхождении образцов, еще предстоит выяснить. Кроме того, оказалось, что заволжско-казахстанский вид солодки G. korshinskyi в этих исследованиях совсем не фигурирует. Необходимо дальнейшее расширение исследований с использованием разных генетических маркеров и привлечением в анализ большого числа образцов разных видов солодки, имеющих различное географическое происхождение.
Предположение о том, что виды солодки гибридизируют между собой, высказывалось еще авторами “Флоры СССР” [18], но установленных фактов не было. В дальнейшем различными методами были получены прямые доказательства возможности возникновения и наличия в природных популяциях солодки межвидовых гибридов [19–21]. В связи с межвидовой гибридизацией структура генетического разнообразия в ареалах рассматриваемых видов солодки может оказаться очень сложной, а эволюционная история видов трудно восстановимой. Однако, как показали результаты наших предварительных исследований, эти вопросы могут быть успешно решены путем проведения анализа изменчивости межгенных спейсеров хпДНК, а также аллозимных маркеров [22, 23].
Существует мнение, что современные ареалы трех рассматриваемых видов солодки формировались с начала четвертичного периода, для которого были характерны миграции видов растений и животных в степной зоне. Тогда же могло возникнуть перекрывание ареалов G. glabra и G. uralensis, и в зоне этого перекрывания возник предположительно гибридный вид – G. korshinskyi [5].
На территориях, примыкающих к южной части Урала, перекрываются ареалы нескольких видов солодки, поэтому в филогеографических исследованиях они заслуживают особого внимания. По данным литературы и наших собственных исследований, проведенных с использованием морфометрических методов и аллозимного анализа [21, 23], на Южном Урале и прилегающих территориях Предуралья и Зауралья наряду с типичными “чистыми” популяциями солодки Коржинского выявлены смешанные и гибридные популяции, сформировавшиеся с участием разных видов солодки (G. korshinskiy, G. glabra и G. uralensis). Возможность естественной межвидовой гибридизации у солодки в уральской части ареала была подтверждена цитоэмбриологическими методами [20]. Гибридные формы в популяциях солодки помимо своеобразных сочетаний морфологических признаков характеризуются и различными вариантами сочетаний видоспецифичных аллелей аллозимных локусов [23].
Цель данной работы: изучение генетического разнообразия и филогенетических отношений близкородственных видов солодки (G. glabra, G. uralensis и G. korshinskyi) в центральной части Северной Евразии на основе анализа полиморфизма маркеров хлоропластной ДНК (хпДНК).
МАТЕРИАЛЫ И МЕТОДЫ
В наше исследование с использованием маркеров хпДНК включено 212 образцов растений. Они были собраны в период с 2003 по 2017 г. в природных популяциях, либо получены при проращивании семян или из живых коллекций Ботанического сада УрО РАН, представляющих отдельные местонахождения в ареалах G. korshinskyi, G. glabra и G. uralensis. Всего материал исследован из 40 местонахождений (табл. 1, рис. 1). Для генетического анализа в каждой исследуемой популяции растения, относящиеся к разным генотипам (клонам), отбирались случайным образом. Для выделения ДНК у этих растений использовали листья, замороженные и хранившиеся в морозильнике при ‒80°C, либо молодые побеги, появившиеся при проращивании в лаборатории на отрезках корневищ. ДНК видовых образцов различного географического происхождения выделяли также из листьев молодых растений, выращенных из семян в лаборатории. Был собран гербарий всех видов солодки. Ваучерные гербарные образцы большинства исследуемых растений хранятся в Музее ИЭРиЖ УрО РАН в г. Екатеринбурге (SVER), а также в лаборатории молекулярной экологии растений этого же института. Определение их видовой принадлежности или гибридного происхождения проведено специалистами ИЭРиЖ и Ботанического сада УрО РАН.
Таблица 1.
Исследуемые выборки видов Glycyrrhiza, распределение гаплотипов и параметры генетической изменчивости по данным хпДНК
| № | Популяция, местонахождение |
Координаты с.ш., в.д. |
N | Вид, гибрид |
Гаплотипы (число особей) |
h | π |
|---|---|---|---|---|---|---|---|
| 1 | Таналык | 51°55′32′′ 58°35′48′′ | 14 | к | Г5(8), Г8(6) | 0.53 | 0.0029 |
| 2 | Киндерли | 52°13′27′′ 58°29′9′′ | 5 | к | Г5(5) | 0.00 | 0.0000 |
| 3 | Донгуз | 51°43′47′′ 54°47′14′′ | 11 | к, к × у | Г5(4), Г6(5), Г7(2) | 0.69 | 0.0017 |
| 4 | Бреды | 52°27′20′′ 60°19′31′′ | 17 | к, к × у | Г5(11), Г6(6) | 0.47 | 0.0004 |
| 5 | Морозовка | 52°30′50′′ 59°54′39′′ | 1 | к | Г5(1) | ||
| 6 | Аркаим | 52°39′25′′ 59°37′55′′ | 16 | к, к × у | Г5(5), Г6(6), Г9(5) | 0.71 | 0.0017 |
| 7 | Степное | 52°11′54′′ 58°39′40′′ | 3 | к × у | Г5(2), Г9(1) | 0.67 | 0.0020 |
| 8 | Петропавловский | 54°01′50′′ 60°08′23′′ | 3 | к | Г5(2), Г6(1) | 0.67 | 0.0005 |
| 9 | Уртазымка | 52°09′12′′ 58°44′52′′ | 1 | к | Г6(1) | 1.00 | 0.0008 |
| 10 | Целинное | 52°11′54′′ 58°39′40′′ | 1 | к | Г5(1) | ||
| 11 | Краснохолм | 51°36′27′′ 54°02′29′′ | 13 | г, к × г, к × у | Г5(4), Г6(8), Г7(1) | 0.56 | 0.0010 |
| 12 | Домбаровский | 50°46′59′′ 59°33′35′′ | 6 | к | Г5(4), Г6(2) | 0.53 | 0.0004 |
| 13 | Бакаловка | 52°01′14′′ 58°28′18′′ | 8 | к | Г5(8) | 0.00 | 0.0000 |
| 14 | Озерное, Курганская обл. |
54°25′01′′ 64°33′10′′ | 10 | к, к × у, к × г | Г1(1), Г5(3), Г6(4), Г11(2) | 0.82 | 0.0025 |
| 15 | Ишим | 56°03′52′′ 69°33′00′′ | 1 | к, к × у | Г9(1) | ||
| 16 | Картабыз | 54°30′56′′ 62°32′16′′ | 6 | к | Г5(4), Г6(2) | 0.53 | 0.0004 |
| 17 | Суровикино | 48°34′03′′ 42°46′13′′ | 1 | г | Г5(1) | 0.80 | 0.0034 |
| 18 | Тормосин | 48°07′30′′ 42°44′06′′ | 4 | г | Г1(2), Г2(1), Г5(1) | ||
| 19 | р. Черная | 51°34′36′′ 54°09′18′′ | 17 | к, к × г | Г5(11), Г6(6) | 0.48 | 0.0004 |
| 20 | Уйское | 54°19′52′′ 59°49′50′′ | 3 | к | Г5(2), Г6(1) | 0.67 | 0.0005 |
| 21 | Троицкий заказник | 53°56′20′′ 61°14′16′′ | 17 | к | Г5(9), Г6(7), Г7(1) | 0.58 | 0.0007 |
| 22 | Рубцовск | 51°30′22′′ 81°14′27′′ | 8 | у | Г8(2), Г10(3), Г11(1), Г14(2) | 0.81 | 0.0022 |
| 23 | Поспелиха | 52°47′14′′ 82°07′50′′ | 1 | у | Г14(1) | ||
| 24 | Баскунчак | 48°08′01′′ 46°55′07′′ | 11 | г | Г1(1), Г2(6), Г5(4) | 0.62 | 0.0020 |
| 25 | Убсу-Нур, Монголия | 50°31′02′′ 93°15′55′′ | 1 | у | Г9(1) | 0.81 | 0.0015 |
| 26 | Минусинск | 53°37′02′′ 91°39′28′′ | 6 | у, г × у | Г5(1), Г12(2), Г13(3) | ||
| 27 | Иловля | 49°38′42′′ 44°18′25′′ | 4 | г | Г2(3), Г5(1) | 0.60 | 0.0013 |
| 28 | Парк Донской | 49°08′05′′ 43°51′20′′ | 1 | г | Г5(1) | ||
| 29 | р. Урал | 51°10′07′′ 51°21′17′′ | 1 | г | Г5(1) | 1.00 | 0.0022 |
| 30 | Уральск | 47°14′00′′ 51°55′24′′ | 1 | г | Г2(1) | ||
| 31 | Алма-Ата | 43°07′50′′ 76°53′35′′ | 3 | у | Г9(3) | 0.00 | 0.0000 |
| 32 | Караганда | 50°01′01′′ 72°58′52′′ | 1 | у | Г9(1) | ||
| 33 | Кура-Араксинская, Азербайджан | 40°01′36′′ 48°28′02′′ | 2 | г | Г3(1), Г5(1) | 0.83 | 0.0028 |
| 34 | Ереван | 40°05′26′′ 44°22′50′′ | 1 | г | Г1(1) | ||
| 35 | Минеральные воды | 44°13′42′′ 43°05′47′′ | 1 | г | Г5(1) | ||
| 36 | Аучи-Калачи, Таджикистан |
40°07′33′′ 69°40′58′′ | 5 | г | Г4(5) | 0.00 | 0.0000 |
| 37 | Сырдарья | 44°27′22′′ 66°05′17′′ | 1 | г | Г4(1) | ||
| 38 | Старая Волга | 46°03′07′′ 47°51′30′′ | 2 | г | Г2(1), Г5(1) | 1.00 | 0.0022 |
| 39 | Саратовская область | 51°43′15′′ 50°23′04′′ | 2 | к | Г7(2) | 0.00 | 0.0000 |
| 40 | Августовка, Самарская область |
52°14′54′′ 50°45′39′′ | 2 | г | Г5(2) | 0.00 | 0.0000 |
Примечание. N – общее число особей, h – разнообразие гаплотипов, π – нуклеотидное разнообразие. Виды и гибриды солодки (г, у, к, к × г, г × у, к × у), выделенные по морфологическим признакам: г – Glycyrrhiza glabra, у – G. uralensis, к – G. korshinskyi. Серым и светло-серым фоном отражены варианты объединения.
Тотальная ДНК выделена с использованием CTAB метода [24]. Для анализа генетической изменчивости использовали межгенные спейсеры trnH–psbA, trnS–trnG, atpH–atpI и 16S–trnA. Амплификацию регионов trnH–psbA, trnS–trnG, atpH–atpI проводили с использованием универсальных праймеров, реакционных условий и температурных режимов, рекомендованных для этих участков [25, 26]. Амплификацию региона 16S–trnA (В.Л. Семериков, неопубликованное) проводили с использованием праймеров 5'-gaaggctgggctagtgactg-3' и 5'-gagataagcggactcgaacc-3' при температуре отжига 60°С и времени 1 мин и времени элонгации 3 мин при 72°С. Использовался метод PCR-RFLP. Рестриктазы Sse и Rsa были применены к региону trnS–trnG, рестриктаза TaqI – к региону atpH–atpI, Tru9 – к региону trnH–psbA, TaqI и HinfI – к региону 16S–trnA. Продукты рестрикции индивидуально от каждого из 212 растений были разделены в 6%-ном денатурирующем полиакриламидном геле с последующим окрашиванием серебром. Все варианты изменчивых регионов хпДНК, идентифицированные методом PCR-RFLP, были использованы для последующего секвенирования методом Сэнгера. Всего секвенирование проведено для 112 образцов солодки. ПЦР-продукты были вырезаны из 1.0%-ного агарозного геля, изолированы с частицами SiO2 [27] и затем использованы как темплаты для прямого секвенирования при помощи BigDye v. 3.1 kit (Gene Analyzers 3130; Applied Biosystems, Foster City, CA). Редактирование и выравнивание полученных последовательностей выполнялось вручную в программе BioEdit [28]. Гаплотип каждого растения был определен путем объединения паттернов разнообразия четырех регионов хпДНК. Сиквенсы всех регионов для каждого гаплотипа были депонированы в GenBank под следующими номерами: MN601933–MN601983 и MN620364–MN620380.
В некоторых популяциях не удавалось собрать достаточного количества образцов из-за выраженной клоновой структуры, присущей видам солодки. Поэтому для проведения статистического анализа генетического разнообразия некоторые одиночные образцы солодки были присоединены к географически близким популяционным выборкам, либо одиночные образцы объединялись в группы по 2–3 образца с учетом их географического происхождения и видовой принадлежности. Тем не менее следует учесть, что в некоторых выборках, содержащих число образцов меньше пяти, результаты анализа генетического разнообразия могут быть искажены.
С помощью пакета программ Arlequin v. 3.5.1.2 [29] определяли уровень дифференциации и распределение генетической изменчивости между группами гаплотипов (анализ молекулярной вариации, AMOVA). Значение FST было получено для измерения молекулярной дивергенции между популяциями и группами популяций. С помощью этой же программы вычисляли параметры молекулярного разнообразия, включающие число гаплотипов в каждой популяции, разнообразие гаплотипов (h) и нуклеотидное разнообразие (π).
Филогенетические отношения между гаплотипами хпДНК были реконструированы с помощью NETWORK ver. 4.6.1.2 (метод Reduced Median, RM) [30] и с помощью байесовского подхода в программе MrBayers ver. 3.2.3 [31] (с использованием модели нуклеотидного замещения GTR + G + I, выбранной с помощью jModeltest). Полные последовательности хлоропластных геномов Astragalus mongolicus (KU666554.1) и Glycyrrhiza lepidota (KY038482.1) были взяты из GenBank и использованы в качестве комбинированной внешней группы. Тест на филогеографическую структуру проводили в программе PERMUT v1.0 [32]. С помощью этой программы при 1000 пермутаций были получены два показателя популяционной дифференциации (GST, NST), которые затем сравнивались друг с другом. Пространственный анализ молекулярной изменчивости (SAMOVA v1) [33] был использован для идентификации популяционных кластеров. Программа использует метод случайного подбора для определения географических групп популяций, которые однородны генетически и при этом максимально дифференцированы друг от друга. Морфологические признаки для идентификации видов изучались на гербарных образцах солодки, собранных в природных популяциях одновременно с материалом для молекулярно-генетических исследований.
РЕЗУЛЬТАТЫ
Длина вырaвненных сиквенсов регионов 16S–trnA, trnH–psbA, atpH–atpI и trnS–trnG составила 1228, 402, 394 и 661 пн соответственно. Общая длина объединенных последовательностей четырех регионов хпДНК – 2685 пн, включая 11 точечных мутаций и 8 инделей. Сочетание изменчивости по четырем маркерным фрагментам позволило выявить среди всех 212 исследованных растений 14 гаплотипов (см. табл. 1, 2).
Таблица 2.
Распределение полиморфных сайтов в нуклеотидных последовательностях выявленных гаплотипов регионов 16S–trnA, trnH–psbA, atpH–atpI, trnS–trnG хпДНК у G. glabra, G. uralensis, G. korshinskyi
| Номер гаплотипа | Позиция нуклеотида | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 16S–trnA | trnH–psbA | atpH–atpI | trnS–trnG | ||||||||||||||||
| 16S | trnA | ||||||||||||||||||
| 9 3 |
1 9 8 |
5 4 3 |
5 0 1 |
1 5 7 |
2 9 0 |
1 0 9 |
1 9 2 |
1 9 4 |
2 4 5 |
3 0 6 |
3 1 0 |
1 0 5 |
1 7 2 |
1 9 1 |
1 9 3 |
2 0 9 |
3 4 8 |
4 6 7 |
|
| 1 | C | G | C | a | G | b | C | A | – | d | C | T | C | e | – | A T | f | C | C |
| 2 | C | G | C | a | G | b | C | A | c | – | A | T | C | e | – | A T | f | C | C |
| 3 | C | G | C | a | G | b | C | A | c | d | C | T | C | – | – | A T | f | C | C |
| 4 | C | G | C | a | G | b | C | A | c | d | C | T | C | e | – | A T | f | A | A |
| 5 | C | G | C | a | G | b | C | A | c | d | C | T | C | e | – | A T | f | C | C |
| 6 | C | G | C | a | G | b | C | A | c | d | C | T | C | e | AT | A T | f | C | C |
| 7 | C | G | G | – | G | b | C | A | c | d | C | T | C | e | – | A T | f | C | C |
| 8 | A | A | G | a | T | b | C | T | c | d | C | C | C | e | – | – | – | C | C |
| 9 | A | A | G | a | T | b | C | T | c | d | C | C | C | e | – | – | f | C | C |
| 10 | A | A | G | a | T | – | C | T | c | d | C | C | C | e | – | – | f | C | C |
| 11 | A | A | G | a | T | b | C | T | c | d | C | C | C | e | – | – | f | C | A |
| 12 | A | A | G | a | T | b | T | T | c | d | C | C | C | e | – | A T | f | C | C |
| 13 | A | A | G | a | T | b | T | T | c | d | C | C | T | e | – | – | f | C | C |
| 14 | A | A | G | a | T | b | C | T | c | d | C | C | T | e | – | – | f | C | C |
При анализе изменчивости хпДНК трех видов солодки обнаружены две разные генетические линии – западная и восточная (рис. 1, 2). Западная линия содержит гаплотипы Г1–Г7, где Г5 – наиболее распространенный гаплотип, который является общим для G. glabra и G. korshinskyi (табл. 1, рис. 2). В этой линии гаплотипы Г1–Г4 специфичны для G. glabra, а гаплотипы Г6 и Г7 характерны только для G. korshinskyi. Гаплотипы Г8–Г14 восточной линии, где предковым является гаплотип 9, характерны для G. uralensis. Но некоторые из них (Г8 и Г9) встречаются и у G. korshinskyi.
Рис. 2.
Генетические взаимоотношения Glycyrrhiza glabra, G. uralensis и G. korshinskyi на основании сравнения последовательностей выявленных гаплотипов четырех регионов хпДНК: а – филогенетическое дерево, построенное в программе MrBayers ver. 3.2.3. Числами обозначены значения апостериорной вероятности (Posterior Probabilities, PP); б – генеалогическая сеть гаплотипов, построенная с помощью RM-метода. Размер окружностей отражает частоту встречаемости гаплотипов, маленькие черные кружки – гипотетические гаплотипы. Г1–Г7 – гаплотипы западной линии, Г8–Г14 – восточной.
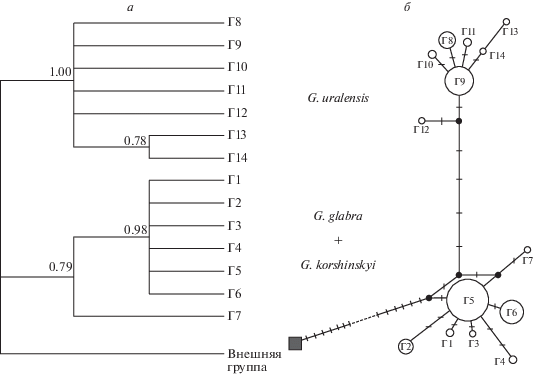
Анализ родства гаплотипов в программе NETWORK показывает две далеко отстоящие друг от друга группы гаплотипов, соответствующие генетическим линиям, которые разделяют пять точечных мутаций (рис. 2). В каждой группе гаплотипы образуют звездчатые структуры с одним предоминантным гаплотипом (Г5 в западной линии и Г9 в восточной) и несколькими связанными с ним дериватами. Это может свидетельствовать о недавней популяционной экспансии этих дериватов. В западной линии через две мутации и предполагаемый вымерший гаплотип в отдельную ветку выделяется гаплотип Г7, характерный для G. korshinskyi. Возможно, этот гаплотип является рекомбинантным, так как в регионе 16S–trnA он совмещает в себе мутации G. glabra и G. uralensis (табл. 2). В восточной линии, по-видимому, таким рекомбинантным гаплотипом (см. регион trnS–trnG) является Г12, выделяющийся на графике родства гаплотипов в отдельную ветвь и встречающийся только в популяции из окрестностей Минусинска.
Иерархический AMOVA (табл. 3) показал значительную дифференциацию между генетическими линиями (FST = 86%). Это соответствует степени дифференциации между видами G. glabra и G. uralensis (FST = 84%). Различия между всеми тремя видами меньше (FST = 64%). При этом G. korshinskyi оказалась генетически ближе к G. glabra (FST = 35%), чем к G. uralensis (FST = 77%). В результатах теста на филогеографическую структуру, который указывает на тенденцию родственных гаплотипов сосуществовать совместно, параметр NST (0.431) превышает GST (0.252), однако эти различия незначимы, т.е. ясный филогеографический сигнал отсутствует. С помощью программы SAMOVA географически все популяции разделились только на две группы: в одной оказались популяции и группы образцов типичной G. uralensis (Рубцовск с Поспелихой, Алма-Ата с Карагандой, Минусинск и Убсу-Нур) и во второй все остальные популяции.
Таблица 3.
Распределение суммарной генетической изменчивости по данным хпДНК
| Изменчивость | d.f. | SSD | CV | % | Индекс фиксации |
|---|---|---|---|---|---|
| Западная и восточная генетические линии | |||||
| Между линиями | 1 | 197.398 | 3.50978 | 86.21 | FST = 0.86208 P < 0.0001 |
| Внутри линий | 192 | 107.808 | 0.56150 | 13.79 | |
| Общая | 193 | 305.206 | 4.07128 | ||
| G. glabra, G. uralensis и G. korshinskyi | |||||
| Между видами | 2 | 110.429 | 1.16959 | 54.42 | FST = 0.64322 P < 0.0001 |
| Внутри видов | 25 | 58.684 | 0.21279 | 45.58 | |
| Общая | 27 | 169.113 | 1.38238 | ||
| G. glabra и G. korshinskyi | |||||
| Между видами | 1 | 33.023 | 0.46880 | 18.20 | FST = 0.35404 P < 0.0001 |
| Внутри видов | 23 | 114.933 | 0.44315 | 17.20 | |
| Общая | 24 | 147.936 | 0.91195 | ||
| G. korshinskyi и G. uralensis | |||||
| Между видами | 1 | 91.271 | 2.51247 | 71.62 | FST = 0.76824 P < 0.0001 |
| Внутри видов | 18 | 42.937 | 0.18254 | 5.2 | |
| Общая | 19 | 133.208 | 2.69501 | ||
| G. glabra и G. uralensis | |||||
| Между видами | 1 | 85.479 | 3.17509 | 75.64 | FST = 0.83683 P < 0.0001 |
| Внутри видов | 9 | 20.803 | 0.33768 | 8.04 | |
| Общая | 10 | 106.282 | 3.51277 | ||
Параметры генетического разнообразия представлены в табл. 1. В целом исследуемые популяции характеризуются средними значениями гаплотипического и низкими нуклеотидного разнообразия. Однако в некоторых популяциях эти показатели достаточно высоки. Наибольшим генетическим разнообразием отличаются популяции Озерное (Курганская обл.) и Аркаим, где преобладает G. korshinskyi и имеются гибридные формы, Тормосин и Баскунчак (состоят из форм G. glabra), а также Рубцовск и Минусинск (состоят из G. uralensis). Уникальный гаплотип обнаружен в Азербайджане (Г3) и один гаплотип (Г4) специфичен только для популяций Средней Азии (Аучи-Калачи, Сырдарья).
ОБСУЖДЕНИЕ
В результате анализа изменчивости межгенных спейсеров хпДНК в исследованном комплексе трех видов солодки в центральной части Северной Евразии мы выявили две филогенетические линии (западную и восточную) и обнаружили существенные генетические различия между Glycyrrhiza glabra L. s.l. и G. uralensis Fisch. s.l. Это согласуется с результатами других исследований, в которых были использованы различные молекулярные маркеры [15–17]. В то же время нами получены данные, свидетельствующие об интрогрессивной гибридизации и перемешивании генных потоков между популяциями разных видов солодки в прошлом, что также отмечается в указанных выше публикациях.
Способность к межвидовой гибридизации у солодки стала, по-видимому, важным фактором формирования солодки Коржинского как нового биологического вида, происхождение которого в основе своей связано с солодкой голой, о чем свидетельствует преобладание в исследованных популяциях этих видов общего и эволюционно исходного в западной линии гаплотипа 5. Специфичные для солодки Коржинского и распространенные в ареале только этого вида Г6 и Г7 связаны в своем происхождении с Г5, а Г7 сформировался, вероятно, как рекомбинантный гаплотип. Это свидетельствует о древней и довольно длительной обособленности предковых популяций G. korshinskyi от G. glabra. Формирование солодки Коржинского происходило, по всей видимости, при непосредственном контакте с G. uralensis, при котором предковые формы G. korshinskyi участвовали в гибридизации с G. uralensis в основном как материнские растения (хлоропластная ДНК в семействе Fabaceae Lindl. s.l. передается потомкам от материнских особей) [34]. При этом первоначально возникшие гибриды в дальнейшем уже участвовали в гибридизации преимущественно с формами солодки уральской. Об этом свидетельствует (судя по результатам аллозимного анализа) насыщение ядерного генома солодки Коржинского генами солодки уральской [23]. В некоторых популяциях G. korshinskyi (Таналык, Аркаим) имеется значительная доля растений (клонов) с гаплотипами Г8 и Г9, что указывает и на участие особей солодки уральской в качестве материнских растений в процессе становления солодки Коржинского. Возможно, что такие растения солодки Коржинского являются потомками от возвратных скрещиваний с G. uralensis, и это свидетельствует о наличии интрогрессии в исследуемом комплексе видов [35]. Все это в целом подтверждает гипотезу Ю.С. Григорьева о гибридном происхождении солодки Коржинского. Таким образом, этот эндемик прошел длительный период формирования как гибридогенный вид. Вероятно, период его становления мог охватывать плиоцен и плейстоцен.
Известно, что степной пояс, протянувшийся от Средней Азии до Юго-Восточной Европы, образовался в результате похолодания в конце плиоцена (2.5–1.6 млн лет назад). Он претерпевал значительные изменения, связанные с сужениями и разрывами примерно в области 60°–70° восточной долготы во время ледниковых периодов. С переходом плиоцена в плейстоцен Каспийское море в несколько раз расширилось на север, вплоть до южных границ Уральских гор и волжско-камского бассейна. Тем не менее область к северу от Черного моря вдоль среднего и нижнего Дона не пострадала от морских трансгрессий, и поэтому степная растительность сохранялась там [36–38]. Вероятно там же выжили и популяции G. glabra, и оттуда этот вид вторично расселился по всей Европе. Star-like филогения с преобладанием анцестрального гаплотипа Г5 указывает на событие “бутылочного горлышка” в эволюционной истории этого вида. Наличие единственного общего и часто встречающегося предкового гаплотипа 5 во многих популяциях G. glabra подтверждает это. Несмотря на относительно небольшое количество проанализированных образцов G. glabra, можно заключить, что распространение специфичных для этого вида гаплотипов (Г1–Г4), производных от Г5, указывает на постгляциальные in situ мутации. Вероятно, гаплотип 4 характерен только для популяций Средней Азии, он сохранился и расселился там в условиях длительной изоляции.
В Западной Сибири во время раннего плейстоцена (0.9–0.4 млн лет назад, мансийско-шайтанского оледенения) ледники продвинулись на юг до 64°–62° с.ш. Речная система Обь–Иртыш–Тобол была запружена ледниками, а заводи достигли предгорий Казахстанского нагорья и Алтайских гор. Ландшафт был превращен в систему озер и болотистых мест, чередующихся с таежной растительностью, которая не пригодна для степных растений [36, 39]. В конце среднего плейстоцена во время ледникового периода (260 000–130 000 лет назад) речная система Обь–Иртыш–Тобол снова была запружена, но описанная выше система озер/болот была менее обширной и не влияла на Омскую и Казахстанскую степные области [36]. Ледниковый покров вызывал подпрудные явления, в связи с чем возникали обширные подпрудно-ледниковые бассейны. Лишь южные приподнятые Приалтайские, Приобские и, возможно, Приказахстанские равнины не заливались подпрудными водами. Накопление генетического разнообразия в восточной группе популяций (Минусинск и Рубцовск) свидетельствует о выживании региональных геномов G. uralensis в течение нескольких ледниковых циклов в разных регионах Азии.
Таким образом, можно предположить, что при изменении ландшафтов и климата в четвертичном периоде ареал солодки был разорван водными преградами на несколько обособленных, географически и экологически изолированных частей, в которых сформировались самостоятельные виды – G. glabra, G. uralensis и G. korshinskyi.
Установлено, что генетическое разнообразие видов Glycyrrhiza, несмотря на их клоновую структуру, близко к средним значениям разнообразия, известным для широко распространенных и долгоживущих травянистых растений [40]. Причем в Азии, включая Китай, оно оказалось значительно выше, чем в других регионах [17, 41, 42]. Например, анализ AFLP, проведенный в природных популяциях G. uralensis в Китае [43], показал средний уровень генетического разнообразия (уровень полиморфизма составил 53.3%, Не = 0.1932). При этом он значительно варьировал от популяции к популяции, что авторы связывают с различиями в уровнях осадков и pH почвы. Высокое морфологическое и генетическое разнообразие солодки в ряде популяций на Южном Урале и смежных территориях и в Сибири, существование там популяций с присутствием гаплотипов из разных линий мы объясняем гибридизацией между представителями западной и восточной групп. Это могло происходить в результате вторичного контакта, возникшего после дегляциации и исчезновения водных преград, во время межледниковий и/или в голоцене. Так как при наступлении благоприятных периодов популяции разных генетических линий расширяли свои ареалы, распространяясь из разных рефугиумов, они должны были формировать контактные зоны. В этих зонах происходили перемешивание генных потоков разных популяций и, возможно, даже рекомбинация хпДНК, что является редким cобытием для этого типа генетических маркеров. Признаки интрогрессии прослеживаются даже на очень больших расстояниях от зон контакта ареалов. Например, во внутренней части ареала G. uralensis в выборке из Минусинска встретился гаплотип 5, относящийся к западной генетической линии солодки.
При расселении на Южном Урале, в Предуралье и Зауралье в голоцене солодка Коржинского могла претерпеть сложные трансформации в результате вторичных контактов с двумя другими видами. В частности, это проявилось в том, что в ряде территорий сформировались сложные гибридные комплексы, в которых выявлены специфичные гаплотипы каждого из трех исследуемых видов солодки (например, в популяции Озерное). Эти процессы способствовали повышению общего генетического разнообразия солодки Коржинского.
В периферийных частях ареала популяции исследуемых видов солодки состоят из немногочисленных, обособленных куртин-клонов различных размеров и формы. Возраст наиболее крупных клонов может достигать многих десятков (возможно, и сотен) лет [4]. В связи с этим в популяциях солодки может длительно сохраняться генетический материал, появившийся в результате очень давних межпопуляционных и межвидовых взаимодействий. Известно, что у перекрестноопыляемых растений, в том числе и у солодки, семенное размножение является фактором увеличения их генетического разнообразия. Однако в природных местообитаниях солодки генеративные особи семенного происхождения появляются редко [4], т.е. смена семенных поколений происходит очень медленно, а эффективная численность популяций невысока. Вследствие этого в таких популяциях может быть выражен дрейф генов и эффект основателя, что усложняет выявление структуры генетического разнообразия солодки как в местных популяциях, так и на обширном ареале.
Большинство известных публикаций, связанных с генетическими исследованиями видов Glycyrrhiza, посвящено выявлению дифференцирующих маркеров и установлению филогенетических связей между видами. При этом недостаточно внимания уделяется вопросам оценки генетического разнообразия в популяциях. Полученные нами данные впервые позволяют с помощью маркеров хпДНК оценить структуру генетического разнообразия в комплексе трех видов солодки в Северной Евразии. Для получения более ясной картины популяционной структуры и генетического разнообразия у Glycyrrhiza glabra, G. uralensis и G. korshinskyi требуется исследование популяций с достаточно большими выборками клонов из многих районов ареала с использованием разных типов генетических маркеров.
Мы благодарим В.П. Гранкину за предоставленные нам образцы семян солодки, а также сотрудников Ботанического сада УрО РАН Е.С. Васфилову и А.Г. Быструшкина за помощь в сборе материала.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН и при финансовой поддержке Комплексной программы УрО РАН, проект № 18-4-4-43.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Мусаев И.Ф., Надежина Т.П., Серых Г.А. Атлас ареалов и ресурсов лекарственных растений / Под ред. Чикова П.С. М.: ГУГК, 1980. С. 301–302.
Yakovlev G.P., Sytin A.K., Roskov Y.R. Legumes of North Eurasia // Pabl. By Royal Bot. Gardens. Kew, 1996. P. 289–292.
Надежина Т.П. О подземных органах солодок секции Euglycyrrhiza Boiss, распространенных на территории СССР // Вопр. изучения и использования солодки в СССР. М.; Л.: Наука, 1966. С. 27–34.
Беляев А.Ю., Васфилова Е.С. Особенности клоновой структуры и некоторые характеристики куртин-клонов солодки в популяциях на Южном Урале и в Приуралье // Вестник ОГУ. 2010. № 5(111). С. 87–93.
Толстиков А.Г., Балтина Л.А., Гранкина В.П. и др. Солодка: биоразнообразие, химия, применение в медицине. Новосибирск: Гео, 2007. 311 с.
Государственная Формакопея Российской Федерации. XIV изд. Т. IV. М., 2018. С. 6429–6437. http://femb.ru/femb/pharmacopea.php.
Плантариум: открытый онлайн атлас-определитель растений и лишайников России и сопредельных стран. 2007—2019. http://www.plantarium.ru/.
Мусаев И.Ф. Ареаграфическая характеристика видов солодки // Ареалы растений флоры СССР. Л., 1976. Т. 3. С. 85–112.
Григорьев Ю.С. К систематике рода Glycyrrhiza L. // Изв. Глав. бот. сада СССР. 1930. Т. 29. № 1–2. С. 92–98.
Круганова Е.А. К систематике и географии рода Glycyrrhiza L. // Вопр. изучения и использования солодки в СССР. М.; Л.: Наука, 1966. С. 19–26.
Черепанов С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб.: Мир и семья, 1995. С. 468.
Гранкина В.П. Система рода Glycyrrhiza L. (Fabaceae) // Новости систематики высших растений. 2008. Т. 40. С. 89–108.
Hayashi H., Hosono N., Kondo M. et al. Phylogenetic relationship of Glycyrrhiza plants based on rbcL sequences // Biol. Pharm. Bull. 1998. V. 21. № 7. P. 782–783.
Hayashi H., Honoso N., Kondo M. et al. Phylogenetic relationship of six Glycyrrhiza species based on rbcL sequences and chemical constituents // Biol. Pharm. Bull. 2000. V. 23. P. 602–606.
Lim J.M., Ahn Y.S., Park C.G. et al. Authentication of traded medicinal herb, Glycyrrhiza spp. (Licorice), based on nrDNA-ITS2 sequence analysis // J. Korean Soc. Int. Agric. 2012. V. 24. P. 435–443.
Kondo K., Shiba M., Yamaji H. et al. Species identification of Licorice using nrDNA and cpDNA genetic markers // Biol. Pharm. Bull. 2007. V. 30. № 8. P. 1497–1502.
Jo I.H., Sung J., Hong C. et al. Development of cleaved amplifed polymorphic sequence (CAPS) and high-resolution melting (HRM) markers from the chloroplast genome of Glycyrrhiza species // 3 Biotech. 2018. V. 8. № 5. P. 220–230.
Григорьев Ю.С., Васильченко И.Т. Род солодка – Glycyrrhiza L.// Флора СССР / Под ред. Комарова В.Л. М.; Л.: Изд-во АН СССР, 1948. Т. 13. С. 230–240.
Ashurmetov O.A. Selection of parental pairs for obtaining hybrids in the genera Glycyrrhiza L. and Meristotropis Fisch. et Mey // Genet. Resour. Crop Ev. 1996. V. 43. P. 167–171.
Зимницкая С.А. Состояние репродуктивной системы популяций видов рода Glycyrrhiza L. (Fabaceae) // Сиб. экол. журн. 2009. Т. 16. № 4. С. 629–634.
Беляев А.Ю., Васфилова Е.С. Близкородственные виды Glycyrrhiza L. на северном пределе распространения в Зауралье // Флора Урала в пределах бывшей Пермской губернии и ее охрана: мат-лы межрегион. конф. Пермь, 2007. С. 32–37.
Беляев А.Ю., Дымшакова О.С., Васфилова Е.С., Кутлунина Н.А. О возможности использования данных по геногеографии солодок Северной Евразии для изучения вопросов флорогенеза // Методы аналитической флористики и проблемы флорогенеза: Материалы I Междунар. науч.-практич. конф. Астрахань, 2012. С. 54–59.
Беляев А.Ю., Васфилова Е.С. Географическая структура морфологического и генетического разнообразия солодки (Glycyrrhiza L.) на Южном Урале и прилегающих территориях // Вест. Курган. гос. ун-та. Сер. естеств. науки. 2015. № 4(38). С. 13–17.
Devey M.E., Bell J.S., Smith D.N., Neale D.B. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. P. 673–679.
Grivet D., Heinze B., Vendramin G.G., Petit R.J. Genome walking with consensus primers: application to the large single copy region of chloroplast DNA // Mol. Ecol. Notes. 2001. V. 1. P. 345–349.
Hamilton M.B. Four primer pairs for the amplification of chloroplast intergenic regions with intraspecific variation // Mol. Ecol. 1999. V. 8. P. 521–523.
Vogelstein B., Gillespie D. Preparative and analytical purification of DNA from 600 agarose // Proc. Natl Acad. Sci. USA. 1979. V. 76. P. 615.
Hall T.A. Bioedit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acid Symp. 1999. V. 41. P. 95–98.
Excoffier L., Lischer H. Arlequin suite ver. 3.5: a new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. 2010. V. 10. P. 564–567.
Bandelt H.J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenics // Mol. Biol. Evol. 1999. V. 16. P. 37–48.
Huelsenbeck J.P., Ronquist F. MrBayes: Bayesian inference of phylogeny // Bioinformatics. 2001. V. 17. P. 754–755.
Pons O., Petit R.J. Measuring and testing genetic differentiation with ordered versus unordered alleles // Genetics. 1996. V. 144. P. 1237–1245.
Dupanloup I., Schneider S., Excoffier L. A simulated annealing approach to define the genetic structure of populations // Mol. Ecol. 2002. V. 11. P. 2571–2581.
Doyle J.J., Doyle J.L., Rauscher J.T., Brown A.H.D. Diploid and polyploid reticulate evolution throughout the history of the perennial soybeans (Glycine subgenus Glycine) // New Phytol. 2004. V. 161. P. 121–132. https://doi.org/10.1046/j.1469-8137.2003.00949.x
Грант В. Видообразование у растений. М.: Мир, 1984. 528 с.
Архипов С.А., Волкова В.С. Геологическая история, ландшафты и климаты плейстоцена Западной Сибири. Новосибирск: НИЦ ОИГГМ СО РАН, 1994. 105 с.
Величко А.А., Ахлестина Е.Ф., Борисова О.К. и др. Восточно-Европейская равнина // Изменение климата и ландшафтов за последние 65 миллионов лет: кайнозой (от палеоцена до голоцена) / Под ред. Величко А.А. М.: ГЕОС, 1999. С. 43–83.
Franzke A., Hurka H., Janssen D. et al. Molecular signals for Late Tertiary/Early Quaternary range splits of an Eurasian steppe plant: Clausia aprica (Brassicaceae) // Mol. Ecol. 2004. V. 13. P. 2789–2795.
Архипов С.А., Волкова В.С., Зольников И.Д. и др. Западная Сибирь // Изменение климата и ландшафтов за последние 65 миллионов лет: кайнозой (от палеоцена до голоцена) / Под ред. Величко А.А. М.: ГЕОС, 1999. С. 84–109.
Hamrick J.L., Godt M.J.W. Allozyme diversity in plant species // Plant Population Genetics, Breeding and Genetic Resources / Eds Brown A.H., Clegg M.T., Kahler A.L., Weir B.S. Massachusetts: Sinauer Associates, 1989. P. 43–46.
Erayman M., Ilhan E., Güzel Y., Eren A.H. Transferability of SSR markers from distantly related legumes to Glycyrrhiza species // Turk. J. Agric. For. 2014. V. 38. I. 1. P. 32–38.
Um Y., Jin M.L., Lee Y. et al. Genetic diversity analysis of Glycyrrhiza uralensis 8 novel polymorphic microsatellite markers // J. Plant Biotechnol. 2016. V. 43. P. 174–180.
Zhang J.-T., Xu B., Li M. Genetic diversity of populations of an endangered medicinal plant species (Glycyrrhiza uralensis) in different environments of North China // J. Med. Plants Res. 2010. V. 4. I. 9. P. 830–836. https://doi.org/10.5897/JMPR10.127
Дополнительные материалы отсутствуют.


