Генетика, 2020, T. 56, № 8, стр. 933-952
Филогенетическая реконструкция подсемейств Asilinae и Stichopogoninae (Diptera, Asilidae) на основе митохондриальных генов 16S и 12S рДНК и ядерного 18S рДНК
Т. В. Галинская 1, 2, *, Д. М. Астахов 3, Е. А. Прописцова 1, В. А. Горин 1
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
2 Всероссийский центр карантина растений
140150 Московская область, пос. Быково, Раменский район, Россия
3 Институт естественных наук, Волгоградский государственный университет
400062 Волгоград, Россия
* E-mail: nuha1313@gmail.com
Поступила в редакцию 12.09.2019
После доработки 03.10.2019
Принята к публикации 26.11.2019
Аннотация
В работе рассматриваются филогенетические отношения подсемейств Asilinae и Stichopogoninae, а также реконструирована филогения подсемейства Asilinae и некоторых родов подсемейства Stichopogoninae на основе молекулярных данных. Показано систематическое положение родов Eremodromus Zimin, 1926; Pamponerus Loew, 1849; Antipalus Loew, 1849; Erax Scopoli, 1763; Leleyellus Lehr, 1995; Filiolus Lehr, 1967; Neomochtherus Osten-Sacken, 1878; Aneomochtherus Lehr, 1996; Dysmachus Loew, 1860; Polysarca Schiner, 1866 и выявлена взаимосвязь между ними на основе молекулярно-генетических данных. Также в анализ включены некоторые представители подсемейств Dasypogoninae и Leptogastrinae.
Семейство ктырей, Asilidae (Diptera, Ortorrapha), насчитывает более 7500 видов [1] и является одним из наиболее крупных в отряде Diptera. Размер ктырей может быть разнообразным – от 5 до 60 мм [2]. Ктыри являются активными хищниками и могут обитать в одном типе экосистем или в двух и более типах растительных сообществ [3–10].
В ходе настоящей работы впервые проведен молекулярно-генетический анализ ряда малоизвестных палеарктических видов из подсемейств Asilinae, Stichopogoninae, Dasypogoninae и Leptogastrinae. Особый интерес представляет и положение рода Molobratia Hull, 1958 в семействе Asilidae. Также были рассмотрены палеарктические представители трибы Asilini Latreille, 1802 (Poly-sarca neptis Loew, 1873).
На настоящий момент существует несколько точек зрения на местоположение рода Molobratia Hull, 1958 в составе семейства Asilidae. Геллер-Гримм [11] и Диков [2, 12] рассматривают этот род в составе подсемейства Dasypogoninae. Галл [13] рассмотрел род Molobratia Hull в составе трибы Dioctriini. Лер повысил статус трибы Dioctriini до подсемейства Dioctriinae и выделил в его составе отдельную трибу Molobratiini [14–16]. Наряду с родом Molobratia нами включен в анализ типовой род подсемейства Dasypogon Meigen, 1803 (Dasypogon diadema (Fabricius, 1781)) и представители еще двух интересных родов Leptarthrus Stephens, 1829 и Pegesimallus Loew, 1858 (Leptarthrus brevirostris (Meigen, 1804) и Pegesimallus mesasiaticus (Lehr, 1958)). По последним данным род Pegesimallus относится к трибе Megapodini и подтрибе Lagodiina Papavero, 1975 [2]. Ситуация с таксономической принадлежностью рода Leptarthrus также не является простой. Лер [17] и Геллер-Гримм [11] рассматривают этот род в составе подсемейства Dasypogonninae. Причем Лер помещает род в трибу Isopogonini [17]. По самым последним исследованиям Дикова род рассматривается в составе подсемейства Brachyrhopalinae, причем систематическое положение рода остается невыясненным [2]. Несмотря на то что ранее уже были получены молекулярно-генетические данные Dasypogon diadema Fabricius, Molobratia teutonus (Linnaeus, 1776) и Leptarthrus brevirostris (Meigen, 1804), исследование представителей этих видов с территории России позволит лучше понять их популяционную структуру.
Филогения подсемейства Asilinae
Триба Asilini Latreille, 1802 по последним данным [2] включает в себя только один род Asilus Linnaeus, 1758. Лер [6] в трибу Asilini помещает роды группы satanas (Satanas Jacobson, 1908; Polysarca Schiner, 1866 и Eremonotus Theodor, 1980) и группы asilus (Asilus Linnaeus, 1758; Asiloephesus Lehr, 1992; Eccoptopus Loew, 1860; Esatanas Lehr, 1986; Polysarcodes Paramonov, 1937 и Reminasus Lehr, 1979). По особенностям строения генитальных комплексов самцов виды из группы satanas он сближает с представителями трибы Neomochtherini, а группы asilus – c представителями трибы Machimini [6].
Триба Apocleini Papavero, 1973 установлена Диковым и включает в себя роды Apoclea Macquart, 1838; Megaphorus Bigot, 1857; Philodicus Loew, 1848 и Promachus Loew, 1848 [2]. Лер [6] рассматривает ее как подсемейство Apocleinae Lehr, 1969, включая в нее следующие палеарктические роды: Apoclea, Philodicus, Polyphonius и Promachus.
Триба Machimini по Дикову включает только один род Machimus Loew, 1849 [2]. Лер при описании трибы [2, 18] помещает в ее состав Machimus Loew; Tolmerus Loew, 1849; Ktyrimisca Lehr, 1967; Antiphrisson Loew, 1849; Odus Lehr, 1986; Conosiphon Becker, 1923; Trichomachimus Engel, 1934; Eutolmus Loew, 1848; Machiremisca Lehr, 1996; Kursenkoiellus Lehr, 1995; Prolatiforceps Martin, 1975 и Reburrus Daniels, 1987. Выделенные Лером роды Neoepitriptus Lehr, 1992 и Odus Lehr, 1986 [19–21], по-видимому, также должны рассматриваться в составе трибы Machimini.
По последним данным [2, 12] триба Neomochtherini включает только два рода – Neomochtherus Osten-Sacken, 1887 и Afromochtherus Lehr, 1996 и в работе [2] Диков указывает, что включенный в трибу Лером род Dysmachus не может быть помещен в какую-либо из существующих современных триб подсемейства Asilinae. Лер [6] выделяет в составе трибы три группы родов: pamponerus, neomochtherus, aneomochtherus. В группу pamponerus он включает 12 родов: Pamponerus Loew, 1849; Antipalus Loew, 1849; Didysmachus Lehr, 1996; Dystolmus Lehr, 1996; Echthistus Loew, 1849; Erax Scopoli, 1763; Erebunus V. Richter, 1966; Minicatus Lehr, 1992; Oldroydiana Lehr, 1996; Paramochtherus Theodor, 1980; Phileris Tsacas et Weinberg, 1976 и Stilpnogaster Loew, 1849. В группе neomochtherus – пять родов: Neomochtherus Osten-Sacken, 1878; Afromochtherus Lehr, 1996; Leleyelus Lehr, 1995; Pashtshenkoa Lehr, 1995 и Tsacasiella Lehr, 1996. Группа aneomochtherus включает семь родов: Aneomochtherus Lehr, 1996; Cerdistus Loew, 1849; Dysmachus Loew, 1860; Filiolus Lehr, 1967; Premochtherus Lehr, 1996; Turkiella Lehr, 1996 и Ujguricola Lehr, 1970. В наш анализ вовлечены представители каждой из групп родов.
Триба Philonicini Lehr, 1996 по Дикову [2], в состав этой трибы может быть включен только один род Philonicus Loew, 1849. Лер в составе трибы рассматривает пять родов: Philonicus Loew; Eremisca Hull; Etrurus Lehr, 1992; Mercuriana Lehr, 1988 и Afroepitriptus Lehr [6].
Из подсемейства Asilinae в анализ включены роды Pamponerus, Antipalus, Erax, Leleyellus, Filiolus, Neomochtherus, Aneomochtherus, Dysmachus, Polysarca, Satanas. Причем особое внимание нами уделено представителям сложной в таксономическом плане трибы Neomochtherini (Pamponerus, Antipalus, Erax, Aneomochtherus, Leleyellus, Filiolus, Didysmachus, Neomochtherus, Dysmachus).
Филогения подсемейства Stichopogoninae
Кроме рода Eremodromus Zimin, в настоящий анализ также вовлечены три вида рода Stichopogon Loew, 1847 (Stichopogon barbistrellus Loew, 1854; Stichopogon scaliger Loew, 1847 и Stichopogon tridactylophagus Lehr, 1975), а также один вид из рода Lasiopogon Loew, 1847 (Lasiopogon cinctus (Fabricius, 1781)).
Представители всех трех родов имеют хорошо выраженную экологическую приуроченность. Представители рода Lasiopogon Loew приурочены к долинам рек [22]. Представители рода Stichopogon Loew обитают в различных ландшафтах (берега рек, солончаки, различные типы песков, а также глинистые и щебнистые пустыни) [22–24]. В структуре рода Stichopogon Loew выделяют три филогенетические группы [22]:
1. Группа nigritta (Stichopogon malkovskii (Lehr, 1964), Stichopogon nigritus (Paramonov, 1930), Stichopogon pholipteron V. Richter, 1973). У представителей этой группы отсутствуют хохолки на латеральных пластинках яйцекладов самок. Представители этой своеобразной группы в настоящий анализ включены не были.
2. Группа barbistrellus (Stichopogon albofasciatus (Meigen, 1820); Stichopogon barbistrellus Loew, 1854; Stichopogon elegantulus (Wiedemann, 1820); Stichopogon inaequalis Loew, 1847; Stichopogon parvipulvillatus Lehr, 1975; Stichopogon rivulorum Lehr, 1975; Stichopogon selenginus Lehr, 1848; Stichopogon tridactylophagus Lehr, 1975). Из этой группы мы включили в анализ два вида Stichopogon tridactylophagus Lehr, 1975 и Stichopogon barbistrellus Loew, 1854.
3. Группа scaliger (Stichopogon ammophilus Lehr, 1975; Stichopogon aurigerum Lehr, 1984; Stichopogon chrysostoma Schiner, 1867; Stichopogon kerzhneri Lehr, 1975; Stichopogon scaliger Loew, 1847). Из этой группы в анализ нами включен Stichopogon scaliger Loew.
Целью работы была реконструкция филогении триб подсемейства Asilinae, с особым вниманием к трибе Neomochtherini, а также понимание положения рода Eremodromus Zimin в составе подсемейства Stichopogoninae. Нами также предпринята попытка выяснить систематическое положение родов Aneomochtherus Lehr, Neomochtherus Osten-Sacken, Filiolus Lehr, Cerdistus Loew и Dysmachus Loew, основываясь на молекулярных данных.
МАТЕРИАЛЫ И МЕТОДЫ
ДНК была выделена из одной ноги насекомого с помощью метода выделения, описанного Галинской с соавт. [25].
ПЦР была проведена с использованием праймеров, представленных в табл. 1.
Таблица 1.
Праймеры и температурные профили ПЦР для амплификации участков генов 12S, 18S, 16S
| Ген | Название праймера | Последовательность праймера (5'–3') | Направленность праймера | Источник |
|---|---|---|---|---|
| 16S | 16Sf-Su | CGCCTGTTTAACAAAAACAT | Прямой | Su et al., 2016 |
| 16Sr-Su | TGAACTCAGATCATGTAAGAAA | Обратный | То же | |
| 12S | DRMT2279N | GTCATTCTAGATACACTTTCCAGTAC | Прямой | Jenkins et al., 1996 |
| DRMT1653S | GGTGCCAGCAGTCGCGGTTA | Обратный | То же | |
| 18S | Asilidae_18S_3_A2.0 | ATGGTTGCAAAGCTGAAAC | Прямой | Giribet et al., 1996 |
| Asilidae_18S_3_9R | GATCCTTCCGCAGGTTCACCTAC | Обратный | То же |
Для ПЦР был использован набор Screen-Mix (ЗАО Евроген). Реакция проводилась в объеме 25 мкл. Температурный профиль реакции: начальная денатурация 3 мин при 94°C; 35 циклов, каждый включает 1 мин при 94°C, 1 мин при 50°C, 1 мин 30 с при 72°C; финальная элонгация 5 мин при 72°C.
Продукты амплификации были визуализированы с помощью электрофореза в 1%-ном агарозном геле с применением EtBr.
Секвенирование было проведено с прямого и обратного праймеров с помощью секвенатора ABI Prism 3130 Ч 1 (Applied Biosystems, США), с использованием Big Dye™ Terminator v. 3.1 Cycle Sequencing kit (Applied Biosystems).
Материал, включенный в анализ, представлен в табл. 2.
Таблица 2.
Материал, использованный для молекулярного анализа
| Номер пробы | Вид | Этикетка | Ген 12S | Ген 16S | Ген 18S | Источник |
|---|---|---|---|---|---|---|
| номер сиквенса в ГенБанке | ||||||
| DNA_2019_2 | Pamponerus germanicus Linnaeus | Беларусь, Витебская обл., Сенненский р-н, 1.3 км В д. Щитовка, опушка смеш. леса, край низинного болота, светоловушка, 54.87362° N, 30.40294° E, 06.VI.2017, 1♂ (Е.А. Держинский) | MN417773 | MN417790 | – | Оригинальные данные |
| DNA_2019_3 | Aneomochtherus flavipes Meigen | Россия, Республика Дагестан, Ногайский р-н, село Терекли-Мектеб, 19–21.VII.2017, 1♂ (Е.В. Ильина) | MN417774 | MN417791 | MN417757 | То же |
| DNA_2019_4 | Antipalus varipes Meigen | Волгоградская обл., Иловлинский р-н, окр. х. Байбаев, прав. бер. р. Дон, луг, 49°10.719′ N, 44°00.790′ E, 18.VI.2017, 1♀ (Д.М. Астахов) | MN417775 | MN417792 | – | » |
| DNA_2019_5 | Erax barbatus Scopoli | Россия, Саратовская обл., Саратовский р-н, 4 км ЮВ с. Рыбушка, 51°14.58′ N, 45°29.93′ E, 1.V.2017, 1♀ (И.А. Забалуев) | MN417776 | MN417793 | MN417758 | » |
| DNA_2019_6 | Leleyellus eulabes Loew | Узбекистан, Кашкадарьинская обл., Дехканабадский р-н, глинистая пустыня, цвет. западинки, 38.419740° N, 66.441090° E, 11.V.2015, 1♀ (К.Г. Самарцев) | MN417777 | MN417794 | – | » |
| DNA_2019_7 | Leleyellus eulabes Loew | Узбекистан, Кашкадарьинская обл., Дехканабадский р-н, глинистая пустыня, цвет. западинки, 38.419740° N, 66.441090° E, 11.V.2015, 1♂ (К.Г. Самарцев) | MN417778 | MN417795 | – | » |
| DNA_2019_8 | Filiolus graminicola Lehr | Казахстан, Мангистауская обл., окр. села Бейнеу, плато Устюрт, 45°26.160′ N, 55°22.015′ E, 05.VI.2017, 1♂ (Д.М. Астахов) | MN417779 | MN417796 | MN417759 | » |
| DNA_2019_9 | Aneomochtherus perplexus Becker | Astrakhan prov., Limansky distr., 7 km SE Promyslovka, 45°67.39′ N, 47°23.80′ E, 4–5.VI.2016, 1 ♂ (К.А. Гребенников) | MN417780 | MN417797 | MN417760 | Оригинальныеданные |
| DNA_2019_10 | Molobratia teutonus Linnaeus | Волгоградская обл., Иловлинский р-н, окр. хутора Хмелевской, прав. бер. р. Дон, меловые горы, 49°11′15.90′′ N, 43°47′49.29′′ E, 9.VI.2016, 1 ♀ (Д.М. Астахов) | – | MN417798 | – | То же |
| DNA_2019_13 | Leptarthrus brevirostris Meigen | Карачаево-Черкесия, окр. п. Архыз, оз. Малая Запятая, околоводн. раст-ть, 2219 м н. у. м., 43°28.381′ N, 41°13.864′ E, 7.VIII.2016, 1 ♀ (Д.М. Астахов) | – | MN417799 | MN417761 | » |
| DNA_2019_14 | Pegesimallus mesasiaticus Lehr | Астраханская обл., возле курорта Тинаки-2, пески, берег Волги, 9–10.VII.2016, 1 ♀ (Е.В. Ильина) | MN417781 | MN417800 | – | » |
| DNA_2019_15 | Stichopogon tridactylophagus Lehr | Дагестан, бархан Сарыкум, 43°00.76′ N, 47°14.017′ E, 4–5.VII.2015, 1 ♀ (Д.М. Астахов) | MN417782 | – | MN417762 | » |
| DNA_2019_16 | Stichopogon tridactylophagus Lehr | Дагестан, бархан Сарыкум, 43°00.76′ N, 47°14.017′ E, 4–5.VII.2015, 1 ♂ (Д.М. Астахов) | – | – | MN417763 | » |
| DNA_2019_18 | Didysmachus picipes Meigen | Мордовия, Темниковский район, Мордовский заповедник, кв. 434, 5.VI.2015, 1 ♂ (А.Б. Ручин) | – | – | MN417764 | » |
| DNA_2019_19 | Neomochtherus caspicus V. Richter | Дагестан, Магарамкентский р-н, 2 км NW Гильяр, Самур, 41°57.47′ N, 48°24.42′ E, 9.VI.2017, 1 ♂ (К.А. Гребенников) | MN417783 | MN417801 | MN417765 | » |
| DNA_2019_20 | Dysmachus dasyproctus Loew | Дагестан, Дербентский р-н, 4 км W Музаим, 41°90.77′ N, 48°23.37′ E, 10–13.VI.2017, 1 ♂ (К.А. Гребенников) | MN417784 | MN417802 | MN417766 | » |
| DNA_2019_21 | Polysarca neptis Loew | Astrakhan prov., Enotaevsky distr., W Volzhsky, 46°9663′ N, 47°5254′ E, 26–28.V.2016, 1♀ (К.А. Гребенников) | MN417785 | – | – | Оригинальные данные |
| DNA_2019_23 | Neoitamus cyanurus Loew | Санкт-Петербург, парк “Сосновка”, 26.VI.2013, 1♂ (А.В. Ковалев) | – | MN417803 | – | То же |
| DNA_2019_25 | Stichopogon scaliger Loew | Волгоградская обл., Октябрьский р-н, окр. хутора Васильевка, степь, 04.VIII.2012, 1♀ (Д.М. Астахов) | MN417786 | – | – | » |
| DNA_2019_26 | Stichopogon scaliger Loew | Волгоградская обл., Октябрьский р-н, окр. хутора Васильевка, степь, 04.VIII.2012, 1♂ (Д.М. Астахов) | MN417787 | – | MN417767 | » |
| DNA_2019_27 | Stichopogon barbistrellus Loew | Астраханская обл., окр. села Досанг, пески, 26–29.VII.2012, 1♂ (Д.М. Астахов) | MN417788 | – | MN417768 | » |
| DNA_2019_28 | Eremodromus gracilis Paramonov | Астраханская обл., окр. села Досанг, пески, 26–29.VII.2012, 1♀ (Д.М. Астахов) | – | MN417769 | » | |
| DNA_2019_29 | Euscelidia pallasii Wiedemann | Саратовская обл., Краснокутский р-н, окр. села Дьяковка, степь, 25–28.VI.2012, 1♀ (Д.М. Астахов) | – | MN417804 | MN417770 | » |
| DNA_2019_30 | Leptogaster cylindrica De Geer | Волгоградская обл., окр. хутора Большенабатовский, степь, 13.VI.2015, 1♀ (Д.М. Астахов) | – | MN417805 | MN417771 | » |
| DNA_2019_31 | Leptogaster stackelbergi Lehr | Волгоградская обл., Калачевский р-н, окр. хутора Логовский, степь, 4.VI.2012, 1♀ (Д.М. Астахов) | MN417789 | MN417806 | MN417772 | » |
| DNA_2019_32 | Leptogaster stackelbergi Lehr | Саратовская обл., Краснокутский р-н, окр. села. Дьяковка, степь, 26–28.VI.2012, 1♂ (Д.М. Астахов) | – | MN417807 | – | » |
| DMA_2017_1 | Stenopogon sabaudus Fabricius, 1794 | Volgograd oblast: Volgograd, Kirov district, village Sasha Chekalin, steppe, 20.VI.2015, 1♀ (D.M. Astakhov) | MH014789 | MH036006 | MH013217 | Оригинальные данные |
| DMA_2 | Stenopogon sabaudus Fabricius, 1794 | Volgograd oblast: Volgograd, Kirov district, village Sasha Chekalin, steppe, 20.VI.2015, 1♂ (D.M. Astakhov) | MH014790 | MH036007 | MH013218 | То же |
| DMA_6 | Echthistus rufinervis (Meigen, 1820) | Volgograd oblast: Serafimovichsky district, neighborhood of Novoaleksandrovka farm, steppe, 6.VI.2015, 1♂, 1♀ (D.M. Astakhov) | MH014791 | MH036008 | – | » |
| DMA_7 | Echthistus rufinervis (Meigen, 1820) | Volgograd oblast: serafimovichsky district, neighborhood of Novoaleksandrovka farm, steppe, 6.VI.2015, 1♂, 1♀ (D.M. Astakhov) | – | MH036009 | MH013219 | » |
| DMA_8 | Neoepitriptus setosulus (Zeller, 1840) | Volgograd oblast: Ilovlinsky district, farm Baybayev, steppe, left bank of River Don, 15.VI.2012, 1♂, 1♀ (D.M. Astakhov) | MH014792 | – | – | » |
| DMA_9 | Neoepitriptus setosulus (Zeller, 1840) | Volgograd oblast: Ilovlinsky district, farm Baybayev, steppe, left bank of River Don, 15.VI.2012, 1♂, 1♀ (D.M. Astakhov) | – | MH036010 | – | » |
| DMA_10 | Antiphrisson mongolicus eryopix Lehr, 1972 | Astrakhan oblast: Dosang village, bush desert, 26–29.VII.2012, 1♂ (D.M. Astakhov) | MH014793 | MH036011 | – | » |
| DMA_11 | Cerdistus graminicola Lehr, 1967 | Volgograd oblast: Volgograd, Kirov district, village Sasha Chekalin, steppe, 20.VI.2015, 1♂, 1♀ (D.M. Astakhov) | – | MH036012 | MH013220 | » |
| DMA_12 | Cerdistus graminicola Lehr, 1967 | Volgograd oblast: Volgograd, Kirov district, village Sasha Chekalin, steppe, 20.VI.2015, 1♂, 1♀ (D.M. Astakhov) | MH014794 | MH036013 | MH013221 | » |
| DMA_14 | Philodicus ponticus (Bigot, 1880) | Astrakhan oblast: Dosang village, sands, 26–29.VII.2012, 1♂, 1♀ (D.M. Astakhov) | MH014795 | MH036014 | MH013222 | » |
| DMA_15 | Albicoma kaptshagaica Lehr, 1986 | Astrakhan oblast: overgrown sands, 5.V.2013, 1♂, 1♀ (D.M. Astakhov) | – | MH036015 | – | Оригинальные данные |
| DMA_16 | Albicoma kaptshagaica Lehr, 1986 | Astrakhan oblast: overgrown sands, 5.V.2013, 1♂, 1♀ (D.M. Astakhov) | MH014796 | MH036016 | MH013223 | То же |
| DMA_19 | Dysmachus cochleatus (Loew, 1854) | Volgograd oblast: Kalachov district, farm Logovsky, steppe, 4.VI.2012, 1♂, 1♀ (D.M. Astakhov) | MH014797 | MH036017 | MH013224 | » |
| DMA_20 | Dysmachus cochleatus (Loew, 1854) | Volgograd oblast: Kalachov district, farm Logovsky, steppe, 4.VI.2012, 1♂, 1♀ (D.M. Astakhov) | MH014798 | MH036018 | – | » |
| DMA_21 | Odus elachypteryx (Loew, 1871) | Astrakhan oblast: village Enotaevka, steppe, 23–25.VII.2012, 1♂, 1♀ (D.M. Astakhov) | MH014799 | MH036019 | – | » |
| DMA_22 | Odus elachypteryx (Loew, 1871) | Astrakhan oblast: village Enotaevka, steppe, 23–25.VII.2012, 1♂, 1♀ (D.M. Astakhov) | MH014800 | MH036020 | – | » |
| DMA_25 | Eremisca vernalis Zinovjeva, 1956 | Astrakhan oblast: Dosang village, sands, 2.V.2012, 1♂, 1♀ (D.M. Astakhov) | – | MH036021 | – | » |
| DMA_26 | Eremisca vernalis Zinovjeva, 1956 | Astrakhan oblast: Dosang village, sands, 2.V.2012, 1♂, 1♀ (D.M. Astakhov) | MH014801 | MH036022 | – | » |
| DMA_27 | Dysmachus stylifer (Loew, 1854) | Volgograd oblast: Oktyabrsky district, village Vasilyevka, fescue-feather grass steppe (lake shore), 6.VI.2012, 1♂ (D.M. Astakhov) | – | MH036023 | – | » |
| DMA_28 | Machimus gonatistes (Zeller, 1840) | Dagestan: Kumtorkalinsky district, barkhan Sarykum, 4.VII.2015, 1♂, 1♀ (D.M. Astakhov) | MH014802 | MH036024 | – | » |
| DMA_29 | Machimus gonatistes (Zeller, 1840) | Dagestan: Kumtorkalinsky district, barkhan Sarykum, 4.VII.2015, 1♂, 1♀ (D.M. Astakhov) | MH014803 | MH036025 | – | » |
| DMA_30 | Dysmachus fuscipennis (Meigen, 1820) | Saratov oblast: national park “Khvalynsky”, meadow steppe, 21.VI.2012, 1♂, 1♀ (D.M. Astakhov) | MH014804 | MH036026 | – | Оригинальные данные |
| DMA_32 | Philonicus albiceps (Meigen, 1820) | Volgograd oblast: Serafimovichsky district, neighborhood of Novoaleksandrovka farm, steppe, 6.VI.2015, 1♀ (D.M. Astakhov) | – | MH036027 | – | То же |
| DMA_33 | Philonicus albiceps (Meigen, 1820) | Dagestan: Kumtorkalinsky district, barkhan Sarykum, 4.VII.2015, 1♂ (D.M. Astakhov) | – | MH036028 | – | » |
| DMA_34 | Astochia caspica Hermann, 1917 | Dagestan: Kumtorkalinsky district, barkhan Sarykum, 4.VII.2015, 1♀ (D.M. Astakhov) | – | MH036029 | – | » |
| DMA_35 | Eutolmus sedakoffii Loew, 1854 | Saratov oblast: Krasnokutsky district, village Dyakovka, mixed-fescue-feather grass steppe, 25.VI.2012, 1♀ (D.M. Astakhov) | – | MH036030 | – | » |
| DMA_46 | Polysarca neptis Loew, 1873 | Astrakhan oblast: Dosang village, sands, 7.V.2016, 1♀ (D.M. Astakhov) | MH014805 | MH036031 | – | » |
| DMA_47 | Polysarca neptis Loew, 1873 | Kazakhstan. Atyrau region: neighborhood of Isatai, 2.V.2016, 1♂ (D.M. Astakhov) | MH014806 | MH036032 | – | » |
| DMA_55 | Astochia caspica Hermann, 1917 | Dagestan: Kumtorkalinsky district, barkhan Sarykum, 4–5.VII.2015, 1♂ (D.M. Astakhov) | – | MH036033 | – | » |
| DMA_56 | Machimus rusticus (Meigen, 1820) | Volgograd oblast: Oktyabrsky district, village Vasilyevka, fescue-feather grass steppe (lake shore), 6.VI.2012, 1♂ (D.M. Astakhov) | MH014807 | MH036034 | – | Оригинальные данные |
| Machimus sp. | – | AY325010.1 | AY325041.1 | ГенБанк | ||
| Proctacanthus nearno Martin, 1962 | – | AY325009.1 | AY325040.1 | То же | ||
| Efferia nemoralis (Hine, 1911) | – | AY325008.1 | AY325039.1 | » | ||
| Promachus sp. | – | AY324985.1 | AY325016.1 | » | ||
| Promachus bastardii (Macquart, 1838) | – | AY324984.1 | AY325015.1 | » | ||
| Asilus crabroniformis Linnaeus, 1758 | KC177475.1 | KC177451.1 | KC177289.1 | » | ||
| Cerdistus sp. | AF456850.1 | – | » | |||
| Satanas sp. | KT225300.1 | – | – | » | ||
| Leptogaster longicauda Hermann, 1917 | KT225296.1 | – | – | » | ||
| Leptogaster flavipes Loew, 1862 | – | KM878927.1 | KM879001.1 | » | ||
| Leptogaster sp. | – | AY325003.1 | AY325034.1 | » | ||
| Psilonyx annulatus (Say, 1823) | – | AY325012.1 | AY325043.1 | » | ||
| Stenopogon martini Bromley, 1937 | – | AY325013.1 | AY325044.1 | » | ||
Нуклеотидные последовательности были первично выравнены в программе MAFFT v. 6 [26], с применением настроек по умолчанию, после чего выравнивание было проверено вручную в программе BioEdit 7.0.5.2 [27] и немного откорректировано. Последовательности 16S рДНК, 12S рДНК и 18S рДНК были выравнены по отдельности и затем совмещены в единое выравнивание, разделенное на партиции, для дальнейшего анализа.
С помощью программы MODELTEST v. 3.6 [28] мы подобрали оптимальные эволюционные модели замен для выравнивания каждого гена. Наиболее подходящими моделями и для Байесова анализа (BI), и для анализа максимального правдоподобия (ML) согласно информационному критерию Акаике (AIC) получились GTR + I + G, GTR + G и JC модели для 16S рДНК, 12S рДНК и 18S рДНК соответственно.
Мы проанализировали как каждый ген по отдельности, так и объединенное выравнивание всех генов вместе. Байесов анализ проводили в программе MrBayes v. 3.2.6 [29]. Было проведено пять независимых MCMC запусков и 1000 деревьев были отброшены на стадии “burn-in”. Сходимость запусков была проверена путем изучения графиков вероятности в программе TRACER v. 1.6 [30]; эффективные размеры выборки (ESS) всегда были выше 200. Поддержка узлов была оценена путем расчета апостериорных вероятностей (BIPP).
Для построения филогении с применением метода максимального правдоподобия (ML), реализованного на веб-сервере RaxML [31], были использованы те же модели нуклеотидных замен, что и в байесовом анализе. Поддержка узлов была оценена с помощью непараметрического бутстреп-метода (MLBS) с 1000 псевдорепликами [32].
Мы рассматривали узлы дерева со значением апостериорных вероятностей (BIPP) выше 0.95 и со значением бутстреп-поддержек (MLBS) выше 75% как узлы с высокой достоверностью; в то время как значения BIPP между 0.95 и 0.90 и значения MLBS между 75 и 50% рассматривались нами как узлы со средней вероятностью. Более низкие значения указывали на практически неразрешенные узлы [33].
РЕЗУЛЬТАТЫ
Совмещенное выравнивание по трем генам содержало 1587 позиций (16S рДНК с 417 позициями, 12S рДНК с 454 позициямии, 18S рДНК с 716 позициями). В окончательном выравнивании по трем генам 985 позиций были консервативными и 602 – вариативными. Выравнивание гена 16S рДНК выявило 203 консервативные позиции и 214 вариативных, гена 12S рДНК – 206 консервативных позиций и 248 вариативных; гена 18S рДНК – 572 консервативные позиции и 144 вариативных.
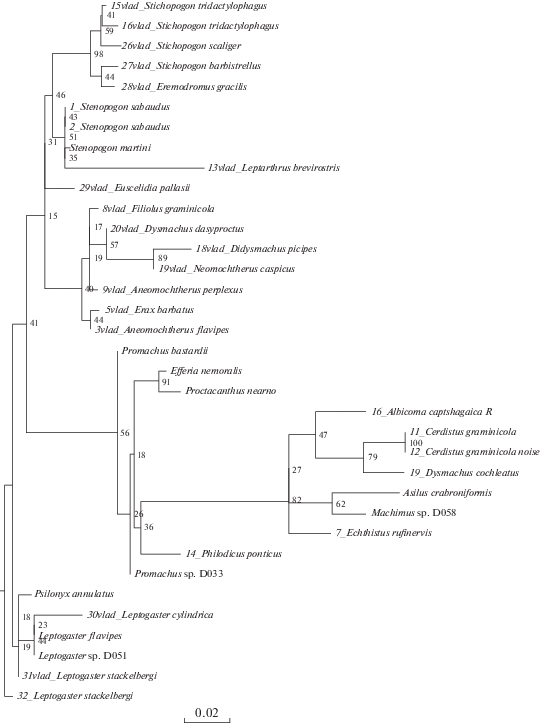
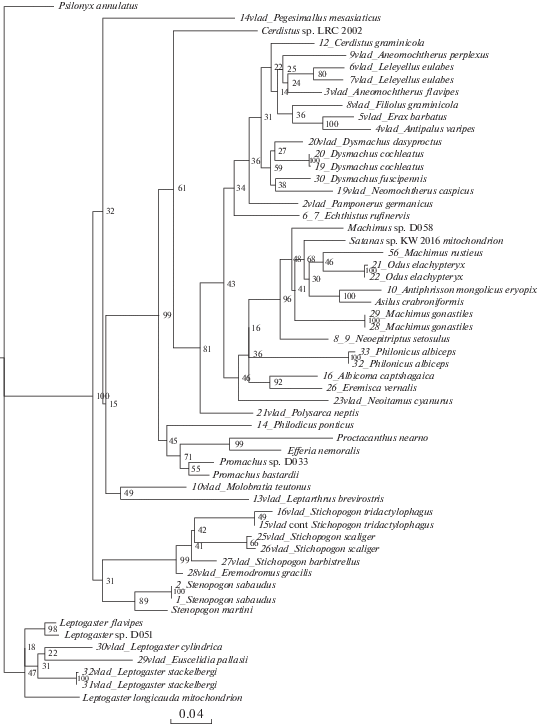
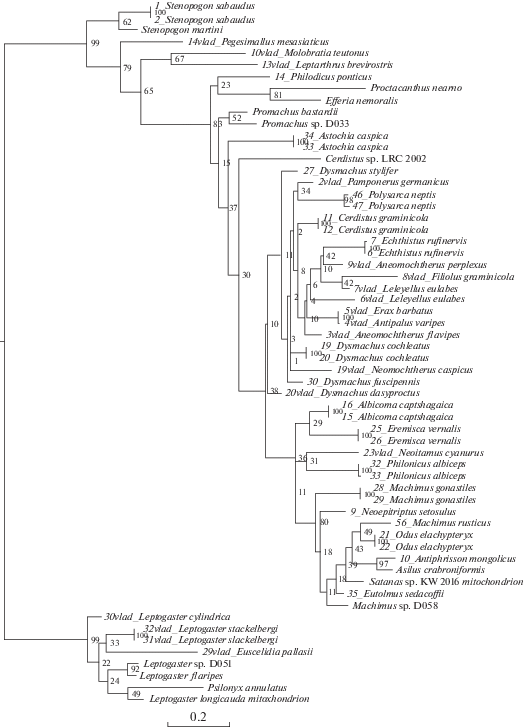
На полученных деревьях (рис. 1–8) хорошо заметно объединение видов подсемейства Asilinae по трибам Neomochtherini (Pamponerus Loew, Antipalus Loew, Erax Scopoli, Leleyellus Lehr, Filiolus Lehr, Neomochtherus Osten-Sacken, Aneomochtherus Lehr, Dysmachus Loew), Machimini (Machimus Loew, Neoepitriptus Lehr, Antiphrisson Loew и Odus Lehr) и Philonicini (Philonicus Loew, Eremisca Hull). Вызывает вопросы положение вида Neoitamus cyanurus, требуется работа с дополнительным материалом, чтобы понять положение рода Neoitamus в составе подсемейства Asilinae.
Рис. 1.
Байесово дерево, построенное на основании последовательностей гена 12S. Байесовы постериорные вероятности указаны на узлах.
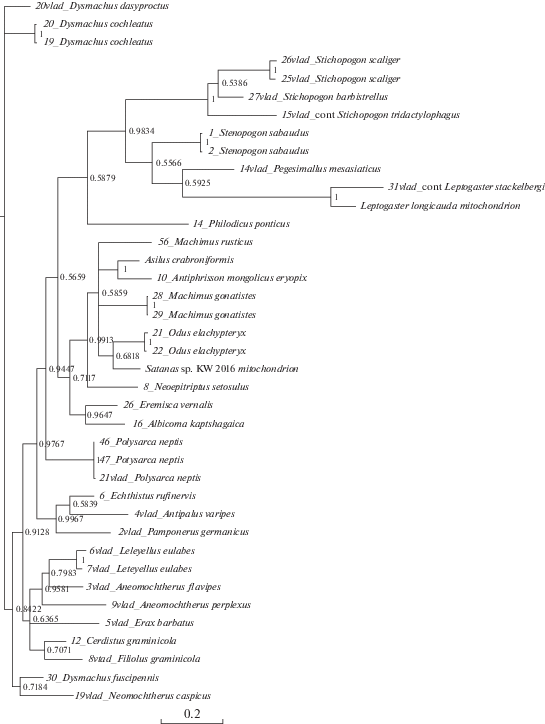
Рис. 2.
Байесово дерево, построенное на основании последовательностей гена 16S. Байесовы постериорные вероятности указаны на узлах.
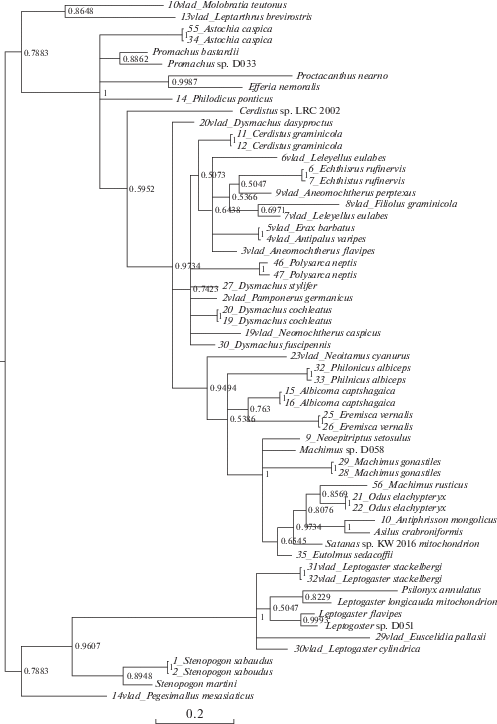
Рис. 3.
Байесово дерево, построенное на основании последовательностей гена 18S. Байесовы постериорные вероятности указаны на узлах.
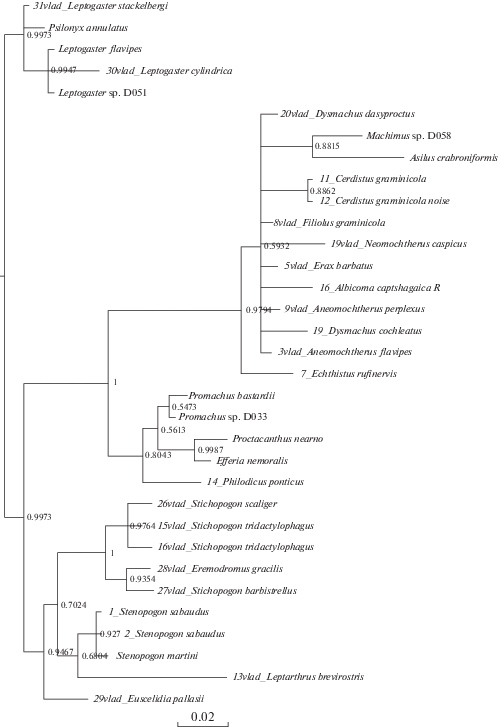
Рис. 4.
Байесово дерево, построенное на основании совмещенных выравниваний генов 12S, 16S, 18S. Байесовы постериорные вероятности указаны на узлах.
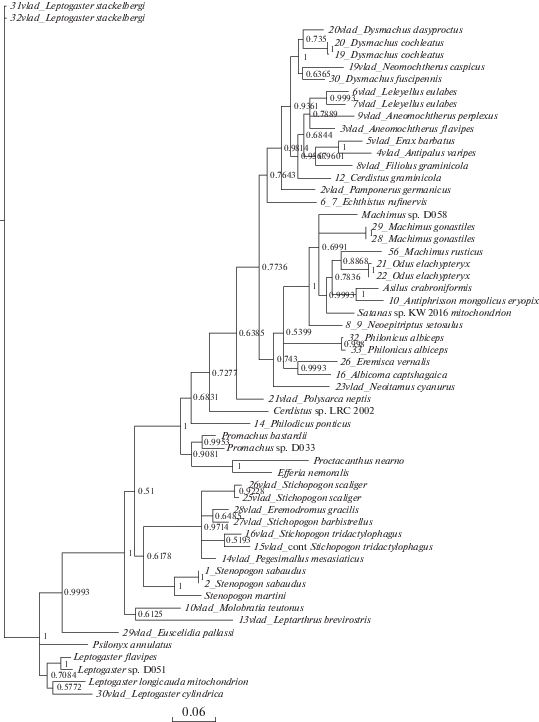
Рис. 5.
Дерево максимального правдоподобия (ML), построенное на основании последовательностей гена 12S. Бутстреп-поддержки указаны на узлах.
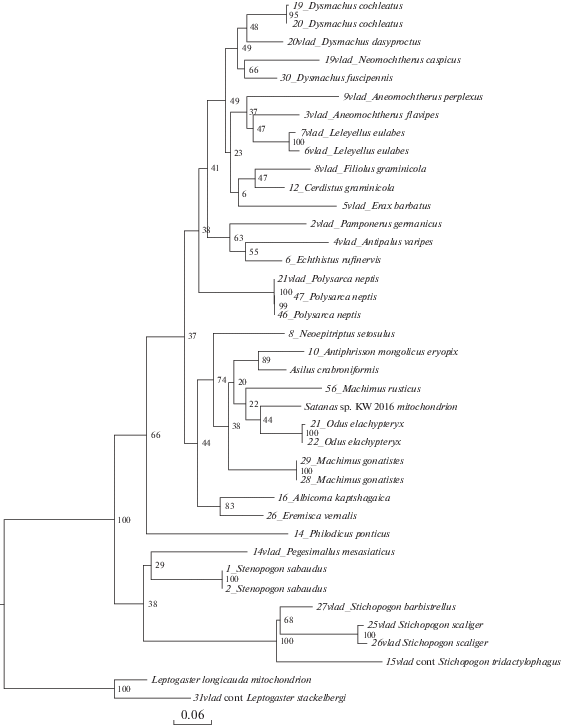
Рис. 6.
Дерево максимального правдоподобия (ML), построенное на основании последовательностей гена 16S. Бутстреп-поддержки указаны на узлах.
ОБСУЖДЕНИЕ
Появление дополнительного материала по подсемейству Stichopogoninae позволило по-новому взглянуть на его филогению. Исключительный интерес представляет исследование малоизвестного рода Eremodromus Zimin, 1926 и выяснение его места в подсемействе Stichopogoninae. Диков отмечает, что у ктырей антенны располагаются в дорсальной половине головы [2]; нами в 2012 г. было показано, что у вида Eremodromus noctivagus Zimin, 1926 антенны расположены в вентральной половине головы [34], что является уникальным состоянием этого признака в семействе Asilidae. Нами проведены молекулярно-генетические исследования вида Eremodromus gracilis (Paramonov, 1930), что позволило понять место рода Eremodromus в подсемействе Stichopogoninae. По результатам нашего анализа хорошо видно, что Eremodromus gracilis наиболее близок к Stichopogon barbistrellus Loew, 1854, что на наш взгляд не является безосновательным и можно объяснить сходством в характере расположения щетинок на VIII стерните самок. У Stichopogon barbistrellus Loew и Stichopogon tridactylophagus Lehr, 1975 “хохолки” (термин Лера [24]) на VIII стерните самок не выражены, также и у представителей рода Eremodromus. У большинства палеарктических видов ктырей рода Stichopogon Loew, 1847 эти пучки волосков хорошо выражены. Виды и роды из подсемейства Leptogastrinae рассматриваются нами в настоящей работе как представители внешней группы (Euscelidia pallasii (Wiedemann, 1818), Leptogaster cylindrica (De Geer, 1776), Leptogaster stackelbergi (Lehr, 1961)) и приводятся на основе личных сборов. Особый интерес представляло рассмотрение описанного Лером вида Leptogaster stackelbergi Lehr [35].
Настоящая работа подтвердила взгляды Лера на состав подсемейства Asilinae, показав распределение по трибам в соответствии с его выводами. Одним из существенных, на наш взгляд, вопросов является то, что на финальном дереве Neomochtherus caspicus (V. Richter, 1966) попал в одну кладу c Dysmachus fuscipennis (Meigen, 1820), хотя по последним данным он является близким с родами Aneomochtherus Lehr, Filiolus Lehr и Leleyellus Lehr [6]. Также не совсем ясна ситуация с Neoitamus cyanurus (Loew, 1849), представитель рода Neoitamus Osten-Sacken, 1878 на настоящий момент не помещен ни в одну из существующих триб [2].
Также нам впервые удалось cделать предположение о месте рода Eremodromus Zimin в подсемействе Stichopogoninae. По-видимому, виды этого рода близки к некоторым видам рода Stichopogon c неразвитыми пучками волосков на VΙΙΙ стерните самок (Stichopogon barbistrellus и S. tridactylophagus).
Авторы благодарны В.В. Аникину (Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского), К.А. Гребенникову (Всероссийский центр карантина растений), Е.А. Держинскому (Витебский государственный университет им. П.М. Машерова), И.А. Забалуеву (Институт проблем экологии и эволюции им. А.Н. Северцова РАН), Е.В. Ильиной (Прикаспийский институт биологических ресурсов Дагестанского научного центра РАН), А.В. Ковалеву (Зоологический институт РАН), А.Б. Ручину (Мордовский государственный природный заповедник им. П.Г. Смидовича), К.Г. Самарцеву (Зоологический институт РАН) за предоставление своих сборов для данной работы.
Исследование выполнено при финансовой поддержке РФФИ и Администрации Волгоградской области в рамках научного проекта № 18-44-343001.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Dikow T. Genomic and transcriptomic resourcesfor assassin flies including the completegenome sequence of Proctacanthus coquilletti (Insecta: Diptera: Asilidae) and 16 representative transcriptomes // PeerJ. 2017. P. 1–20.
Dikow T. Phylogeny of Asilidae inferred from morphological characters of imagines // Bull. Am. Museum Natural History. 2009. V. 319. 175 p.
Dennis D.S., Lavigne R.J. Comparative behavior of Wyoming robber flies II (Diptera: Asilidae) // University of Wyoming Agricultural Experiment Station Science Monograph. 1975. V. 30. P. 1–68.
Londt J.G.H. Predation by Afrotropical Asilidae (Diptera): an analysis of 2000 prey records // Afr. Entomol. J. Entomological Society of Southern Africa. 2006. V. 14. № 2. P. 317–328.
Dennis D.S., Lavigne R.J., Dennis J.G. Spiders (Araneae) as prey of robber flies (Diptera: Asilidae) // J. Entomol. Res. Soc. 2012. V. 14. № 1. P. 65–76.
Лер П.А. Ктыри подсемейства Asilinae (Diptera, Asilidae) Палеарктики. Эколого-морфологический анализ, систематика и эволюция. Владивосток: Дальнаука, 1996. 184 с.
Рихтер В.А. Хищные мухи-ктыри (Diptera, Asilidae) Кавказа // Определители по фауне СССР, издаваемые Зоологическим институтом Академии наук СССР. Л.: Наука, 97. 1968. Вып. 97. С. 1–285.
Астахов Д.М. Ландшафтно-стациальное распределение ктырей (Diptera, Asilidae) Нижнего Поволжья // Энтомол. обозр. 2013. Т. 92. № 2. С. 287–302.
Астахов Д.М. Хищные мухи-ктыри (Diptera, Asilidae) Нижнего Поволжья // Тр. Русского энтомол. об-ва. 2015. Т. 86. № 1. 410 с.
Astakhov D.M., Ruchin A.B., Romadina O.D., Pristrem I.M. To robber flies fauna (Diptera: Asilidae) of Mordovia, Russia // Biodiversitas. 2019. V. 20. № 4. P. 994–1005. https://doi.org/10.13057/biodiv/d200409
Geller-Grimm F. A world catalogue of the genera of the family Asilidae (Diptera) // Studia Dipterologica. 2004. V. 10. № 2. P. 473–526.
Dikow T. A phylogenetic hypothesis for Asilidae based on a total evidence analysis of morphological and DNA sequence data (Insecta: Diptera: Brachycera: Asiloidea) // Organisms Diversity & Eolution. 2009. V. 9. P. 165–188.
Hull F.M. Robber flies of the world // Bul. United States Nat. Museum. 1962. V. 224. № 2. P. 431–907.
Лер П.А. Сем. Asilidae–ктыри. Определитель насекомых Дальнего Востока России. Т. IV. Двукрылые и блохи. Ч. 1. Владивосток: Дальнаука, 1999. С. 591–640.
Лер П.А. Ктыри подсем. Dioctriinae, stat. n. (Diptera, Asilidae). I. Таксономия, экология, филогения // Энтомол. обозр. 2001. Т. 80. № 1. С. 194–208.
Лер П.А. Ктыри (Diptera, Asilidae) подсем. Dioctriinae Hull Азии. II. Таксономия, экология // Энтомол. обозр. 2002. Т. 81. № 2. С. 445–459.
Lehr P.A. Family Asilidae // Catalogue of Palaearctic Diptera. Athericidae–Asilidae / Ed. Soys Б. Budapest: Akad. Kiadó, 1988. V. 5. P. 197–326.
Лер П.А. Эколого-морфологический анализ ктырей (Diptera, Asilidae) II // Энтомол. обозр. 1969. Т. 48. № 3. С. 532–560.
Лер П.А. Новые роды и виды палеарктических ктырей подсем. Asilinae (Diptera, Asilidae) // Энтомол. обозр. 1986. Т. 65. № 1. С. 167–181.
Лер П.А. Новый род ктырей подсемейства Asilinae (Diptera, Asilidae) из Палеарктики // Зоол. журн. 1986. Т. 65. № 2. С. 302–305.
Лер П.А. “Малые” роды ктырей подсемейства Asilinae (Diptera, Asilidae). 1. Таксономия, экология // Зоол. журн. 1992. Т. 71. № 5. С. 91–105.
Лер П.А. Ктыри трибы Stichopogonini (Diptera, Asilidae) фауны СССР. Сообщ. 2 // Зоол. журн. 1984. Т. 63. № 6. С. 859–864.
Лер П.А. Ктыри рода Stichopogon Loew, 1847 (Diptera, Asilidae) фауны СССР. I // Энтомол. обозр. 1975. Т. 54. № 2. С. 432–441.
Лер П.А. Ктыри рода Stichopogon Loew, 1847 (Diptera, Asilidae) фауны СССР. II // Энтомол. обозр. 1975. Т. 54. № 3. С. 641–651.
Galinskaya T.V., Oyun N.Yu., Teterina A.A., Shatalkin A.I. DNA barcoding of Nothybidae (Diptera) // Oriental Insects. 2016. V. 50. № 2. P. 69–83. https://doi.org/10.1080/00305316.2016.1174747
Katoh K., Misawa K., Kuma K., Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform // Nucl. Acids Res. 2002. V. 30. № 13. P. 3059–3066.
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucleic Acids Symposium Series. London: Inform. Retrieval Ltd. 1999. P. 95–98.
Posada D., Crandall K.A. Modeltest: testing the model of DNA substitution // Bioinformatics. 1998. V. 14. № 9. P. 817–818.
Ronquist F., Huelsenbeck J.P. MrBayes 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. № 12. P. 1572–1574.
Rambaut A., Suchard M., Xie W., Drummond A. Tracer v. 1.6. Institute of Evolutionary Biology. Univ. Edinburgh, 2014. Available at: http://tree.bio.ed.ac.uk/software/tracer/.
Kozlov A., Darriba D., Flouri T. et al. 2018: RAxML-NG: A fast, scalable, and user-friendly tool for maximum likelihood phylogenetic inference. bioRxiv: 447110.
Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap // Evolution. 1985. V. 39. № 4. P. 783–791.
Huelsenbeck J.P., Hillis D.M. Success of phylogenetic methods in the four-taxon case // Systematic Biol. 1993. V. 42. № 3. P. 247–264.
Рихтер В.А., Астахов Д.М. Заметки по морфологии ктырей (Diptera, Asilidae) // Энтомол. обозр. 2012. Т. 91. № 2. С. 441–442.
Лер П.А. Ктыри подсемейства Leptogastrinae (Diptera, Asilidae) фауны СССР // Энтомол. обозр. 1961. Т. 50. № 3. С. 686–703.
Дополнительные материалы отсутствуют.