Генетика, 2020, T. 56, № 8, стр. 922-932
Пространственно-генетическое структурирование популяции у обыкновенной бурозубки Sorex araneus (Lipotyphla, Mammalia): изменчивость микросателлитных маркеров
Н. А. Щипанов 1, А. В. Артамонов 1, С. В. Титов 2, С. В. Павлова 1, *
1 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
2 Пензенский государственный университет
440026 Пенза, Россия
* E-mail: swpavlova@mail.ru
Поступила в редакцию 16.08.2019
После доработки 01.10.2019
Принята к публикации 03.10.2019
Аннотация
Изменчивость пяти микросателлитных локусов была изучена у обыкновенной бурозубки S. araneus хромосомной расы Москва; всего проанализировано три локальные выборки (n = 39) на минимальной друг от друга дистанции (350–700 м). Обнаружены высокое разнообразие аллелей в изученных выборках и значимая генетическая дифференциация населения. При попарных сравнениях выявлено достоверное различие между выборками, причем наибольшие генетические различия наблюдались на минимальной географической дистанции. Для объяснения причин возникновения генетической гетерогенности популяции проведен анализ демографических характеристик населения на месте взятия выборок и на соседних участках. Полученный результат соответствует моделям популяционной системы Алтухова.
Обыкновенная бурозубка – вид с выдающимся хромосомным полиморфизмом, образует на своем ареале не менее 76 хромосомных рас [1]. В местах контакта ареалов рас за счет баланса между дисперсией особей и отбором против гетерозигот (межрасовых гибридов) образуются “напряженные” (tension) гибридные зоны [2]. Поток генов между формами в напряженных гибридных зонах ограничен, и это обусловливает их дивергенцию за счет действия отбора или генетического дрейфа [3–5]. Ширина напряженных зон обратно пропорциональна величине отбора против гибридов [6]. У обыкновенной бурозубки сложность гибридов определяется кариотипическими различиями родительских рас, а ширина гибридных зон обратно пропорциональна количеству различий [7]. Это позволило бы говорить о дивергенции хромосомных рас, однако исследования по изменчивости ДНК-маркеров не свидетельствуют об ограничении межрасового потока генов. Так, распределение митотипов не соответствует кариотипическому структурированию и образует звездообразную фигуру [8–11]. Исследователи отмечают высокое гаплотипическое разнообразие: редкие и уникальные гаплотипы составляют около 70%, и именно эти гаплотипы различают выборки [9, 12–14]. Изучение ядерной ДНК не выявило значимого ограничения межрасового потока генов [15, 16]. Fst свидетельствует о структурировании населения, но при этом генетические дистанции между популяциями одной и различных рас сходны [15, 17, 18] и не связаны с географическими дистанциями [9, 19–21].
Оценка потока генов в связи с ограничением возможности гибридизации дала противоречивые результаты. Так, для гибридов между шведскими расами Abisko и Sidensjö обнаружены уменьшение веса тестикул и повышенная смертность сперматозоидов [22], но Fst по аутосомным микросателлитам низкий 0.018 [13]. У гибридов между другими шведскими расами Hällefors и Uppsala [20] не обнаружено признаков снижения фертильности [22], но Fst идентичен (0.018) гибридам Abisko–Sidensjö с пониженной фертильностью. При сравнении популяций в нескольких других гибридных зонах Fst составлял от 0.013 до 0.036 и не зависел от сложности гибридов [15].
Очевидно, что такое несоответствие кариотипической и молекулярной дифференциации требует объяснений. Если низкий уровень молекулярной дифференциации – свидетельство неограниченного потока генов [13, 16], то невозможно объяснить зависимость ширины гибридной зоны от уровня кариотипических различий. Неясно также и почему снижение фертильности гибридов не сказывается на генетической дистанции [13, 22]. Учитывая, что связанное с хромосомными перестройками ограничение потока генов можно рассматривать как один из начальных этапов дивергенции, объяснение указанных противоречий имеет принципиальное значение.
Ранее мы [23, 24] уже обращали внимание на то, что и обилие редких аллелей и несоответствие генетических и географических дистанций хорошо согласуются с моделью популяционной системы [25–27]. Цель данной работы – провести оценку распределения частот генетических маркеров в смежных локальных популяциях в мелком географическом масштабе (внутри одной хромосомной расы), а также попробовать объяснить их распределение с учетом демографических характеристик популяции и сравнить полученный результат с ожиданиями в модели подразделенной популяции.
МАТЕРИАЛЫ И МЕТОДЫ
Место работы и животные
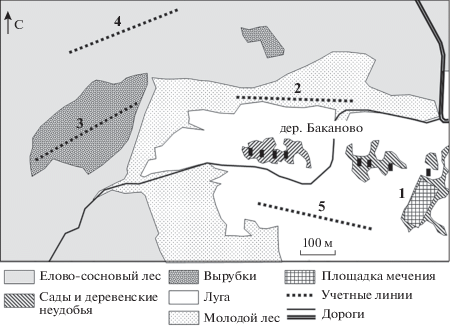
Для демографических характеристик был использован материал, собранный в ходе продолжающегося мониторинга мелких млекопитающих на стационаре “Крутицы” в Старицком районе Тверской области (56°18′ N, 34°53′ E), в центральной части ареала расы Москва [28]. Наблюдения проводили в августе в нескольких основных местообитаниях на пяти участках, в трех из которых взяты выборки для генетического анализа (рис. 1).
Рис. 1.
Схема взаимного расположения пяти участков наблюдений на стационаре “Крутицы”. Материал для анализа микросателлитов был собран на участках 1–3. Участок 1 – заброшенная в 70-е годы территория деревни с высокотравными зарослями рудеральной флоры, лугового разнотравья с доминированием злаков и островками молодого леса; участок 2 – брошенное в 1998 г. картофельное поле, сейчас молодой березовый лес с заметной примесью сосны (с диаметром ствола 10–20 см), мертвопокровник с единичными луговыми травянистыми растениями; участок 3 – вырубка 1998 г., заросшая молодым березняком, нижний ярус сильно захламлен, разнотравье с пятнами мертвопокровника и куртинами зеленомошников и долгомошников; участок 4 расположен в условно-коренном елово-сосновом лесу, зеленомошник с участками мертвопокровника; участок 5 – злаково-разнотравный луг.
Мечение зверьков (ампутация концевых фаланг с последующей их фиксацией в 96%-ном этаноле) проводили по специально разработанному для бурозубок протоколу [29]. На участках 2–5 наблюдения проводили на линиях из 50 живоловок общей длиной 375 м каждая. На участке 1 – на площадке общей площадью 0.65 га, 87 живоловок. Наблюдения на участках 2 и 5 были начаты в 2006 г. Для ретроспективного анализа демографических показателей использовали данные 2014–2018 гг., когда учет был проведен на всех пяти участках. Всего было помечено 439 обыкновенных бурозубок, 2380 повторных ловов. В 2017 г., когда проводили сбор материала для генетического анализа, помечено 128 особей, 644 повторных отлова. В обсуждении использованы данные долгосрочных наблюдений на участках 2 и 5.
Плотность (D) зверьков на линиях рассчитана для оседлых бурозубок как отношение числа животных с повторными ловами к площади облова, а число нерезидентов – как разница общего числа особей и особей, определенных на линии как оседлые. На площадке плотность определена как число особей, пойманных повторно на центральных линиях, плюс половинное число таких особей на периметре, а нерезидентами считали всех особей, не давших повторных ловов [30]. Для характеристики потока мигрантов использовали индекс обилия нерезидентов In – количество обнаруживаемых нерезидентов за одну проверку на 100 ловушек и индекс уловистости Ic – доля улова нерезидентов в общем среднесуточном улове.
Микросателлиты
ДНК выделяли из когтевых фаланг пальцев, зафиксированных в этаноле (96%) по общепринятой хлороформ-фенольной методике [31, 32]. Полимеразную цепную реакцию (ПЦР) проводили в амплификаторе “Терцик” (ДНК-диагностика, Россия) в 25 мкл реакционной смеси, содержащей 50 мМ трис-HCl (pH 8.9), 20 мМ сульфата аммония, 20 мкМ ЭДТА, 170 мкг/мл бычьего сывороточного альбумина (BSA), смесь дезоксинуклеозидтрифосфатов (200 мкМ каждого из них), 2 мМ хлористого магния, 0.6 мкМ каждого из праймеров, 0.1–0.2 мкг ДНК и 2 ед. акт. Taq-полимеразы. Реакцию проводили при условиях 94°С – 30 с, 54–64°С – 30 с (отжиг), 72°С – 30 с (30 циклов) с использованием специфических праймеров (табл. 1) для микросателлитных локусов C117, C119, D29 с тринуклеотидными и D107, D11 с тетрануклеотидными повторами [33]. Полученные ПЦР-продукты были подвергнуты электрофоретическому разделению в 8%-ном полиакриламидном геле (ПААГ) в камере PROTEAN® II xi (Bio-Rad, USA) с целью выявления аллельного состава генотипа для каждого образца. Для более точной идентификации аллелей локусов C119 и D29 были разработаны оригинальные обратные праймеры, дающие меньшие по размерам фрагменты. Количество микросателлитных повторов в одноразмерных фрагментах последовательностей на каждой фореграмме определяли по результатам секвенирования одного из них на автоматическом секвенаторе ABI 3500 (Applied Biosystems, USA) с набором реагентов BigDye® Terminator v3.1 Cycle Sequencing Kits и праймерами, использованными при амплифицировании. Всего было просеквенировано 26 аллельных фрагментов по локусу C117, 27 – по C119, 16 – по D29, 27 – по D107 и 19 – по D11.
Таблица 1.
Праймеры, использованные для анализа микросателлитной ДНК (STR-повторы) в популяциях обыкновенной бурозубки (по [33] c изменениями)
| Локус | $Т_{{{\text{отж}}}}^{^\circ }$ | Последовательность 5'–3' | Размер фрагмента, пн | Микросателлитный повтор |
|---|---|---|---|---|
| C117 | 54 | D: TAGATGACCAGGATGGAG R: ACAGAGCTGGGAATCAGT |
210 | (CAT)n |
| C119 | 60 | D: CCAGCCTTTACTTCTGCTAC R: TGGGTCTCATTCCTCTGAC Rm: ATGGAGAGGTTACTGAGACC |
276 154 |
(ATG)n |
| D29 | 64 | D: GGAAGCAGCGTGAGACTACC R: AATGGAGACGTGACTGAGACC |
164 | (CAT)n |
| D107 | 60 | D: AGGAAGACTGGGGGTATGTT R: TAGGTCTGCTGCCTGCAT |
248 | (CTAT)n |
| D11 | 62 | D: GTGTCGAGAGTCGGAAAACC R: AGCCAGGAACAAGCCCTAC Rm: TCTTTCTCTGACAACTTGGGAT |
287 198 |
(TAGA)n |
Анализ
S-индекс (стандартное отклонение log10Nt) использовали как меру варьирования обилия [34–36]. В наших расчетах Nt – корень из популяционной плотности (d√D). Размах колебаний оценивали как максимальную разницу между log10Nt в смежные годы, деленную на S. Варьирование показано как ±sd. Синхронность динамики численности оценивали по коэффициенту ранговой корреляции Спирмена [37, 38]. Плотность в местообитаниях сравнивали в парном тесте Вилкоксона в пакете программ Statistica 7.
Всего в анализ включено 39 особей, отловленных на участках 1–3 в 2017 г. (табл. 2). Проверку на наличие нуль-аллелей и оценку достоверности с 95%-ным доверительным интервалом проводили в программе Micro-Checker [39]. Общая характеристика изменчивости (число аллелей на локус A и откорректированное по минимальному размеру выборки число аллелей Аc, ожидаемая (He) и наблюдаемая (Hо) гетерозиготность внутри каждой выборки и гетерозиготность между всеми выборками (Ht), разброс аллелей (R), индекс Garza-Williamson (G-W) [40] и Garza-Williamson модифицированный (G-W')) получена в программе Arlequin 3.5 [41]. Дистанции между выборками (попарно для каждого локуса и локусов в целом), Fst [42], $F_{{{\text{st}}}}^{'}$ и Rst [43], с использованием процедуры jackknife (100 итераций) и G-тест для 1000 пермутаций [44] рассчитаны в программе FSTAT 2.9.4 [45] для пошаговой модели мутирования, SSM [46].
Таблица 2.
Общая характеристика изменчивости микросателлитов
| Участок/выборка | n | Локус | A (Ac) | Ho | He(Ht) | R | G-W | G-W ' |
|---|---|---|---|---|---|---|---|---|
| Участок 1/В.1 | 11 | C117 | 6 | 0.455 | 0.836 | 8 | 0.67 | 0.21 |
| C119 | 10 | 0.636 | 0.905 | 19 | 0.50 | 0.37 | ||
| D11 | 6 | 0.636 | 0.797 | 6 | 0.86 | 0.75 | ||
| D29 | 3 | 0.364 | 0.325 | 2 | 1 | 0.60 | ||
| D107 | 8 | 0.727 | 0.866 | 16 | 0.47 | 0.30 | ||
| Среднее | 6.6 ± 2.6 | 0.564 ± 0.149 | 0.745 ± 0.239 | 10.2 ± 7.1 | 0.70 ± 0.23 | 0.45 ± 0.23 | ||
| Участок 2/В.2 | 14 | C117 | 10 | 0.5 | 0.899 | 13 | 0.35 | 0.35 |
| C119 | 11 | 0.714 | 0.915 | 18 | 0.58 | 0.41 | ||
| D11 | 6 | 0.928 | 0.775 | 5 | 1 | 0.75 | ||
| D29 | 3 | 0.5 | 0.537 | 2 | 1 | 0.60 | ||
| D107 | 10 | 0.357 | 0.770 | 25 | 0.39 | 0.37 | ||
| Среднее | 8 ± 3.4 | 0.6 ± 0.224 | 0.779 ± 0.151 | 12.6 ± 9.4 | 0.66 ± 0.32 | 0.50 ± 0.18 | ||
| Участок 3/В.3 | 14 | C117 | 9 | 0.429 | 0.852 | 11 | 0.75 | 0.31 |
| C119 | 12 | 0.786 | 0.915 | 26 | 0.44 | 0.44 | ||
| D11 | 5 | 0.786 | 0.735 | 5 | 0.83 | 0.63 | ||
| D29 | 4 | 0.929 | 0.611 | 4 | 0.80 | 0.80 | ||
| D107 | 8 | 0.643 | 0.862 | 8 | 0.89 | 0.3 | ||
| Среднее | 7.6 ± 3.2 | 0.714 ± 0.189 | 0.795 ± 0.122 | 10.8 ± 8.9 | 0.74 ± 0.17 | 0.50 ± 0.22 | ||
| Объединенная выборка | 33* | C117 | 6 | 0.474 | 0.884 | 13 | 0.59 | 0.29 |
| C119 | 10 | 0.712 | 0.933 | 26 | 0.51 | 0.40 | ||
| D11 | 6 | 0.784 | 0.821 | 7 | 0.90 | 0.67 | ||
| D29 | 3 | 0.597 | 0.607 | 4 | 0.93 | 0.32 | ||
| D107 | 8 | 0.576 | 0.880 | 26 | 0.58 | 0.70 | ||
| Среднее | 6.6 ± 2.6 | 0.629 ± 0.121 | 0.824 ± 0.128 | 15.2 ± 10.4 | 0.70 ± 0.24 | 0.48 ± 0.24 |
Примечание. n – число особей. * – после корректировки по минимальной выборке. A (Ac) – число аллелей на локус и откорректированное по минимальному размеру выборки число аллелей (Ac); наблюдаемая (Ho) и ожидаемая (He) гетерозиготность внутри каждой выборки и гетерозиготность между всеми выборками (Ht); R – разброс аллелей; индекс Garza-Williamson (G-W) и индекс G-W' модифицированный.
РЕЗУЛЬТАТЫ
Генетическая изменчивость
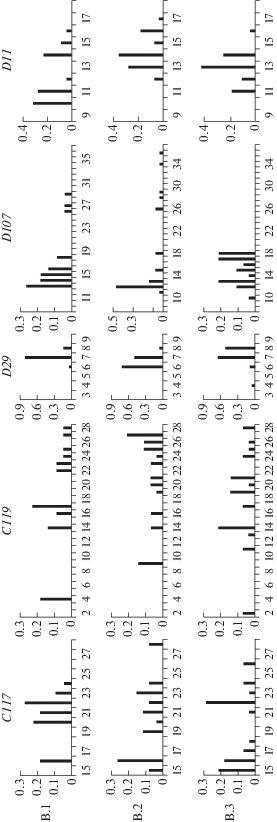
Для всех выборок (табл. 2) характерно высокое аллельное разнообразие, исключая локус D29, по которому обнаружено всего три аллеля. Наибольшее аллельное разнообразие (12 аллелей) и наибольший разброс аллелей (R = 26) – в локусе C119. Возможное (p < 0.05) присутствие нуль-аллелей обнаружено в локусах С117 – 11, С119 – 1 и D107 – 9 на 39 пар. Распределение частот аллелей во всех выборках довольно равномерное, исключая D29 в В.1, аллели не образуют выраженных пиков (рис. 2). Ожидаемая гетерозиготность большинства микросателлитов была достоверно выше наблюдаемой, кроме локусов D29 (во всех выборках) и D11 (В.3). Индекс G-W, оцененный по всем локусам, близок к критическому значению 0.68, модифицированный G-W' существенно ниже 0.68 (табл. 2).
Рис. 2.
Частоты микросателлитов в выборках В.1–В.3 на участках 1–3 (номера слева). Частота – по оси ординат, число повторов – по оси абсцисс.
Оценка генетических дистанций выявляет достоверное генетическое структурирование населения (табл. 3). При попарном сравнении с учетом всех пяти микросателлитных систем обнаружено достоверное различие выборок по Fst и Rst. Наибольшая генетическая дистанция обнаружена между соседними выборками В.1 и В.2, а наименьшая – между удаленными В.1 и В.3 (табл. 4).
Таблица 3.
Структурированность популяции S. araneus на месте работ
| Локус | Fst | $F_{{{\text{st}}}}^{'}$ | Rst | Fis | G-тест |
|---|---|---|---|---|---|
| C117 | 0.010 | 0.014 | –0.018 | 0.458*** | ** |
| C119 | 0.015 | 0.023 | 0.015 | 0.226*** | ** |
| D107 | 0.048 | 0.070 | –0.055 | 0.317*** | *** |
| D29 | 0.176 | 0.243 | 0.250 | –0.227 | *** |
| D11 | 0.069 | 0.101 | 0.294 | –0.020 | *** |
| Все | 0.055 | 0.080 | 0.080 | 0.193*** | *** |
Демографические показатели
Наименьшая плотность населения с наиболее глубокими провалами, достоверно ниже остальных участков, отмечена на участке 4 в фоновом местообитании – условно коренном елово-сосновом лесу (рис. 3).
Рис. 3.
Популяционная плотность на пяти исследуемых участках. Серой заливкой выделены участки 1–3, где изучали разнообразие микросателлитов. По оси ординат – число особей на 1 га. * p < 0.05, t – p < 0.08.
Наиболее высокая и наименее вариабельная популяционная плотность была обнаружена на участке 1. Такой же высокой она оказалась и на участке 3 – вырубке, но здесь этот показатель был более вариабелен. Относительно высокая плотность выявлена на участке 5 (обширный луг).
Среди трех местообитаний, откуда взяты выборки для анализа микросателлитов, наименьшая, но слабо изменчивая популяционная плотность отмечена на участке 2 (заросшее поле).
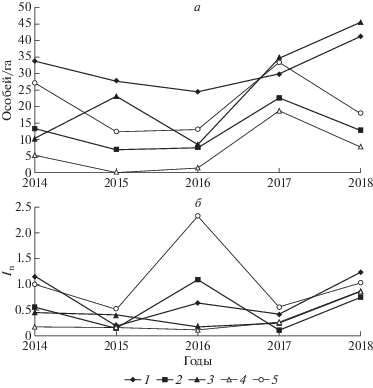
На всех участках, кроме 4-го, S-индекс не достигал критического значения 0.5 для флуктуирующих популяций [35]: 0.04, 0.11, 0.16, 0.65 и 0.10 на участках 1, 2, 3, 4 и 5 соответственно. Наибольший размах колебаний отмечен на участке 4 – 10.4, а на участках 1, 2, 3 и 5 он был 1.2, 1.3, 1.8 и 1.1, т.е. оставался в пределах случайного колебания.
Многолетняя динамика популяционной плотности (рис. 4,а) была синхронна на участках 2, 4 и 5, Rs > 0.9, p < 0.01. На участках 1 и 3 колебания плотности несинхронны ни с этими участками, ни между собой. Динамика индекса нерезидентности (In) в целом была сходна на смежных участках 1, 2 и 5 (рис. 4,б), но достоверна (Rs > 0.9, p < < 0.01) лишь на участках 2 и 5. Индекс относительной уловистости (Ic) был наименьшим и наименее вариабельным на участках 1 и 3: 0.03 ± 0.01 и 0.05 ± 0.03 соответственно. На участках 2 и 5 Ic был более чем в 2 раза выше и сильно изменчив: 0.11 ± 0.10 и 0.13 ± 0.11. На участке 4 Ic характеризуется и самыми сильными межгодовыми различиями: 0.30 ± 0.40.
Рис. 4.
Многолетняя динамика популяционной плотности (а) и нерезидентности In (б) у обыкновенной бурозубки на участках 1, 2, 3, 4 и 5. Черным маркером помечены участки 1–3, где изучали разнообразие микросателлитов.
На участке 1 зверьки постоянно занимали больше половины ловушек, посещение пространства характеризовалось довольно высокой долей совмещенной активности (доля поимок в совместно посещаемые ловушки) и числом соседей, посещающих ловушки оседлой особи (табл. 5). Максимальные доли совмещенных поимок на рассмотренных участках находятся в пределах 0.35–0.37, т.е. можно предполагать, что такая плотность населения близка к предельно допустимой. Среднее число соседей максимально на участке 1. Таким образом, вселение на участок 1 маловероятно.
Таблица 5.
Показатели наполненности пространства на исследуемых участках
| Показатель | Участки | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Доля посещенных ловушек | 0.61 ± 0.15 | 0.45 ± 0.25 | 0.52 ± 0.17 | 0.28 ± 0.22 | 0.52 ± 0.21 |
| Доля совмещенных ловов | 0.36 ± 0.11 | 0.37 ± 0.12 | 0.21 ± 0.11 | 0.10 ± 0.18 | 0.35 ± 0.15 |
| Число соседей в ловушке | 0.71 ± 0.35 | 0.61 ± 0.25 | 0.32 ± 0.24 | 0.19 ± 0.34 | 0.66 ± 0.48 |
На участке 2 зверьки посещали около половины ловушек, доля совмещенных ловов была близка к максимальной и относительно постоянна, количество соседей также довольно велико. В период наблюдений этот участок был постоянно заселен близко к его предельной емкости.
На участке 3, несмотря на высокую занятость ловушек, относительно низки доля совмещенных ловов и число соседей, но велика межгодовая изменчивость этих показателей. Участок 5 при высоких средних показателях также характеризуется их высокой изменчивостью. По-видимому, на участках 3 и 5 периодически возникала возможность вселения, а участок 4 был постоянно доступен для вселения.
Доля перезимовавших обыкновенных бурозубок в улове составила 0.14, 0.16, 0.09, 0.06 и 0.11 на участках 1, 2, 3, 4 и 5 соответственно. В лесу, участок 4, доля достоверно (p < 0.05) ниже любого из других участков. Доля обыкновенных бурозубок, помеченных на участках в предыдущем году, составляла около 0.5 от общего количества перезимовавших зверьков (n = 75). Заметим, что средняя величина участка у сеголеток после зимовки увеличивалась примерно в 2 раза, что соответствует доле вновь обнаруженных взрослых бурозубок. То есть большинство зверьков, принимавших участие в размножении, по-видимому, основали участки недалеко от учетной линии уже в июле предыдущего года.
ОБСУЖДЕНИЕ
Высокое разнообразие аллелей и бóльший уровень различий между выборками из популяций внутри расы, по сравнению с популяциями различных рас, при отсутствии корреляции генетических и географических дистанций отмечали у обыкновенной бурозубки неоднократно [18, 20, 21]. Особенностью нашего исследования является анализ выборок внутри одной расы, взятых на минимальном расстоянии друг от друга и не разделенных физическими преградами.
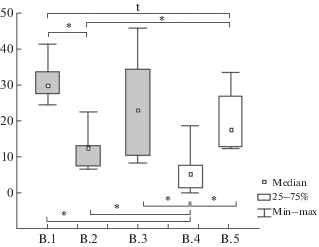
Все три анализируемые выборки обладали высоким аллельным разнообразием, достоверно различались и по частотам аллелей (Fst), и по их разнообразию (Rst), причем наибольшие различия обнаружены между соседними выборками. В пользу образования относительно автономных группировок могло бы свидетельствовать снижение наблюдаемой гетерозиготности примерно на 20% по сравнению с ожидаемой. Однако эффект Валунда – дефицит гетерозигот в выборке – не может использоваться как “индекс подразделенности” без дополнительного анализа условий [47]. Предположить наличие каких-либо внешних изолирующих механизмов, исходя из общих представлений о биологии обыкновенной бурозубки, невозможно. Этот вид встречается во всех типах местообитаний умеренной и бореальной зоны [48]. Зверьки преодолевают довольно широкие водные пространства, периодически заселяя островки на озерах в Финляндии [49], переплывают реки [50]. В ходе реколонизации современного ареала расы преодолели Сев. Двину, Оку, Каму, Печору и Енисей в среднем течении [51]. Автономность группировок, на расстояниях порядка 300 м, не может быть объяснена короткими дистанциями расселения. Так, эти дистанции для S. araneus оценивают в диапазоне 1000–300 м [7]. Известны переходы зверьков в 3–5 км по льду, покрытому снегом [52]. Низкие значения индексов нерезидентности не должны вводить в заблуждение. Нерезидентные бурозубки очень плохо ловятся в живоловки. В действительности количество нерезидентов примерно равно резидентному населению [53, 54]. Применительно к обыкновенной бурозубке правильнее говорить о препятствиях не для расселения, а для вселения зверьков. Таким препятствием может являться “наполненность” местообитания, что значительно снижает эффективность иммиграции. Гетерогенность генофонда при доле мигрантов в населении порядка 0.5 была обнаружена и в экспериментальной популяционной системе, что, по мнению авторов, свидетельствовало о низкой эффективной миграции [55, 56].
Обыкновенные бурозубки рассматриваются как одиночные территориальные животные [57]. Несмотря на то, что у зверьков не обнаружено специфичного территориального поведения [58], а строго изолированными являются лишь участки перезимовавших самок [59], практически все авторы отмечают агрессивность и стремление к изолированности участков у сеголеток обыкновенной бурозубки [48]. Перекрывание участков сеголеток отмечается лишь на периферии [59–62] и, по-видимому, является вынужденным. В нашем случае высокая плотность зверьков наблюдалась в местообитаниях, возникающих после антропогенного изменения ландшафта. Показатели насыщенности популяции здесь близки к максимальным. Однако возникновение субпопуляций с повышенной популяционной плотностью не является следствием только антропогенной трансформации ландшафта. Подобные группировки возникают на ветровальных участках, в излучинах рек и около стариц, на окраинах болот и т.п. [48].
Высокая плотность на изучаемых локальных участках может поддерживаться в течение нескольких поколений. Глубоких провалов численности здесь не наблюдалось в течение, по крайней мере, пяти лет наблюдений. Однако G-W-индекс был близок, а модифицированный G-W' существенно ниже критического значения 0.68, что указывает на недавнее прохождение “бутылочного горлышка” [40]. Действительно, на участках 2 и 5, где наблюдения ведутся с 2006 г., в 2011 г. была глубокая депрессия численности. По-видимому, при большей продолжительности наблюдений мы бы наблюдали депрессию и на других участках. Заметим, что значительные колебания обилия, связанные с повторяющимися депрессиями численности, вообще характерны для вида [48].
Тем не менее, принимая во внимание хорошее перезимовывание в таких местах (высокая доля особей, сохранившихся на своих участках с предыдущего года), население этих территорий можно рассматривать как временно автономные субпопуляции. Накоплению частот, достаточных для достоверного различения выборок по генетическим маркерам за короткий период их автономного существования, способствуют особенности популяционной экологии бурозубок. В размножении участвуют в основном перезимовавшие самки и только перезимовавшие самцы. Участие самок сеголеток в размножении не превышает 10%. Перезимовывает и доживает до размножения менее 20% популяции [48], а пик обилия зверьков наблюдается в июле [63]. Массовое вымирание сеголеток – “осенняя эпидемия” происходит во второй половине лета [64]. Оно начинается задолго до сезонного ухудшения условий и, по-видимому, связано с отсутствием пригодных для оседания территорий [65–67]. Таким образом, ежегодно выбраковывается более 80% аллелей.
В фоновых лесных местообитаниях обыкновенные бурозубки достигают высоких уровней популяционной плотности лишь в годы пиков численности. Здесь, в нашем случае, у особи, как правило, отсутствуют соседи, а совмещенная активность составляет менее 10%. Это обширное пространство доступно для иммиграции.
Таким образом, популяцию S. araneus можно представить как систему взаимодействующих субпопуляций, в которых существуют условия для быстрого изменения частот аллелей. При этом аллели могут “эмигрировать” в фоновые местообитания – общий пул, “материк”, из которого вновь попадают в субпопуляции – “острова”. Роль “ядра–регулятора” выполняет население фоновых местообитаний, а система в целом похожа на экспериментальную модель популяционной системы типа “острова–материк” [27].
Метапопуляционный подход не объясняет локального разнообразия аллелей, так как при использовании незамкнутых моделей миграции уровень различий неизбежно возрастает с увеличением географической дистанции (например [68]). Это не позволяет объяснить высокое аллельное разнообразие и отсутствие связи генетических и географических дистанций у обыкновенной бурозубки в рамках метапопуляционной концепции. Обнаруженные нами демографические и генетические паттерны напоминают эффекты в моделях популяционных систем Алтухова: колебания обилия и значимое различие аллельных частот в субпопуляциях [27]. Открытым остается вопрос о “замкнутости” системы взаимодействующих субпопуляций обыкновенной бурозубки. Однако есть основания предполагать, что у мигрантов этого вида существует бόльшая вероятность остаться в пределах некоторой системы локальных популяций, чем выйти за ее пределы [69]. Каких-либо внешних преград для перемещения зверьков при этом не обнаружено. Природа формирования такой “закольцованной” системы нам пока не ясна. Однако если подразделенность обыкновенной бурозубки на независимые популяции явление закономерное, то можно ожидать, что и формирование популяционных систем является ситуацией обычной для этого вида. В этом случае ограничения потока генов между расами можно не обнаружить из-за генетических эффектов, свойственных популяционным системам.
Авторы благодарны к. б. н. О.О. Григорьевой (ИПЭЭ им. А.Н. Северцова РАН) за консультации при анализе разнообразия микросателлитов.
Работа частично поддержана грантом РФФИ 19-04-00985 (СП) и Программой Президиума РАН “Биоразнообразие и биологические ресурсы России” (Программа 41) (СП). Часть работы выполнена в рамках базовой части государственного задания ФГБОУ ВО “Пензенский государственный университет” в сфере научной деятельности на 2017–2019 гг. (проект 6.7197.2017/БЧ) (СТ).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Bulatova N.S., Biltueva L.S., Pavlova S.V. et al. Chromosomal differentiation in the common shrew and related species // Shrews, Chromosomes and Speciation. Cambridge: Cambr. Univ. Press, 2019. P. 134–185. https://doi.org/10.1017/9780511895531
Fedyk S., Pavlova S.V., Chętnicki W., Searle J.B. Chromosomal hybrid zones // Shrews, Chromosomes and Speciation. Cambridge: Cambr. Univ. Press, 2019. P. 271–311. https://doi.org/10.1017/9780511895531
Barton N.H., Hewitt G.M. Hybrid zones and speciation // Essays in Honour of M. J. D. White: Evolution and Speciation. Cambridge: Cambr. Univ. Press, 1981. P. 109–145.
Barton N.H., Hewitt G.M. Analysis of hybrid zones // Annu. Rev. Ecol. Syst. 1985. V. 16. P. 113–148.
Feder J.L., Egan S.P., Nosil P. The genomics of speciation-with-gene-flow // Trends Genet. 2012. V. 28. P. 342–350.
Hewitt G.M. Hybrid zones – natural laboratories for evolutionary studies // TREE. 1988. V. 3. № 7. P. 158–165.
Bulatova N.S., Jones R.M., White T.A. et al. Natural hybridization between extremely divergent chromosomal races of the common shrew (Sorex araneus, Soricidae, Soricomorpha): hybrid zone in European Russia // Evol. Biol. 2011. V. 24. P. 573–586.
Andersson A.C., Alström-Rapaport C., Fredga K. Lack of mitochondrial DNA divergence between chromosome races of the common shrew, Sorex araneus, in Sweden. Implications for interpreting chromosomal evolution and colonization history // Mol. Ecol. 2005. V. 14. P. 2703–2716.
Распопова А.А., Щипанов Н.А. Изменчивость участка цитохрома b в разных хромосомных расах и популяциях обыкновенной бурозубки Sorex araneus L., 1758 // Генетика. 2011. Т. 47. № 4. С. 527–536.
Lundqvist A.C., Alström-Rapaport C., Tegelström H. Fennoscandian phylogeography of the common shrew Sorex araneus. Post-glacial recolonisation combining information from chromosomal variation with mitochondrial DNA data // Acta Theriologica. 2011. V. 56. P. 103–116.
Thaw S., White T.A., Bannikova A.A., Searle J.B. Phylogeography // Shrews, Chromosomes and Speciation. Cambridge: Cambr. Univ. Press, 2019. P. 113–133. https://doi.org/10.1017/9780511895531
Ratkiewicz M., Fedyk S., Banaszek A. et al. The evolutionary history of the two karyotypic groups of the common shrew, Sorex araneus, in Poland // Heredity. 2002. V. 88. P. 235–242.
Andersson A.C., Narain Y., Tegelström H., Fredga K. No apparent reduction of gene flow in a hybrid zone between the West and North European karyotypic groups of the common shrew, Sorex araneus // Mol. Ecol. 2004. V. 13. P. 1205–1215.
White T.A., Searle J.B. Mandible asymmetry and genetic diversity in island populations of the common shrew, Sorex araneus // Evol. Biol. 2008. V. 21. P. 636–641. https://doi.org/10.1111/j.1420-9101.2007.01481.x
Horn A., Basset P., Yannic G. et al. Chromosomal rearrangements do not seem to affect the gene flow in hybrid zones between karyotypic races of the common shrew (Sorex araneus) // Evolution. 2012. V. 66. P. 882–889. https://doi.org/10.1111/j.1558-5646.2011.01478.x
Yannic G., Basset P., Horn A., Hausser J. Gene flow between chromosomal races and species // Shrews, Chromosomes and Speciation. Cambridge: Cambr. Univ. Press, 2019. P. 313–335. https://doi.org/10.1017/9780511895531
Wyttenbach A., Goudet J., Cornuet J.M., Hausser J. Microsatellite variation reveals low genetic subdivision in a chromosome race of Sorex araneus (Mammalia, Insectivora) // J. Heredity. 1999. V. 90. P 323–327.
Jadwiszczak K.A., Ratkiewicz M., Banaszek A. Analysis of molecular differentiation in a hybrid zone between chromosomally distinct races of the common shrew Sorex araneus (Insectivora: Soricidae) suggests their common ancestry // Biol. J. Linn. Soc. 2006. V. 89. № 1. P. 79–90.
Wyttenbach A., Hausser J. Microsatellites in Sorex araneus (Insectivora): highly polymorphic markers for population genetic studies within and between chromosomal races // Hereditas. 1996. V. 125. P. 177–181.
Wyttenbach A., Narain Y., Fredga K. Genetic structuring and gene flow in a hybrid zone between two chromosome races of the common shrew (Sorex araneus, Insectivora) revealed by microsatellites // Heredity. 1999. V. 82. P. 79–88.
Григорьева О.О., Шестак А.Г., Потапов С.Г. и др. Полиморфизм микросателлитных локусов и поток генов в зоне контакта четырех хромосомных рас обыкновенной бурозубки Sorex araneus L. (Mammalia) // Изв. РАН. Сер. биол. 2011. № 5. С. 501–510.
Narain Y., Fredga K. Spermatogenesis in common shrews, Sorex araneus, from a hybrid zone with extensive Robertsonian polymorphism // Cytogenet. Cell Genet. 1998. V. 80. P. 158–164.
Щипанов Н.А., Павлова С.В. Многоуровневая подразделенность в группе видов “araneus” рода Sorex. 1. Хромосомная дифференциация // Зоол. журн. 2016. Т. 95. № 2. С. 216–233. https://doi.org/10.7868/S0044513416020148
Щипанов Н.А., Павлова С.В. Роль популяционного структурирования в формировании кариотипического разнообразия обыкновенной бурозубки Sorex araneus (Lipotyphla, Mammalia) // Экология. 2019. № 2. С. 101–111.
Алтухов Ю.П., Рычков Ю.Г. Популяционные системы и их структурные компоненты. Генетическая стабильность и изменчивость // Журн. общей биологии. 1970. Т. 31. № 5. С. 507–525.
Алтухов Ю.П. Генетические процессы в популяциях. М.: Наука, 1983. 279 с.
Алтухов Ю.П. Генетические процессы в популяциях (3-е перераб. и дополн. изд.). М.: ИКЦ Академкнига, 2003. 431 с.
Булатова Н.Ш., Павлова С.В. Хромосомная раса в эпицентре гибридных зон // Вестник ВОГиС. 2007. Т. 11. № 2. С. 432–435.
Щипанов Н.А., Калинин А.А., Олейниченко В.Ю. и др. К методике изучения использования пространства землеройками-бурозубками // Зоол. журн. 2000. Т. 79. С. 362–371.
Щипанов Н.А. Мечение на линиях живоловок для мониторинга мелких млекопитающих. Метод расчета популяционной плотности и индексов нерезидентности // Зоол. журн. 2020 (принята в печать).
Arrigi F.E., Bergendahl G., Mandel M. Isolation and characterization of DNA from fixed cells and tissues // Exp. Cell. Res. 1968. № 50. P. 47–53.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 509 p.
Basset P., Yannic G., Yang F.T. et al. Chromosome localization of microsatellite markers in the shrews of the Sorex araneus group // Chromosome Res. 2006. V. 14. P. 253–262.
Stenseth N.C., Framstad E. Reproductive effort and optimal reproductive rates in small rodents // Oikos. 1980. V. 34. № 1. P. 23–34.
Henttonen H., McGuire A.D., Hansson L. Comparisons of amplitudes and frequencies (spectral analyses) of density variations in long-term data sets of Clethrionomys species // Annales Zool. Fennici. 1985. V. 22. № 3. P. 221–227.
Stenseth N.C., Bjørnstad O.N., Saitoh T. Seasonal forcing on the dynamics of Clethrionomys rufocanus: modeling geographic gradients in population dynamics // Population Ecol. 1998. V. 40. № 1. P. 85–95.
Bjørnstad O.N., Stenseth N.C., Saitoh T., Lingjære O.C. Mapping the regional transitions to cyclicity in Clethrionomys rufocanus: spectral densities and functional data analysis // Population Ecol. 1998. V. 40. № 1. P. 77–84.
Saitoh T., Stenseth N.C., Bjørnstad O.N. The population dynamics of the vole Clethrionomys rufocanus in Hokkaido, Japan // Population Ecol. 1998. V. 40. № 1. P. 61–76.
Van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. Micro-Checker: software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538.
Garza J.C., Williamson E.G. Detection of reduction in population size using data from microsatellite loci // Mol. Ecol. 2010. V. 10. P. 305–318.
Excoffier L.G., Schneider L.S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis // Evol. Bioinformatics Online. 2005. V. 1. P. 47–50.
Nei M. F-statistics and analysis of gene diversity in subdivided populations // Annals Hum. Genet. 1977. V. 41. P. 225–233.
Slatkin M.A. Measure of population subdivision based on microsatellite allele frequencies // Genetics. 1995. V. 139. P. 457–462.
Goudet J., Raymond M., Demeeus T., Rousset F. Testing differentiation in diploid populations // Genetics. 1996. V. 144. P. 1933–1940.
Goudet J. Fstat (ver. 2.9.4), a program to estimate and test population genetics parameters // http://www2.unil.ch/popgen/softwares/fstat.htm. Updated from Goudet (1995). 2003.
Kimura M., Ohta T. Stepwise mutation model and distribution of allelic frequencies in a finite population // Proc. Natl Acad. Sci. USA. 1978. V. 75. P. 2868–2872.
Selander R.K. Behavior and Genetic Variation in Natural Populations // Am. Zoologist. 1970. V. 10. P. 53–66.
Shchipanov N.A., Zima J., Churchfield S. Introducing the common shrew chromosomal hybrid zones // Shrews, Chromosomes and Speciation. Cambridge: Cambr. Univ. Press, 2019. P. 19–64. https://doi.org/10.1017/9780511895531
Hanski I., Peltonen A., Kaski L. Natal dispersal and social dominance in the common shrew Sorex araneus // Oikos. 1991. V. 62. P. 48–58.
Калинин А.А., Куприянова И.Ф. Методика количественного учета мелких млекопитающих при миграциях через водные преграды // Зоол. журн. 2015. Т. 94. № 2. С. 365–369.
Shchipanov N.A., Pavlova S.V. Density-dependent processes determine the distribution of chromosomal races of the common shrew Sorex araneus (Lipotyphla, Mammalia) // Mammal Res. 2017. V. 62. № 3. P. 267–282. https://doi.org/10.1007/s13364-017-0314-4
Tegelström H., Hansson L. Evidence of long-distant dispersal in the common shrew (Sorex araneus) // Z. Saugetierk. 1987. Bd 52. S. 52–54.
Щипанов Н.А., Купцов А.В., Калинин А.А., Олейниченко В.Ю. Конуса и живоловки ловят разных землероек-бурозубок (Insectivora, Soricidae) // Зоол. журн. 2003. Т. 83. № 10. С. 1258–1265.
Щипанов Н.А., Купцов А.В., Демидова Т.Б. и др. Нерезидентность и расселение у обыкновенных бурозубок (Sorex araneus, Insectivora) // Зоол. журн. 2008. Т. 87. № 3. С. 331–343.
Алтухов Ю.П., Победоносцева Е.Ю. Исследование биологических особенностей экспериментальной популяционной системы Drosophila melanogaster // Журн. общей биологии. 1979. Т. 40. № 6. С. 916–923.
Алтухов Ю.П., Победоносцева Е.Ю. Особенности генетического процесса в экспериментальной популяционной системе Drosophila melanogaster // Журн. общей биологии. 1979. Т. 40. № 3. С. 368–367.
Rychlik L. Evolution of social systems in shrews // Evolution of Shrews. Mammal Research Institute. Białowieża. 1998. P. 347–406.
Олейниченко В.Ю. Поведение сеголеток обыкновенной (Sorex araneus), средней (Sorex caecutiens) и малой (Sorex minutus) бурозубок на освоенной и чужой территориях // Зоол. журн. 2007. Т. 86. № 10. С. 1259–1271.
Churchfield S. The natural history of shrews // Christopher Helm. London, 1990.
Shillito J.F. Field observation on the growth, reproduction and activity of a woodland population of the common shrew Sorex araneus L. // Proc. Zool. Soc. London. 1963. V. 140. P. 99–113. https://doi.org/10.1111/j.1469-7998.1963.tb01856.x
Shillito J.F. Observations on the range and movements of a woodland population of the common shrew Sorex araneus L. // Proc. Royal Soc. London. 1963. V. 140. P. 533–546.
Shchipanov N.A., Kalinin A.A., Demidova T.B. et al. Population ecology of red-toothed shrews, Sorex araneus, S. caecutiens, S. minutus, and S. isodon, in Central Russia // Advances in the Biology of Shrews II. Special Publication of the Intern. Society of Shrew Biologists. N.Y., 2005. P. 201–216.
Калинин А.А., Демидова Т.Б., Олейниченко В.Ю., Щипанов Н.А. Сезонная динамика численности землероек-бурозубок (Insectivora, Soricidae) // Зоол. журн. 2008. Т. 87. С. 218–225.
Crowcroft W.P. The Life of the Shrew. London: Max Reinhardt, 1957. 166 p.
Buckner C.H. Some aspects of the population ecology of the common shrew, S. araneus, near Oxford, England // J. Mamm. 1969. V. 50. P. 326–322.
Pernetta J.C. Population ecology of British shrews in grassland // Acta Theriologica. 1977. V. 22. P. 279–296.
Churchfield S. Population dynamics and seasonal fluctuations in numbers of the common shrew in Britain // Acta Theriologica. 1980. V. 25. P. 451–459.
Hanski I. Metapopulation Ecology. N.Y.: Oxford Univ. Press, 1999. 313 p.
Shchipanov N.A. Understanding the boundaries between chromosome races of common shrews in terms of restricted movement by individual shrews // Rus. J. Theriol. 2007. V. 6. P. 117–122.
Дополнительные материалы отсутствуют.


