Генетика, 2021, T. 57, № 11, стр. 1297-1305
Экспрессия гена β1-адренорецептора (ADRB1) в миокарде больных хронической сердечной недостаточностью
Э. Ф. Муслимова 1, *, Т. Ю. Реброва 1, Д. С. Кондратьева 1, Э. Л. Сондуев 1, Б. Н. Козлов 1, С. А. Афанасьев 1
1 Научно-исследовательский институт кардиологии, Томский национальный исследовательский медицинский центр Российской академии наук
634012 Томск, Россия
* E-mail: muslimovef@yandex.ru
Поступила в редакцию 16.02.2021
После доработки 06.04.2021
Принята к публикации 11.05.2021
Аннотация
Проведен анализ уровня относительной экспрессии гена β1-адренорецептора ADRB1 в миокарде 78 пациентов с хронической сердечной недостаточностью на фоне сочетанного развития ишемической болезни сердца и артериальной гипертензии. Выявлено значимое снижение уровня экспрессии гена ADRB1 у пациентов с гипертрофией левого желудочка. В рассматриваемой когорте уровень экспрессии гена ADRB1 не зависел от функционального класса сердечной недостаточности. Экспрессия ADRB1 оказалась более высокой у пациентов, принимавших препараты ацетилсалициловой кислоты, но не показала значимой связи с приeмом β-адреноблокаторов или ингибиторов АПФ.
Одним из важнейших звеньев нейрогуморальной регуляции хроно-инотропных возможностей миокарда являются β1-адренорецепторы (β1-АР), локализованные на мембранах кардиомиоцитов. β1-АР напрямую влияют на внутрисердечную гемодинамику и способность сердца переносить физическую нагрузку. Кратковременная активация β1-АР приводит к развитию мощного положительного инотропного эффекта за счет увеличения внутриклеточного содержания ионов Ca2+ [1, 2]. При стимуляции β1-АР повышается уровень цАМФ, что приводит к фосфорилированию фосфоламбана. Это убирает ингибирующее действие фосфоламбана на активность Ca2+-АТФазы SERCA2a и способствует ускорению релаксации миокарда [3]. Таким образом, β1-АР играют важную роль в работе белков Ca2+-транспортирующей системы саркоплазматического ретикулума кардиомиоцитов, нарушение которой может приводить к развитию сердечной недостаточности [4].
Однако под влиянием длительной или сильной стимуляции катехоламинами, например при хронической сердечной недостаточности (ХСН), изменяется количество и функциональное состояние β1-АР на мембране кардиомиоцитов [5]. Более того, стимуляция β1-АР может привести к кардиотоксическому эффекту – инициации апоптоза кардиомиоцитов, в основе которого лежит перегрузка клеток Ca2+ [6].
Преобладающие на кардиомиоцитах β1-АР кодируются геном ADRB1 (MIM 109630), локализованным на 10-й хромосоме (10q25.3) [7, 8]. В настоящее время много внимания уделяется роли полиморфных вариантов гена ADRB1 в развитии и прогрессировании сердечно-сосудистых заболеваний [9, 10]. Менее интенсивно исследуется связь между сократительной функцией миокарда и уровнем экспрессии гена ADRB1. Однако отмечено, что у больных ХСН экспрессия гена ADRB1 повышалась совместно с увеличением сократительного резерва миокарда после сердечной ресинхронизирующей терапии [11]. Количественная оценка мРНК β1-АР, анализ изменения их уровня является важным инструментом в изучении патофизиологической регуляции этих рецепторов.
Целью нашего исследования была оценка уровня экспрессии гена β1-адренорецептора ADRB1 в миокарде в зависимости от клинических параметров у больных хронической сердечной недостаточностью.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 78 пациентов с ХСН, развившейся на фоне сочетанного течения ишемической болезни сердца и артериальной гипертензии. Возраст пациентов составил 64 (59; 69) года. Выборка включала 63 (80.8%) мужчины и 15 (19.2%) женщин. Клиническая характеристика пациентов представлена в табл. 1. Принимаемые лекарственные препараты указаны на момент поступления.
Таблица 1.
Клиническая характеристика пациентов с хронической сердечной недостаточностью
| Параметр | Значение |
|---|---|
| Инфаркт миокарда в анамнезе, n (%) | 52 (66.7) |
| Возраст первого инфаркта миокарда, годы | 62 (53; 67) |
| Сердечная недостаточность, ФК I/II/III, n (%) | 4 (5.1)/46 (59.0)/28 (35.9) |
| Фракция выброса левого желудочка, % | 62 (53; 65) |
| Конечный систолический объем, мл | 45 (36; 59) |
| Конечный диастолический объем, мл | 118 (101; 127) |
| Конечный систолический размер, мм | 34 (31; 37) |
| Конечный диастолический размер, мм | 51 (48; 54) |
| Индекс сферичности | 0.56 (0.53; 0.59) |
| Пик Е, см/с | 71 (61; 83) |
| Пик А, см/с | 85 (64; 96) |
| Отношение Е/А | 0.87 (0.69; 1.11) |
| Гипертрофия левого желудочка, n (%) | 18 (23.1) |
| Дилатация левого желудочка, n (%) | 7 (9.0) |
| Дилатация левого предсердия, n (%) | 28 (35.9) |
| Диастолическая дисфункция, n (%) | 53 (67.9)* |
| Митральная недостаточность I/II степени, n (%) | 25 (32.1)/7 (9.0) |
| Трикуспидальная недостаточность I степени, n (%) | 11 (14.1) |
| Нарушение толерантности к глюкозе/сахарный диабет 2-го типа, n (%) | 8 (10.3)/27 (34.6) |
| Ожирение, n (%) | 24 (30.8) |
| Ингибиторы АПФ, блокаторы рецепторов ангиотензина II, n (%) | 61 (78.2) |
| β-адреноблокаторы, n (%) | 63 (80.8) |
| Гиполипидемические препараты, n (%) | 66 (84.6) |
| Ацетилсалициловая кислота 75–100 мг, n (%) | 48 (61.5)** |
Функциональный класс (ФК) ХСН в соответствии с классификацией Нью-Йоркской кардиологической ассоциации (NYHA) был определен с помощью теста 6-минутной ходьбы. Пройденное расстояние в 426–550 и 301–425 м соответствует I и II ФК, а расстояние в 151–300 м соответствует III ФК [12].
Всем пациентам выполнено эхокардиографическое исследование сердца. Эхокардиографию проводили, используя аппарат Philips HD15 (Нидерланды) из стандартных позиций с оценкой размеров отделов сердца и фракцией выброса левого желудочка (ЛЖ) по методу Симпсона. Также диагностировалось наличие гипертрофии ЛЖ при увеличении индекса массы миокарда ЛЖ >115 у мужчин и >95 г/м2 у женщин [12].
Для генетического исследования использовали интраоперационные биоптаты сердца – ушко правого предсердия, иссекаемые при подключении аппарата искусственного кровообращения во время плановой операции коронарного шунтирования. Сразу после иссечения биоптаты помещали в ледяной раствор Кребса–Хензеляйта следующего состава в мМ: NaCl – 120, KCl – 4.8; CaCl2 – 2.0, MgSO4 – 1.2, KH2PO4 – 1.2, NaHCO3 – 20.0, глюкоза – 10.0. Данный раствор позволяет поддерживать жизнеспособность кардиомиоцитов с сохранением их сократительной функции [13]. В условиях стерильного бокса биоптаты освобождали от соединительной ткани и забирали образцы 20–25 мг. При невозможности немедленного выделения РНК образцы помещали в RNAlater RNA Stabilization Reagent (Кат. № 76104 QIAGEN, Германия) и хранили при –80°C. Образцы миокарда разрушали на гомогенизаторе TissueLyser LT (QIAGEN), и из гомогената выделяли тотальную РНК с помощью коммерческого набора RNeasy Fibrous Tissue Mini Kit (Кат. № 74704, QIAGEN). Качество образцов РНК оценивали спектрофотометрическим методом по отношению A260/A280 (NanoVue, Heaithcare Bio-Science, Швеция), которое варьировало в пределах от 1.93 до 2.03. Для синтеза кДНК использовали реактивы RevertAid First Strand cDNA Synthesis Kit (Кат. № K1622, Thermo Scientific, США).
Полимеразную цепную реакцию в режиме реального времени проводили на амплификаторе LightCycler 96 (Roche) с использованием праймеров, разработанных и синтезированных OOO “ДНК-Синтез” (Россия): hADRB1-F = CAGGTGAACTCGAAGCCC; hADRB1-R = CTCCCATCCCTTCCCAA; hADRB1-probe = FAM-AAAGCCACGGACCGTTGCAC-BHQ1. Подбор праймеров осуществлялся так, чтобы была исключена возможность амплификации геномной ДНК за счет расположения праймеров/зонда в разных экзонах. Для повышения эффективности реакции подбирались праймеры/зонд, не содержащие димеры и шпильки. Все праймеры/зонды проходят проверку в системе BLAST. В качестве референсного был использован ген глицеральдегид-3-фосфат-дегидрогеназы GAPDH (TaqMan® Gene Expression Assays, Hs03929097_g1 (VIC), Thermo Scientific), рекомендованный в качестве гена “домашнего хозяйства” при исследовании разных отделов и патологий сердца [14, 15].
Постановку реакции проводили в триплетах, в одном планшете параллельно проводили реакции для целевого гена и гена “домашнего хозяйства”. Для мастер-микса использованы 10× DreamTaq Buffer (Кат. № B65, Thermo Scientific), DreamTaq DNA Polymerase (Кат. № EP0701, Thermo Scientific), Invitrogen dNTP Set 100 mM (Кат. № 10297117, Thermo Scientific). Расчет уровня экспрессии проводили с помощью программного обеспечения LightCycler 96 (Roche) с применением стандартной кривой, поправкой на эффективность реакции и калибратор постановок по методу Pfaffl [16]: Ratio = = (Etarget)∆Ct,target(calibrator – test)/(Eref)∆Ct,ref(calibrator – test), где Е – эффективность реакции; Ct – пороговый цикл генов мишеней (target) и референсного гена (ref); ∆Ct, target(calibrator – test) – Ct гена мишени в калибраторе минус Ct гена мишени в опытном образце; ∆Ct, ref(calibrator – test) – Ct референсного гена в калибраторе минус Ct референсного гена в опытном образце.
Статистический анализ проводили с помощью стандартного пакета программ SPSS версии 13 (IBM, США). Количественные данные были предварительно проверены на соответствие нормальному закону распределения с помощью критерия Шапиро–Уилка. Так как большая часть исследуемых параметров, включая уровень экспрессии гена ADRB1, не соответствовала нормальному закону распределения, то дальнейший анализ проводили с помощью критерия Манна–Уитни или теста Краскела–Уоллиса. Результаты представляли в виде медианы и интерквантильного размаха. Также оценивали силу линейной взаимосвязи между количественными показателями с помощью коэффициента ранговой корреляции Спирмена. Связь между качественными данными определяли с помощью χ2 Пирсона или двустороннего точного теста Фишера. Уровень значимости различий принимали p < 0.05.
РЕЗУЛЬТАТЫ
При проведении ПЦР в режиме реального времени эффективность реакции для гена ADRB1 в среднем составляла 1.94 ± 0.12 (94%), коэффициент детерминации R2 – 0.98 ± 0.01; для гена GAPDH эффективность реакции составила 1.93 ± 0.1 (93%), коэффициент R2 – 0.98 ± 0.02.
В исследуемой выборке относительная экспрессия гена ADRB1 была сопоставима (p = 0.526) у мужчин и женщин – 1.2 (0.7; 1.7) и 1.3 (0.8; 1.7) – и линейно не связана с возрастом пациентов (r = = 0.154, p = 0.191). Отсутствовали различия в уровне экспрессии гена в миокарде пациентов с ХСН ФК I, II, III, что показано на рис. 1.
Рис. 1.
Уровень экспрессии гена ADRB1 относительно GAPDH у пациентов с ХСН ФК I (1.4 (0.8; 1.6)), ФК II (1.2 (0.8; 1.8)), ФК III (1.3 (0.7; 1.6)). При сравнении использован тест Краскела–Уоллиса.
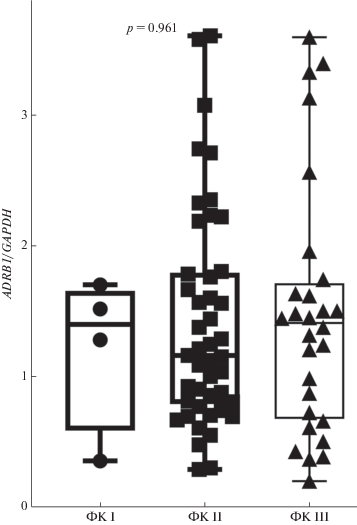
Наличие инфаркта миокарда (ИМ) в анамнезе также не влияло на экспрессию ADRB1 (p = 0.556). Экспрессия гена составила у пациентов без ИМ 1.3 (0.8; 1.7) и у больных с ИМ в анамнезе 1.2 (0.7; 1.7). В исследуемой выборке наблюдалась тенденция к более высокой экспрессии гена ADRB1 при сахарном диабете 2-го типа – 1.5 (0.9; 2.1) против 1.2 (0.7; 1.6) у пациентов без гипергликемии, но различия не достигли статистической значимости (p = 0.069). У пациентов с ожирением и без него уровень экспрессии оказался одинаков (p = = 0.956) – 1.2 (0.7; 1.7) и 1.2 (0.8; 1.7). Статистически значимых различий не выявлено у лиц с дилатацией левого предсердия (1.5 (0.9; 1.7) против 1.1 (0.7; 1.7), p = 0.110) или левого желудочка (1.2 (0.7; 2.2) против 1.2 (0.8; 1.7), p = 0.984) по сравнению с пациентами без изменений отделов сердца. Экспрессия гена ADRB1 у пациентов с диастолической дисфункцией ЛЖ составила 1.2 (0.7; 1.6), без нее – 1.3 (0.8; 1.7) (p = 0.369). Коэффициент корреляции между уровнем экспрессии гена ADRB1 и фракцией выброса левого желудочка составил r = = –0.202 (p = 0.085). Имела место слабая прямая линейная взаимосвязь (r = 0.248, p = 0.039) между уровнем экспрессии и скоростью пика A, но корреляция с другими показателями ЭхоКГ, в том числе скоростью пика E и отношением E/A, отсутствовала.
Тем не менее выявлено значимое (p = 0.022) снижение экспрессии ADRB1 на 21–35% в миокарде пациентов с гипертрофией ЛЖ. Результаты представлены на рис. 2. Хорошо известно, что к развитию гипертрофии ЛЖ приводит митральная недостаточность. Аналогичная зависимость получена и для нашей выборки (Fisher’s Exact Test = 16.621, p < 0.001, рис. 3,а). Но при этом уровень экспрессии ADRB1 между лицами с митральной недостаточностью I, II степени и без нее оказался сопоставимым (рис. 3,б), как и при наличии и отсутствии трикуспидальной недостаточности (1.2 (0.9; 1.6) и 1.3 (0.7; 1.7) соответственно, p = 0.818).
Рис. 2.
Уровень экспрессии гена ADRB1 относительно GAPDH у пациентов с гипертрофией ЛЖ (1.1 (0.6; 1.3)) и без нее (1.4 (0.8; 2.0)). При сравнении использован критерий Манна–Уитни.
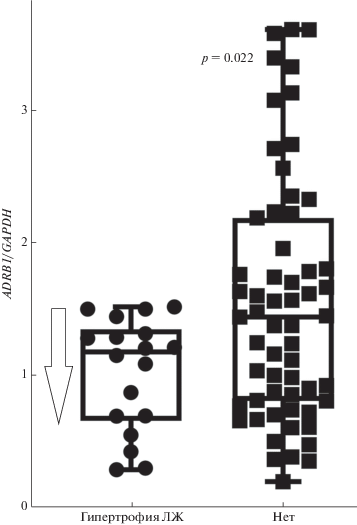
Рис. 3.
Частота гипертрофии левого желудочка (а) и уровень экспрессии гена ADRB1 относительно GAPDH (б) у пациентов с митральной недостаточностью (МН). Экспрессия гена при отсутствии МН – 1.3 (0.7; 1.7), при МН 1-й степени – 1.5 (0.8; 1.9), при МН 2-й степени – 1.2 (1.1; 1.3). При сравнении частот использован χ2 Пирсона, при сравнении уровней экспрессии – тест Краскела–Уоллиса.

Выполнен анализ уровня экспрессии гена ADRB1 в зависимости от приема лекарственных препаратов на момент поступления пациента в стационар. В нашей выборке ни β-адреноблокаторы (1.2 (0.7; 1.7) у принимавших и 1.2 (0.9; 1.6) у не принимавших, p = 0.353), ни гиполипидемические препараты (1.2 (0.7; 1.6) против 1.3 (0.6; 1.8), p = 0.868), ни ингибиторы АПФ и блокаторы рецепторов ангиотензина II (1.2 (0.7; 1.6) против 1.4 (0.9; 2.0), p = 0.115) не показали значимого влияния на значения ADRB1/GAPDH. В то же время пациенты, принимавшие препараты ацетилсалициловой кислоты (АСК), отличались значимо более высокой экспрессией ADRB1 (p = 0.048), что показано на рис. 4. При этом в группе лиц, принимавших препараты АСК, частота случаев гипертрофии ЛЖ (6 (12.5%) из 48 пациентов) была значимо (p = 0.006) ниже, чем среди пациентов, по каким-либо причинам не принимавших АСК (10 (43.5%) из 23 пациентов).
Рис. 4.
Уровень экспрессии гена ADRB1 относительно GAPDH у пациентов, принимавших препараты АСК (1.4 (0.8; 2.0)) и не принимавших АСК (0.9 (0.6; 1.4)). Группа “Выпавшие” – лица, у которых не удалось выяснить информацию о приеме препаратов АСК на момент поступления. При сравнении групп, принимавших и не принимавших препараты АСК, использован критерий Манна–Уитни.

ОБСУЖДЕНИЕ
Классический путь внутриклеточной трансляции сигналов β1-АР хорошо изучен – это активация комплекса аденилатциклаза–Gs-белки, приводящая к повышению уровня цАМФ. Первичной мишенью для цАМФ является протеинкиназа A. Она фосфорилирует белки (Ca2+-каналы L-типа, фосфоламбан, тропонин I, рианодиновые рецепторы и др.), которые влияют на сократимость кардиомиоцитов за счет увеличения притока Ca2+, обратного захвата Ca2+ в саркоплазматический ретикулум или за счет модулирования чувствительности миофиламентов к этим ионам [17].
Известно, что при ХСН из-за повышенной концентрации катехоламинов имеет место хроническая гиперсимпатикотония, характеризующаяся длительной активацией β1-АР. Это приводит к десенситизации, т.е. угнетению рецепторного ответа с течением времени в условиях наличия постоянного стимула высокой интенсивности, снижается экспрессия β1-АР на кардиомиоцитах. Как следствие, у пациентов с ХСН наблюдается уменьшение инотропного резерва миокарда и насосной функции сердца [2, 18].
Оценка экспрессии гена β1-АР ADRB1 является одним из способов изучить влияние различных клинических параметров на состояние симпатоадреналовой системы при ХСН. Мы определяли относительный уровень экспрессии ADRB1/GAPDH в миокарде пациентов с ХСН ФК I, ФК II и ФК III, но не обнаружили статистически значимых различий. Отсутствовала линейная корреляция с фракцией выброса ЛЖ. Также не было различий по уровню экспрессии гена ADRB1 у пациентов с диастолической дисфункцией ЛЖ и без нее. И хотя в исследуемой выборке была выявлена слабая прямая зависимость между уровнем экспрессии и скоростью кровотока в период предсердной систолы (пик A), мы не обнаружили связи между экспрессией и скоростью кровотока через митральный клапан в раннюю фазу диастолы (пик Е) и отношением E/А, характеризующим трансмитральный кровоток.
Известно, что на скорость пика A оказывает влияние податливость ЛЖ и сократимость ЛП. Несмотря на отсутствие явной зависимости уровня экспрессии гена от тяжести ФК ХСН и корреляции с параметрами ЭхоКГ, экспрессия ADRB1 оказалась значительно снижена в миокарде пациентов с гипертрофией ЛЖ. Более того, ранее в той же выборке пациентов мы оценили уровень экспрессии гена ATP2A2, кодирующего SERCA2a, и гена рианодиновых рецепторов RYR2. Относительная экспрессия генов ATP2A2 и RYR2 также была снижена у пациентов с гипертрофией ЛЖ, показатель ATP2A2/GAPDH коррелировал со скоростью пика A и RYR2/GAPDH [13]. При исследовании экспрессии гена ADRB1 была обнаружена прямая линейная связь между изучаемым фактором и экспрессией гена ATP2A2 (r = 0.293, p = 0.030). Однако отсутствовала статистически значимая линейная зависимость между уровнями экспрессии гена ADRB1 и гена RYR2 (r = 0.165, p = 0.223).
Cтимуляция β1-АР через цАМФ приводит к фосфорилированию одного из ключевых белков Са2+-транспортирующей системы саркоплазматического ретикулума кардиомиоцитов – фосфоламбана. Дефосфорилированный фосфоламбан является ингибитором активности SERCA2a, осуществляющей обратный захват ионов Ca2+ из цитозоля в депо. Фосфорилирование снимает это торможение, соответственно стимуляция β1-АР ведет к увеличению активности SERCA2a [3]. Известно, что снижение активности или содержания SERCA2a приводит к ухудшению обратного захвата Ca2+ в саркоплазматический ретикулум, что может провоцировать развитие сердечной недостаточности [19]. Следовательно, меньший уровень экспрессии генов ADRB1 и ATP2A2 в миокарде пациентов с гипертрофией ЛЖ может свидетельствовать о неблагоприятных процессах, способствующих прогрессированию сократительной дисфункции миокарда.
С другой стороны, сниженная экспрессия гена ADRB1 может быть компенсаторным ответом на повышенный уровень катехоламинов крови, характерный для пациентов с ХСН и коррелирующий со степенью тяжести дисфункции ЛЖ [2, 20]. Однако в исследуемой выборке почти 81% пациентов принимали β-адреноблокаторы. Такая терапия позволяет устранить избыточное влияние катехоламинов на β-адренергические рецепторы и уменьшить степень ремоделирования сердца, что улучшает клинический прогноз [12]. Оказалось, что по уровню экспрессии гена ADRB1 группы пациентов, принимавших β-адреноблокаторы и не принимавших их, не различались.
При анализе влияния лекарственной терапии на уровень экспрессии гена ADRB1 зависимость обнаружена только в отношении приема препаратов АСК. Пациенты, принимавшие АСК, имели значимо более высокую экспрессию гена ADRB1. Среди пациентов, принимавших препараты АСК, также реже встречалась гипертрофия ЛЖ. Однако препараты АСК применяются у больных ХСН при строгих показаниях, например после инфаркта миокарда или в случаях ангиопластики с применением стентов с лекарственным покрытием в рамках двойной антитромботической терапии [12].
Важным фактором развития гипертрофии ЛЖ является митральная недостаточность. Митральная недостаточность I степени характеризуется незначительной митральной регургитацией (МР), II степени – умеренной, III степени – выраженной, а IV степени – тяжелой митральной регургитацией. Пациенты с незначительной или умеренной МР могут длительное время оставаться бессимптомными на фоне небольших гемодинамических компенсаторных изменений. Известно, что МР приводит к компенсаторной гипертрофии ЛЖ и увеличению конечного диастолического объема, что позволяет восстановить эффективный сердечный выброс [21]. Исследуемая нами выборка не является исключением, пациенты с митральной недостаточностью чаще имели гипертрофию ЛЖ. Однако уровень экспрессии гена ADRB1 оказался сопоставим между лицами с незначительной, умеренной МР и без МР.
Одним из ограничений нашего исследования является то, что мы не определили уровень катехоламинов у пациентов, адренореактивность организма и количество рецепторов на мембранах кардиомиоцитов, что затрудняет оценку связи между относительным уровнем экспрессии гена ADRB1 и адренореактивностью организма больных ХСН.
Таким образом, в выборке пациентов с хронической сердечной недостаточностью, развившейся на фоне ишемической болезни сердца и артериальной гипертензии, выявлено значимое снижение уровня экспрессии гена β1-адренорецептора ADRB1 в миокарде пациентов с гипертрофией левого желудочка. В то же время пациенты с разным функциональным классом сердечной недостаточности имели сопоставимый уровень экспрессии гена ADRB1. Относительная экспрессия ADRB1 оказалась более высокой у пациентов, принимавших препараты ацетилсалициловой кислоты, но не показала значимой связи с приeмом β-адреноблокаторов или ингибиторов АПФ.
Исследование выполнено при поддержке гранта Российского научного фонда, проект № 20-75-00003: “Оценка ассоциации экспрессии генов Ca(2+)-транспортирующих белков саркоплазматического ретикулума кардиомиоцитов с тяжестью течения хронической сердечной недостаточности ишемического генеза”.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ranade K., Jorgenson E., Sheu W.H.-H. et al. A polymorphism in the β1 adrenergic receptor is associated with resting heart rate // Am. J. Hum. Genet. 2002. V. 70. № 4. P. 935–942. https://doi.org/10.1086/339621
Костюкевич М.В., Зыков К.А., Миронова Н.А. и др. Роль аутоантител к ßJ-адренорецептору при сердечно-сосудистых заболеваниях // Кардиология. 2016. Т. 56. № 12. С. 82–91. https://doi.org/10.18565/cardio.2016.12.82-91
Luo W., Grupp I.L., Harrer J. et al. Targeted ablation of the phospholamban gene is associated with markedly enhanced myocardial contractility and loss of 3-agonist stimulation // Circ. Res. 1994. V. 75. № 3. P. 401–409. https://doi.org/10.1161/01.RES.75.3.401
Zhihao L., Jingyu N., Lan L. et al. SERCA2a: A key protein in the Ca2+ cycle of the heart failure // Heart Failure Rev. 2020. V. 25. P. 523–535. https://doi.org/10.1007/s10741-019-09873-3
Najafi A., Sequeira V., Kuster D.W.D., Velden J. van der. β-Adrenergic receptor signalling and its functional consequences in the diseased heart // Eur. J. Clin. Invest. 2016. V. 46. № 4. P. 362–374. https://doi.org/10.1111/eci.12598
Zhu W.Z., Wang S.Q., Chakir K. et al. Linkage of β1-adrenergic stimulation to apoptotic heart cell death through protein kinase A-independent activation of Ca2+/calmodulin kinase II // J. Clin. Invest. 2003. V. 111. № 5. P. 617–625. https://doi.org/10.1172/JCI16326
Frielle T., Collins S., Daniel K.W. et al. Cloning of the cDNA for the human beta1-adrenergic receptor // Proc. Natl Acad. Sci. USA. 1987. V. 84. № 22. P. 7920–7924. https://doi.org/10.1073/pnas.84.22.7920
Yang-Feng T.L., Xue F.Y., Zhong W.W. et al. Chromosomal organization of adrenergic receptor genes // PNAS. 1990. V. 87. № 4. P. 1516–1520. https://doi.org/10.1073/pnas.87.4.1516
Кузнецова О.О., Никулина С.Ю., Чернова А.А. и др. Роль полиморфизма гена β-1-адренорецепторов в развитии дилатационной кардиомиопатии // РМЖ. Мед. обозрение. 2020. Т. 4. № 7. С. 394–398. https://doi.org/10.32364/2587-6821-2020-4-7-394-398
Якушин С.С., Солодун М.В. Полиморфизм гена β1-адренорецептора, постинфарктное ремоделирование миокарда и сердечно-сосудистый риск: есть ли взаимосвязь? // Мед. Совет. 2018. № 5. С. 42–46. https://doi.org/10.21518/2079-701X-2018-5-42-46
Vanderheyden M., Mullens W., Delrue L. et al. Endomyocardial upregulation of beta1 adrenoreceptor gene expression and myocardial contractile reserve following cardiac resynchronization therapy // J. Card. Fail. 2008. V. 14. № 2. P. 172–178. https://doi.org/10.1016/j.cardfail.2007.10.016
Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение // Кардиология. 2018. Т. 58. S6. С. 3–164. https://doi.org/10.18087/cardio.2475
Муслимова Э.Ф., Реброва Т.Ю., Кондратьева Д.С. и др. Экспрессия гена Са2+-АТФазы SERCA2A (ATP2A2) и гена рианодиновых рецепторов (RYR2) у больных хронической сердечной недостаточностью // Генетика. 2020. Т. 56. № 7. С. 819–825. https://doi.org/10.31857/S0016675820070103
Li M., Rao M., Chen K. et al. Selection of reference genes for gene expression studies in heart failure for left and right ventricles // Gene. 2017. V. 620. P. 30–35. https://doi.org/10.1016/j.gene.2017.04.006
Molina C.E., Jacquet E., Ponien P. et al. Identification of optimal reference genes for transcriptomic analyses in normal and diseased human heart // Cardiovascular Res. 2018. V. 114. № 2. P. 247–258. https://doi.org/10.1093/cvr/cvx182
Pfaffl M.W. Quantification strategies in real-time PCR // A-Z of Quantitative PCR. La Jolla, CA, USA: IUL, 2004. P. 87–112.
Lohse M.J., Engelhardt S., Eschenhagen T. What is the role of β-adrenergic signaling in heart failure? // Circ. Res. 2003. V. 93. № 10. P. 896–906. https://doi.org/10.1161/01.RES.0000102042.83024.CA
Brodde O.-E. β1- and β2-adrenoceptor polymorphisms and cardiovascular diseases // Fundam. & Clin. Pharmacology. 2008. V. 22. № 2. P. 107–125. https://doi.org/10.1111/j.1472-8206.2007.00557.x
Greenberg B., Yaroshinsky A., Zsebo K.M. et al. Design of a phase 2b trial of intracoronary administration of AAV1/SERCA2a in patients with advanced heart failure: The CUPID 2 Trial (calcium up-regulation by percutaneous administration of gene therapy in cardiac disease phase 2b) // JACC: Heart Failure. 2014. V. 2. № 1. P. 84–92. https://doi.org/10.1016/j.jchf.2013.09.008
Cohn J.N., Levine T.B., Olivari M.T. et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure // N. Engl. J. Med. 1984. V. 311. P. 819–823. https://doi.org/10.1056/NEJM198409273111303
Митральная регургитация. Клинические рекомендации. Министерство здравоохранения РФ, 2016. 25 с. https://racvs.ru/clinic/files/2016/mitral-regurg.pdf
Дополнительные материалы отсутствуют.


