Генетика, 2021, T. 57, № 11, стр. 1306-1317
Тканевой гоносомный мозаицизм у пациентов с нарушением формирования пола, связанным с аномалиями дифференцировки гонад
Н. В. Опарина 1, *, Н. Ю. Райгородская 2, О. Ю. Латышев 3, Л. Н. Самсонова 3, Е. А. Володько 3, С. А. Суязова 4, В. Б. Черных 5
1 Московский областной научно-исследовательский клинический институт
им. М.Ф. Владимирского
129110 Москва, Россия
2 Саратовский государственный медицинский университет им. В.И. Разумовского
410012 Саратов, Россия
3 Российская медицинская академия непрерывного профессионального образования
125993 Москва, Россия
4 Государственный университет управления
109542 Москва, Россия
5 Медико-генетический научный центр им. академика Н.П. Бочкова
115522 Москва, Россия
* E-mail: nv_oparina@mail.ru
Поступила в редакцию 25.03.2021
После доработки 04.06.2021
Принята к публикации 15.06.2021
Аннотация
Представлены результаты исследования гоносомного мозаицизма, в том числе его межтканевой вариабельности в лимфоцитах периферической крови, буккальном эпителии и ткани гонад, у пациентов с нарушением формирования пола (НФП), связанным с аномалиями половых хромосом (гоносомные НФП, n = 8) и с аномалиями дифференцировки гонад (46,XY НФП, n = 10). При исследовании использовался комплекс методов анализа отдельных клеток: стандартное кариотипирование в комбинации с интерфазным FISH. По результатам исследования гоносомный мозаицизм выявлен у 12 (67%) из 18 обследованных пациентов. Скрытый, изолированный тканью гонад, соматический мозаицизм с Х-моносомной клеточной линией выявлен у 4/10 пациентов из группы 46,XY НФП. Истинный, межтканевой, мозаицизм с двумя клеточными линиями, одна из которых с Х-моносомией, выявлен у 8/8 пациентов группы гоносомных НФП. Впервые для пациентов с истинным мозаицизмом была произведена количественная оценка межтканевой вариабельности Х-моносомной клеточной линии. Для этого использовался коэффициент вариации (CV), диапазон выявленных значений которого составил от 2.3 до 49%. В соответствии с полученными значениями CV межтканевая вариабельность оценена как низкая, умеренная или высокая. При проведении корреляционного анализа выявлена статистически значимая (p < 0.1) обратная зависимость степени маскулинизации по шкале Прадера от доли Х-моносомной клеточной линии в лимфоцитах, буккальном эпителии и ткани гонад, а также прямая связь присутствия Х-моносомной клеточной линии в одной из тканей с ее наличием в других тканях. Поиск мозаицизма в тканях разного гистогенеза с использованием комплекса методов анализа отдельных клеток позволяет получить более полное представление о гоносомной конституции и выявить скрытый дисбаланс, что очень важно при обследовании пациентов с НФП. Предложенный и использованный нами в настоящей работе коэффициент вариации (CV) является удобным инструментом для количественной оценки вариабельности клеточных линий в разных тканях одного пациента и шагом к стандартизации результатов генетических исследований.
Нарушение формирования пола (НФП) – обширная гетерогенная группа врожденных заболеваний и патологических состояний, обусловленных несоответствием между генетическим, гонадным и фенотипическим полом. Частота встречаемости НФП составляет 1 : 4500 новорожденных [1]. Согласно современной классификации выделено три группы НФП, каждая из которых отражает хромосомный (генетический) пол и включает отдельные клинические варианты, указывающие на генетическую этиологию или морфологическую форму возникших аномалий дифференцировки гонад и развития половых органов:
I группа: гоносомные НФП, такие как синдром Шерешевского–Тернера (СШТ), синдром Клайнфельтера, Х/ХY смешанная дисгенезия гонад или овотестикулярная форма, ХХ/ХY химеризм и другие формы.
II группа: 46,ХY НФП, такие как полная, неполная дисгенезия гонад и овотестикулярная форма, тестикулярная регрессия и различные нарушения биосинтеза и действия андрогенов и другие формы.
III группа: 46,ХХ НФП, такие как овотестикулярная форма, тестикулярная дисгенезия гонад, а также состояния, связанные с избытком андрогенов, и другие формы [1].
Нарушение дифференцировки гонад может быть вызвано различными причинами: аномалиями половых хромосом, гоносомными CNV (copy number variation), изменением дозы генов, контролирующих дифференцировку пола, генными мутациями, эпигенетическими нарушениями. Причиной гоносомных НФП являются численные и/или структурные аномалии половых хромосом или гетерокариотипический (46,XX/46,XY) химеризм. При этом возникает дисбаланс Х- и Y-сцепленных генов, который и приводит к нарушению формирования пола на уровне дифференцировки гонад. Это важное отличие гоносомных от других групп НФП, разные нозологические варианты которых затрагивают как дифференцировку гонад, так и последующие этапы развития половой системы [2, 3].
Аномалии гоносом могут быть представлены как немозаичными, так и мозаичными формами и могут являться причиной не только нарушений формирования пола, гипогонадизма, но и задержки физического и умственного развития, репродуктивных проблем, однако могут встречаться и у здоровых индивидуумов. Ограниченное количество доступных для исследования тканей является препятствием для обнаружения соматического, в том числе гонадного, мозаицизма. Поэтому многие вопросы, связанные с распространенностью, динамикой и закономерностями распределения гоносомного мозаицизма в различных тканях, его влияние на фенотип недостаточно изучены, а его диагностика и клиническая интерпретация является актуальной проблемой [4].
Цель работы – исследование гоносомного мозаицизма в нескольких тканях у пациентов с разными формами нарушения формирования пола, связанными с аномалиями половых хромосом (гоносомные НФП) и с аномалиями дифференцировки гонад (46,XY НФП).
МАТЕРИАЛЫ И МЕТОДЫ
Выборку составили 18 пациентов с НФП, связанным с нарушением дифференцировки гонад, в том числе восемь пациентов с хромосомным НФП, различные варианты гоносомного дисбаланса у которых выявлены с помощью стандартного цитогенетического исследования (СЦИ), и десять пациентов с 46,XY НФП и дисгенезией гонад. Все случаи нарушения формирования пола являлись спорадическими, т.е. впервые отмечены в родословной, сибсы пациентов здоровы, браки родителей неродственные.
Из исследования исключали пациентов, у которых были диагностированы моногенные формы НФП, в том числе синдромы Дениса–Дрэша, Фрезье, дефекты биосинтеза и действия андрогенов (синдром тестикулярной феминизации, дефицит 5a-редуктазы и др.), врожденная гиперплазия коры надпочечников (дефицит 21-гидроксилазы и другие формы ВГКН).
Возраст обследованных пациентов варьировал от 5 мес. до 17 лет (медиана возраста составила 7.5 лет, с межквартильным интервалом 12.8 года). Среди обследованных девять детей в возрасте от 0 до 4 лет, девять подростков в возрасте от 11 до 17 лет.
Наружные половые органы при рождении сформированы неправильно у 14 из 18 пациентов (степень маскулинизации от II до III по шкале Прадерa). В мужском поле воспитания зарегистрировано 12 пациентов, в женском поле воспитания – пять пациентов. У одного пациента с 46,XY НФП в возрасте 1 года 8 мес. выполнена смена гражданского пола с мужского на женский с последующим проведением феминизирующей пластики гениталий. Гонадэктомия выполнена у 18 пациентов. Дериваты Мюллеровых протоков (ДМ) обнаружены у 16 пациентов. У двух пациентов с 46,XY НФП и одного пациента с гоносомным НФП диагностирована гонадобластома. Материалом для исследования являлись образцы тканей разного эмбрионального происхождения (лимфоциты периферической крови, клетки буккального эпителия и ткань биоптатов гонад).
Стандартное цитогенетическое исследование выполняли на ФГА-стимулированных лимфоцитах периферической крови в соответствии с общепринятым протоколом [5]. Для визуализации бэндинга хромосом использовали GTG-метод дифференциального окрашивания. Анализировали от 20 до 100 метафазных пластинок [6].
Флуоресцентную in situ гибридизацию (FISH) выполняли на препаратах интерфазных ядер культивированных и некультивированных лимфоцитов периферической крови, некультивированных клеток буккального эпителия, на депарафинизированных срезах гистологических образцов биопсийного материала. Для определения числа копий хромосом использовали ДНК-зонды, специфичные к центромерным районам X-/Y-хромосом, аутосом 7 и 18 (SE X (DXZ1), Y (DYZ3), 7 (D7Z1), 18 (D18Z1); Kreatech, Leica, Нидерланды). Сигналы от аутосомных зондов использовали в качестве внутреннего контроля. Предгибридизационную подготовку и гибридизацию выполняли согласно протоколу производителя (Poseidon, Kreatech, Leica, Нидерланды). Количество проанализированных клеток для каждого образца составило от 100 до 1000 в каждой исследуемой ткани.
Для визуализации метафазных GTG-окрашенных хромосом и флуоресценции гибридизационных сигналов использовали микроскоп Nikon Eclipse Ci (Nikon Corporation, Япония) с программным обеспечением ВидеоТестКарио 3.1 (Видеотест, Россия) и LUCIA Cytogenetics – FISH (LUCIA Cytogenetics, Чехия). Результаты исследований записаны в соответствии с Международной цитогеномной номенклатурой [7].
Статистический анализ выполняли с помощью непараметрических методов с использованием Excel из пакета программ Microsoft Office 2016 (Microsoft Inc., США), программы Statistica, версия 12 (StatSoft, США), а также R версии 4.0.3 (The R Foundation for Statistical Computing, Австрия) [8] с пакетами vegan [9] и pwr [10]. Для количественной оценки межтканевой вариабельности клеточных линий нами предложено использовать коэффициент вариации (CV), который рассчитывали по формуле:
где Sx и $\bar {x}$ – соответственно стандартное отклонение и среднее доли X-моносомии по отдельному пациенту [11, 12]. Значения CV расценивались согласно рекомендуемым критериям [11, 12], где интервал 0–15% соответствует низкой вариабельности, 15–30% – умеренной, 30–100% – высокой вариабельности. Корреляционный анализ проводили с использованием r-критерия Спирмена и W-критерия Кендалла. Согласно проведенной с помощью пакета [10] предварительной оценке мощность критерия значимости коэффициента корреляции, равного 0.4 (умеренная взаимосвязь), при 18 наблюдениях и стандартном уровне значимости α = 0.05 составляет (1 – β) = 0.39. Этот показатель ниже рекомендуемого значения (1 – β) = 0.8, поэтому уровень значимости повышен до α = 0.10, что для коэффициента 0.4 даст мощность критерия (1 – β) = 0.52. Далее в анализе статистически значимыми считали корреляции при уровне вероятности p < 0.10 [9, 12].
РЕЗУЛЬТАТЫ
В группе гоносомных НФП (n = 8) пациенты имели различные варианты дисгенезии гонад и фенотипические черты СШТ (табл. 1). Четыре пациента данной группы имели феминное строение наружных половых органов при рождении и женский пол воспитания. Внутренние гениталии представляли собой гипоплазированную матку или маточный тяж и фаллопиевы трубы, вдоль которых располагались гонады в виде фиброзных тяжей. При гистологическом исследовании гонад помимо соединительной ткани определялись элементы овариальной стромы. Еще четыре пациента этой группы при рождении определены и воспитывались в мужском поле, имели двойственное строение наружных половых органов: расщепленную мошонку, промежностную гипоспадию, микропенис. У них выявлены ДМ в виде гипоплазированной матки и маточных труб. Гонады этих пациентов дифференцированы асимметрично (по типу смешанной дисгенезии гонад): яичко с одной стороны и стрек с другой стороны (контралатерально). При гистологическом исследовании в ткани удаленных гонад обнаружены элементы недифференцированной стромы, фиброз. Гонадобластома диагностирована у одного пациента.
Таблица 1.
Клинические характеристики пациентов с НФП
| Код пациента | Возраст | Паспортный пол | Наружные
половые органы
при рождении, маскулинизация по шкале Прадера |
Локализация и макроморфология гонад по данным УЗИ | Гонадэктомия | ДМ | Гистологический диагноз морфологической структуры удаленных гонад | ||
|---|---|---|---|---|---|---|---|---|---|
| правая | левая | ||||||||
| 1 | 14 лет | Ж | Двойственные | II | Не определяется | Не определяется | Д | + | Фиброзные тяжи с обеих сторон |
| 2 | 17 лет | Ж | Женские | 0 | Не определяется | Не определяется | Д | + | Фиброзные тяжи с обеих сторон |
| 3 | 5 мес. | М | Двойственные | III | Не определяется | Яичко в мошонке | П | + | Фиброзный тяж справа |
| 4 | 12 лет | Ж | Женские | 0 | Не определяется | Не определяется | Д | + | Фиброзные тяжи с обеих сторон |
| 5 | 17 лет | М | Двойственные | III | Гипоплазированная гонада в малом тазу | Яичко в мошонке | П | + | Дисгенетичное яичко с придатком, с герминативными клетками, без признаков функциональной активности справа |
| 6 | 7 мес. | М | Двойственные | II | Гипоплазированная гонада в малом тазу | Яичко в мошонке | П | + | Тяж с элементами ткани яичника, эктопией ткани надпочечника, герминативными клетками, гонадобластома справа |
| 7 | 14 лет | Ж | Женские | 0 | Не определяется | Не определяется | Д | + | Фиброзные тяжи с обеих сторон |
| 8 | 11 лет | М | Двойственные | III | Яичко в паховом канале | Не определяется | Л | + | Фиброзный тяж с элементами ткани яичка слева |
| 9 | 16 лет | Ж | Женские | I | Не определяется | Не определяется | Д | + | Фиброзные тяжи с обеих сторон, гонадобластома |
| 10 | 14 лет | М | Двойственные | III | Яичко в мошонке, микролитиаз | Гипоплазированное яичко в паховом канале | Д | – | Яички с атрофией эпителия семенных канальцев, гиперплазия кл. Лейдига с обеих сторон, сперматоцеле справа |
| 11 | 2 года | М | Двойственные | III | Яичко в мошонке | Гипоплазированная гонада в паховом канале | Л | + | Тяж с элементами ткани яичника и кл. Лейдига слева |
| 12 | 12 лет | М | Двойственные | III | Дисгенетичное яичко с признаками атрофии в паховом канале | Гипоплазированное яичко | П | – | Соединительная ткань с элементами атрофичной ткани сперматогенного эпителия яичка справа |
| 13 | 1 год | М | Двойственные | III | Яичко в мошонке | Не определяется | Л | + | Тяж с элементами ткани яичника и герминативными клетками, гонадобластома слева |
| 14 | 4 года | М | Двойственные | III | Яичко в мошонке | Не определяется | Л | + | Овотестис слева |
| 15 | 2 года | М | Двойственные | III | Яичко в мошонке | Абдоминальная гонада | Л | + | Дисгенетичное яичко слева |
| 16 | 5 мес. | М | Двойственные | III | Яичко в паховом канале | Не определяется | Л | + | Фиброзный тяж слева |
| 17 | 2 года | М | Двойственныe | II | Яичко в мошонке | Абдоминальная гонада | Л | + | Овотестис слева |
| 18 | 1 год | М → Ж | Двойственные | II | Абдоминальная гонада | Абдоминальная гонада | Л | + | Овотестис с обеих сторон |
В группе 46,XY НФП (n = 10) пациенты имели различные варианты дисгенезии гонад. Женский пол при рождении определен у одного пациента. При обследовании в возрасте 16 лет у этого пациента отмечено правильное феминное строение наружных половых органов, полная билатеральная дисгенезия тестикул, гипоплазированная матка и трубы с обеих сторон, гонадобластома. У остальных пациентов этой группы (9/10) выявлена неполная форма дисгенезии гонад. Наружные половые органы имели двойственное строение с различной степенью маскулинизации: проксимальную форму гипоспадии в сочетании с крипторхизмом, недоразвитием кавернозных тел. При визуализации внутренних половых органов обнаружено наличие ДМ – гипоплазированной матки и маточных труб. Гонады были представлены яичком c одной стороны и дисгенетичной гонадой контралатерально у 6/9 пациентов. По данным гистологического исследования, у 4/6 пациентов дисгенетичные гонады представляли собой стрек. У 2/6 пациентов – двойственно-дифференцированные гонады, состоящие из овариального и тестикулярного компонентов (овотестис). Наличие двустороннего овотестис установлено у 1/9 пациентов. Билатеральная паховая ретенция яичек с признаками их атрофии и проявлениями гипергонадотропного гипогонадизма выявлена у 2/9 пациентов этой группы.
При СЦИ у всех пациентов с гоносомным НФП (n = 8) выявлен мозаичный кариотип с двумя клеточными линиями, одна из которых с Х-моносомией (табл. 2). Во второй клеточной линии структурно измененная Х-хромосома выявлена у 2/8 пациентов, нормальная Y-хромосома – у 3/8 пациентов и структурно измененная Y-хромосома – у 3/8 пациентов. По результатам FISH исследования простой мозаицизм обнаружен во всех исследованных тканях у пациентов этой группы.
Таблица 2.
Результаты молекулярно-цитогенетического исследования разных тканей у 18 пациентов с НФП
| Код пациента | Паспортный пол | Кариотип по данным СЦИ | Выявленные в исследованных тканях клеточные линии с различным набором гоносом по результатам FISH | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| лимфоциты, % клеток | буккальный эпителий, % клеток | гонады, % клеток | |||||||||
| X | XX | XY | X | XX | XY | X | XX | XY | |||
| 1 | Ж | mos45,X[45]/46,Х,psuidic(X)(p11.2)[7] | 90 | 10 | 0 | 60 | 40 | 0 | 75 | 25 | 0 |
| 2 | Ж | mos45,X[30]/46,Х,i(X)(q10)[5] | 94 | 6 | 0 | 93 | 7 | 0 | 90 | 10 | 0 |
| 3 | М | mos45,X[38]/46,XY[8] | 81 | 0 | 19 | 66 | 0 | 34 | 65 | 0 | 35 |
| 4 | Ж | mos45,X[52]/46,XY[48 ] | 51 | 0 | 49 | 79 | 0 | 21 | 85 | 0 | 15 |
| 5 | М | mos45,X[17]/46,X,psuidic(Y)(q11.2)[13] | 65 | 0 | 35 | н.и. | н.и. | н.и. | 44 | 0 | 56 |
| 6 | М | mos45,X[24]/46,X,del(Y)(q11.2)[6] | 83 | 0 | 17 | 67 | 0 | 33 | 95 | 0 | 5 |
| 7 | Ж | mos45,X[12]/46,X,psuidic(Y)(q11.2)[8] | 65 | 0 | 35 | н.и. | н.и. | н.и. | 60 | 0 | 40 |
| 8 | М | mos45,X[6]/46,XY[24] | 43 | 0 | 57 | 60 | 0 | 40 | 20 | 0 | 80 |
| 9 | Ж | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 9 | 0 | 91 |
| 10 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 7 | 0 | 93 |
| 11 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 0 | 0 | 100 |
| 12 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 0 | 0 | 100 |
| 13 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 7 | 0 | 93 |
| 14 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 29 | 0 | 71 |
| 15 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 0 | 0 | 100 |
| 16 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 0 | 0 | 100 |
| 17 | М | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 0 | 0 | 100 |
| 18 | М → Ж | 46,XY | 0 | 0 | 100 | 0 | 0 | 100 | 0 | 0 | 100 |
Примечание. М → Ж – смена пола с мужского на женский, н.и. – не исследовано. X – клеточная линия с одной Х-хромосомой, вторая гоносома отсутствует; ХХ – клеточная линия с двумя Х-хромосомами; XY – клеточная линия с одной Х-хромосомой и одной Y-хромосомой в каждой клетке. При обозначении клеточных линий макроструктурные перестройки вовлеченных гоносом не учитывались. Истинный гоносомный генотип указан в столбце “кариотип”.
Изолированный тканью гонад соматический гоносомный мозаицизм с двумя клеточными линиями, одна из которых с Х-моносомией, а вторая с XY, выявлен у 4/10 пациентов из группы 46,XY НФП.
У пациентов с истинным, межтканевым, гоносомным мозаицизмом из группы гоносомных НФП представленность Х-моносомной клеточной линии варьировала от 43 до 94% в лимфоцитах, от 60 до 93% в буккальном эпителии, от 20 до 95% в ткани гонад (рис. 1).
Рис. 1.
Наличие и представленность X-моносомной клеточной линии в интерфазных ядрах клеток разных тканей в выборке из 18 пациентов с НФП. Каждому пациенту соответствуют три столбца разного цвета. Отсутствие столбца означает 0%. Столбец серого цвета у пациентов 5 и 7 имеет произвольную высоту и означает, что ткань не исследована.
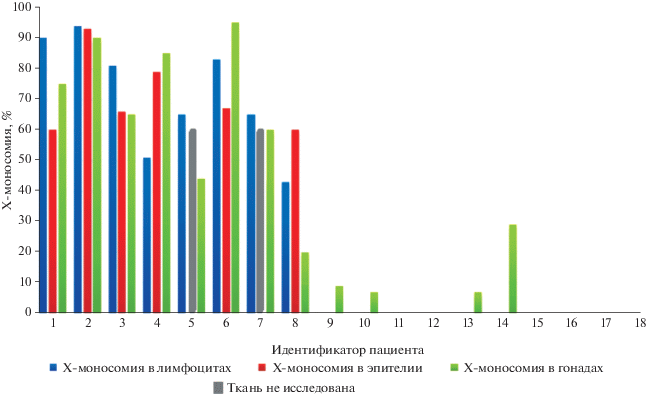
Представленность Х-моносомной клеточной линии у четырех пациентов с изолированным тканью гонад соматическим мозаицизмом из группы 46,XY НФП варьировала от 7 до 29%. Из них в трех наблюдениях (пациенты 9, 10, 13) представленность Х-моносомной линии в ткани гонад составила менее 10%, в одном наблюдении (пациент 14) – 29%.
Для количественной оценки межтканевой вариабельности X-моносомной клеточной линии у пациентов с истинным, межтканевым, гоносомным мозаицизмом из группы гоносомных НФП (n = 8) нами предложен новый подход с использованием коэффициента вариации (CV) (рис. 2). В тех случаях, когда значение по какой-либо ткани отсутствовало (пациенты 5 и 7), расчет выполнен по исследованным тканям. Межтканевая вариабельность X-моносомной клеточной линии определена в диапазоне от 2.3 до 49%. У одного пациента межтканевая вариабельность расценена как высокая, у четырех – как умеренная и у трех – как низкая.
Рис. 2.
Значения коэффициента вариации (CV), демонстрирующие межтканевую вариабельность доли X-моносомной клеточной линии у пациентов из группы НФП гоносомные.

Самая низкая межтканевая вариабельность зарегистрирована у пациента женского пола (пациент 2), имеющего цитогенетически идентифицированные перестройки вовлеченной в мозаицизм Х-хромосомы (табл. 3). При этом X-моносомная клеточная линия доминировала во всех исследованных тканях. Самая высокая межтканевая вариабельность зарегистрирована у пациента 8 с вовлеченной в мозаицизм Y-хромосомой без цитогенетически идентифицированных структурных изменений и с мужским полом воспитания. Доминирование X-моносомной клеточной линии отмечено только в одной из трех исследованных тканей: в буккальном эпителии.
Таблица 3.
Данные о межтканевой вариабельности, доминировании X-моносомной клеточной линии в различных тканях и о наличии макроструктурных перестроек в вовлеченной в мозаицизм гоносоме у пациентов с гоносомным НФП
| Межтканевая вариабельность Х-моносомной клеточной линии |
CV, % | Код пациента | Пол | Доминирование Х-моносомии в тканях | Изменение доли Х-моносомии в тканях | Вовлеченная в мозаицизм гоносома |
Тип макроструктурной перестройки вовлеченной гоносомы | Точки разрыва | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Л | БЭ | Г | ||||||||
| Низкая | 2.3 | 2 | Ж | + | + | + | Нет | аbnХ | Изохромосома | q10 |
| Низкая | 5.7 | 7 | Ж | + | н.и. | + | Нет | аbnY | Псевдоизодицентрик | q11.2 |
| Низкая | 12.7 | 3 | М | + | + | + | Нет | Y | Не выявлены | Отсутствуют |
| Умеренная | 17.2 | 6 | М | + | + | + | Г > Л > БЭ | аbnY | Делеция | q11.2 |
| Умеренная | 20 | 1 | Ж | + | + | + | Л > Г > БЭ | аbnХ | Псевдоизодицентрик | p11.2 |
| Умеренная | 25.7 | 4 | Ж | – | + | + | Г > БЭ > Л | Y | Не выявлены | Отсутствуют |
| Умеренная | 27.2 | 5 | М | + | н.и. | – | Л > Г | аbnY | Псевдоизодицентрик | q11.2 |
| Высокая | 49 | 8 | М | – | + | – | БЭ > Л > Г | Y | Не выявлены | Отсутствуют |
С целью оценки клинической значимости цитогенетического исследования различных тканей был проведен корреляционный анализ. Для оценки возможной зависимости (как линейной, так и нелинейной) стадии маскулинизации по шкале Прадерa от доли X-моносомной клеточной линии в различных тканях рассчитаны ранговые коэффициенты корреляции Спирмена (r) и конкордации Кендалла (W). В совершенной ранжировке доли X-моносомной клеточной линии и коэффициента вариации наименьший ранг присваивался максимальному значению доли, а наибольший ранг присваивался наблюдениям с отсутствием X-моносомной клеточной линии во всех трех исследованных тканях (11, 12, 15–18). В ранжировке шкалы Прадерa наименьший ранг присвоен максимальному значению шкалы у пациентов описываемой нами группы. Тестировались двусторонние альтернативные гипотезы. Выявлена статистически значимая (p < 0.1) обратная зависимость степени маскулинизации по шкале Прадерa от доли Х-моносомной клеточной линии в лимфоцитах (r = –0.44, p = 0.0665), буккальном эпителии (r = –0.51, p = 0.0432) и ткани гонад (r = = –0.49, p = 0.0397), а также прямая связь присутствия Х-моносомной клеточной линии в одной из тканей с ее наличием в других тканях (W = 0.78, р = 0.0010).
Таким образом, с учетом исследования различных тканей гоносомный мозаицизм выявлен у 12 (67%) из 18 обследованных пациентов. Истинный, межтканевой, мозаицизм с двумя клеточными линиями, одна из которых с Х-моносомией, выявлен у 8/8 пациентов группы гоносомных НФП. Представленность Х-моносомной клеточной линии варьировала от 43 до 94% в лимфоцитах, от 60 до 93% в буккальном эпителии, от 20 до 95% в ткани гонад. Межтканевая вариабельность Х-моносомной клеточной линии у 3/8 пациентов оценена как низкая, у 4/8 пациентов как умеренная и у 1/8 пациентов как высокая. Диапазон CV составил от 2.3 до 49%. Изолированный тканью гонад соматический мозаицизм с Х-моносомной клеточной линией выявлен у 4/10 пациентов из группы 46,XY НФП. Представленность Х-моносомной клеточной линии при этом варьировала от 7 до 29%.
Выявлена статистически значимая (p < 0.1) обратная зависимость степени маскулинизации по шкале Прадера от доли Х-моносомной клеточной линии в лимфоцитах (r = –0.44, p = 0.0665), буккальном эпителии (r = –0.51, p = 0.0432) и ткани гонад (r = –0.49, p = 0.0397), а также прямая связь присутствия Х-моносомной клеточной линии в одной из тканей с ее наличием в других тканях (W = 0.78, р = 0.0010).
ОБСУЖДЕНИЕ
Аномалии гоносом, возникающие на генном, хромосомном, геномном и эпигенетическом уровнях организации генома, могут изменять экспрессию X- и Y- сцепленных про-тестикулярных генов и являться одной из причин нарушения дифференцировки гонад [4, 13, 14]. Гоносомный дисбаланс, возникающий на постзиготических стадиях из-за нарушения митотической сегрегации хромосом, может проявляться различными вариантами мозаицизма и широким спектром фенотипов [2, 3]. Сложность диагностики мозаицизма заключается как в ограниченном количестве доступных для исследования тканей, так и в отсутствии универсального метода.
В настоящей работе нами представлены результаты исследования гоносомного мозаицизма в лимфоцитах, буккальном эпителии и ткани гонад у 18 пациентов с 46,XY и дисгенезией гонад (n = 10) и гоносомной (n = 8) формами НФП. При исследовании использован комплекс методов анализа отдельных клеток: классическое кариотипирование в комбинации с интерфазным FISH. По результатам исследования у 4/10 пациентов с 46,XY НФП в ткани гонад выявлен скрытый мозаицизм, одна из линий которого с Х-моносомией. Представленность Х-моносомной клеточной линии варьировала от 7 до 29%.
46,XY НФП является высокогетерогенной группой, в которую включено множество клинико-генетических вариантов. В литературе описаны случаи выявления скрытого тканевого гоносомного мозаицизма с Х-моносомной клеточной линией у 46,XY пациентов с тестикулярной дисгенезией гонад и овотестикулярной формой, при тестикулярной регрессии, в том числе у пациентов с синдромом Свайера [15–19]. Наличие Х-моносомной клеточной линии в бипотенциальной гонаде может негативно отразиться на ее дальнейшей дифференцировке [20]. Однако постзиготическая потеря Y-хромосомы человека, являющаяся следствием мутаций в соматических клетках, связана с широким спектром заболеваний, таких как рак, болезнь Альцгеймера, патология сердца и сосудов [21]. Это необходимо учитывать для корректной интерпретации результатов настоящей работы, свидетельствующих о наличии изолированного соматического мозаицизма. Нами применялся таргетный подход поиска гоносомного дисбаланса с использованием ограниченного количества ДНК-зондов. Возможно, у пациентов с уровнем мозаицизма менее 10% нарушение генотипа клеток с выявленной Х-моносомией носит более сложный характер и отражает совсем другие процессы, например малигнизацию. Из гистологического описания известно, что гонадобластома диагностирована у пациентов 9 и 13. У пациента 10 обнаружено наличие тестикулярного микролитиаза, сперматоцеле, атрофии эпителия яичка. Такие процессы могут сопровождаться усилением апоптоза или онкозом клеток в поврежденном органе и стать одной из возможных причин появления анеуплоидной линии. В работе Faure-Conter [22] сообщается о семи случаях, когда выявление герминально-клеточного рака предшествовало диагнозу НФП, и о четырех случаях, когда диагноз НФП предшествовал выявлению онкологического процесса в гонадах. С другой стороны, представленность Х-моносомной клеточной линии в ткани гонад у пациента 14 выше, чем у пациента 8 с истинным, межтканевым, мозаицизмом и кариотипом 45,X/46,XY из группы гоносомных НФП (29 и 20% соответственно). Сочетание 46,XY кариотипа и овотестикулярной формы является одним из редких вариантов нарушения дифференцировки гонад и может возникать в результате изменения экспрессии про-тестикулярных (SRY, SOX9 и др.) генов. Как вариант нарушения дифференцировки овотестикулярная форма встречается с частотой 1 : 100 000 новорожденных, описана у пациентов с 46,XX кариотипом, с 46,XX/46,XY химеризмом или 45,X/46,XY мозаицизмом [23]. Очевидно, что тестикулярная регрессия, частичная дисгенезия гонад при кариотипе 46,XY и смешанная дисгенезия гонад при 45,X/46,XY гоносомном НФП представляют собой близкие, сходные, частично генетически и фенотипически перекрывающиеся клинико-морфологические варианты нарушения дифференцировки гонад и формирования пола, проявляющиеся широким спектром фенотипов и дефицитом маскулинизации [18].
Нами выявлена статистически значимая (p < 0.10) обратная корреляция степени маскулинизации по шкале Прадера от доли Х-моносомной клеточной линии в лимфоцитах (r = –0.44, p = 0.0665), буккальном эпителии (r = –0.51, p = 0.0432) и ткани гонад (r = –0.49, p = 0.0397). Однако объем исследованной выборки не позволяет повысить уровень значимости выявленной зависимости.
По результатам исследования у пациентов с гоносомным НФП (n = 8) во всех исследованных тканях выявлен мозаицизм, состоящий из двух клеточных линий, одна из которых с Х-моносомией. Вторая клеточная линия у всех пациентов являлась эуплоидной и содержала Х- или Y-хромосому с макроструктурными изменениями (5/8) или без таковых (3/8). Других клеточных линий, отличающихся копийностью или дополнительными структурными изменениями гоносом, не выявлено. Это позволяет говорить об истинном, межтканевом, простом мозаицизме со стабильным количеством клеточных линий во всех исследованных тканях. Наиболее вероятный генез такого мозаицизма митотический, в результате анафазного отставания одной из гоносом в изначально эуплоидной зиготе. Структурные перестройки гоносом, дефекты центромеры, кинетохора и т.д. могут быть триггерами этого процесса [21].
Возникновение Х-моносомной клеточной линии может произойти на разных этапах формирования или развития эмбриона, а скорость накопления мутаций в тканях различна. Поэтому нами была исследована межтканевая вариабельность доли Х-моносомной клеточной линии у каждого пациента, что является важным аналитическим параметром, отражающим митотическую стабильность вовлеченной хромосомы и активность процесса накопления мутаций в тканях. Впервые произведена количественная оценка результатов с использованием коэффициента вариации (CV) как инструмента со стандартизованной интерпретацией полученных значений, исходя из которой межтканевая вариабельность может быть расценена как низкая, умеренная или высокая. Полученные значения CV находились в диапазоне от 2.3 до 49%. Только у 3/8 пациентов CV не превышал 15% и был расценен как низкий, что позволяет считать долю Х-моносомии во всех исследованных тканях идентичной. У 4/8 пациентов вариабельность расценена как умеренная при интервале CV от 15 до 30%. И низкая, и умеренная вариабельность наблюдалась у пациентов как с вовлеченной в мозаицизм структурно измененной гоносомой, так и с нормальной Y-хромосомой. Но у пациентов с низкой вариабельностью Х-моносомная клеточная линия доминировала во всех исследованных тканях. При умеренной вариабельности доминирование Х-моносомии во всех исследованных тканях наблюдали в двух случаях (пациенты 1 и 6). В одном случае Х-моносомия доминировала в буккальном эпителии и гонадах при равном соотношении клеточных линий в лимфоцитах (пациент 4). В одном случае Х-моносомия доминировала в лимфоцитах при равном соотношении клеточных линий в гонадах (пациент 5). Высокая вариабельность (CV = 49%) выявлена у одного пациента (пациент 8) с вовлеченной в мозаицизм Y‑хромосомой без цитогенетически идентифицированных структурных изменений. Х-моносомия доминировала только в буккальном эпителии этого пациента и составила 60%. В лимфоцитах соотношение Х-моносомной и Y-несущей клеточных линий составило 43 : 57% соответственно. А в ткани гонад Х-моносомия составила 20%. Это самый низкий показатель Х-моносомии в ткани гонад среди пациентов с гоносомным НФП. И этот показатель ниже, чем у пациента 14 с соматическим гоносомным мозаицизмом и овотестикулярной формой НФП.
Результаты ряда исследований свидетельствуют o межтканевой вариабельности доли клеточных линий у пациентов с гоносомным мозаицизмом. Так, Peek и соавт. [24], обследовав группу из 10 пациенток с СШТ, пришли к выводу, что мозаицизм в лимфоцитах, буккальном и уретральном эпителии не коррелирует с мозаицизмом в гонадах. Кроме того, сепарировав и отдельно исследовав ооциты, гранулезные и стромальные клетки, они выявили в них разную частоту встречаемости Х‑моносомии. Reddy и Sulkova [25] описали пять пациентов с 45,Х/46,ХY кариотипом и выраженным различием доли Х-моносомии как между лимфоцитами и гонадами, так и между клетками Сертолли и Лейдига в дисгенетичных гонадах. Nomura и соавт. [26] сообщали о пациенте с 45,Х/46,ХY кариотипом и экстремальной вариабельностью Y-несущей клеточной линии: 0.2% в лимфоцитах и 50% в гонадах. Анализу межтканевой вариабельности посвящена работа Graff и соавт. [27], где сообщается, что при исследовании лимфоцитов и буккального эпителия от 142 взрослых с СШТ доля Х-моносомии между двумя тканями оказалась идентична в 32.4% наблюдений, а несоответствие выявлено в 41% наблюдений.
Наличие самого явления межтканевой вариабельности клеточных линий, особенно высоких и экстремальных вариантов, свидетельствует о том, что случаи межтканевого мозаицизма могут выявляться и интерпретироваться как изолированный мозаицизм. Нами выявлена статистически значимая связь присутствия Х-моносомной клеточной линии в одной из тканей с ее наличием в других тканях (W = 0.78, р = 0.0010). Ограниченное количество доступных для исследования тканей является одним из существенных препятствий при изучении мозаицизма.
Идентификация и анализ структурной целостности вовлеченной в мозаицизм гоносомы, так же как и идентификация сформировавшихся клеточных линий, имеют прогностическое значение. При выборе тактики лечебных мероприятий наличие нормальной или структурно аномальной Y‑хромосомы у пациентов женского пола является показанием для проведения профилактической гонадэктомии из-за высокого риска возникновения и прогрессии неопластического процесса в дисгенетичной гонаде [28]. Учитывая возможность межтканевой вариабельности клеточных линий, поиск Y-хромосомы в тканях разного гистогенеза снижает риск ошибок диагностики. Пациентки с мозаицизмом Х/ХХ имеют лучший репродуктивный прогноз и большую продолжительность жизни, чем пациентки со структурно измененной Х-хромосомой, вовлеченной в мозаицизм [29]. В то же время при мозаицизме Х/ХХ с низкой долей ХХ-эуплоидных клеток требуется уточнение происхождения каждой из Х-хромосом для исключения однородительской дисомии. Поиск мозаицизма оправдан и при задержке роста, которая является одним из частых фенотипических эффектов Х-моносомии. У пациентов с 45,X/46,XY мозаицизмом задержка роста чаще всего происходит после двух лет, при этом пациенты женского пола отстают в росте значительнее, чем пациенты мужского пола [30].
Сложность диагностики мозаицизма заключается в том, что на сегодняшний день нет универсального метода, а есть два принципиально разных подхода: анализ либо отдельных клеток, либо совокупности (массива) клеток. Преимуществом использованного нами комплексного подхода к анализу отдельных клеток является возможность оценить различные варианты хромосомной конституции (в пределах разрешающей способности метода), включая сбалансированные перестройки и низкоуровневый мозаицизм (менее 5%), корректно описать все присутствующие клеточные линии, в том числе динамический мозаицизм, а также проанализировать межтканевую вариабельность распределения клеточных линий. Следует отметить, что на сегодняшний день современные молекулярные методы анализа массива клеток, такие как сравнительная геномная гибридизация (arrayCGH) и секвенирование нового поколения (NGS), такой возможностью не обладают [31].
Таким образом, поиск мозаицизма в тканях разного гистогенеза с использованием комплекса методов анализа отдельных клеток позволяет получить более полное представление о гоносомной конституции и выявить скрытый дисбаланс, что очень важно при обследовании пациентов с НФП.
Впервые произведенная в настоящем исследовании количественная оценка межтканевой вариабельности клеточных линий при мозаицизме с использованием коэффициента вариации (CV) является шагом к стандартизации результатов генетических исследований, может способствовать выявлению новых закономерностей при изучении мозаицизма и облегчает клиническую интерпретацию полученных результатов.
Работа проведена без привлечения дополнительного финансирования со стороны третьих лиц.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов. Все авторы внесли существенный вклад в подготовку статьи, прочли и одобрили финальную версию.
Список литературы
Hughes I.A., Houk C., Ahmed S.F. et al. Consensus statement on management of intersex disorders // Arch. Dis. Child. 2006. V. 91. № 7. P. 554–563. https://doi.org/10.1136/adc.2006.098319
Gardner R.J.M., David J.A. Chromosome Abnormalities and Genetic Counseling. 5th ed. Oxford Univ. Press, 2018. 634 p.
Курило Л.Ф. Хромосомные заболевания органов половой системы // Клинич. и эксперим. морфология. 2015. № 1. С. 48–59.
Курило Л.Ф., Андреева М.В., Коломиец О.Л. и др. Генетические синдромы с нарушениями развития органов половой системы // Андрология и генитальная хирургия. 2013. № 4. С. 17–27.
Рубцов Н.Б. Методы работы с хромосомами млекопитающих: учебное пособие. Н.: Новосибирский гос. ун-т, 2006. 152 с.
Кузнецова Т.В., Шилова Н.В., Творогова М.Г. и др. Практические рекомендации по обеспечению качества и надежности цитогенетических исследований // Мед. генетика. 2019. Т. 18. № 5. С. 3–27. https://doi.org/10.25557/2073-7998.2019.05.3-27
McGowan-Jordan J., Simons A., Schmid M. ISCN 2016: An International System for Human Cytogenomic Nomenclature (2016) // Reprint of Cytogenetic and Genome Research. 2016. V. 149. № 1–2. 140 p.
R Core Team. [Элeктpoнный pecypc]. URL https://www.R-project.org/ R: A language and environment for statistical computing. R Foundation for Statistical Computing (02.12.2020).
Vegan: Community Ecology Package. R package version 2.5-7 [Электронный ресурс]. URL https:// CRAN.R-project.org/package=vegan (02.12.2020).
pwr: Basic Functions for Power Analysis. R package version 1.3-0 [Электронный ресурс]. URL https:// CRAN.R-project.org/package=pwr (02.12.2020).
Ефимова М.Р., Петрова Е.В., Ганченко О.И., Михайлов М.Ф. Общая теория статистики. Практикум. 4-е изд. М.: Юрайт, 2019. 355 с.
Писарева О.М. Методы прогнозирования развития социально-экономических систем. М.: Высш. шк., 2007. 591 с.
Gomes N.L., Chetty T., Jorgensen A., Mitchell R.T. Disorders of sex development–novel regulators, impacts on fertility, and options for fertility preservation // Int. J. Mol. Sci. 2020. V. 21. № 7. P. 2282. https://doi.org/10.3390/ijms21072282
Veitia R.A., Salas-Corte’s L., Ottolenghi C. et al. Testis determination in mammals: More questions than answers // Mol. Cell. Endocrinology. 2001. V. 179. № 1–2. P. 3–16. https://doi.org/10.1016/s0303-7207(01)00460-9
Röpke A., Kalinski T., Mohnike K. et al. Distribution of sex chromosomes in dysgenetic gonads of mixed type // Cytogenet. Genome Res. 2007. V. 116. № 1–2. P. 146–151. https://doi.org/10.1159/000097435
Röpke A., Pelz A.F., Volleth M. et al. Sex chromosomal mosaicism in the gonads of patients with gonadal dysgenesis, but normal female or male karyotypes in lymphocytes // Am. J. Obstet. Gynecol. 2004. V. 190. № 4. P. 1059–1062. https://doi.org/10.1016/j.ajog.2003.09.053
Berberoğlu M., Şıklar Z. The evaluation of cases with y-chromosome gonadal dysgenesis: Clinical experience over 18 years // J. Clin. Res. Pediatr. Endocrinol. 2018. V. 10. № 1. P. 30–37. https://doi.org/10.4274/jcrpe.4826
Andrade J.G., Guerra-Júnior G., Maciel-Guerra A.T. 46,XY and 45,X/46,XY testicular dysgenesis: Similar gonadal and genital phenotype, different prognosis // Arq. Bras. Endocrinol. Metabol. 2010. V. 54. № 3. P. 331–334. https://doi.org/10.1590/s0004-27302010000300013
Chand M.T., Turner S., Solomon L.A. et al. A case of 45,X/46,XY mosaicism presenting as Swyer syndrome // J. Pediatr. Adolesc. Gynecol. 2020. V. 33. № 5. P. 575–580. https://doi.org/10.1016/j.jpag.2020.06.008
Kamel A.K., Abd El-Ghany H.M., Mekkawy M.K. et al. Sex chromosome mosaicism in the gonads of DSD patients: A karyotype/phenotype correlation // Sex. Dev. 2015. V. 9. № 5. P. 279–288. https://doi.org/10.1159/000442332
Guo X., Dai X., Zhou T. et al. Mosaic loss of human Y chromosome: what, how and why // Hum. Genet. 2020. V. 139. № 4. P. 421–446. https://doi.org/10.1007/s00439-020-02114-w
Faure-Conter C., Orbach D., Fresneau B. et al. Disorder of sex development with germ cell tumors: Which is uncovered first? // Pediatr. Blood Cancer. 2020. V. 67. № 4. P.e28169. https://doi.org/10.1002/pbc.28169
Mekkawy M.K., Kamel A.K., Dessouky N. et al. Cytogenetic spectrum of ovotesticular difference of sex development (OT DSD) among a large cohort of DSD patients and literature review // Sex. Dev. 2019. V. 13. № 5–6. P. 221–227. https://doi.org/10.1159/000508153
Peek R., Schleedoorn M., Smeets D. et al. Ovarian follicles of young patients with Turner’s syndrome contain normal oocytes but monosomic 45,X granulosa cells // Hum. Reprod. 2019. V. 34. № 9. P. 1686–1696. https://doi.org/10.1093/humrep/dez135
Reddy K.S., Sulcova V. Pathogenetics of 45,X/46,XY gonadal mosaicism // Cytogenet. Cell Genet. 1998. V. 82. № 1–2. P. 52–57. https://doi.org/10.1159/000015064
Nomura R., Miyai K., Okada M. et al. A 45,X/46,XY DSD (Disorder of Sexual Development) case with an extremely uneven distribution of 46,XY cells between lymphocytes and gonads // Clin. Pediatr. Endocrinol. 2015. V. 24. № 1. P. 11–14. https://doi.org/10.1297/cpe.24.11
Graff A., Donadille B., Morel H. et al. Added value of buccal cell FISH analysis in the diagnosis and management of Turner syndrome // Hum. Reprod. 2020. V. 35. № 10. P. 2391–2398. https://doi.org/10.1093/humrep/deaa197
Baer T.G., Freeman C.E., Cujar C. et al. Prevalence and physical distribution of SRY in the gonads of a woman with Turner syndrome: Phenotypic presentation, tubal formation, and malignancy risk // Horm. Res. Paediatr. 2017. V. 88. № 3–4. P. 291–297. https://doi.org/10.1159/000477240
Machiela M.J., Zhou W., Karlins E. et al. Female chromosome X mosaicism is age-related and preferentially affects the inactivated X chromosome // Nat. Communications. 2016. № 7. P. 11843. https://doi.org/10.1038/ncomms11843
Pan L., Su Z., Song J. et al. Growth data and tumour risk of 32 Chinese children and adolescents with 45,X/46,XY mosaicism // BMC Pediatrics. 2019. V. 19. № 1. P. 143. https://doi.org/10.1186/s12887-019-1520-9
Черных В.Б., Яманди Т.А., Сафина Н.Ю. Новые молекулярные технологии в диагностике генетических причин мужского бесплодия // Андрология и генитальная хирургия. 2017. Т. 18. № 1. С. 10–22. https://doi.org/10.17650/2070-9781-2017-18-1-10-22
Дополнительные материалы отсутствуют.


