Генетика, 2021, T. 57, № 2, стр. 229-240
Математическое моделирование отбора по ограниченному полом признаку: к вопросу о существовании полиморфизма по размеру помета в естественных популяциях песцов
О. Л. Жданова 1, *, Е. Я. Фрисман 2, **
1 Институт автоматики и процессов управления Дальневосточного отделения
Российской академии наук
690041 Владивосток, Россия
2 Институт комплексного анализа региональных проблем Дальневосточного отделения
Российской академии наук
679016 Биробиджан, Россия
* E-mail: axanka@iacp.dvo.ru
** E-mail: frisman@mail.ru
Поступила в редакцию 10.04.2020
После доработки 08.06.2020
Принята к публикации 25.08.2020
Аннотация
Предложена модель отбора по признаку, ограниченному полом и проявляющемуся у особей женской части популяции. Модель модифицирована для описания отбора по такому признаку в экологически лимитированной популяции с возрастной структурой. Результаты моделирования направлены на объяснение существующего генетического разнообразия по размеру помета в различных (естественных и искусственных) популяциях песцов (Alopex lagopus). Модель предполагает, что поддержание полиморфизма по размеру помета связано с наличием периодических изменений в обеспеченности естественных популяций песцов кормом и существенно зависит от параметра, описывающего относительное преимущество в выживаемости особей из малых пометов при бескормице. В работе показано, что отбор по ограниченному полом признаку обеспечивает поддержание полиморфизма по размеру помета в более широком диапазоне значений данного параметра, чем отбор по не ограниченному полом признаку, описываемый классической моделью отбора для случая, когда выживаемость и плодовитость особи определяются только ее собственным генотипом вне зависимости от пола. Известно, что наличие возрастной или стадийной структуры в популяции значительно увеличивает шансы сохранения генетического разнообразия в нестационарной среде. Расширение предложенной модели отбора на популяцию с двумя стадиями развития позволило показать, что полиморфизм по размеру помета возможен в еще более широких границах значений рассматриваемого параметра.
Эколого-генетическое направление математической биологии, рассматривающее взаимосвязанные изменения численности и генетической структуры популяции появилось в 60-е годы прошлого столетия, когда формировались представления о плотностно- и частотно-зависимых составляющих в действии естественного отбора [1–4]. Работы в этой области позволили охарактеризовать действие эволюционных факторов, в первую очередь естественного отбора, на динамику генетической структуры и численности популяций, которые сталкиваются с естественным ограничением экологических ресурсов (т.е. находящихся под действием лимитирующих факторов окружающей среды) [5, 6]. Эколого-генетический подход открывает большие перспективы для изучения эволюции естественных популяций, а также для прогнозирования изменений, связанных с антропогенным воздействием [7–9]. При этом возникают серьезные сложности, связанные с верификацией исследуемых моделей, так как для оценки используемых экологических и генетических параметров необходимы данные эколого-генетического мониторинга на длительном временном промежутке. Получить такие данные удовлетворительного объема и содержания довольно сложно. Тем не менее выявление в реальных популяциях даже качественных закономерностей эволюции и динамики, аналогичных описываемым рассматриваемыми моделями, является необходимым шагом на пути становления объединенной эколого-генетической теории. Возможно, отсутствие или грубость оценок, полученных на реальных популяциях, обусловили ряд неудачных попыток (например, [10]) экспериментально подтвердить гипотезу о связи популяционных циклов с действием естественного отбора по отдельному генному локусу, что привело к укоренению представлений о полигенных эффектах в теории эволюции жизненного цикла [11–13]. Однако работа Аксенович с соавт. [14], выполненная на реальных данных о размере помета у песцов (Alopex lagopus), позволила вновь вернуться к однолокусной модели, что в корне меняет устоявшуюся парадигму жизненного цикла (Life History paradigm) [15].
Естественные популяции песца, населяющие прибрежные и континентальные территории, радикально различаются по своей репродуктивной стратегии. Прибрежные песцы питаются морскими птицами, рыбой, тюленями и морскими беспозвоночными [16]. Из года в год наблюдаются лишь очень небольшие колебания доступности этих ресурсов. Каждый год прибрежные песцы производят приплод небольшого размера [17]. Континентальные песцы питаются мелкими грызунами, главным образом полевками, численность которых характеризуется циклическими колебаниями [18]. В голодные годы популяции континентальных песцов демонстрируют крайне низкий репродуктивный уровень, а в годы с обильной пищей (когда в популяциях жертвы наблюдается подъем численности) резко увеличивают свою плодовитость [19–21]. Это позволяет предположить, что прибрежные песцы однородны по размеру помета, а континентальные неоднородны и представлены особями с разной потенциальной плодовитостью. В работе [14] на основе комплексного сегрегационного анализа типа наследования размера помета в расширенной генеалогии фермерских песцов было показано, что данный признак является аутосомным женским признаком, а его наследование можно описать в рамках смешанной модели с основным геном и контролем малого размера помета по рецессивному типу.
Применение классических уравнений математической теории популяционной генетики для описания динамики популяции песцов оказывается затруднительным, поскольку генотип потомков определяют оба родителя, а их число и выживаемость в помете – генотип матери. В результате такой ограниченности признака полом нарушаются соотношения Харди–Вайнберга, связывающие частоты аллелей и генотипов в смежных поколениях, что приводит к необходимости вводить в уравнения эволюции частоты генотипов, а не аллелей. Это делает эволюционные уравнения крайне сложными даже в случае однородной популяции без учета ее возрастной структуры [22–24]. Возможности сохранения полиморфизма при таком типе отбора в циклически изменяющихся условиях посвящено немало работ, при этом цикл окружающей среды обычно считается равным двум [25–27], а возрастная структура не рассматривается, т.е. популяция считается однородной.
В настоящей работе мы сначала приведем вывод уравнений динамики частот генотипов в однородной двуполой популяции, находящейся под действием отбора по ограниченному полом признаку, влияющему на приспособленность и проявляющемуся у женской части популяции. Затем адаптируем эту модель для рассматриваемой ситуации, когда происходят периодические изменения в окружающей среде, связанные с динамикой пищевых ресурсов. Будем полагать, что период внешнего цикла равен четырем, причем в течение этого цикла есть только один пик ресурсов и три такта с малым их количеством. Учтем при этом, что наиболее плодовитый доминантный генотип при ограничении пищевых ресурсов оказывается менее приспособленным, чем рецессивный генотип с меньшей плодовитостью.
Далее мы модифицируем предложенную модель и учтем наряду с отбором по признаку “размер помета”, который ограничен полом, еще и возрастную структуру популяции и экологическое лимитирование роста численности [28].
Проанализируем и сравним условия поддержания полиморфизма при циклическом отборе в рамках классической модели отбора, в случае отбора по признаку, ограниченному полом, в однородной популяции и в популяции с возрастной структурой и экологическим лимитированием.
Одной из первых задач математической популяционной генетики стал количественный анализ результата действия отбора по признаку, влияющему на приспособленность особей и контролирующемуся одним аутосомным диаллельным локусом, в менделевской панмиктичной изолированной популяции диплоидных организмов [29, 30]; анализ основан на модели:
(1)
${{p}_{А}}\left( {n + 1} \right) = {{p}_{А}}\left( n \right){{\left( {{{w}_{{AA}}}{{p}_{А}}\left( n \right) + {{w}_{{Aa}}}{{p}_{а}}\left( n \right)} \right)} \mathord{\left/ {\vphantom {{\left( {{{w}_{{AA}}}{{p}_{А}}\left( n \right) + {{w}_{{Aa}}}{{p}_{а}}\left( n \right)} \right)} {{{{\bar {w}}}_{n}}}}} \right. \kern-0em} {{{{\bar {w}}}_{n}}}},$где n – номер поколения; pA(n) – частота аллеля А и pa(n) – частота аллеля а в n-ом поколении; wAA, wAa и waa – приспособленности генотипов АА, Аа и аа соответственно; ${{\bar {w}}_{n}} = {{w}_{{AA}}}p_{{_{A}}}^{2}\left( n \right)$ + $2{{w}_{{Aa}}}{{p}_{A}}\left( n \right){{p}_{a}}\left( n \right) + $ + ${{w}_{{aa}}}p_{a}^{2}\left( n \right)$ – средняя приспособленность популяции в n-ом поколении. При этом под приспособленностью wij генотипа ij (i и j могут принимать значения А или а) обычно понимается среднее число гамет, произведенных на одну родившуюся особь соответствующего генотипа и вошедших в зиготы следующего поколения [31]. Это определение эквивалентно более простому определению приспособленности wij, как произведению средней выживаемости vij особей данного генотипа на среднее число потомков mij, произведенных одной особью этого генотипа. Предполагается, что при стабильных внешних условиях приспособленности генотипов зависят только от самих генотипов и не меняются со временем.
Для объяснения существующего генетического разнообразия по размеру помета в различных (естественных и искусственных) популяциях песцов Аксенович и др. [14] высказали гипотезу, что каждый год самки с генотипами AA и Aa производят большие пометы (в среднем m1 щенков на помет), а самки aa – маленькие (со средним m2). Далее предполагалось, что при дефиците пищевых ресурсов коэффициент выживаемости маленьких пометов, произведенных матерями с генотипом aa, в k раз превосходит таковой в больших пометах, произведенных матерями с генотипами Aа и AA. Было предложено следующее уравнение динамики частоты аллеля а в череде поколений:
Это уравнение оказывается эквивалентно частному случаю модели (1) и может быть получено подстановкой wAA = wAa = m1v и waa = m2vk.
Анализ, выполненный в работе [14] и основанный, в частности, на численных итерациях уравнения (*), показал, что в результате эволюции
1) прибрежные популяции песцов могли утратить аллель А (доминантный, помет большого размера) и оказаться мономорфными по аллеллю а (рецессивный признак, малый размер помета), что является результатом действия отбора против гомо- (AA) и гетерозигот (Aa): wAA = wAa < waa;
2) континентальные популяции могут быть полиморфными из-за циклических изменений в действии отбора, связанных с циклами доступности пищевых ресурсов: в голодные годы отбор действует против особей из больших пометов, так как из-за нехватки корма выживаемость в них в k раз ниже, чем в малых. Каждые 4 года подъем популяции грызунов приводит к обилию пищи песцов и к изменению направления отбора в пользу особей из больших пометов, поскольку при избытке корма выживаемость особей в больших и малых пометах выравнивается (k = 1), но число родившихся в больших пометах естественно больше, чем в малых. При соотношении по числу новорожденных щенков в больших и малых пометах 12 : 8, значения k = 1.7 в годы небольших запасов корма и снижающиеся значения k = 1 раз в 4 года с обилием запасов пищи приводят к установлению сбалансированного полиморфизма с равными частотами аллелей А и a. Однако при более низких значениях величины k в годы небольших запасов корма (k < 1.5) в континентальных популяциях песцов должна происходить фиксация доминантного аллеля. Таким образом, вопрос о существовании полиморфизма по размеру помета в континентальных популяциях песцов остается открытым. В случае фиксации доминантного аллеля можно предположить, что фермерские песцы унаследовали аллели большого и малого размера помета от своих континентальных и прибрежных предков соответственно. Другая, более интересная, гипотеза состоит в том, что они могли унаследовать оба аллеля от континентальных песцов, при условии, что система сбалансированного генетического полиморфизма по размеру помета поддерживалась в естественных популяциях. Хедрик [32] отмечает, что условие установления полиморфизма в модели Аксенович и др. [14] можно получить, используя результаты [33], рассчитав более точные границы разницы выживаемости в голодные годы в больших и малых пометах: 1.666 < k < 1.718, и это является крайне строгим ограничением – около 3% от возможных значений k, ставящим под сомнение справедливость предложенной модели для реальных популяций песцов. Далее Хедрик [32] уточняет, что если отбор идет только по женской линии вероятность существования полиморфизма уменьшается более чем в 4 раза (0.7%); при этом, к сожалению, не приводится модель, на которой основаны данные расчеты.
В настоящей работе мы покажем, что отбор по признаку, ограниченному полом, наоборот увеличивает возможности установления полиморфизма и, следовательно, гипотеза о системе сбалансированного генетического полиморфизма по размеру помета, существующего в естественных популяциях песцов, имеет серьезные основания.
ЕСТЕСТВЕННЫЙ ОТБОР ПО ОГРАНИЧЕННОМУ ПОЛОМ ПРИЗНАКУ, КОНТРОЛИРУЕМОМУ ОДНИМ ДИАЛЛЕЛЬНЫМ ЛОКУСОМ
Отметим, что модель (1) для рассматриваемой ситуации не вполне корректна, так как приспособленность индивидуума (wij) определяется его собственным генотипом (ij), в то время как на самом деле она должна определяться генотипом матери, а именно принадлежностью потомка к большому или малому помету. По-видимому, в данном случае более адекватной будет модель действия отбора по ограниченному полом признаку, влияющему на приспособленность и проявляющемуся у женской части популяции. При построении такой модели естественно сделать следующие основные предположения:
1. Признак аутосомный, т.е. генотип потомка определяют оба родителя.
2. Приспособленность wij определяется генотипом матери и выражается как произведение средней выживаемости vij женских особей с генотипом ij на среднее число потомков mij, произведенных одной женской особью этого генотипа.
3. Считаем, что частоты генов одинаковы в мужской и женской частях популяции, однако на этапе вывода модели необходимо рассматривать процесс размножения с учетом разделения полов, так как важно отследить влияние генотипа матери.
В Приложении 1 получены уравнения динамики частот генотипов в популяции с неперекрывающимися поколениями, находящейся под действием отбора по ограниченному полом признаку, влияющему на приспособленность и проявляющемуся у женской части популяции. Рассматривается диаллельный признак с произвольным доминированием и предполагается, что условия среды не меняются (полное доминирование и циклическое изменение средовых условий введем позже для описания наследования размера помета у песцов). Уравнения динамики имеют вид (Приложение 1):
(2)
$\left\{ \begin{gathered} {{p}_{{AA}}}(n + 1) = \left( {{{w}_{{AA}}}{{p}_{{AA}}}(n) + \frac{1}{2}{{w}_{{Aa}}}{{p}_{{Aa}}}(n)} \right){{\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} \mathord{\left/ {\vphantom {{\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} {W(n)}}} \right. \kern-0em} {W(n)}}, \hfill \\ {{p}_{{Aa}}}(n + 1) = \left\{ {\frac{1}{2}{{w}_{{Aa}}}{{p}_{{Aa}}}(n) + {{w}_{{AA}}}{{p}_{{AA}}}(n)(1 - {{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)) + {{w}_{{aa}}}(1 - {{p}_{{AA}}}(n) - } \right. \hfill \\ - \,\,{{p}_{{Aa}}}(n)){{\left. {\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} \right\}} \mathord{\left/ {\vphantom {{\left. {\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} \right\}} {W(n)}}} \right. \kern-0em} {W(n)}}, \hfill \\ \end{gathered} \right.$где pAA(n), pAa(n) и pаа – частоты соответствующих генотипов в n-ом поколении, wij – приспособленность генотипа ij женской части популяции, произведение средней выживаемости vij женских особей с генотипом ij на среднее число потомков mij, произведенных одной женской особью этого генотипа,
Типы отбора и особенности динамики модели (2)
Прежде чем перейти к анализу возможных режимов динамики частот аллелей генов, влияющих на размер помета у песцов, имеет смысл проанализировать, какое вообще разнообразие режимов динамики может порождать модель (2). Естественно сравнить эти режимы с хорошо известными и подробно описанными (например, в [31]) режимами классической модели, основанной на уравнении (1). Исследование, включающее приведенный в Приложении 1 анализ условий существования и устойчивости стационарных точек системы (2), позволяет заключить, что для модели (2) можно выделить те же динамические режимы – типы отбора, как и в классическом случае. Так, при повышенной приспособленности гетерозигот (waa < wAa и wAA < wAa; рис. 1,а) происходит установление стабильного (сбалансированного) полиморфизма; при пониженной приспособленности гетерозигот наблюдается бистабильность, когда любое из двух мономорфных равновесий может быть достигнуто в зависимости от начальных условий (рис. 1,б); при промежуточном доминировании осуществляется направленный отбор и происходит вытеснение неоптимального аллеля (рис. 1,в). При этом динамика модели (2) (рис. 1, кружки) отличается от динамики модели классического отбора (1) (рис. 1, линии): отбор идет медленнее. По-видимому, это связано с нарушением соотношения Харди–Вайнберга, которое представляет собой избыток гетерозигот, наблюдаемый в процессе движения к равновесию (рис. 2).
Рис. 1.
Динамика частоты аллеля A (pA) в череде поколений n при различных типах отбора, линии соответствуют модели (1), кружки – модели (2); разными цветами обозначена динамика при различных значениях частоты аллеля А в начальный момент времени. а – установление полиморфизма при повышенной приспособленности гетерозигот: waa = 1.3, wAa = 1.5, wAA = 1.2; б – дизруптивный отбор: waa = 1.45, wAa = 1.2, wAA = 1.5; в – вытеснение неоптимального аллеля при промежуточном доминировании: waa =1.15, wAa = 1.2, wAA = 1.5.
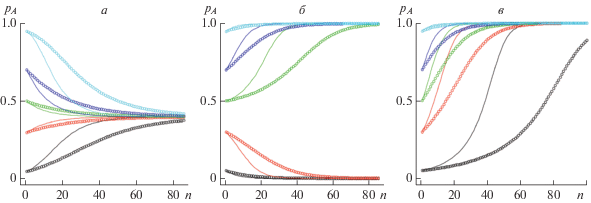
Рис. 2.
Динамика частот генотипов pAА и pAa (ось слева) и их отклонений от равновесия Харди–Вайнберга (HW_dev(pAA) и HW_dev(pAa), ось справа) в череде поколений n при различных типах отбора (значения приспособленностей фрагментов рисунка соответствуют рис. 1). Начальные условия: слева – равновесие ХВ: pAА(0) = 0.01, pAa(0) = = 0.18, справа – нарушение равновесия ХВ: pAА(0) = 0.8, pAa(0) = 0.0.
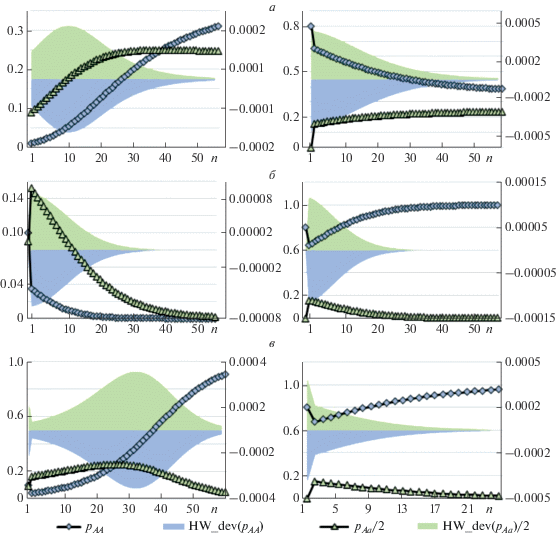
На рис. 2 представлены примеры динамики частот генотипов (pAA и pAa) для разных типов отбора, также приведена динамика величин отклонения от равновесия Харди–Вайнберга, которые вычислялись следующим образом: HW_dev(pAA) = = pAA – $p_{A}^{2}$, HW_dev(pAa)/2 = (pAa – 2pA(1 – pA))/2. Можно видеть, что отклонение от равновесия Харди–Вайнберга всегда присутствует в процессе перехода к равновесию и представляет собой избыток гетерозигот (HW_dev(pAa) > 0), вне зависимости от начальных условий; на графиках слева начальные условия соответствуют равновесию Харди–Вайнберга, а справа – нет. По мере приближения к стационарной точке величина отклонения уменьшается и устанавливается равновесие Харди–Вайнберга.
Проведенное исследование показало, что действие отбора по признаку, ограниченному полом и проявляющемуся у женской части популяции, при стабильных внешних условиях фактически тождественно по конечным результатам отбору, описываемому классической моделью (1), однако существенно отличается по времени и характеру траектории перехода к положению равновесия. Это позволяет предполагать, что в переменных внешних условиях можно ожидать принципиально больших различий.
Вернемся к обсуждению наследования большого и малого размера помета у песцов. Учитывая полное доминирование, здесь можно выписать следующее соотношение приспособленностей генотипов: wAA = wAa < waa для прибрежных популяций, где в условиях постоянного ограничения пищевых ресурсов выживаемость в малых пометах выше, чем в больших, настолько, что к концу молочного вскармливания там оказывается больше живых щенков, чем в изначально больших пометах. Это соответствует направленному отбору, в результате которого происходит вытеснение аллеля А. С другой стороны, в фермерских популяциях, где пищи достаточно, соотношение приспособленностей меняется на обратное wAA = wAa > waa и происходит уже вытеснение рецессивного аллеля а, контролирующего малый размер помета. Полиморфизм при постоянных приспособленностях в рамках данной модели (т.е. модели (2) при постоянных приспособленностях и полном доминировании) получить нельзя, для этого нужно учесть цикличность условий окружающей среды, которые приводят к циклическим изменениям соотношения приспособленностей.
Циклический отбор по размеру помета у песцов
В условиях изменяющихся пищевых ресурсов, характерных для континентальных популяций песцов, должны изменяться и приспособленности генотипов. Повторим моделирование, позволившее получить сбалансированный полиморфизм по рассматриваемому гену [14], при этом будем использовать уточненную модель (2), учитывающую, что проявление данного признака ограничено полом, и учтем циклическое изменение условий среды, заключающееся в значительном сезонном увеличении запасов пищи каждые 4 года.
Поскольку было оценено, что в среднем самки генотипов АА и Аа производят 12 детенышей каждый год (mAA = mAa = 12), а самки аа – восемь (maa = = 8), репродуктивная способность самок с генотипами АА и Аа в 1.5 раза выше, чем у самок aa. При этом нет данных о том, что выживаемость самок связана с размерами помета или как-то зависит от обилия корма, поэтому выживаемость самок естественно считать постоянной vAA = vAa = vaa = v. Вместе с тем выживаемость детенышей не зависит от величины помета, в котором они появились (и соответственно от генотипа матери), только в годы с обильной пищей, а в голодные годы – в маленьких пометах выживаемость детенышей выше, чем в больших. Поскольку речь идет именно о пометах при вскармливании, это можно учесть в рамках модели (2), полагая, что в голодные годы фертильность многоплодных особей (mAA и mAa) в k раз меньше, чем в годы с обильной пищей, где k – соотношение выживаемости приплода из больших пометов в “тучные” и голодные годы.
Итак, будем основываться на модели (2), но полагать приспособленности периодически меняющимися величинами. Каждые 4 года мелкие грызуны демонстрируют всплеск численности [34, 35] и наиболее плодовитые генотипы песца (АА и Aa) в эти годы имеют наибольший адаптивный успех, поэтому в каждый 4-й год:
в остальные годы:
где v – выживаемость самок песцов после переживания в помете. Заметим, что для достижения полиморфизма величина коэффициента k должна быть больше 1.5, поскольку живых щенков в малых пометах в голодные годы должно быть больше, чем в больших, иначе произойдет вытеснение аллеля а. Вместе с тем точные оценки абсолютных значений величин приспособленностей не столь важны. Характер динамики определяется их относительными значениями. Так, можно положить waa = 1, а wAA = wAa = 1.5 в годы с обильной пищей и wAA = wAa = 1.5/k в голодные годы, или waa = 1.4 а wAA = wAa = 2.1 в годы с обильной пищей и wAA = wAa = 2.1/k в голодные годы.
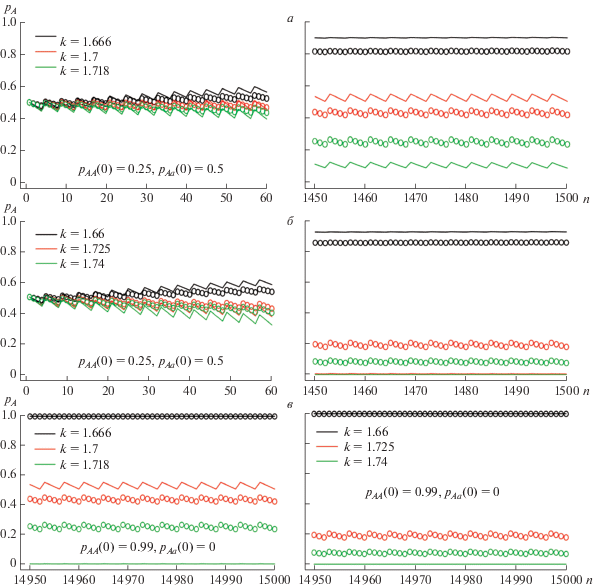
Результаты моделирования с такими периодически меняющимися приспособленностями представлены на рис. 3. Как и в случае отбора с постоянными приспособленностями, видно замедление отбора по признаку, ограниченному полом (кружки), по сравнению с простым отбором, описываемым уравнением (1), но при таких же периодически меняющихся значениях приспособленностей генотипов, как и в модели (2) (линии). На рис. 3,а приведена динамика для значений k, из интервала рассчитанного [31] 1.666 < k < 1.718, где полиморфизм возможен в рамках модели простого отбора. Из рис. 3,б можно видеть, что если учитывать тип данного признака (ограниченность полом), то поддержание полиморфизма оказывается возможным в более широком диапазоне значений k. В частности, при k = 1.725 и даже 1.74 отчетливо видно сохранение полиморфизма после 1500 поколений динамики модели (2) с указанными периодическими значениями приспособленностей, в то время как модель (1) при этих же периодических изменениях приспособленностей демонстрирует полную утрату аллеля A. На рис. 3,а, б начальные условия выбраны так, что оба аллеля имеют одинаковую частоту (pA = pa = 0.5). Если предполагать, что аллель a появился в результате мутации, то на начальном этапе он присутствовал в очень небольшой дозе; на рис. 3,в приведена динамика при других начальных условиях (pA = 0.99, pa = 0.01); здесь понадобилось значительно большее количество расчетных поколений, чтобы увидеть эффект отбора. Естественно, что потеря аллеля a здесь более вероятна при небольшом преимуществе в выживаемости малых пометов (при k = 1.666, 1.66); при больших значениях k полиморфизм сохраняется в модели (2); в модели (1) при тех же периодических изменениях величин приспособленностей происходит вытеснение аллеля А уже при k = 1.718, что связано не с изменением начального значения, а с увеличением количества поколений расчета.
Рис. 3.
Динамика частоты аллеля A (pA) в череде поколений n при различных значениях k. Значения параметров: waa = = 1.4, wAa = wAA = 2.1. а, б – слева приведена динамика на начальном этапе 0–60-е поколение, справа – с 1450 по 1500, при начальных значениях pAА(0) = 0.25, pAa(0) = 0.5; в – динамика после 14 950 поколений, при начальных значениях pAА(0) = 0.99, pAa(0) = 0.0.
ЕСТЕСТВЕННЫЙ ОТБОР ПО ОГРАНИЧЕННОМУ ПОЛОМ ПРИЗНАКУ В ЛИМИТИРОВАННОЙ ПОПУЛЯЦИИ С ВОЗРАСТНОЙ СТРУКТУРОЙ
Следующий фактор, который не был учтен при моделировании, – это возрастная подразделенность у песца. Известно, что наличие возрастной или стадийной структуры в популяции значительно увеличивает шансы сохранения генетического разнообразия в нестационарной среде [36]. Далее мы откажемся от предположения о неперекрывающихся поколениях и перейдем к обсуждению действия отбора в структурированной популяции.
В моделях динамики (1), (2) рассматривается лишь изменение генетической структуры популяции в предположении, что различные ее поколения не перекрываются. Однако это предположение несправедливо, если продолжительность жизни каждого поколения оказывается существенно больше времени, протекающего между сезонами размножения. В этом случае каждая локальная популяция во время размножения состоит из особей, принадлежащих к разным возрастным группам, и численности каждой выделяемой возрастной группы естественно рассматривать в качестве переменных модели.
Рассмотрим модель популяции с возрастной структурой, которая может быть представлена совокупностью двух возрастных классов: младшего, включающего неполовозрелых особей, и старшего, состоящего из особей, участвующих в размножении.
Обозначим через Xn – численность младшего возрастного класса в n-ый сезон размножения, а Yn – численность репродуктивной части популяции. Период размножения заканчивается появлением новорожденных особей следующего поколения. Будем предполагать, что времени, протекающего между двумя последовательными периодами размножения, достаточно для развития особей младшего возраста до половозрелого состояния, а новорожденных до состояния младшего возраста. Допустим, что выживаемость и воспроизводительная способность половозрелых особей не зависят от возраста.
Лимитирование численности младшего возрастного класса осуществляется путем уменьшения выживаемости приплода с ростом его численности, которое происходит по линейному закону: f(X) = 1 – X/K, как в модели Ферхюльста. Здесь K – это емкость экологической ниши, или максимально возможная численность младшего возрастного класса. В этом случае естественно перейти к относительным значениям численностей: x = X/K, y = Y/K. Тогда уравнения, описывающие динамику относительных численностей рассматриваемых возрастных групп в череде поколений, будут следующими:
(3)
$\left\{ \begin{gathered} {{x}_{{n + 1}}} = w{{y}_{n}} \hfill \\ {{y}_{{n + 1}}} = {{x}_{n}}(1 - {{x}_{n}}) + c{{y}_{n}}, \hfill \\ \end{gathered} \right.$где w – это репродуктивный потенциал старшего возрастного класса, с – его выживаемость.
В случае, когда репродуктивный потенциал (w) связан с признаком, который ограничен полом, зависит от генотипа матери и определяется генетически одним адаптивным диаллельным геном, динамику численности и генетического состава двухвозрастной популяции можно описать следующей системой уравнений [Приложение 2]:
(4)
$\left\{ {\begin{array}{*{20}{l}} \begin{gathered} x(n + 1) = y(n)w(n), \hfill \\ y(n + 1) = (1 - x(n))x(n) + cy(n), \hfill \\ {{q}_{{AA}}}(n + 1) = \left( {{{w}_{{AA}}}{{p}_{{AA}}}(n) + \frac{1}{2}{{w}_{{Aa}}}{{p}_{{Aa}}}(n)} \right) \times \hfill \\ \times \,\,{{\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} \mathord{\left/ {\vphantom {{\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} {w(n)}}} \right. \kern-0em} {w(n)}}, \hfill \\ \end{gathered} \\ \begin{gathered} {{q}_{{Aa}}}(n + 1) = \left\{ {\frac{1}{2}{{w}_{{Aa}}}{{p}_{{Aa}}}(n) + {{w}_{{AA}}}{{p}_{{AA}}}(n) \times } \right. \hfill \\ \times \,\,\left( {1 - {{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right) + {{w}_{{aa}}}(1 - {{p}_{{AA}}}(n) - \hfill \\ {{\left. { - \,\,{{p}_{{Aa}}}(n))\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} \right\}} \mathord{\left/ {\vphantom {{\left. { - \,\,{{p}_{{Aa}}}(n))\left( {{{p}_{{AA}}}(n) + \frac{1}{2}{{p}_{{Aa}}}(n)} \right)} \right\}} {w(n)}}} \right. \kern-0em} {w(n)}}, \hfill \\ {{p}_{{AA}}}(n + 1) = \{ {{q}_{{AA}}}(n)(1 - x(n))x(n) + \hfill \\ {{ + \,\,{{p}_{{AA}}}(n)cy(n)\} } \mathord{\left/ {\vphantom {{ + \,\,{{p}_{{AA}}}(n)cy(n)\} } {\{ (1 - x(n))x(n) + cy(n)\} }}} \right. \kern-0em} {\{ (1 - x(n))x(n) + cy(n)\} }}, \hfill \\ {{p}_{{Aa}}}(n + 1) = \{ {{q}_{{Aa}}}(n)(1 - x(n))x(n) + \hfill \\ {{ + \,\,{{p}_{{Aa}}}(n)cy(n)\} } \mathord{\left/ {\vphantom {{ + \,\,{{p}_{{Aa}}}(n)cy(n)\} } {\{ (1 - x(n))x(n) + cy(n)\} }}} \right. \kern-0em} {\{ (1 - x(n))x(n) + cy(n)\} }}, \hfill \\ \end{gathered} \end{array}} \right.$где pij – это частоты генотипов ij в половозрелой части популяции, qij – в неполовозрелой (i и j = А и а); w(n) = wAApAA(n) + wAapAa(n) + wаа(1 – pAA(n) – – pAa(n)) – средняя приспособленность потомства на первом году жизни.
Жизненный цикл песца в большей степени соответствует модели двухвозрастной популяции, поскольку продолжительность жизни половозрелых особей составляет несколько лет, а детеныши, как правило, вступают в процесс размножения на втором году жизни.
Традиционное аналитическое исследование системы (4), аналогичное исследованию системы (2), приведенному в Приложении 1, показывает, что модель (4) имеет три генетически различных равновесия: два мономорфных и одно полиморфное, совпадающие с равновесиями модели (2). Причем равновесные частоты генотипов в обеих возрастных группах совпадают: pij = qij. Cтационарные значения численности возрастных классов определяются как: x = (w + c – 1)/w, y = (w + c – 1)/w2. При этом направление отбора определяет взаимное расположение приспособленностей генотипов, а величина (w + c) определяет динамику численности. Здесь мы опустим подробное обсуждение возможной динамики модели (4) и перейдем к моделированию расхождения репродуктивных стратегий в естественных популяциях песцов.
Моделирование дифференциации репродуктивных стратегий у прибрежных и континентальных песцов с помощью модели отбора в двухвозрастной популяции
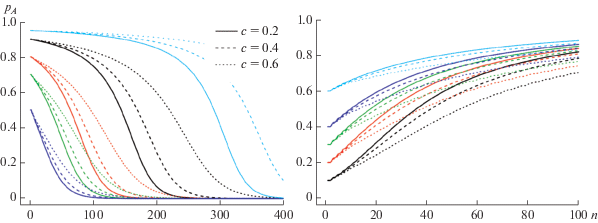
Как и в предыдущей модели для прибрежных популяций, естественный отбор направлен против аллеля А {waa > wAA, wAA = wAa} и популяция становится мономорфной (рис. 4, слева). Скорость вытеснения аллеля A зависит от величин wij, c и начальной частоты аллеля A. Таким образом, полученные результаты согласуются с наблюдаемой в настоящее время ситуацией, когда прибрежные песцы производят пометы небольшого размера, т.е. их популяция мономорфна по рассматриваемому гену. На рис. 4 справа изображена ситуация, характерная для фермерских популяций, где пищевых ресурсов достаточно и происходит вытеснение аллеля а.
Рис. 4.
Динамика частоты аллеля A (pA) в череде поколений n при различных значениях параметра с. Кривые разных цветов соответствуют различным начальным условиям. Слева – вытеснение аллеля А, waa = 2, wAa = 1.5, wAA = 1.5; справа – вытеснение аллеля а, waa = 1.4, wAa = 2.1, wAA = 2.1.
Далее будем моделировать динамику континентальных популяций, учитывая циклы кормовой базы тем же способом, что и в однородной модели (рис. 3), при этом динамика зависит от дополнительного параметра c – выживаемости половозрелых особей. Результаты моделирования представлены на рис. 5. Присутствие половозрелых особей, которые участвуют в размножении неоднократно, значительно меняет картину, полиморфизм может сохраняться в более широком диапазоне значений k, чем в однородной популяции. При этом отбор идет медленнее, после 1500 поколений (рис. 5, слева внизу) полиморфизм существует при всех заданных значениях параметров: k от 1.55 до 1.8 и с от 0.2 до 0.5. Дальнейшие расчеты показывают, что ситуация еще меняется, происходит медленное вытеснение неоптимальных аллелей: аллеля а при небольшом преимуществе в выживаемости малых пометов (k = 1.55 и 1.6) и аллеля А при очень большом (k = 1.8). При этом выживаемость половозрелой группы (c) по-разному влияет на результат отбора. Большие значения с предотвращают утрату аллеля малого помета (а) при небольшом его преимуществе по выживаемости (рис. 5, k = 1.6, c = 0.5), а малые значения с, наоборот, препятствуют установлению мономорфизма и потере аллеля А в случае большого преимущества по выживаемости малых пометов (рис. 5, k = 1.8, c = 0.2).
Рис. 5.
Динамика частоты аллеля A (pA) в череде поколений n при различных значениях k и с. Значения параметров: waa = 1.4, wAa = wAA = 2.1. Слева вверху приведена динамика на начальном этапе 0–60-е поколение, на других фрагментах – после нескольких сотен (тысяч) поколений, при начальных значениях pAА(0) = 0.25, pAa(0) = 0.5.
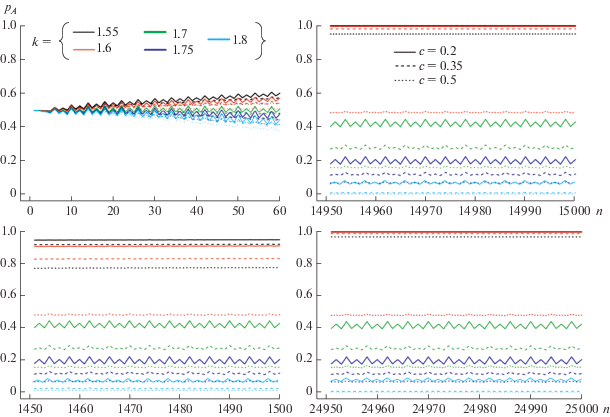
Рассмотренные нами модели не учитывают возможного обмена генами между континентальными и прибрежными популяциями, который, по-видимому, существует. В частности, недавно был зафиксирован случай миграции самки песца из прибрежного в континентальный район со сменой пищевого рациона (от разнообразной морской пищи к леммингам) [37]. Полагая, что такой генетический обмен происходит регулярно и в обе стороны, можно предположить, что прибывающий с мигрантами аллель А довольно быстро элиминируется из генофонда прибрежных популяций, так как направленный отбор там более быстрый (рис. 4, слева); в то время как даже небольшое пополнение континентальных популяций песцов особями с генотипом аа способствует поддержанию полиморфизма даже при небольшом преимуществе по выживаемости в малых пометах.
ЗАКЛЮЧЕНИЕ
Математическая теория естественного отбора по признакам, сцепленным с полом, хорошо разработана [31, 38, 39]; однако известны и другие типы признаков, обусловленных генами, расположенными в аутосомах, но проявляющихся по-разному в зависимости от пола [40, 41]. В частности, развитие признаков, ограниченных полом, обусловлено генами, расположенными в аутосомах обоих полов, но проявляются они только у одного пола. К данным признакам относится продуктивность животных, например молочность и жирность молока у крупного рогатого скота, яйценоскость и размер яиц у кур, а также размер помета у многоплодных животных.
Понимание результатов действия отбора по таким признакам весьма важно. Однако применение классических уравнений математической теории популяционной генетики здесь ограничено тем фактом, что генотип потомков определяют оба родителя, а их выживаемость – генотип матери. В результате нарушаются соотношения Харди–Вайнберга, связывающие частоты аллелей и генотипов в смежных поколениях, что приводит к необходимости писать уравнения эволюции для частот генотипов, а не аллелей, как в классической теории отбора, и делает эволюционные уравнения крайне сложными даже в случае однородной популяции без учета ее возрастной структуры [22–24]. Возможности сохранения полиморфизма при таком типе отбора в циклически изменяющихся условиях посвящено немало работ, при этом цикл окружающей среды обычно считается равным 2 [25–27].
В настоящей работе предложена модель отбора по материнской линии признака “размер помета”, ограниченного полом, в экологически лимитированной популяции с возрастной структурой для объяснения существующего генетического разнообразия по размеру помета в различных (естественных и искусственных) популяциях песцов. Проанализирована возможность поддержания полиморфизма в рамках классической теории и в случае отбора по материнской линии.
На данный момент вопрос о существовании полиморфизма по размеру помета в континентальных популяциях песцов остается открытым, так как возможно и другое объяснение наличия аллелей большого и малого размера помета у фермерских песцов. В частности, могла произойти фиксация доминантного аллеля в континентальных популяциях, и тогда фермерские песцы унаследовали разные аллели от своих континентальных и прибрежных предков. Более интересная гипотеза состоит в том, что они унаследовали оба аллеля от континентальных песцов, при условии, что система сбалансированного генетического полиморфизма по размеру помета поддерживалась в естественных популяциях. Однако условие установления полиморфизма, которое дает классическая модель отбора, является крайне строгим ограничением по диапазону параметра k, характеризующего преимущество в выживаемости малых пометов в голодные годы.
Моделирование, проведенное в данной работе, учитывающее характер наследования данного признака, а именно его ограниченность полом, позволяет расширить диапазон значений k, обеспечивающих поддержание полиморфизма. Кроме того, известно, что наличие возрастной или стадийной структуры в популяции значительно увеличивает шансы сохранения генетического разнообразия в нестационарной среде [36]. Обобщение модели отбора на популяцию с двумя стадиями развития позволило увидеть, что полиморфизм возможен в еще более широких границах значений рассматриваемого параметра. Кроме того, поддержанию полиморфизма в континентальных популяциях песцов должен способствовать приток генов из прибрежных популяций за счет миграций. Таким образом, проведенное исследование показало, что отбор по ограниченному полом признаку и наличие возрастной структуры увеличивают возможность сохранения полиморфизма в популяции континентальных песцов.
Работа выполнена в рамках государственных заданий Института автоматики и процессов управления ДВО РАН, Института комплексного анализа региональных проблем ДВО РАН, а также при частичной финансовой поддержке РФФИ (проект 18-04-00073).
Список литературы
MacArthur R.H., Wilson E.O. The Theory of Island Biogeography. Princeton; N.J.: Princeton Univ. Press, 1967. 203 p.
Charlesworth B. Selection in density-regulated populations // Ecology. 1971. V. 52. P. 469−474.
Rougharden J. Density dependent natural selection // Ecology. 1971. V. 52. P. 453−468.
Pianka E.R. Evolutionary Ecology. N.Y.: Harper and Row, 1978, 2nd ed. 397 p.
Hanski I. Metapopulation Ecology. Oxford Univ. Press, 1999.
Жданова О.Л., Колбина Е.А., Фрисман Е.Я. Проблемы регулярного поведения и детерминированного хаоса в математической модели эволюции менделевской лимитированной популяции // Дальневост. математический журн. 2003. Т. 4. № 2. С. 289–303.
Фрисман Е.Я., Жданова О.Л., Колбина Е.А. Влияние промысла на генетическое разнообразие и характер динамического поведения менделевской лимитированной популяции // Генетика. 2010. Т. 46. № 2. С. 272–281.
Жданова О.Л., Фрисман Е.Я. Влияние оптимального промысла на характер динамики численности и генетического состава двухвозрастной популяции // Изв. РАН. Серия биол. 2013. № 6. С. 738–749.
Жданова О.Л., Фрисман Е.Я. Модельный анализ последствий оптимального промысла для эволюции двухвозрастной популяции // Информатика и системы управления. 2014. Т. 40. № 2. С. 12–21.
Boonstra R., Boag P.T. A test of the Chitty hypothesis: inheritance of life-history traits in meadow voles Microtus pennsylvanicus // Evolution. 1987. V. 41. № 5. P. 929–947.
Stearns S.C. The Evolution of Life Histories. Oxford: Oxford Univ. Press, 1992. 249 p.
Mousseau T.A., Sinervo B., Endler J. Adaptive Genetic Variation in the Wild. N.Y.: Oxford Univ. Press, 2000. 265 p.
Roff D.A. Life History Evolution. Sunderland, MA, USA: Sinauer Associates Inc., 2002. 365 p.
Axenovich T.I., Zorkoltseva I.V., Akberdin I.R. et al. Inheritance of litter size at birth in farmed arctic foxes (Alopex lagopus, Canidae, Carnivora) // Heredity. 2007. V. 98. P. 99–105.
Nespolo R.F. A simple adaption to cycling selection: A complex population dynamic explained by a single-locus Mendelian model for litter size // Heredity. 2007. V. 98. P. 63–64.
Володин И.А., Калашникова М.В., Клинкова Е.С. и др. Структура поселения песца Alopex lagopus beringensis на северной оконечности острова Беринга // Зоол. журн. 2012. Т. 91. № 10. С. 1231–1243.
Hersteinsson P., Macdonald D.W. Diet of Arctic foxes (Alopex lagopus) in Iceland // J. Zool. 1996. V. 240. P. 457–474.
Angerbjörn A., Tannerfeldt M., Erlinge S. Predator-prey relationships: Arctic foxes and lemmings // J. Anim. Ecol. 1999. V. 68. P. 34–49.
Tannerfeldt M., Angerbjörn A. Fluctuating resources and the evolution of litter size in the arctic fox // Oikos. 1998. V. 83. P. 545–559.
Tannerfeldt M., Angerbjörn A. Life history strategies in a fluctuating environment: establishment and reproductive success in the arctic fox // Ecography. 1998. V. 19. P. 209–220.
Elmhagen B., Tannerfeldt M., Verucci P., Angerbjörn A. The arctic fox (Alopex lagopus) – an opportunistic specialist // J. Zool. 2000. V. 251. P. 139–149.
Wright S. Evolution and the Genetics of Populations: V. 2. The Theory of Gene Frequencies. Chicago, 1969. 512 p.
Nagylaki T. Introduction to Theoretical Population Genetics. Berlin: Springer-Verlag, 1992. 369 p.
Gavrilets S. One-locus two-allele models with maternal (parental) selection // Genetics. 1998. V. 149. № 2. P. 1147–1152.
Reinhold K. Evolutionary genetics of sex-limited traits under fluctuating selection // J. Evolutionary Biol. 1999. V. 12. № 5. P. 897–902.
Reinhold K. Maintenance of a genetic polymorphism by fluctuating selection on sex-limited traits // J. Evolutionary Biol. 2000. V. 13. № 6. P. 1009–1014.
Yamamichi M., Hoso M. Roles of maternal effects in maintaining genetic variation: Maternal storage effect // Evolution. 2017. V. 71. № 2. P. 449–457.
Жданова О.Л., Фрисман Е.Я. Математическое моделирование механизма дифференциации репродуктивных стратегий в естественных популяциях (на примере песцов, Alopex lagopus) // Компьют. исследования и моделирование. 2016. Т. 8. № 2. С. 213−228.
Haldane J.B.S. A mathematical theory of natural and artificial selection. Part 1 // Trans. Cambr. Philos. Soc. 1924. V. 23. P. 19−41.
Fischer R.A. The Genetical Theory of Natural Selection. Oxford: Clarendon Press, 1930. 360 p.
Ратнер В.А. Математическая популяционная генетика: (Элементарный курс). Сиб. отд-ние: Наука, 1977. 127 с.
Hedrick P.W. Cyclic fitness variation and polymorphism: Cycling selection for litter size in arctic foxes // Heredity. 2007. V. 98. P. 339. https://doi.org/10.1038/sj.hdy.6800980
Haldane J.B.S., Jayakar S.D. Polymorphism due to selection of varying direction // J. Genetics. 1963. V. 58. № 2. P. 237–242.
Frafjord K. Reproductive effort in the arctic fox Alopex lagopus: a review // Norw. J. Agric. Sci. 1993. V. 7. P. 301–309.
Kaikusalo A., Angerbjörn A. The arctic fox population in Finnish Lapland during 30 years, 1964–93 // Ann. Zool. Fenn. 1995. V. 32. P. 69–77.
Ellner S. Environmental fluctuations and the maintenance of genetic diversity in age or stage-structured populations // Bull. Mathematical Biol. 1996. V. 58. № 1. P. 103–127.
Fuglei E., Tarroux A. Arctic fox dispersal from Svalbard to Canada: one female’s long run across sea ice // Polar Research. 2019. V. 38. P. 3512. https://doi.org/10.33265/polar.v38.35127
Li C.C. First Course in Population Genetics. Pacific Grove, California: Boxwood Press, 1976. 631 p.
Hedrick P.W. Genetics of Populations, 2nd edn. Sudbury, MA: Jones and Bartlett, 2000. 553 p.
Лобашев М.Е. Генетика. 2-е изд. Л.: Изд-во Ленингр. ун-та, 1967. 752 с.
Falconer D.S. Introduction to Quantitative Genetics, 3rd edn. N.Y.: John Wiley and Sons, 1989. 438 p.
Дополнительные материалы отсутствуют.


