Генетика, 2022, T. 58, № 1, стр. 5-26
Эпигенетические механизмы регуляции экспрессии генов у бактерий рода Bacillus
Н. Г. Васильченко 1, *, Е. В. Празднова 1, Е. И. Левитин 2
1 Южный федеральный университет, Академия биологии и биотехнологии
им. Д.И. Ивановского
344058 Ростов-на-Дону, Россия
2 Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра “Курчатовский институт”
117545 Москва, Россия
* E-mail: nvasilchenko@sfedu.ru
Поступила в редакцию 28.08.2020
После доработки 28.06.2021
Принята к публикации 08.07.2021
- EDN: QZUBPX
- DOI: 10.31857/S001667582201012X
Аннотация
Бурное развитие молекулярно-генетических технологий позволило детально проанализировать явления, которые можно отнести к эпигенетическим – фенотипические переключения в культурах бактериальных клеток. Изменения фенотипа на фоне неизменного генома могут быть временной реакцией на внешние факторы и исчезать со сменой условий или могут быть обусловлены клеточной дифференциацией, поддерживаются независимо от внешних факторов. В литературе используется чрезвычайно неоднородная терминология с синонимичными терминами для таких явлений в зависимости от их особенностей (бистабильность, специализация, гистерезис, фазовая вариация, диссоциация). Одной из целей данного обзора является систематизация применяемой терминологии. В качестве объекта анализа выбраны представители рода Bacillus, поскольку у них выявлено значительное число эпигенетических феноменов. Кроме того, бистабильность является важным фактором, влияющим на эффективность использования бактерий рода Bacillus в биотехнологических процессах. Настоящая работа дает краткий обзор эпигенетических переключений в роде Bacillus, их механизмов, способов обнаружения и исследования, их возможную эволюционную и экологическую роль, а также практическое применение.
Для подавляющего большинства бактерий характерен феномен “бистабильности”, т.е. существования параллельных морфологически и физиологически различных линий клеток в культуре, полученной из одного клона. Например, типичным случаем бистабильности является параллельное существование в клональной популяции линий неподвижных клеток, формирующих биопленку, и свободноплавающих клеток бактерий [1]. Разнообразие внутри клональных клеточных линий может как определяться генетическими изменениями, так и проявляться без изменений геномных последовательностей. Эти проявления иногда достаточно сложно различить. Как правило, генетически обусловленные изменения практически необратимы и стабильно наследуются, в то время как признаки, не связанные с изменениями последовательности ДНК, легко переключаются. Тем не менее существуют геномные изменения, предопределяющие обратимые и квазиобратимые переключения фенотипа с высокой частотой 10–5–10–2 на поколение – рекомбинация транспозонов, изменение копийности плазмид и основной хромосомы [2], появление реверсивных и супрессорных мутаций [3]. Проявления фенотипической изменчивости могут быть как кратковременными, так и могут наследоваться c частотой переключений менее 10–6 на поколение. Переключения эпигенетических состояний могут быть стохастическими и независимыми для каждой отдельной клетки или кооперативными, запускающими единый для всех клеток популяции сценарий, имитируя поведение тканей многоклеточного организма [4]. До 2000 г. комплексное изучение переключаемых состояний бактериальной клетки представляло собой почти неразрешимую проблему. Но за последние десять лет произошел качественный рывок, связанный с накоплением данных и появлением новых методов исследований. Это делает вполне доступным анализ механизма и проявлений почти любого случая фенотипической бистабильности. Обзор механизмов, феноменологии и роли эпигенетического переключения бистабильных состояний в роде Bacillus интересен как с точки зрения значения этой группы в природе и биотехнологии, так и потому, что бациллы оказались одним из самых важных модельных объектов изучения регуляции этих процессов.
ИСТОРИЯ ИЗУЧЕНИЯ
Понятие эпигенетического или фенотипического наследования получает смысл с того момента, как Нагели сформулировал в 1860 г. идею о разделении материала живого организма на “сому” (тело организма) и “идиоплазму” (генетический материал), а Шванн в 1865 г. сформулировал представление о линиях клеток с наследуемым дифференцированным состоянием [5], хотя сам термин “эпигенетика” был введен взамен размытого понятия “эпигенез” лишь в 1944 г. [6]. Дифференцированные клетки бактерий были описаны еще до того, как исследуемые организмы были охарактеризованы как бактерии. Так, Кютцинг в 1843 г. описал гетероцисты цианобактерий (“водорослей”) [7], а Беркли в 1874 г. дал описание дифференциации спор и вегетативных клеток миксобактерии Chondromyces crocatus, которую он ошибочно считал миксомицетом [8]. Первым сообщением о наблюдаемом процессе дифференциации клетки бацилл стали статьи Коха и Кона о формировании эндоспор бациллами в 1874 г. [9]. Хотя с момента получения бактериальных чистых культур Пастером и Кохом была очевидна их морфологическая и физиологическая гетерогенность, воспроизводящаяся в течение нескольких поколений, никаких средств анализа для понимания механизмов переключения и наследования таких структур не было.
С момента появления генетики как науки и построения генетических карт стало возможным разделение признаков, наследуемых через генетический аппарат и помимо него [10]. К началу 80-х гг. для линий клеток животных, растений, а также для модельных эукариотических микроорганизмов помимо наблюдения многочисленных случаев фенотипического наследования были описаны конкретные механизмы: метилирование ДНК, сайленсинг, реструктуризация хроматина и посттрансляционная модификация гистонов [10]. Особые эпигенетические механизмы, впоследствии идентифицированные как “прионы”, наследуемые белковые конформации, были обнаружены у аскомицетов: НetS у Podospora anserina в 1952 г. [11] и Psi+ у S. cerevisiae в 1965 г. [12].
В то же время эпигенетические механизмы бактерий практически не изучались. Тем не менее некоторые ярко выраженные эпигенетические явления у прокариот открыты достаточно давно: в 1935 г. были исследованы L-формы бактерий [13], в 1940-х гг. – открыты клетки-персистеры (persister cells) [14], наблюдаемые у многих бактерий (в том числе бацилл).
Бактерии долгое время рассматривались как организмы, существующие в клональных популяциях генетически идентичных клеток, с фенотипами, отражающими их генетическое строение. При этом считалось, что эпигенетические механизмы у бактерий либо представлены очень слабо, либо отсутствуют вовсе. О данной точке зрения может косвенно свидетельствовать число публикаций в PubMed [15], относящихся к изучению эпигенетических механизмов у эукариот и у бактерий. За период с 1958 г. по 2021 г. статей, в которых были изучены и описаны эпигенетические механизмы у эукариот, было опубликовано в 55 раз больше в сравнении с аналогичной тематикой в отношении бактерий (из 1589 статей по эпигенетике бактерий лишь 107 относятся к изучению данного вопроса у бактерий рода Bacillus [15]). Стоит также отметить тот факт, что большая часть статей, касающихся изучения эпигенетических механизмов у бактерий, была опубликована в течение двух последних десятилетий, что свидетельствует о росте интереса в мировой науке к исследованиям в данной области.
Многие состояния клетки, известные длительное время, такие как компетентность B. subtilis, обнаруженная в 1961 г. [16], а также коллективные переключения поведения с образованием структур разнообразного строения, не рассматривались как эпигенетически запрограммированные. Поэтому, несмотря на широкое наблюдение эпигенетического разнообразия среди бактерий рода Bacillus, играющих важную роль в природе и технологиях, а также используемых как модельный объект во многих исследованиях, почти все работы, касающиеся эпигенетической бистабильности бацилл, сделаны лишь после 2000 г.
ИСПОЛЬЗУЕМАЯ ТЕРМИНОЛОГИЯ
Смысл термина “эпигенетика” с момента его введения в 1942 г. сильно изменился и трактуется разными исследователями очень по-разному [17]. Наиболее общее определение можно сформулировать так: “самоподдерживающееся состояние клетки, не предетерминированное генетически”. То есть существует возможность альтернативных состояний и их переключения.
В целом понятие “эпигенетическая регуляция” можно определить как надгенетические изменения в паттернах экспрессии генов, которые сохраняются в поколениях. Эпигенетические механизмы эукариот включают такие процессы как метилирование ДНК, модификации гистонов, сайленсинг, связанный с РНК (РНК-интерференция). Эти и другие механизмы контролируют и изменяют паттерн экспрессии генов. Показана роль эпигенетических механизмов в эмбриогенезе эукариот, клеточной дифференцировке, геномном импринтинге и влияние на онкологические заболевания, которые возникают из-за неправильной экспрессии или “молчания” различных генов [18, 19].
Существует широкое разнообразие терминов, характеризующих эпигенетические явления. Здесь приведены основные варианты терминологии, применяемые в отношении бактерий.
1. “Эпигенетика” в наиболее широком смысле – любые изменения клеточной морфологии или физиологии, непосредственно не связанные с геномом. Особенно широко термин “эпигенетика” в этом значении используется для обозначения ковалентных модификаций ДНК, воспроизводящихся в пострепликационном цикле. У эубактерий из ковалентных модификаций ДНК встречается лишь метилирование. Поэтому термин “эпигеном” в настоящее время используется как синоним термина “метилом”, т.е. паттерн распределения метилированных нуклеотидов по всей клеточной ДНК. Следует специально отметить, что такое использование термина “эпигенетика” и “эпигеном” может не подразумевать наличия переключаемых состояний. В отношении единообразно воспроизводящейся надгенетической структуры уместно употребить термин “конститутивная эпигенетика”.
2. “Состояние гомеостаза”, “гистерезис”, “бистабильность”. Клетка представляется как сложная динамическая система с множеством различных состояний. Некоторые из них являются более вероятными или метастабильными и имеют тенденцию поддерживаться в течение нескольких генераций клеток.
3. Сегрегация, диссоциация, расщепление культуры. Феноменологическое описание клональной культуры, в которой возникают клетки с измененной морфологией или культуральными свойствами, которые более-менее устойчиво наследуют эти свойства.
4. Специализация, дифференциация, дифференцировка. Развитие клетки по пути, отличному от программы материнских клеток. Такие клетки могут продолжить деление в измененном состоянии (эпигенетическое наследование); это состояние может быть терминальным – тогда клетка теряет способность к дальнейшему делению и гибнет (как, к примеру, гетероцисты цианобактерий или материнская клетка при споруляции бацилл); либо при дальнейшем делении происходит дедифференцировка клетки (например, состояние компетентной клетки или споры не передается потомкам).
5. Фазовые состояния, фазовые варианты, фазеварионы. Возникновение в клональной культуре множественных линий с отличающимся паттерном экспрессии генов. Как правило, наследование неустойчиво и продолжается лишь в ограниченном числе делений. При пересеве, споруляции, шоковых воздействиях на культуру происходит перезагрузка эпигенетического статуса.
Перечисленные термины в исследованиях, связанных с эпигенетикой, используются часто как синонимы, а также существует значительное количество терминов, изобретенных ad hoc.
МЕТОДЫ ИССЛЕДОВАНИЯ
Традиционные методы исследования
В традиционной микробиологической практике клоны с возникшим de novo эпигенетическим состоянием часто выявлялись по измененной морфологии колоний (расплывающаяся–нерасплывающаяся, сухая–слизистая, окрашенная–неокрашенная, расползающаяся, формирующая пленку и т.п.), появлявшихся при рассеве культуры. Часто клоны с измененной морфологией и измененными биохимическими и физиологическими свойствами обнаруживались при стрессовых воздействиях или отбирались в селективных условиях. При обнаружении клонов с измененными культуральными свойствами их подвергали неоднократным пассажам и рассевам, в некотором диапазоне условий, с целью определить стабильность наследуемости измененного приобретенного признака. Клоны, устойчиво сохранявшие приобретенный признак, рассматривались как несущие мутацию, а показывавшие некоторый уровень возврата к исходным свойствам представляли собой кандидатов для выявления фенотипического наследования. Клоны с высокой частотой реверсий, вызванной геномными событиями (перестройками, появлением супрессорных мутаций), можно было выявить при помощи генетического анализа (рекомбинации с клонами дикого типа, секвенированием подозрительных участков, слиянием протопластов). Невозможность выявить геномный характер наследственных изменений была косвенным указанием на эпигенетическую природу явления [20]. Поэтому до полного изучения деталей механики поддержания эпигенетического состояния само его существование оставалось гипотетичным. Наиболее надежным показателем наличия эпигенетического механизма, связанного с конкретной структурой, считается эксперимент, в котором какой-либо маркер-репортер оказывается под контролем данного механизма при его искусственном соединении с данной структурой (например, ген-репортер, поставленный под контроль промотора, подверженного эпигенетической регуляции, проявляет паттерн экспрессии, сопутствующий соответствующему эпигенетическому переключению). Тем не менее такой подход совершенно неприменим к переключениям, зависящим от коллективного поведения бактерий и поддержания структуры пространственной организации популяции. Большая часть исследований, касающаяся группового, кратковременного, многофакторного, малозаметного фенотипически эпигенетического наследования, требует иного подхода.
Новые методы
За последние двадцать лет появилось множество технических и аналитических подходов, применяемых для эффективного анализа эпигенетики бактерий, здесь перечислены наиболее часто используемые.
1. Секвенирование полного генома клона, несущего измененные, предположительно наследуемые характеристики, что позволяет отсечь или подтвердить предположение о возможной мутации [21].
2. Бисульфитное, нанопоровое, SMRT и другое секвенирование, а также родственные методы дают возможность создать полную карту метилома (к настоящему моменту имеется более 2000 полных метиломов) и сопоставить соответствие различий метилированных и деметилированных участков измененным физиологическим характеристикам клона [22].
3. Проточная цитометрия позволяет точно посчитать в культуре количество клеток с измененными физиологическими характеристиками, благодаря чему становится возможным анализ неустойчивых состояний, при которых переключение происходит с высокой частотой – один раз в несколько поколений [23, 24].
4. Микрофлюидный анализ линии потомков индивидуальных клеток позволяет проследить кратковременные эпизоды неустойчивого наследования фенотипов и количественную характеристику частот переключений [25].
5. К настоящему моменту имеются базы данных протеомов, транскриптомов, метиломов и интерактомов многих видов, поэтому обнаружение в клетке изучаемого организма элементов, аналогичных найденным в близких такcонах и связанных с эпигенетическим наследованием, также предполагает наличие эпигенетического переключения [26].
6. Многие эпигенетические состояния наблюдаются в клетках, составляющих часть пространственной структуры бактериального сообщества, биопленки, агрегата или цепочки клеток. В настоящее время существует возможность непосредственного анализа состояния клетки и автоматизированного отслеживания ее судьбы в составе такой структуры при помощи новых микроскопических систем визуализации [27].
Большинство исследований бистабильности были выполнены на стандартном лабораторном штамме B. subtilis 168. Тем не менее, как оказалось, он может служить лишь ориентировочной моделью, поскольку, как было показано во многих работах, он в результате мутагенеза при доместикации утратил многие гены, участвующие в формировании пространственных многоклеточных структур, организации коллективного поведения и регуляторов цикла развития. Среди утраченных компонентов несколько генов системы межклеточной сигнализации Rap (например, rapP), сигма-субъединицы (например, σN), регуляторные элементы, обеспечивавшие тонкую регуляцию уровня фосфорилирования одного из центральных клеточных регуляторов – транскрипционного фактора DegU [28–30]. В настоящее время исследования ведутся также с другими штаммами B. subtilis, близкими к природным изолятам, и другими видами данного рода [30].
ИЗУЧЕННЫЕ И ГИПОТЕТИЧЕСКИЕ МЕХАНИЗМЫ ЭПИГЕНЕТИЧЕСКОЙ СПЕЦИАЛИЗАЦИИ
Бистабильность в теории динамических систем, частным случаем которой являются модели живых организмов, рассматривается как два типа переключателей: переключатели типа кнопки (push-button) и переключатели типа реле (switch, trigger). Переключатели типа кнопки действуют лишь пока фактор, вызвавший переключение “индуктор”, продолжает присутствовать в системе, а с его уходом система возвращается в исходное состояние. Переключатели второго типа – “реле”, будучи переключенные индуктором остаются в новом состоянии независимо от наличия индуктора. В клетке и сообществе клеток есть множество переключателей как первого, так и второго вида. Переключение физиологического состояния может быть мгновенным, а может быть растянутым на протяжении нескольких поколений. Нет четкой границы между видами переключений. Кроме того, один и тот же механизм может работать как переключатель первого, так и второго рода. Так, например, классическая модель регуляции, lac-промотор E. coli, в основном работает как переключатель типа “кнопка” [31]. Большинство механизмов поддержания альтернативных состояний клетки более сложны и включают себя несколько переключателей, как типа кнопки, так и типа реле. Это может приводить к инерционности переключений и существованию множества разнообразных форм, а иногда и континуума состояний [32].
С точки зрения продолжительности состояния относительно клеточного цикла следует выделить состояния, не препятствующие делению и продолжающиеся в течение нескольких поколений, и состояния терминальной специализации, для которых переход к делению возможен лишь после выхода из данного состояния или невозможен вообще, как в случае программируемой клеточной смерти.
С точки зрения поведения популяции формы бистабильности можно также разделить на две категории: первая, когда переключение происходит стохастически, независимо для каждой клетки, и вторая – кооперативная, когда клетки ведут себя подобно тканям многоклеточного организма, осуществляя синхронные переключения состояния по всей популяции, будучи связанными системой внеклеточной химической сигнализации.
Дадим краткую характеристику основных известных молекулярных механизмов эпигенетического переключения состояний клеток.
Метилирование
Метилирование геномных участков – широко распространенный среди бактерий механизм модификации характера экспрессии генов. В течение длительного времени он считался единственным видом ковалентных модификаций оснований ДНК, хотя в последнее время появились сведения о других модификациях [33]. Во многих работах между понятием “метилирование ДНК” и понятием “эпигенетика” ставится знак равенства [4], хотя между метилированием и изменением фенотипа нет прямой взаимосвязи, и только для единичных случаев в роде Bacillus показано появление бистабильности, связанной с эпигенетическим наследованием паттернов метилирования на фоне идентичного генотипа. В клетках бактерий обнаружено три основных типа метилирования: с образованием N6-метиладенина, N4-метилцитозина и 5-метилцитозина [34].
К моменту описания нескольких систем метилирования у бацилл [35] было понятно, что бактериальные ДНК-метилазы (метилтрансферазы) преимущественно работают в паре с рестриктазами, являясь системой метилирования–рестрикции, работающей в качестве иммунной защиты от чужеродной ДНК. Обнаружены и так называемые “орфанные метилтрансферазы”, не имеющие рестриктного партнера. В клетках бацилл найдено около 60 таких систем различной специфичности из трех различных семейств. Каждый штамм обладает “уникальным” набором систем метилирования. При этом родственные и неродственные метилтрансферазы широко распространены по разным бациллярным пангеномам благодаря межвидовому горизонтальному переносу [36]. Группы бацилл с высокой частотой горизонтального переноса, такие как B. cereus sensu lato, B. pumilus sensu lato, B. subtilis sensu lato, обладают в значительной степени перекрывающимся набором метилаз, неравномерно распределенным по штаммам. Часть метилома неизменна в пределах конкретного штамма, поскольку большинство метилаз экспрессируются с конститутивных промоторов, находящихся под контролем преимущественно вегетативно-специфичных сигма-субъединиц (σA). При межштаммовом обмене ДНК происходит не только обмен генами, но и перезагрузка метилома. Такая схема не приводит к появлению культуральной бистабильности внутри штамма, а является примером “конститутивной” эпигенетики. В отличие от эукариот в клетках бактерий наиболее важную роль играет метилирование аденина. До недавнего времени в бациллах были изучены лишь адениновые ДНК-метилазы, хотя недавно в одном из штаммов B. pumilus была обнаружена цитозин-специфическая система метилирования (N4-метилцитозин), экспериментальное отключение которой дает множественные изменения в экспрессионной активности по всему геному [37]. Еще одним отличием от эукариот является то, что в клетках бактерий отсутствуют деметилазы. Поэтому “перезагрузка” метилома при смене паттерна метилаз происходит за счет “разбавления” метилированных молекул ДНК в процессе деления клетки. Экспрессия гетерологичной метилазы Dam из E. coli в клетках B. subtilis приводила к активации систем репарации и вырезанию N6-метиладенина, но такой механизм регуляции паттерна метилирования неизвестен для природных штаммов [38].
Метилирование ДНК может быть фенотипически нейтральным, а может оказывать существенное воздействие на транскрипцию, репликацию и пространственную структуру ДНК, если оказывается в зоне узнавания соответствующего механизма [4, 39]. Иногда метилирование проявляется в виде фенотипических бистабильных состояний при наличии обратной связи между метилированием участка ДНК и эффективностью метилирования. Сейчас известно несколько механизмов такой зависимости.
Первый механизм, описанный у бацилл только в одной работе, но уже неоднократно упоминаемый у других бактерий, состоит в следующем: между высокоафинным белком, связывающимся со специфическим участком ДНК и экранирующем его, и метилированием участка идет конкуренция. Так, при исследовании штаммов B. subtilis, несущих метилтрансферазу DnmA, оказалось, что многие сайты, соответствующие консенсусу узнавания (GACGmAG), не были метилированы. Как оказалось, точки отсутствия метилирования соответствовали участкам связывания высокоаффинных белков, в частности маркировали места связывания репрессоров в промоторах. При суперэкспрессии метилазы многие участки связывания репрессоров все же метилировались и метилирование данного участка воспроизводилось беспрепятсятвенно во многих поколениях клеток благодаря тому, что метильные группы связывания репрессором оказывались лишены афинности к соответствующему репрессору [40]. Механизм бистабильности экспрессии гена за счет экранирования сайта метилирования был изучен на многих видах и сейчас существуют искусственные гетерологичные экспрессионные кассеты с наследственно переключаемым по этому механизму уровнем экспрессии [41].
Второй механизм возможной бистабильности связан с воспроизведением метилированной ДНК по механизмам, подобным эукариотическим. Наличие метильной группы в одной цепи ДНК в данной точке повышает эффективность ее метилирования по другой цепи по сравнению с метилированием de novo немодифицированной ДНК. В таком случае при устойчивой экспрессии метилазы устойчиво воспроизводится существующий паттерн метилирования в любом из альтернативных вариантов. В случае экспрессионного шума или при экспрессии метилазы лишь в определенные моменты роста культуры возникает разнообразие субклонов, отличающихся наследуемым паттерном метилирования. Такие временно формируемые эпигенетические состояния часто называют фазовыми вариантами. Такой механизм представляется крайне вероятным для определенных видов популяционного разнообразия бацилл. В то же время пока он обнаружен лишь среди грамотрицательных бактерий, таких как E. coli [42].
Петля самоактивации гена или группы генов
Классическая схема самоактивации подразумевает прямую или косвенную зависимость эффективной транскрипции промотора, которая в свою очередь зависит от продукта экспрессии гена, находящегося под контролем этого промотора. Продукт оперона может одновременно быть и транскрипционным фактором, участвующим в инициации транскрипции, и запускать другие гены, усиливающие экспрессию с этого промотора. Особенность эубактерий в том, что последовательности всех промоторов в геноме расклассифицированы по нескольким большим группам, каждая из которых экспрессируется с участием специальной сигма-субъединицы РНК-полимеразы или сигма-фактора. В клетке B. subtilis имеются 17 видов сигма-факторов. Каждое состояние клетки соответствует своему паттерну экспрессирующихся сигма-факторов. Базовую информацию по сигма-факторам можно найти в классическом обзоре [43]. Основной фактор σA работает почти во всех клетках. Фактор σB контролирует экспрессию генов в условиях стресса, σD – генов подвижности и хемотаксиса, σE,F,K,G ответственны за экспрессию генов при споруляции. Остальные сигма-факторы в основном обеспечивают работу оперонов, участвующих во взаимодействии с химически активными агентами вне клетки. Большинство промоторов сигма-факторов являются самоактивирующимися, т.е. транскрипция с них может происходить с участием соответствующего сигма-фактора и/или с участием этого сигма-фактора происходит непосредственное или косвенное усиление экспрессии белков; так, промотор sigB может экспрессироваться с участием σB, sigF – с участием σF, sigD – с участием σD. Кроме того, экспрессия оперонов, зависимых от каждого из сигма-факторов, приводит к экспрессии генов, вызывающих положительную петлю активации промотора соответствующего sig-гена. Полный компендиум механизмов активации каждого из генов и взаимодействий соответствующих белков можно найти на сайте [44]. Таким образом, состояние, связанное с экспрессией определенного сигма-фактора, в принципе может поддерживаться самопроизвольно. Следует отметить, что хотя построена достаточно полная качественная карта взаимодействий для B. subtilis, наличие множества факторов, положительно и отрицательно влияющих на экспрессию каждого из ключевых генов, предсказание поведения системы требуют применения сложных математических моделей, учитывающих многие дополнительные количественные и динамические параметры. Такие модели существуют лишь для ограниченного количества случаев. В частности, определенные модели предполагают дополнительную стабилизацию альтернативных состояний за счет конкуренции сигма-факторов [45]. Определенную роль в такой конкуренции могут сыграть некодирующие 6S РНК [46] и анти-сигма-факторы [45], подавляющие транскрипцию, контролируемую сигма-субъединицами, присутствующими в недостаточном количестве. Особую роль в клетке играет σH, фактор переходного состояния. С участием σH происходит транскрипция многих генов, ответственных за дестабилизацию выбранного гистерезисного состояния и переключения в новое метастабильное состояние. Так, с участием σH в переходном состоянии происходит транскрипция sigA, оперонов чувства кворума, генов, ответственных за реструктуризацию цитоскелета [44].
Ферментативная самоактивация
В клетке бацилл возможно поддержание альтернативных состояний за счет создания петли обратной связи, формируемой взаимной активацией ферментов. Такие петли действительно известны; так, например, в пуле киназ B. subtilis при инициации процесса споруляции происходит взаимное и автофосфорилирование киназ KinA,B,C,D и активируемых ими факторов споруляции. Видимо, подобный механизм не работает сам по себе как устойчивое самоподдерживающееся состояние в ряду поколений, но он используется как составная часть процессов дифференциации, например при фосфорилировании Spo0A при споруляции или DegU при запуске образования матрикса биопленки. Запуск происходит при активации киназы за счет изменения сенсорного домена в ответ на внешний сигнал, а далее амплифицируется за счет авто или взаимного фосфорилирования нескольких киназ. В клетке бацилл существует более 50 таких так называемых “двухкомпонентных сенсорных систем” и запуск дифференцированной экспрессии почти каждого из сигма-факторов сопровождается активацией соответствующего пула киназ. Общий обзор двухкомпонентных сенсорных систем можно найти на сайте SubtiWiki [47]. Более полную компиляцию см. в работе [44]. Как было сказано, что хотя автокаталитическая активация имеет самоподдерживающийся характер, степень устойчивости динамической системы, возможно, недостаточна для поддержания выраженной фенотипической бистабильности. Поэтому кооперативные состояния, существующие длительное время, такие как биопленка, имеют дополнительные механизмы стабилизации [48].
Прионы
Воспроизводящиеся конформационные состояния белка (прионы) в настоящее время довольно хорошо изучены на примере инфекционных конформаций белков млекопитающих и эпигенетически наследуемых состояний дрожжей. Прионы представляют собой особые конформации третичной структуры белка, обычно в виде амилоидных агрегатов. Белок “нормальной конформации” при контакте с белком-прионом также уходит в агрегированное состояние, приобретая конформацию приона. Прионовые агрегаты могут быть фрагментированы за счет протеолитической активности, при помощи шаперонов или другими воздействиями, формируя “прионовые затравки “prion seeds”, служащие источником дальнейшего распространения прионовой инфекции. Первичные последовательности белков, формирующих прионы, имеют характерные последовательности: богатые глутамином или аспарагином аминокислотные повторы, что дает возможность с высокой достоверностью предсказать возможность формирования амилоидов. Предсказание дало высокую долю амилоидных белков в бактериальных протеомах [49]. Среди около 100 предсказанных амилоидных белков B. subtilis значительное количество регуляторов транскрипции, трансляции, а также секретируемых белков, в том числе растворимых сигнальных пептидов и токсинов, компонентов клеточной стенки и всех основных белков, формирующих матрикс биопленки. Однако до настоящего времени прионная регуляция у бацилл не обнаружена. Тем не менее возможность поддержания альтернативных состояний была показана для двух бактериальных белков: секретируемого токсина Klebsiella pneumoniae микроцина [50] и фактора терминации транскрипции Rho в клетках Clostidium botulinum [51]. Микроцин – секретируемый токсин, образующий трансмембранные поры в клетках бактерий. При начале роста культуры K. pneumoniae секретируемый микроцин представляет собой растворимый активный белок. При старении культуры в ней иногда происходит спонтанное зарождение микроцина-приона, агрегирующего растворимый токсин в амилоидные филаменты. Перенесение культуральной жидкости, содержащей прионовые филаменты, в молодую культуру приводит к ее кооперативной прионизаци [50]. Как оказалось, схема прионизации легко воспроизводится в гетерологической системе экспрессии E. coli с рекомбинантными модификациями белка [52]. Для терминатора транскрипции C. botulinum Rho было показано, что он содержит потенциально амилоидный участок и, будучи экспрессирован в гетерологических системах (S. cerevisiae и E. coli), ведет себя как прион, т.е. формирует эпигенетически наследуемые состояния [51]. Поскольку клетки бацилл синтезируют множество прионоподобных белков, в частности ортолог Rho (крайне близкий по свойствам белку из Clostridium), а также бацитрацин и другие токсины, аналоги микроцина, формирование альтернативных прионных структур крайне вероятно у бацилл. Формирование переключаемых амилоидоподобных состояний обсуждалось как один из вероятных механизмов формирования биопленки и структуры колонии [53].
Наследование внеклеточного матрикса и структуры пространственной организации популяции
Бактериальная популяция может быть организована как жидкая культура индивидуально плавающих клеток, а может быть весьма упорядочена в трехмерую структуру, где положение клеток влияет на их поведение и судьбу. Взаимодействия непосредственно через контакт клеток или через полисахариды матрикса запускают сигналы внутриклеточной регулировки. Внутри пространственно организованной популяции бактерий, как правило, обнаруживаются градиенты концентрации биологически активных веществ, что влияет на способы дифференцировки в течение поколений. Передача сигналов о пространственной организации и внешних контактах клетки может происходить через систему хемотаксиса или через трансмембранные белки, взаимодействующие с цитоскелетом [54].
Чувство кворума (Quorum sensing, QS)
Бациллы, как и другие бактерии выделяют в среду аутоиндукторы (АИ), сигнальные молекулы, влияющие на физиологическое поведение клеток бактерий того же вида или других видов. Эти вещества представляют собой низкомолекулярные пептиды, циклопептиды, липопептиды и их производные. АИ имеют поверхностные или внутриклеточные рецепторы в клетках бактерий и действуют по механизму положительной обратной связи: связывание АИ с рецептором бактерии вызывает включение механизма синтеза или секреции клеткой этого же вещества. Таким образом при достижении порогового уровня готовности популяции сигнал, первоначально стохастически запущенный одной клеткой, амплифицируется всеми клетками культуры, благодаря чему достигается кооперативность и синхронность изменения статуса популяции которая ведет себя подобно тканям многоклеточного организма [55]. Положительная петля регуляции может служить как средством поддержания “коллективного эпигенетического состояния”, так и вторичным сигналом для запуска клеточной дифференциации. Существуют также QS-системы с отрицательной обратной связью, позволяющие ограничивать распространение сигналов типа “чувства кворума” или локально воздействовать на соседние клетки. В клетках B. subtilis 168 существуют две основные системы чувства кворума: 1) группа секретируемых пентапептидов PhrA-PhrH, подавляющих Rap-белки (ингибиторы трансляции); 2) геранил-олигопептид ComX запускающий фосфорилирование фактора транскрипции ComA через мембранный рецептор ComP и каскад процессов формирования поздней специализации клеток. Клетки других штаммов бацилл имеют широкое разнообразие систем коммуникации, в той или иной степени напоминающих две вышеперечисленные [56].
Экспрессионный шум
Гетерогенность экспрессии генов в клетке на уровне транскрипции в популяции – закономерное следствие малого размера клеток. При небольшом количестве факторов, регулирующих транскрипцию, сильные стохастические вариации количества продукта экспрессии между клетками и во временной развертке – “экспрессионный шум” (noisy expression) оказываются почти неизбежными. В случае, когда для функционирования клетки важно тонко регулируемое количество нужного фактора (белка, РНК, метаболита), как правило, имеются специальные механизмы для регуляции его доступности. В то же время экспрессионный шум сам по себе может играть существенную роль в физиологии и гомеостазе культуры бацилл. Так, гетерогенность экспрессии может использоваться для запуска стохастического перехода индивидуальной клетки в иное физиологическое состояние, если уровень продукта экспрессии достигает порогового значения, при котором запускается механизм перехода. Для культур большинства видов бацилл запуск перехода к споруляции является стохастическим и несколько растянутым по времени, хотя и является реакцией на одни и те же изменения среды. С другой стороны, экспрессионный шум может использоваться для обеспечения кооперативного перехода с использованием механизмов чувства кворума. Клетка, достигшая порогового уровня накопленного продукта, выделяет в среду сигнальный пептид, тот связывается сенсорной системой других клеток и запускает коллективный выброс сигнала из клеток с подпороговым уровнем накопленного продукта [57, 58]. Возможны и другие стратегии использования экспрессионного шума. Так, в нескольких работах была показана роль некодирующих 6S РНК и Rap-белков, осуществляющих подавление экспрессии на посттранскриционном этапе на фоне гетерогенности экспрессии [59, 60]. Согласно математическим моделям, такого рода регуляция может приводить к стабилизации синтеза белковых продуктов, экспрессирующихся генов на двух уровнях – высоком и низком. Пока неясно, насколько такие эффекты проявляются в виде морфологически выраженных альтернативных фенотипов или участвуют в поддержании бистабильности иного рода.
Материнский эффект
Данный эффект наблюдается как инерционность признака в ряду поколений за счет передачи материала материнского организма дочернему в виде запаса метаболитов. Классическим примером материнского эффекта являются эксперименты, при которых дрозофилы, прошедшие цикл развития на богатой среде, откладывали яйца с большим количеством желтка, чем прошедшие цикл на бедной среде, что приводило к появлению более крупных личинок, из которых получались мухи, откладывавшие более крупные яйца. Инерционное наследование присуще и клеткам бацилл, наследующим от родительской клетки часть паттерна метилирования, пул ферментов и метаболиты, разбавляемые в последующих делениях. Такого рода наследование может оказаться критичным для выживания, если происходит через терминально специализированное состояние клетки. Так, соотношение выгод от ранней и поздней споруляции и эффективности прорастания спор зависит от накопленных в споре метаболитов [61], от которых зависит эффективность прорастания спор.
ФЕНОМЕНОЛОГИЯ
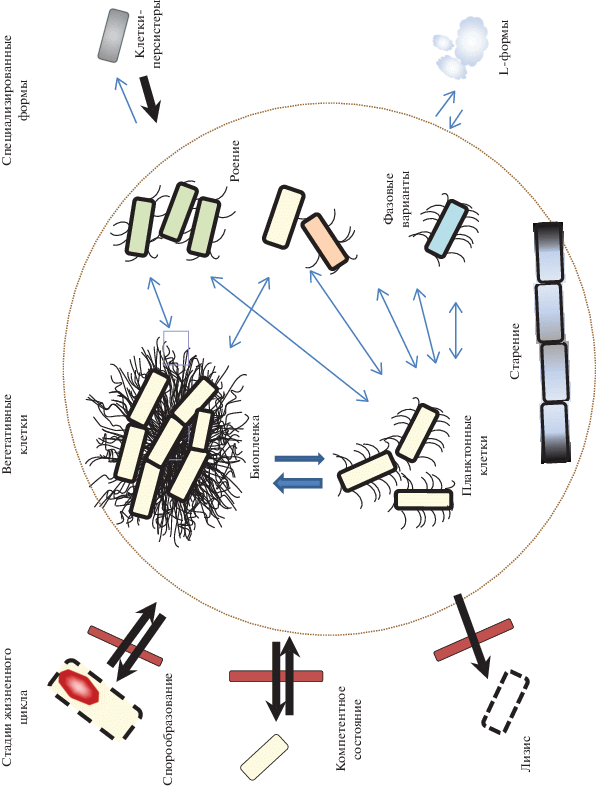
Жизненный цикл бацилл с некоторой долей условности можно разделить на пять основных видов специализации: 1) рост в виде вегетативных планктонных клеток, преобладающих в логарифмической культуре; 2) формирование поздних агрегирующих вегетативных состояний, таких как биопленка, при переходе в стационарную фазу; 3) образование компетентных клеток; 4) споруляция; 5) программируемая клеточная смерть – лизис. За исключением вегетативных клеток (1 и 2) все перечисленные виды специализации являются терминальными, т.е. состояние клетки не передается по наследству. Каждому из состояний соответствует характерный паттерн экспрессии транскрипционных факторов и определенный уровень их фосфорилирования. Выбор одной из пяти программ определяется, с одной стороны, набором факторов среды, с другой, может зависеть от взаимодействия клеток. Так, богатая питательная среда и оксигенные условия способствуют росту в вегетативной форме, аноксигенные вызывают лизис, достижение определенной плотности клеток в культуре приводит к появлению компетентных клеток, истощение среды запускает споруляцию, старение культуры запускает формирование биопленки. Выбор стратегии осуществляется при помощи внутриклеточных сигналов, включающих каскады реакций фосфорилирования, протеолитического расщепления, выключения/включения групп промоторов. Одновременно в выборе пути участвуют секреторные пептиды, играющие роль феромонов, которые по механизму “чувства кворума” запускают переход в специализированное состояние значительной части культуры. Карта основных элементов сигнальной сети, осуществляющей выбор стратегии специализации клеток, приведена в ряде обзоров, например [62], и рассмотрена как математическая модель динамической системы [63, 64]. Основные элементы сети “принятия решений” хорошо охарактеризованы [63], как и механизмы поддержания функционирования планктонных клеток, запуска споруляции, компетентности, лизиса, в то время как в механизмах формирования агрегированных структур остается много неясного. Здесь мы не будем касаться деталей механизма каждого из процессов, а дадим лишь краткую характеристику, приведя ссылки на соответствующие обзоры.
На рис. 1 приведена упрощенная схема взаимодействий клеточных и внеклеточных механизмов, отвечающая за решение о переходе клетки на тот или иной путь специализации. Эта схема – компиляция на основании многочисленных исследований, сделанных на типовом штамме B. subtilis 168. Фрагменты рассмотрены в многочисленных обзорах и при обсуждении данных моделирования и экспериментальных работ [1, 63, 65]. В основной схеме сети сигнальных взаимодействий можно выделить четыре основных блока переключаемых состояний: 1) состояние планктонных подвижных клеток, для которого характерен активный транскрипционный репрессор SinR; 2) состояние биопленки, характеризующееся умеренным уровнем экспрессии и фосфорилирования Spo0A и активированным транскрипционным регулятором DegU; 3) компетентное состояние – высокий уровень транскрипционного активатора ComK; 4) состояние перехода к споруляции, которому соответствует максимальный уровень активности Spo0A. Эти четыре включенных состояния были подробно описаны на типовом штамме B. subtilis 168, они связаны между собой антагонистической регуляцией на уровне транскрипции, посттранскрипционных процессах и межклеточной сигнализации. Далее будут представлены все выявленные механизмы, отвечающие за бистабильность в культуре бактериальных клеток, а также дана обобщающая схема.
Рис. 1.
Взаимодействия сигнальной системы клеток бацилл, ответственной за основные типы включаемой дифференциации. Овалы обозначают белковые элементы, прямоугольники – экспрессируемые опероны. Стрелки обозначают непосредственное и опосредованное воздействие активности одного белкового элемента на активность других структур без различия транскрипционных и посттранскрипционных эффектов, т.е. включают активацию транскрипции, стабилизацию мРНК, предохранение от протеолиза, активационное фосфорилирование и др. Линия с перемычкой обозначает ингибирование или инактивацию элемента сигнальной сети. Оранжевым овалом с соответствующим номером выделены особенно важные элементы сигнальной сети, способные автономно поддерживать альтернативные состояния бистабильности. Обозначены четыре центра бистабильности: 1 – транскрипционный репрессор SinR, ответственный за удержание состояния планктонных клеток; 2 – транскрипционный активатор DegU, в активном фосфорилированном состоянии поддерживающий формирование биопленки и роение; 3 – транскрипционный активатор ComK, поддерживающий формирование компетентного состояния; 4 – транскрипционный активатор Spo0A, ответственный за споруляцию и участвующий в поддержании биопленки. Розовый фон – клетка; элементы в нем – взаимодействия внутри клетки. Элементы вне розового фона обозначают факторы внеклеточной сигнализации, ответственные за коллективное поведение.
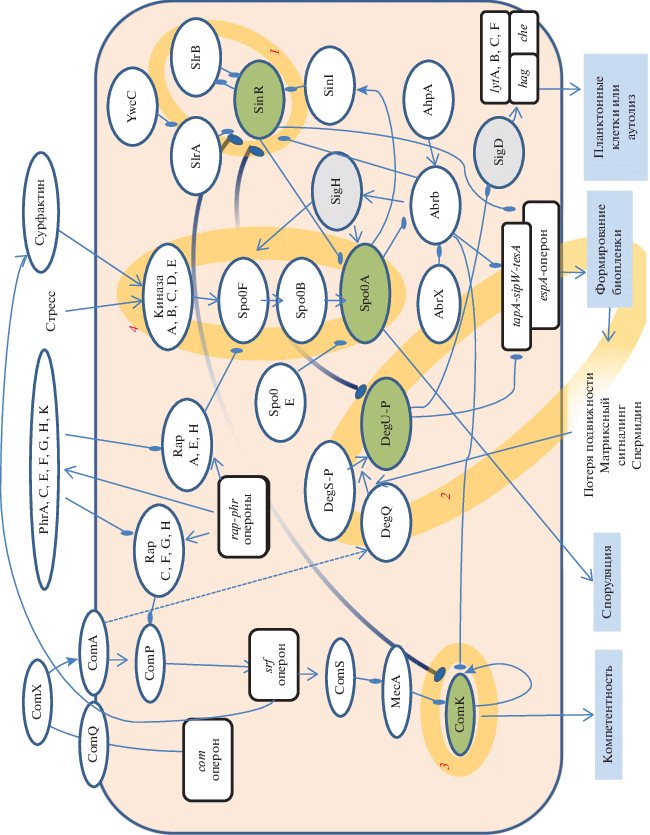
Планктонное состояние: быстро делящиеся подвижные клетки, характеризуются высокой активностью SinR – транскрипционного репрессора с широким кругом плейотропных межбелковых взаимодействий, осуществляющего в вегетативных клетках репрессию генов многих регуляторных белков, в том числе нескольких σ-субъединиц и других факторов транскрипции, участвующих в переходе клеток в специализированные состояния или опосредованную их инактивацию. В планктонных клетках за счет эффективной транскрипции, осуществляемой σD, происходит экспрессия генов автолиза, участвующих в разделении цепочек клеток, оперонов, ответственных за формирование жгутиков и хемотаксис. Репрессия конкурирующих генов, в том числе sigH, и цепочка белковых взаимодействий, препятствующих фосфорилированию факторов транскрипции DegU, Spo0A, ComK, способствуют сохранению планктонного состояния в ряду поколений. При повышении плотности культуры и истощении среды появляется тенденция к подавлению активности репрессора SinR за счет экспрессии конкурирующих генов. Обычно непосредственным фактором, выключающим активность SinR, является активация гена sinI, продукт которого образует неактивный комплекс с SinR, снимая репрессию с его антагонистов, в том числе abrB, экспрессия которых в дальнейшем препятствует его синтезу. Так как sinI экспрессируется очень неоднородно, переход в новое состояние оказывается стохастическим.
Биопленка. При переходе в стационарную стадию в жидкой среде и при росте на поверхности субстрата происходит изменение морфологии клеток бацилл и запускается процесс формирования биопленки. Клетки слипаются, теряют жгутики, формируется межклеточный матрикс – гель, каркас которого состоит преимущественно из волокон экзополисахаридов и связующего амилоидного белка TasA, заякоренного на поверхности клеточных стенок при помощи белка TapA. Внешние факторы, запускающие формирование биопленки, – частичное истощение среды, контакт клеток, торможение жгутиков, накопление катаболитов в среде. В отличие от споруляции, компетентности и лизиса вегетативные клетки биопленки не являются терминальным состоянием, а воспроизводятся в ряду поколений, а также могут переходить в состояние компетентности или спорулировать. Запуск состояния биопленки связан с активацией DegU. Формирование биопленки происходит на фоне определенного уровня активности Spo0A, также участвующего в споруляции. Биопленка не является равномерной, и существует несколько категорий растущих и покоящихся клеток биопленки с различной специализацией [1, 66]. DegU – транскрипционный фактор, является элементом двухкомпонентной системы фосфорилирования киназ DegU–DegS, которая активируется за счет сигнала подавленного функционирования жгутиков, через белок DegQ. Само состояние биопленки, видимо, поддерживается не только петлей автокаталитического фосфорилирования. Это можно предположить, исходя из того, что трудно представить механизм передачи строго определенного уровня сигнала в ряду поколений воспроизводящихся в биопленке клеток, поскольку уровень транскрипции и трансляции подвержен колебаниям, в то время как стабильность наследуемого состояния самоактивации фермента зависит от тонкого баланса синтеза и деградации. Уровень транскрипции и трансляции подвержен колебаниям и трудно предположить полную стабильность наследуемого состояния самоактивации фермента, которое зависит от тонкого баланса синтеза и деградации. Можно предположить, что стабилизация дифференцированного состояния клеток биопленки является многофакторной. Клетки биопленки подвергаются отбору за счет “каннибалистического поведения” большинства дифференцированных клеток, т.е. недифференцированные клетки подвергаются воздействию токсинов, выделяемых клетками в дифференцированном состоянии [1]. Иммобилизованная клетка при дедифференцировке получает сигнал о нарушении функции жгутиков через Swr белки, препятствующий дефосфорилированию DegU. Постепенно накапливаются сведения, что сам контакт с другими клетками и матриксом является сенсорным сигналом, стабилизирующим дифференцированное состояние [67]. В последнее время появились некоторые предположительные данные о возможной роли метилирования в поддержании стабильности биопленки [68].
Компетентное состояние характеризуется остановкой деления и формированием специальных механизмов захвата ДНК из среды. После некоторого времени состояние компетентности заканчивается с восстановлением статуса вегетативной клетки и последующим делением. Механизм формирования состояния естественной компетентности достаточно консервативен для грамположительных бактерий и, видимо, свойствен всем видам бацилл [69], тем не менее в отличие от лабораторного штамма B. subtilis 168 природные изоляты редко проявляют компетентное состояние, вероятно вследствие того, что гены, ответственные за его запуск и формирование, выключены через сайленсинг за счет мелких некодирующих РНК и метилирования. В некоторых случаях запуск компетентного состояния может быть осуществлен за счет суперэкспрессии регуляторных белков, таких как ComK [70]. В штамме B. subtilis 168 запуск состояния компетентности происходит при достижении клетками растущей культуры определенной плотности. Запуск идет через внешний сигнал – секретируемый пептид ComX, который, связываясь с мембранным рецептором ComA, запускает каскад реакций, приводящий к активации гена фактора транскрипции ComK, который является собственным активатором, и тем самым обеспечивается поддержание состояния. Клетки перестают двигаться и в мембране из продуктов генов, экспрессируемых под контролем ComK, формируется система захвата ДНК из среды. Мембранный экспорт “феромона” ComX в среду также активируется тем же каскадом. Это обеспечивает координированный переход в компетентное состояние значительной части популяции бацилл.
Споруляция, необратимая специализация, представляет собой неравное деление, при котором меньшая часть делящейся клетки, погружаясь внутрь, превращается в покоящуюся эндоспору, а материнская часть клетки, поспособствовав формированию споры, отмирает. Споруляция – самый известный и подробно изученный случай дифференциации клетки. Процесс споруляции включает в себя дифференциальную систему экспрессии приблизительно 500 генов и сложную сеть сигналов, работающих дифференциально в материнской клетке и проспоре. Споруляция запускается максимально высоким уровнем фосфорилирования фактора транскрипции Spo0A, достигаемого за счет нескольких взаимно фосфорилирующих киназ. В ходе споруляции на ранней стадии отключаются все остальные системы дифференциации и запускаются споруляционные сигма-факторы в соответствующих компартментах спорулирующей клетки. Подробно механизм споруляции бацилл рассмотрен в многочисленных обзорах [71, 72].
Автолиз. В условиях резкого голодания или плохой аэрации среды у большинства бацилл запускается механизм массового самоубийства, в виде продукции автолизина гидролизующего пептидогликан клеточной стенки. Запуск самопроизвольного лизиса связан с понижением уровня АТФ в клетке и деполяризацией цитоплазматической мембраны. Автолиз идет при активной экспрессии skf- и sdp-оперонов на фоне повышения активности SinR. В литературе автолиз бацилл рассматривается как вариант альтруистического поведения, способствующего выживанию некоторых клеток в условиях истощенной среды [73].
Существование аналогичной схемы дифференциации предполагается для большинства видов рода Bacillus. Тем не менее полного исследования системы взаимодействий, аналогичной построенной для B. subtilis 168, нет ни для одного другого штамма. В то же время работы по транскриптомике и протеомике других видов показывают, что паттерн экспрессии ортологов и паралогов ключевых генов, ответственных за регуляцию основных форм жизненного цикла, в принципе соответствует таковому, который характерен для B. subtilis [74]. Для группы B. cereus есть характеристики отдельных фрагментов цепочек взаимодействий, а для других групп бацилл существуют только феноменологические описания процесса формирования биопленки [74, 75].
Роение (swarming) представляет собой согласованное передвижение клеток бактерий, соединенных между собой специальными пилями. Роение свойственно почти всем штаммам рода Bacillus, но не наблюдается на стандартном лабораторном штамме B. subtilis 168. Анализ других штаммов показывает промежуточный уровень фосфорилирования DegU на фоне эффективной экспрессии генов жгутиков и хемотаксиса под контролем σD.
Для бацилл также характерно синхронное выделение некоторых ферментов, пигментов и других вторичных метаболитов. В случае появления такого рода бистабильности было показано, что состояния бистабильности экспрессии по крайней мере частично контролируются уровнем ортологов SinR, например [76]. Интересно, что экспрессия белков внутриклеточных включений, таких как кристаллические белки B. thuringiensis, может быть контролируема SinR и Spo0A состояниями или независима от жизненных стадий [77, 78].
Фазовые вариации. При росте в экспоненциальной культуре, начиная с поздней лаг-фазы, у многих бактерий с высокой частотой наблюдается переход части клеток между двумя или более фенотипическими состояниями с частичной или полной инактивацией многих локусов. Для бацилл пока нет ясности с механизмами формирования фазовых вариантов. Тем не менее в экспериментах по поточной цитометрии было показано, что линии фазовых вариантов действительно существуют и представляют собой наследуемые фенотипические состояния [24]. Следует отметить, что в некоторых работах “фазовыми вариациями” называются любые эпигенетические переключения.
Клетки-персистеры. Клетки-персистеры представляют собой формы с крайне медленным ростом, у которых заторможено развитие почти всех клеточных функций, обладающих устойчивостью ко многим стрессовым факторам, температуре, антибиотикам, повышенным концентрациям детергентов и др. При снятии стресса выжившие клетки-персистеры прорастают в обычные колонии вегетативных клеток, генетически идентичных исходному штамму. Они были обнаружены уже 80 лет назад у широкого круга бактерий. До недавнего времени было невозможно ни изучить механизм их формирования, ни выяснить, представляют ли они наследуемое эпигенетическое состояние или терминальный вариант специализации клетки [79]. В культурах бацилл клетки-персистеры образуются с низкой частотой (порядка 10–6) [80, 81]. Поскольку клеток-персистеров крайне мало, а их рост сопровождается быстрым переключением в программу обычной вегетативной клетки, их трудно выделить в достаточном количестве для цитологического и молекулярно-биологического исследования. Относительно недавно за счет микрофлюидного анализа индивидуальных клеток-персистеров нескольких видов бактерий, в том числе и B. subtilis, удалось показать передачу данного фенотипа в нескольких поколениях [82]. Механизм образования и поддержания фенотипа персистеров неясен, хотя косвенные данные по персистерам E. сoli и Salmonella enterica дают возможность предположить стохастическое метилирование многих геномных локусов при формировании клетки-персистера, поскольку нокаут некоторых генов метилаз приводил к прекращению появления персистеров в культуре [68]. Исследование библиотек мутантов E. coli с целью выявить штаммы с высокой частотой образования персистеров обнаруживает клоны, в которых инактивированы очень различные гены с плейотропными проявлениями, в некоторых случаях нежизнеспособные без компенсаторных мутаций [83].
L-формы. Представляют собой штаммы бактерий, лишенные нормальной клеточной стенки, формы и регулярной организации элементов цитоскелета, растущие за счет спонтанного отпочковывания нерегулярных выпячиваний. L-формы B. subtilis воспроизводятся как устойчивое эпигенетическое состояние благодаря тому, что для формирования нормальной палочкообразной клетки с нормальной клеточной стенкой необходима иммобилизация протопласта внутри растущей клеточной стенки, хотя сама по себе пептидогликановая оболочка может быть сформирована без затравки для роста в виде матрицы пептидогликана [84, 85].
Старение клеток бацилл. Как уже было сказано, вегетативная бациллярная клетка делится симметрично перетяжкой посередине с участием Z-кольца, образуя морфологически идентичные дочерние клетки. Тем не менее в образующихся клетках можно выделить различающиеся полюса, соответствующие перетяжке более старого и более нового деления. При каждом новом делении один конец бактериальной палочковидной клетки оказывается продуктом последнего деления, а другой соответствует структуре, получившейся в результате деления несколько поколений назад. Соответственно каждой клетке можно приписать рейтинг возраста. Отслеживание судьбы потомков старых клеток B. subtilis показывает, что они образуют субпопуляцию с заметно сниженной скоростью роста [86, 87]. Возможно, в некоторых условиях эффективность споруляции коррелирует с возрастом клетки [87]. Работы, сделанные на E. coli, показали, что стареющий конец клетки активно накапливает агрегаты неправильно свернутых и частично деградировавших белков [88, 89]. Можно предположить, что некоторые адаптивные механизмы, такие как образование мини-клеток E. coli и споруляция бацилл, позволяют избавиться от такого рода структурной наследственности [90]. Аналогичные примеры накопления балластного материала в старых структурах сомы для мицелиальных грибов и дрожжей имеют длительную историю изучения [91, 92].
Общее количество проявлений бистабильности в культуре клеток бацилл огромно и варьирует от штамма, условий и характеристик культуры. Мы предлагаем лишь краткую схему, частично компилирующую изложенные выше представления о бистабильности бацилл. Схема представлена на рис. 2.
РОЛЬ БИСТАБИЛЬНОСТИ ДЛЯ ВЫЖИВАНИЯ В ПРИРОДЕ
Бистабильность играет очень большую роль в выживании бактерий. Это подтверждается тем, что механизмы поддержания бистабильности могут быть достаточно консервативны. Однако прямое исследование значения бистабильности встречается со значительными трудностями. Большинство эволюционно консервативных механизмов поддержания и переключения бистабильности ассоциированы со сложными сигнальными сетями, участвующими в других процессах внутриклеточной регуляции. Нокаут или мутагенез генов, ассоциированных с бистабильностью, приводит к очень многообразным изменениям фенотипа. К тому же не всегда понятно, насколько бистабильность лабораторных штаммов соответствует природным. Так, штамм B. subtilis 168, на котором проведено большинство исследований сигнальных путей бацилл, как указано во многих работах, в процессе доместикации, видимо, утратил многие регуляторные переключатели, а некоторые формы специализированного поведения, такие как роение, свойственные почти всем штаммам рода Bacillus, у него вообще отсутствуют. Кроме того, ситуацию природного биотопа, меняющуюся непрерывно в течение длительного времени, трудно имитировать в лабораторных условиях. Поэтому роль бистабильности в экологии и эволюции изучается на основе косвенных моделей. Гипотезы об ее адаптивной роли следуют традиционным концепциям теории эволюции и эволюционной экологии.
Основные формы специализации клеток бацилл – вегетативные клетки, споруляцию, состояние компетентности, лизис – с точки зрения экологии и эволюционной приспособленности стоит рассматривать скорее как этапы жизненного цикла, чем как параллельно существующие альтернативные состояния. Каждому из них можно приписать четко определенную функцию: споруляция – образование спор длительного хранения, компетентность – обмен генетическим материалом, автолизис – обеспечение выживания части клеток в резко изменившихся условиях и рассев генетического материала в виде ДНК из лизировавшихся клеток. В данном случае популяция может рассматриваться как составной единый организм, а способность к воспроизведению и выживанию в эволюционном процессе проходит проверку на метапопуляционном уровне.
Итак, первая, вполне очевидная гипотеза предполагает, что существование дифференцированных физиологических форм в культуре позволит более эффективно использовать среду. Так, бистабильность с наличием свободноплавающих клеток и клеток в составе биопленки позволяет одновременно осуществить две стратегии в пределах одного первоначального клона. Биопленка способствует удержанию и эффективному использованию секретируемых ферментов, закреплению клеток на субстрате, эффективной борьбе с конкурентами за счет накопления токсинов или формированию устойчивых связей с симбиотическими микроорганизмами, экранированию от вредных внешних воздействий. Пленка также полезна с точки зрения приложения кооперативных воздействий на внешние объекты. Так, например, пленка B. thuringiensis служит местом накопления экзо- и эндотоксинов, выделяемых при споруляции, в составе биопленки, в количестве, достаточном для отравления макроскопических беспозвоночных, используемых в дальнейшем как источник метаболитов. Планктонные клетки служат расселительной стадией, которые могут эффективно скрещиваться. Кооперированное расплывание клеток в виде роения служит средством заселения новой среды в условиях конкуренции. Переключение экспрессии генов метаболических путей может быть использовано для дифференциальной стратегии использования химических веществ.
Аналогичным образом, наличие различных фазеварионов в растущей культуре, вероятно, позволяет отобрать формы, наиболее эффективно растущие в среде, а возможно способствует уменьшению конкуренции растущих клонов за счет специализации потребления метаболитов, имеющихся в среде. Поскольку синтез белковых компонентов определенных метаболических путей является очень ресурсоемким процессом, метаболическая специализация, т.е. выключение промоторов отдельных оперонов или целых групп промоторов экономит ресурсы, при этом обеспечивая достаточно полное использование разнообразия метаболитов среды за счет разнообразия клонов.
Коллективные состояния бактерий подразумевают альтруистическое поведение, выражающееся в том, что клетка тратит ресурсы или снижает собственные шансы на размножение за счет вклада в пользу всей популяции. В связи с этим появляется вероятность отклонений за счет спонтанных мутаций в сторону эгоистического поведения – отказа от энергоемкого синтеза метаболитов, торможения деления или программируемой смерти. Действительно клетки-мутанты, названные читерами, способные обходить механизмы, регулирующие коллективное поведение, были найдены. Одновременно с этим были обнаружены и эволюционные механизмы, позволяющие сообществу бактерий подавлять такого рода эффекты, аналогично многоклеточному организму [93, 94].
Вторая гипотеза, которую следует иметь в виду, что бистабильность в каждом конкретном случае вообще может не являться адаптивным признаком. Возможно, что наблюдаемая в лабораторных условиях бистабильность не является релевантной для природных штаммов в реальной среде обитания. Так, например, адаптивная роль эпигенетического переключателя Psi+ в дрожжах S. cerevisisiae [95] оказалась заметной лишь в лабораторных штаммах на фоне мутантных аллелей, не отмеченных в природных штаммах, а само эпигенетическое переключение в природе не наблюдается [96]. При этом хотя сама по себе бистабильность не является адаптивным фактором, но может быть вторичным проявлением важного функционирующего механизма. Так, петля положительной обратной связи необязательно должна проявляться в форме бистабильных состояний, а может быть лишь способом усиления сигнала. Таким образом, бистабильность в виде измененного эпигенетического состояния может оказаться всего лишь проявлением амплифицированного сигнала внутри пошедшего в разнос регуляторного механизма. Интересно, что если механизм играет важную роль, то гены, участвующие в формировании такой бистабильности, будут достаточно консервативными, как и само явление.
Третья гипотеза предполагает, что существование промежуточного состояния при переключении невыгодно с энергетической точки зрения. Так, экспрессия генов по принципу “все или ничего” при экспрессии с регуляторных случаев предпочтительна с точки зрения экономии ресурсов при промежуточной концентрации индукторов. Например, это характерно для регуляции оперонов при помощи репрессоров LacI-GalR группы, таких как CcpA в B. subtilis и его ортологов. Видимо, гетерогенность уровня экспрессии генов (expression noise) является важным фактором функционирования клетки. В некоторых случаях он может быть полезен для создания гетерогенности физиологических состояний в популяции и извлечения из этого кооперативной выгоды, в некоторых подвергаться жесткому ограничению при помощи специальных механизмов. Побочным эффектом такой регуляции может быть появление стабильно воспроизводящихся альтернативных состояний.
Четвертая гипотеза “хеджирование рисков” (bet-hedging) – наличие долгосрочной стратегии выживания в череде поколений в меняющихся условиях. Она предполагает распределение рисков неопределенности среди нескольких по-разному дифференцированных растущих клонов. При этом пониженная адаптивность каждого из клонов в каждом из состояний среды компенсируется их наследственным фенотипическим разнообразием, адаптивные ресурсы которого перекрывают в какой-то степени возможную вариативность среды. Таким образом, можно ожидать расширенное воспроизведение хотя бы некоторых из клонов культуры в изменившихся условиях среды. Можно предположить, что все эпигенетически наследуемые состояния клетки и культуры подвержены контролю балансирующего отбора (balancing selection) и/или являются его результатом. Эта гипотеза является одним из важнейших элементов общей теории эволюции, поэтому изучение и моделирование этого феномена вызвало большой интерес. Поскольку для микроорганизмов пока изучение сложных популяционно-генетических явлений на уровне отдельных клеток в природе пока невозможно, изучение касалось построения математических моделей и моделирования эволюционного процесса в бактериальной культуре. Так, в одной работе проводился отбор в популяции Pseudomonas fluorescens в ряду поколений с периодической сменой направления отбора на противоположный [97]. В течение нескольких циклов отбора альтернативные фенотипы получались за счет геномных мутаций. Примерно через 10 циклов мутагенеза среди получаемых клонов с измененным фенотипом отобрались также “эпигенетические мутаторы”, т.е. генотипы, позволяющие поддерживать соответствующие эпигенетически наследуемые фенотипы и переключать их с некоторой частотой. Штаммы рода Bacillus изучались в экспериментах по искусственной эволюции в лаборатории и очевидно, что эволюция затрагивала гены, связанные с бистабильностью, однако прямых результатов формирования эпигенетических механизмов у бацилл в ходе лабораторных исследований пока не опубликовано [98].
Подобные наблюдения позволяют предполагать, что важнейшие регуляторы в основных системах жизнеобеспечения клетки должны содержать в себе возможность поддержания эпигенетического переключения и наследования приобретенных состояний, поскольку линии клеток микроорганизмов подвергаются постоянному воздействию балансирующего отбора. Эта концепция находит подтверждение в том, что среди белков, основных регуляторов клеточных процессов, вероятно имеется значительная доля имеющих консенсусы для формирования альтернативных состояний [49]. Такого типа механизм позволяет за счет спорадических переключений формировать приспособленность в изменившихся условиях, без изменения последовательности ДНК, что может сопровождаться необратимой потерей функциональности гена [97]. В то же время математический анализ показывает, что слишком высокая эпигенетическая лабильность большого количества механизмов является эволюционно тупиковой стратегией [99].
ЗНАЧЕНИЕ ДЛЯ ПРИРОДНОЙ СРЕДЫ И ЧЕЛОВЕКА
Наличие специализированных состояний клеток бацилл по основной схеме жизненного цикла (вегетативные клетки (1), споруляция (2), компетентность (3) и лизис (4)) является основой для планирования генетических и физиологических манипуляций в лаборатории, планирования и моделирования поведения клеток бацилл в природе. В ходе лабораторных процедур основные состояния специализации клеток бацилл используются с целью получения биомассы (1, 2) и ДНК-трансформации (1, 3), экспрессии соответствующего рекомбинантного гена (1, 2), долговременного хранения культуры (1, 2) [20].
С точки зрения биотехнологии существование бистабильности бацилл критично, поскольку это один из главных механизмов, позволяющий бактериям избегать контроля лимитирующих факторов среды. Гетерогенность бактериальной культуры снижает универсальность и воспроизводимость биотехнологических процессов. При использовании бацилл в сельскохозяйственном и пищевом производстве это может способствовать появлению форм с непредсказуемыми характеристиками. Повышенная устойчивость бацилл в биопленке к ряду неблагоприятных воздействий, в том числе к антибактериальным агентам, и долговременное выживание бактериальных спор в матриксе биопленки породили целую науку о методах, позволяющих преодолеть эту устойчивость [100]. Биопленки, неравномерная споруляция, частичный лизис культуры создают трудности для эффективного отделения продуктов секреции бацилл, накопленных в жидкой культуральной среде, от клеток. В то же время многие процессы с участием бациллярных клеток в природе и технологических процессах целиком зависят от динамики воспроизведения планктонных и иммобилизованных форм, например процессы биологической деградации силикатных пород B. mucilaginosus, B. edaphicus и др. [101].
ЗАКЛЮЧЕНИЕ
В клетках развивающейся популяции бацилл постоянно происходит смена программ поведения, зависящая от окружения или предопределенная предыдущим развитием. Значительная доля таких переключений достаточно долговременна и может самоподдерживаться. Эпигенетическое переключение может быть кооперативным или стохастическим. Представление о клетке бацилл как о структуре, не обладающей морфологической сложностью достаточной для воспроизведения многих альтернативных состояний, ушло в прошлое. Методы нового поколения (геномного секвенирования, компьютерного моделирования на основе обширных баз данных, массового трекинга состояний отдельной клетки бацилл) позволяют более аккуратно выявить механизмы поддержания бистабильных состояний. Роль бистабильности, как в природных используемых штаммах бацилл очень велика. Она в значительной степени определяет экологический и биотехнологический потенциал штаммов рода Bacillus. Тем не менее изучение бистабильности бацилл сильно отстает от исследования других модельных организмов E. coli, P. fluorescens, S. cerevisiae. Остается неясной значимость широкого разнообразия метилтрансфераз бацилл с точки зрения бистабильности. Гипотетическими остаются механизмы формирования фазовых вариаций растущей культуры. Непонятно, какую роль играют клеточные контакты в биопленке и других коллективных взаимодействиях, и в отличие от Pseudomonas sp. неясно даже, как устроены сенсорные механизмы такого взаимодействия. Неясны механизмы, контролирующие роение. Нет данных о весьма вероятной кооперативной агрегации многочисленных амилоидных белков. Частично меньшая изученность связана с широким разнообразием проявлений бистабильности, с менее удобными репортерными системами. Кроме того, практически вся схема внутриклеточных и межклеточных взаимодействий была построена на изучении единственного лабораторного штамма B. subtilis 168, который представляет лишь одну группу внутри рода Bacillus и к тому же утратил многие элементы сигнальных сетей вследствие отбора при доместикации.
Можно предположить, что наибольший прогресс в изучении бистабильности бацилл следует ожидать за счет вовлечения в исследования широкого разнообразия природных штаммов, вовлечения новых математических моделей; необходимо сделать упор на недостаточно до сих пор изучавшиеся и гипотетические механизмы, такие как конформационные переходы белков (прионы), структурное наследование и роль нетранслируемых РНК. Это позволит расширить представление об имеющихся механизмах формирования бистабильного состояния у бактерий рода Bacillus.
Работа поддержана Министерством науки и высшего образования Российской Федерации в рамках госзадания (Южный федеральный университет, проект № 0852-2020-0029).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Шарипова М.Р., Марданова А.М., Рудакова Н.Л. и др. Бистабильность и формирование матрикса биопленки как механизмы адаптации Bacillus subtilis в стационарной фазе // Микробиология. 2021. Т. 90. № 1.
Hartwell L. Genetics: From Genes to Genomes. Boston: McGraw-Hill Higher Education, 2008. 827 p.
Gunka K., Tholen S., Gerwig J. et al. A high-frequency mutation in Bacillus subtilis: Requirements for the decryptification of the gudB glutamate dehydrogenase gene // J. Bacteriol. 2012. V. 194. № 5. P. 1036–1044. https://doi.org/10.1128/JB.06470-11
Casadesús J., Low D. Epigenetic gene regulation in the bacterial world // Microbiol. Mol. Biol. Rev. Am. Soc. Microbiol. 2006. V. 70. № 3. P. 830–856.
Coleman W. Cell, nucleus, and inheritance: An historical study // Proc. Am. Philos. Soc. 1965. V. 109. № 3. P. 124–158.
Deichmann U. Epigenetics: The origins and evolution of a fashionable topic // Dev. Biol. 2016. V. 416. № 1. P. 249–254. https://doi.org/10.1016/j.ydbio.2016.06.005
Kützing F.T. Phycologia Generalis: oder Anatomie, Physiologie und Systemkunde der Tange. Leipzig, 1843. 458 p.
Berkeley M.J. Notices of North American fungi // Grevillea. 1874. V. 3. № 25. P. 1–17.
Strick J.E., Gradmann E. Laboratory disease: Robert Koch’s medical bacteriology // Br. J. Hist. Sci. 2011. V. 44. № 1. P. 140.
Felsenfeld G. A brief history of epigenetics // Cold Spring Harb. Perspect. Biol. 2014. V. 6. № 1. P. a018200. https://doi.org/10.1101/cshperspect.a018200
Rizet G. Les phenomenes de barrage chez Podospora anserina: Analyse genetique des barrages entre les souches s et S // Rev. Cytol. Biol. Veg. 1952. V. 13. P. 51–92.
Cox B.S. Ψ, A cytoplasmic suppressor of super-suppressor in yeast: 4 // Heredity. 1965. V. 20. № 4. P. 505–521.
Klieneberger E. The natural occurrence of pleuro-pneumonia-like organisms in apparent symbiosis with Streptobacillus moniliformis and other bacteria // J. Pathol. Bacteriol. 1935. V. 40. P. 93–105.
Bigger J.W. Treatment of Staphyloeoeeal infections with penicillin by intermittent sterilisation // Lancet. 1944. P. 497–500.
PubMed [Electronic resource] // PubMed. URL: https://pubmed.ncbi.nlm.nih.gov/ (accessed: 17.12.2020).
Anagnostopoulos C., Spizizen J. Requirements for transformation in Bacillus subtilis // J. Bacteriol. 1961. V. 81. № 5. P. 741–746. https://doi.org/10.1128/jb.81.5.741-746.1961
Deans C., Maggert K.A. What Do You Mean, “Epigenetic”? // Genetics. 2015. V. 199. № 4. P. 887–896. https://doi.org/10.1534/genetics.114.173492
Epigenetics in human disease and prospects for epigenetic therapy | Nature [Electronic resource]. URL: https://www.nature.com/articles/nature02625?free=2 (accessed: 15.12.2020).
Portela A., Esteller M. Epigenetic modifications and human disease: 10 // Nat. Biotechnol. 2010. V. 28. № 10. P. 1057–1068.
Harwood C.R., Cutting S.M. Molecular Biological Methods for Bacillus. Wiley, 1990. 581 p.
Goodwin S., McPherson J.D., McCombie W.R. Coming of age: ten years of next-generation sequencing technologies: 6 // Nat. Rev. Genet. 2016. V. 17. № 6. P. 333–351. https://doi.org/10.1038/nrg.2016.49
Beaulaurier J., Schadt E.E., Fang G. Deciphering bacterial epigenomes using modern sequencing technologies: 3 // Nat. Rev. Genet. 2019. V. 20. № 3. P. 157–172. https://doi.org/10.1038/s41576-018-0081-3
Smits W.K., Veening J.-W., Kuipers O.P. Phenotypic variation and bistable switching in bacteria // Bacterial Physiology: A Molecular Approach / Ed. El-Sharoud W. Berlin; Heidelberg: Springer, 2008. P. 339–365. https://doi.org/10.1007/978-3-540-74921-9_12
Ambriz-Aviña V., Contreras-Garduño J.A., Pedraza-Reyes M. Applications of flow cytometry to characterize bacterial physiological responses // BioMed Res. Int. Hindawi. 2014. V. 2014. P. e461941. https://doi.org/10.1155/2014/461941
Tewari Kumar P., Decrop D., Safdar S. et al. Digital microfluidics for single bacteria capture and selective retrieval using optical tweezers: 3 // Micromachines. Multidisciplinary Digital Publ. Institute. 2020. V. 11. № 3. P. 308. https://doi.org/10.3390/mi11030308
Reel P.S., Reel S., Pearson E. et al. Using machine learning approaches for multi-omics data analysis: A review // Biotechnol. Adv. 2021. V. 49. P. 107739. https://doi.org/10.1016/j.biotechadv.2021.107739
Zhang M., Zhang J., Wang Y. et al. Non-invasive single-cell morphometry in living bacterial biofilms: 1 // Nat. Commun. 2020. V. 11. № 1. P. 6151. https://doi.org/10.1038/s41467-020-19866-8
Murray E.J., Kiley T.B., Stanley-Wall N.R.Y. A pivotal role for the response regulator DegU in controlling multicellular behaviour // Microbiology. 2009. V. 155. № 1. P. 1–8. https://doi.org/10.1099/mic.0.023903-0
Barreto H.C., Cordeiro T.N., Henriques A.O. et al. Rampant loss of social traits during domestication of a Bacillus subtilis natural isolate: 1 // Sci. Rep. Nature Publ. Group. 2020. V. 10. № 1. P. 18886. https://doi.org/10.1038/s41598-020-76017-1
Omer Bendori S., Pollak S., Hizi D. et al. The RapP-PhrP quorum-sensing system of Bacillus subtilis strain NCIB3610 affects biofilm formation through multiple targets, due to an atypical signal-insensitive allele of RapP // J. Bacteriol. 2015. V. 197. № 3. P. 592–602. https://doi.org/10.1128/JB.02382-14
Robert L., Paul G., Chen Y. et al. Pre-dispositions and epigenetic inheritance in the Escherichia coli lactose operon bistable switch // Mol. Syst. Biol. 2010. V. 6. № 1. P. 357. https://doi.org/10.1038/msb.2010.12
Díaz-Hernández O., Santillán M. Bistable behavior of the lac operon in E. coli when induced with a mixture of lactose and TMG // Front. Physiol. 2010. V. 1. P. 158. https://doi.org/10.3389/fphys.2010.00022
Wang X., Jiang S., Deng Z. et al. Genetic variants of the oppA gene are involved in metabolic regulation of surfactin in Bacillus subtilis // Microb. Cell Factories. 2019. V. 18. № 1. P. 1–12. https://doi.org/10.1093/femsre/fuy036
Sánchez-Romero M.A., Cota I., Casadesús J. DNA methylation in bacteria: from the methyl group to the methylome // Curr. Opin. Microbiol. 2015. V. 25. P. 9–16. https://doi.org/10.1016/j.mib.2015.03.004
Trautner T.A., Pawlek B., Bron S. et al. Restriction and modification in B. subtilis // Mol. Gen. Genet. MGG. 1974. V. 131. № 3. P. 181–191. https://doi.org/10.1007/BF00267958
Sitaraman R. The role of DNA restriction-modification systems in the biology of Bacillus anthracis // Front. Microbiol. 2016. V. 7. P. 11. https://doi.org/10.3389/fmicb.2016.00011
Liu G., Jiang Y.M., Liu Y.C. et al. A novel DNA methylation motif identified in Bacillus pumilus BA06 and possible roles in the regulation of gene expression // Appl. Microbiol. Biotechnol. 2020. V. 104. № 8. P. 3445–3457. https://doi.org/10.1007/s00253-020-10475-5
Guha S., Guschibauer W. Expression of Escherichia coli dam gene in Bacillus subtilis provokes DNA damage response: N6–methyladenine is removed by two repair pathways // Nucl. Acids Res. 1992. V. 20. № 14. P. 3607–3615. https://doi.org/10.1093/nar/20.14.3607
Low D.A., Casadesús J. Clocks and switches: Bacterial gene regulation by DNA adenine methylation // Curr. Opin. Microbiol. 2008. V. 11. № 2. P. 106–112. https://doi.org/10.1016/j.mib.2008.02.012
Nye T.M., van Gijtenbeek L.A., Stevens A.G. et al. Methyltransferase DnmA is responsible for genome-wide N6-methyladenosine modifications at non-palindromic recognition sites in Bacillus subtilis // Nucl. Acids Res. 2020. V. 48. № 10. P. 5332–5348. https://doi.org/10.1093/nar/gkaa266
Olivenza D.R., Nicoloff H., Sánchez-Romero M.A. et al. A portable epigenetic switch for bistable gene expression in bacteria: 1 // Sci. Rep. 2019. V. 9. № 1. P. 11261. https://doi.org/10.1038/s41598-019-47650-2
Taghbalout A., Landoulsi A., Kern R. et al. Competition between the replication initiator DnaA and the sequestration factor SeqA for binding to the hemimethylated chromosomal origin of E. coli in vitro // Genes Cells. 2000. V. 5. № 11. P. 873–884. https://doi.org/10.1046/j.1365-2443.2000.00380.x
Haldenwang W.G. The sigma factors of Bacillus subtilis // Microbiol Rev. 1995. V. 59. № 1. P. 1–30. https://doi.org/10.1128/mr.59.1.1-30.1995
Zhu B., Stülke J. SubtiWiki in 2018: from genes and proteins to functional network annotation of the model organism Bacillus subtilis // Nucl. Acids Res. 2018. V. 46. № D1. P. D743–D748.
Mauri M., Klumpp S. A model for sigma factor competition in bacterial cells // PLoS Comput. Biol. 2014. V. 10. № 10. P. e1003845. https://doi.org/10.1371/journal.pcbi.1003845
Steuten B., Hoch P.G., Damm K. et al. Regulation of transcription by 6S RNAs // RNA Biol. 2014. V. 11. № 5. P. 508–521. https://doi.org/10.4161/rna.28827
Fabret C., Feher V.A., Hoch J.A. Two-component signal transduction in Bacillus subtilis: how one organism sees its world // J. Bacteriol. 1999. V. 181. № 7. P. 1975–1983. https://doi.org/10.1128/JB.181.7.1975-1983.1999
O’Toole G.A., Wong G.C. Sensational biofilms: surface sensing in bacteria // Curr. Opin. Microbiol. 2016. V. 30. P. 139–146. https://doi.org/10.1016/j.mib.2016.02.004
Iglesias V., de Groot N.S., Ventura S. Computational analysis of candidate prion-like proteins in bacteria and their role // Front. Microbiol. 2015. V. 6. P. 1123. https://doi.org/10.3389/fmicb.2015.01123
Bieler S., Estrada L., Lagos R. et al. Amyloid formation modulates the biological activity of a bacterial protein // J. Biol. Chem. 2005. V. 280. № 29. P. 26880–26885. Epub 2005 May 25. PMID: 15917245.https://doi.org/10.1074/jbc.M50203120015917245
Yuan A.H., Hochschild A. A bacterial global regulator forms a prion // Science. 2017. V. 355. № 6321. P. 198–201. https://doi.org/10.1126/science.aai7776
Shahnawaz M., Park K.W., Mukherjee A. et al. Prion-like characteristics of the bacterial protein Microcin E492: 1 // Sci. Rep. 2017. V. 7. № 1. P. 45720. https://doi.org/10.1038/srep45720
Otzen D., Riek R. Functional Amyloids // Cold Spring Harb. Perspect. Biol. 2019. V. 11. № 12. P. a033860. https://doi.org/10.1101/cshperspect.a033860
Kassinger S.J., van Hoek M.L. Biofilm architecture: An emerging synthetic biology target // Synth. Syst. Biotechnol. 2020. V. 5. № 1. P. 1–10. https://doi.org/10.1016/j.synbio.2020.01.001
Kalamara M., Spacapan M., Mandic-Mulec I. et al. Social behaviours by Bacillus subtilis: quorum sensing, kin discrimination and beyond // Mol. Microbiol. 2018. V. 110. № 6. P. 863–878. https://doi.org/10.1111/mmi.14127
Gastélum G., de la Torre M., Rocha J. Rap protein paralogs of Bacillus thuringiensis: A multifunctional and redundant regulatory repertoire for the control of collective functions // J. Bacteriol. 2020. V. 202. № 6. P. e00747-19. https://doi.org/10.1128/JB.00747-19
Bailly-Bechet M., Benecke A., Hardt W.D. et al. An externally modulated, noise-driven switch for the regulation of SPI1 in Salmonella enterica serovar Typhimurium // J. Math. Biol. 2011. V. 63. № 4. P. 637–662.
Silva-Rocha R., de Lorenzo V. Noise and robustness in prokaryotic regulatory networks // Annu. Rev. Microbiol. 2010. V. 64. № 1. P. 257–275.
Wassarman K.M. 6S RNA, a global regulator of transcription // Regulating with RNA in Bacteria and Archaea. John Wiley & Sons, Ltd., 2018. P. 355–367. https://doi.org/10.1128/microbiolspec.RWR-0019-2018
Burenina O.Y., Hoch P.G., Damm K. et al. Mechanistic comparison of Bacillus subtilis 6S-1 and 6S-2 RNAs–commonalities and differences // RNA. 2014. V. 20. № 3. P. 348–359. https://doi.org/10.1261/rna.042077.113
Mutlu A., Trauth S., Ziesack M. et al. Phenotypic memory in Bacillus subtilis links dormancy entry and exit by a spore quantity-quality tradeoff: 1 // Nat. Commun. 2018. V. 9. № 1. P. 69. https://doi.org/10.1038/s41467-017-02477-1
Freyre-González J.A., Manjarrez-Casas A.M., Merino E. et al. Lessons from the modular organization of the transcriptional regulatory network of Bacillus subtilis // BMC Syst. Biol. 2013. V. 7. № 1. P. 127. https://doi.org/10.1186/1752-0509-7-127
Schultz D., Wolynes P.G., Ben Jacob E. et al. Deciding fate in adverse times: Sporulation and competence in Bacillus subtilis // Proc. Natl Acad. Sci. USA. 2009. V. 106. № 50. P. 21027–21034. https://doi.org/10.1073/pnas.0912185106
Faria J.P., Overbeek R., Taylor R.C. et al. Reconstruction of the regulatory network for Bacillus subtilis and reconciliation with gene expression data // Front. Microbiol. 2016. V. 7. P. 275. https://doi.org/10.3389/fmicb.2016.00275
Vlamakis H., Chai Y., Beauregard P. et al. Sticking together: Building a biofilm the Bacillus subtilis way: 3 // Nat. Rev. Microbiol. 2013. V. 11. № 3. P. 157–168. https://doi.org/10.1038/nrmicro2960
Cairns L.S., Hobley L., Stanley-Wall N.R. Biofilm formation by Bacillus subtilis: New insights into regulatory strategies and assembly mechanisms // Mol. Microbiol. 2014. V. 93. № 4. P. 587–598. https://doi.org/10.1111/mmi.12697
Steinberg N., Kolodkin-Gal I. The matrix reloaded: Probing the extracellular matrix synchronizes bacterial communities // J. Bacteriol. 2015. V. 197. № 13. P. 2092–2103. https://doi.org/10.1128/JB.02516-14
Xu Y.Y., Liu S., Zhang Y. et al. Role of DNA methylation in persister formation in uropathogenic E. coli // bioRxiv. 2020. P. 2020.01.07.897686. https://doi.org/10.1101/2020.01.07.897686
Mirończuk A.M., Kovács Á.T., Kuipers O.P. Induction of natural competence in Bacillus cereus ATCC14579 // Microb. Biotechnol. 2008. V. 1. № 3. P. 226–235. https://doi.org/10.1111/j.1751-7915.2008.00023.x
Attaiech L., Charpentier X. Silently transformable: The many ways bacteria conceal their built-in capacity of genetic exchange // Curr. Genet. 2017. V. 63. № 3. P. 451–455. https://doi.org/10.1007/s00294-016-0663-6
Tan I.S., Ramamurthi K.S. Spore formation in Bacillus subtilis // Environ. Microbiol. Rep. 2014. V. 6. № 3. P. 212–225. https://doi.org/10.1111/1758-2229.12130
Errington J. Regulation of endospore formation in Bacillus subtilis: 2 // Nat. Rev. Microbiol. 2003. V. 1. № 2. P. 117–126. https://doi.org/10.1038/nrmicro750
Engelberg-Kulka H., Amitai S., Kolodkin-Gal I. et al. Bacterial programmed cell death and multicellular behavior in bacteria // PLOS Genet. 2006. V. 2. № 10. P. e135. https://doi.org/10.1371/journal.pgen.0020135
Caro-Astorga J., Frenzel E., Perkins J.R. et al. Biofilm formation displays intrinsic offensive and defensive features of Bacillus cereus: 1 // Npj Biofilms Microbiomes. 2020. V. 6. № 1. P. 1–15. https://doi.org/10.1038/s41522-019-0112-7
Majed R., Faille C., Kallassy M. et al. Bacillus cereus Biofilms–Same, Only Different // Front. Microbiol. 2016. V. 7. P. 1054. https://doi.org/10.3389/fmicb.2016.01054
Pflughoeft K.J., Sumby P., Koehler T.M. Bacillus anthracis sin locus and regulation of secreted proteases // J. Bacteriol. Am. Soc. Microbiol. 2011. V. 193. № 3. P. 631–639. https://doi.org/10.1128/JB.01083-10
Fagerlund A., Dubois T., Økstad O.A. et al. SinR controls enterotoxin expression in Bacillus thuringiensis biofilms // PLoS One. 2014. V. 9. № 1. P. e87532. https://doi.org/10.1371/journal.pone.0087532
Grandvalet C., Gominet M., Lereclus D. Identification of genes involved in the activation of the Bacillus thuringiensis inhA metalloprotease gene at the onset of sporulation. The GenBank/EMBL/DDBJ accession number for the sequence reported in this paper is AF287346 // Microbiology. 2001. V. 147. № 7. P. 1805–1813. https://doi.org/10.1099/00221287-147-7-1805
Balaban N.Q., Merrin J., Chait R. et al. Bacterial persistence as a phenotypic switch // Science. 2004. V. 305. № 5690. P. 1622–1625. https://doi.org/10.1126/science.1099390
Day T. Interpreting phenotypic antibiotic tolerance and persister cells as evolution via epigenetic inheritance // Mol. Ecol. 2016. V. 25. № 8. P. 1869–1882. https://doi.org/10.1111/mec.13603
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. № 1. P. 357–372. https://doi.org/10.1146/annurev.micro.112408.134306
Manuse S., Shan Y., Canas-Duarte S.J. et al. Bacterial persisters are a stochastically formed subpopulation of low-energy cells // PLoS Biol. 2021. V. 19. № 4. P. e3001194. https://doi.org/10.1371/journal.pbio.3001194
Windels E.M., Michiels J.E., Fauvart M. et al. Bacterial persistence promotes the evolution of antibiotic resistance by increasing survival and mutation rates: 5 // ISME J. 2019. V. 13. № 5. P. 1239–1251. https://doi.org/10.1038/s41396-019-0344-9
Mercier R., Kawai Y., Errington J. General principles for the formation and proliferation of a wall-free (L-form) state in bacteria // eLife. 2014. V. 3. P. e04629. https://doi.org/10.7554/eLife.04629
Domínguez-Cuevas P., Mercier R., Leaver M. et al. The rod to L-form transition of Bacillus subtilis is limited by a requirement for the protoplast to escape from the cell wall sacculus // Mol. Microbiol. 2012. V. 83. № 1. P. 52–66. https://doi.org/10.1111/j.1365-2958.2011.07920.x
Veening J.-W., Stewart E.J., Berngruber T.W. et al. Bet-hedging and epigenetic inheritance in bacterial cell development // Proc. Natl Acad. Sci. USA. 2008. V. 105. № 11. P. 4393–4398. https://doi.org/10.1073/pnas.0700463105
Dunn G., Mandelstam J. Cell polarity in Bacillus subtilis: Effect of growth conditions on spore positions in sister cells // J. Gen. Microbiol. 1977. V. 103. № 1. P. 201–205. https://doi.org/10.1099/00221287-103-1-201
Rokney A., Shagan M., Kessel M. et al. E. coli transports aggregated proteins to the poles by a specific and energy-dependent process // J. Mol. Biol. 2009. V. 392. № 3. P. 589–601. https://doi.org/10.1016/j.jmb.2009.07.009
Winkler J., Seybert A., König L. et al. Quantitative and spatio-temporal features of protein aggregation in Escherichia coli and consequences on protein quality control and cellular ageing // EMBO J. 2010. V. 29. № 5. P. 910–923. https://doi.org/10.1038/emboj.2009.412
Rang C.U., Proenca A., Buetz C. et al. Minicells as a damage disposal mechanism in Escherichia coli // mSphere. 2018. V. 3. № 5. P.e00428-18. https://doi.org/10.1128/mSphere.00428-18
He C., Zhou C., Kennedy B.K. The yeast replicative aging model // Biochim. Biophys. Acta BBA – Mol. Basis Dis. 2018. V. 1864. № 9. Part A. P. 2690–2696. https://doi.org/10.1016/j.bbadis.2018.02.023
Osiewacz H.D. Genes, mitochondria and aging in filamentous fungi // Ageing Res. Rev. 2002. V. 1. № 3. P. 425–442. https://doi.org/10.1016/s1568-1637(02)00010-7
Martin M., Dragos A., Otto S.B. et al. Cheaters shape the evolution of phenotypic heterogeneity in Bacillus subtilis biofilms: 9 // ISME J. 2020. V. 14. № 9. P. 2302–2312.
Lyons N.A., Kolter R. A single mutation in rapP induces cheating to prevent cheating in Bacillus subtilis by minimizing public good production: 1 // Commun. Biol. 2018. V. 1. № 1. P. 1–12. https://doi.org/10.1038/s42003-018-0136-1
True H.L., Lindquist S.L. A yeast prion provides a mechanism for genetic variation and phenotypic diversity: 6803 // Nature. 2000. V. 407. № 6803. P. 477–483. https://doi.org/10.1038/35035005
Wickner R.B., Edskes H.K., Bateman D. et al. The yeast prions [PSI+] and [URE3] are molecular degenerative diseases // Prion. 2011. V. 5. № 4. P. 258–262. https://doi.org/10.4161/pri.17748
Beaumont H.J., Gallie J., Kost C. et al. Experimental evolution of bet hedging // Nature. 2009. V. 462. № 7269. P. 90–93. https://doi.org/10.1038/nature08504
Kovács Á.T., Dragoš A. Evolved biofilm: Review on the experimental evolution studies of Bacillus subtilis pellicles // J. Mol. Biol. 2019. V. 431. № 23. P. 4749–4759. https://doi.org/10.1016/j.jmb.2019.02.005
Libby E., Ratcliff W.C. Shortsighted evolution constrains the efficacy of long-term bet hedging // Am. Nat. 2019. V. 193. № 3. P. 409–423. https://doi.org/10.1086/701786
Sharma D., Misba L., Khan A.U. Antibiotics versus biofilm: An emerging battleground in microbial communities // Antimicrob. Resist. Infect. Control. 2019. V. 8. № 1. P. 76. https://doi.org/10.1186/s13756-019-0533-3
Etesami H., Emami S., Alikhani H.A. Potassium solubilizing bacteria (KSB): Mechanisms, promotion of plant growth, and future prospects – A review // J. Soil Sci. Plant Nutr. 2017. V. 17. № 4. P. 897–911. https://doi.org/10.4067/S0718-95162017000400005
Дополнительные материалы отсутствуют.