Генетика, 2022, T. 58, № 1, стр. 27-34
Перспектива внедрения аллеля Ppd-D1a в сорта яровой мягкой пшеницы в России
С. Б. Лепехов *
Федеральный Алтайский научный центр агробиотехнологий
656910 Барнаул, Россия
* E-mail: sergei.lepehov@yandex.ru
Поступила в редакцию 10.03.2021
После доработки 13.04.2021
Принята к публикации 12.05.2021
- EDN: KXRETF
- DOI: 10.31857/S0016675822010064
Аннотация
Сорта яровой мягкой пшеницы с аллелью Ppd-D1a нечувствительны к фотопериоду и широко распространены в мире. В России подавляющее большинство сортов яровой мягкой пшеницы чувствительны к длине светового дня. Внедрение аллеля Ppd-D1a в российские сорта яровой мягкой пшеницы позволит ускорить селекционный процесс, используя одну–две дополнительные вегетации в год. Цели работы: 1) рассмотреть закономерности распространения аллеля Ppd-D1a среди яровой мягкой пшеницы северного полушария, 2) выявить влияние аллеля Ppd-D1a на агрономические признаки яровой мягкой пшеницы, 3) наметить основные пути селекционной работы при создании российских сортов яровой мягкой пшеницы, нечувствительной к фотопериоду. Частота встречаемости аллеля Ppd-D1a возрастает от стран верхних широт к странам нижних широт. Влияние аллеля Ppd-D1a на агрономические признаки зависит от географической широты проведения эксперимента и сводится к сокращению периода “всходы – колошение”, к снижению высоты растения, количества колосков в колосе и содержания белка в зерне, к повышению продолжительности функционирования листьев после колошения. Аллель Ppd-D1a оказывает отрицательное влияние на урожайность пшеницы севернее 50° с.ш. Высокая встречаемость аллеля Ppd-D1a в канадских сортах яровой мягкой пшеницы свидетельствует о том, что данный аллель может получить распространение в некоторых регионах России. Отрицательные эффекты, вызванные наличием аллеля Ppd-D1a, могут быть компенсированы обоснованным подбором родительских пар для гибридизации.
На длительность периода “всходы–колошение” у мягкой пшеницы влияют три генетические системы: гены чувствительности к яровизации – Vrn, гены чувствительности к фотопериоду – Ppd и гены Eps (earliness per se) [1]. Гены чувствительности к яровизации и фотопериоду ускоряют или замедляют наступление колошения у пшеницы в зависимости от стимулов окружающей среды [2]. Например, в высокоширотных регионах северного полушария гены чувствительности к яровизации задерживают развитие колоса у озимых сортов, для избежания повреждения органов цветка низкими температурами зимой. В регионах, где лето слишком жаркое, гены нечувствительности к фотопериоду ускоряют развитие колоса, чтобы растение успело вступить в репродуктивную фазу до наступления жары [3].
Пшеница относится к растениям длинного светового дня, но нечувствительность к фотопериоду – это важная составляющая ее изменений в ходе Зеленой революции [4]. Реакция различных генотипов на фотопериод находится под контролем серии генов чувствительности к фотопериоду (Ppd) [5]. На сегодняшний день идентифицировано три таких гена, включая Ppd-A1, Ppd-B1 и Ppd-D1, локализованных на хромосомах 2A, 2B и 2D соотетственно [6, 7]. Аналогично генетической системе Vrn (за исключением Vrn-B1), доминантные аллели локуса Ppd (Ppd1a) придают растению нечувствительность к длине светового дня, а рецессивные аллели (Ppd1b) детерминируют чувствительность к фотопериоду [8]. Ген Ppd-D1 обладает самым сильным эффектом. За ним по силе влияния следуют Ppd-B1 и Ppd-A1 [9]. Различия между аллелями гена Ppd-D1 вызваны делецией 2089 пн у аллеля Ppd-D1a. Аллель нечувствительности к фотопериоду Ppd-D1a гексаплоидной пшеницы на самом деле экспрессируется неправильно, то есть активируется без сигнала окружающей среды или продолжительности дня и изменяет экспрессию ключевого цветочного регулятора FT, вызывая более раннее цветение [4].
Низкая фотопериодическая чувствительность важна для сортов, возделываемых на широте южнее 45° с.ш., где световой день может быть коротким [10]. Пшеница с аллелем Ppd-D1a имеет одинаковый период от всходов до колошения как при коротком (<10 ч), так и при длинном световом (>16 ч) дне. Чувствительная к фотопериоду пшеница с аллелем Ppd-D1b при коротком дне существенно задерживает колошение. Нечувствительность к фотопериоду позволяет получать несколько урожаев в год [11] или проводить посев в отличное от традиционной для России посевной кампании время года, то есть не поздней весной. Внедрение аллеля Ppd-D1a в российские сорта яровой мягкой пшеницы позволит ускорить селекционный процесс, используя одну–две дополнительные вегетации в год. В масштабном сравнении сортов яровой мягкой пшеницы, созданных в Северном Казахстане, Западной Сибири, канадских прериях, севере США, Северо-Восточном Китае и генотипов из СИММИТ, продемонстрирована широкая адаптация для казахстанских и сибирских сортов в северных пунктах испытания, а также их строгая фотопериодическая чувствительность [12].
Цель работы: 1) рассмотреть закономерности распространения аллеля Ppd-D1a среди яровой мягкой пшеницы северного полушария, 2) выявить влияние аллеля Ppd-D1a на морфобиологические признаки у яровой мягкой пшеницы, высеваемой весной, 3) наметить основные пути селекционной работы при создании российских сортов яровой мягкой пшеницы нечувствительной к фотопериоду.
РАСПРОСТРАНЕНИЕ АЛЛЕЛЯ Ppd-D1a В СЕВЕРНОМ ПОЛУШАРИИ И ЕГО ВЛИЯНИЕ НА АГРОНОМИЧЕСКИЕ ПРИЗНАКИ ЯРОВОЙ МЯГКОЙ ПШЕНИЦЫ
Во всем мире широко распространены сорта пшеницы, нечувствительные к фотопериоду. Однако таких сортов больше в регионах, где яровая пшеница выращивается в течение зимнего периода, а озимая пшеница, посеянная осенью, должна созреть в следующем году до наступления высоких температур, как в случае Южной Европы [13].
Для яровой пшеницы характерно возрастание доли чувствительных к фотопериоду сортов при продвижении с юга на север (табл. 1). Нечувствительность к фотопериоду была передана европейским сортам мягкой пшеницы итальянским селекционером Н. Стрампелли, который использовал японский сорт Akakomugi для уменьшения длины соломины и сокращения периода “всходы–колошение” [29]. Значительному распространению нечувствительности к фотопериоду у пшениц в Северной Африке, Средиземноморье и Азии способствовало привлечение в скрещивания сортов из СИММИТ и ИКАРДА [30]. В Японии скороспелые сорта с аллелем Ppd-D1a отбирались для избегания предуборочного прорастания и поражения фузариозом [21]. Вероятно, селекционеры закрепили наиболее подходящий вариант гена Ppd для местых условий на основе отбора по агрономически важным признакам [24]. Так, у всех сортов, возделываемых в пакистанских провинциях Пенджаб и Синдх до Зеленой революции, обнаружен аллель Ppd-D1a [16].
Таблица 1.
Распространение аллеля Ppd-D1a среди яровой мягкой пшеницы в северном полушарии (регионы упорядочены по географической широте)
| Регион (страна) | Изучено образцов | Выявлено образцов с аллелем Ppd-D1a | % | Литературный источник |
|---|---|---|---|---|
| Индия | 99 | 90 | 91 | [14] |
| Пакистан | 59 | 58 | 98 | [15] |
| 119 | 107 | 90 | [16] | |
| Марокко | 20 | 3 | 15 | [17] |
| Южная Корея1 | 15 | 15 | 100 | [18] |
| Турция2 | 11 | 10 | 91 | [19] |
| Южная Европа (Португалия, Испания, Италия, Албания, бывшая Югославия, Греция, Болгария) | 55 | 18 | 33 | [20] |
| Болгария | 2 | 1 | 50 | [13] |
| Хоккайдо (Япония) | 10 | 1 | 10 | [21] |
| Северо-восточная зона яровой пшеницы в Китае | 25 | 9 | 36 | [22] |
| Украина3 | 27 | 9 | 33 | [23] |
| Западная и Центральная Европа (Великобритания, Франция, Бельгия, Германия, Чехия, Румыния) | 167 | 2 | 1 | [20] |
| Беларусь | 98 | 0 | 0 | [24] |
| Канада | 82 | 26 | 32 | [25] |
| 70 | 26 | 37 | [26] | |
| Сибирь (Россия) | 48 | 1 | 2 | [27] |
| Россия4 | 143 | 5 | 3 | [28] |
| Северная Европа (Швеция, Норвегия, Финляндия) | 23 | 1 | 4 | [20] |
В исследовании Лихенко с соавт. [27] обнаружен только один сибирский сорт с аллелем Ppd-D1а – Тулун 15. В исследовании 2014 г. в России обнаружено всего пять сортов яровой мягкой пшеницы, из них четыре гетерогенных сорта с аллелем Ppd-D1а [28].
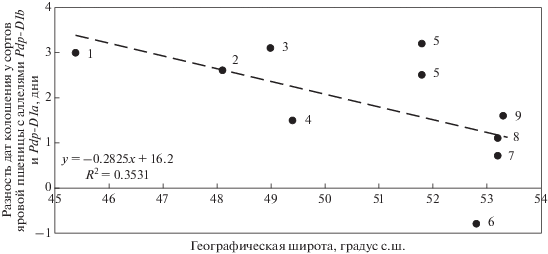
Сорта яровой мягкой пшеницы с аллелем Ppd-D1а всегда колосятся раньше, чем сорта с аллелем Ppd-D1b [31]. Несоблюдение требований фотопериода у чувствительных сортов (с аллелем Ppd-D1b) задерживает колошение, величина которого зависит от географической широты региона произрастания [3]. Мы проанализировали результаты девяти исследований о влиянии аллелей гена Ppd-D1 на длительность периода “всходы–колошение”. Если в работе данный показатель не приводился для каждой географической точки, то рассчитывалась средняя географическая широта проведения полевого эксперимента (рис. 1).
Установлен средний, но статистически незначимый коэффициент корреляции между географической широтой проведения эксперимента и разностью дат колошения у генотипов с аллелями Ppd-D1b и Ppd-D1a (r = –0.59). Уравнение линейной регрессии позволяет предположить более раннее наступление колошения для сортов с аллелем Ppd-D1a на 2.1–0.7 дня на широте 50–55 градусов – основной широте сева яровой мягкой пшеницы в России. Таким образом, анализ данных подтвердил часто встречающийся в научной литературе тезис о минимальном влиянии аллеля Ppd-D1a на ускорение фазы колошения в северных районах возделывания пшеницы с продолжительным летним днем [9, 37], поскольку естественной длины дня достаточно для удовлетворения требований растений к фотопериоду [38].
Аллели локуса Ppd-D1 имеют плейотропный эффект, величина которого зависит от географической широты и от генетического фона испытываемых линий [39]. Универсальное влияние аллеля Ppd-D1a, обнаруженное во многих исследованиях, сводится к снижению высоты растения [10, 25, 26, 33, 38], уменьшению количества колосков в колосе [10, 40], снижению содержания белка в зерне [25, 38], более продолжительному функционированию флагового листа после колошения [32, 33].
Влияние генов фотопериодической чувствительности на урожайность варьирует в засимости от географической широты и даты посева [41, 42]. Зависимость такова, что сравнение генотипов, различающихся по фотопериодической чувствительности, в нижних широтах Северной Америки (44°–49° с.ш.) выявляет преимущество аллеля Ppd-D1a [26, 38, 39], а в верхних широтах Северной Америки (49°–53° с.ш.) – аллеля Ppd-D1b [10, 33, 36, 43]. Также имеются данные о нейтральном влиянии гена на урожайность в тех же широтах (46°–53° с.ш.) [25, 32, 34].
СОЗДАНИЕ СОРТОВ ЯРОВОЙ МЯГКОЙ ПШЕНИЦЫ С АЛЛЕЛЕМ Ppd-D1a ДЛЯ РОССИИ
Основное преимущество, которое дает нечувствительность к фотопериоду, заключается в возможности возделывания яровой мягкой пшеницы в межсезонье [44]. Это может быть как челночная селекция, так и выращивание пшеницы в вегетационных комнатах селекцентров России. Пшеница с аллелем Ppd-D1a способна колоситься и формировать зерновки при минимальных затратах на искусственное освещение и даже при естественном освещении при посеве в сентябре. Эта особенность позволит получить одну–две дополнительные вегетации в год, которые могут быть использованы для сокращения времени создания селекционных линий и для выравнивания генетически неоднородного селекционного материала. Другие возможные направления использования сортов с аллелем Ppd-D1a – селекция на скороспелость и сокращение длины соломины.
Данные табл. 1 демонстрируют общеизвестную закономерность возрастания доли чувствительных к фотопериоду сортов яровой мягкой пшеницы при продвижении с юга на север. Однако частота аллеля Ppd-D1a у сортов Канады не укладывается в общую тенденцию. В Канаде ген Ppd-D1a был внедрен в местные сорта в 1986 г., чтобы использовать челночную селекцию для продвижения поколений в межсезонье [25]. Встречаемость аллеля Ppd-D1a у канадских сортов яровой мягкой пшеницы аномально высока по сравнению с пшеницей из стран той же географической широты (табл. 1). A. Kamran с соавт. при исследовании канадских сортов и селекционных линий обнаружили аллель Ppd-D1a у 72% генотипов [34]. Таким образом, факт уже свершившегося распространения аллеля Ppd-D1a у сортов яровой мягкой пшеницы в Канаде позволяет говорить, по крайней мере, об актуальности аналогичных исследований для России.
Очевидно, что использование аллеля Ppd-D1a для ускорения селекции возможно, только если нечувствительность к фотопериоду не оказывает негативного влияния на урожайность [33].
Не до конца понятным остается вопрос: связано ли снижение урожайности, при сравнении чувствительных и нечувствительных к фотопериоду изогенных линий в северных широтах, с действием аллеля Ppd-D1a или со скороспелостью, к которой ведет наличие этого аллеля? Скороспелость не является оптимальным признаком для регионов с удовлетворительными по влагообеспеченности условиями, а также в природных зонах с достаточно увлажненной второй половиной лета, например в степных районах Сибири. Общеизвестна отрицательная взаимосвязь между длительностью периода “всходы–колошение” и урожайностью [45]. Укороченный вегетационный период, вызванный наличием аллеля Ppd-D1a, может быть компенсирован заменой одних аллелей генов Vrn другими, а также исключением генов Eps. Это осуществимо, поскольку для генов Ppd-D1, Vrn и Eps описан аддитивный тип взаимодействия [35, 46]. Кроме того, аллелей пяти главных генов развития (Ppd-B1, Ppd-D1, Vrn-A1, Vrn-B1 и Vrn-D1) недостаточно для объяснения значительной части изменчивости периода “всходы–колошение” [47], поэтому возможность компенсировать раннее колошение у линий с аллелем Ppd-D1a не сводится только к генам яровизации. Например, сочетание гена Rht12, замедляющего колошение, и аллеля Ppd-D1a, ускоряющего колошение, у озимой пшеницы позволило добиться оптимального времени колошения [48]. F. Yang с соавт. приводят пример нечувствительного к фотопериоду китайского сорта Kefeng 4 с аллелем Ppd-D1a, который на широте 48° конкурировал с чувствительными к фотопериоду сортами. Авторы предположили наличие у этого сорта каких-то других генов, влияющих на период “всходы–колошение” [22]. Известно, что генетический фон также влияет на величину сокращения периода “всходы–колошение” у изогенных линий с аллелем Ppd-D1a [38, 39].
Возможная причина некоторых неудач, при вовлечении в скрещивания иностранных сортов с аллелем Ppd-D1a в России, могла заключаться в сцеплении гена Ppd1 и гена редукции высоты растения Rht8 [49]. Поскольку Rht8 и Ppd-D1a действуют независимо и аддитивно на высоту растения, комбинирующий эффект двух генов больше, чем эффект каждого гена по отдельности [50]. Снижения длины соломины нельзя допускать по причине взаимосвязи высоты растения и засухоустойчивости [51]. Так как все аллели генов Vrn и Ppd, ассоциированные с ранним колошением, снижают высоту растения [25], такие фенотипы, вероятно, браковались селекционерами. Снижение высоты растения, вызванное наличием аллеля Ppd-D1a, может быть компенсировано за счет скрещиваний с традиционными высокорослыми сортами яровой мягкой пшеницы России.
Негативное влияние на количество колосков в колосе, связанное с присутствием аллеля Ppd-D1a, может быть погашено путем гибридизации с крупноколосыми сортами. Работа по изучению исходного материала для селекции ведется повсеместно, поэтому нахождение источников необходимых признаков не будет затруднено.
Непонятным остается вопрос о положительном влиянии аллеля Ppd-D1a на длительность функционирования флагового листа после колошения. Имеет ли влияние на этот признак сам ген Ppd-D1 или какой-то другой сцепленный с ним ген? Так, обнаружен QTL для сохранности зеленой окраски листа после колошения на хромосоме 2D, который косегрегировал с геном Ppd-D1 [52]. Меньшее содержание белка в зерне у линий с аллелем Ppd-D1a может быть следствием более длительной жизни их листьев после колошения, поскольку выявлена отрицательная корреляция между данными признаками [53].
Украинские исследователи полагают, что чувствительность к фотопериоду не критична для адаптации мягкой пшеницы [23]. В Северной Америке в локусе Ppd-D1 закрепились как чувствительные, так и нечувствительные к фотопериоду аллели, вероятно в результате отбора в пользу нечувствительного аллеля в жаркие годы и чувствительного – в более прохладные годы [54].
Таким образом, частота встречаемости аллеля Ppd-D1a возрастает от стран верхних широт к странам нижних широт. Влияние аллеля Ppd-D1a на агрономические признаки зависит от географической широты проведения эксперимента и сводится к сокращению периода “всходы–колошение”, к снижению высоты растения, количества колосков в колосе и содержания белка в зерне, к повышению продолжительности функционирования листьев после колошения. Аллель Ppd-D1a оказывает отрицательное влияние на урожайность пшеницы севернее 50° с.ш. Внедрение аллеля Ppd-D1a, вызывающего нечувствительность к фотопериоду, в сорта яровой мягкой пшеницы, будет способствовать ускорению селекционного процесса в России. Возможный негативный эффект рассматриваемого аллеля на урожайность будет компенсирован обоснованным подбором пар для скрещиваний, а также за счет меньшего времени, требуемого на создание линий, следовательно, работой с большим количеством вариантов сочетания генов и признаков.
Работа выполнена в рамках государственного задания Федерального Алтайского научного центра агробиотехнологий 0534-2019-0013 “Использование молекулярно-генетических методов исследований в селекции растений”.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Список литературы
Stelmakh A.F. Genetic systems regulating flowering response in wheat // Wheat: Prospects for Global Improvement. Developments in Plant Breeding. Dordreht: 1997. V. 6. P. 491–501. https://doi.org/10.1007/978-94-011-4896-2_64
Law C.N., Worland A.J. Genetic analysis of some flowering time and adaptive traits in wheat // New Phytol. 1997. V. 137. Iss. 1. P. 19–28. https://doi.org/10.1046/j.1469-8137.1997.00814.x
Kamran A., Iqbal M., Spaner D. Flowering time in wheat (Triticum aestivum L.): A key factor for global adaptability // Euphytica. 2014. V. 197. P. 1–26. https://doi.org/10.1007/s10681-014-1075-7
Beales J., Turner A., Griffiths S. et al. A pseudo-response regulator is misexpressed in the photoperiod insensitive Ppd-D1a mutant of wheat (Triticum aestivum L.) // Theor. Appl. Genet. 2007. V. 115. P. 721–733. https://doi.org/10.1007/s00122-007-0603-4
Worland T., Snape J.W. Genetic basis of worldwide wheat varietal improvement // The World Wheat Book: A History of Wheat Breeding. Paris: Lavoisier Publishing, 2001. P. 59–100.
Law C.N., Sutka J., Worland A.J. A genetic study of day length response in wheat // Heredity. 1978. V. 41. P. 575–585. https://doi.org/10.1038/hdy.1978.87
Scarth R., Law C.N. The location of the photoperiod gene Ppd-B1 and an additional genetic factor for ear emergence time on chromosome 2B of wheat // Heredity. 1983. V. 51. P. 607–619. https://doi.org/10.1038/hdy.1983.73
Pugsely A.T. The photoperiodic sensitivity of some spring wheats with special reference to the variety Thatcher // Aust. J. Agric. Res. 1966. V. 17. Iss. 5. P. 591–599. https://doi.org/10.1071/AR9660591
Worland A.J. The influence of the flowering time genes on environmental adaptability in European wheats // Euphytica. 1996. V. 89. P. 49–57. https://doi.org/10.1007/BF00015718
Dyck J., Matus-Cadiz M., Hucl P. et al. Agronomic performance of hard red spring wheat isolines sensitive and insensitive to photoperiod // Crop Sci. 2004. V. 44. № 6. P. 1976–1981. https://doi.org/10.2135/cropsci2004.1976
Mohler V., Lukman R., Ortiz-Islas S. et al. Genetic and physical mapping of photoperiod insensitive gene Ppd-B1 in common wheat // Euphytica. 2004. V. 138. P. 33–40. https://doi.org/10.1023/B:EUPH.0000047056.58938.76
Trethowan R.M., Morgunov A., He Z. et al. The global adaptation of bread wheat at high latitudes // Euphytica. 2006. V. 152. P. 303–316. https://doi.org/10.1007/s10681-006-9217-1
Kolev S., Ganeva G., Christov N. et al. Allele variation in loci for adaptive response and plant height and its effect on grain yield in wheat // Biotechnology & Biotechnological Equipment. 2010. V. 24. Iss. 2. P. 1807–1813. https://doi.org/10.2478/V10133-010-0042-2
Singh S., Singh A., Jain N. et al. Molecular characterization of vernalization and photoperiod genes in wheat varieties from different agro-climatic zones of India // Cereal Res. Communications. 2013. V. 41. Iss. 3. P. 376–387. https://doi.org/10.1556/crc.2013.0017
Iqbal M., Shahzad A., Ahmed I. Allelic variation at the VrnA1, Vrn-B1, Vrn-D1, Vrn-B3 and Ppd-D1a loci of Pakistani spring wheat cultivars // Electronic J. Biotechnol. 2011. V. 14. № 1. P. 1–8. https://doi.org/10.2225/vol14-issue1-fulltext-6
Rasheed A., Xia X., Mahmood T. et al. Comparison of economically important loci in landraces and improved wheat cultivars from Pakistan // Crop Sci. 2016. V. 56. № 1. P. 1–15. https://doi.org/10.2135/cropsci2015.01.0015
Henkrar F., El-Haddoury J., Ouabbou H. et al. Genetic characterization of Moroccan and the exotic bread wheat cultivars using functional and random DNA markers linked to the agronomic traits for genomics-assisted improvement // 3 Biotech. 2016. V. 6. Iss. 1. P. 97. https://doi.org/10.1007/s13205-016-0413-y
Cho E.J., Kang C.-S., Yoon Y.M., Park C.S. The relationship between allelic variations of Vrn-1 and Ppd-1 and agronomic traits in Korean wheat cultivars // Indian J. Genet. 2015. V. 75. № 3. P. 294–300. https://doi.org/10.5958/0975-6906.2015.00046.2
Andeden E.E., Yediay F.E., Baloch F.S. et al. Distribution of vernalization and photoperiod genes (Vrn-A1, Vrn-B1, Vrn-D1, Vrn-B3, Ppd-D1) in Turkish bread wheat cultivars and landraces // Cereal Res. Communications. 2011. V. 39. Iss. 3. P. 352–364. https://doi.org/10.1556/crc.39.2011.3.5
Shcherban A.B., Borner A., Salina E.A. Effect of VRN-1 and PPD-D1 genes on heading time in European bread wheat cultivars // Plant Breeding. 2015. V. 134. Iss. 1. P. 49–55. https://doi.org/10.1111/pbr.12223
Seki M., Chono M., Matsunaka H., et al. Distribution of photoperiod-insensitive alleles Ppd-B1a and Ppd-D1a and their effect on heading time in Japanese wheat cultivars // Breeding Sci. 2011. V. 61. Iss. 4. P. 405–412. https://doi.org/10.1270/jsbbs.61.405
Yang F.P., Zhang X.K., Xia X.C. et al. Distribution of the photoperiod insensitive Ppd-D1a allele in Chinese wheat cultivars // Euphytica. 2009. V. 165. P. 445–452. https://doi.org/10.1007/s10681-008-9745-y
Chebotar G., Bakuma A., Filimonov V., Chebotar S. Haplotypes of Ppd-D1 gene and alleles of Ppd-A1 and Ppd-B1 in Ukrainian bread wheat varieties // Visnyk of the Lviv University. Series Biology. 2019. Iss. 80. P. 82–89. https://doi.org/10.30970/vlubs.2019.80.10
Фомина Е.А., Дмитриева Т.М., Малышев С.В., Урбанович О.Ю. Молекулярно-генетическая характеристика коллекции сортов пшеницы (Triticum aestivum L.) по аллельному составу гена чувствительности к фотопериоду Ppd-D1 и генов, кодирующих cbf-факторы Fr-B2 локуса // Мол. и прикладная генетика. 2018. Т. 25. С. 7–14.
Chen H., Moakhar N.P., Iqbal M. et al. Genetic variation for flowering time and height reducing genes and important traits in western Canadian spring wheat // Euphytica. 2016. V. 208. P. 377–390. https://doi.org/10.1007/s10681-015-1615-9
Perez-Lara E., Semagn K., Chen H. et al. Allelic variation and effects of 16 candidate genes on disease resistance in western Canadian spring wheat cultivars // Mol. Breeding. 2017. V. 37. № 3. P. 23. https://doi.org/10.1007/s11032-017-0627-7
Лихенко И.Е., Стасюк А.И., Щербань А.Б. и др. Изучение аллельного состава генов Vrn-1 и Ppd-1 у раннеспелых и среднеранних сортов яровой мягкой пшеницы Сибири // Вавилов. журн. генет. и селекции. 2014. Т. 18. Вып. 4/1. С. 691–703.
Лысенко Н.С., Киселева А.А., Митрофанова О.П., Потокина Е.К. Каталог мировой коллекции ВИР. Выпуск 815. Мягкая пшеница. Молекулярное тестирование аллелей Vrn- и Ppd-генов у допущенных к использованию в Российской Федерации селекционных сортов. СПб.: ВИР, 2014. 30 с.
Strampelli N. Early Ripening Wheats and the Advance of Italian Wheat Production. Rome: 1932. P. 5–7.
Ferrara G.O., Mosaad M.G., Mahalakshmi V., Rajaram S. Photoperiod and vernalisation response of Mediterranean wheats, and implications for adaptation // Wheat: Prospects for Global Improvement. Developments in Plant Breeding. Dordrecht: Springer, 1997. P. 509–516. https://doi.org/10.1007/978-94-011-4896-2_66
Pérez-Gianmarco T.I., Slafer G.A., González F.G. Wheat pre-anthesis development as affected by photoperiod sensitivity genes (Ppd-1) under contrasting photoperiods // Functional Plant Biol. 2018. V. 45. Iss. 6. P. 645–657. https://doi.org/10.1071/FP17195
Blake N.K., Lanning S.P., Martin J.M. et al. Effect of variation for major growth habit genes on maturity and yield in five spring wheat populations // Crop Sci. 2009. V. 49. № 4. P. 1211–1220. https://doi.org/10.2135/cropsci2008.08.0505
Lanning S.P., Hucl P., Pumphrey M. et al. Agronomic performance of spring wheat as related to planting date and photoperiod response // Crop Science. 2012. V. 52. № 4. P. 1633–1639. https://doi.org/10.2135/cropsci2012.01.0052
Kamran A., Randhawa H.S., Pozniak C., Spaner D. Phenotypic effects of the flowering gene complex in Canadian spring wheat germplasm // Crop Sci. 2013. V. 53. № 1. P. 84–94. https://doi.org/10.2135/cropsci2012.05.0313
Kamran A., Iqbal M., Navabi A. et al. Earliness per se QTLs and their interaction with the photoperiod insensitive allele Ppd-D1a in the Cutler × AC Barrie spring wheat population // Theor. Appl. Genet. 2013. V. 126. Iss. 8. P. 1965–1976. https://doi.org/10.1007/s00122-013-2110-0
Perez-Lara E., Semagn K., Chen H. et al. QTLs associated with agronomic traits in the Cutler × AC Barrie spring wheat mapping population using single nucleotide polymorphic markers // PLoS One. 2016. V. 11. Iss. 8. e0160623. https://doi.org/10.1371/journal.pone.0160623
Файт В.И., Балашова И.А., Федорова В.Р., Бальвинская М.С. Идентификация генотипов Ppd-1 сортов мягкой пшеницы методами генетического и STS-ПЦР анализа // Физиол. растений и генетика. 2014. Т. 46. № 4. С. 325–336.
Marshall L., Busch R., Cholick F. et al. Agronomic performance of spring wheat isolines differing for day length response // Crop Sci. 1989. V. 29. № 3. P. 752–757. https://doi.org/10.2135/cropsci1989.0011183X002900-030043x
Carter A.H., Garland-Campbell K., Kidwell K.K. Genetic mapping of quantitative trait loci associated with important agronomic traits in the spring wheat (Triticum aestivum L.) cross ‘Louise’ × ‘Penawawa’ // Crop Sci. 2011. V. 51. № 1. P. 84–95. https://doi.org/10.2135/cropsci2010.03.0185
Wall P.C., Cartwright P.M. Effects of photoperiod, temperature and vernalization on the phenology and spikelet numbers of spring wheats // Ann. Appl. Biol. 1974. V. 76. Iss. 3. P. 299–309. https://doi.org/10.1111/j.1744-7348.1974.tb01370.x
Busch R.H., Elsayed F.A., Heiner R.E. Effect of daylength insensitivity on agronomic traits and grain protein in hard red spring wheat // Crop Sci. 1984. V. 24. № 6. P. 1106–1109. https://doi.org/10.2135/cropsci1984.0011183X002400-060023x
Matsuyama H., Fujita M., Seki M. et al. Growth and yield properties of near-isogenic wheat lines carrying different photoperiodic response genes // Plant Prod. Sci. 2015. V. 18. Iss. 1. 57–68. https://doi.org/10.1626/pps.18.57
Knott D.R. Effects of genes for photoperiodism, semi-dwarfism, and awns on agronomic characters in a wheat cross // Crop Sci. 1986. V. 26. № 6. P. 1158–1162. https://doi.org/10.2135/cropsci1986.0011183X002600-060016x
Tanio M., Kato K., Ishikawa N. et al. Effect of shuttle breeding with rapid generation advancement on heading traits of Japanese wheat // Breeding Sci. 2006. V. 56. Iss. 3. P. 311–320. https://doi.org/10.1270/jsbbs.56.311
Ригин Б.В., Зуев Е.В., Тюнин В.А. и др. Селекционно-генетические аспекты создания продуктивных форм мягкой яровой пшеницы с высокой скоростью развития // Тр. по прикладной бот., генет. и селекции. 2018. Т. 179. Вып. 3. С. 194–202. https://doi.org/10.30901/2227-8834-2018-3-194-202
Kumar S., Sharma V., Chaudhary S. et al. Genetics of flowering time in bread wheat Triticum aestivum: complementary interaction between vernalization-insensitive and photoperiod-insensitive mutations imparts very early flowering habit to spring wheat // J. Genetics. 2012. V. 91. № 1. P. 33–47.
Bloomfield M.T., Hunt J.R., Trevaskis B. et al. Ability of alleles of PPD1 and VRN1 genes to predict flowering time in diverse Australian wheat (Triticum aestivum) cultivars in controlled environments // Crop Pasture Sci. 2018. V. 69. Iss. 11. P. 1061–1075. https://doi.org/10.1071/CP18102
Chen L., Du Y., Lu Q. et al. The photoperiod-insensitive allele Ppd-D1a promotes earlier flowering in Rht12 dwarf plants of bread wheat // Front. Plant Sci. 2018. V. 9. P. 1312. https://doi.org/10.3389/fpls.2018.01312
Worland A.L., Law C.N. Genetic analysis of chromosome 2D of wheat I. The location of genes affecting height, day length insensitivity and yellow rust resistance // Zeitschrift fur Pflanzenzuchtung. 1985. B. 96. № 4. S. 331–345.
Zhang K., Wang J., Qin H. et al. Assessment of the individual and combined effects of Rht8 and Ppd-D1a on plant height, time to heading and yield traits in common wheat // The Crop J. 2019. V. 7. Iss. 6. P. 845–856. https://doi.org/10.1016/j.cj.2019.06.008
Потоцкая И.В., Шаманин В.П., Шепелев С.С., Моргунов А.И. Синтетическая гексаплоидная пшеница как исходный материал для селекции на засухоустойчивость в условиях Западной Сибири // Вестник Омского гос. аграр. университета. 2019. № 1(33). С. 38–46.
Naruoka Y., Sherman J.D., Lanning S.P. et al. Genetic analysis of green leaf duration in spring wheat // Crop Sci. 2012. V. 52. № 1. P. 99–109. https://doi.org/10.2135/cropsci2011.05.0269
Cook J.P., Acharya R.K., Martin J.M. et al. Genetic analysis of stay-green, yield, and agronomic traits in spring wheat // Crop science. 2021. V. 61. Iss. 1. P. 383–395. https://doi.org/10.1002/csc2.20302
Kalous J.R., Martin J.M., Sherman J.D. et al. Phenotypic variation and patterns of linkage disequilibrium associated with introduced genes in spring wheat // Crop Sci. 2011. V. 51. № 6. P. 2466–2478. https://doi.org/10.2135/cropsci2011.03.0172
Дополнительные материалы отсутствуют.