Генетика, 2022, T. 58, № 10, стр. 1210-1220
Ландшафт альтернативного сплайсинга в децидуальных клетках плаценты при физиологической беременности
Е. А. Трифонова 1, 2, *, М. М. Гавриленко 1, А. А. Бабовская 1, А. А. Зарубин 1, М. Г. Сваровская 1, Е. В. Ижойкина 3, И. А. Степанов 3, В. Н. Сереброва 1, И. Г. Куценко 2, В. А. Степанов 1
1 Научно-исследовательский институт медицинской генетики Томского национального исследовательского медицинского центра, Российская академия наук
634050 Томск, Россия
2 Сибирский государственный медицинский университет
634050 Томск, Россия
3 Областной перинатальный центр им. И.Д. Евтушенко
634063 Томск, Россия
* E-mail: ekaterina.trifonova@medgenetics.ru
Поступила в редакцию 04.04.2022
После доработки 15.05.2022
Принята к публикации 31.05.2022
- EDN: QVKUTB
- DOI: 10.31857/S0016675822100101
Аннотация
Альтернативный сплайсинг (АС) РНК – ключевой этап посттранскрипционной регуляции экспрессии генов, который обеспечивает пластичность транскрипции и контроль экспрессии изоформ РНК в данный момент времени в определенном типе тканей и клеток. Предположительно, этот механизм играет важную роль в развитии и функционировании плаценты. В исследовании проведено глубокое полнотранскриптомное секвенирование с детальным анализом событий альтернативного сплайсинга в децидуальных клетках (ДК) плацентарной ткани при физиологическом течении беременности. В децидуальных клетках идентифицированы 149 067 событий АС, аннотированных в GENCODE v.26, в 20 463 генах, из которых 4038 генов характеризовались десятью и более изоформами. Анализ реконструированной генной сети продемонстрировал высокую степень взаимодействий альтернативно сплайсированных генов и позволил выявить регуляторные связи, обеспечивающие координированную экспрессию большинства центральных генов, которые ассоциированы с инициацией и элонгацией трансляции у эукариот, а также модуляцией ангиогенеза и адгезии клеток, опосредованной DE-кадгерином. Полученные результаты подтверждают важность альтернативного сплайсинга, который существенно увеличивает транскрипционное разнообразие и представляет собой значимый механизм регуляции генов в децидуальных клетках. Следует отметить, что ряд генов, подверженных АС в ДК, ассоциирован с осложнениями беременности, в связи с чем представляется актуальным дальнейшее изучение данного механизма процессинга РНК в когорте пациенток с акушерской патологией.
Альтернативный сплайсинг (АС) представляет собой посттранскрипционный регуляторный механизм, продуцирующий множественные изоформы РНК из одного предшественника мРНК. АС значительно увеличивает транскриптомное и протеомное разнообразие кодирующего генома человека и является важной составляющей регуляции экспрессии генов. Известно, что этому явлению подвержены около 95% всех генов человека [1]. Механизмы, принимающие участие в процессе АС, включают использование альтернативных донорных и акцепторных сайтов, альтернативных первого и последнего экзонов, пропуск экзонов, взаимоисключающие экзоны и удержание интронов [2]. Поскольку альтернативно сплайсированные транскрипты одного гена могут продуцировать белки с различными функциями, в последнее десятилетие растет интерес к изучению роли данного механизма процессинга РНК в развитии заболеваний человека [3]. К примеру, была показана связь АС генов, экспрессирующихся в нервной системе, с болезнью Альцгеймера и расстройствами аутистического спектра [4]. Обнаружена ассоциация с аберрантным АС, таких многофакторных заболеваний, как сердечно-сосудистые болезни, рак различной локализации, шизофрения, преэклампсия, задержка развития плода и др. [5–8].
Несмотря на всесторонний анализ альтернативного сплайсинга пре-мРНК во многих тканях и клетках человека в норме и при патологии, ранее не проводился глобальный скрининг изменений альтернативного сплайсинга как в целом в плацентарной ткани, так и в отдельных клеточных популяциях, формирующих ее.
Известно, что одним из решающих событий для успешной имплантации эмбриона и развития плаценты является гормонально-контролируемая дифференцировка стромальных клеток эндометрия в децидуальные клетки (ДК) и формирование децидуальной оболочки. Ряд исследований продемонстрировал ключевую роль децидуальных стромальных клеток и их микроокружения в иммунном контроле над инвазией трофобласта, процессах ремоделирования тканей и развитии плода [9, 10]. Таким образом, децидуальные стромальные клетки служат основным функциональным клеточным компонентом в децидуальной ткани плаценты, выполняя трофическую, гормональную, защитную, иммунорегуляторную и гемопоэтическую функции, в связи с чем данный тип клеток является одним из наиболее интересных объектов для исследования событий АС при беременности как с теоретической точки зрения, так и с позиции предиктивной медицины. В представленном исследовании впервые в мире проведено глубокое полнотранскриптомное секвенирование ДК плацентарной ткани с детальным анализом событий альтернативного сплайсинга при физиологическом течении беременности.
МАТЕРИАЛЫ И МЕТОДЫ
Проведение настоящего исследования одобрено Комитетом по биомедицинской этике НИИ медицинской генетики Томского НИМЦ. Материал для исследования представлен биоптатами материнской части плаценты женщин с физиологическим течением беременности (N = 7). Сбор биоптатов осуществлялся по стандартной методике [11] акушерами-гинекологами на базе ОГАУЗ “ОПЦ им. И.Д. Евтушенко” г. Томска. Полученный материал немедленно промывался физиологическим раствором и помещался в криопробирки, которые далее хранились в жидком азоте, чтобы свести к минимуму деградацию РНК. У всех пациентов срезы плацентарной ткани были охарактеризованы гистологически с окрашиванием гематоксилин-эозином. Лазерная микродиссекция осуществлена на оборудовании PALM (Carl Zeiss, Германия) с технологией автоматизированного захвата фрагментов (“Laser Capture Microdissection”). Для выделения тотальной РНК использован набор Single Cell RNA Purification Kit (Norgen, США). Концентрация и качество РНК были оценены с помощью Agilent 2100 Bioanalyzer. Приготовление библиотек проведено по протоколу SMARTer Stranded Total RNA-Seq Kit v2 (Takara, США). Массовое параллельное секвенирование выполнено на приборе Next-seq 2000 (Illumina). Выравнивание на референсный геном (hg38) было выполнено с помощью программы STAR. Аннотацию транскрипционных активных областей, полученных в настоящей работе в результате секвенирования децидуальных клеток, проводили в программной среде R c использованием базы данных “gencode.v19”. Функциональный анализ последовательностей, демонстрирующих АС, проводили с помощью веб-инструмента “WebGestalt” (WEB-based Gene SeT AnaLysis Toolkit) и базы данных “STRING” (Search Tool for the Retrieval of Interacting Genes/Proteins) [12, 13]. Анализ событий альтернативного сплайсинга выполнен в среде R с помощью пакета “SGSeq”, позволяющего прогнозировать и количественно оценивать события сплайсинга на основе данных полногеномного РНК-секвентрования. Профиль АС и экзоны в данном подходе предсказываются из прочтений, сопоставленных с эталонным геномом, и собираются в граф, описывающий события сплайсинга. События сплайсинга идентифицируются циклично с использованием графа и оцениваются количественно на основании локальных прочтений, приходящихся на начало или конец вариантов сплайсинга [14]. Экспериментальные исследования были выполнены на базе Центра коллективного пользования научно-исследовательским оборудованием ЦКП “Медицинская геномика” НИИ медицинской генетики Томского НИМЦ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты аннотации транскрипционных активных областей, полученных в настоящей работе, свидетельствуют, что большинство из анализируемых генов соответствуют протеинкодирующим регионам генома человека (15 843). В оставшемся кластере преобладают локусы длинных некодирующих РНК и транскрибируемых непроцессированных псевдогенов (в табл. 1 приводятся усредненные данные по всем анализируемым образцам).
Таблица 1.
Результаты аннотации транскрипционных активных областей, полученных в настоящей работе
| Идентифицированные транскрипты | Количество транскриптов |
|---|---|
| Длинные некодирующие РНК (lincRNA) | 3540 |
| МикроРНК (miRNA) | 68 |
| Неидентифицированная РНК (misc_RNA) | 8 |
| Полиморфные псевдогены (polymorphic_pseudogene) | 20 |
| Процессированные псевдогены (processed_pseudogene) | 17 |
| Белок-кодирующие (protein_coding) | 15 633 |
| Малые ядрышковые РНК (snoRNA) | 2 |
| Малые ядерные РНК (snRNA) | 7 |
| Транскрибируемые процессированные псевдогены (transcribed_processed_pseudogene) | 141 |
| Транскрибируемые непроцессированные псевдогены (transcribed_unprocessed_pseudogene) | 550 |
| Транскрибируемые унитарные псевдогены (transcribed_unitary_pseudogene) | 95 |
| Непроцессированные псевдогены (unprocessed_pseudogene) | 66 |
| Транслированные процессированные псевдогены (translated_processed_pseudogene) | 1 |
| Унитарные псевдогены (unitary_pseudogene) | 2 |
| Гены вариабельной цепи иммуноглобулина (IG_(C/J/V)_gene) | 11 |
| Инактивированный ген иммуноглобулина (IG_V_pseudogene) | 4 |
| Гены вариабельной цепи Т-клеточного рецептора (TR_(C/D/J/V)_gene) | 11 |
| Инактивированный ген T-клеточного рецептора (TR_V_pseudogene) | 1 |
| Транскрипты с неустановленной функцией (TEC) | 25 |
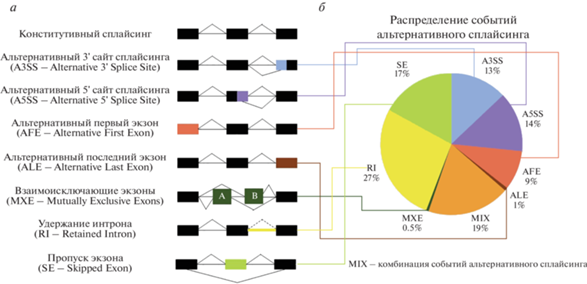
В соответствии с рекомендуемым подходом к анализу, описанному в ранее опубликованном исследовании [14], мы идентифицировали 149067 событий АС в 20 463 генах. Основываясь на паттернах сплайсинга, данные события можно классифицировать на семь основных типов: альтернативный промотор, взаимоисключающие экзоны, сохранение интрона, пропуск экзона, альтернативный акцепторный сайт, альтернативный терминатор и альтернативный донорский сайт, преобладающими из которых являются сохранение интрона и пропуск экзона (рис. 1). Из более чем 20 тыс. генов, экспрессирующихся в ДК плаценты, 91% (около 18 тыс.) имели больше одной изоформы РНК, а 21% (4038 генов) – более десяти изоформ. Наибольшее количество изоформ (27) идентифицировано для гена HNRNPH1, кодирующего гетерогенный ядерный рибонуклеопротеин H1, представляющий собой РНК-связывающий белок, который обеспечивает субстрат для событий процессинга пре-мРНК.
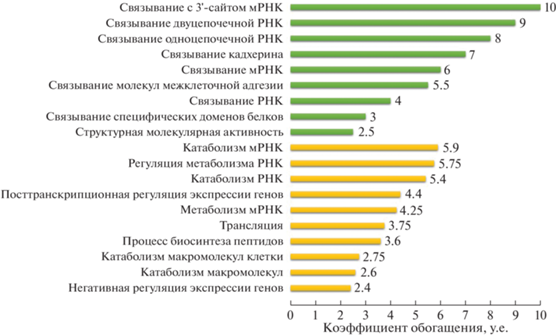
Для количественной оценки обнаруженных событий АС были рассчитаны значения коэффициента PSI (percentage spliced in); который характеризует долю каждого обнаруженного события сплайсинга во всех экспрессируемых изоформах. Экспрессия некоторых изоформ была довольно низкой (PSI < 0.05), и большинство событий АС не могли быть стабильно обнаружены во всех данных образцах. Для идентификации наиболее значимых событий АС использовали следующие критерии: значение показателя CPM (counts per million) больше десяти, доля альтернативного транскрипта (значение коэффициента PSI) больше или равна 0.05 и меньше или равна 0.95. Указанным критериям соответствовал 1871 событие АС 352 генов, из них два и более транскрипта имели 312 генов, основные биологические функции и молекулярные процессы которых, согласно базы данных “GeneOntology”, статистически значимо (false discovery rate (FDR) > 0.05) связаны с негативной и посттранскрипционной регуляцией экспрессии генов, метаболизмом мРНК, процессом биосинтеза пептидов и катаболическим процессом макромолекул клетки, связыванием с РНК, молекулами клеточной адгезии, кадгерином и др. (рис. 2).
Рис. 2.
Основные GO-категории, ассоциированные с кластером генов, для которых было идентифицировано более двух транскриптов, экспрессирующихся в ДК. Желтым цветом обозначены биологические процессы, зеленым – молекулярные функции.
В целях более детальной функциональной аннотации альтернативно сплайсированных генов нами были выбраны 158 генов, для которых были обнаружены пять и более транскриптов, экспрессирующихся в ДК (список генов доступен по запросу у авторов статьи). Анализ реконструированной с использованием программы “STRING” белок-белковой сети (рис. 3), включающей 101 продукт данных генов, свидетельствует о высокой степени их взаимодействий (более 130 парных взаимодействий имеют значения коэффициента combined_score ≥ 0.9).
Рис. 3.
Сеть белок-белковых взаимодействий продуктов альтернативно сплайсированных генов, экспрессирующихся в ДК.
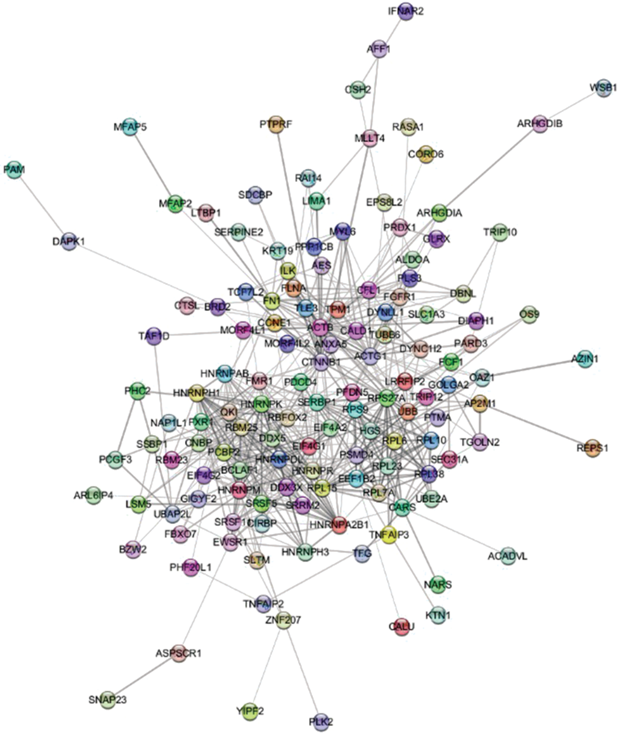
Центральное место в построенной сети с максимальным числом и силой взаимодействий (node_degree ≥ 10, score ≥ 0.99) занимают следующие 17 генов: RPS27A, HNRNPK, CTNNB1, EIF4G1, HNRNPM, ACTB, HNRNPA2B1, HNRNPH1, RPS9, RPL6, EEF1B2, RPL10, RPL15, RPL23, RPL38, RPL7A, SERBP1, ассоциированных, согласно аннотации сигнальных путей в базах данных “KEGG” и “Reactome”, с инициацией и элонгацией трансляции у эукариот, а также регуляцией экспрессии белков Slit и Robo, обладающих множеством разнообразных функций, включая модуляцию ангиогенеза и адгезии клеток, опосредованную DE-кадгерином. Примечательно, что для 13 генов из данного кластера (RPS27A, HNRNPK, HNRNPM, HNRNPA2B1, HNRNPH1, RPS9, RPL6, EEF1B2, RPL10, RPL15, RPL23, RPL38, RPL7A) характерно явление ко-экспрессии.
Результаты функциональной аннотации кластера генов, характеризующихся экспрессией пяти и более транскриптов в ДК, демонстрируют их сверхпредставленность в процессах, связанных с каноническим сигнальным путем Wnt/β-катенин, регуляцией сплайсинга мРНК, убиквитинирования и формированием адгезивных контактов, что свидетельствует о важной роли альтернативно сплайсированных генов ДК в межклеточной коммуникации в плацентарной ткани, а также в механизмах эпителиально-мезенхимального перехода (табл. 2).
Таблица 2.
Результаты функциональной аннотации кластера генов, характеризующихся экспрессией пяти и более транскриптов в ДК
| Категория | Описание | Коэффициент обогащения | FDR |
|---|---|---|---|
| Биологические процессы (Gene Ontology) | |||
| GO:0044334 | Канонический сигнальный путь Wnt, участвующий в положительной регуляции перехода эпителиальных клеток в мезенхимальные | 2.1 | 0.0289 |
| GO:0010909 | Положительная регуляция процесса биосинтеза гепарансульфат-протеогликанов | 1.92 | 0.0415 |
| GO:1900044 | Регуляция убиквитинирования, связанного с белком k63 | 1.53 | 0.0152 |
| GO:0150105 | Локализация белка в межклеточном соединении | 1.49 | 0.0184 |
| GO:0098974 | Организация постсинаптического актинового цитоскелета | 1.4 | 0.0288 |
| GO:2000637 | Положительная регуляция подавления экспрессии генов микроРНК | 1.32 | 0.0074 |
| GO:0048024 | Регуляция сплайсинга мРНК с помощью сплайсосомы | 1.1 | <0.0001 |
| GO:0000381 | Регуляция альтернативного сплайсинга мРНК с помощью сплайсосомы | 1.08 | 0.00057 |
| Пути KEGG | |||
| hsa04520 | Адгезивные контакты | 1.05 | 0.0028 |
| hsa04962 | Реабсорбция воды, регулируемая вазопрессином | 1.05 | 0.0321 |
| hsa05100 | Бактериальная инвазия в эпителиальные клетки | 0.95 | 0.0222 |
| hsa03010 | Рибосома | 0.88 | 0.0025 |
| hsa05205 | Протеогликаны при раке | 0.8 | 0.0021 |
| hsa03040 | Сплайсосома | 0.75 | 0.0402 |
| hsa04510 | Фокальная адгезия | 0.7 | 0.0210 |
| Пути Reactome | |||
| HSA-9636383 | Предотвращение фагосомально-лизосомального слияния | 1.62 | 0.0040 |
| HSA-8876493 | Интерналин-опосредованное проникновение Listeria monocytogenes в клетки-хозяева | 1.62 | 0.0040 |
| HSA-9706377 | Усиление передачи сигналов через FLT3 в результате нарушения CBL-опосредованного подавления рецептора в раковых клетках | 1.55 | 0.0337 |
| HSA-9637628 | Модуляция Mycobacterium tuberculosis иммунной системы хозяина | 1.55 | 0.0337 |
| HSA-196025 | Формирование кольцевых щелевых соединений | 1.53 | 0.0059 |
| HSA-4641265 | Подавление генов-мишеней Wnt | 1.49 | 0.0072 |
| HSA-8951430 | Регулирование RUNX3 передачи сигналов Wnt | 1.49 | 0.0388 |
Известно, что путь Wnt/β-катенина является каноническим сигнальным путем Wnt, который регулирует несколько биологических процессов, включая пролиферацию, миграцию, инвазию и апоптоз. К настоящему времени накоплены данные, в основном полученные на животных моделях, которые демонстрируют ключевую роль этого сигнального пути в развитии плаценты, имплантации бластоцисты, а также регуляции пролиферации и инвазии клеток трофобласта [15–18]. Помимо этого, нарушение экспрессии компонентов пути Wnt/β-катенина было связано с широким спектром гестационных заболеваний у мышей [19].
Аналогично животным моделям, сбалансированное действие передачи сигналов по пути Wnt/β-катенина критически важно и для нормальной плацентации человека. Как гиперактивация, так и недостаточная активация передачи сигналов Wnt-пути были ассоциированы с различными репродуктивными нарушениями: снижением инвазии трофобласта, хориокарциномой, молярной беременностью, преэклампсией и невынашиванием беременности [18, 20, 23]. Механизмы, лежащие в основе данных наблюдений, предположительно связаны с ведущей ролью сигнального пути Wnt в процессах инвазии и дифференцировки трофобласта человека, опосредованной межклеточными взаимодействиями в децидуальной ткани плаценты [24]. Кроме того, обнаружено участие молекул сигнального пути Wnt в регуляции уровня ангиогенных факторов, таких как VEGF (фактор роста эндотелия сосудов), гипоэкспрессия которых является важным компонентом патогенеза осложненного течения беременности [25].
В настоящее время не вызывает сомнений ключевая роль сигнального пути Wnt/β-катенина в опухолевой трансформации и прогрессии некоторых злокачественных новообразований [26, 27]. Данное наблюдение представляет особый интерес в контексте полученных нами результатов аннотации кластера генов, характеризующихся экспрессией пяти и более транскриптов в ДК, в базе данных “DisGeNET” на платформе веб-ресурса “WebGestalt” (табл. 3). Вышеобозначенные гены преимущественно ассоциированы с онкологическими заболеваниями, тем не менее, для двух генов показана связь с патологическим течением беременности. Так, ген CD46 ассоциирован с развитием HELLP-синдрома (score в базе данных “DisGeNET” составил 0.330), а ген FN1 связан с невынашиванием беременности (score = 0.300). Наряду с этим, согласно литературным данным, продукт гена FN1 – белок фибронектин является скрининговым маркером преждевременных родов и ассоциирован с развитием преэклампсии (ПЭ) [28, 29], а однонуклеотидные полиморфные маркеры гена CD46 ассоциированы как с ПЭ [30], так и с идиопатическим привычным невынашиванием беременности [31].
Таблица 3.
Результаты аннотации транскрипционных активных областей, полученных в настоящей работе
| Категория | Заболевание | Коэффициент обогащения | Уровень значимости | Гены |
|---|---|---|---|---|
| C1275278 | Внескелетная миксоидная хондросаркома | 38.84 | 0.001 | EWSR1, TFG |
| C1846434 | Гипоплазия лопатки | 20.81 | <0.001 | FGFR1, FLNA, ACTB |
| C0027626 | Инвазивные новообразования | 5.43 | <0.001 | FN1, ALDOA, CFL1, PDCD4, KRT19, ACTB, CTNNB1, CALU |
| C0024668 | Новообразования молочной железы | 4.39 | <0.001 | FN1, ACTG1, RPL6, PLK2, ACTB, RASA1, HNRNPAB |
Необходимо отметить, что проблема взаимоотношений беременности и роста злокачественных новообразований занимает особое место в современной медицине. В первую очередь интерес к данной проблеме обусловлен сходством обоих процессов по многим признакам на молекулярном, клеточно-тканевом и организменном уровнях, включая изменения нейроэндокринного, иммунного и метаболического статуса организма, сходные фенотипические свойства эмбриональных и злокачественных клеток, такие как способность к инвазивному росту, аутокринной секреции ростовых факторов, индукции микроциркуляции, “ускользанию” из-под иммунного надзора организма и другие [32]. В рамках данной проблемы особое внимание исследователей в последние годы уделяется поиску общих сигнальных путей инвазии клеток трофобласта в децидуальную ткань плаценты и процессов опухолевой инвазии. Показано, что клетки вневорсинчатого трофобласта и раковые клетки демонстрируют очень похожий молекулярный фенотип, как на уровне транскрипционной активности генов, так и на уровне метилирования промоторов [33–35]. Следует отметить, что клетки трофобласта с их способностью к пролиферации и дифференцировке, апоптозу и выживанию, миграции, ангиогенезу и иммунной модуляции, использующие в процессе инвазии сходные с раковыми процессами молекулярные пути, делают их привлекательной моделью для изучения рака.
Примечательно, что канонический Wnt-каскад, контролирующий связывание β-катенина с транскрипционными факторами TCF/LEF, является наиболее важным патогенетическим звеном в поддержании фенотипа опухолеинициирующих клеток и эпителиально-мезенхимального перехода, необходимых для метастазирования опухоли [36]. Важно отметить, что формирование плаценты начинается с прорастания ворсинок трофобласта в децидуальную оболочку матери с последующим формированием активно пролиферирующих участков – цитотрофобластических колонн, часть наиболее дистально расположенных клеток которых также претерпевает эпителиально-мезенхимальный переход и приобретает способность к миграции и инвазии. После инициации инвазии трофобласта в децидуальную оболочку начинает формироваться пул вневорсинчатого трофобласта, принимающего активное участие в ремоделировании спиральных артерий. На молекулярном уровне эпителиально-мезенхимальный переход в плаценте может реализовываться путем различных сигнальных каскадов, включая и путь Wnt/β-катенина [37]. Примечательно, что мутации в этом каскаде ассоциированы с опухолевым ростом, участвуют в поддержании опухолеинициирующих клеток и метастазировании, а ингибиторы сигнального пути Wnt рассмативаются в качестве перспективных противоопухолевых препаратов. Так, показано, что подавление экспрессии или делеции β-катенина ингибирует образование опухолеинициирующих клеток в модели хронического миелолейкоза, острой миелоцитарной лейкемии и опухолях молочной железы [36].
Современные исследования продемонстрировали, что АС РНК, является важным уровнем регуляции экспрессии генов, нарушения которого могут способствовать росту и химиорезистентности опухолевых клеток [38, 39]. В связи с этим, аномальные изменения сплайсинга пре-мРНК считаются одной из ключевых особенностей раковых клеток, а изучение АС – одним из перспективных направлений поиска потенциальных биомаркеров для диагностики злокачественных опухолей.
Сплайсинг пре-мРНК осуществляет сплайсосома, представляющая собой высоко динамичную структуру, состоящую из рибонуклеопротеиновых комплексов, включающих в состав ряд малых ядерных РНК и около 200 белков [40]. Большая часть этих белков является регуляторами сплайсинга, которые контролируют выбор сайта сплайсинга посредством распознавания определенных участков пре-мРНК и определяют, какие участки должны войти в конечный транскрипт зрелой мРНК. В данном контексте интересными представляются полученные нами результаты функциональной аннотации генов, характеризующихся экспрессией пяти и более транскриптов в ДК, которые свидетельствуют об ассоциации данного кластера генов с такими биологическими процессами (Gene Ontology) и сигнальными путями KEGG как “Регуляция альтернативного сплайсинга мРНК с помощью сплайсосомы” и “Сплайсосома”.
Таким образом, представляются чрезвычайно перспективными дальнейшие исследования, характеризующие функциональную роль альтернативно сплайсированных генов в ген-генных сетях сигнального пути Wnt/β-катенина при физиологической и патологической беременности, а также онкологических заболеваниях. Изучение альтернативного сплайсинга ДК открывает возможности для понимания формирования на уровне транскрипции тканевых и клеточных различий, путей развития различных патологических процессов, а также некоторых механизмов плацентации и канцерогенеза, что позволит обнаружить критически важные гены и сигнальные пути, которые могут служить биомаркерами и/или мишенями для разработки таргетной терапии акушерских заболеваний и злокачественных новообразований.
АС играет фундаментальную роль во многих важнейших аспектах физиологии человека, включая гомеостаз, дифференцировку клеток, а также приобретение и поддержание идентичности тканей. В настоящей работе впервые в мире проведен анализ событий альтернативного сплайсинга в децидуальных клетках плацентарной ткани человека. Полученные результаты подтверждают важность альтернативного сплайсинга, который существенно увеличивает транскрипционное разнообразие и представляет собой значимый механизм регуляции генов в децидуальных клетках. Логический анализ реконструированной генной сети продемонстрировал высокую степень взаимодействий альтернативно-сплайсированных генов и позволил выявить регуляторные связи, обеспечивающие координированную экспрессию большинства центральных генов. Центральное место в построенной сети занимают гены RPS27A, HNRNPK, CTNNB1, EIF4G1, HNRNPM, ACTB, HNRNPA2B1, HNRNPH1, RPS9, RPL6, EEF1B2, RPL10, RPL15, RPL23, RPL38, RPL7A, SERBP1, ассоциированные с инициацией и элонгацией трансляции у эукариот, а также модуляцией ангиогенеза и адгезии клеток, опосредованной DE-кадгерином. Для более детального изучения АС и характеристики соотношения отдельных изоформ генов в ДК требуется выполнение дальнейшего комплексного анализа на основе данных геномного и транскриптомного секвенирования, а также количественной оценки представленности изоформ мРНК ключевых генов с применением метода ПЦР в реальном времени над которым в настоящее время и работают авторы.
Настоящее исследование показало, что ряд генов, подверженных альтернативному сплайсингу в децидуальных клетках, ассоциирован с осложнениями беременности, что обусловливает высокую актуальность дальнейшего изучения данного механизма процессинга РНК в когорте пациенток c акушерской патологией. Необходимо отметить, что продукты альтернативно сплайсированных генов по результатам функциональной аннотации и литературным данным также ассоциированы с развитием онкологических заболеваний через сигнальный путь Wnt/β-катенина. В связи с этим, представляются чрезвычайно перспективными дальнейшие исследования, характеризующие функциональную роль АС в ген-генных сетях каскада Wnt при физиологической и патологической беременности, а также при развитии опухолевых заболеваний, что может обеспечить не только разработку новых стратегий профилактики и терапии акушерской патологии и злокачественных новообразований, но и лучшее понимание молекулярных механизмов данных патологических состояний.
Работа выполнена при финансовой поддержке РФФИ № 20-34-90128.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Pan Q., Shai O., Lee L.J. et al. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing // Nature Genet. 2008. V. 40. № 12. P. 1413–1415. https://doi.org/10.1038/ng.259
Wang E.T., Sandberg R., Luo S. et al. Alternative isoform regulation in human tissue transcriptomes // Nature. 2008. V. 456. № 7221. P. 470–476. https://doi.org/10.1038/nature07509
Wang G.S., Cooper T.A. Splicing in disease: disruption of the splicing code and the decoding machinery // Nat. Rev. Genet. 2007. V. 8. № 10. P. 749–761. https://doi.org/10.1038/nrg2164
Raj T., Li Y.I., Wong G. et al. Integrative transcriptome analyses of the aging brain implicate altered splicing in Alzheimer’s disease susceptibility // Nat. Genet. 2018. V. 50. № 11. P. 1584–1592. https://doi.org/10.1038/s41588-018-0238-1
Tejedor J.R., Tilgner H., Iannone C. et al. Role of six single nucleotide polymorphisms, risk factors in coronary disease, in OLR1 alternative splicing // RNA. 2015. V. 6. P. 1187–1202. https://doi.org/10.1261/rna.049890
Kahles A., Lehmann K., Toussaint N.C. et al. Comprehensive analysis of alternative splicing across tumors from 8705 patients // Cancer Cell. 2018. V. 34. № 2. P. 211–224. https://doi.org/10.1016/j.ccell.2018.07.001
Takata A., Matsumoto N., Kato T. Genome-wide identification of splicing QTLs in the human brain and their enrichment among schizophrenia-associated loci // Nat. Communications. 2017. V. 8. P. 14519. https://doi.org/10.1038/ncomms14519
Ruano C.S.M., Apicella C., Jacques S. et al. Alternative splicing in normal and pathological human placentas is correlated to genetic variants // Hum. Genet. 2021. V. 140. № 5. P. 827–848. https://doi.org/10.1007/s00439-020-02248-x
Schatz F., Guzeloglu-Kayisli O., Arlier S. et al. The role of decidual cells in uterine hemostasis, menstruation, inflammation, adverse pregnancy outcomes and abnormal uterine bleeding // Hum. Reprod. Update. 2016. V. 4. P. 497–515. https://doi.org/10.1093/humupd/dmw004
Brighton P.J., Maruyama Y., Fishwick K. et al. Clearance of senescent decidual cells by uterine natural killer cells in cycling human endometrium // Elife. 2017. V. 6. P. e31274. https://doi.org/10.7554/eLife.31274
Robson S.C., Simpson H., Ball E. et al. Punch biopsy of the human placental bed // Am. J. Obstetrics and Gynecol. 2002. V. 187. № 5. P. 1349–1355. https://doi.org/10.1067/mob.2002.126866
WEB-based GEne SeT AnaLysis Toolkit. http://www. webgestalt.org/. Accessed April, 2022.
Szklarczyk D., Gable A.L., Lyon D. et al. STRING v11: Protein–protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets // Nucl. Ac. Res. 2019. V. 47. № D1. P. D607–D613. https://doi.org/10.1093/nar/gky1131
Goldstein L.D., Ca Y., Pau G. et al. Prediction and quantification of splice events from RNA-seq data // PLoS One. 2016. V. 11. № 5. P. e0156132. https://doi.org/10.1371/journal.pone.0156132
Knöfler M., Pollheimer J. Human placental trophoblast invasion and differentiation: a particular focus on Wnt signaling // Front. Genet. 2013. V. 4. P. 190. https://doi.org/10.3389/fgene.2013.00190
Sonderegger S., Pollheimer J., Knöfler M. Wnt signalling in implantation, decidualisation and placental differentiation–review // Placenta. 2010. V. 31. № 10. P. 839–847. https://doi.org/10.1016/j.placenta.2010.07.011
Bao H., Liu D., Xu Y. et al. Hyperactivated Wnt-β-catenin signaling in the absence of sFRP1 and sFRP5 disrupts trophoblast differentiation through repression of Ascl2 // BMC Biology. 2020. V. 18. № 1. P. 1–14. https://doi.org/10.1186/s12915-020-00883-4
Chronopoulou E., Koika V., Tsiveriotis K. et al. Wnt4, Wnt6 and β-catenin expression in human placental tissue – is there a link with first trimester miscarriage? Results from a pilot study // Reprod. Biol. and Endocrinology. 2022. V. 20. № 1. P. 1–10. https://doi.org/10.1186/s12958-022-00923-4
Xie H., Tranguch S., Jia X. et al. Inactivation of nuclear Wnt-beta-catenin signaling limits blastocyst competency for implantation // Development. 2008. V. 135. № 4. P. 717–727. https://doi.org/10.1242/dev.015339
Zeng X., Zhang Y., Xu H. et al. Secreted frizzled related protein 2 modulates epithelial–mesenchymal transition and stemness via Wnt/β-catenin signaling in choriocarcinoma // Cell. Physiol. and Biochem. 2018. V. 50. № 5. P. 1815–1831. https://doi.org/10.1159/000494862
Pollheimer J., Loregger T., Sonderegger S. et al. Activation of the canonical wingless/T-cell factor signaling pathway promotes invasive differentiation of human trophoblast // Am. J. Pathol. 2006. V. 168. № 4. P. 1134–1147. https://doi.org/10.2353/ajpath.2006.050686
Chen Y., Zhang Y., Deng Q. et al. Wnt5a inhibited human trophoblast cell line HTR8/SVneo invasion: Implications for early placentation and preeclampsia // J. of Maternal-Fetal & Neonatal Med. 2016. V. 29. № 21. P. 3532–3538. https://doi.org/10.3109/14767058.2016.1138102
Wang G., Zhang Z., Chen C. et al. Dysfunction of WNT4/WNT5A in deciduas: Possible relevance to the pathogenesis of preeclampsia // J. Hypertension. 2016. V. 34. № 4. P. 719–727. https://doi.org/10.1097/hjh.0000000000000851
Hess A.P., Hamilton A.E., Talbi S. et al. Decidual stromal cell response to paracrine signals from the trophoblast: amplification of immune and angiogenic modulators // Biol. Reprod. 2007. V. 76. № 1. P. 102–117. https://doi.org/10.1095/biolreprod.106.054791
Newman A.C., Hughes C.C.W. Macrophages and angiogenesis: A role for Wnt signaling // Vascular Cell. 2012. V. 4. № 1. P. 1–7. https://doi.org/10.1186/2045-824X-4-13
Yang C., Iyer R.R., Albert C.H. et al. β-Catenin signaling initiates the activation of astrocytes and its dysregulation contributes to the pathogenesis of astrocytomas // PNAS. 2012. V. 109. № 18. P. 6963–6968. https://doi.org/10.1073/pnas.1118754109
Watanabe T., Nanamiya H., Kojima M. et al. Clinical relevance of oncogenic driver mutations identified in endometrial carcinoma // Translational Oncology. 2021. V. 14. № 3. P. 101010. https://doi.org/10.1016/j.tranon.2021.101010
Honest H., Bachmann L.M., Gupta J.K. et al. Accuracy of cervicovaginal fetal fibronectin test in predicting risk of spontaneous preterm birth: Systematic review // BMJ. 2002. V. 325. № 7359. P. 301. https://doi.org/10.1136/bmj.325.7359.301
Bodova K.B., Biringer K., Dokus K. et al. Fibronectin, plasminogen activator inhibitor type 1 (PAI-1) and uterine artery Doppler velocimetry as markers of preeclampsia // Disease Markers. 2011. V. 30. № 4. P. 191–196. https://doi.org/10.3233/DMA-2011-0772
Banadakoppa M., Balakrishnan M., Yallampalli C. Common variants of fetal and maternal complement genes in preeclampsia: Pregnancy specific complotype // Sci. Reports. 2020. V. 10. № 1. P. 1–9. https://doi.org/10.1038/s41598-020-60539-9
Abdi-Shayan S., Monfaredan A., Moradi Z. et al. Association of CD46 IVS1-1724 C>G single nucleotide polymorphism in Iranian women with unexplained recurrent spontaneous abortion (URSA) // Iranian J. Allergy, Asthma and Immunol. 2016. V. 15. № 4. P. 303–308.
Louwen F., Muschol-Steinmetz C., Reinhard J. et al. A lesson for cancer research: Placental microarray gene analysis in preeclampsia // Oncotarget. 2012. V. 3. № 8. P. 759. https://doi.org/10.18632/oncotarget.595
Smith Z.D., Shi J., Gu H. et al. Epigenetic restriction of extraembryonic lineages mirrors the somatic transition to cancer // Nature. 2017. V. 549. № 7673. P. 543–547. https://doi.org/10.1038/nature23891
Macaulay E.C., Chatterjee A., Cheng X. et al. The genes of life and death: A potential role for placental-specific genes in cancer: Active retrotransposons in the placenta encode unique functional genes that may also be used by cancer cells to promote malignancy // BioEssays. 2017. V. 39. № 11. P. 1700091. https://doi.org/10.002/bies.201700091
Afzal J., Maziarz J.D., Hamidzadeh A. et al. Evolution of placental invasion and cancer metastasis are causally linked // Nat. Ecol. Evol. 2019. V. 3. № 12. P. 1743–1753. https://doi.org/10.1038/s41559-019-1046-4
Татарский В.В. Сигнальный путь Wnt: перспективы фармакологического регулирования // Усп. мол. онкологии. 2016. Т. 3. № 1. С. 28–31. https://doi.org/10.17650/2313-805X.2016.3.1.28-31
Вишнякова П.А., Тарасова Н.В., Володина М.А. и др. Эпителиально-мезенхимальный переход в плаценте при преэклампсии // Акушерство и гинекология. 2016. № 12. С. 53–57. https://doi.org/10.18565/aig.2016.12.53-7
Sebestyén E., Zawisza M., Eyras E. Detection of recurrent alternative splicing switches in tumor samples reveals novel signatures of cancer // Nucl. Ac. Res. 2015. V. 43. № 3. P. 1345–1356. https://doi.org/10.1093/nar/gku1392
Martinez-Montiel N., Rosas-Murrieta N.H., Anaya Ruiz M. et al. Alternative splicing as a target for cancer treatment // Int. J. Mol. Sci. 2018. V. 19. № 2. P. 545. https://doi.org/10.3390/ijms19020545
Will C.L., Lührmann R. Spliceosome structure and function // Cold Spring Harbor Perspectives in Biology. 2011. V. 3. № 7. P. a003707. https://doi.org/10.1101/cshperspect.a003707
Дополнительные материалы отсутствуют.