Генетика, 2022, T. 58, № 10, стр. 1197-1209
Генетическая структура подверженности коморбидности сердечно-сосудистого континуума
И. А. Гончарова 1, *, Ю. А. Королева 1, А. А. Слепцов 1, Т. В. Печерина 2, В. В. Кашталап 2, В. П. Пузырев 1, 3, М. С. Назаренко 1, 3
1 Научно-исследовательский институт медицинской генетики Томского национального исследовательского медицинского центра Российской академии наук
634050 Томск, Россия
2 Научно-исследовательский институт комплексных проблем
сердечно-сосудистых заболеваний
650002 Кемерово, Россия
3 Сибирский государственный медицинский университет
634050 Томск, Россия
* E-mail: irina.goncharova@medgenetics.ru
Поступила в редакцию 04.04.2022
После доработки 06.05.2022
Принята к публикации 12.05.2022
- EDN: MGFDVO
- DOI: 10.31857/S0016675822100034
Аннотация
Проанализирована генетическая структура подверженности коморбидности сердечно-сосудистого континуума (ССК) и оценена функциональная значимость генетических вариантов, ассоциированных с патологией. Показано, что с заболеваниями ССК ассоциированы rs1333049 (CDKN2B-AS1), rs3739998 (KIAA1462), rs3765124 (ADAMDEC1), rs1007856 (ITGB5), формирующие генетическую структуру подверженности к ИБС, осложненной ИМ независимо от наличия/отсутствия факторов риска. Генетические варианты rs626750 (MMP3/MMP12), rs1991401 (DDX5), rs2878771 (AQP2) и rs2277698 (TIMP2) связаны с ишемической болезнью сердца ИБС и ИМ в зависимости от наличия факторов риска (АГ, ГХ и СД2). С ИМ без сопутствующих патологий ассоциированы rs3739998 (KIAA1462), rs1991401 (DDX5), rs2878771 (AQP2); с ИМ + АГ – rs1333049 (CDKN2B-AS1), rs3765124 (ADAMDEC1), rs1007856 (ITGB5); с ИМ + АГ + ГХ – rs1333049 (CDKN2B-AS1), rs3765124 (ADAMDEC1), rs1007856 (ITGB5), rs626750 (MMP3/MMP12); с “синтропией ССК” – rs3739998 (KIAA1462), rs2277698 (TIMP2). Все SNPs, ассоциированные с заболеваниями ССК, являются cis-eQTL-локусами и влияют на экспрессию генов в тканях органов-мишеней ССК или изменяют аффинность транскрипционных факторов в результате потери или появления сайтов их связывания.
Ишемическая болезнь сердца (ИБС) и ее осложнение в виде инфаркта миокарда (ИМ) входят в состав заболеваний сердечно-сосудистого континуума (ССК), основными пусковыми механизмами которого являются гиперхолестеринемия (ГХ), артериальная гипертензия (АГ) и сахарный диабет второго типа (СД2) [1]. Между патологическими состояниями, входящими в сердечно-сосудистый континуум, имеется тесная связь, что подтверждается клинически их высокой частотой одновременной встречаемости.
Болезни ССК представляют собой многофакторные заболевания с существенной генетической компонентой. В своей основе они имеют сложную генетическую структуру с разнообразными по частоте и эффектам комбинациями аллелей. Учитывая, что заболевания ССК тесно связаны друг с другом с эпидемиологической и патофизиологической точек зрения, можно предположить, что их генетическая составляющая имеет много общего.
Широкогеномные исследования ассоциаций (GWAS) идентифицировали сотни однонуклеотидных вариантов (SNPs), ассоциированных с риском ИБС, уровнем артериального давления или АГ, уровнями липидов в сыворотке крови или ГХ, уровнем глюкозы в сыворотке крови или СД2, индексом массы тела или ожирением [2]. Однако работы, в которых проводится поиск общих для болезней ССК генетических вариантов/генов/регионов хромосом, немногочисленны. Часть из них основана на обобщении результатов GWAS в отношении отдельных заболеваний ССК в разных выборках [3–8]. Вместе с тем, механизмы, с помощью которых ассоциированные гены способствуют увеличению риска развития заболевания, в большей степени неизвестны [9].
В работах нашего исследовательского коллектива ранее с использованием широкого спектра SNPs и различных методических подходов проведена оценка особенностей генетической компоненты, лежащей в основе развития коморбидности ССК. Было установлено, что генетическая компонента подверженности различна для ИБС, сочетания ИБС + АГ, а также ИБС + АГ + ГХ + СД2 [10], а полиморфизм генов, белковые продукты которых участвуют в процессах фиброгенеза, маркирует различия генетической компоненты между ИБС с ИМ без дополнительных факторов риска и ИБС с ИМ и сопутствующими АГ, ГХ и СД2 [11]. Однако данные исследования имеют ряд ограничений, включая небольшие по объему выборки.
Особенностью настоящего исследования является расширение группы больных с ИБС, осложненной ИМ и различным сочетанием сопутствующих факторов риска, которые обусловливают большую тяжесть заболевания. Кроме того, важным моментом в изучении заболеваний ССК является оценка функциональной значимости генетических вариантов с привлечением широкого спектра баз данных, которая ранее была оценена лишь частично [12].
Таким образом, цель настоящего исследования заключалась в анализе генетической структуры подверженности коморбидным состояниям у пациентов с различными сочетаниями заболеваний ССК с последующей оценкой in silico функциональной значимости вариантов, ассоциированных с патологией.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены пациенты с ИБС и ИМ (n = 539), госпитализированные с острым коронарным синдромом (ОКС) или для проведения аортокоронарного шунтирования в НИИ КПССЗ (г. Кемерово). Длительность ИБС в среднем составила 5.4 ± 7.0 лет. Средний возраст больных соответствовал 59.5 ± 9.1 годам. Соотношение мужчин и женщин 2.99 (404/135). Среди пациентов артериальная гипертензия регистрировалась у 410 (76.1%), гиперхолестеринемия у 224 (41.5%), ожирение у 174 (32.3%), сахарный диабет второго типа у 135 (25.0%).
Для изучения генетической структуры коморбидности сердечно-сосудистого континуума из общей группы пациентов были сформированы следующие подгруппы: больные с ИМ, но без сопутствующих АГ, ГХ и СД2 (подгруппа обозначена как ИМ, n = 95); с АГ, но без ГХ и СД2 (подгруппа обозначена как ИМ + АГ, n = 154); с АГ и ГХ, но без СД2 (подгруппа обозначена как ИМ + АГ + ГХ, n = 115); с АГ, ГХ и СД2 (подгруппа обозначена как “синтропия ССК”, n = 90). В анализ генетической структуры коморбидности из общей группы не вошли 85 человек: больные с СД2, но без других изученных сопутствующих заболеваний; с ГХ, но без других сопутствующих заболеваний; не известно наличие АГ или ГХ.
В качестве группы сравнения использовалась популяционная выборка жителей Сибирского региона (n = 286), средний возраст которых соответствовал 56.7 ± 10.1 годам. Соотношение мужчин и женщин в группе составило 1.26 (160/126). По этнической принадлежности все обследованные индивиды русские. Национальная принадлежность устанавливалась на основании результатов анкетирования. Формирование выборки выполнено с использованием материала биобанка НИИ медицинской генетики.
Генотипирование 58 SNPs выполнялось с помощью MALDI-TOF масс-спектрометрии на системе приборов Sequenom Mass ARRAY (Sequenom, США). Характеристика используемой панели генетических вариантов приведена в статье [13]. В панель для генотипирования был включен маркер CDKN2B-AS1 (rs1333049), ранее показавший ассоциацию с “синтропией ССК” в наших исследованиях с использованием микрочипов Illumina Custom Genotyping Microarraysi Select HD (Illumina, США) [10]. Прочтение генотипов CDKN2B-AS1 (rs1333049) в вышеприведенном исследовании было выполнено с обратной цепи, тогда как в настоящем исследовании – с прямой.
Статистический анализ данных проведен в программной среде R. Анализ различий по качественным признакам (пол, наличие сопутствующих патологий), а также частот аллелей и генотипов выполняли при помощи критерия χ2 с поправкой на множественность сравнений методом перестановок (permutation test). Для сравнения средних величин между группами использовали тест Манна–Уитни. Статистические гипотезы проверяли на 5%-ном уровне значимости.
Анализ функционального эффекта генетических вариантов, которые приводят к аминокислотной замене в структуре белка, выполнен с помощью онлайн инструментов геномного браузера Ensembl (https://www.ensembl.org/index.html) и программы Glycosylation Predictor (https://comp.chem.nottingham.ac.uk/glyco/). Регуляторный потенциал SNPs проанализирован с помощью онлайн сервисов HaploReg v4.1 (https://pubs.broadinstitute.org/mammals/haploreg/haploreg.php) и RegulomeDB v2.0 (https://regulomedb.org/regulome-search/). Связь полиморфизма с количественными изменениями в профиле экспрессии генов (eQTL) оценен с помощью данных проектов Genotype-Tissue Expression (GTEx Portal; http://www.gtexportal.org/), NESDA NTR Conditionale QTL Catalog (https://eqtl.onderzoek.io/index.php?page=info), FIVEx (https:// fivex.sph.umich.edu/), POLYMPACT (https://bcglab.cibio.unitn.it/polympact/). Предикция взаимодействия длинной некодирующей РНК и микроРНК с мРНК генов выполнена с использованием инструментов LncRRIsearch (http://rtools.cbrc.jp/ LncRRIsearch/index.cgi), MIENTURNET (http:// userver.bio.uniroma1.it/apps/mienturnet/) и miRTarBase (https://mirtarbase.cuhk.edu.cn/~miRTarBase/ miRTarBase_2022/php/index.php).
РЕЗУЛЬТАТЫ
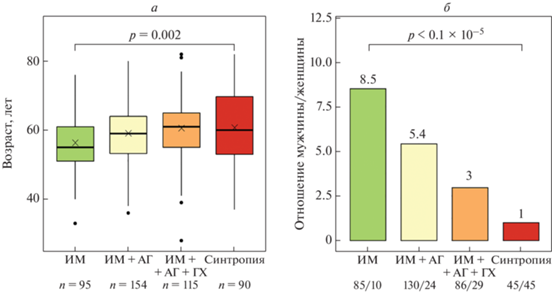
При разделении группы пациентов с ИБС и ИМ на подгруппы в зависимости от наличия/отсутствия АГ, ГХ и СД2 выявлено, что число коморбидных заболеваний ССК в подгруппах и средний возраст пациентов имеют прямо пропорциональную зависимость, а соотношение мужчин и женщин обратно пропорциональную (рис. 1). В подгруппах “ИМ” и “синтропия ССК” средний возраст составил 56.4 ± 8.7 и 60.7 ± 9.6 лет (р = 0.002), а соотношение мужчин и женщин 8.5 (85/10) и 1 (45/45; р < 0.1 × 10–5) соответственно.
Рис. 1.
Связь степени коморбидности заболеваний ССК и среднего возраста пациентов (а), а также соотношения мужчин и женщин (б). ИБС – ишемическая болезнь сердца; ИМ – инфаркт миокарда; ГХ – гиперхолестеринемия; АГ – артериальная гипертензия; СД2 – сахарный диабет второго типа.
В популяции славян-жителей Сибирского региона частота “редких” аллелей rs3739998 (KIAA1462), rs3765124 (ADAMDEC1) и rs1007856 (ITGB5) выше по сравнению с европейцами (табл. 1). Анализ ассоциации показал, что с ИБС, осложненной ИМ, связаны rs1333049 (CDKN2B-AS1), rs3739998 (KIAA1462), rs3765124 (ADAMDEC1), rs1007856 (ITGB5) (табл. 1). Генотипы/аллели CC/С rs1333049, CC/С rs3739998, AA/A rs3765124, AA/A rs1007856 ассоциированы с умеренным увеличением риска развития данной патологии. Наиболее “сильную” ассоциацию в отношении ИБС и ИМ показал вариант rs1333049 (CDKN2B-AS1): генотип CC увеличивал риск патологии в 1.9 раз (OR = 1.86; 95%CI (1.27–2.72); p = 0.001).
Таблица 1.
Полиморфные варианты генов, ассоциированные с ИБС и ИМ
| SNP ID/ген | MAF европейцы (n = 18 854)/жители Сибирского региона (n = 286), % | Генотип/аллель, ассоциированный с ИБС | Частота генотипа в популяции/ у пациентов с ИБС, %; OR (95%CI); p | Частота аллеля в популяции/ у пациентов с ИБС, %; OR (95%CI); p |
|---|---|---|---|---|
| rs1333049:G>C/CDKN2B-AS1 | C = 47/44 | CC/С | 17.3/28.0; 1.86 (1.27–2.72); 0.002 |
44.2/54.3; 1.50 (1.21–1.87); 0.0002 |
| rs3739998:G>C/KIAA1462 | G = 44/58 | CC/С | 15.9/25.6; 1.82 (1.24–2.68); 0.003 |
41.9/50.0; 1.39 (1.12–1.72); 0.003 |
| rs3765124:A>G/ADAMDEC1 | G = 43/49 | AA/A | 24.3/34.8; 1.66 (1.19–2.33); 0.004 |
51.1/58.1; 1.32 (1.07–1.63); 0.01 |
| rs1007856:A>G/ITGB5 | G = 44/52 | АА/A | 22.2/31.1; 1.58 (1.12–2.24); 0.015 |
48.5/56.2; 1.36 (1.10–1.68); 0.004 |
Примечание. MAF – частота редкого аллеля, согласно базе данных gnomAD NCBI; ИБС – ишемическая болезнь сердца; OR – отношение шансов; 95%CI – 95%-ный доверительный интервал; p – уровень значимости, полученный с помощью критерия χ2; полужирным шрифтом выделена ассоциация с наиболее высоким значением отношения шанса и уровнем значимости.
Генетические варианты, ассоциированные с ИБС и ИМ, проанализированы как в подгруппах пациентов, которые не имели традиционных факторов риска (АГ, ГХ и СД2), так и в подгруппах с их различными сочетаниями (табл. 2). В результате выявлено, что варианты rs3739998 (KIAA1462), rs1991401 (DDX5) и rs2878771 (AQP2) ассоциированы с развитием ИБС и ИМ без факторов риска. Варианты генов rs1333049 (CDKN2B-AS1), rs3765124 (ADAMDEC1) и rs1007856 (ITGB5) формируют подверженность к ИБС и ИМ на фоне АГ. Полиморфизм rs1333049 (CDKN2B-AS1), rs3765124 (ADAMDEC1), rs1007856 (ITGB5) и rs626750 (MMP3/MMP12) связан с риском ИБС и ИМ на фоне АГ и ГХ. Фенотип “синтропия ССК” ассоциирован с вариантами rs3739998 (KIAA1462) и rs2277698 (TIMP2).
Таблица 2.
Полиморфные варианты генов, ассоциированные с ИБС и ИМ на фоне факторов риска
| Пациенты с ИБС и ИМ | SNP ID/ген | Предрасполагающие генотипы; их частота в популяции/у пациентов; OR (95%CI); p |
|---|---|---|
| Без АГ, ГХ и СД2 | rs3739998:G>C/KIAA1462 | CC; 15.9/26.8; 2.05 (1.17–3.59); 0.017 |
| rs1991401:A>G/DDX5 | GG; 12.7/23.9; 2.17 (1.07–4.43); 0.048 | |
| rs2878771:G>C/AQP2 | GG; 61.4/76.4; 2.03 (1.09–3.82); 0.035 | |
| C АГ | rs1333049:G>C/CDKN2B-AS1 | CC; 17.3/27.9; 1.97 (1.21–3.21); 0.008 |
| rs3765124:A>G/ADAMDEC1 | AA; 24.3/36.8; 1.81 (1.17–2.81); 0.011 | |
| rs1007856:A>G/ITGB5 | AA; 22.2/34.4; 1.84 (1.17–2.90); 0.011 | |
| C АГ + ГХ | rs1333049:G>C/CDKN2B-AS1 | CC; 17.3/27.5; 1.82 (1.07–3.10); 0.038 |
| rs3765124:A>G/ADAMDEC1 | AA; 24.3/41.3; 2.19 (1.36–3.51); 0.002 | |
| rs1007856:A>G/ITGB5 | AA; 22.2/37.2; 2.08 (1.28–3.38); 0.004 | |
| rs626750:G>A/MMP3/MMP12 | GG; 60.2/73.6; 1.85 (1.12–3.04); 0.021 | |
| C АГ + ГХ + СД2 | rs3739998:G>C/KIAA1462 | CC; 15.9/35.6; 2.93 (1.69–5.07); 0.0002 |
| rs2277698:C>T/TIMP2 | CC; 76.9/88.1; 2.31 (1.12–4.76); 0.031 |
Примечание. ИБС – ишемическая болезнь сердца; ИМ – инфаркт миокарда; ГХ – гиперхолестеринемия; АГ – артериальная гипертензия; СД2 – сахарный диабет второго типа; OR – отношение шансов; 95%CI – 95%-ный доверительный интервал; p – уровень значимости, полученный с помощью критерия χ2; полужирным шрифтом выделены SNP/гены, которые ассоциированы только с определенным сочетанием заболеваний ССК.
Для понимания механизмов, обеспечивающих связь генетических вариантов с патологией, в работе была оценена in silico функциональная значимость SNPs, ассоциированных с заболеваниями ССК (табл. 3). Большая часть вариантов располагается в некодирующих регионах: в интронах (rs1007856 (ITGB5), rs1991401 (DDX5)); в межгенном регионе локуса 9p21.3 в области белок-некодирующей РНК CDKN2B-AS1 (rs1333049); между генами MMP3 и MMP12 (rs626750); в 3'UTR регионе гена AQP2 (rs2878771). Миссенс-варианты в генах KIAA1462 (rs3739998:G>C) и ADAMDEC1 (rs3765124:A>G) приводят к замене аминокислот в структуре кодируемых ими белков (ENSP00000364526.1:p.Ser1002Thr и ENSP00000256412.4:p.Asn444Ser соответственно). Полиморфизм гена KIAA1462 является “доброкачественным”, а SNPs гена ADAMDEC1 – “возможно патогенным”, при использовании шкал предсказания патогенности геномного браузера Ensembl. Аминокислота серин в обоих белках KIAA1462 и ADAMDEC1 подвергается гликозилированию, согласно программе Glycosylation Predictor [14]. В случае rs3739998 (KIAA1462):G>C и замены p.Ser1002Thr происходит потеря гликозилирования, а при замене p.Asn444Ser, наоборот, – его приобретение. Вариант rs2277698 (TIMP2) приводит к синонимичной замене аминокислот в белке.
Таблица 3.
Функциональная значимость восьми SNPs, ассоциированных с заболеваниями ССК
| № | SNP ID/тип/ген/локус | Предрасполагающий генотип/заболевания ССК | Оценка регуляторного потенциала SNP | cis-eQTL-локусы (генотип/аллель, направление изменения экспрессии, ген – ткань) | POLYMPACT (аллель, изменение аффинности сайта связывания ТФ, название ТФ) | |||
|---|---|---|---|---|---|---|---|---|
| HaploReg | RegulomeDB ранг/шкала |
GTEx Portal | NESDA NTR Conditional eQTL Catalog | FIVEx | ||||
| 1 | rs1333049:G>C/ межгенный/ CDKN2B-AS1/9p21.3 | СС; ИБС с ИМ; ИБС с ИМ + АГ; ИБС с ИМ + АГ + ГХ | МГ (2), ТФ (2) | 5/0.13 | – | – | – | С “–” SALL1, ZNF713, ZNF14; ∨ SIRT6, MYOD1; ∧ POLR3A, SALL3 |
| 2 | rs3739998:G>C/ миссенс/KIAA1462 (JCAD)/10p11.23 | СС; ИБС с ИМ; ИБС с ИМ + АГ + ГХ + СД2 | МГ (21), ДНКаза (19), ТФ (2), СБ (1) | 1b/0.64 | CC↓ KIAA1462 – А, ББА |
– | – | – |
| 3 | rs3765124:A>G/ миссенс/ ADAMDEC1/ 8p21.2 | АА; ИБС с ИМ; ИБС с ИМ + АГ; ИБС с ИМ + АГ + ГХ | МГ (2), ТФ (3) | 7/0.18 | АА↑ ADAMDEC1 – А, ББА, К, ЖТ; АА↑ ADAM28 – К | G↓ ADAMDEC1; G↓ ADAM28 – К | G↓ ADAMDEC1 – К (моноциты); G↓ ADAM28 – К (нейтрофилы) | – |
| 4 | rs1007856:A>G/ интрон/ITGB5/3q21.2 | АА; ИБС с ИМ; ИБС с ИМ + АГ; ИБС с ИМ + АГ + ГХ | ДНКаза (9), ТФ (4) | 4/0.61 | АА↓ ITGB5 – А, КА, ББА, К | – | G↓ ITGB5 – ЖТ; G↑ ITGB5 – ББА | G ∨ PGR, TMEM37; ∧ SMAD4, ZNF266 |
| 5 | rs1991401:A>G/ интрон/DDX5/2 кб “вверх” от гена CEP95/17q23.3 | GG; ИБС с ИМ | МГ (24), ДНКаза (53), ТФ (3), СБ (44) | 2a/0.83 | GG↓ DDX5 – К, ББА, А, ЖТ, ГМ; GG↑ CEP95 – К, ББА, А | G↓ DDX5; G↑ CEP95 – К | G↓ DDX5 – К (нейтрофилы;
Т-клетки); G↑ CEP95 – К
(нейтрофилы,
Т-клетки;
моноциты); G↑ POLG2 – К (нейтрофилы) |
G “+” ZNF430; “–” ZNF791; ∨ HOXC13; ∧ ZNF679 |
| 6 | rs2878771:G>C/ 3'UTR AQP2/интрон гена LOC101927318/ 12q13.12 | GG; ИБС с ИМ | МГ (1), ДНКаза (1), ТФ (1) | 4/0.61 | GG↓AQP2 – ГМ; GG↓ BCDIN3D – НП | – | С↑AQP2 – ГМ | С “+” TBX3; ∨ SMAD1-9 |
| 7 | rs626750:G>A/ межгенный/MMP3 и MMP12/11q22.2 | GG; ИБС с ИМ + АГ + ГХ | МГ (6), ДНКаза (1), ТФ (2) | 7/0.18 | GG↑ MMP1 – ТК | – | – | А “+” CEBPB; ∨ AHR |
| 8 | rs2277698:C>T/ синонимичная замена/TIMP2/ 17q25.3 | СC; ИБС с ИМ + АГ + ГХ + СД2 | МГ (3) | 5/0.13 | – | T↓ TIMP2 – К | – | Т ∨ GTF2IRD1 ∧ ZNF766 |
Примечание. ИБС – ишемическая болезнь сердца; ИМ – инфаркт миокарда; ГХ – гиперхолестеринемия; АГ – артериальная гипертензия; СД2 – сахарный диабет второго типа; МГ (количество тканей) – модификации гистонов; ДНКаза (количество тканей) – гиперчувствительные к ДНКазе I сайты; ТФ (количество факторов) – транскрипционные факторы; СБ (количество белков) – связанные белки; А – аорта, ББА – большеберцовая артерия, ГМ – головной мозг, ЖТ – жировая ткань, КА – коронарная артерия, К – кровь, НП – надпочечники, ТК – толстый кишечник; “–” – потеря сайта связывания для ТФ; “+” – появление сайта связывания для ТФ; ∨ – снижение аффинности для связывания ТФ более чем в 2 раза; ∧ – повышение аффинности связывания ТФ более чем в 2 раза; полужирным шрифтом выделены генетические варианты, которые являются “причинными” для изменения экспрессии генов.
При использовании онлайн сервиса HaploReg выявлено, что все ассоциированные с изученными фенотипами SNPs располагаются в регионах активных хроматиновых доменов, которые формируются посредством эпигенетической модификации гистонов, являясь “метками” активных промоторов/энхансеров, локализованы в гиперчувствительных к ДНКазе I сайтах, связываются с транскрипционными факторами (ТФ) или с белками в различных тканях, в том числе в органах-мишенях ССК (табл. 3). Однако согласно шкале RegulomeDB наиболее существенный регуляторный потенциал наблюдается для rs3739998 (KIAA1462) и rs1991401 (DDX5).
По данным GTEx Portal, который включает данные о генотипах и экспрессии генов в 54 тканях 1000 относительно здоровых индивидов, полиморфные варианты rs3739998 (KIAA1462), rs3765124 (ADAMDEC1), rs1007856 (ITGB5), rs1991401 (DDX5) и rs2878771 (AQP2) относятся к cis-eQTL-локусам и связаны с изменением экспрессии генов в клетках органов-мишеней ССК (кровь, артерии, сердце, жировая ткань, надпочечники, толстый кишечник и головной мозг; табл. 3). Например, генотип СС rs3739998 гена KIAA1462, ассоциированный с ИБС и ИМ, в том числе на фоне АГ + ГХ + СД2, связан со снижением экспрессии гена KIAA1462 в аорте и большеберцовой артерии. Генотип АА rs3765124 гена ADAMDEC1, увеличивающий риск развития ИБС и ИМ на фоне АГ и ГХ, связан с повышением уровня экспрессии этого гена в аорте, большеберцовой артерии, цельной крови и жировой ткани, а также с повышением экспрессии гена ADAM28 в цельной крови.
Для облегчения функциональной интерпретации регуляторных генетических вариантов из транскриптомных ресурсов популяционного масштаба, таких как GTEx и др., разработан инструмент FIVEx (Functional Interpretation and Visualization of Expression), с помощью которого можно оценить вероятность того, что конкретный генетический вариант является причинным и тканеспецифичным для изменения экспрессии гена/генов выявить совместно регулируемые гены, использовать дополнительную информацию из других ресурсов (GWAS Catalog, UKB PheWeb, FinnGEN PheWeb и др.). Согласно данным FIVEx, генетические варианты rs3765124 (ADAMDEC1), rs1007856 (ITGB5), rs1991401 (DDX5) и rs2878771 (AQP2), ассоциированные с изученными в настоящем исследовании фенотипами, могут влиять на изменение экспрессии генов в тканях-мишенях сердечно-сосудистых заболеваний (ССЗ), но это влияние оценивается как слабое, а SNPs не являются причинными (табл. 3). Только rs1991401 гена DDX5, возможно, представляет собой причинный вариант, обусловливающий изменение экспрессии генов СЕР95 (PIP – posterior inclusion probabilities, характеристика “причинности” варианта = 1) и DDX5 в клетках крови – нейтрофилах, Т-клетках (PIP = 0.99), а также гена POLG2 в нейтрофилах крови (PIP = 0.98).
Вместе с тем информация о функциональной роли SNP, основанная на вышепредставленных ресурсах, не в полной мере отражает механизмы регуляции функционирования генов в тканях при различных патологических состояниях. В одном из исследований (STARNET) был проведен анализ eQTL на основе РНК-секвенирования (RNA-seq) тканей внутренней грудной артерии без атеросклеротических поражений, корня аорты, крови, подкожной жировой ткани, висцеральной брюшной жировой ткани, скелетных мышц и печени, полученных от 600 человек, перенесших аортокоронарное шунтирование. Было обнаружено значительно больше eQTL-локусов, чем в исходном наборе данных GTEx, что подчеркивает тот факт, что не все регуляторные варианты заболевания могут быть обнаружены в здоровых тканях [15]. При сопоставлении данных, полученных в настоящем исследовании, и данных STARNET показано, что rs1333049 является цис-eQTL для гена CDKN2B и транс-eQTL для генов AFF1, UBN2, USP47, ECI1 и GABARAPL3 в тканях внутренней грудной артерии у больных ИБС [9].
На основании данных ресурса POLYMPACT проведена оценка влияния SNPs, показавших ассоциации с коморбидными фенотипами, на изменение сайтов связывания транскрипционных факторов. На гены ТФ приходится 8% всех генов человека и мутации или полиморфные варианты в этих генах, а также нарушение последовательности ДНК в сайтах связывания ТФ ассоциированы с широким спектром заболеваний и фенотипов [16]. Оценка изменения ДНК-связывающих мотивов ТФ показала, что помимо изменения аффинности ТФ наличие альтернативных аллелей некоторых SNPs приводит к потере имеющихся или появлению новых сайтов связывания (табл. 3).
Наиболее значимые изменения в функционировании генома происходят, вероятно, при появлении или исчезновении сайтов связывания ТФ. Так, выявлено, что наличие альтернативного аллеля С rs1333049 (CDKN2B-AS1) приводит к потере сайта связывания для ТФ SALL1, ZNF713, ZNF14, аллеля G rs1991401 (DDX5) – к потере сайта для ZNF791 и появлению сайта для ZNF430, аллеля С rs2878771 (AQP2) – к появлению сайта для TBX3, а аллеля А rs626750 (MMP3/MMP12) – к появлению сайта для CEBPB (табл. 3).
ОБСУЖДЕНИЕ
Результаты исследования показали, что накопление коморбидных заболеваний ССК связано с увеличением возраста пациентов, а при нарастании количества патологических фенотипов происходит изменение соотношения полов – увеличение доли женщин и уменьшение мужчин. Увеличение числа заболеваний с возрастом является известным фактом. Так, например, показано, что в США два и более хронических заболеваний наблюдаются у половины лиц моложе 65 лет, у 63% лиц в возрасте 65–74 года и у 83% лиц в возрасте 85 лет и старше [17]. Соотношение между мужчинами и женщинами с возрастом также в целом меняется в сторону увеличения численности женщин. По данным РОССТАТа в Российской Федерации в 2021 г. соотношение мужчин и женщин в возрастной группе 30–34 года составило 1.01, тогда как в группе 80–84 года – 0.35 [18]. Однако по тем же данным между возрастными группами 55–59 и 60–64 года, куда относятся пациенты исследуемых в настоящей работе групп, различия в соотношении мужчины/женщины незначительны (0.811 и 0.730 соответственно). В настоящем же исследовании показано, что с возрастанием степени коморбидности соотношение между полами изменяется значительно (от 8.5 до 1), что может говорить о том, что коморбидные состояния при ССЗ являются фактором меньшей выживаемости мужчин по сравнению с женщинами.
В результате исследования выявлено, что SNPs rs1333049 (CDKN2B-AS1), rs3739998 (KIAA1462), rs3765124 (ADAMDEC1), rs1007856 (ITGB5), rs1991401 (DDX5), rs2878771 (AQP2), rs2277698 (TIMP2) и rs626750 (MMP3/MMP12) формируют генетическую структуру предрасположенности коморбидности заболеваний сердечно-сосудистого континуума. Причем с большим количеством патологических фенотипов заболеваний ССК ассоциированы rs1333049 (CDKN2B-AS1), rs3739998 (KIAA1462), rs3765124 (ADAMDEC1) и rs1007856 (ITGB5), что подтверждает некоторые ранее установленные ассоциации. Так, например, в полногеномных ассоциативных исследованиях [2] и в популяции жителей Западной Сибири [19, 20] показана ассоциация генотипов CC rs1333049 (CDKN2B-AS1) и CC rs3739998 (KIAA1462) с ИБС/ИМ.
Связь rs1333049 с ИБС объясняется его тесным сцеплением с другими вариантами локуса 9p21.3, которые изменяют функциональную активность генов клеточного цикла (CDKN2B, CDKN2A) и гена длинной некодирующей РНК (ANRIL или CDKN2B-AS1) в клетках крови и атеросклеротических бляшек коронарных артерий, в результате чего нарушаются процессы адгезии моноцитов к эндотелиальным клеткам, пролиферации, миграции и апоптоза гладкомышечных клеток сосудов, ремоделирования внеклеточного матрикса и ответ на воспаление [21]. Неслучайно в исследовании STARNET, включающем пациентов с ИБС, в ткани внутренней грудной артерии показана связь rs1333049 с экспрессией не только гена CDKN2B, но и других дистантных генов AFF1, UBN2, USP47, ECI1 и GABARAPL3 [9]. В основе последней ассоциации, по-видимому, лежит взаимодействие CDKN2B-AS1 с мРНК данных генов (LncRRIsearch), а CDKN2B-AS1 может быть “губкой” для miR-3074-3p, экспериментально подтвержденными мишенями которой являются UBN2 и AFF1, экспрессируемые в артериях (MIENTURNET и miRTarBase).
Полиморфизм локуса 9p21.3 связан с увеличением экспрессии ANRIL, большим количеством пораженных атеросклерозом коронарных артерий, тяжестью ИБС и риском развития ИМ [22]. Аллель C rs1333049 модулирует ассоциацию между уровнем диастолического артериального давления и степенью кальцификации коронарных артерий, внося вклад в патогенез ИБС [23]. В настоящем исследовании выявлена связь генотипа СС и аллеля С rs1333049 с риском развития ИБС и ИМ в сочетании с факторами риска сердечно-сосудистых заболеваний (артериальная гипертензия и гиперхолестеринемия). Ранее в работе О.А. Макеевой с соавт. [10] также показана ассоциация rs1333049 с “синтропией ССК”, т.е. фенотипом ИБС + АГ + ГХ + СД2 [10], но в настоящем исследовании ассоциация не была подтверждена. Различия можно объяснить тем, что в настоящей работе выборка “синтропия ССК” включала преимущественно женщин с ИБС в сочетании с ИМ, а не только с ИБС, как в работе [10].
При попытке выявить механизмы, объясняющие ассоциацию rs1333049 с патологическими фенотипами ССК, было обнаружено, что наличие аллеля С rs1333049 приводит к потере сайта связывания для ТФ SALL1, ZNF713, ZNF14 и снижению аффинности для SIRT6 (табл. 3). В свою очередь SALL1 входит в область дупликации из числа CNV, связанных с синдромом гипоплазии правых отделов сердца [24], а SIRT6 участвует в регуляции метаболизма глюкозы и липидов, тем самым влияя на такие патологические состояния, как сахарный диабет, ожирение, сердечно-сосудистые и онкологические заболевания [25].
Полиморфизм rs3739998 гена KIAA1462, согласно критериям патогенности (шкала PolyPhen геномного браузера Ensembl), приводит к “доброкачественной” миссенс-замене аминокислот (p.Ser1002Thr) в структуре белкового продукта данного гена [26]. Тем не менее по данным программ предикции HaploReg и RegulomeDB rs3739998 – регуляторный вариант (rSNPs) в отношении контроля экспрессии генов в различных тканях, что может быть связано с тем, что он является сайтом связывания белка CTCF [26, 27], который, в свою очередь, является многофункциональным транскрипционным фактором.
Полиморфизм rs3739998:G>C сцеплен с локализованным в интроне вариантом rs2487928:G>A и с синонимичной заменой rs9337951:G>A, альтернативные аллели которых связаны с риском развития ИБС и повышенного артериального давления [2]. В исследовании STARNET, включающем пациентов с ИБС, аллель A rs2487928 и аллель А rs9337951, ассоциированные с патологией, связаны с увеличением экспрессии гена KIAA1462 в пораженной атеросклерозом аорте [9]. В настоящем исследовании генотип СС rs3739998, ассоциированный с заболеваниями ССК, связан со снижением экспрессии гена KIAA1462 в аорте и в большеберцовой артерии у относительно здоровых индивидов (по данным GTEx Portal). Таким образом, имеется противоречие в направленности связи генотипов rs3739998, rs2487928 и rs9337951, ассоциированных с патологией, с экспрессией гена KIAA146 в артериях. Это может быть обусловлено сложной регуляцией функциональной активности гена в различных клетках и тканях в норме и при патологии, в том числе посредством расположенного в этом же локусе гена белок-некодирующей РНК LOC101929256. Кроме того, замена p.Ser1002Thr, согласно программе Glycosylation Predictor, приводит к потере гликозилирования, что может изменить свойства белка, в частности, способствовать его нестабильности у носителей генотипа СС. Белок JCAD (junctional cadherin 5 associated), кодируемый геном KIAA146, является механочувствительным и взаимодействует с актин-связывающими белками, активируя сигнальный путь Hippo/YAP/TAZ [28]. У мышей с делецией гена Jcad только в эндотелиальных клетках отмечается уменьшение количества и степени выраженности атеросклеротических бляшек в аорте [28]. Это подчеркивает важную роль JCAD в развитии атеросклеротического поражения артерий и возможно в формировании нестабильной атеросклеротической бляшки и следовательно риске развития острых сосудистых событий. Однако для решения вопроса о механизмах связи JCAD вариабельности локуса гена KIAA146 (10p11.23) с другими фенотипами ССК (например, ожирением [29]) необходимо проведение дополнительных функциональных исследований.
Миссенс-вариант rs3765124 гена ADAMDEC1 относится к категории “возможно патогенных”, согласно шкале PolyPhen предсказания патогенности геномного браузера Ensembl, приводя к замене p.Asn444Ser в дезинтегриновом домене белка, который особенно важен для взаимодействия с другими белками, в частности интегринами. Однако у ADAMDEC1 этот домен сильно укорочен по сравнению с другими белками ADAM-семейства, что, возможно, отражает его нефункциональность в отношении связывания с интегринами [30]. Более того, по данным Glycosylation Predictor замена p.Asn444Ser приводит к приобретению гликозилирования серина, что может изменить свойства ADAMDEC1, который экспрессируется в зрелых дендритных клетках и при трансформации моноцитов в макрофаги [30, 31]. Предполагают, что роль данного белка при воспалительных заболеваниях, включая атеросклероз, связана с иммунным ответом [32–34]. С другой стороны, ADAMDEC1 выявлен в активированных тромбоцитах, где он участвует в образовании высокомолекулярного эпидермального ростового фактора (EGF) [35], который, в свою очередь, регулирует пролиферацию эндотелиальных клеток, активацию макрофагов в атеросклеротических бляшках и ремоделирование сосудов, тем самым играя важную роль в атеросклерозе и артериальной гипертензии [36].
Кроме изменения свойств ADAMDEC1, связь rs3765124 с патологией может быть объяснена его тесным сцеплением с другими функционально значимыми вариантами. В частности, в локусе 8p12 выявлены вариации числа копий участков ДНК (CNV), которые затрагивают гены ADAMDEC1, ADAM7, ADAM28, а также ген белок-некодирующей РНК LOC101929294 [37, 38]. В настоящем исследовании показано, что генотип AA rs3765124 гена ADAMDEC1 ассоциирован с риском заболеваний ССК. Индивиды с данным генотипом характеризуются увеличением экспрессии гена ADAMDEC1 в клетках крови, артерий и жировой ткани, а также увеличением экспрессии гена ADAM28 в клетках крови (по данным GTEx Portal). Ранее было показано, что экспрессия гена ADAMDEC1 значительно повышается в нестабильных регионах атеросклеротических бляшек сонных артерий по сравнению со стабильными участками [39], а аллель A rs3765124 (ADAMDEC1) входит в состав гаплотипа, который ассоциирован с повышением уровня FVIII в плазме крови при венозной тромбоэмболии [40], что связано с артериальным тромбозом при ИБС и факторами риска атеросклероза (уровни инсулина, глюкозы, холестерола ЛПНП в сыворотке крови) [41].
Связь генотипа AA rs1007856 гена ITGB5 с риском развития заболеваний ССК установлена в настоящем исследовании впервые, хотя другой вариант, rs142695226, расположенный между генами ITGB5 и UMPS, ассоциирован с ИБС по данным метаанализа GWAS CARDIoGRAMplusC4D и UK Biobank [42], а полиморфизм rs4141663 – с уровнем артериального давления [42]. Согласно GTEx Portal, генотип АА rs1007856 (ITGB5) связан со снижением экспрессии гена ITGB5 в клетках крови и артерий. Кроме того, показано, что экспрессия гена ITGB5 снижена в нестабильных атеросклеротических бляшках различных артерий по сравнению с интактными внутренними грудными артериями, однако она повышается в мононуклеарных клетках крови при инфаркте миокарда [43].
Ген ITGB5 кодирует бета-субъединицу интегрина, которая в комбинации с различными альфа-цепями формирует гетеродимеры белка, важного для находящихся на поверхности клеток рецепторов адгезии и передачи сигналов в клетку. Существует целый ряд экспериментальных работ, которые подчеркивают важную роль интегрина αvβ5 в атерогенезе. Мыши с гомозиготной делецией β5–/– были жизнеспособны, нормально развивались и были способны к репродукции, однако демонстрировали повышенную проницаемость сосудов в ответ на действие эндотелиального ростового фактора сосудов (VEGF) и аномальный ангиогенез [44]. Более того, интегрин αvβ5 играет важную роль в адгезии, миграции и пролиферации гладкомышечных клеток аорты при атерогенезе [45].
Кроме вышеописанных ассоциаций полиморфных вариантов генов с наибольшим количеством изученных фенотипов, также установлены ассоциации: rs1991401 (DDX5) и rs2878771 (AQP2) с развитием ИБС и ИМ без традиционных факторов риска; rs626750 (MMP3/MMP12) с ИБС и ИМ на фоне артериальной гипертензии и гиперхолестеринемии; rs2277698 (TIMP2) с фенотипом “синтропия ССК”.
По данным RegulomeDB наиболее сильным регуляторным потенциалом обладает rs1991401 (DDX5) в отношении экспрессии генов DDX5 и CEP95 в различных тканях и органах. Ген DDX5 кодирует мультифункциональную РНК-хеликазу, которая участвует в ремоделировании сосудов [46]. Кроме того, по данным POLYMPACT наличие аллеля G rs1991401 (DDX5) приводит к потере сайта для ТФ ZNF791 и появлению сайта для ZNF430.
Полиморфный вариант rs2878771 гена AQP2 также является cis-eQTL-локусом и связан с изменением уровня экспрессии гена LASS5 (CERS5) в клетках крови. Продукт гена LASS5 изменяет синтез церамидов в эндотелиальных клетках через AMPK-Alfa путь, что может быть важным звеном патогенеза атеросклероза [47]. По данным POLYMPACT наличие аллеля С rs2878771 (AQP2) приводит к появлению сайта для ТФ TBX3 и снижению аффинности для SMAD1-9, а наличие аллеля А rs626750 (MMP3/MMP12) – к появлению сайта для CEBPB. Показано, что ТФ TBX3 играет критическую роль в развитии сердца, а мутации в гене TBX3 связаны со множественными дефектами развития, включая пороки сердца [48]; CEBPB ассоциирован с резистентностью к инсулину, плохим гликемическим контролем и повышенным кардиометаболическим риском, а аллельные варианты гена CEBPB могут влиять на метаболические нарушения, развитие диабета второго типа и сердечно-сосудистых заболеваний [49, 50]. Члены семейства SMAD являются участниками сигнального пути трансформирующего фактора роста-бета (TGF-β), и редкие миссенс-варианты, в частности, в гене SMAD4 могут приводить к аневризмам и расслоению грудной аорты [51].
В заключение следует отметить, что ИБС, осложненная ИМ, которая развивается на фоне факторов риска (артериальная гипертензия, гиперхолестеринемия и сахарный диабет второго типа), представляет собой сложный для изучения фенотип. Анализ ассоциаций генетического полиморфизма с коморбидностью заболеваний ССК является одним из этапов изучения связи генотипа и фенотипа, однако он не позволяет однозначно понять, лежит ли в основе выявленной ассоциации истинная плейотропия. Несмотря на ограничение исследования, заключающееся в небольшой численности выборок-подгрупп при анализе отдельных фенотипов ССК, в настоящей работе подтверждена установленная ранее в широкогеномных исследованиях ассоциация генотипов CC rs1333049 (CDKN2B-AS1) и CC rs3739998 (KIAA1462) с риском развития ишемической болезни сердца и инфаркта миокарда. Полиморфные варианты rs3765124 (ADAMDEC1), rs1007856 (ITGB5), rs1991401 (DDX5), rs2878771 (AQP2), rs2277698 (TIMP2) и rs626750 (MMP3/MMP12) после репликации ассоциации в больших по размеру выборках и построения прогностических моделей могут быть использованы в качестве биомаркеров для тестирования подверженности коморбидным заболеваниям сердечно-сосудистого континуума.
Кроме того, необходимы экспериментальные исследования культур клеток и модельных животных для определения функциональной значимости генетического полиморфизма, ассоциированного с заболеваниями ССК. Особый интерес с данной точки зрения представляют варианты rs3739998 (KIAA1462) и rs3765124 (ADAMDEC1), поскольку это одновременно миссенс-варианты, приводящие к аминокислотной замене в структуре их белков, и cis-eQTL-локусы, изменяющие экспрессию генов KIAA1462, ADAMDEC1 и ADAM28 в клетках органов-мишеней ССК (кровь, артерии, сердце, жировая ткань и головной мозг).
Таким образом, в результате настоящего исследования установлено, что варианты rs1333049 (CDKN2B-AS1), rs3739998 (KIAA1462), rs3765124 (ADAMDEC1), rs1007856 (ITGB5), rs1991401 (DDX5), rs2878771 (AQP2), rs2277698 (TIMP2) и rs626750 (MMP3/MMP12) формируют генетическую структуру подверженности коморбидности заболеваний сердечно-сосудистого континуума. eQTL rs1333049, rs3739998, rs3765124, rs1007856 и rs1991401 могут быть вовлечены в тканеспецифичные регуляторные механизмы при данных заболеваниях. Предположено, что длинная некодирующая РНК CDKN2B-AS1 регулирует miR-3074-3p/AFF1, UBN2 ось в клетках артерий, принимая участие в патогенезе их атеросклеротического поражения.
Работа выполнена в рамках Государственного задания Министерства науки и высшего образования № 122020300041-7.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Dzau V., Braunwald E. Resolved and unresolved issues in the prevention and treatment of coronary artery disease: A workshop consensus statement // Am. Heart J. 1991. V. 121. № 4. Pt 1. P. 1244–1263. https://doi.org/10.1016/0002-8703(91)90694-d
Buniello A., MacArthur J.A.L., Cerezo M. et al. The NHGRI-EBI GWAS Catalog of published genome-wide association studies, targeted arrays and summary statistics 2019 // Nucl. Acids Res. 2019. V. 47. № D1. P. 1005–1012. https://doi.org/10.1093/nar/gky1120
Gottesman O., Drill E., Lotay V. et al. Can genetic pleiotropy replicate common clinical constellations of cardiovascular disease and risk? // PLoS One. 2012. V. 7. № 9. P. e46419. https://doi.org/10.1371/journal.pone.0046419
Wu C., Li S., Cui Y. Genetic association studies: An information content perspective // Curr. Genomics. 2012. V. 13. № 7. P. 566–573. https://doi.org/10.2174/138920212803251382
Rankinen T., Sarzynski M.A., Ghosh S., Bouchard C. Are there genetic paths common to obesity, cardiovascular disease outcomes, and cardiovascular risk factors? // Circ. Res. 2015. V. 116. № 5. P. 909–922. https://doi.org/10.1161/CIRCRESAHA.116.302888
Kraja A.T., Chasman D.I., North K.E. et al. Pleiotropic genes for metabolic syndrome and inflammation // Mol. Genet. Metab. 2014. V. 112. № 4. P. 317–338. https://doi.org/10.1016/j.ymgme.2014.04.007
Yao C., Chen B.H., Joehanes R. et al. Integromic analysis of genetic variation and gene expression identifies networks for cardiovascular disease phenotypes // Circulation. 2015. V. 131. № 6. P. 536–549. https://doi.org/10.1161/CIRCULATIONAHA.114.010696
Jia X., Yang Y., Chen Y. et al. Multivariate analysis of genome-wide data to identify potential pleiotropic genes for type 2 diabetes, obesity and coronary artery disease using MetaCCA // Int. J. Cardiol. 2019. V. 283. P. 144–150. https://doi.org/10.1016/j.ijcard.2018.10.102
Franzén O., Ermel R., Cohain A. et al. Cardiometabolic risk loci share downstream cis- and trans-gene regulation across tissues and diseases // Science. 2016. V. 353. № 6301. P. 827–830. https://doi.org/10.1126/science.aad6970
Makeeva O.A., Sleptsov A.A., Kulish E.V. et al. Genomic study of cardiovascular continuum comorbidity // Acta Naturae. 2015. V. 7. № 3. P. 89–99. https://doi.org/10.32607/20758251-2015-7-3-89-99
Гончарова И.А., Макеева О.А., Голубенко М.В. и др. Гены фиброгенеза в детерминации предрасположенности к инфаркту миокарда // Мол. биология. 2016. Т. 50. № 1. С. 94–105. https://doi.org/10.7868/S0026898415060099
Гончарова И.А., Назаренко М.С., Бабушкина Н.П. и др. Генетическая предрасположенность к инфаркту миокарда в разных возрастных группах // Мол. биология. 2020. Т. 54. № 2. С. 224–232. https://doi.org/10.31857/S0026898420020044
Гончарова И.А., Печерина Т.Б., Марков А.В. и др. Роль генов фиброгенеза в формировании подверженности к коронарному атеросклерозу // Кардиология. 2018. Т. 58. № 8. С. 33–44. https://doi.org/10.18087/cardio.2018.8.10160
Hamby S.E., Hirst J.D. Prediction of glycosylation sites using random forests // BMC Bioinformatics. 2008. V. 9. P. 500. https://doi.org/10.1186/1471-2105-9-500
Wong D., Turner A.W., Miller C.L. Genetic insights into smooth muscle cell contributions to coronary artery disease // Arterioscler. Thromb. Vasc. Biol. 2019. V. 39. № 6. P. 1006–1017. https://doi.org/10.1161/ATVBAHA.119.312141
Lambert S.A., Jolma A., Campitelli L.F. et al. The human transcription factors // Cell. 2018. V. 172. № 4. P. 650–665. https://doi.org/10.1016/j.cell.2018.01.029
Forman D.E., Maurer M.S., Boyd C. et al. Multimorbidity in older adults with cardiovascular disease // J. Am. Coll. Cardiol. 2018. V. 71. № 19. P. 2149–2161. https://doi.org/10.1016/j.jacc.2018.03.022
Федеральная служба государственной статистики (РОССТАТ). Численность населения Российской Федерации по полу и возрасту на 1 января 2021 года (Статистический бюллетень). М., 2021. 443 с. https://rosstat.gov.ru/storage/mediabank/Bul_chislen_nasel-pv_01-01-2021.pdf
Shakhtshneider E., Orlov P., Semaev S. et al. Analysis of polymorphism rs1333049 (located at 9P21.3) in the white population of Western Siberia and associations with clinical and biochemical markers // Biomolecules. 2019. V. 9. № 7. P. 290. https://doi.org/10.3390/biom9070290
Nikulina S., Artyukhov I., Shesternya P. et al. Clinical application of chromosome 9p21.3 genotyping in patients with coronary artery disease // Exp. Ther. Med. 2019. V. 18. № 4. P. 3100–3108. https://doi.org/10.3892/etm.2019.7884
Cunnington M.S., Koref M.S., Mayosi B.M. et al. Chromosome 9p21 SNPs associated with multiple disease phenotypes correlate with ANRIL expression // PLoS Genet. 2010. V. 6. № 4. P. e1000899. https://doi.org/10.1371/journal.pgen.1000899
Almontashiri N.A., Fan M., Cheng B.L. et al. Interferon-γ activates expression of p15 and p16 regardless of 9p21.3 coronary artery disease risk genotype // J. Am. Coll. Cardiol. 2013. V. 61. № 2. P. 143–147. https://doi.org/10.1016/j.jacc.2012.08.1020
Kim D.S., Smith J.A., Bielak L.F. et al. The relationship between diastolic blood pressure and coronary artery calcification is dependent on single nucleotide polymorphisms on chromosome 9p21.3 // BMC Med. Genet. 2014. V. 15. P. 89. https://doi.org/10.1186/s12881-014-0089-2
Giannakou A., Sicko R.J., Kay D.M. et al. Copy number variants in hypoplastic right heart syndrome // Am. J. Med. Genet. A. 2018. V. 176. № 12. P. 2760–2767.https://doi.org/10.1002/ajmg.a.40527
Kugel S., Mostoslavsky R. Chromatin and beyond: The multitasking roles for SIRT6 // Trends Biochem. Sci. 2014. V. 39. № 2. P. 72–81. https://doi.org/10.1016/j.tibs.2013.12.002
Howe K.L., Achuthan P., Allen J. et al. Ensembl 2021 // Nucl. Acids Res. 2021. V. 49. № D1. P. D884–D891. https://doi.org/10.1093/nar/gkaa942
Boyle A.P., Hong E.L., Hariharan M. et al. Annotation of functional variation in personal genomes using RegulomeDB // Genome Res. 2012. V. 22. № 9. P. 1790–1797. https://doi.org/10.1101/gr.137323.112
Xu S., Xu Y., Liu P. et al. The novel coronary artery disease risk gene JCAD/KIAA1462 promotes endothelial dysfunction and atherosclerosis // Eur. Heart. J. 2019. V. 40. № 29. P. 2398–2408. https://doi.org/10.1093/eurheartj/ehz303
Price R.A., Li W.D., Bernstein A. et al. A locus affecting obesity in human chromosome region 10p12 // Diabetologia. 2001. V. 44. № 3. P. 363–366. https://doi.org/10.1007/s001250051627
Bates E.E., Fridman W.H., Mueller C.G. The ADAMDEC1 (decysin) gene structure: Evolution by duplication in a metalloprotease gene cluster on chromosome 8p12 // Immunogenetics. 2002. V. 54. № 2. P. 96–105. https://doi.org/10.1007/s00251-002-0430-3
Fritsche J., Müller A., Hausmann M. et al. Inverse regulation of the ADAM-family members, decysin and MADDAM/ADAM19 during monocyte differentiation // Immunology. 2003. V. 110. № 4. P. 450–457. https://doi.org/10.1111/j.1365-2567.2003.01754.x
Crouser E.D., Culver D.A., Knox K.S. et al. Gene expression profiling identifies MMP-12 and ADAMDEC1 as potential pathogenic mediators of pulmonary sarcoidosis // Am. J. Respir. Crit. Care Med. 2009. V. 179. № 10. P. 929–938. https://doi.org/10.1164/rccm.200803-490OC
Balakrishnan L., Nirujogi R.S., Ahmad S. et al. Proteomic analysis of human osteoarthritis synovial fluid // Clin. Proteomics. 2014. V. 11. № 1. P. 6. https://doi.org/10.1186/1559-0275-11-6
Liu T., Deng Z., Xie H. et al. ADAMDEC1 promotes skin inflammation in rosacea via modulating the polarization of M1 macrophages // Biochem. Biophys. Res. Commun. 2020. V. 521. № 1. P. 64–71. https://doi.org/10.1016/j.bbrc.2019.10.073
Chen R., Jin G., McIntyre T.M. The soluble protease ADAMDEC1 released from activated platelets hydrolyzes platelet membrane pro-epidermal growth factor (EGF) to active high-molecular-weight EGF // J. Biol. Chem. 2017. V. 292. № 24. P. 10112–10122. https://doi.org/10.1074/jbc.M116.771642
Lamb D.J., Modjtahedi H., Plant N.J., Ferns G.A. EGF mediates monocyte chemotaxis and macrophage proliferation and EGF receptor is expressed in atherosclerotic plaques // Atherosclerosis. 2004. V. 176. № 1. P. 21–26. https://doi.org/10.1016/j.atherosclerosis.2004.04.012
MacDonald J.R., Ziman R., Yuen R.K. et al. The database of genomic variants: A curated collection of structural variation in the human genome // Nucl. Acids Res. 2014. V. 42. P. D986–D992. https://doi.org/10.1093/nar/gkt958
Gene [Internet] // Bethesda (MD): National Library of Medicine (US), National Center for Biotechnology Information. 2008. https://www.ncbi.nlm.nih.gov/gene/
Papaspyridonos M., Smith A., Burnand K.G. et al. Novel candidate genes in unstable areas of human atherosclerotic plaques // Arterioscler. Thromb. Vasc. Biol. 2006. V. 26. № 8. P. 1837–1844. https://doi.org/10.1161/01.ATV.0000229695.68416.76
Berger M., Moscatelli H., Kulle B. et al. Association of ADAMDEC1 haplotype with high factor VIII levels in venous thromboembolism // Thromb. Haemost. 2008. V. 99. № 5. P. 905–908. https://doi.org/10.1160/TH08-01-0059
Kamphuisen P.W., Eikenboom J.C., Bertina R.M. Elevated factor VIII levels and the risk of thrombosis // Arterioscler. Thromb. Vasc. Biol. 2001. V. 21. № 5. P. 731–738. https://doi.org/10.1161/01.atv.21.5.731
Verweij N., Eppinga R.N., Hagemeijer Y., van der Harst P. Identification of 15 novel risk loci for coronary artery disease and genetic risk of recurrent events, atrial fibrillation and heart failure // Sci. Rep. 2017. V. 7. № 1. P. 2761. https://doi.org/10.1038/s41598-017-03062-8
Oksala N., Pärssinen J., Seppälä I. et al. Kindlin 3 (FERMT3) is associated with unstable atherosclerotic plaques, anti-inflammatory type II macrophages and upregulation of beta-2 integrins in all major arterial beds // Atherosclerosis. 2015. V. 242. № 1. P. 145–154. https://doi.org/10.1016/j.atherosclerosis.2015.06.058
Reynolds L.E., Wyder L., Lively J.C. et al. Enhanced pathological angiogenesis in mice lacking beta3 integrin or beta3 and beta5 integrins // Nat. Med. 2002. V. 8. № 1. P. 27–34. https://doi.org/10.1038/nm0102-27
Lee B.H., Bae J.S., Park R.W. et al. βig-h3 triggers signaling pathways mediating adhesion and migration of vascular smooth muscle cells through αvβ5 integrin // Exp. Mol. Med. 2006. V. 38. № 2. P. 153–161. https://doi.org/10.1038/emm.2006.19
Weber S.N., Bohner A., Dapito D.H. et al. TLR4 deficiency protects against hepatic fibrosis and diethylnitrosamine-induced pre-carcinogenic liver injury in fibrotic liver // PLoS One. 2016. V. 11. № 7. P. e0158819. https://doi.org/10.1371/journal.pone.0158819
Çoban N., GüçlüGeyik F., Yıldırım Ö., ErginelÜnaltuna N. Seramidmetabolizmasıileilişkili CERS5 (LASS5) geninin endotel hücrelerind eateroskleroz patogene zindeki rolünün araştırılması [Investigating the role of ceramide metabolism-associated CERS5 (LASS5) gene in atherosclerosis pathogenesis in endothelial cells] // Turk. Kardiyol. Dern. Ars. 2017. V. 45. № 2. P. 118–125. https://doi.org/10.5543/tkda.2016.82389
Chen D., Qiao Y., Meng H. et al. Genetic analysis of the TBX3 gene promoter in ventricular septal defects // Gene. 2013. V. 512. № 2. P. 185–188. https://doi.org/10.1016/j.gene.2012.10.066
Bennett C.E., Nsengimana J., Bostock J.A. et al. CCAAT/enhancer binding protein alpha, beta and delta gene variants: Associations with obesity related phenotypes in the Leeds Family Study // Diab. Vasc. Dis. Res. 2010. V. 7. № 3. P. 195–203. https://doi.org/10.1177/1479164110366274
Cerda A., Amaral A.A., de Oliveira R. et al. Peripheral blood miRome identified miR-155 as potential biomarker of metS and cardiometabolic risk in obese patients // Int. J. Mol. Sci. 2021. V. 22. № 3. P. 1468. https://doi.org/10.3390/ijms22031468
Duan X.Y., Guo D.C., Regalado E.S. et al. SMAD4 rare variants in individuals and families with thoracic aortic aneurysms and dissections // Eur. J. Hum. Genet. 2019. V. 27. № 7. P. 1054–1060. https://doi.org/10.1038/s41431-019-0357-x
Дополнительные материалы отсутствуют.


