Генетика, 2022, T. 58, № 11, стр. 1240-1250
Древняя и современная гибридизация сибирской кедровой сосны и кедрового стланика на юге Якутии
М. М. Белоконь 1, *, Ю. С. Белоконь 1, Е. А. Петрова 2, Г. В. Васильева 2, А. П. Ефимова 3, Е. С. Захаров 3, 4, С. Н. Горошкевич 2, Д. В. Политов 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Институт мониторинга климатических и экологических систем Сибирского отделения
Российской академии наук
634055 Томск, Россия
3 Институт биологических проблем криолитозоны Сибирского отделения
Российской академии наук
677007 Якутск, Россия
4 Северо-Восточный федеральный университет им. М.К. Аммосова
677980 Якутск, Россия
* E-mail: belokon@vigg.ru
Поступила в редакцию 06.06.2022
После доработки 20.06.2022
Принята к публикации 21.06.2022
- EDN: BRWGLX
- DOI: 10.31857/S0016675822110029
Аннотация
С помощью анализа генотипов взрослых растений кедрового стланика, Pinus pumila (Pall.) Regel, и сибирской кедровой сосны, Pinus sibirica Du Tour, по аллозимам (ядерным кодоминантным маркерам с бипарентальным наследованием) и мтДНК исследована зона гибридизации на северной границе перекрывания ареалов на стыке Приленского плато со Становым и Алданским нагорьями. Получены доказательства современной гибридизации этих видов, а также прошлых гибридизационных событий. Наше исследование выявило, что в условиях Южной Якутии гибридизация проходит преимущественно однонаправленно с асимметричным потоком генов между видами. В большинстве изученных выборок из зоны симпатрии отмечается замена митохондриальных геномов Pinus sibirica геномами Pinus pumila. Данное явление может носить адаптивный характер и способствовать расширению ареала сибирской кедровой сосны.
Межвидовая гибридизация широко распространена среди высших растений, в том числе и древесных [1–3]. Отсутствие репродуктивных барьеров среди сосен в пределах подрода Strobus рода Pinus хорошо документировано [4, 5]. Гибридизационные события, по-видимому, имели значительное влияние на формирование современных видов сосен [6–9].
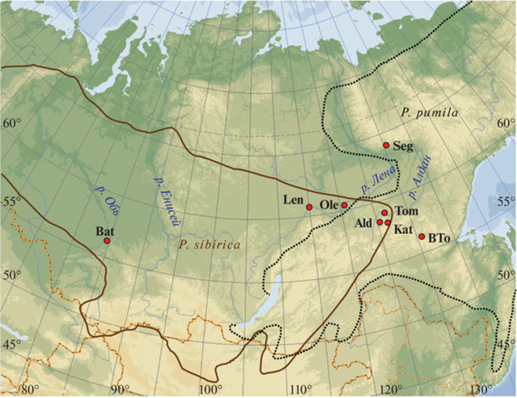
Сибирская кедровая сосна, Pinus sibirica Du Tour, занимает обширный ареал в таежном поясе от Приуралья, Урала и Западной Сибири до Забайкалья. Ареал кедрового стланика, Pinus pumila (Pall.) Regel, простирается от оз. Байкал на западе до Камчатки и Курильских островов на востоке. Стланик встречается в подгольцовом поясе высокогорий, в составе смешанных таежных древостоев на средних высотах, а также в низкогорьях. В Прибайкалье и Забайкалье расположена зона перекрывания ареалов и контакта этих видов (рис. 1). Места совместного произрастания кедровой сосны и стланика были обнаружены на восточном побережье оз. Байкал (Баргузинский заповедник), в дельте Верхней Ангары, в Южном Забайкалье (гора Алханай, Могойтуйский хребет Хэнтей-Чикойского нагорья), по всей горной системе Станового хребта до Алданского нагорья на крайнем северо-востоке зоны перекрывания ареалов [10–13]. В этих местах происходит естественная гибридизация с образованием гибридов в различных сочетаниях. Поскольку кедровая сосна и стланик представляют собой виды с контрастными экологическими особенностями, естественные гибриды первого поколения между ними можно идентифицировать морфологически по наличию нескольких невертикальных стволов, или ветвей, отходящих от основного ствола по стланиковому типу, а также по цвету созревающих женских шишек [12]. Однако такое определение не всегда является точным.
Первое генетическое доказательство межвидовой гибридизации было получено с применением аллозимных локусов [14, 15]. В дальнейшем были изучены зоны гибридизации в Баргузинском заповеднике, в дельте Верхней Ангары [10, 12], в Южном Забайкалье [13]. На северо-востоке зоны перекрывания ареалов (Алданское нагорье) при помощи маркеров хлоропластной и мтДНК изучены две локальности с совместным произрастанием видов [11]. Обнаружена однонаправленная интрогрессия митохондриальных геномов – все деревья сибирской кедровой сосны в гибридной зоне обладают мтДНК от кедрового стланика. У части особей (17%) выявлены хлоропластные геномы, которые были унаследованы от кедрового стланика или гибридов. Таким образом, в геномах всех деревьев, определенных морфологически как сибирская кедровая сосна, выявлены следы гибридизации.
Задачей нашего исследования было изучение гибридизации между сибирской кедровой сосной и кедровым стлаником на севере зоны перекрывания ареалов на стыке Приленского плато со Становым и Алданским нагорьями с применением аллозимов (ядерных кодоминантных маркеров с бипарентальным наследованием) и мтДНК.
МАТЕРИАЛЫ И МЕТОДЫ
В Южной Якутии P. sibirica распространена на Приленском плато до северных отрогов Станового и Алданского нагорья, по долинам рек, в составе таежных лесов на высотах 450–500 м над уровнем моря. P. pumila занимает высоты от 700 м над уровнем моря и выше, до подгольцового пояса. Места их совместного произрастания в составе смешанных древостоев встречаются довольно редко. Для данного исследования мы выбрали три популяции сосны кедровой сибирской в местах, где современные ареалы видов не перекрываются, две группы выборок из зоны симпатрии в Алданском районе Республики Саха (Якутия), представленные особями обоих видов и предполагаемыми гибридами, а также две популяции кедрового стланика за пределами этой зоны (табл. 1, рис. 1).
Таблица 1.
Расположение, фенотипическая видовая идентификация и численности изученных выборок кедровых сосен
| Название выборки | Регион | Координаты | Сокращенное обозначение | Численность и видовая идентификация |
|---|---|---|---|---|
| Баталино | З. Сибирь, Томская область, Томский р-н, уроч. Баталино | 56°14′ с.ш. 84°32′ в.д. | BatS | 30 особей P. sibirica без признаков гибридности |
| Ленск | Респ. Саха (Якутия), Ленский р-н, окрестности г. Ленск | 60°43′ с.ш. 114°54′ в.д. | LenS | 26 особей P. sibirica без признаков гибридности |
| Олёкминск | Респ. Саха (Якутия), Олёкминский р-н, окрестности г. Олёкминск | 60°23′ с.ш. 120°26′ в.д. | OleS | 20 особей P. sibirica без признаков гибридности |
| Алдан | Респ. Саха (Якутия), Алданский район, 5 км от г. Алдан, окрестности пос. Ленинский | 58°20′ с.ш. 125°17′ в.д. | AldS | 56 особей P. sibirica без признаков гибридности |
| AldН | 15 особей, определенных как гибриды | |||
| AldP | 25 особей P. pumila без признаков гибридности | |||
| Алдан 2 | Респ. Саха (Якутия), Алданский район, окрестности пос. Ленинский, вдоль дороги на Якокут | 58°34′ с.ш. 125°28′ в.д. | Ald2S | 41 особь P. sibirica, у одного дерева отмечены признаки гибридности |
| Алдан 3 | Респ. Саха (Якутия), Алданский район, окрестности г. Алдан, Белая гора | 58°27′ с.ш. 125°25′ в.д. | Ald3P | 41 особь P. pumila без признаков гибридности |
| Томмот | Респ. Саха (Якутия), Алданский район, окрестности пос. Томмот | 58°58′ с.ш. 126°16′ в.д. | TomS | 45 особей P. sibirica, признаки гибридности отмечены у двух деревьев |
| TomP | 20 особей P. pumila без признаков гибридности | |||
| Каталах | Респ. Саха (Якутия), Алданский район, южнее п. Томмот | 58°15′ с.ш. 126°18′ в.д. | KatP | 30 особей P. pumila, признаки гибридности отмечены у одного дерева |
| Большое Токо | Респ. Саха (Якутия), Нерюнгринский р-н, окрестности оз. Большое Токо (Токко) | 56°16′ с.ш. 130°32′ в.д. | BToP | 34 особи P. pumila без признаков гибридности |
| Сегян-Кюёль | Центральная Якутия, Кобяйский улус, окрестности п. Сегян-Кюёль | 64°00′ с.ш. 130°18′ в.д. | SegP | 33 особи Pinus pumila без признаков гибридности |
В качестве материала для генетического анализа использовали вегетативные почки. Для аллозимного анализа готовили гомогенаты с добавлением 0.5 М Трис-HCl буфера pH 7.5, содержащего 3% поливинилпирролидона и 0.2% β-меркаптоэтанола. Горизонтальный электрофорез экстрактов в 13%-ном крахмальном геле с последующим гистохимическим окрашиванием срезов для выявления зон активности ферментов проводили по описанным ранее методикам [14]. В анализ были включены 22 локуса, кодирующие 15 изоферментов: алкогольдегидрогеназу (ADH, 1.1.1.1), формиатдегидрогеназу (FDH, 1.2.1.2), флуоресцентную эстеразу (FE, 3.1.1.1), глутаматдегидрогеназу (GDH, 1.4.1.2-4), глутаматоксалоацетаттрансаминазу (GOT, 2.6.1.1), изоцитратдегидрогеназу (IDH, 1.1.1.42), лейцинаминопептидазу (LAP, 3.4.11.l), малатдегидрогеназу (MDH, 1.1.1.37), менадионредуктазу (MNR, 1.6.99.2), фосфоенолпируваткарбоксилазу (PEPCA, 4.1.1.31), фосфоглюкоизомеразу (PGI, 5.3.1.9), 6-фосфоглюконатдегидрогеназу (PGD, 1.1.1.44), фосфоглюкомутазу (PGM, 5.4.2.2), шикиматдегидрогеназу (SKDH, 1.l.1.25) и супероксиддисмутазу (SOD, 1.15.1.1).
Тотальную ДНК выделяли из тех же гомогенатов вегетативных почек с использованием CTAB [16]. В качестве видоспецифичного митохондриального маркера использовали интрон 2 локуса NADH-дегидрогеназы-1 (nad1 intron2), для которого описаны разные длины ампликонов у исследуемых видов сосен [17]. Фрагмент nad1 intron2 амплифицировали с помощью полимеразной цепной реакции (ПЦР) со специфическими праймерами [18] и ранее использованными условиями и режимами амплификации [11]. Амплифицированные фрагменты разделяли путем электрофореза в 1.5%-ном агарозном геле в буфере TAE (трис-ацетат-ЭДТА) [19].
Оценку байесовской апостериорной вероятности принадлежности к конкретному гибридному классу (вид 1, вид 2, гибриды F1 и F2 и поколение обратного скрещивания с видом 1 или видом 2) по многолокусным аллозимным генотипам проводили в программе NewHybrids, версия 1.1_b3 [20] с использованием графического интерфейса и 300 000 повторов.
РЕЗУЛЬТАТЫ
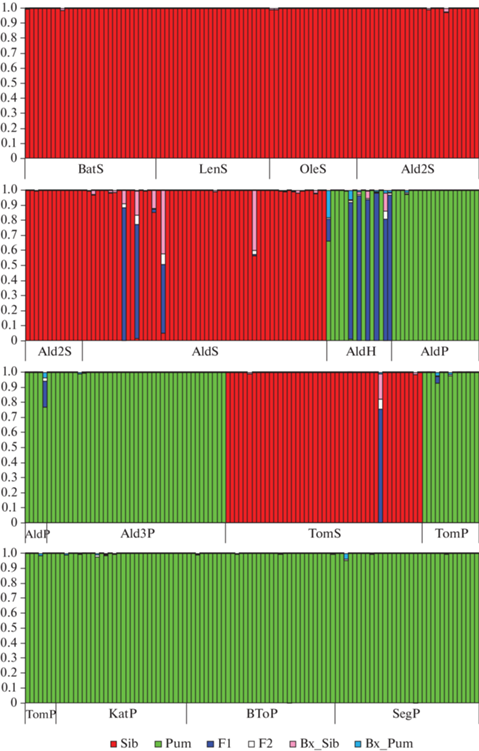
Все образцы были генотипированы по 22 аллозимным локусам: Adh-1, Fdh, Fe-2, Gdh, Got-1, Got-2, Got-3, Idh, Lap-3, Mdh-1, Mdh-2, Mnr-1, Pepca, 6Pgd-2, 6Pgd-3, Pgi-2, Pgm-1, Pgm-2, Skdh-1, Skdh-2, Sod-1 и Sod-2. Максимальный вес для различения видов имеет Skdh-2, по этому локусу у P. sibirica и P. pumila фиксированы разные аллели. Аллельный состав остальных изученных локусов частично или полностью перекрывается. При этом локусы Adh-1, Fe-2, Gdh, Got-2, Got-3, Lap-3, Mdh-2, Mnr-1, Pgm-1, Pgm-2, Pepca, Skdh-1, Sod-1 и Sod-2 также имеют высокий диагностический вес за счет различий в частотах преобладающих аллелей и наличия видоспецифичных аллелей. Результаты анализа многолокусных генотипов сибирской кедровой сосны, кедрового стланика и их предполагаемых гибридов в программе NewHybrids приведены на рис. 2.
Полиморфизм выборок по фрагменту nad1 intron2 мтДНК (P. sibirica, S – 2530 пн; P. pumila, P – 2181 пн) представлен в табл. 2.
Таблица 2.
Видовой состав изученных выборок и полиморфизм по длинам фрагмента nad1 intron2 мтДНК
| Выборка | P. sibirica | Гибриды | P. pumila | nad1 intron2 | |
|---|---|---|---|---|---|
| S | P | ||||
| Баталино | 30 | − | − | 30 | − |
| Ленск | 26 | − | − | 26 | − |
| Олёкминск | 20 | − | − | 1 | 19 |
| Алдан | 56 | 15 | 25 | − | 96 |
| Алдан 2 | 41 | − | − | − | 41 |
| Алдан 3 | − | − | 41 | − | 41 |
| Томмот | 45 | − | 20 | − | 65 |
| Каталах | − | 1 | 29 | − | 30 |
| Большое Токо | − | − | 36 | − | 36 |
| Сегян-Кюёль | − | − | 33 | − | 33 |
В выборке Баталино (BatS), Томская область, все особи сибирской кедровой сосны имеют типичный для вида фрагмент nad1 intron2 мтДНК (2530 пн) и характерные генотипы по аллозимным локусам (рис. 2, табл. 2). Деревья P. sibirica из выборки Ленск (LenS) также не демонстрируют гибридности по генетическим маркерам. Среди 20 деревьев из выборки Олёкминск (OleS) у 19 выявлен типичный для стланика фрагмент nad1 intron2 мтДНК (2181 пн). У одного дерева фрагмент nad1 intron2 соответствует P. sibirica. При этом генотипы по аллозимным локусам у всех деревьев характерны для сибирской кедровой сосны.
В зоне симпатрии P. sibirica и P. pumila в окрестностях г. Алдан было выделено несколько выборок различающегося видового состава (табл. 1). Среди 56 деревьев сибирской кедровой сосны из выборки Алдан (AldS) по изоферментным данным пять особей несли следы гибридизации (рис. 2): две особи определены как гибриды F1; одно дерево – бэккросс на P. sibirica; два дерева несли следы более отдаленной гибридизации – вероятные вторичные и более отдаленные бэккроссы на P. sibirica. Из 15 образцов, определенных по морфологии как гибриды (AldH), шесть оказались гибридами F1, один – бэккроссом на стланик, у которого в предках был гибрид, восемь особей генетически не отличались от кедрового стланика. В группе из 25 растений кедрового стланика (AldP) только у одного выявлены вероятные следы гибридизации в третьем поколении. Остальные особи не демонстрируют признаков гибридности.
Выборка Ald2S из смешанного насаждения с незначительным присутствием кедрового стланика состояла из 41 дерева сосны кедровой сибирской без фенотипических признаков гибридности. Только у одного дерева были отмечены несколько ветвей, отходящих от ствола по стланиковому типу. Все особи имеют типичный для стланика фрагмент nad1 intron2 мтДНК и характерные для сибирской кедровой сосны генотипы по аллозимным локусам.
Выборка Ald3P из смешанного насаждения без присутствия P. sibirica состояла из 41 особи кедрового стланика без признаков гибридности. Генетический анализ выявил у всех растений фрагмент nad1 intron2, соответствующий стланику, а также типичные для стланика аллозимные генотипы.
В выборке Томмот (TomS) из 45 деревьев сибирской кедровой сосны 44 не демонстрировали признаков гибридизации по изоферментам, но при этом длина фрагмента nad1 intron2 у всех особей соответствовала P. pumila. Генотип одного дерева по аллозимным локусам был отнесен с высокой вероятностью к гибриду F1 с небольшой примесью бэккросса на кедровую сосну. У 20 образцов стланика (TomP) генетических следов гибридизации не обнаружено.
Все 30 особей кедрового стланика из выборки Каталах (KatP) и по аллозимным генотипам, и по мтДНК оказались типичными P. pumila без следов гибридизации. Две выборки P. pumila из зоны аллопатрии – Большое Токо (BToP) и Сегян-Кюёль (SegP) представлены растениями с типичными для стланика генотипами.
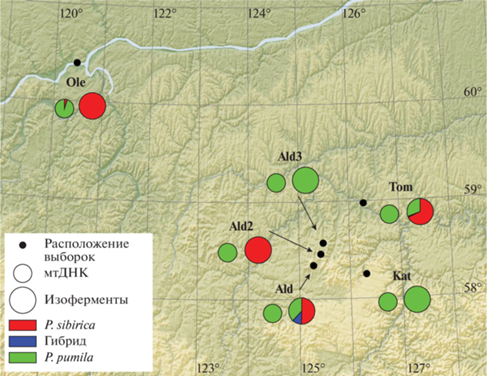
Таким образом, среди деревьев, относимых по габитусу к сибирской кедровой сосне, по всей северной границе зоны перекрывания ареалов от Олёкминска до Томмота наблюдается практически полная замена мтДНК кедровой сосны на мтДНК стланика (рис. 3). При этом в большинстве выборок аллозимные генотипы P. sibirica соответствуют типичным для вида.
В Алданском районе гибридные по морфологическим признакам растения были обнаружены только в двух локальностях с совместным произрастанием P. sibirica и P. pumila – Ald и Tom. Оказалось, что в генотипах некоторых из них нет следов гибридизации и они могут быть отнесены к кедровому стланику. Среди деревьев сибирской кедровой сосны шесть оказались гибридами, причем три из них могут быть отнесены к F1. В генотипах растений P. pumila следов гибридизации практически не обнаружено, за исключением одного отдаленного гибрида из выборки Ald.
ОБСУЖДЕНИЕ
Необходимыми условиями для гибридизации двух видов являются формирование зон контакта и перекрывания ареалов, отсутствие репродуктивных барьеров, совпадение сроков репродукции. Сходная морфология пыльцы у P. sibirica и P. pumila делает взаимное опыление возможным [21]. Необходимым условием для переопыления является хотя бы частичное перекрывание сроков цветения видов в смешанных популяциях. Как показали наблюдения, в зонах гибридизации вокруг оз. Байкал такое перекрывание возможно в пределах 12 дней, в то время как продолжительность цветения каждого из видов составляет 15 дней [9, 22]. Сроки созревания микростробилов и женских шишек у гибридных растений промежуточные между кедровой сосной и стлаником [23].
Кроме перекрывания фенофаз цветения на структуру гибридных популяций влияет численное соотношение особей родительских видов и гибридов в составе насаждения. Исследование происхождения зародышей семян от свободного опыления на побережье оз. Байкал (Давша, Баргузинский заповедник) установило, что в структуре опыления ведущая роль принадлежит P. sibirica – виду с преобладающей численностью, который опыляет и P. pumila, и гибриды. Также была подтверждена гипотеза о том, что гибриды первого поколения могут участвовать в опылении, давая начало как бэккроссам, так и гибридам второго поколения [24]. На основании анализа nad1 intron2 было показано, что в смешанных популяциях на побережье Байкала, где большинство гибридных растений являются гибридами F1, в роли материнских растений преимущественно выступает вид с более высокой численностью в данном насаждении [25]. У 15 из 16 гибридов из дельты Верхней Ангары, где в насаждении преобладает P. pumila, мтДНК оказалась от стланика. В выборке из Баргузинского заповедника мтДНК гибридов была преимущественно от P. sibirica (у 21 гибрида из 22), несмотря на то, что пыльца кедрового стланика в данной локальности не играет заметной роли в структуре опыления [26].
Изучение семенной продуктивности гибридов показало, что они отличаются значительно более высокой долей недоразвитых и пустых семян по сравнению с чистыми видами [22, 26]. Тем не менее в результате экспериментов по искусственному опылению чистых видов и их гибридов в условиях стационара было установлено, что наибольшее количество полноценных семян формируется в случае опыления материнских растений одного из родительских видов пыльцой гибрида. Обратные сочетания с опылением гибридных растений чистыми видами дают меньше полных семян. Наиболее низкая продуктивность отмечена при опылении гибрида пыльцой P. sibirica [27].
Наше исследование выявило преимущественно однонаправленную гибридизацию с асимметричным потоком генов между видами в условиях Южной Якутии. Данные мтДНК указывают на то, что в процессе гибридизации материнскими растениями выступали особи кедрового стланика, которые опылялись пыльцой сибирской кедровой сосны. Затем гибридные растения также могли опыляться пыльцой сибирской кедровой сосны и далее до возникновения ситуации, когда большая часть ядерных генов оказывалась постепенно замещенной генами P. sibirica. Такой процесс довольно протяжен во времени и предусматривает на начальном этапе значительный перевес численности растений P. pumila (материнский вид) над P. sibirica. Возможно, что среди потомства гибридов F1 селективное преимущество получали бэккроссы от опыления кедровой сосной. Можно предположить, что P. pumila имела большее распространение на юге Приленского плато, но в дальнейшем из-за изменений климатических и экологических условий была оттеснена в более высотные местообитания. Поскольку крайняя восточная точка нахождения единичной особи P. sibirica с характерной для кедровой сосны мтДНК – Олёкминск, можно заключить, что продвижение вида с запада на восток происходило довольно длительное время и исключительно за счет однонаправленной гибридизации.
В зоне контакта видов в Алданском районе Республики Саха происходит современная гибридизация, в которой участвуют кедровый стланик с типичными для него генотипами как по ядерным маркерам, так и по мтДНК, и сибирская кедровая сосна с характерными для вида ядерными маркерами, но с мтДНК от стланика. Наши изоферментные данные являются первыми результатами анализа локусов ядерного генома симпатричных кедровых сосен в данном регионе, они подтверждают наличие гибридов F1 и бэккроссов различного направления, что также соответствует ранее полученным данным по хпДНК [11].
В горных местообитаниях на островах Хонсю и Хоккайдо (Япония) кедровый стланик обитает в контакте с сосной мелкоцветковой, P. parviflora var. pentaphylla, что приводит к их гибридизации [28, 29], при этом в ряде локальностей происходит однонаправленная интрогрессия митохондриальных геномов от P. pumila к P. parviflora var. pentaphylla. С возрастанием высоты над уровнем моря увеличивается численность гибридных особей с мтДНК от стланика, при этом хпДНК интрогрессирует в обратном направлении [29, 30]. Авторы предположили, что такая структура зоны гибридизации связана с различиями в распространении пыльцы и семян. Как известно, у большинства хвойных хпДНК наследуется по отцовской линии и переносится с пыльцой, а мтДНК – по материнской и распространяется с семенами [31]. В трех зонах совместного произрастания на о. Хонсю обнаружена широкая интрогрессия мтДНК P. pumila к P. parviflora var. pentaphylla – почти все особи, по морфологии относимые к P. parviflora или к гибридам, обладали мтДНК от стланика, при этом хпДНК у них встречалась в разных сочетаниях [32].
Еще одним примером асимметричной интрогрессии цитоплазматических геномов могут служить североамериканские сосны – P. contorta и P. banksiana [33]. Характерный для P. contorta митотип встречается довольно далеко в зоне аллопатрии P. banksiana. По-видимому, это оказалось результатом древних гибридизационных событий. В зоне современного контакта и гибридизации этих видов распределение хлоротипов зависит от структуры популяции. Численное преимущество особей одного или другого вида определяет преобладающий тип хпДНК у гибридных растений.
С одной стороны, появление популяций сибирской кедровой сосны с мтДНК кедрового стланика можно трактовать лишь как результат механической однонаправленной интрогрессии, модерируемой неразвитыми механизмами презиготической изоляции, что характерно для видов хвойных в пределах родов, консерватизмом геномной организации из-за низких скоростей эволюции [34], а также перекрыванием фенофаз мужского и женского “цветения” [35]. То есть замещение мтДНК можно трактовать как селективно нейтральный процесс, связанный лишь с межвидовым потоком генов, возникающим как следствие репродуктивных особенностей видов. Но с другой стороны, учитывая экстремальные для P. sibirica условия существования на северо-восточной границе его ареала, захват митохондрий другого вида и закрепление чужеродных митотипов может быть также и следствием адаптивных процессов. В последние годы активно обсуждается роль так называемой адаптивной интрогрессии [36]. Интрогрессия митохондриального субгенома кедрового стланика, который содержит у растений десятки генов [37], контролирующих в том числе энергетический обмен, привела к полному замещению мтДНК сибирской кедровой сосны на мтДНК P. pumila. Этот быстрый в эволюционном масштабе времени процесс (по сравнению с “дарвиновской” эволюцией, основанной на случайных мутациях и поддержке естественным отбором той ничтожной доли из них, которая может нести положительный селективный потенциал) мог стать полезной адаптацией, обеспечившей существование вида на самом северо-востоке ареала, на территории, где условия сильно отличаются от зоны оптимума вида [38].
В отличие от модели постепенного формирования изоляции двух видов, которая проходит стадию гибридизации через поток генов между еще недостаточно сильно дивергировавшими исходными формами, в случае данной пары видов кедровых сосен мы имеем дело с сильно разошедшимися видами, имеющими глубокие различия как в морфологии и экологии, так и в ядерном геноме, и в органельных субгеномах [7]. По всей видимости, формирование этих видов проходило миллионы лет назад в разных рефугиумах, с накоплением существенных геномных различий, обусловливающих разные паттерны адаптации, и нынешние гибридизационные процессы не имеют прямого отношения к той фазе первичного обмена генами. Вторичная зона симпатрии в данном случае не привела к формированию такой широкой зоны интерградации фенотипических признаков и генотипической структуры, как это можно наблюдать для видов палеарктических елей [39–42] и лиственниц [43, 44]. В целом в пределах зоны симпатрии, в том числе и в рассматриваемом регионе Южной Якутии, P. sibirica и P. pumila ведут себя как хорошие виды. Гибриды постоянно образуются в биотопах, где виды находятся в условиях непосредственного контакта, но нигде особи с промежуточными фенологическими характеристиками и генотипами по генным локусам ядерной локализации не доминируют, не вытесняют исходные виды. В данном случае мы наблюдаем скорее не единую сплошную гибридную зону, а отдельные локальные зоны и очаги гибридизации, которая может идти далее первого–второго поколения [13], но при этом нигде не приводит к смешению видов. Захват чужеродной мтДНК, видимо, является альтернативной стратегией регуляции межвидового потока генов, которая позволяет избежать формирования плохо коадаптированных комплексов ядерных генов (гибридный дисгенез, регуляторная несовместимость) [45], но в то же время дает возможность однонаправленного, а потенциально и взаимного, обогащения генетической структуры, примерами чему могут служить не только растения, но и некоторые группы животных [46].
Несовпадающие границы ареалов в зонах контактов близких видов по разным маркерам – ядерным, митохондриальным и хлоропластным неоднократно описывались для хвойных разных регионов Палеарктики, в частности для пихт [47, 48], лиственниц [43], елей [49–51]. Наблюдаемое нами явление имеет большое значение для практической видовой идентификации особей кедровых сосен в зонах симпатрии, поскольку в зависимости от используемого класса молекулярно-генетических маркеров одно и то же растение может быть признано представителем одного из родительских видов или их гибридом. В то же время пространственные границы распространения различных элементов органельных и ядерных геномов кедровых сосен требуют более детального изучения методами геномики.
Работа выполнена при финансовой поддержке по теме Государственного задания Министерства науки и высшего образования РФ для Института общей генетики им. Н.И. Вавилова РАН № 0112-2019-0001 и по теме Государственного задания Министерства науки и высшего образования Российской Федерации проект № FWGR-2021-0007.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Arnold M.L. Natural Hybridization and Evolution. N.Y.: Oxford Univ. Press, 1997. 215 p.
Barton N.H., Hewitt G.M. Analysis of hybrid zones // Annual Rev. Ecol. and Systematics. 1985. V. 16. P. 113–148. https://doi.org/10.1146/annurev.es.16.110185.000553
Коропачинский И.Ю., Милютин Л.И. Естественная гибридизация древесных растений. Новосибирск: “Гео”, 2006. 233 с.
Critchfield W.B. Hybridization and classification of the white pines (Pinus section Strobus) // Taxon. 1986. V. 35. № 4. P. 647–656. https://doi.org/10.2307/1221606
Vasilieva G.V., Goroshkevich S.N. Artificial crosses and hybridization frequency in five-needle pines // Dendrobiology. 2018. V. 80. P. 123–130. https://doi.org/10.12657/denbio.080.012
Syring J., Farrell K., Businsky R. et al. Widespread genealogical nonmonophyly in species of Pinus subgenus Strobus // Systematic Biology. 2007. V. 56(2). P. 163–181. https://doi.org/10.1080/10635150701258787
Tsutsui K., Suwa A., Sawada K. et al. Incongruence among mitochondrial, chloroplast and nuclear gene trees in Pinus subgenus Strobus (Pinaceae) // J. Plant Research. 2009. V. 122. P. 509–521. https://doi.org/10.1007/s10265-009-0246-4
Wang B., Wang X.-R. Mitochondrial DNA capture and divergence in Pinus provide new insights into the evolution of the genus // Mol. Phylogenet. Evol. 2014. V. 80. P. 20–30. https://doi.org/10.1016/j.ympev.2014.07.014
Горошкевич С.Н., Петрова Е.А., Васильева Г.В. и др. Межвидовая гибридизация как фактор сетчатой эволюции 5-хвойных сосен Северной и Восточной Азии // Хвойные бореальной зоны. 2010. Т. XXVII. № 1–2. С. 50–57.
Goroshkevich S.N. Natural hybridization between Russian stone pine (Pinus sibirica) and Japanese stone pine (Pinus pumila) // Breeding and Genetic Resources of Five-needle Pines: Growth, Adaptability, and Pest Resistance. IUFRO Working Party 2.02.15. Proc. RMRS-P-32. Medford: Fort Collins, U.S. Forest Service, 2004. P. 169–171.
Petrova E.A., Zhuk E.A., Popov A.G. et al. Asymmetric introgression between Pinus sibirica and Pinus pumila in the Aldan plateau (Eastern Siberia) // Silvae Genetica. 2018. V. 67. P. 66–71. https://doi.org/10.2478/sg-2018-0009
Горошкевич С.Н. О возможности естественной гибридизации Pinus sibirica и Pinus pumila в Прибайкалье // Бот. журн. 1999. Т. 84. № 9. С. 48–57.
Петрова Е.А., Горошкевич С.Н., Белоконь М.М. и др. Естественная гибридизация кедра сибирского (Pinus sibirica Du Tour) и кедрового стланика (Pinus pumila (Pallas) Regel) в южном Забайкалье // Хвойные бореальной зоны. 2012. Т. XXX. № 1–2. С. 152–156.
Politov D.V., Belokon M.M., Maluchenko O.P. et al. Genetic evidence of natural hybridization between Siberian stone pine, Pinus sibirica Du Tour, and dwarf Siberian stone pine, P. pumila (Pall.) Regel // Forest Genetics. 1999. V. 6. № 1. P. 41–48.
Политов Д.В., Белоконь М.М., Малюченко О.П. и др. Генетические доказательства естественной гибридизации между сибирской кедровой сосной Pinus sibirica и кедровым стлаником Pinus pumila (Pinaceae) // Проблемы ботаники на рубеже XX–XXI веков: Тез. докл., представленных II (X) съезду Русского бот. об-ва, 26–29 мая 1998 г. Санкт-Петербург, 1998. С. 180.
Doyle J.J., Doyle J.L. Isolation of plant DNA from fresh tissue // Focus. 1990. V. 12. P. 12–15.
Gugerli F., Senn J., Anzidei M. et al. Chloroplast microsatellites and mitochondrial nad1 intron 2 sequences indicate congruent phylogenetic relationships among Swiss stone pine (Pinus cembra), Siberian stone pine (Pinus sibirica), and Siberian dwarf pine (Pinus pumila) // Mol. Ecol. 2001. V. 10. P. 1489–1497. https://doi.org/10.1046/j.1365-294x.2001.01285.x
Demesure B., Sodzi M., Petit R.J. A set of universals primers for amplification of polymorphic non-coding regions of mitochondrial and chloroplast DNA in plants // Mol. Ecol. 1995. V. 4. P. 129–131. https://doi.org/10.1111/j.1365-294x.1995.tb00201.x
Sambrook J., Fritsch E.R., Maniatis T. Molecular Cloning: A Laboratory Manual (2nd ed.). N.Y.: Cold Spring Harbor Lab. Press, 1989.
Anderson E.C., Thompson E.A. A model-based method for identifying species hybrids using multilocus genetic data // Genetics. 2002. V. 160. P. 1217–1229. https://doi.org/10.1093/genetics/160.3.1217
Куприянова Л.А., Литвинцева М.В. Группа Cembra рода Pinus, ее объем и связи по палинологическим данным // Бот. журн. 1974. Т. 59. № 5. С. 630–644.
Goroshkevich S.N., Popov A.G., Vasilyeva G.V. Ecological and morphological studies in the hybrid zone between Pinus sibirica and Pinus pumila // Annals Forest Res. 2008. V. 51. P. 43–52. https://doi.org/10.15287/afr.2008.144
Васильева Г.В., Жук Е.А., Попов А.Г. Фенология цветения кедра сибирского (Pinus sibirica Du Tour), кедрового стланика (Pinus pumila (Pall.) Regel) и гибридов между ними // Вестник Томского гос. ун-та. Биология. 2010. № 1(9). С. 61–67.
Petrova E.A., Goroshkevich S.N., Politov D.V. et al. Population genetic structure and mating system in the hybrid zone between Pinus sibirica Du Tour and Pinus pumila (Pall.) Regel at the Eastern Baikal Lake shore // Annals Forest Res. 2008. V. 51. P. 19–30. https://doi.org/10.15287/afr.2008.142
Белоконь С.Ю., Петрова Е.А., Белоконь Ю.С., Белоконь М.М. Анализ происхождения межвидовых гибридов сибирского кедра и кедрового стланика из Прибайкалья // Леса Евразии – Подмосковные вечера: Материалы Х междунар. конф. молодых ученых, посвященной 90-летию со дня основания Московского гос. ун-та леса и 170-летию со дня рождения профессора М.К. Турского. М.: ГОУ ВПО МГУЛ, 2010. С. 168–170.
Петрова Е.А., Горошкевич С.Н., Политов Д.В. и др. Семенная продуктивность и генетическая структура популяций в зоне естественной гибридизации кедра сибирского и кедрового стланика в северном Прибайкалье // Хвойные бореальной зоны. 2007. Т. XXIV. № 2–3. С. 329–335.
Vasilyeva G.V., Goroshkevich S.N. Crossability of Pinus sibirica and P. pumila with their hybrids // Silvae Genetica. 2013. V. 62. № 1–2. P. 61–67. https://doi.org/10.1515/sg-2013-0008
Watano Y., Imazu M., Shimizu T. Chloroplast DNA typing by PCR-SSCP in the Pinus pumila – P. parviflora var. pentaphylla complex (Pinaceae) // J. Plant Research. 1995. V. 108. P. 493–499.
Watano Y., Imazu M., Shimizu T. Spatial distribution of cpDNA and mtDNA haplotypes in a hybrid zone between Pinus pumila and P. parviflora var. pentaphylla (Pinaceae) // J. Plant Research. 1996. V. 109. P. 403–408. https://doi.org/10.1007/BF02344555
Watano Y., Kanai A., Tani N. Genetic structure of hybrid zones between Pinus pumila and P. parviflora var. pentaphylla (Pinaceae) revealed by molecular hybrid index analysis // Am. J. Botany. 2004. V. 91. № 1. P. 65–72. https://doi.org/10.3732/ajb.91.1.65
Neale D.B., Sederoff R.R. Paternal inheritance of chloroplast DNA and maternal inheritance of mitochondrial DNA in loblolly pine // Theor. Appl. Genet. 1989. V. 77. P. 212–216. https://doi.org/10.1007/BF00266189
Senjo M., Kimura K., Watano Y. et al. Extensive mitochondrial lntrogression from Pinus pumila to P. pawiflora var. pentaphylla (Pinaceae) // J. Plant Research. 1999. V. 112. P. 97–105.
Godbout J., Yeh F.C., Bousquet J. Large-scale asymmetric introgression of cytoplasmic DNA reveals Holocene range displacement in a North American boreal pine complex // Ecol. Evol. 2012. V. 2. № 8. P. 1853–1866.
Buschiazzo E., Ritland C., Bohlmann J., Ritland K. Slow but not low: Genomic comparisons reveal slower evolutionary rate and higher dN/dS in conifers compared to angiosperms // BMC Evolutionary Biology. 2012. V. 12. № 8. P. 1–14. https://doi.org/10.1186/1471-2148-12-8
Горошкевич С.Н., Петрова Е.А., Политов Д.В. и др. Эколого-географическая дифференциация и интеграционные процессы в группе близкородственных видов с трансконтинентальным ареалом (на примере 5-хвойных сосен северной и восточной Азии) // Хвойные бореальной зоны. 2007. Т. XXIV. № 2–3. С. 167–173.
Edelman N.B., Mallet J. Prevalence and adaptive impact of introgression // Annual Review Genet. 2021. V. 55. P. 265–283. https://doi.org/10.1146/annurev-genet-021821-020805
Hipkins V.D., Krutovskii K.V., Strauss S.H. Organelle genomes in conifers: structure, evolution and diversity // Forest Genetics. 1994. V. 1. № 4. P. 179–189.
Кедровые леса Сибири. Новосибирск: Наука, 1985. 258 с.
Бобров Е.Г. Лесообразующие хвойные СССР. Л.: Наука, 1978. 188 с.
Правдин Л.Ф. Ель европейская и ель сибирская в СССР. М.: Наука, 1975. 176 с.
Политов Д.В., Крутовский К.В. Клинальная изменчивость и интрогрессивная гибридизация в популяциях европейской и сибирской елей // Жизнь популяций в гетерогенной среде. Йошкар-Ола, 1998. С. 78–89.
Krutovskii K.V., Bergmann F. Introgressive hybridization and phylogenetic relationships between Norway, Picea abies (L.) Karst., and Siberian, P. obovata Ledeb., spruce species studied by isozyme loci // Heredity. 1995. V. 74. P. 464–480.
Semerikov V.L., Lascoux M. Nuclear and cytoplasmic variation within and between Eurasian Larix (Pinaceae) species // Am. J. Botany. 2003. V. 90. № 8. P. 1113–1123. https://doi.org/10.3732/ajb.90.8.1113
Semerikov V.L., Semerikov L.F., Lascoux M. Intra- and interspecific allozyme variability in Eurasian Larix Mill. species // Heredity. 1999. V. 82. P. 193–204. https://doi.org/10.1046/j.1365-2540.1999.00471.x
Landry C.R., Hartl D.L., Ranz J.M. Genome clashes in hybrids: insights from gene expression // Heredity. 2007. V. 99. № 5. P. 483–493. https://doi.org/10.1038/sj.hdy.6801045
Walsh J., Kovach A.I., Olsen B.J. et al. Bidirectional adaptive introgression between two ecologically divergent sparrow species // Evolution. 2018. V. 72. P. 2076–2089. https://doi.org/10.1111/evo.13581
Semerikova S.A., Khrunyk Y.Y., Lascoux M., Semerikov V.L. From America to Eurasia: A multigenomes history of the genus Abies // Mol. Phylogenet. Evol. 2018. V. 125. P. 14–28. https://doi.org/10.1016/j.ympev.2018.03.009
Semerikova S.A., Semerikov V.L., Lascoux M. Post-glacial history and introgression in Abies (Pinaceae) species of the Russian Far East inferred from both nuclear and cytoplasmic markers // J. Biogeography. 2011. V. 38. № 2. P. 326–340. https://doi.org/10.1111/j.1365-2699.2010.02394.x
Tsuda Y., Chen J., Stocks M. et al. The extent and meaning of hybridization and introgression between Siberian spruce (Picea obovata) and Norway spruce (Picea abies): cryptic refugia as stepping stones to the west? // Mol. Ecol. 2016. V. 25. № 12. P. 2773–2789. https://doi.org/10.1111/mec.13654
Мудрик Е.А., Полякова Т.А., Шатохина А.В. и др. К вопросу о границе распространения североевропейских и сибирских гаплотипов nad1 мтДНК у елей комплекса Picea abies – P. obovata в Западной Сибири // Генетика популяций: прогресс и перспективы. Материалы Междунар. науч. конф., посвященной 80-летию со дня рождения академика Ю.П. Алтухова (1936–2006) и 45-летию основания лаборатории популяционной генетики им. Ю.П. Алтухова ИОГен РАН (17–21 апреля 2017 г., Звенигородская биологическая станция им. С.Н. Скадовского Биологического факультета МГУ им. М.В. Ломоносова). М.: Ваш Формат, 2017. С. 178–179.
Мудрик Е.А., Полякова Т.А., Шатохина А.В. и др. Пространственное распределение гаплотипов второго интрона гена nad1 в популяциях ели комплекса европейской и сибирской елей (Picea abies–P. obovata) // Генетика. 2015. Т. 51. № 10. С. 1117–1125. https://doi.org/10.7868/S0016675815100124
Дополнительные материалы отсутствуют.