Генетика, 2022, T. 58, № 11, стр. 1311-1324
Изучение популяционной структуры байкальских сиговых рыб на основе полиморфизма микросателлитных локусов
Т. В. Сидорова 1, *, В. В. Смирнов 2, С. В. Кирильчик 1, Л. В. Суханова 1
1 Лимнологический институт Сибирского отделения Российской академии наук
664033 Иркутск, Россия
2 Байкальский музей Иркутского научного центра Сибирского отделения
Российской академии наук
664520 пос. Листвянка, Россия
* E-mail: tuyana_be@mail.ru
Поступила в редакцию 19.05.2022
После доработки 29.06.2022
Принята к публикации 30.06.2022
- EDN: CPMELH
- DOI: 10.31857/S001667582211011X
Аннотация
С использованием пяти микросателлитных локусов, Bwf1, Bom22b, Cocl23, Cam1, Cam5, изучен полиморфизм девяти популяций байкальского комплекса сиговых рыб, представленного в озере тремя видами: омулем и двумя сигами, озерным и озерно-речным. Обобщенная выборка составила 244 особи. Популяции омуля и озерного сига кластеризуются в две отдельные группы с небольшими попарными генетическими расстояниями. Расстояния между группами невелики, на основании чего можно заключить, что байкальские сиг и омуль дивергировали друг от друга в недавнем геологическом прошлом. На большом расстоянии от этих групп находится популяция омуля из оз. Кулинда (бассейн р. Кичера, северного притока оз. Байкал), что подтверждает ее изолированность от всего комплекса омуль/озерный сиг. Промежуточное положение популяции омуля, нерестящейся в еще одном северном притоке озера, р. Верхняя Ангара, между остальными байкальскими популяциями омуля и кулиндинским омулем свидетельствует о наличии потока генов из оз. Кулинда в северные притоки озера. Также на большом расстоянии находится нерестящийся в р. Верхняя Ангара озерно-речной сиг, несмотря на наложение сроков и мест нереста с верхнеангарским омулем. Выявленный рисунок генетического полиморфизма свидетельствует о недавней симпатрической дивергенции байкальских омуля, озерного сига и их популяций, подтверждает факт географической изоляции одной из популяций байкальского омуля в оз. Кулинда ледниково-тектонического происхождения и не противоречит гипотезе о продолжительной аллопатрической дивергенции предка байкальского озерно-речного сига за пределами озера.
Изучение популяционного полиморфизма видов, имеющих промысловое значение и большой ареал обитания, является актуальной задачей популяционной экологии. Для изучения микроэволюционных процессов [1], генетической структуры популяций, а также взаимодействий между ними [2, 3] широко используются микросателлитные локусы благодаря высокому уровню полиморфизма аллелей и гетерозиготности, большой представленности в геноме, как в некодирующих участках, так и в составе регуляторных последовательностей [4].
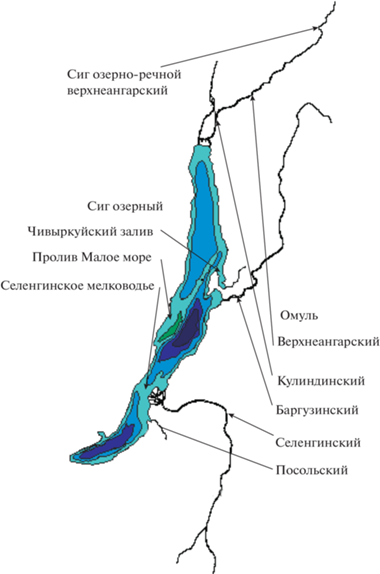
Объект данного исследования – популяции сиговых рыб Байкала: байкальский омуль и два сига, озерный и озерно-речной, освоившие практически все реки и заливы, а в открытом озере – глубины до 400 м (рис. 1, табл. 1). Популяционная структура отдельных видов байкальских сиговых изучалась изоферментным анализом [5–9] и рестрикционным анализом мтДНК [10–12]. Однако совместного анализа видов одним методом до сих пор не проводилось. В настоящей работе впервые для исследования процессов внутриозерной эволюции использованы микросателлитные локусы и осуществлен единовременный сравнительный анализ популяционного полиморфизма всех трех видов байкальских сиговых. В контексте полученных данных обсуждается спорный таксономический статус байкальских видов.
Таблица 1.
Места сбора проб и объем проанализированного материала
| Вид | Номер выборки |
Популяция/МЭГ* (место размножения) |
Число образцов |
|---|---|---|---|
| Байкальский омуль **/***Coregonus migratorius Georgi, 1775 |
1 | Баргузинский омуль/прибрежная МЭГ (р. Баргузин) | 44 |
| 2 | Посольский омуль/придонно-глубоководная МЭГ (Посольский сор, р. Большая) | 32 | |
| 3 | Селенгинский омуль/пелагическая МЭГ (р. Селенга) |
29 | |
| 5 | Кулиндинский омуль, географический изолят байкальского омуля (оз. Кулинда) | 37 | |
| 4 | Верхнеангарский омуль/прибрежная МЭГ (р. Верхняя Ангара) | 12 | |
| Байкальский озерный сиг **/***Coregonus baicalensis Dybowski, 1874 |
6 | Селенгинский сиг (Селенгинское мелководье) | 39 |
| 7 | Чивыркуйский сиг (Чивыркуйский залив) | 10 | |
| 8 | Маломорский сиг (пролив Малое Море) | 22 | |
| Байкальский озерно-речной сиг **Coregonus pidschian (Gmelin, 1789) ***Coregonus fluviatilis Isachenko, 1925 |
9 | Верхнеангарский озерно-речной сиг (р. Верхняя Ангара) | 19 |
* – морфо-экологическая группа (МЭГ) омуля, размножающегося в притоках оз. Байкал; ** – согласно электронной базе данных FishBase www.fishbase.org/; *** – согласно электронному каталогу рыб Эшмейера: www.calacademy.org.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования и характеристики локусов
Объектом исследования явились девять выборок из девяти популяций байкальских сиговых рыб (рис. 1, табл. 1). В микросателлитный анализ включены:
– четыре популяции пелагобионта байкальского омуля, размножающегося в притоках озера, и представляющие три, выделяемые ихтиологами, морфо-экологические группы [13];
– популяция омуля оз. Кулинда – географический изолят байкальского омуля периода олигоцена [14, 15];
– три популяции озерного сига, нерест которого проходит непосредственно в озере, его мелководных участках;
– одна популяция озерно-речного сига, мигрирующего на нерест в крупные притоки озера.
Ткани (мышцы, плавники, печень) отбирались у половозрелых рыб в период нереста на путях миграций. Общее число рыб составило 244 особи.
Выделение ДНК
Суммарная ДНК выделялась экстракцией фенолом и хлороформом [16] из фиксированных в 95%-ном этаноле тканей (мышцы, плавники, печень).
ПЦР
Микросателлитные локусы амплифицировали с помощью полимеразной цепной реакции (ПЦР), используя праймеры, характеристика которых дана в табл. 2. ПЦР проводилась в 10 мкл реакционной смеси, содержащей 10 нг ДНК, 1 мкМ каждого праймера, 10 мМ Трис-HCl, pH 8.9, 40 мМ KCl, 5 мМ MgCl2 и 1 е.а. Taq-полимеразы при следующих условиях: 3 мин при 95°С, последующие 30 циклов (30 с при 94°С, 30 с при локус-специфичной температуре отжига (см. в табл. 2) и 30 с при 72°С) и 10 мин при 72°С. При амплификации локуса Cam1 оптимальное количество ПЦР-продукта получали, увеличивая число циклов амплификации до 40. При увеличении числа циклов более качественный продукт получался при использовании Taq-полимеразы, свободной от ДНК. Реакция в данном случае проводилась в буфере, содержащем 16 мМ (NH4)2SO4, 65 мМ Трис-HCl, pH 8.8 и 0.01% Tween 20.
Таблица 2.
Характеристики микросателлитных локусов
| Локус | Элемент повтора |
tотжига, °С |
Последовательность праймеров |
|---|---|---|---|
| Bwf1 [17] | (GA)16N95(TG)13 | 60 | L: TACAGAGAAATACACACAACGCATCAA R: GAGAGGTTCCATTACTGAGCAC |
| 22b [18] | (CT)15 | 60 | L: GCTGTATGAGGATAGCATTC R: GCATTAGGTCGTTTTGTGT |
| Coc123 [19] | (GT)8 | 60 | L: GCCATGGATGCCTTCTTGAT R: GGCCTTAACTTGTACACGGTCTG |
| Cam1 [18] | (GT)3C(GT)3A(GT)6N9(CA)6N19(GT)11 | 65 | L: GGCTGGTGTGAACAAAAACA R: CCACGTACAGGGAGGCTACA |
| Cam5 [18] | (GT)16 | 58 | L: CGGTCATGGACAAGGTTATTC R: GGGTTCACATTCAAGGCACT |
Электрофорез
Продукты ПЦР разделялись с помощью вертикального электрофореза в 6%-ном денатурирующем полиакриламидном геле [20]. Использовали раствор 6%-ного полиакриламида в буфере ТВЕ: 0.05 M Трис-HCl и 0.02 M EDTA, pH 8.0. Визуализация полос осуществлялась методом окрашивания нитратом серебра и радиографическим методом с применением в качестве метки радиоактивного изотопа 32P. Для определения размеров микросателлитных фрагментов использовался маркер молекулярной массы с шагом 25 пн (Promega, США).
Включение радиоактивной метки (кинирование)
Мечение 5'-концов праймеров проводили с помощью реакции кинирования. Реакционная смесь для кинирования содержала буфер Mg-DTT, буфер Трис-HCl, 10 пM праймеров, Т4 полинуклеотидкиназу, аденозин-5'-[γ-32P] трифосфат и воду. Меченые праймеры использовали в реакции ПЦР. После электрофоретического разделения продуктов реакции ПЦР полиакриламидный гель закладывали с рентгеновской пленкой для получения радиоавтографа. Затем проводился анализ длин фрагментов по снимку.
Фиксация серебром
После электрофореза гель переносили в пластиковую емкость и подвергали последующей обработке, включающей несколько этапов:
1. Гель выдерживали при перемешивании 15 мин в фиксирующем растворе 0.1% СТАВ.
2. Промывали три раза 0.3%-ным гидроксидом аммония.
3. Выдерживали при перемешивании 15–20 мин в серебряном растворе, содержащем 0.1% нитрата серебра, 4 мМ гидроксида натрия и 0.4% гидроксида аммония.
4. Проявляли изображение на свету в трех сменах проявителя (раствор 0.1%-ного параформа и 2%-ного карбоната натрия).
Затем проводился анализ длин фрагментов по снимку.
Статистическая обработка данных
При помощи программы Micro-checker [21] данные были протестированы на наличие “нулевых” аллелей, “доминирования коротких аллелей” и “заикания”. По результатам обработки данных в программе Micro-cheker наличие “нулевых” аллелей на основании дефицита гетерозигот по методу Brookfield [22] с вероятностью более 95% было предсказано для локусов Bwf1 и 22b для популяций посольского и верхнеангарского омулей, а также селенгинского и маломорского сигов; только для локуса Bwf1 для популяций баргузинского омуля и верхнеангарского озерно-речного сига; для локусов Coc123 и Cam5 для популяции селенгинского омуля (табл. 3). Для популяций кулиндинского омуля и чивыркуйского сига не было найдено ни одного “нулевого” аллеля. Однако при коррекции входных данных на основе оценок частот нулевых аллелей [23] резко возрастало количество отсутствующих данных (missing data) и, как следствие, значительно сокращалось число анализируемых локусов. Соответственно дальнейший анализ вели без коррекции, а информацию о наличии “нулевых” аллелей использовали для интерпретации значений соответствия частот аллелей в исследованных выборках равновесию Харди–Вайнберга.
Таблица 3.
Результаты обработки данных полиморфизма пяти микросателлитных локусов в программе Micro-сheker
| Локус | Омуль | Озерный сиг | Озерно-речной сиг | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| Bwf1 | + | + | – | + | – | + | – | + | + |
| Bom22b | – | + | – | + | – | + | – | + | – |
| Cocl23 | – | – | + | – | – | – | – | – | – |
| Cam1 | – | – | – | – | – | – | – | – | – |
| Cam5 | – | – | + | – | – | – | – | – | – |
Примечание. 1–9 – номера выборок (для табл. 3, 5, 6): 1 – баргузинский омуль, 2 – посольский омуль, 3 – селенгинский омуль, 4 – верхнеангарский омуль, 5 – кулиндинский омуль, 6 – селенгинский сиг, 7 – чивыркуйский сиг, 8 – маломорский сиг, 9 – верхнеангарский озерно-речной сиг. Знаком (+) и (–) обозначено наличие и отсутствие нулевых аллелей.
В программе Arlequin v3.5 [24] по пяти локусам (Bwf1, Cocl23, Bom22b, Cam1, Cam5) было проведено вычисление наблюдаемой (HO) и ожидаемой (HE) гетерозиготности, отклонения от равновесия Харди–Вайнберга, количества аллелей на локус, аллельного разнообразия, среднего индекса аллельных “потерь” Garza–Williams (G–W-индекс) на локус, а также был вычислен критерий FST [25, 26] как показатель меры генетической дифференциации. Значения FST и метод объединения ближайших соседей (NJ), реализованные в программах Arlequin [24] и MEGA7.0 [27], использовались для построения схемы, отражающей степень репродуктивной обособленности между анализируемыми популяциями. Для построения дерева гаплотипов, основанного на данных полиморфизма микросателлитных локусов, использовались генетические расстояния Da [28] и метод объединения ближайших соседей (NJ – Neighbor-Joining), реализованные в программе Population v1.2.32 [29]. При построении схем визуализацию осуществляли в программе FigTree v1.4.4 [30].
Для выявления границ популяций и их числа была использована программа STRUCTURE [31]. В основе программы лежит алгоритм Монте-Карло по схеме марковских цепей (MCMC) для байесовской статистики, при помощи которого можно определить популяционную структуру, опираясь на наиболее вероятное разделение данных на кластеры. В программе STRUCTURE при анализе микросателлитных данных предполагается, что популяции находятся в равновесии Харди–Вайнберга и равновесны по сцеплению. Параметры настраивались на основании статей, посвященных анализу популяций с неравными выборками, а также подбору надежных значений, обеспечивающих достоверность полученных данных [32, 33], и приведены в табл. 4.
РЕЗУЛЬТАТЫ
Генетическое разнообразие
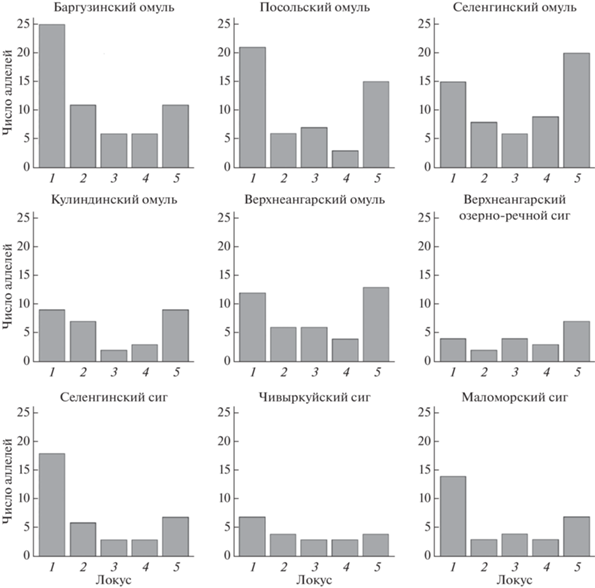
Проведенный анализ выявил высокий полиморфизм изученных популяций байкальских сиговых по исследованным локусам (табл. 5). Наименьшее число выявленных аллелей на локус в анализируемой выборке составило два (22b и Cocl23), а наибольшее – 26 (рис. 2). В целом по всем выборкам среднее число аллелей на локус составило восемь. Популяции байкальского омуля по числу выявленных аллелей и уровню гетерозиготности в целом оказались более полиморфными (среднее число аллелей – 10.9, средний уровень HE = 0.77, HO = 0.70) чем популяции озерного сига (среднее число аллелей – 6.4, средний уровень HE = 0.6404, HO = 0.60). Еще более низкий уровень полиморфизма показали малочисленные популяции – географический изолят байкальского омуля – омуль оз. Кулинда (среднее число аллелей – 5.6, средний уровень HE = 0.58, HO = 0.60) и верхнеангарская популяция озерно-речного сига (среднее число аллелей – 4.4, средний уровень HE = 0.51, HO = 0.47).
Таблица 5.
Генетическая характеристика выборок из популяций байкальских сиговых по микросателлитным локусам
| Локус | Характеристика выборки |
Омуль | Озерный сиг | Озерно-речной сиг | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| Bwf1 | n | 44 | 32 | 28 | 13 | 36 | 38 | 10 | 21 | 19 |
| A | 26* | 22* | 15 | 14* | 8 | 19* | 7 | 15* | 6* | |
| p | 0.000 | 0.007 | 0.577 | 0.000 | 0.301 | 0.000 | 0.590 | 0.007 | 0.000 | |
| HO | 0.636 | 0.813 | 0.857 | 0.615 | 0.556 | 0.737 | 0.800 | 0.762 | 0.316 | |
| HE | 0.946 | 0.929 | 0.899 | 0.638 | 0.579 | 0.940 | 0.815 | 0.919 | 0.744 | |
| Bom22b | n | 43 | 30 | 28 | 14 | 37 | 38 | 10 | 21 | 19 |
| A | 11 | 6* | 8 | 8* | 6 | 8* | 4 | 6* | 2 | |
| p | 0.006 | 0.000 | 0.005 | 0.000 | 0.006 | 0.000 | 0.778 | 0.000 | 0.607 | |
| HO | 0.674 | 0.233 | 0.857 | 0.428 | 0.649 | 0.472 | 0.700 | 0.381 | 0.526 | |
| HE | 0.759 | 0.453 | 0.710 | 0.865 | 0.631 | 0.784 | 0.558 | 0.786 | 0.443 | |
| Cocl23 | n | 43 | 31 | 28 | 15 | 36 | 38 | 10 | 21 | 19 |
| A | 6 | 7 | 8* | 6 | 2 | 3 | 3 | 4 | 4 | |
| p | 0.009 | 0.012 | 0.088 | 0.470 | 0.197 | 0.690 | 0.738 | 0.224 | 1.000 | |
| HO | 0.651 | 0.581 | 0.535 | 1.000 | 0.389 | 0.500 | 0.500 | 0.714 | 0.158 | |
| HE | 0.747 | 0.673 | 0.718 | 0.763 | 0.501 | 0.568 | 0.573 | 0.598 | 0.154 | |
| Cam1 | n | 44 | 29 | 27 | 15 | 36 | 38 | 10 | 22 | 18 |
| A | 6 | 3 | 9 | 4 | 3 | 3 | 3 | 3 | 3 | |
| p | 0.001 | 0.003 | 0.000 | 0.005 | 0.836 | 0.210 | 0.046 | 1.000 | 0.113 | |
| HO | 0.841 | 0.517 | 0.629 | 1.000 | 0.444 | 0.447 | 0.900 | 0.591 | 0.444 | |
| HE | 0.619 | 0.618 | 0.753 | 0.689 | 0.402 | 0.591 | 0.574 | 0.574 | 0.446 | |
| Cam5 | n | 43 | 29 | 28 | 15 | 37 | 38 | 10 | 22 | 19 |
| A | 11 | 15 | 20* | 13 | 9 | 7 | 4 | 7 | 7 | |
| p | 0.641 | 0.042 | 0.005 | 0.475 | 0.002 | 0.489 | 1.000 | 0.642 | 0.787 | |
| HO | 0.814 | 0.862 | 0.667 | 0.933 | 0.973 | 0.474 | 0.400 | 0.591 | 0.895 | |
| HE | 0.857 | 0.909 | 0.939 | 0.912 | 0.780 | 0.444 | 0.363 | 0.573 | 0.763 | |
| Средняя по пяти локусам |
HO ±s.d. |
0.723 0.096 | 0.601 0.253 | 0.709 0.142 | 0.796 0.260 | 0.602 0.230 | 0.526 0.119 | 0.660 0.207 | 0.608 0.148 | 0.468 0.276 |
| Средняя по пяти локусам |
HE ±s.d. |
0.786 0123 | 0.716 0.202 | 0.804 0.107 | 0.834 0.105 | 0.579 0.142 | 0.667 0.197 | 0.577 0.161 | 0.690 0.156 | 0.510 0.252 |
| Средняя по пяти локусам |
G–W ±s.d. |
0.456 0.096 | 0.455 0.109 | 0.4249 0.042 | 0.393 0.137 | 0.444 0.191 | 0.429 0.170 | 0.4077 0.209 | 0.409 0.163 | 0.445 0.132 |
Примечание. n – число исследованных экземпляров; А – число аллелей (* обозначено наличие нулевых аллелей); р – вероятность соответствия генотипических распределений равновесию Харди–Вайнберга (жирным шрифтом отмечены статистически достоверные результаты при Р < 0.05). Значения HO и HE подчеркнуты в случае, когда HO > HE при Р < 0.05. G–W-индекс – средний индекс аллельных “потерь” Garza–Williams на локус.
Рис. 2.
Число аллелей по пяти микросателлитным локусам. 1 – Bwf1, 2 – Bom22b, 3 – Cocl23, 4 – Cam1, 5 – Cam5.
G–W-индекс для всех исследованных выборок оказался существенно менее 0.70, что предполагает прохождение популяций через “бутылочное горлышко” [34].
Генетическая дифференциация и популяционная структура
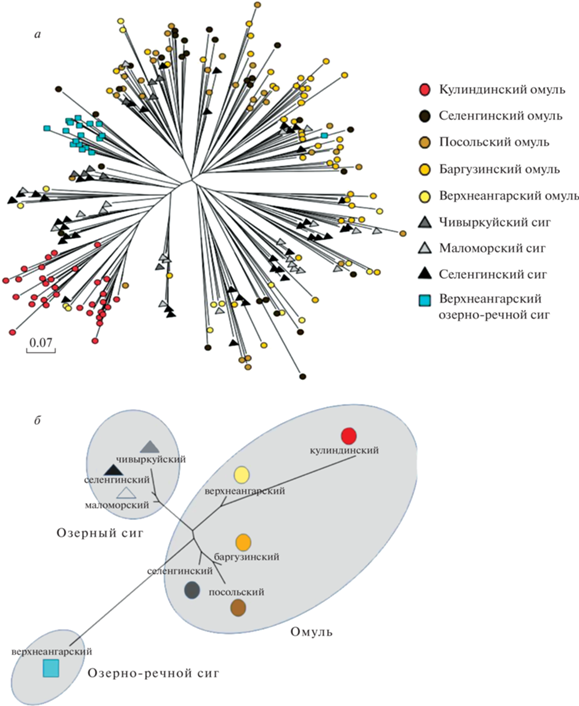
Согласно полученным значениям FST (табл. 6) все проанализированные выборки достоверно отличались друг от друга, за исключением селенгинского озерного сига, который не демонстрировал достоверных различий от двух других выборок озерных сигов (чивыркуйского и маломорского). Если руководствоваться интерпретацией значений FST, предложенной Райтом [35], очень большая дифференциация выявлена между популяциями кулиндинского омуля и верхнеангарского озерного сига (FST = 0.306), которые, в свою очередь, умеренно дифференцированы от четырех популяций омуля и трех популяций озерных сигов (FST = = 0.135–0.217). Попарные значения FST между популяциями омуля (исключая омуля оз. Кулинда) и популяциями озерного сига располагаются на предложенной шкале ниже умеренных, но выше незначительных показателей (FST = 0.062–0.127); разброс значений FST между популяциями омуля смещается в сторону незначительных показателей (FST = 0.03–0.1); различия между озерными сигами либо недостоверны, либо незначительны (FST = 0.012–0.038). Общая картина дифференциации между проанализированными выборками наглядно представлена на дереве, построенном на основе полученных попарных значений FST методом ближайших соседей (NJ) в программе MEGA7.0 (рис. 3,б). На схеме, построенной методом ближайших соседей (NJ) на основе генетических расстояний между гаплотипами Da, реализованных в программе Population (рис. 3,а) только гаплотипы популяций кулиндинского омуля и верхнеангарского озерно-речного сига, демонстрирующих очень большую дифференциацию по значениям FST, образуют хорошо идентифицируемые отдельные группы.
Таблица 6.
Оценки показателей попарной генетической дифференциации FST
| Номер выборки | Омуль | Озерный сиг | Озерно- речной сиг |
||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 1 | – | ||||||||
| 2 | 0.030 | – | |||||||
| 3 | 0.042 | 0.0362 | – | ||||||
| 4 | 0.074 | 0.100 | 0.067 | – | |||||
| 5 | 0.202 | 0.194 | 0.204 | 0.135 | – | ||||
| 6 | 0.062 | 0.087 | 0.092 | 0.093 | 0.208 | – | |||
| 7 | 0.097 | 0.104 | 0.118 | 0.127 | 0.218 | 0.027 | – | ||
| 8 | 0.071 | 0.099 | 0.081 | 0.075 | 0.202 | 0.012 | 0.038 | – | |
| 9 | 0.183 | 0.214 | 0.149 | 0.190 | 0.306 | 0.217 | 0.204 | 0.188 | – |
Рис. 3.
Деревья, построенные по данным полиморфизма пяти микросателлитных локусов. а – для особей методом ближайших соседей (NJ – Neighbor Joining) на основе генетических расстояний между гаплотипами Da [24], реализованных в программе Population v1.2.32; б – для популяций методом NJ на основе попарных значений FST [21, 22], реализованных в программе Arlequin и MEGA7.0.
Результаты обсчета данных в STRUCTURE для разного количества кластеров приведены на рис. 4, каждая вертикальная линия представляет долю участия обозначенных цветом кластеров в многолокусном генотипе особи.
Рис. 4.
Результаты обсчета данных в STRUCTURE для сиговых Байкала. K = 2 (а), 3 (б), 4 (в), 5 (г), 6 (д), 7 (е), 8 (ж), 9 (з), 10 (и) кластеров. Цифры отражают принадлежность особей к популяциям на основе мест вылова (1 – баргузинский омуль, 2 – посольский омуль, 3 – селенгинский омуль, 4 – верхнеангарский омуль, 5 – кулиндинский омуль, 6 – селенгинский сиг, 7 – чивыркуйский сиг, 8 – маломорский сиг, 9 – верхнеангарский озерно-речной сиг). Каждая вертикальная линия представляет долю участия обозначенных цветом кластеров в многолокусном генотипе особи.
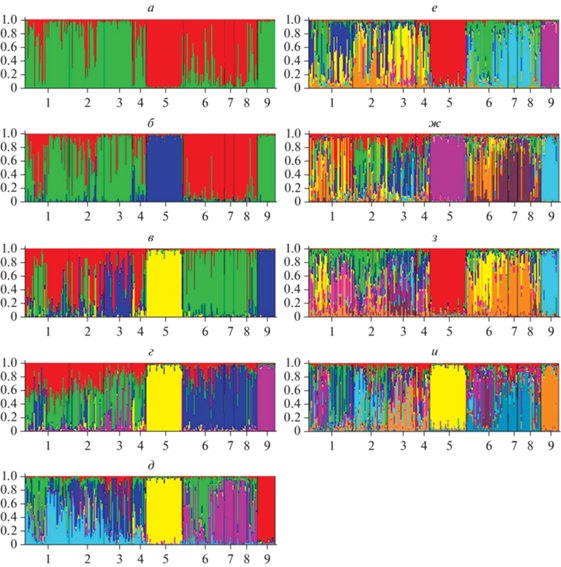
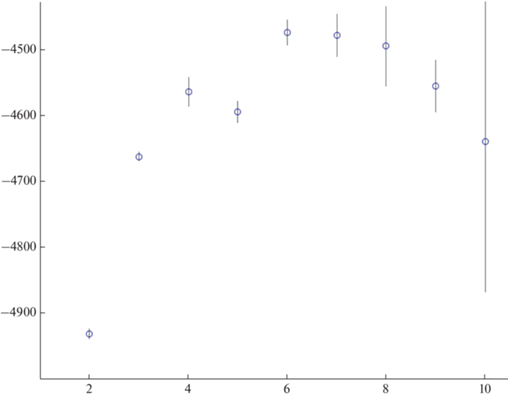
При анализе в программе STRUCTURE для определения истинного количества кластеров применяют метод, предложенный Эванно в 2005 г. [32] и реализованный сервисом STRUCTURE HARVESTER [36]. Результат применения этой программы представлен на рис. 5. Наибольшее значение ΔК соответствует разделению анализируемых выборок на 6 кластеров. В то же время ΔК для случаев с возможным разделением на 7 и 8 кластеров и их дисперсия имеют близкие вероятные значения. Данный результат хорошо согласуется со схемами, построенными на основе генетических расстояний между гаплотипами Da (рис. 3,а) и попарных значений генетической дифференциации FST между выборками (табл. 6; рис. 3,б). Так, при разделении в программе STRUCTURE анализируемых выборок на кластеры (рис. 5) в очевидные кластеры обособились только выборки верхнеангарского озерно-речного сига и кулиндинского омуля. На схеме, построенной по генетическим расстояниям между гаплотипами Da, только гаплотипы популяций кулиндинского омуля и верхнеангарского озерно-речного сига, демонстрирующих очень большую дифференциацию по значениям FST, образуют хорошо идентифицируемые отдельные группы (рис. 3,а). Вместе с тем восемь из девяти анализируемых выборок показали статистически достоверные попарные различия по FST.
ОБСУЖДЕНИЕ
Во всех проанализированных выборках присутствуют достоверные отклонения частот аллелей от равновесия Харди–Вайнберга (табл. 6): всего 22 случая, из которых в 17 наблюдался избыток гомозигот и в пяти – избыток гетерозигот. Известно, что наличие нуль-аллелей может приводить к проявлению ложной гомозиготности у гетерозиготных особей. Анализ на наличие “нулевых” аллелей (табл. 3, 5) показал, что из 17 выявленных случаев избытка гомозигот 11 может быть вызвано их присутствием. Остальные 11 случаев (6 – избыток гомозигот и 5 – избыток гетерозигот) выявлены только в выборках из популяций омуля. Гипотезу о действующем на локусы отборе в данной ситуации можно отвергнуть, если считать, что микросателлитные локусы селективно нейтральны. Возможность инбридинга в случае отклонения в сторону гомозиготности можно рассматривать только для посольского омуля, в выборке которого недостаток гетерозигот наблюдался по всем исследованным локусам, независимо от наличия или отсутствия “нулевых” аллелей. Интенсивное искусственное воспроизводство посольского омуля, начавшееся с 50-х гг. 20-го в., на сегодняшний день полностью заместило естественное [13], что и могло привести к инбридингу. В трех наиболее полиморфных популяциях омуля по отдельным локусам наблюдается как снижение гетерозиготности (баргузинской – 22b и Coc123, селенгинской – Cam1 и верхнеангарской – Cam1), так и повышение (баргузинской – Cam1, селенгинской – 22b и верхнеангарской – Cam5). Такой результат можно объяснить эффектом Валунда, когда изменениям подвержена частота гетерозигот только в тех локусах, в которых имеется вариация аллельной частоты между субпопуляциями. При эффекте Валунда частота некоторых гетерозигот понижается, другие не подвергаются воздействию или же их частота повышается [37]. Что мы и наблюдаем в указанных популяциях, для которых наличие субпопуляционной структуры хорошо описано морфо-экологическими методами [13]. Что касается небольшой и географически обособленной популяции омуля из оз. Кулинда, для нее можно было бы ожидать повышенный уровень гомозиготности за счет интенсивного дрейфа генов и инбридинга. Однако такого смещения не обнаружено. Напротив, выявлено преобладание гетерозигот в двух локусах (22b и Cam5). Если вспомнить, что оз. Кулинда расположено на пути р. Кичера, протекающей через еще одно вышерасположенное Верхнекичерское озеро, в котором обитает этот же омуль, можно предположить, что в данном случае мы наблюдаем эффект смешивания обособленных субпопуляций, который приводит к смещению частот аллелей от соотношения Харди–Вайнберга.
G–W-индекс свидетельствует о прохождении популяций через бутылочное горлышко [34]. Полученный результат согласуется с данными анализа генетического полиморфизма мтДНК. Так, П. Брзузан и соавт., основываясь на результатах рестрикционного анализа мтДНК небольшого количества особей чивыркуйской и маломорской популяций, указывают на возможное резкое уменьшение численности озерного сига во время плейстоценовых похолоданий [10]. Полученный результат согласуется также с результатами молекулярно-филогенетических реконструкций на основе последовательностей гена цитохрома b мтДНК байкальских сиговых, согласно которому дивергенция между байкальскими омулем и озерным сигом произошла в недавнем геологическом прошлом, предположительно после последнего Сартанского оледенения [38]. На схеме генетического родства между популяциями байкальских сиговых рыб, построенной на основе FST значений по данным полиморфизма пяти микросателлитных локусов, популяции омуля кластеризованы в одну группу с небольшими попарными генетическими расстояниями, что свидетельствует о недавнем времени дивергенции этих популяций (табл. 6; рис. 3,б). Популяции озерных сигов также кластеризованы в одну группу с небольшими попарными генетическими расстояниями, что также свидетельствует об их недавней дивергенции (табл. 6; рис. 3,б). Расстояния между этими группами невелики, на основании чего можно заключить, что байкальский озерный сиг и байкальский омуль, в свою очередь, тоже разделились в недавнем геологическом прошлом, что соответствует данным упомянутого выше молекулярно-филогенетического анализа [13, 38]. На большом расстоянии от этих групп находится популяция кулиндинского омуля, что подтверждает географическую изолированность этой популяции от всего комплекса сиговых Байкала. Как упоминалось выше, проникновению омуля в оз. Кулинда (бассейн Байкала) мешают непреодолимые пороги, расположенные в верховьях р. Кичеры, вытекающей из озера [13, 14]. Полностью изолированная маленькая популяция быстро накапливает различия за счет большой скорости генетического дрейфа. Промежуточное положение верхнеангарского омуля между остальными байкальскими омулями и кулиндинским омулем явно свидетельствует о наличии потока генов из оз. Кулинда в р. Верхнюю Ангару и согласуется с географией мест нереста популяций. Также на большом расстоянии находится верхнеангарский озерно-речной сиг (рис. 3,б), что согласуется с гипотезой о продолжительной аллопатрической изоляции его предковой формы за пределами озера и данными филогенетического анализа [38]. В то же время одинаковая удаленность кулиндинского омуля и верхнеангарского озерно-речного сига от омулей и озерных сигов Байкала не соответствует генетическим расстояниям, определенным на основании анализа полиморфизма мтДНК. Это очередной раз подтверждает, что с увеличением времени дивергенции генетические расстояния, определенные с помощью микросателлитов, становятся не пропорциональны времени по причине насыщения мутациями, приводящего к гомоплазии (конвергенции аллелей).
Использование иерархической кластеризации для выявления подразделенности внутри крупных кластеров широко применяется в популяционной генетике рыб, включая лососевые виды [39–41]. В целом рисунок разделения проанализированных выборок на кластеры в программе STRUCTURE (рис. 4) также подтверждает результаты молекулярно-филогенетического анализа [13, 38] и недавнее время дивергенции популяций омуля и озерного сига в присутствии потока генов. В очевидные кластеры обособились только выборки верхнеангарского озерно-речного сига и кулиндинского омуля (попарное значение FST = 0.306).
Таким образом, рисунок генетического полиморфизма, выявленный с использованием ядерных генетических маркеров (микросателлитов) путем сравнительного анализа большого количества популяций, представляющих все три вида байкальских сиговых, и сопоставление с имеющимися в литературе данными [5–13, 15, 42–44] окончательно подтверждает предположение о недавней симпатрической дивергенции байкальских омуля и озерного сига и их популяций [11]. Также полученные результаты согласуются с фактом географической изоляции предковой формы байкальского омуля в оз. Кулинда ледниково-тектонического происхождения [14]. Очевидная обособленность байкальского, нерестящегося в р. Верхняя Ангара озерно-речного сига от остальных проанализированных выборок по всем анализируемым параметрам еще раз подтверждает гипотезу об изоляции (аллопатрической дивергенции) его предка за пределами озера в некоем рефугиуме, имеющем отношение к Ангаро-Енисейскому бассейну с последующим образованием енисейской речной формы, определяемой рядом автров как C. fluviatilis, и конспецифичной ей байкальской формы, обитающей в оз. Байкал и его притоках, в которых и проходит нерест [13, 38, 45].
Работа выполнена в рамках темы Госзадания ЛИН СО РАН № 121032300154 при финансовой поддержке проекта РФФИ № 20-54-44017 Монг_а.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Bowcock A., Ruiz-Linares A., Tomfohrde J. et al. High resolution of human evolutionary trees with polymorphic microsatellites // Nature. 1994. V. 368. P. 455–457. https://doi.org/10.1038/368455a0
Jarne P., Lagoda P.J.L. Microsatellites, from molecules to populations and back // Trends Ecol. Evol. 1996. V. 11. № 10. P. 424–429. https://doi.org/10.1016/0169-5347(96)10049-5
Li Y.-C., Korol A.B., Fahima T., Nevo E. Microsatellites within genes: Structure, function, and evolution // Mol. Biol. Evol. 2004. V. 21. № 6. P. 991–1007. https://doi.org/10.1093/molbev/msh073
López-Flores I., Garrido-Ramos M.A. The repetitive DNA content of eukaryotic genomes // Genome Dynamics. 2012. V. 7. P. 1–28. https://doi.org/10.1159/000337118
Мамонтов А.М., Яхненко В.М. Биохимический полиморфизм омуля // Морфология и экология рыб: Сб. статей / Под ред. Галазия Г.И. Новосибирск, 1987. С. 14–19.
Яхненко В.М., Осинов А.Г., Мамонтов А.М. Морфологическая и популяционно-генетическая дифференциация байкальского озерного сига Coregonus lavaretus baicalensis Dybowski // Генетика. 1992. Т. 28. № 7. С. 139–150.
Мамонтов А.М., Яхненко В.М. Морфологическая и генетико-биохимическая оценка популяционной дифференциации байкальского озерно-речного сига Coregonus lavaretus pidschian (Coregonidae) // Вопр. ихтиологии. 1995. Т. 35. № 2. С. 175–181.
Mamontov A.M., Yakhnenko V.M. Ecological, morphological and iso-enzyme differentiation of coregonid populations in Lake Baikal // Arch. Hydrobiol. Spec. Issues Advanc. Limnol. 1995. № 46. P. 13–23.
Mamontov A.M., Yakhnenko V.M. Izoenzyme polymorphizm in Lake Baikal omul (Coregonus autumnalis migratorius Georgi) // Arch. Hydrobiol. Spec. Issues Advanc. Limnol. 1998. № 50. P. 375–381.
Brzuzan P., Yakhnenko V.M., Mamontov A.M. et al. Mitochondrial DNA variation in whitefish Coregonus lavaretus from Lake Baikal as revealed by restriction analysis // Arch. Hydrobiol. Spec. Issues Advanc. Limnol. 1998. № 50. C. 357–362.
Суханова Л.В., Смирнов В.В., Смирнова-Залуми Н.С. и др. Исследование популяций байкальского омуля Coregonus autumnalis migratorius методом рестрикционного анализа митохондриальной ДНК // Вопр. ихтиологии. 1996. Т. 36. № 5. С. 667–673.
Суханова Л.В., Смирнов В.В., Смирнова-Залуми Н.С., Кирильчик С.В. Новые данные по рестрикционному анализу мтДНК популяций байкальского омуля Coregonus autumnalis migratorius (Georgi) // Сиб. экол. журн. 1999. № 6. С. 655–658.
Cмирнов В.В., Смирнова-Залуми Н., Суханова Л.В. Микроэволюция байкальского омуля: Coregonus autumnalis migratorius (Georgi). Новосибирск: Изд-во СО РАН, 2009. 246 с.
Базаров Д.Д. Кайнозой Прибайкалья и Западного Забайкалья. Новосибирск: Наука, 1986. 181 с.
Смирнов В.В., Воронов М.Г., Воронов A.B. О внутривидовой структуре байкальского омуля Coregonus autumnalis migratorius (Georgi) // Вопр. ихтиологии. 1987. Т. 27. № 2. С. 342–345.
Sambrook J., Fitch E.P., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab., 1989.
Patton J.C., Gallaway B.J., Fechhelm R.G., Cronin M.A. Genetic variation of microsatellite and mitochondrial DNA markers in broad whitefish (Coregonus nasus) in the Colville and Sagavanirktok rivers in northern Alaska // Can. J. Fisheries and Aquatic Sciences. 1997. V. 54(7). P. 1548–1556. https://doi.org/10.1139/f97-062
Гайкалов И.В., Ильина О.В., Кирильчик С.В., Суханова Л.В. Описание трех микросателлитных локусов байкальского омуля Coregonus migratorius (Georgi) // Генетика. 2008. Т. 44. № 3. С. 423–426.https://doi.org/10.1134/s1068162009010117
Turgeon J., Estoup A., Bernatchez L. Species flock in the North American Great Lakes: Molecular ecology of the lake nipigon ciscoes (Teleostei: Coregonidae: Coregonus) // Evolution. 1999. V. 53. P. 1857–1871. https://doi.org/10.1111/j.1558-5646.1999.tb04568.x
Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. М.: Мир, 1984. 480 с.
van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. Micro-checker: software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538. https://doi.org/10.1111/j.1471-8286.2004.00684.x
Brookfield J.F.Y. A simple new method for estimating null allele frequency from heterozygote deficiency // Mol. Ecol. 1996. V. 5. P. 453–455. https://doi.org/10.1046/j.1365-294X.1996.00098.x
Huang K., Ritland K., Dunn D.W. et al. Estimating relatedness in the presence of null alleles // Genetics. 2016. V. 202(1). P. 247–260. https://doi.org/10.1534/genetics.114.163956
Excoffier L., Lischer H.E.L. Arlequin suite ver. 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Resources. 2010. V. 10(3). P. 564–567.https://doi.org/10.1111/j.1755-0998.2010.02847.x
Cockerham C.C. Analyses of gene frequenscies // Genetics. 1973. V. 74. P. 679–700.
Weir B., Cockerham C.C. Estimating F-statistics for the analysis of population structure // Evolution. 1984. V. 38(6). P. 1358–1370. https://doi.org/10.2307/2408641
Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis Version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 33(7). P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Nei M., Tajima F., Tateno Y. Accuracy of estimatedphylogenetic trees from molecular data // J. Mol. Evol. 1983. V. 19. P. 153–170. https://doi.org/10.1007/BF02300753
Langella O. Populations 1.2.31. 2002. http://bioinformatics.org/project/?group_id=84
Rambaut A. 2018. FigTree v.1.4.4 [accessed 25 October 2021]. http://tree.bio.ed.ac.uk/software/figtree/
STRUCTURE software (cited 2021 07). Available from: https://rosenberglab.stanford.edu/datasets.html
Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: A simulation study // Mol. Ecol. 2005. V. 14. № 8. P. 2611–2620. https://doi.org/10.1111/j.1365-294X.2005.02553.x
Wang J. The computer program STRUCTURE for assigning individuals to populations: easy to use but easier to misuse // Mol. Ecol. Resources. 2017. V. 17. I. 5. P. 2611–2620. https://doi.org/10.1111/1755-0998.12650
Garza J.C., Williamson E.G. Detection of reduction in population size using data from microsatellite loci // Mol. Ecol. 2001. V. 10(2). P. 305–318. https://doi.org/10.1046/j.1365-294x.2001.01190.x
Wright S. Evolution and the Genetics of Populations: Variability within and Among Natural Populations. Univ. Chicago Press, 1978. V. 4. 590 p.
Earl D.A., van Holdt B.M. STRUCTURE HARVESTER: A website and program for visualizing STRUCTURE output and implementing the Evanno method // Conservat. Genet. Resources. 2012. V. 4. № 2. P. 359–361. https://doi.org/10.1007/s12686-011-9548-7
Хедрик Ф. Генетика популяций. M.: Техносфера, 2003. 592 с.
Sukhanova L.V., Smirnov V.V., Smirnova-Zalumi N.S. et al. Molecular phylogeography of Lake Baikal Coregonid fishes // Advanc. Limnol. 2012. V. 63. P. 261–283. https://doi.org/10.1127/advlim/63/2012/261
Vähä J.P., Erkinaro J., Niemelä E., Primmer C.R. Life his tory and habitat features influence the within river ge netic structure of Atlantic salmon // Mol. Ecol. 2007. V. 16. P. 2638–2654. https://doi.org/10.1111/j.1365-294X.2007.03329.x
Zhivotovsky L.A., Yurchenko A.A., Nikitin V.D. et al. Eco-geographic units, population hierarchy, and a two level conservation strategy with reference to a critically en dangered salmonid, Sakhalin taimen Parahucho perryi // Conserv. Gen. 2014. V. 16. I. 2. P. 431–441. https://doi.org/10.1007/s10592-014-0670-4
Semenova A., Stroganov A., Afanasiev K., Rubtsova G. Population structure and variability of Pacific herring (Clupea pallasii) in the White Sea, Barents and Kara seas re vealed by microsatellite DNA analyses // Polar Biol. 2015. V. 38. № 7. P. 951–965. https://doi.org/10.1007/s00300-015-1653-8
Слободянюк С.Я., Кирильчик С.В., Мамонтов А.М., Скулин В.А. Сравнительный рестрикционный анализ митохондриальной ДНК байкальского Coregonus lavaretus baiсalensis и баунтовского C. lavaretus baunti озерных сигов // Вопр. ихтиологии. 1993. Т. 33. № 5. С. 631–636.
Politov D.V., Gordon N.Y., Makhrov A.A. Genetic identification and taxonomic relationships of six Siberian species of Coregonus // Arch. Hydrobiology. Spec. Issues Advanced Limnology. 2002. V. 57. P. 21–34.
Politov D.V., Bickham J.W., Patton J.C. Molecular phylogeography of Palearctic and Nearctic ciscoes // Annales Zool. Fennici. 2004. V. 41. № 1. P. 13–23.
Бочкарёв Н.А., Зуйкова Е.И., Политов Д.В. Таксономический статус и происхождение некоторых экологических форм сигов вида Coregonus lavaretus (L.) из водоемов Сибири // Генетика. 2017. Т. 53. № 8. С. 922–932.
Дополнительные материалы отсутствуют.