Генетика, 2022, T. 58, № 11, стр. 1292-1310
Морфологическая, экологическая и генетическая изменчивость сигов Coregonus lavaretus sensu lato из верхнего и среднего течения р. Лены
Н. А. Бочкарев 1, *, Д. С. Сендек 2, А. В. Катохин 3, Е. И. Зуйкова 1, А. Н. Матвеев 4, Л. А. Пестрякова 5, Е. С. Захаров 5, В. П. Самусёнок 4, А. Л. Юрьев 4, Д. В. Политов 6
1 Институт систематики и экологии животных Сибирского отделения
Российской академии наук
630091 Новосибирск, Россия
2 Государственный научно-исследовательский институт Озерного и речного рыбного хозяйства
199053 Санкт-Петербург, Россия
3 Федеральный исследовательский центр, Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
4 Иркутский государственный университет
664003 Иркутск, Россия
5 Северо-Восточный федеральный университет
677980 Якутск, Россия
6 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: nikson_1960@mail.ru
Поступила в редакцию 31.05.2022
После доработки 28.06.2022
Принята к публикации 29.06.2022
- EDN: OJSVJJ
- DOI: 10.31857/S0016675822110030
Аннотация
Представлены результаты морфогенетического анализа популяций сигов среднего течения р. Лена и симпатрических форм/видов сигов Баунтовской системы озер. Установлено, что в озерах обитают до восьми форм/видов сигов с относительно высокой степенью дифференциации. В озерах Доронг, Баунт и Б. Капылюши обитают близкие по числу жаберных тычинок, но различные по числу прободенных чешуй в боковой линии симпатрические сиги. В оз. Баунт, кроме того, обитает эндемичный ряпушковидный многотычинковый сиг. Анализ изменчивости гена ND1 мтДНК различных форм с привлечением популяций сига из среднего течения р. Лены показал, что гаплотипы сигов Баунтовской системы озер сильно перемешаны и в своей основе имеют несколько хорошо выраженных филогенетических линий. Ряпушковидный сиг имеет более древнее происхождение по сравнению с другими видами пыжьяновидных сигов р. Coregonus.
Сиговые рыбы (Teleostei: Salmoniformes: Salmonidae: Coregoninae) известны как одна из наиболее эволюционно пластичных и сложных в филогенетическом и филогеографическом отношениях групп. Среди сиговых Палеарктики наиболее широко распространены и полиморфны “настоящие” сиги комплекса Coregonus lavaretus sensu lato. Ранее обычно представлявшиеся в ранге внутривидовых форм [1–3], в современную эпоху как аллопатрические, так и симпатрические популяции все чаще выделяются в отдельные виды. Так, в последней сводке по пресноводным рыбам Европы приводится список из 58 видов сигов этого видового комплекса [4]. В отечественной систематике значительная часть этих видов признается [5], но чаще рассматривается в качестве подвидов, экологических форм, рас или “племен”. Так, в некоторых крупных водоемах севера европейской части России выделялось до десяти симпатричных внутривидовых форм сигов [1, 2]. Считается, что поддержание морфоэкологического разнообразия сигов комплекса lavaretus определяется специализацией популяций к разным спектрам питания, дифференциацией по числу жаберных тычинок, скорости роста и миграционного поведения. В водоемах ледовитоморского побережья Евразии малотычинковые формы сига традиционно называются пыжьяном, который был описан из бассейна р. Обь И.Г. Гмелиным как отдельный вид Salmo (Coregonus) pidschian (Gmelin, 1789). В более общей форме для восточно-европейских и сибирских популяций применяется термин “пыжьяновидные сиги”. Статус пыжьяна по разным авторам варьирует от видового [5] до подвидового C. lavaretus pidschian (Gmelin, 1789) [1–3, 6]. В водоемах Сибири сиг-пыжьян представлен множеством аллопатрических и симпатрических речных, озерно-речных и озерных форм самой различной степени экологической и морфологической дифференциации [1, 5, 7]. Особенно выделяются морфоэкологическим разнообразием водоемы среднего и верхнего течения крупных сибирских рек – Оби [8, 9], Енисея [1, 7, 10] и Лены [7, 11–13]. Ленский сиг остается наименее изученным, хотя он чрезвычайно интересен для изучения филогенетических взаимоотношений сигов и филогеографических связей. Помимо всего эти формы/виды сигов в прошлом, вероятно, имели связь с крупнейшей древней озерной системой кайнозоя – палеобайкалом, а в настоящее время – с образовавшимися в результате орографических трансформаций водоемов Байкальской рифтовой зоны (БРЗ). Наличие в регионе крупных, существующих непрерывно значительное время (в геологическом понимании), озерно-речных систем заставляет предполагать в этом регионе наличие плейстоценовых рефугиумов.
В последние десятилетия прогресс в изучении статуса и эволюционных взаимоотношений сигов связан c применением молекулярно-генетических маркеров. Анализ паттернов морфологической изменчивости сигов, особенно связанной с быстро эволюирующими трофическими и двигательными характеристиками, показал, что за фенотипической дифференциацией может стоять выраженная генетическая [14–22], но может наблюдаться и обратная картина – практическое отсутствие различий в частотах генов и эпигенетические особенности, обусловленные дифференциальной экспрессией регуляторных генов [23]. Из симпатрических речных форм Сибири изучены малотычинковые сиги из бассейна р. Енисей, известные под названиями сиг Исаченко, или енисейский речной (горбоносый) сиг С. fluviatilis Issatchenko и восточносибирский сиг C. lavaretus pidschian natio brachymystax Smitt. Эти сиги хорошо различаются как по морфологическим признакам [1, 24, 25], так и по митохондриальной ДНК [26]. Между парой симпатрических сигов из р. Анадырь – горбуном (пыжьян) C. (l.) pidschian и востряком (C. anaulorum Kaganowsky in Berg) также наблюдаются существенные различия по морфологическим признакам [6, 27, 28] и наличие нескольких хорошо дифференцированных линий мтДНК [29, 30]. Симпатрические сиги из р. Амур C. chadary и C. ussuriensis хорошо дифференцированы по меристическим признакам, однако по мтДНК различия между ними менее значительны [29, 30]. К симпатрическим сигам из низовьев рек Сибирской Арктики относятся вышеупомянутый восточносибирский, а также и ледниково-равнинный сиг C. lavaretus pidschian n. glacialis Kirillov, которые сильно дифференцированы генетически [30–32].
В водоемах Евразии симпатрических пар или “букетов” озерных сигов намного больше, чем речных. Многие симпатрические сиги населяют озера Альп [33, 34] и Фенноскандии [2, 35–37], однако существенной генетической дифференциации между формами европейских сигов не обнаружено, даже для тех, для которых признан видовой статус [38, 39].
В Сибири озерных форм сигов, обитающих симпатрично и различающихся по темпу роста, структуре питания, положению рта и числу жаберных тычинок, гораздо меньше. Например, в оз. Байкал описаны близкие к комплексу lavaretus (а не к арктическому омулю C. autumnalis) байкальский омуль C. migratorius и его близкий родственник озерный сиг C. baicalensis, а также байкальский озерно-речной сиг (так же известный как С. fluviatilis) [18, 19, 40, 41]. Симпатрические сиги обитают в Телецком озере (бассейн верхнего течения р. Обь) [8], в озерах Тоджинской котловины (верхнее течение р. Енисей) и в оз. Орон (бассейн р. Витим) [7, 11, 42]. Наибольшим разнообразием сигов характеризуется Баунтовская система озер бассейна р. Витим (озера Доронг, Большие и Малые Капылюши, Баунт), где насчитывают до восьми форм/видов сигов [7, 12, 43, 44]. В оз. Баунт можно выделить следующие формы/виды: 1) ряпушковидный среднечешуйчатый сиг из оз. Баунт (в некоторых источниках баунтовская ряпушка C. sardinella baunti) [45] – в Аннотированном каталоге (1998 г.) эта форма/вид включена в состав сибирской ряпушки в качестве подвида C. sardinella; 2) среднечешуйчатый малотычинковый сиг из оз. Баунт, внешне почти не отличимый от сигов из р. Витим; 3) малотычинковый и многочешуйчатый пыжьяновидный сиг из оз. Баунт, по морфологическим признакам идентичный малотычинковому сигу из оз. Капылюши, которого было предложено выделить в отдельный вид Coregonus skrjabini [12]; 4) среднетычинковый и среднечешуйчатый сиг обнаружен в оз. Баунт относительно недавно [16]; 5) малотычинковый и среднечешуйчатый пыжьяновидный сиг из оз. Доронг; 6) мелкий среднетычинковый и среднечешуйчатый сиг из оз. Доронг; 7) среднетычинковый и многочешуйчатый сиг из озер Большие и Малые Капылюши, который имеет общепризнанный видовой/подвидовой статус – баунтовский сиг (C. baunti, Muchomediarov или C. lavaretus baunti); 8) малотычинковый и многочешуйчатый сиг из оз. Б. Капылюши, обозначаемый в литературе как сиг-пыжьян. В оз. Орон были обнаружены симпатрические сиги, близкие по форме тела и меристическим признакам к сигам из озер Доронг и Баунт. Главное их отличие от сигов из оз. Баунт наблюдается по несколько меньшему числу прободенных чешуй в боковой линии. В результате исследований были описаны одна малотычинковая и две среднетычинковые формы/вида. При этом среднетычинковым сигам Ю.Е. Калашников предложил присвоить собственные названия C. l. baunti и C. l. oronensis [11]. Малотычинковый и малочешуйчатый сиг был отнесен к C. l. pidschian. Однако детальной таксономической ревизии этих форм/видов не проводилось. Очевидно, что эти формы/виды тесно связаны с сигами из Баунтовских озер.
Анализ фрагмента мтДНК ND-1 не выявил между формами/видами сигов из озер Доронг и Баунт существенных различий. По-видимому, исследованные группировки представляют собой результат гибридизации нескольких филогенетических линий сигов, и при этом их гаплотипы перемешаны как между формами/видами, так и между водоемами. В то же время анализ мтДНК и аллозимов “баунтовской ряпушки” из оз. Баунт показал, что она относится не к ряпушкам, а к древней филогенетической линии, близкой к группе пыжьяновидных сигов байкальского происхождения [16, 30, 46].
На происхождение форм/видов сигов из Баунтовской системы озер существует несколько альтернативных точек зрения. Согласно первой, все эти формы/виды сформировались в тех озерах, где они обитают в настоящее время. Считается, что причинами их формирования являются уникальные геологические и экологические условия региона, в частности наличие термальных источников, которые повышают среднегодовые температуры в оз. Баунт [7, 12, 42]. Г.Л. Карасев [12] полагал, что весенненерестующие сиги являются наиболее древними. Согласно другой точке зрения, бóльшая часть форм/видов сигов из Баунтовской системы озер могла сформироваться в результате постледникового расселения и гибридизации [47]. И, наконец, Ю.С. Решетников полагает, что среднетычинковые формы сигов из Баунтовской системы озер (за исключением C. l. baunti) являются производными сига Палласа (C. l. pallasi), а ряпушковидный сиг является озерной формой сибирской ряпушки (C. sardinella) [3].
Цель работы – анализ филогенетических и филогеографических связей между современными симпатрическими формами/видами сигов из Баунтовской системы озер и верхнего течения р. Лена. На основании морфологического и генетического анализа предложена гипотеза их происхождения.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика района работ
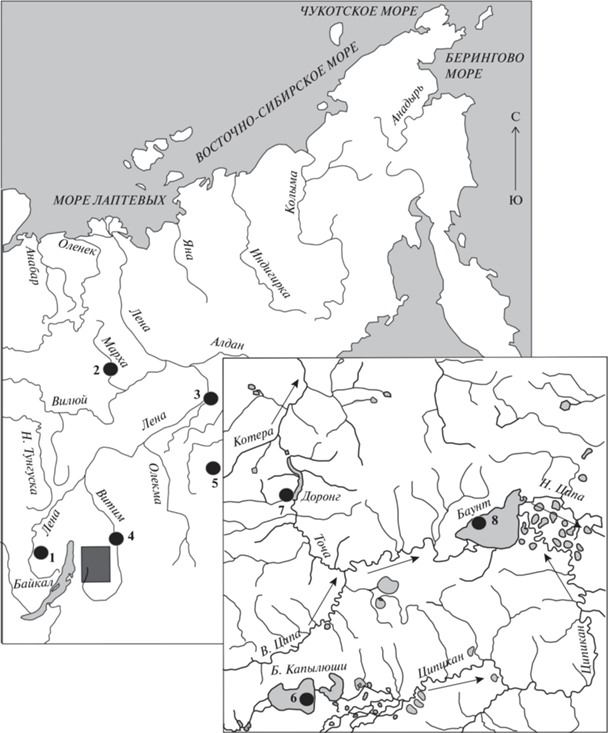
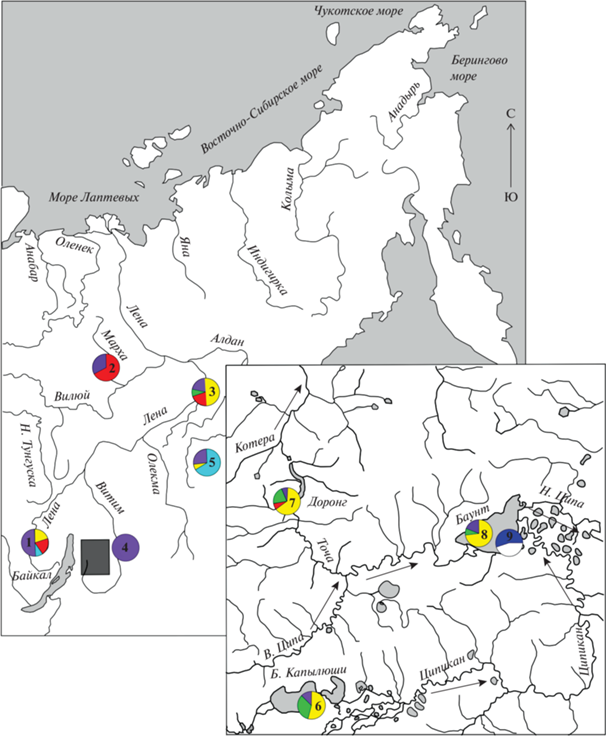
В работе были использованы выборки сигов комплекса C. lavaretus sensu lato: из бассейна р. Лены (верхняя Лена) (59°39′ с.ш., 112°55′ в.д.), р. Марха, бассейна р. Вилюй (левый приток Лены) (65°06′ с.ш., 116°42′ в.д.), из устья р. Буотама (61°14′ с.ш., 128°34′ в.д.) – правого притока среднего течения р. Лены (рис. 1). В группировку сигов из р. Витим были включены выборки из самой р. Витим и оз. Орон (Орон Витимский) (57°07′ с.ш., 116°32′ в.д.), а также ряд форм/видов сигов из Баунтовской (Ципо-Ципиканской) системы озер (рис. 1, врезка), которая расположена в северо-западной части Витимского нагорья Байкальской рифтовой зоны; оз. Б. Токо бассейна р. Алдан, правого притока р. Лена (56°02′ с.ш., 130°52′ в.д.). Озеро Доронг (55°17′ с.ш., 112°16′ в.д.) представляет собой узкий вытянутый водоем с крутыми берегами, связанный с оз. Баунт реками Точа и В. Ципа. Озеро Доронг находится на водоразделе бассейнов оз. Байкал и р. Витим на высоте 1107 м. Озеро Б. Капылюши (54°47′ с.ш., 112°10′ в.д.) расположено у подножья горы Бурпала (1588 м) на высоте 1175 м над уровнем моря. Через протоку длиной около 600 м оз. Б. Капылюши соединяется с оз. М. Капылюши; берега озер пологие, с хорошо выраженными песчано-галечными пляжами. Озеро М. Капылюши связано с оз. Баунт через извилистую протоку с заморными Окуневыми озерами, и р. Ципикан, которая характеризуется обилием порогов и перекатов. Наиболее крупное озеро Баунт (55°27′ с.ш., 113°14′ в.д.) лежит у подножья вулкана Большой Хаптон и связано с Витимом р. Н. Ципа.
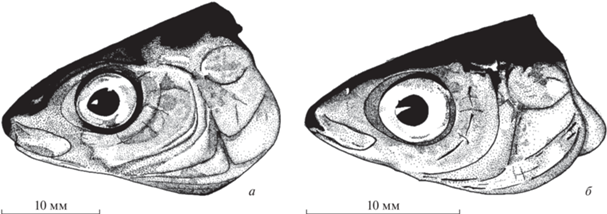
Ихтиофауна
В реках Лена, Вилюй и Алдан обитают обычные для этих мест виды рыб, в том числе и восточносибирский сиг-пыжьян [13, 48]. Видовой состав рыб из Баунтовских озер относительно беден. Помимо сиговых рыб в этой системе озер обитают: в оз. Доронг ‒ байкало-ленский хариус Thymallus baicalolenensis Matveev, Samusenok, Pronin et Tel’pukhovsky, острорылый ленок Brachymystax lenok (Pallas, 1773), щука Esox lucius Linnaeus, 1758, окунь Perca fluviatilis Linnaeus, 1758, ерш Gymnocephalus cernuus (Linnaeus, 1758), елец Leuciscus leuciscus (Linnaeus, 1758), речной гольян Phoxinus phoxinus (Linnaeus, 1758) и налим Lota lota (Linnaeus, 1758). Наиболее многочисленны в озере малотычинковые и среднетычинковые среднечешуйчатые сиги. В озерах Большие и Малые Капылюши отмечены те же самые виды, что и в оз. Доронг, а также плотва Rutilus rutilus (Linnaeus, 1758), но отсутствуют ленок и хариус. Здесь наиболее многочисленны много- и среднетычинковые многочешуйчатые симпатрические сиги, которые помимо числа тычинок, различаются формой головы (рис. 1). В озере Баунт обитают таймень Hucho taimen (Pallas, 1773), щука, плотва, язь Leuciscus idus (Linnaeus, 1758), елец, речной гольян, окунь, ерш, налим. Иногда встречается осетр Acipenser baeri, Brandt, 1869. В пойме обитает серебряный карась Carassius auratus gibelio (Bloch, 1782). Наиболее многочисленным видом в озере является баунтовский ряпушковидный сиг.
Сбор материала и морфологический анализ
Лов различных форм/видов сигов в реках и озерах проводили в летний период. В озерах Баунт и Доронг лов проводили в 2009 и 2010 г. сетями с ячеей от 18 до 35 мм. В оз. Б. Капылюши сигов ловили в середине августа 2011 г. сетями с ячеей от 12 до 40 мм на глубинах от 2 до 20 м. В р. Марха, верхнем течении Лены и в устье р. Буотама для сборов материала применяли закидной “тугунковый” невод. В оз. Б. Токо применяли жаберные сети с ячеей 22–40 см. В данной статье мы использовали 12 выборок, принадлежащих к различным формам/видам сигов из восьми различных водоемов бассейна р. Лена (табл. 1, рис. 2).
Таблица 1.
Места сбора и объем исследованного материала
| № | Форма/вид | Водоем | N | ND1(n) |
|---|---|---|---|---|
| 1 | Восточносибирский сиг | Р. Лена, верхн. течение | 15 | 10 |
| 2 | Восточносибирский сиг | Р. Марха | 18 | 9 |
| 3 | Восточносибирский сиг | Р. Буотама, устье | 26 | 10 |
| 4 | Восточносибирский сиг | Р. Витим | 25 | 5 |
| 5 | Восточносибирский сиг | Оз. Б. Токо | 12 | 11 |
| 6 | Coregonus baunti | Оз. Б. Капылюши | 44 | 11 |
| 7 | Малотычинковый сиг | Оз. Б. Капылюши | 45 | 11 |
| 8 | Малотычинковый сиг | Оз. Доронг | 67 | 11 |
| 9 | Среднетычинковый сиг | Оз. Доронг | 12 | 10 |
| 10 | Ряпушковидный сиг | Оз. Баунт | 26 | 6 |
| 11 | Пыжьяновидный сиг | Оз. Баунт | 59 | 4 |
| 12 | Среднетычинковый сиг | Оз. Баунт | 9 | 3 |
Рис. 2.
Карта-схема Баунтовской системы озер. Места лова рыб. 1 – В. Лена, 2 – р. Марха, 3 – р. Бутама, 4 – оз. Б. Токо, 5 – р. Витим, 6 – оз. Б. Капылюши (две выборки), 7 – оз. Доронг (две выборки), 8 – оз. Баунт (три выборки). Стрелками показано направление течения рек.
Для сбора морфологических данных сразу после лова рыбу с расправленными плавниками выкладывали на пенополиуретановый коврик и фотографировали с помощью цифрового фотоаппарата Nikon D500. Взвешивание особей, подсчет прободенных чешуй в боковой линии и жаберных тычинок проводили одновременно с фотографированием. Измерение рыб проводили по фотографиям в лаборатории с помощью программы AxioVision 3.1 [49, 50]. Чтобы устранить размерную изменчивость, значение каждого признака делили на среднее геометрическое всех промеров [51, 52]. Полученное значение логарифмировали. Для визуальной оценки различий был построен график распределения особей.
Меристические данные проверили на нормальность. Поскольку в соответствии с F-критерием Левена дисперсии были примерно одинаковы (p > 0.05), то для сравнения средних использовали однофакторный дисперсионный анализ вместе с апостериорным критерием Тьюки HSD для неравных по размеру выборок. Оценку достоверности между выборками по пластическим признакам проводили с помощью многомерного дисперсионного анализа MANOVA. Для статистической обработки использовали статистический пакет PAST [53].
Анализ мтДНК
Геномную ДНК выделяли фенольно-хлороформным методом из фиксированной 96% этанолом печени сигов. Нами проведен анализ изменчивости фрагмента гена митохондриальной ДНК (мтДНК), включающий гены 16S-RNA-tRNA-Leu-ND1-tRNA-Ile-tRNA-Gln, амплифицированного в полимеразной цепной реакции (ПЦР) с использованием внешних праймеров LGL381 и LGL563 и трех пар внутренних праймеров [26, 40, 54]. Продукты ПЦР очищали с помощью набора реактивов “БИОСИЛИКА” (Новосибирск, Россия) и секвенировали по Сэнгеру по прямому и обратному праймерам с использованием BigDye Terminator v3.1 (Applied Biosystems) на ДНК-анализаторе ABI 3130xl Genetic Analyzer (Applied Biosystems, Inc., США) в ЦКП “Геномика” СО РАН (Новосибирск, Россия, http://sequest.niboch.nsc.ru). Нуклеотидные последовательности выравнивали с помощью алгоритма ClustalW и редактировали вручную. Оригинальные нуклеотидные последовательности депонировали в международную базу данных GenBank (табл. 2). Для анализа генетического полиморфизма вычисляли: число полиморфных (сегрегирующих) сайтов (S), число гаплотипов (h), гаплотипическое разнообразие (Hd), нуклеотидное разнообразие (π), среднее число нуклеотидных различий (k). Расчеты выполнялись в программе DnaSP v.5.10 [55]. Для оценки степени межпопуляцонной дифференциации в программе ARLEQUIN v.3.5 [56] были рассчитаны парные значения FST при 10 000 репликаций. Для оценки нейтральности эволюции были использованы тесты Таджимы (Tajima’s D) и Фу (Fu’s FS) [57, 58]. Статистическая значимость результатов была вычислена при 10 000 репликаций. Для выявления демографических параметров были построены гистограммы распределения попарных различий (mismatch distributions, MMD) [59]. Для анализа гипотезы популяционной экспансии оценивали среднестатистическое отклонение (SSD) и индекс Харпендинга (r) [60]. Для оценки генеалогических связей между гаплотипами предполагаемых форм/видов сигов построили медианную сеть в программе Network v.4.5 с помощью алгоритма медианного связывания (median-joining) [61].
Таблица 2.
Характеристика исследованных форм/видов сигов по меристическим признакам. Номера гаплотипов в NCBI
| №1 | sp.br. | l.l. | Номер доступа последовательностей в GenBank |
|---|---|---|---|
| 1 | 21.3 ± 0.76 | 80.20 ± 0.78 | KM013418–KM013424, MT862526, MT862535 |
| 2 | 20.13 ± 0.46 | 81.26 ± 0.52 | KM013405–KM013409, MT862525 |
| 3 | 19.39 ± 0.37 | 80.88 ± 0.85 | MT862527–MT862533 |
| 4 | 21.80 ± 0.44 | 81.12 ± 0.60 | OK018185–OK018189* |
| 5 | 21.08 ± 0.72 | 81.06 ± 0.63 | KM013410–KM013417, MT862534 |
| 6 | 35.52 ± 0.29 | 93.39 ± 0.46 | KC339252–KC339263* |
| 7 | 22.83 ± 0.23 | 94.32 ± 0.48 | KC339264–KC339274* |
| 8 | 22.04 ± 0.27 | 84.46 ± 0.65 | JN629005, JN629006, MW741833–MW741836 |
| 9 | 32.58 ± 0.72 | 84.00 ± 0.86 | JN629010–JN629013, MW741829–MW741832 |
| 10 | 43.22 ± 0.44 | 82.87 ± 0.34 | JN629014–JN629024 |
| 11 | 22.13 ± 0.21 | 85.07 ± 0.38 | JN629001– JN629004 |
| 12 | 33.33 ± 0.67 | 83.33 ± 0.97 | JN629007–JN629009 |
Примечание. Номера популяций соответствуют приведенным в табл. 1. sp.br. – число жаберных тычинок на первой дуге (X ± m). l.l. – число прободенных чешуй в боковой линии (X ± m). Звездочками обозначены сиквенсы, сделанные для настоящей работы.
РЕЗУЛЬТАТЫ
Морфология
Все популяции/формы/виды сигов из бассейна р. Лена (ее верхнего и среднего течения) по количеству прободенных чешуй в боковой линии (l.l.) делятся на малочешуйчатые, среднечешуйчатые и многочешуйчатые. Число чешуй варьирует от 76 до 83 у малочешуйчатых, от 83 до 86 у среднечешуйчатых и от 86 до 102 у многочешуйчатых сигов. К малочешуйчатым популяциям/формам/видам сигов относятся все речные сиги бассейна р. Лена, сиги из оз. Б. Токо. Симпатрические сиги из озер Доронг и Баунт можно отнести к среднечешуйчатым сигам. К многочешуйчатым сигам относятся только симпатрические сиги из оз. Б. Капылюши (рис. 3). По числу прободенных чешуй в боковой линии речные сиги и сиги оз. Б. Токо не различаются друг от друга. При сравнении речных популяций сига с выборками многочешуйчатых сигов из оз. Б. Капылюши и выборками сигов из озер Доронг и Баунт почти во всех случаях обнаруживались достоверные различия.
Рис. 3.
Распределение числа жаберных тычинок и прободенных чешуй в боковой линии у симпатрических сигов оз. Б. Капылюши. 1 ‒ малотычинковый сиг, 2 ‒ среднетычинковый сиг оз. Б. Капылюши (C. baunti).
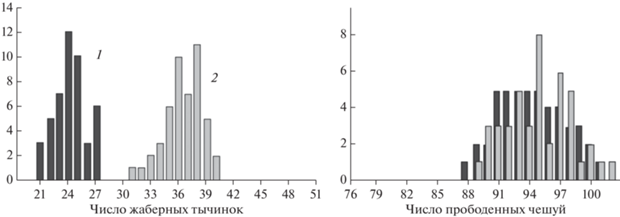
По числу жаберных тычинок (sp.br.) сиги из исследованного региона подразделялись на малотычинковых (sp.br. 18–27) и среднетычинковых (sp.br. 27–35), ряпушковидного баунтовского сига, можно отнести к многотычинковым сигам (рис. 3). По количеству жаберных тычинок речные малотычинковые сиги бассейна р. Лена и малотычинковые сиги из всех озер отличаются друг от друга незначительно, но достоверно отличаются от всех среднетычинковых сигов и баунтовского ряпушковидного сига. Среднетычинковые сиги из озер Доронг, Баунт и Б. Капылюши по числу жаберных тычинок хоть и принадлежат к одной группе, но среднетычинковые сиги из оз. Б. Капылюши и оз. Доронг достоверно различаются друг от друга (табл. 3).
Таблица 3.
Попарное сравнение исследованных популяций сига-пыжьяна числа прободенных чешуй в боковой линии (выше диагонали) и жаберных тычинок (ниже диагонали) по средневзвешенному критерию Тьюки
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | – | 1.000 | 1.000 | 0.999 | 0.999 | 0.000 | 0.000 | 0.001 | 0.006 | 0.222 | 0.000 | 0.065 |
| 2 | 0.186 | – | 1.000 | 1.000 | 1.000 | 0.000 | 0.000 | 0.015 | 0.069 | 0.688 | 0.001 | 0.351 |
| 3 | 0.126 | 1.000 | – | 1.000 | 1.000 | 0.000 | 0.000 | 0.019 | 0.085 | 0.737 | 0.002 | 0.399 |
| 4 | 1.000 | 0.023 | 0.013 | – | 1.000 | 0.000 | 0.000 | 0.034 | 0.132 | 0.833 | 0.004 | 0.514 |
| 5 | 1.000 | 0.258 | 0.181 | 0.999 | – | 0.000 | 0.000 | 0.028 | 0.115 | 0.803 | 0.003 | 0.475 |
| 6 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | – | 0.999 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 7 | 0.529 | 0.000 | 0.000 | 0.941 | 0.424 | 0.000 | – | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 8 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | – | 1.000 | 0.902 | 1.000 | 0.993 |
| 9 | 0.996 | 0.006 | 0.003 | 1.000 | 0.987 | 0.000 | 0.992 | 0.000 | – | 0.992 | 0.995 | 1.000 |
| 10 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | – | 0.523 | 1.000 |
| 11 | 0.956 | 0.001 | 0.001 | 1.000 | 0.915 | 0.000 | 1.000 | 0.000 | 1.000 | 0.000 | – | 0.839 |
| 12 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.064 | 0.000 | 0.000 | 0.000 | 0.387 | 0.000 | – |
Дендрограмма сходства по пластическим признакам показывает структурированность выборок в виде двух кластеров (I и II). В кластер I вошли C. baunti из оз. Б. Капылюши и баунтовский ряпушковидный сиг (табл. 1). Кластер II состоит из двух ветвей (a) и (б). Ветвь (a) включает в себя среднечешуйчатых сигов из озер Баунт и Доронг и малотычинкового сига из оз. Б. Капылюши (рис. 4). Ветвь (б) включает в себя выборки малотычинковых сигов из оз. Доронг и Баунт и всех малотычинковых сигов из бассейнов рек Лена и Витим (табл. 1). Многомерный дисперсионный анализ (MANOVA) по пластическим признакам показал, что выборки хорошо дифференцированы (Wilk’s Λ = 0.0004378, F = 10.04 d.f.1 = 352, d.f.2 = = 3213) и достоверно отличаются друг от друга (р < 0.001) (табл. 4). Попарное сравнение показало, что ряпушковидный сиг достоверно отличается от остальных сигов. Среднетычинковые сиги отличаются почти от всех малотычинковых сигов, симпатричных с ними. Малотычинковые речные сиги разных популяций слабо дифференцированы друг от друга, но, как правило, отличаются от соответствующих симпатрических с ними озерных сигов.
Рис. 4.
UPGMA-дендрограмма популяций сигов верхнего и среднего бассейна р. Лена по пластическим признакам (обозначения как в табл. 1).

Таблица 4.
Попарное сравнение выборок (MANOVA) по пластическим признакам (значения p)
| № | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.9230 | – | 0.9652 | – | 0.0000 | 0.0001 | 0.8082 | – | 0.0000 | 0.0000 | – |
| 2 | 0.9846 | 0.1770 | 0.4325 | 0.0000 | 0.0000 | 0.0405 | 0.2702 | 0.0000 | 0.0000 | 0.8069 | |
| 3 | 0.9550 | – | 0.0000 | 0.0000 | 0.9134 | – | 0.0000 | 0.0018 | – | ||
| 4 | 0.3426 | 0.0000 | 0.0000 | 0.0059 | 0.2964 | 0.0000 | 0.0000 | 0.8979 | |||
| 5 | 0.0000 | 0.0001 | 0.2809 | – | 0.0000 | 0.0000 | – | ||||
| 6 | 0.0000 | 0.0000 | 0.0094 | 0.0000 | 0.0000 | 0.0027 | |||||
| 7 | 0.0000 | 0.0056 | 0.0000 | 0.0000 | 0.0207 | ||||||
| 8 | 0.5101 | 0.0000 | 0.0471 | 0.9619 | |||||||
| 9 | 0.0000 | 0.0000 | – | ||||||||
| 10 | 0.0000 | 0.000 | |||||||||
| 11 | 0.036 |
Митохондриальная ДНК
Наибольший вклад в изменчивость фрагмента 16S-RNA-tRNA-Leu-ND1-tRNA-Ile-tRNA-Gln мтДНК вносит изменчивость белок-кодирующего гена ND1, остальные участки более консервативны. Все рассматриваемые популяции сигов из бассейна р. Лена характеризуются высокими показателями генетического полиморфизма ND1. Максимальные значения обнаружены у ряпушковидного сига. У C. baunti из оз. Б. Капылюши зарегистрированы одни из самых низких показателей генетического полиморфизма.
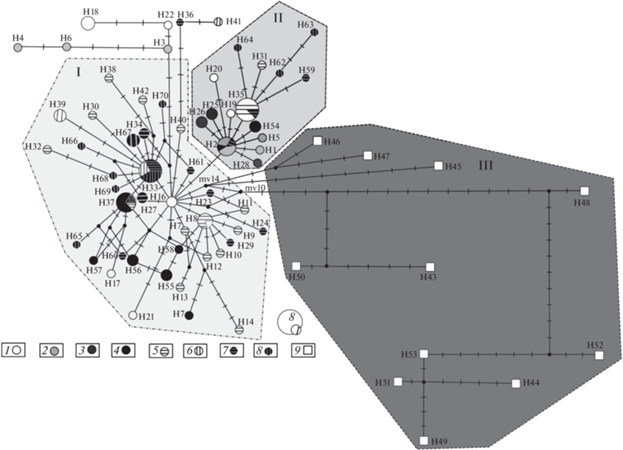
Реконструкция генеалогических взаимоотношений между популяциями сигов из водоемов Баунтовской системы озер, верхнего и среднего течения р. Лена выявила три основные гаплогруппы (рис. 5). В гаплогруппу I вошла часть гаплотипов симпатрических сигов из озер Б. Капылюши и Баунт, часть гаплотипов малотычинкового сига из верхнего течения р. Лена, устья р. Буотама, р. Витим и все гаплотипы сигов из оз. Б. Токо. Вторая гаплогруппа удалена от первой на два мутационных шага и включает в себя остальные гаплотипы вышеперечисленных группировок. Гаплогруппа III сформирована гаплотипами ряпушковидного сига. Группа гаплотипов (H3, H4, H6, H7, H13, H14, H18, H21, H22, H29, H33, H34) из популяций сигов из рек Марха, Витим и верхнего течения р. Лена удалена от трех выделенных гаплогрупп и по структуре представляет собой цепь. В составе гаплогрупп I и II отмечено несколько звездообразных структур (с центральными гаплотипами Н2, H8, H16, H33, H35). Звездообразные структуры первой гаплогруппы связаны между собой множеством альтернативных связей разной длины, которые означают, как правило, вероятность обратных или параллельных мутаций. Каждая структура характеризуется наличием множества минорных гаплотипов, удаленных от центрального на один–три мутационных шага. В центре гаплогруппы I расположен гаплотип H16, обнаруженный в популяции сигов из р. Лена. Вторая гаплогруппа имеет более простое строение и состоит из двух звездообразных структур с множеством минорных гаплотипов, удаленных от центрального на один-два мутационных шага. Третья гаплогруппа включает в себя сеть гаплотипов ряпушковидного сига из оз. Баунт. Оригинальная часть гаплогруппы III связана с гаплогруппой I через восемь мутационных шагов и двух гипотетических гаплотипов (рис. 5). Дистантная часть гаплогруппы III связана с гаплогруппой I через общий гипотетический гаплотип.
Рис. 5.
Медианные сети гаплотипов (16S RNA-tRNA-Leu-NADH1-tRNA-Ile-tRNA-Gln мтДНК) сигов верхнего и среднего течения р. Лена. Размер узла пропорционален частоте встречаемости гаплотипа. I–III – гаплогруппы. Выборки как в табл. 1. 9 – ряпушковидный сиг.
По распределению основных гаплотипов в бассейне средней и верхней Лены видно, что гаплотипы сигов сильно перемешаны (рис. 6). Только гаплотипы сильно дивергировавшего ряпушковидного сига отмечены в единственном водоеме – озере Баунт.
Рис. 6.
Географическое распределение гаплотипов сигов в бассейне верхнего и среднего течения р. Лены. Выборки как в табл. 1. 9 – распределение гаплотипов ряпушковидного сига.
Для анализа молекулярной дисперсии (AMOVA) были сформированы группы согласно географическому распределению и формам/видам (табл. 5), а также по экологическим характеристикам (малотычинковых и среднетычинковых) сигов из разных озер. Ряпушковидный сиг, как генетически удаленный, в этот анализ не включен. При проведении анализа по 11 выборкам было показано, что внутригрупповая изменчивость преобладает во всех сравнениях – 70.97–72.73% (табл. 5). Внутригрупповая генетическая дифференциация для экологической модели показала относительно высокую долю изменчивости – 24.76% при низких значениях индекса фиксации. При изменении состава групп результаты практически не изменялись.
Таблица 5.
Иерархический анализ молекулярной дисперсии (AMOVA) для изученных форм/видов сигов (1–12) и по объединенным группам (малотычинковых и среднетычинковых)
| Уровни иерархии | d.f. | Процент изменчивости |
Индексы фиксации (p) |
|---|---|---|---|
| Между группами | 10 | 17.02 | 0.17016 (0.080) |
| Между популяциями внутри групп | 2 | 10.26 | 0.12358 (0.000***) |
| Внутри популяций | 86 | 72.73 | 0.27271 (0.020*) |
| По двум группам мало- и среднетычинковых форм/видов сигов | |||
| Между группами | 1 | 4.26 | 0.25864 (0.000***) |
| Между популяциями внутри групп | 11 | 24.76 | 0.29026 (0.000***) |
| Внутри популяций | 86 | 70.97 | 0.04264 (0.184) |
Гаплотипы сигов из оз. Б. Токо формируют собственную звездообразную структуру (H7–H14), тесно связанную с другой звездообразной структурой (Н16) (рис. 6). В бассейне р. Витим гаплотипы сигов из оз. Б. Токо не отмечены, однако в озере встречались гаплотипы сигов из верхней Лены. Во всех точках присутствуют гаплотипы, которые формируют рассеянные слабо связанные сети. Такая структура характерна для арктических видов/форм сигов, известных как C. pidschian n. glacialis. Так в оз. Орон (Витимский) такие гаплотипы были доминирующими.
Тест Таджимы D в большинстве случаев принимает отрицательные и недостоверные значения. Исключение составляет выборка C. baunti, которая характеризуется положительными значениями (табл. 6). Достоверные значения были получены для выборок сигов из оз. Б. Токо, р. Лена, для выборки малотычинкового сига из оз. Б. Капылюши и малотычинкового сига из оз. Доронг. Тест Фу FS для сигов из оз. Б. Токо, малотычинковых сигов из озер Б. Капылюши и Доронг характеризовался отрицательными достоверными значениями. Тест на нейтральность эволюции для всей выборки сигов продемонстрировал отрицательные и достоверные значения по обоим параметрам.
Таблица 6.
Тест на нейтральность по ND1 мтДНК для изученных форм/видов сигов
| Выборка | n | Тест Таджимы (D) | p | Тест Фу (FS) | p |
|---|---|---|---|---|---|
| 1 | 10 | –0.09186 | 0.49500 | –2.51467 | 0.05800 |
| 2 | 10 | –0.12729 | 0.47700 | –1.96882 | 0.08500 |
| 3 | 9 | –0.80442 | 0.24300 | –2.03350 | 0.05500 |
| 4 | 12 | 0.61425 | 0.73500 | –0.57666 | 0.33400 |
| 5 | 11 | –1.41744 | 0.07900 | –2.81763 | 0.02500 |
| 6 | 11 | 0.17177 | 0.61200 | 0.67459 | 0.06670 |
| 7 | 11 | –1.29764 | 0.08800 | –3.14039 | 0.02500 |
| 8 | 11 | 0.72706 | 0.81700 | –2.90752 | 0.05500 |
| 9 | 10 | –0.98485 | 0.18600 | –1.54678 | 0.06500 |
| 10 | 6 | –0.68157 | 0.32300 | –2.29890 | 0.03500 |
| 11 | 3 | – | – | – | – |
| 12 | 4 | 0.68673 | 0.76500 | –0.61511 | 0.16400 |
| Для всех | 110 | –2.02563 | 0.00400 | –25.77617 | 0.00000 |
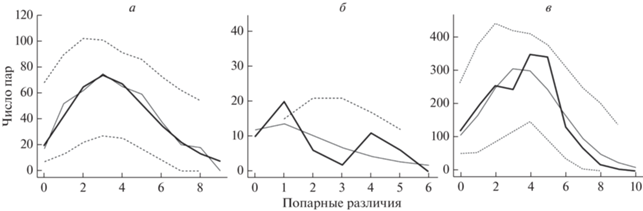
Попарное сравнение выборок выявило в основном низкие, редко средние и высокие значения FST между изучаемыми группировками (от 0.00089 до 0.52092). Относительно высокие значения, как правило, связаны с географически удаленными популяциями сигов из оз. Б. Токо, бассейнов рек Алдан и Марха (связь с ряпушковидным сигом не анализировали). Согласно индексу суммы квадратичного отклонения (SSDobs) и индекса Харпендинга (r) обе модели демографической и пространственной экспансии оказались равноценными, оба показателя были недостоверны. Анализ наблюдаемого и ожидаемого распределения числа попарных нуклеотидных различий показал, что кривые имеют различный характер распределения (рис. 7,а, б). Показано, что для выборки сигов верхнего течения р. Лена характерно унимодальное распределение, тогда как озерные группировки сигов демонстрировали мультимодальную форму кривой распределения (рис. 7,б, в).
Рис. 7.
График распределения числа попарных различий между нуклеотидными последовательностями (а) для речных популяций сигов р. Лена с притоками (б) для гаплотипов сигов оз. Б. Токо. (в) для симпатрических сигов Баунтовской системы озер и р. Витим. Сплошная толстая линия – наблюдаемое распределение, тонкая линия – ожидаемое распределение, пунктирная линия – 95%-ный доверительный интервал.
ОБСУЖДЕНИЕ
Морфология
Все обитающие в оз. Байкал сиговые рыбы относятся к многочешуйчатым сигам. Все сиги Баунтовской системы озер по числу прободенных чешуй в боковой линии относятся к среднечешуйчатым или к многочешуйчатым формам/видам. Пограничное значение этого признака у мелкого ряпушковидного сига возможно связано со сложностью подсчета мелких чешуй, и его настоящая величина несколько занижена. По этому признаку сиги Баунтовских озер отличаются от всех популяций сигов бассейна р. Лены, у которых достоверно меньше чешуй в боковой линии. Сходными с баунтовскими сигами значениями этого признака обладают только сиги Жаровских озер нижнего течения р. Витим и оз. Дальнее (бассейн р. Киренга ‒ верхнее течение р. Лена) [13]. Очевидно, что закономерность в распространении этих форм/видов сигов обусловлена влиянием особых экологических условий и историей форм/видов сигов обитающих в Байкальской рифтовой зоне (БРЗ). Кроме водоемов БРЗ много- и среднечешуйчатые формы сигов в Сибири обитают только в бассейне р. Б. Енисей. Притом, в нижних по течению озерах обитают многотычинковые формы, а в верхних ‒ малотычинковые [26, 62]. Следует иметь в виду, что бассейн р. Енисей связан с БРЗ в течение относительно непродолжительного временного периода [25].
Морфоэкологическую дифференциацию сигов обычно связывают с их трофической специализацией. Согласно нашим исследованиям, малотычинковые сиги во всех озерах питаются хирономидами, крупными донными ракообразными, крупными и воздушными насекомыми, реже встречаются циклопы и остракоды [16]. Ряпушковидный сиг из оз. Баунт является стенофагом и питается исключительно зоопланктоном. Среднетычинковые сиги из озер Доронг и Баунт, в том числе и среднетычинковый сиг из оз. Б. Капылюши, употребляют в пищу весь спектр доступных организмов. Анализ числа жаберных тычинок позволяет утверждать, что во всех трех Баунтовских озерах экологические ниши заняты соответствующими формами/видами сигов. В оз. Баунт обитает доминирующий по численности многотычинковый ряпушковидный сиг, но при этом встречаются и среднетычинковые формы сигов, вероятно, мигрирующие из озер Доронг и Капылюши. По всей видимости, в связи с присутствием в оз. Баунт многотычинкового ряпушковидного сига, доминирующего в этой экологической нише, число среднетычинковых сигов в озере незначительно. Тем не менее, они доминируют в озерах, расположенных выше по течению рек, где ряпушковидный сиг не обнаружен.
МтДНК
Все выборки пыжьяновидных сигов характеризуются высокими показателями генетического полиморфизма (табл. 7), что характерно для давно существующих популяций с высоким эффективным размером, которые при своем становлении, возможно, объединились с популяциями иного происхождения. По всей видимости, некоторые популяции сигов из бассейна р. Лены прошли через “бутылочное горлышко”. В медианной сети гаплотипы сигов из разных локальностей исследованного района сильно перемешаны, и при этом гаплотипы сигов из Баунтовских озер рассредоточены, как минимум, по нескольким звездообразным структурам двух основных гаплогрупп. Это позволяет предполагать, что нынешнее разнообразие сигов Баунтовских озер изначально имеет гибридную природу. Из всех изученных популяций/форм/видов сигов только гаплотипы сига из оз. Б. Токо сформировали отдельную звездообразную структуру, что позволяет предположить высокий уровень изоляции данной популяции и ее относительно недавнее прохождение через “бутылочное горлышко” (рис. 5). Ряпушковидный сиг характеризуется высокими показателями генетического полиморфизма и, в отличие от пыжьяновидных сигов, его гаплотипы сформировали слабо связанную медианную сеть, что указывает на его древнее происхождение. Часть гаплотипов ряпушковидного сига более тесно связана с гаплотипами пыжьяновидных сигов, чем с оригинальными гаплотипами [16, 46]. Этот факт позволяет предположить давнюю гибридизацию ряпушковидного сига с пыжьяновидными сигами местных популяций. Генетическое своеобразие ряпушковидного сига подтверждается также аллозимными данными [46] и дифференциацией последовательностей митохондриального гена цитохрома b [18].
Таблица 7.
Полиморфизм последовательности фрагмента 16S RNA-tRNA-Leu-NADH1-tRNA-Ile-tRNA-Gln генов мтДНК в популяциях сигов из некоторых водоемов и среднего течения р. Лена
| Популяции | Фрагмент ДНК | Длина, пн | n | h | Hd | S | π | K |
|---|---|---|---|---|---|---|---|---|
| 1. В. Лена,восточносибирский сиг | 16S rRNA | 735 | 10 | 2 | 0.200 | 1 | 0.0003 | 0.200 |
| tRNA-Leu | 75 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 10 | 8 | 0.956 | 12 | 0.0043 | 4.156 | |
| tRNA-Ile | 72 | 10 | 4 | 0.711 | 3 | 0.0117 | 0.867 | |
| tRNA-Gln | 68 | 10 | 3 | 0.689 | 2 | 0.0111 | 0.822 | |
| Всего | 1929 | 10 | 8 | 0.956 | 18 | 0.0031 | 6.044 | |
| 2. Р. Марха,восточносибирский сиг | 16S rRNA | 735 | 9 | 2 | 0.389 | 1 | 0.0005 | 0.389 |
| tRNA-Leu | 75 | 9 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 9 | 6 | 0.833 | 7 | 0.0022 | 2.111 | |
| tRNA-Ile | 72 | 9 | 2 | 0.500 | 1 | 0.0068 | 0.500 | |
| tRNA-Gln | 68 | 9 | 2 | 0.500 | 1 | 0.0070 | 0.500 | |
| Всего | 1929 | 9 | 5 | 0.722 | 8 | 0.0015 | 2.889 | |
| 3. Р. Буотама,восточносибирский сиг | 16S rRNA | 735 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 |
| tRNA-Leu | 75 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 10 | 7 | 0.933 | 9 | 0.0032 | 3.089 | |
| tRNA-Ile | 72 | 10 | 3 | 0.378 | 2 | 0.0056 | 0.400 | |
| tRNA-Gln | 68 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| Всего | 1929 | 10 | 7 | 0.933 | 11 | 0.0018 | 3.489 | |
| 4. Р. Витим,восточносибирский сиг | 16S rRNA | 735 | 12 | 1 | 0 | 0 | 0.0000 | 0.000 |
| tRNA-Leu | 75 | 12 | 1 | 0 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 12 | 6 | 0.864 | 7 | 0.0027 | 2.682 | |
| tRNA-Ile | 72 | 12 | 2 | 0.167 | 1 | 0.0023 | 0.167 | |
| tRNA-Gln | 68 | 12 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| Всего | 1929 | 12 | 8 | 0.864 | 8 | 0.0015 | 2.848 | |
| 5. Оз. Б. Токо,восточносибирский сиг | 16S rRNA | 735 | 11 | 3 | 0.582 | 2 | 0.0011 | 0.836 |
| tRNA-Leu | 75 | 11 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 11 | 7 | 0.818 | 9 | 0.0021 | 2.036 | |
| tRNA-Ile | 72 | 11 | 3 | 0.345 | 3 | 0.0074 | 0.054 | |
| tRNA-Gln | 68 | 11 | 2 | 0.182 | 1 | 0.0026 | 0.182 | |
| Всего | 1929 | 11 | 9 | 0.945 | 1 | 0.0016 | 3.061 | |
| 6. Оз. Б. КапылюшиC. baunti | 16S rRNA | 735 | 13 | 3 | 0.182 | 3 | 0.0006 | 0.462 |
| tRNA-Leu | 75 | 13 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 13 | 5 | 0.692 | 8 | 0.0028 | 2.692 | |
| tRNA-Ile | 72 | 13 | 3 | 0.295 | 2 | 0.0043 | 0.308 | |
| tRNA-Gln | 68 | 13 | 2 | 0.154 | 1 | 0.0021 | 0.154 | |
| Всего | 1929 | 13 | 7 | 0.795 | 14 | 0.0019 | 3.615 | |
| 7. Оз. Б. Капылюши,малотычинковый сиг | 16S rRNA | 735 | 11 | 3 | 0.473 | 4 | 0.0014 | 1.018 |
| tRNA-Leu | 75 | 11 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 11 | 8 | 0.927 | 12 | 0.0029 | 2.872 | |
| tRNA-Ile | 72 | 11 | 3 | 0.473 | 2 | 0.0071 | 0.509 | |
| tRNA-Gln | 68 | 11 | 2 | 0.182 | 1 | 0.0025 | 0.182 | |
| Всего | 1929 | 11 | 9 | 0.964 | 19 | 0.0024 | 4.582 | |
| 8. Оз. Доронг,малотычинковый сиг | 16S rRNA | 735 | 6 | 2 | 0.533 | 1 | 0.00073 | 0.533 |
| tRNA-Leu | 75 | 6 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 6 | 6 | 1.000 | 12 | 0.00479 | 4.667 | |
| tRNA-Ile | 72 | 6 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| tRNA-Gln | 68 | 6 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| Всего | 1929 | 6 | 6 | 1.000 | 13 | 0.00271 | 5.200 | |
| 9. Оз. Доронг,среднетычинковый сиг | 16S rRNA | 735 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 |
| tRNA-Leu | 75 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 10 | 5 | 0.800 | 5 | 0.0014 | 1.333 | |
| tRNA-Ile | 72 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| tRNA-Gln | 68 | 10 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| Всего | 1929 | 10 | 5 | 0.800 | 5 | 0.0007 | 1.333 | |
| 10. Оз. Баунт,ряпушковидный сиг(баунтовская ряпушка) | 16S rRNA | 735 | 11 | 9 | 0.964 | 5 | 0.0048 | 3.527 |
| tRNA-Leu | 75 | 11 | 2 | 0.182 | 1 | 0.0024 | 0.182 | |
| ND1 | 975 | 11 | 11 | 1.000 | 39 | 0.0158 | 15.382 | |
| tRNA-Ile | 72 | 11 | 2 | 0.436 | 1 | 0.00611 | 0.436 | |
| tRNA-Gln | 68 | 11 | 1 | 0.000 | 0 | 0.00000 | 0.000 | |
| Всего | 1929 | 11 | 11 | 1.000 | 52 | 0.01012 | 19.527 | |
| 11. Оз. Баунт,малотычинковый сиг | 16S rRNA | 735 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 |
| tRNA-Leu | 75 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 4 | 4 | 0.1000 | 8 | 0.00479 | 4.667 | |
| tRNA-Ile | 72 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| tRNA-Gln | 68 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| Всего | 1929 | 4 | 4 | 0.866 | 8 | 0.00242 | 4.667 | |
| 12. Оз. Баунт,среднетычинковый сиг | 16S rRNA | 735 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 |
| tRNA-Leu | 75 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| ND1 | 975 | 4 | 4 | 0.1000 | 8 | 0.00479 | 4.667 | |
| tRNA-Ile | 72 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| tRNA-Gln | 68 | 4 | 1 | 0.000 | 0 | 0.0000 | 0.000 | |
| Всего | 1929 | 4 | 4 | 0.866 | 8 | 0.00242 | 4.667 |
Иерархический анализ молекулярной дисперсии AMOVA показал, что бóльшая часть анализируемой генетической изменчивости приходится на внутрипопуляционную составляющую (72%). Попарное сравнение выявило в основном низкие значения FST между сравниваемыми выборками что позволяет говорить об активном потоке генов между популяциями, который мог быть ограничен расстоянием. В некоторых сравнениях значения индекса достигают более значительных величин. Последнее заключение подтверждается более высокими значениями данного индекса, при сопоставлении максимально удаленных группировок сигов из р. Марха и оз. Б. Токо и выборок сигов из Баунтовской системы озер (табл. 5).
Тесты на нейтральность принимают отрицательные значения в случае экспансивного роста популяции или в случае действия отрицательного отбора. Высокие, достоверные и отрицательные значения теста Фу FS, как правило, свидетельствуют о продолжающейся гибридизации в популяциях и пространственной экспансии. Именно эти процессы отмечаются для популяций сигов из оз. Б. Токо и малотычинковых сигов из оз. Б. Капылюши. При объединении гаплотипов разнотычинковых сигов из оз. Б. Капылюши были получены отрицательные недостоверные значения для обоих индексов. Это может свидетельствовать о разнонаправленных процессах в популяциях сигов даже в пределах одного водоема. Недостоверные значения среднеквадратического отклонения и индекса Харпендинга не позволяют отдать предпочтение той или иной демографической модели.
Происхождение форм среднетычинковых сигов
Существует гипотеза, что в конце одного из последних оледенений в ареал многочешуйчатых сигов пра-баунтовской системы озер, ранее принадлежавших бассейну оз. Байкал, вселились малочешуйчатые пыжьяновидные сиги из бассейна р. Лена [12]. Реализация такого события оказалась возможной в связи с изменением направления водостока из “пра-баунтовских” водоемов с байкальского на ленский [63]. Вернее всего, что данное событие произошло одновременно с изменением стока оз. Байкал с ленского (Пра-Манзурский сток) на енисейский [64, 65]. Таким образом, речные малотычинковые и малочешуйчатые сиги (р. Лена) проникли через полноводную р. Ципа и распространились далее по рекам Нижняя и Верхняя Ципа, оз. Баунт, р. Точа до оз. Доронг. Озера Б. и М. Капылюши находятся в системе р. Ципикан несколько выше по высоте над уровнем моря, чем оз. Доронг. В период даже максимального подъема воды система этих озер, по всей видимости, лишь нечасто и нестабильно объединялась с системой расположенных ниже над уровнем моря озер Доронг и Баунт. По этой причине автохтонные многочешуйчатые сиги в оз. Б. Капылюши подверглись меньшей гибридизации с пыжьяновидными сигами, чем популяции сигов из озер Баунт и Доронг. Сложность проникновения витимских рыб в оз. Капылюши подтверждается отсутствием в нем реофильных видов – ленка и хариуса. Географическое распределение гаплотипов сигов также объясняется недавними постледниковыми событиями, которые отражают относительно небольшой промежуток времени. На такой вывод наталкивает незначительное распространение (в речной системе) части гаплотипов.
Остается открытым вопрос о происхождении всей среднетычинковой группы сигов. До последнего времени доминировала точка зрения, что “букет” форм/видов сформировался по причине особых экологических и геологических условий этого региона [11–13, 42] и что все обитающие в системе озер формы/виды сигов сформировались там, где они обитают. Полученные нами данные о высокой гаплотипической и нуклеотидной изменчивости мтДНК ряпушковидного сига показывают, что этот морфологически и генетически хорошо дифференцированный вид вряд ли мог длительное время эволюционировать в одном озере Баунт или небольшой системе озер. Вероятно, в прошлом его ареал был значительно шире. Нельзя исключать также, что предок баунтовского ряпушковидного сига также имел отношение к эволюции пра-ряпушек комплекса Coregonus sardinella/C. albula, ранее широко расселенного в Евразии [66]. Возможно, что среднетычинковые сиги Баунтовских озер являются результатом интрогрессивной гибридзации автохтонных ряпушковидных сигов-планктонофагов, сформировавшимися после вселения пыжьяновидного сига ленского происхождения в систему оз. Баунт.
ЗАКЛЮЧЕНИЕ
Различия исследованных нами популяций сигов из верхнего и среднего течения р. Лены по морфологическим признакам имеет неслучайный характер. Распределение числа жаберных тычинок сигов бассейна р. Лена непосредственно связано с экологией сигов. Так, в озере Б. Токо и в русловой части рек обитают только малотычинковые сиги-бентофаги, что вполне отражает наши взгляды на экологию этих форм/видов сигов. Однако в Баунтовской системе озер симпатрично сосуществуют малотычинковые бентофаги, среднетычинковые эврифаги и многотычинковые планктофаги, следов которых не обнаружено в оз. Б. Токо и в многочисленных крупных озерах бассейна р. Б. Енисей [26]. Скорее всего, распределение среднетычинковых форм/видов сигов в водоемах Сибири свидетельствует об их гибридном происхождении, чем о длительной эволюции.
В озерах Доронг и Капылюши доминируют среднетычинковые сиги планктофаги, в то время как в оз. Баунт экологическая ниша сигов планктофагов занята доминирующим здесь по численности эндемичным ряпушковидным сигом. По всей видимости, численность среднетычинковых сигов оз. Баунт ограничена реликтовым ряпушковидным сигом, более приспособленным к питанию планктоном.
Существование популяций сигов с разным количеством чешуй в боковой линии, обитающих в бассейнах рек Витим, Лена, Енисей и Амур напрямую связаны с путями расселения сигов в прошлом [65, 67]. По сравнению с бассейном р. Лена, в бассейне р. Енисей более многочисленны многочешуйчатые и среднечешуйчатые сиги, что вероятно обусловлено расселением байкальских многочешуйчатых сигов через р. Ангара в бассейн р. Енисей (Тоджинскую котловину). Переориентация стока Баунтовских озер с байкальского на ленский позволило ленским малочешуйчатым формам проникать в бассейн р. Ципа и в результате гибридизации число прободенных чешуй в боковой линии у баунтовских сигов снизилось до современного уровня.
Возможно, что наличие нескольких форм весенненерестующих сигов в относительно небольших Баунтовских озерах связано с присутствием в оз. Баунт весенненерестующего ряпушковидного сига. Результаты генетических анализов показывают, что происхождение последнего имеет более длинную историю, чем время формирования всех ныне живущих байкальских форм/видов сигов [25, 30, 46].
Работа выполнена при поддержке гранта РФФИ FSRG-2020-0019 и частичной поддержке грантов РФФИ № 20-04-00610 и (Монг_а) № 20-44-20-54-44017.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. Ч. I. М.: Изд-во АН СССР, 1948. 468 с.
Правдин И.Ф. Сиги водоемов Карело-Финской ССР. М.–Л.: Изд-во АН СССР, 1954. 324 с.
Решетников Ю.С. Экология и систематика сиговых рыб. Москва: Наука, 1980. 300 с.
Kottelat M., Freyhof J. Handbook of European Freshwater Fishes. Cornol, Switzerland–Berlin, 2007. 640 p.
Богуцкая Н.Г., Насека А.М. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: Тов-во науч. изданий КМК, 2004. 389 с.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука, 2002. 496 с.
Скрябин А.Г. Сиговые рыбы юга Сибири. Новосибирск: Наука, 1979. 230 с.
Гундризер А.Н., Иоганзен Б.Г., Кафанова В.В., Кривощеков Г.М. Рыбы Телецкого озера. Новосибирск: Наука, 1981. 159 с.
Голубцов А.С., Малков Н.П. Очерк ихтиофауны Республики Алтай: систематическое разнообразие, распространение и охрана. М.: Тов-во науч. изданий КМК, 2007. 164 с.
Скрябин А.Г. Биология байкальских сигов. М.: Наука, 1969. 112 с.
Калашников Ю.Е. Рыбы бассейна реки Витим. Новосибирск: Наука, 1978. 191 с.
Карасев Г.Л. Рыбы Забайкалья. Новосибирск: Наука, 1987. 296 с.
Скрябин А.Г. Рыбы Баунтовских озер Забайкалья. Новосибирск: Наука, 1977. 232 с.
Bernatchez L., Colombani F., Dodson J.J. Phylogenetic relationships among the subfamily Coregoninae as revealed by mitochondrial DNA restriction analysis // J. Fish Biol. 1991. V. 39. P. 283–290. https://doi.org/10.1111/J.1095-8649.1991
Bernatchez L., Dodson J.J. Allopatric origin of sympatric populations of lake whitefish (Coregonus clupeaformis) as revealed by mitochondrial DNA restriction analysis // Evolution. 1990. V. 44. № 5. P. 1263–1271. https://doi.org/10.1111/j.1558-5646.1990.tb05230.x
Bochkarev N.A., Zuykova E.I., Abramov S.A. et al. Morphological, biological and mtDNA sequences variation of coregonid species from the Baunt Lake system (the Vitim River basin) // Adv. in Limnology. 2013. V. 64. P. 257–277. https://doi.org/10.1127/1612-166x2013/0064-0025
Politov D.V. Coregonids of Russia: Evolutionary genetic approach in assessment of current state of biodiversity // Fundamental and Applied Limnology. 2017. V. 189. № 3. P. 181–192. https://doi.org/10.1127/fal/2017/0814
Sukhanova L.V., Smirnov V.V., Smirnova-Zalumi N.S. et al. Molecular phylogeography of Lake Baikal Coregonid Fishes // Adv. in Limnology. 2012. V. 63. P. 261–283. https://doi.org/10.1127/advlim/63/2012/261
Sukhanova L.V., Smirnov V.V., Smirnova-Zalumi N.S. et al. Grouping of Baikal omul Coregonus autumnalis migratorius Georgi within the C. lavaretus complex confirmed by using a nuclear DNA marker // Ann. Zool. Fennici. 2004. V. 41. № 1. P. 41–49.
Балдина С.Н., Гордон Н.Ю., Политов Д.В. Генетическая дифференциация муксуна Coregonus muksun (Pallas) и родственных видов сиговых рыб (Coregonidae, Salmoniformes) Сибири по мтДНК // Генетика. 2008. Т. 44. № 7. С. 896–905.
Бодали Р.А., Вуоринен Д.А., Решетников Ю.С., Рист Д.Д. Генетические связи пяти видов сиговых рыб Сибири // Вопр. ихтиологии. 1994. Т. 34. № 2. С. 195–203.
Бочкарев Н.А., Зуйкова Е.И., Политов Д.В. Видовая и популяционная структура сигов р. Coregonus из Баунтовской системы озер (бассейн р. Витим) // Биология, биотехника разведения и состояние запасов сиговых рыб. Тюмень: Госрыбцентр, 2013. С. 26–32.
Renaut S., Nolte A.W., Bernatchez L. Mining transcriptome sequences towards identifying adaptive single nucleotide polymorphisms in lake whitefish species pairs (Coregonus spp. Salmonidae) // Mol. Ecol. 2010. V. 19. P. 115–131. https://doi.org/10.1111/j.1365-294X.2009.04477.x
Исаченко В.Л. Новый вид сига из бассейна р. Енисей // Тр. Сиб. ихтиол. лаборатории. 1925. Т. 2. № 1. С. 3–18.
Смирнов В.В., Смирнова-Залуми Н.С., Суханова Л.С. Микроэволюция байкальского омуля Coregonus autumnalis migratorius (Georgi). Новосибирск: Изд-во СО РАН, 2009. 246 с.
Bochkarev N.A., Zuykova E.I., Katokhin A.V. Morphology and mitochondrial DNA variation of the Siberian whitefish Coregonus lavaretus pidschian (Gmelin) in the upstream water bodies of the Ob and Yenisei rivers // Evol. Ecol. 2011. V. 25. P. 557–572. https://doi.org/10.1007/s10682-010-9437-7
Кагановский А.Г. Промысловые рыбы реки Анадырь и Анадырского лимана // Вестн. Дальневосточного филиала АН СССР. 1933. № 1/2. С. 137–139.
Решетников Ю.С., Слугин И.В., Мамонтова Т.Г. О симпатрических популяциях сига реки Анадырь // Изменчивость рыб пресноводных экосистем. М.: Наука, 1979. С. 113–136.
Baldina S.N., Gordon N.Y., Politov D.V. Genetic relationships of the Ussuri cisco, Coregonus ussuriensis Berg 1906, in view of mtDNA data // Adv. in Limnology. 2007. V. 60. P. 83–89.
Бочкарёв Н.А., Зуйкова Е.И., Политов Д.В. Таксономический статус и происхождение некоторых экологических форм сигов вида Coregonus lavaretus (L.) из водоемов Сибири // Генетика. 2017. Т. 53. № 8. С. 922–932 https://doi.org/10.1134/S0016675818090047
Бочкарев Н.А., Сендек Д.С., Зуйкова Е.И. и др. Популяционная структура и происхождение некоторых экологических форм Сoregonus lavaretus pidschian из р. Оленёк // Генетика. 2021. Т. 57. № 7. С. 797–809. https://doi.org/10.31857/S0016675821070043
Сендек Д.С., Иванов Е.В. О причинах генетической неоднородности сига-пыжьяна Coregonus lavaretus pidschian реки Анабар // Экол. генетика. 2017. Т. 15. № 1. С. 20–26. https://doi.org/10.17876/ecogen15320-26
Hudson A.G., Vonlanthen P., Seehausen O. Rapid parallel adaptive radiations from a single hybridogenic ancestral population // Proc. of the Royal Society B-Biological Sciences. 2011. 278/1702. P. 58–66. https://doi.org/10.1098/rspb.2010.0925
Vonlanthen P., Roy D., Hudson A.G. et al. Divergence along a steep ecological gradient in lake whitefish (Coregonus sp.) // J. Evol. Biol. 2009. V. 22. № 3. P. 498–514. https://doi.org/10.1111/j.1420-9101.2008.01670.x
Ilmast N., Sendek D., Zuykova E. et al. Morphological and genetic variability of the mass whitefish forms in Lake Onega // KnE Life Sciences. 2020. V. 5. № 1. P. 141–151. https://doi.org/10.18502/kls.v5i1.6037
Kahilainen K. Ecology of Sympatric Whitefish (Coregonus lavaretus (L.)) Forms in a Subarctic Lake. Helsinki: Edita Prima, 2004. 44 p.
Ильмаст Н.В., Сендек Д.С., Титов С.Ф и др. К вопросу о дифференциации экологических форм/подвидов сига Coregonus lavaretus озера Каменного // Уч. зап. Петрозаводск. гос. ун-та. 2016. № 4(157). С. 42–53.
Ostbye K., Amundsen P.A., Bernatchez L. et al. Parallel evolution of ecomorphological traits in the European whitefish Coregonus lavaretus (L.) species complex during postglacial times // Mol. Ecol. 2006. V. 15. № 13. P. 3983–4001. https://doi.org/10.1111/j.1365-294X.2006.03062.x
Winkler K.A., Pamminger-Lahnsteiner B., Wanzenbock J., Weiss S. Hybridization and restricted gene flow between native and introduced stocks of Alpine whitefish (Coregonus sp.) across multiple environments // Mol. Ecol. 2011. V. 20. № 3. P. 456–472. https://doi.org/10.1111/j.1365-294X.2010.04961.x
Politov D.V., Bickham J.W., Patton J.C. Molecular phylogeography of Palearctic and Nearctic ciscoes // Ann. Zool. Fennici. 2004. V. 41. № 1. P. 13–23.
Politov D.V., Gordon N.Y., Makhrov A.A. Genetic identification and taxonomic relationships of six Siberian Coregonus species // Biol. and Management of Coregonid Fishes, Archiv fuer Hydrobiologie Special Issues – Advances in Limnology. 2002. V. 57. P. 21–34.
Калашников Ю.Е. Многотычинковые сиги озера Орон системы р. Витим // Вопр. ихтиологии. 1968. Т. 8. № 4(51). С. 637–645.
Анпилова В.И. О систематическом положении баунтовской ряпушки (р. Витим) // Докл. АН СССР. 1956. Т. 111. № 4. С. 898–900.
Мухомедияров Ф.Б. Ряпушка – Coregonus sardinella baunti subsp. nova из системы Ципа-Ципиканских озер бассейна реки Витим // Докл. на 1-й науч. сессии Якутской базы АН СССР. Якутск: 1948. С. 270–280.
Пронин Н.М., Бурдуковская Т.Г., Батуева М.Д. и др. Паразитофауна сиговых рыб рода Coregonus из водоемов Ципо-Ципиканской системы (Забайкалье) // Вопр. ихтиологии. 2015. Т. 55. № 5. С. 739–746 https://doi.org/10.7868/S0042875215040141
Baldina S.N., Gordon N.Y., Bochkarev N.A., Politov D.V. Genetic differentiation among sympatric whitefishes and ciscoes from Transbaikalian Lake Baunt by mtDNA and allozyme loci // Proc. 12th Int. Symp. on the Biol. and Management of Coregonid Fishes (25–29 August 2014, Listvianka, Russia). Listvyanka–Irkutsk: 2014. P. 38–39.
Мамонтов А.М. Ледниковые периоды и формообразования у реликтовых сиговых рыб в водоемах юга Сибири // Вопр. ресурсоведения, ресурсопользования, экологии и охраны. Ч. 5. Якутск: Якутский гос. ун-тет, 2000. С. 127–146.
Кириллов Ф.Н. Рыбы Якутии. М.: Наука, 1972. 359 с.
Бочкарёв Н.А., Зуйкова Е.И. Дополнительные возможности сбора морфологических данных у рыб // Мат. Всерос. конф. “Биол. аспекты рационального использования и охраны водоемов Сибири” (Томск, 2007). Томск: Лито–Принт, 2007. С. 304.
Бочкарев Н.А., Зуйкова Е.И., Политов Д.В. Дополнительные возможности сбора и регистрации морфологических данных у рыб // Биология, биотехника разведения и состояние запасов сиговых рыб. Тюмень: Госрыбцентр, 2013. С. 32–36.
Darroch J.N., Mosimann J.E. Canonical and principal components of shape // Biometrika. 1985. V. 72. № 2. P. 241–252.
Mosimann J.E. Size allometry: size and shape variables with characteristics of the log normal and generalized gamma distributions // J. Am. Stat. Association. 1970. V. 65. P. 930–945.
Hammer O., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4. № 1. P. 1–9.
Politov D.V., Gordon N.Y., Afanasiev K.I. et al. Identification of Palearctic coregonid fish species using mtDNA and allozyme genetic markers // J. Fish Biol. 2000. V. 57. Suppl. A. P. 51–71.
Librado P., Rozas J. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data // Bioinformatics. 2009. V. 25. P. 1451–1452. https://doi.org/10.1093/bioinformatics/btp187
Excoffier L., Lischer H.E.L. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Res. 2010. V. 10. P. 564–567. https://doi.org/10.1111/j.1755-0998.2010.02847.x
Fu Y.-X., Li W.-H. Statistical tests of neutrality of mutations // Genetics. 1993. V. 133. P. 693–709.
Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism // Genetics. 1989. V. 123. № 3. P. 585–595.
Excoffier L., Laval G., Schneider S. Arlequin version 3.0: An integrated software package for population genetics data analysis // Evol. Bioinformatics Online. 2005. V. 5. № 1. P. 47–50.
Rogers A.R., Harpending H. Population growth makes waves in the distribution of pair-wise genetic differences // Mol. Biol. Evolution. 1992. V. 9. № 3. P. 552–569.
Bandelt H.-J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48.
Гундризер А.Н. Рыбы Тувинской АССР: Автореф. дис. … докт. биол. наук. Томск: Томский гос. ун-т, 1975. 48 с.
Кожов М.М. Пресные воды Восточной Сибири. Иркутск: 1950. 368 с.
Кононов Е.Е., Мац В.Д. История формирования стока вод Байкала // Изв. вузов. Геол. и разведка. 1986. № 6(32) С. 91–98.
Мац В.Д., Щербаков Д.Ю., Ефимова И.М. Позднемеловая кайнозойская история Байкальской впадины и формирование уникального биоразнообразия Байкала // Стратиграфия. Геол. корреляция. 2011. Т. 19. № 1. С. 40–61.
Sendek D.S. Phylogenetic relationships in vendace and least cisco, and their distribution areas in western Eurasia // Ann. Zool. Fennici. 2021. V. 58. P. 289–306.
Еникеев Ф.И. Палеогеография Сартанского оледенения горного обрамления Муйской впадины (Северное Забайкалье) // Горные исследования. 2018. № 3. С. 58–70. https://doi.org/10.17223/25421379/8/6
Дополнительные материалы отсутствуют.