Генетика, 2022, T. 58, № 11, стр. 1280-1291
Внутривидовая дифференциация азиатской горбуши по данным о последовательности митохондриального гена cytb
Д. А. Зеленина 1, *, Л. А. Животовский 1, 2, В. А. Сошнина 1, 3, О. Ю. Вилкова 1, М. К. Глубоковский 1
1 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
107187 Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: d.zelenina@gmail.com
Поступила в редакцию 24.01.2022
После доработки 30.05.2022
Принята к публикации 07.06.2022
- EDN: OECIZQ
- DOI: 10.31857/S0016675822110145
Аннотация
Работа посвящена изучению внутривидового генетического полиморфизма горбуши. Уникальность этого представителя тихоокеанских лососей рода Oncorhynchus заключается в существовании двух аллохронных репродуктивно изолированных группировок – линий четных и нечетных лет нереста. Нами впервые исследована изменчивость митохондриального гена цитохрома b (cytb) во всех основных регионах Дальнего Востока России. Показана уверенная генетическая дифференциация между линиями, в то время как внутри линий стабильных межрегиональных и темпоральных различий выявлено не было. Гаплотипическое разнообразие в пределах четной линии заметно превышало таковое в пределах нечетной, агенетические различия между “четной” и “нечетной” горбушей превышали межпопуляционную изменчивость в пределах каждой из линий.
Горбуша (Oncorhynchus gorbuscha) обитает в бассейне северной части Тихого океана и в непромысловых количествах в сопредельных водах Ледовитого океана. Нерестовый ареал этого анадромного вида тихоокеанских лососей простирается от рек Корейского полуострова до р. Лены в Азии и от рек Калифорнии до р. Маккензи в Северной Америке. Нагульные скопления горбуши в океане концентрируются в прикурильском и приалеутском районах, а также в Японском море; численность азиатских популяций горбуши заметно выше, чем американских. Динамика численности этого вида характеризуется резкими короткопериодными колебаниями по четным и нечетным годам, что связано с созреванием подавляющего большинства особей на втором году жизни [1, 2]; в связи с этим горбуша на всем ареале представлена двумя репродуктивно независимыми линиями – четных и нечетных лет нереста. Имеются также значительные по амплитуде долгопериодные – до нескольких десятков лет – изменения численности горбуши, которые, как полагают, определяются колебаниями абиотических факторов среды, влияющих на воспроизводство популяций данного вида, а также, возможно, и глобальным потеплением [3].
Горбуша – доминирующий объект лососевого промысла на Дальнем Востоке России. Ежегодный вылов ее достигает более 80% от всех добываемых у нас тихоокеанских лососей и в отдельные годы превышает 400 тыс. тонн. Кроме того, в настоящее время горбуша наряду с кетой – основной объект искусственного воспроизводства дальневосточных лососей. Несмотря на определенные успехи в изучении динамики численности и популяционной структуры горбуши, прогнозирование мощности ее подходов к береговым районам промысла как в Азии, так и в Северной Америке зачастую бывает неудачным: амплитуда колебаний численности взрослых особей в каждой конкретной локальности оказывается труднопредсказуемой. Это обусловливает большие потери уловов в одних районах промысла и переловы горбуши в других.
В течение ряда десятилетий внутривидовая структура горбуши изучалась по экологическим [4, 5], морфологическим [6, 7] и кариологическим признакам [8], а также селективно значимым белковым маркерам [6, 9–15]. С наступлением XXI в. популяционные исследования горбуши преимущественно основывались на различных типах молекулярно-генетических маркеров: митохондриальных [16–19], ядерных селективно-нейтральных микросателлитных локусах [20, 21], адаптивном локусе главного комплекса гистосовместимости MHC-1 [22] и совокупности однонуклеотидных полиморфизмов [23].
Взгляды исследователей на популяционную структуру горбуши достаточно сильно разнятся в деталях, при этом большинство из них сходятся во мнении относительно главных принципов внутривидовой организации данного вида, выделяя несколько иерархических группировок. Иными словами, горбуша, по их мнению, в пределах каждой из линий представлена рядом относительно независимых самовоспроизводящихся локальных группировок. Эти группировки отвечают популярной в ихтиологии концепции локального стада [11, 24–26], которая в настоящее время лежит в основе стратегии популяционных исследований всех тихоокеанских лососей и практических рекомендаций по их рациональному использованию.
Основная цель настоящего исследования заключается в сравнительном изучении митохондриального полиморфизма двух линий горбуши и оценке уровня дифференциации локальных и сезонных группировок внутри них. В связи с этим при подборе материала для работы мы руководствовались следующими принципами: 1) анализ одинакового числа выборок из каждой линии, а именно: 15 выборок четных лет нереста и 15 – нечетных; 2) представленность всех основных регионов воспроизводства горбуши Дальнего Востока России для обеих линий; 3) для каждого региона – изучение равного числа выборок, в ряде случаев позволившее провести сравнение сборов разных лет для конкретных локальных стад и разных сроков их нерестового хода, т.е. разных сезонных рас (табл. 1), и на этой основе оценить стабильность дифференциации групп в поколениях.
Таблица 1.
Характеристика исследованного материала
| Регион | Место сбора | Выборки четных лет нереста | Выборки нечетных лет нереста | ||||
|---|---|---|---|---|---|---|---|
| обозначение | даты сбора | объем выборки | обозначение | даты сбора | объем выборки | ||
| Чукотка | Мейныпильгынская озерно-речная система | CHUK14 | 02–15.07.2014 | 30 | CHUK13 | 21.06–18.07.2013 | 30 |
| Восточная Камчатка | р. Апука | APU06 | 02–04.08.2006 | 31 | APU07 | 02.07.2007 | 30 |
| APU16E | 23.06–09.07.2016 | 32 | APU15Е | 22.06-05.07.2015 | 32 | ||
| APU16L | 31.07.2016 | 32 | APU15L | 02–08.08.2015 | 32 | ||
| Магадан | р. Тауй | TAUI12 | 16.07.2012 | 27 | TAUI11 | 15.07.2011 | 45 |
| TAUI16 | 19.07.2016 | 29 | TAUI17 | 27.07.2017 | 32 | ||
| Западная Камчатка | р. Большая | BOL06 | 09.08.2006 | 27 | BOL09 | 06.08.2009 | 32 |
| BOL10 | 24.07.2010 | 30 | BOL11 | 27–28.07.2011 | 31 | ||
| BOL12 | 02.08.2012 | 31 | BOL13 | 2013 г. | 32 | ||
| Хабаровский край |
р. Амур | AMUR10 | 15.07.2010 | 29 | AMUR09 | 2009 г. | 32 |
| р. Ботчи | BOT18 | 12–17.07.2018 | 31 | BOT19 | 10–16.07.2019 | 32 | |
| Сахалин | р. Поронай | POR10 | 30.07.2010 | 31 | POR09 | 31.07.2009 | 28 |
| Южные Курилы | р. Курилка (KUR)/ Курильский залив (KURZ) | KUR14 | 15.09.2014 | 33 | KUR13E | 09.08.2013 | 44 |
| KURZ16 | 15.08.2016 | 31 | KUR13L | 27.09.2013 | 48 | ||
| KURZ18 | 19.08.2018 | 31 | KUR15 | 27.08.2015 | 32 | ||
Работа посвящена изучению полиморфизма митохондриального гена cytb в популяциях азиатской горбуши и представляет собой первое исследование, охватывающее все основные регионы воспроизводства этого вида на Дальнем Востоке России.
МАТЕРИАЛЫ И МЕТОДЫ
Материал для молекулярно-генетического анализа азиатских стад был собран сотрудниками ФГБНУ “ВНИРО” в период с 2006 по 2019 гг. (табл. 1). Все изученные особи горбуши были выловлены в реках или в их приустьевом пространстве в преднерестовом состоянии.
Выделение и очистку тотальной ДНК из тканей плавников или сердца исследуемых особей горбуши проводили методом адсорбции на микроколонках AcroPrep™ 96 filter plate, 1 mL ‒ 1.0 μm, glass fiber media (PALL, США), основываясь на методике, описанной ранее [27].
Амплификацию гена cytb и постановку сиквенс-реакции осуществляли в соответствии с опубликованной методикой [28]. Секвенирование проводили на приборе ABI Prism Genetic Analyzer 3500 (Applied Biosystems, США).
Для обработки результатов секвенирования и множественного выравнивания последовательностей использовали пакет программ Geneous 6.0.5 [29]. Филогенетические отношения между гаплотипами визуализировали в программе PopArt [30] с применением алгоритма TCS [31]. Генетическое разнообразие, молекулярную дисперсию и уровень дифференциации выборок на основании вероятностного теста [32] оценивали в программе Arlequin v3.5.1.3 [33].
Для графического представления и выделения генетически близких групп выборок вычисляли попарное генетическое сходство (r) между выборками [34] по данным о частотах 12 гаплотипов (А1–А6, В1–В6), а затем собственные векторы (“главные координаты”) корреляционной матрицы значений r [35] с дальнейшим вращением методом Varimax с использованием компьютерного пакета SPSS [36].
РЕЗУЛЬТАТЫ
Исследуемый фрагмент длиной 1018 пн соответствовал позициям 15577–16594 полного митохондриального генома горбуши (GenBank #EF455489) и позициям 74‒1094 гена cytb. Суммарно в совокупности образцов выявлено 73 гаплотипа. В пределах линии горбуши четных лет нереста обнаружено 53 гаплотипа, а в нечетных – 33; при этом только 13 присутствовали в обеих линиях. Полученные последовательности депонированы в Генбанк под номерами, указанными в Приложении. Для облегчения восприятия материала названия гаплотипов в Приложении и на рисунках приведены в сокращенном варианте: A1 вместо OG-A1, В1 вместо OG-В1 и т.д. Гаплотипический состав выборок представлен в Приложении.
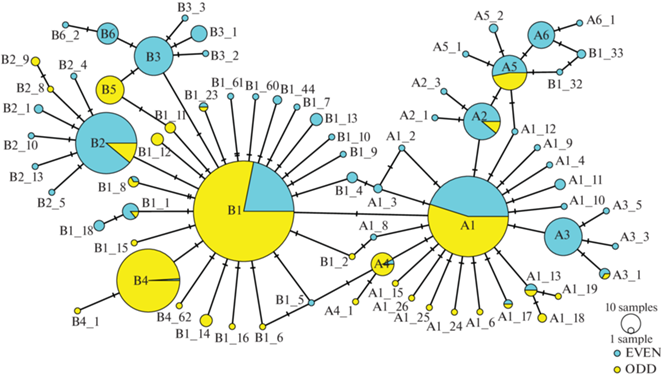
Анализ гаплотипической сети, построенной с применением алгоритма кластеризации TCS (рис. 1), позволяет разделить все 73 последовательности на две основные группы A и B с центральными гаплотипами OG-A1 и OG-B1 соответственно. Помимо этого внутри каждой из этих совокупностей было выявлено некоторое количество массовых гаплотипов, являющихся центральными для своих гаплогрупп А2, А3, А4, А5, А6, В2, В3, В4, В5, В6. Как следует из рис. 1 и Приложения, только 7 из 12 центральных гаплотипов присутствуют в обеих линиях горбуши, причем лишь два из них, OG-A1 и OG-B1, встречаются массово практически во всех выборках как в четные, так и в нечетные годы. Гаплотипы OG-A2, OG-A5 и OG-B2 существенно преобладают в линии четных лет нереста, но при этом были отмечены по крайней мере у нескольких рыб другой линии. Гаплотипы OG-A4 и OG-B4, за единичными исключениями, характерны только для нечетной линии горбуши. Оставшиеся пять центральных гаплотипов присущи лишь одной из линий: OG-A3, OG-A6, OG-B3 и OG-B2 – линии четных лет нереста, а OG-B5–линии нечетных.
Рис. 1.
Сеть гаплотипов cytb горбуши, построенная с применением алгоритма кластеризации TCS. Для каждого гаплотипа показана доля особей четных и нечетных лет нереста.
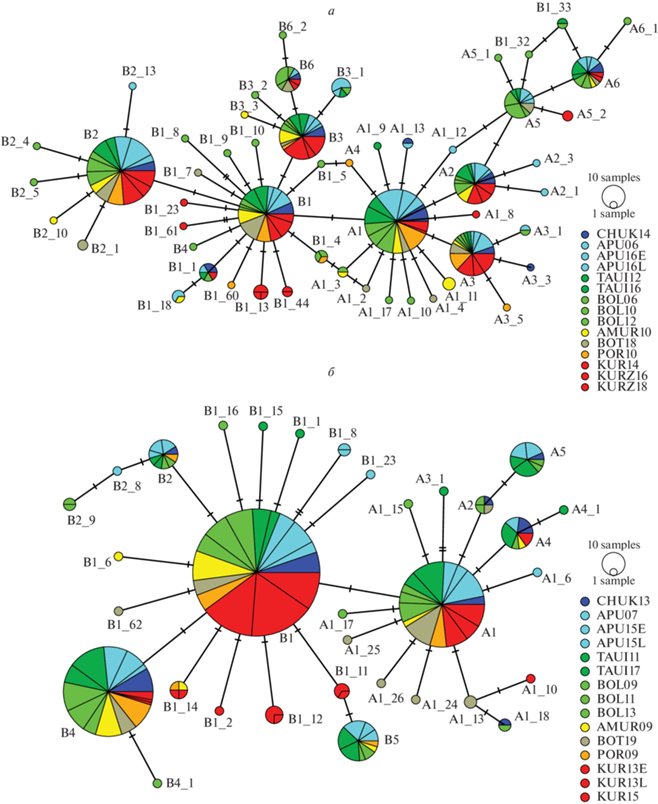
Анализ вариабельности гена cytb и сравнительная оценка основных параметров генетической изменчивости в двух линиях горбуши указывают на заметно более высокий митохондриальный полиморфизм горбуши четных лет нереста (табл. 2). Это наглядно подтверждается при сопоставлении TCS-сетей гаплотипов (рис. 2), построенных для каждой из линий в отдельности. Сеть гаплотипов “четной” горбуши значительно разветвленнее, в ней можно выделить большее количество гаплогрупп и массовых гаплотипов, распространенных по всему ареалу или на значительной его части. В случае нечетной линии горбуши, напротив, широкое распространение на ареале характерно только для трех гаплогрупп А1, В1 и В4, центральные гаплотипы которых присутствуют во всех регионах воспроизводства.
Таблица 2.
Полиморфизм последовательности гена cytb в выборках горбуши. Обозначения выборок приведены в соответствии с табл. 1
| Линия горбуши четных лет нереста | Линия горбуши нечетных лет нереста | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Выборка | N | H | S | π × 100 | h | Pi | Выборка | N | H | S | π × 100 | h | Pi |
| CHUK14 | 30 | 11 | 10 | 0.1994 | 0.9034 | 2.029885 | CHUK13 | 30 | 8 | 8 | 0.1425 | 0.777 | 1.450575 |
| APU06 | 31 | 13 | 12 | 0.2459 | 0.9204 | 2.503226 | APU07 | 30 | 9 | 10 | 0.1685 | 0.823 | 1.714943 |
| APU16E | 32 | 10 | 8 | 0.1836 | 0.8367 | 1.868952 | APU15E | 32 | 7 | 8 | 0.1143 | 0.744 | 1.163306 |
| APU16L | 32 | 12 | 11 | 0.2056 | 0.8387 | 2.092742 | APU15L | 32 | 7 | 9 | 0.1763 | 0.8165 | 1.794355 |
| TAUI12 | 27 | 12 | 10 | 0.2228 | 0.9088 | 2.267806 | TAUI11 | 45 | 10 | 12 | 0.184 | 0.8182 | 1.872727 |
| TAUI16 | 29 | 8 | 7 | 0.1669 | 0.8498 | 1.699507 | TAUI17 | 32 | 7 | 8 | 0.1767 | 0.8226 | 1.798387 |
| BOL06 | 27 | 17 | 15 | 0.2569 | 0.9487 | 2.615385 | BOL09 | 32 | 6 | 8 | 0.1048 | 0.6714 | 1.066532 |
| BOL10 | 30 | 14 | 13 | 0.2658 | 0.9057 | 2.705747 | BOL11 | 31 | 7 | 7 | 0.1052 | 0.714 | 1.070968 |
| BOL12 | 31 | 16 | 12 | 0.226 | 0.9118 | 2.301075 | BOL13 | 32 | 12 | 14 | 0.1751 | 0.8448 | 1.782258 |
| AMUR10 | 29 | 12 | 13 | 0.2057 | 0.9163 | 2.093596 | AMUR09 | 32 | 7 | 6 | 0.0913 | 0.6653 | 0.929435 |
| POR10 | 31 | 12 | 11 | 0.2036 | 0.8882 | 2.073118 | POR09 | 28 | 6 | 6 | 0.1091 | 0.746 | 1.111111 |
| BOT18 | 31 | 9 | 8 | 0.1496 | 0.8344 | 1.522581 | BOT19 | 32 | 9 | 8 | 0.124 | 0.8004 | 1.262097 |
| KUR14 | 33 | 7 | 6 | 0.1793 | 0.8352 | 1.825758 | KUR13E | 44 | 6 | 5 | 0.0657 | 0.537 | 0.669133 |
| KURZ16 | 31 | 13 | 13 | 0.2159 | 0.9161 | 2.197849 | KUR13L | 48 | 8 | 8 | 0.0576 | 0.4583 | 0.585993 |
| KURZ18 | 31 | 11 | 11 | 0.2146 | 0.8774 | 2.184946 | KUR15 | 32 | 4 | 3 | 0.0614 | 0.5544 | 0.625 |
| Среднее | 11.8 | 10.67 | 0.2094 | 0.8861 | 2.132145 | Среднее | 7.53 | 8 | 0.1238 | 0.7195 | 1.259788 | ||
Рис. 2.
Гаплотипическая сеть cytb горбуши четных (а) и нечетных (б) лет нереста, построенная с применением алгоритма кластеризации TCS. Для каждого гаплотипа отмечены доли особей из различных выборок, обозначенных в соответствии с табл. 1. Выборки из рек разных регионов Дальнего Востока России представлены различными цветами: Чукотка – темно-синий, Восточная Камчатка – светло-бирюзовый, Магаданское побережье – темно-зеленый, Западная Камчатка – светло-зеленый, р. Амур – светло-желтый, Северное Приморье (р. Ботчи) – серый, Сахалин – оранжевый, Южные Курилы – красный. Размер круга соответствует количеству особей, несущих данных гаплотип.
Анализ молекулярной дисперсии, результаты которого представлены в табл. 3, был выполнен как для всей совокупности особей, так и для каждой из линий в отдельности. Как и следовало ожидать, при всех вариантах анализа наибольшая доля генетического разнообразия приходится на его внутрипопуляционную компоненту. В случае исследования горбуши обеих линий она составила 87.52%, при этом различия между “четной” и “нечетной” горбушей (9.33%) превышали межпопуляционную изменчивость в пределах каждой из линий (3.16%). При проведении расчетов для каждой из линий по отдельности выраженная межпопуляционная изменчивость (6.07%) была обнаружена только у горбуши нечетных лет нереста.
Таблица 3.
Результаты оценки молекулярной дисперсии AMOVA
| ОБЕ ЛИНИИ | |||||
|---|---|---|---|---|---|
| Уровень различий | d.f. | Сумма квадратов | Дисперсия | % дисперсии | Индекс фиксации |
| Между группами | 1 | 21.175 | 0.04216 | 9.33 | FCT: 0.09326 |
| Между популяциями внутри групп | 28 | 23.945 | 0.01427 | 3.16 | FSC: 0.03482 |
| Внутри популяций | 937 | 370.711 | 0.39564 | 87.52 | FST: 0.12484 |
| Всего | 966 | 415.831 | 0.45207 | ||
| ЧЕТНАЯ ЛИНИЯ | |||||
| Уровень различий | d.f. | Сумма квадратов | Дисперсия | % дисперсии | Индекс фиксации |
| Между популяциями | 14 | 16.454 | 0.00371 | 0.35 | FST: 0.00348 |
| Внутри популяций | 440 | 467.612 | 1.06275 | 99.65 | |
| Всего | 454 | 484.066 | 1.06647 | ||
| НЕЧЕТНАЯ ЛИНИЯ | |||||
| Уровень различий | d.f. | Сумма квадратов | Дисперсия | % дисперсии | Индекс фиксации |
| Между популяциями | 14 | 15.873 | 0.02289 | 6.07 | FST: 0.06069 |
| Внутри популяций | 497 | 176.047 | 0.35422 | 93.93 | |
| Всего | 511 | 191.920 | 0.37711 |
Четкую дифференциацию между линиями четных и нечетных лет азиатской горбуши также демонстрируют главные координаты, построенные по данным о частотах гаплотипов мтДНК (рис. 3). Отличие прослеживается по всем трем главным координатам, на которые приходится 96.7% всей изменчивости. Оценка уровня межвыборочных различий с помощью вероятностного теста (табл. 4) в пределах каждой из линий указывает на статистически значимую дифференциацию южнокурильских популяций горбуши нечетных лет нереста от прочих выборок этого поколения, что и обусловливает межпопуляционную изменчивость “нечетной горбуши”, выявленную тестом AMOVA.
Рис. 3.
Кластеризация выборок горбуши линий нечетных (круги) и четных (треугольники) лет нереста. Вклад трех главных координат в общую изменчивость представлен по осям. Цвета, обозначающие региональную принадлежность выборок, приведены в легенде к рис. 2.
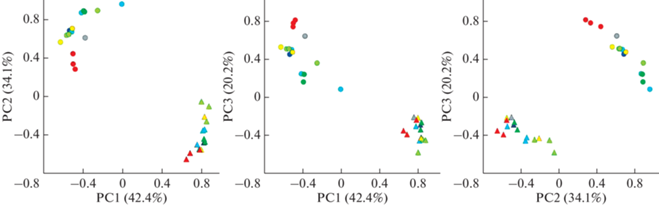
Таблица 4.
Результаты вероятностного теста (exact test) на попарную дифференцированность выборок горбуши четных (А) и нечетных (Б) лет нереста – под диагональю; уровень статистической достоверности различий (* P < 0.05, ** P < 0.01, *** P < 0.001; NS – различия недостоверны) – над диагональю. Статистически достоверные различия отмечены полужирным курсивом
| А | |||||||||||||||
| CHUK14 | APU06 | APU16E | APU16L | TAUI12 | TAUI16 | BOL06 | BOL10 | BOL12 | AMUR10 | BOT18 | POR10 | KUR14 | KURZ16 | KURZ18 | |
| CHUK14 | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | * | NS | NS | |
| APU06 | 0.301 | NS | NS | NS | NS | NS | * | NS | NS | NS | NS | ** | NS | * | |
| APU16E | 0.819 | 0.056 | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | |
| APU16L | 0.562 | 0.128 | 0.65 | NS | NS | NS | NS | NS | NS | NS | NS | *** | NS | ** | |
| TAUI12 | 0.971 | 0.619 | 0.559 | 0.762 | NS | NS | NS | NS | NS | NS | NS | * | NS | NS | |
| TAUI16 | 0.892 | 0.104 | 0.967 | 0.731 | 0.822 | NS | NS | NS | NS | NS | NS | NS | NS | * | |
| BOL06 | 0.758 | 0.528 | 0.483 | 0.855 | 0.953 | 0.434 | NS | NS | NS | NS | NS | *** | NS | ** | |
| BOL10 | 0.068 | 0.013 | 0.264 | 0.298 | 0.108 | 0.080 | 0.771 | NS | ** | * | NS | *** | * | *** | |
| BOL12 | 0.873 | 0.079 | 0.936 | 0.942 | 0.750 | 0.873 | 0.952 | 0.452 | NS | NS | NS | * | NS | * | |
| AMUR10 | 0.663 | 0.158 | 0.318 | 0.131 | 0.740 | 0.705 | 0.275 | 0.009 | 0.458 | * | NS | NS | NS | NS | |
| BOT18 | 0.208 | 0.105 | 0.206 | 0.232 | 0.159 | 0.184 | 0.098 | 0.013 | 0.139 | 0.049 | NS | ** | NS | ** | |
| POR10 | 0.191 | 0.247 | 0.192 | 0.059 | 0.477 | 0.177 | 0.391 | 0.130 | 0.083 | 0.119 | 0.178 | ** | NS | * | |
| KUR14 | 0.039 | 0.003 | 0.091 | 0.001 | 0.028 | 0.076 | 0.001 | 0.000 | 0.013 | 0.095 | 0.003 | 0.007 | NS | NS | |
| KURZ16 | 0.931 | 0.354 | 0.780 | 0.163 | 0.832 | 0.807 | 0.521 | 0.046 | 0.509 | 0.674 | 0.275 | 0.556 | 0.224 | NS | |
| KURZ18 | 0.074 | 0.019 | 0.084 | 0.002 | 0.053 | 0.033 | 0.009 | 0.001 | 0.022 | 0.080 | 0.003 | 0.029 | 0.962 | 0.371 | |
| Б | |||||||||||||||
| CHUK13 | APU07 | APU15E | APU15L | TAUI11 | TAUI17 | BOL09 | BOL11 | BOL13 | AMUR09 | BOT19 | POR09 | KUR13E | KUR13L | KUR15 | |
| CHUK13 | * | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | *** | *** | * | |
| APU07 | 0.013 | ** | NS | NS | NS | *** | ** | NS | *** | NS | * | *** | *** | ** | |
| APU15E | 0.409 | 0.01 | NS | * | NS | NS | NS | NS | NS | * | NS | *** | *** | NS | |
| APU15L | 0.203 | 0.111 | 0.552 | NS | NS | NS | NS | NS | NS | * | NS | *** | *** | ** | |
| TAUI11 | 0.068 | 0.149 | 0.014 | 0.275 | NS | ** | * | NS | *** | * | NS | *** | *** | *** | |
| TAUI17 | 0.136 | 0.166 | 0.345 | 0.995 | 0.125 | NS | NS | NS | NS | * | NS | *** | *** | ** | |
| BOL09 | 0.467 | 0.001 | 0.426 | 0.133 | 0.002 | 0.092 | NS | NS | NS | * | NS | *** | *** | * | |
| BOL11 | 0.935 | 0.007 | 1 | 0.331 | 0.036 | 0.226 | 0.932 | NS | NS | NS | NS | ** | *** | NS | |
| BOL13 | 0.423 | 0.438 | 0.674 | 0.721 | 0.086 | 0.735 | 0.175 | 0.734 | NS | NS | NS | ** | *** | NS | |
| AMUR09 | 0.604 | 0 | 0.625 | 0.092 | 0.001 | 0.07 | 1 | 0.929 | 0.111 | ** | NS | *** | *** | * | |
| BOT19 | 0.048 | 0.064 | 0.04 | 0.029 | 0.022 | 0.031 | 0.018 | 0.083 | 0.503 | 0.008 | NS | *** | *** | * | |
| POR09 | 0.428 | 0.021 | 0.726 | 0.519 | 0.25 | 0.294 | 0.361 | 0.892 | 0.794 | 0.414 | 0.288 | *** | *** | * | |
| KUR13E | 0.001 | 0 | 0 | 0 | 0 | 0 | 0.001 | 0.003 | 0.002 | 0.001 | 0 | 0 | NS | NS | |
| KUR13L | 0 | 0 | 0.001 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.557 | NS | |
| KUR15 | 0.011 | 0.002 | 0.055 | 0.004 | 0 | 0.004 | 0.024 | 0.078 | 0.111 | 0.024 | 0.024 | 0.021 | 0.272 | 0.48 | |
ОБСУЖДЕНИЕ
Изучение полиморфизма митохондриальной ДНК традиционно находит широкое применение в филогенетических и филогеографических построениях. Настоящая работа является частью масштабных исследований изменчивости митохондриального гена cytb тихоокеанских лососей рода Oncorhynchus в пределах всего ареала. Сравнительный анализ уровня вариабельности показал, что среди пяти анадромных видов (чавыча, кижуч, нерка, кета, горбуша) этого рода для горбуши характерен наиболее высокий внутривидовой полиморфизм [37, 38]. Большинство гаплотипов cytb отличаются на одну нуклеотидную замену, что наглядно продемонстрировано на рис. 1; это утверждение касается как массовых гаплотипов, так и происходящих от них минорных.
Линия четных лет нереста более полиморфна по гену cytb, ее гаплотипическая сеть значительно разветвленнее, и число массовых гаплотипов, отмеченных в большинстве регионов, существенно превышает таковое для “нечетной” линии. Этот результат находится в соответствии с данными Л.Т. Бачевской и В.В. Переверзевой [17], полученными ранее при изучении фрагмента этого гена в 2 раза меньшей длины. В то же время согласно результатам ПЦР-ПДРФ полного митохондриального генома горбуши [16] и анализа нуклеотидных последовательностей контрольного региона [20] более высокий уровень полиморфизма наблюдался в линии нечетных лет нереста, а в случае сравнительного исследования комбинированных гаплотипов двух генов мтДНК – ND2 и cytb – этот показатель для обеих линий был одинаков [19]. Таким образом, вариабельность мтДНК в целом выше в линии нечетных лет нереста, а обратный эффект, отмеченный для гена cytb, может быть обусловлен особенностями молекулярной эволюции этого белка и требует дополнительного рассмотрения. Что же касается исследований ядерного генома, аллозимные [15] и микросателлитные [21] маркеры обнаруживали более высокий полиморфизм в “четной” линии, а SNP-локусы [23] – в “нечетной”.
В отношении популяционной структуры вида у горбуши в научной литературе рассматривались различные популяционно-генетические модели, которые, на наш взгляд, можно разделить на три группы.
1. “Модель локальных стад”, согласно которой горбуша дифференцирована на ряд отграниченных друг от друга самовоспроизводящихся группировок, приуроченных к районам нереста и даже к отдельным нерестовым рекам или же к определенным районам морского нагула. К этой же модели можно отнести и взгляды тех исследователей, которые выделяют у горбуши сезонные расы в качестве крупных внутривидовых группировок.
2. “Модель перемешивающихся стад”, согласно которой стада горбуши регулярно обмениваются большим количеством мигрантов, т.е. по сути являются панмиксными [9, 39, 40]. Эта модель была популярна среди американских исследователей в 60–70-е гг. Наши данные по изменчивости митохондриальной ДНК у горбуши не подтверждают и эту гипотезу, поскольку кластеризация выборок горбуши внутри каждой из темпоральных линий все же не хаотична в пространстве и во времени.
3. “Модель флуктуирующих стад”, согласно которой границы и количество самовоспроизводящихся стад горбуши внутри темпоральных линий горбуши не являются константными, а подвержены периодическим изменениям во времени [6]. Эти изменения, на наш взгляд, обусловлены регулярными, иногда значительными, флуктуациями миграционных потоков между локальными стадами горбуши. В соответствии с моделью флуктуирующих стад локальное стадо имеет определенную региональную приуроченность – в смысле районов происхождения составляющих его особей. Однако степень региональной приуроченности локального стада (т.е. процент особей с происхождением из рек этого региона) может значительно меняться из года в год: от полной приуроченности (около 100%) до частичной (80–60% и менее).
Модель флуктуирующих стад далека от гипотезы панмиксии в модели “перемешивающихся стад”: флуктуации миграционных потоков могут происходить асинхронно в разных районах ареала. Следствием этого будет сохранение существовавшей ранее популяционной структуры в одних районах ареала вида и перестройка в других. Иными словами, в одних участках ареала популяционная структура может временно соответствовать панмиксной модели со значительным обменом особей. Со временем ситуация с потоком генов может измениться на противоположную. В частности, массовый стреинг у горбуши может происходить в период смены доминирующей по численности линии [41, 42]. Важнейшими параметрами модели флуктуирующих стад являются интенсивность миграций и периодичность изменения мощности миграционных потоков (соизмеримая с длительностью нескольких генераций). Таким образом, модель флуктуирующих стад в отношении жесткости субпопуляционных границ является как бы промежуточной между моделью локальных стад и моделью перемешивающихся стад. Однако практические следствия из модели флуктуирующих стад (относящиеся к теории прогнозирования численности, оценке запасов, стратегии рациональной эксплуатации, динамике популяционного состава) не будут “промежуточными” и поэтому требуют разработки соответствующей теории [43]. Модель флуктуирующих стад является по своему характеру динамической во времени, а не статической как модели локального стада или перемешивающегося стада.
Как уже отмечалось выше, среди сторонников концепции локальных стад горбуши не существовало единого мнения об их привязанности к элементам пространственно-временной структуры вида. Часть исследователей объединяли в рамках рыбохозяйственного локального стада горбушу, воспроизводящуюся в реках одного крупного региона. Важнейшими региональными стадами азиатской горбуши и по сей день считают: западнокамчатское, восточнокамчатское, амурское, восточносахалинское, южнокурильское [44–46]. Другие ихтиологи полагали, что у азиатской горбуши наиболее крупными являются локальные группировки, связанные с конкретными районами морского нагула – япономорским, охотоморским, беринговоморским [5, 47]. И, наконец, существовала точка зрения, что сезонные расы азиатской горбуши (летняя и осенняя) представляют собой самостоятельные крупные темпоральные группировки [48–51].
Полученные нами результаты однозначно указывают на то, что на всем ареале горбуша представлена в первую очередь двумя независимыми популяционно-генетическими группами – аллохронными линиями четных лет и нечетных лет нереста. Принципиально такой же результат был ранее получен при многомерном анализе морфологических экстерьерных признаков на всем ареале дальневосточной горбуши [6, 7]. Отметим также, что ранее были обнаружены рельефные и устойчивые во времени различия между линиями горбуши четных и нечетных лет нереста по селективно значимым белковым маркерам [9, 10, 12, 52], кариологическим особенностям [8] и молекулярно-генетическим маркерам [16, 18–21, 23].
Очевидно, что существование горбуши на протяжении всего ареала в виде двух темпорально и репродуктивно изолированных группировок – линий четных и нечетных лет нереста – обусловлено ее уникальной внутривидовой структурой. Строго двухлетний жизненный цикл обеспечивается присутствием в каждой из линий единственной возрастной группы (исключения из этого правила столь редки, что могут в данном случае в расчет не приниматься). Таксономический статус и генезис этих темпоральных группировок горбуши будут рассмотрены в последующих публикациях.
Локализация выборок горбуши в пространстве главных координат подтверждает существование устойчивых различий между линиями четных и нечетных лет нереста (рис. 3), при этом никаких обособленных кластеров выборок, приуроченных к определенным участкам ареала (континентам, рекам, более крупным регионам воспроизводства, районам морского нагула) или к сезонным расам, методом многомерного шкалирования выявлено не было. Таким образом, заметной иерархии популяционных группировок горбуши внутри линии четных или нечетных лет нереста по данным анализа митохондриальной ДНК мы не наблюдаем. В то же время в расположении выборок в пространстве главных компонент нет и хаотичности: в линии горбуши нечетных лет нереста прослеживается определенное сходство между южнокурильскими выборками, что было обнаружено и при проведении попарных сравнений выборок (табл. 4Б).
Таким образом, на основании полученных данных популяционная структура у горбуши представляется нам двухуровневой. Первый уровень составляют линии четных и нечетных лет нереста, каждая из которых является самовоспроизводящейся темпоральной группировкой. Второй уровень представлен системой субизолятов, взаимодействующих друг с другом внутри каждой темпоральной линии горбуши. Мы рассчитываем исследовать характер взаимодействий между группировками горбуши в пределах линий, уточнить их статус и определить степень внутрилинейной дифференциации в ходе проводимых исследований полиморфизма ядерной ДНК.
Авторы благодарят Е.В. Голубь, А.В. Гриценко, А.А. Дуленина, А.Н. Ельникова, А.В. Семенихина, О.Н. Сараванского, Т.Ю. Углову и ряд других сотрудников Камчатского, Магаданского и Хабаровского филиалов ФГБНУ “ВНИРО”, принимавших участие в сборе генетического материала.
Работа выполнена при поддержке гранта Минобрнауки РФ (соглашение № 075-15-2021-1084).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Иванков В.Н. О возрастной структуре популяции горбуши // Вопр. ихтиологии. 1965. Т. 5. № 4. С. 662–667.
Bilton H.T., Ricker W.E. Supplementary checks on the scales of pink salmon (Oncorhynchus gorbuscha) and chum salmon (O. keta) // J. Fish. Res. Board of Canada. 1965. V. 22. № 6. P. 1477–1489.
Глубоковский М.К., Марченко С.Л. К вопросу о становлении жизненных стратегий у тихоокеанских лососей Oncorhynchus (Salmonidae) // Вопросы ихтиологии. 2019. Т. 59. № 4. С. 429.
Смирнов А.И. Биология, размножение и развитие тихоокеанских лососей. М.: Изд-во МГУ, 1975. 335 с.
Гриценко О.Ф. О популяционной структуре горбуши Oncorhynchus gorbuscha (Walbaum) // Вопр. ихтиологии. 1981. Т. 21. № 5. С. 787–799.
Глубоковский М.К., Животовский Л.А. Популяционная структура горбуши: система флуктуирующих стад // Биология моря. 1986. Т. 12. № 2. С. 39–44.
Глубоковский М.К. Эволюционная биология лососевых рыб. М.: Наука, 1995. 343 с.
Горшкова Г.В., Горшков С.А. Хромосомный полиморфизм горбуши четных и нечетных лет // Докл. АН СССР. 1983. Т. 273. № 4. С. 1023–1024.
Aspinwall N. Genetic analysis of North American population of the pink salmon (Oncorhynchus gorbuscha) possible evidence for the neutral mutation random drift hypothesis // Evolution. 1974. V. 28. № 2. P. 295–305.
Салменкова Е.А., Омельченко В.Т., Малинина Т.В. и др. Популяционно-генетические различия между смежными поколениями у горбуши, размножающейся в реках азиатского побережья Северной Пацифики // Генетика и размножение морских животных. Владивосток: ДВНЦ АН СССР, 1981. С. 95–104.
Алтухов Ю.П. Генетические процессы в популяциях. М.: Наука, 1983. 279 с.
Beacham I.D., Withlei R.E., Gould A.P. Biochemical genetic stock identification of pink (Oncorhynchus gorbuscha) in southern British Columbia and Puget Sound // Canad. J. Fish. Aquat. Sci. 1985. V. 42. P. 1474–1483.
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т. и др. Балансирующий отбор как возможный фактор поддержания единообразия аллельных частот ферментных локусов в популяциях тихоокеанского лосося – горбуши Oncorhynchus gorbuscha (Walbaum) // Генетика. 1987. Т. 23. № 10. С. 1884–1896.
Кирпичников В.С. Генетические исследования тихоокеанских лососей // Журн. общей биологии. 1990. Т. 51. № 1. С. 1–15.
Hawkins S.L., Varnavskaya N.V., Matzak E.A. et al. Population structure of odd-broodline Asian pink salmon and its contrast to the even-broodline structure // J. Fish Biology. 2002. V. 60. P. 370–388. https://doi.org/10.1006/jfbi.2001.1850
Churikov D., Gharrett A.J. Comparative phylogeography of the two pink salmon broodlines: an analysis based on a mitochondrial DNA genealogy // Mol. Ecol. 2002. V. 11. № 6. P. 1077–1101. https://doi.org/10.1046/j.1365-294x.2002.01506.x
Бачевская Л.Т., Переверзева В.В. Изменчивость гена цитохрома b митохондриальной ДНК горбуши Oncorhynchus gorbuscha (Walbaum) из рек материкового побережья Охотского моря и острова Завьялова // Изв. РАН. Сер. биол. 2013. № 1. С. 15–23.
Sato S., Urawa S. Genetic variation of Japanese pink salmon populations inferred from nucleotide sequence analysis of the mitochondrial DNA control region // Environ. Biol. Fish. 2017. V. 100. P. 1355–1372. https://doi.org/10.1007/s10641-017-0648-4
Podlesnykh A.V., Kukhlevsky A.D., Brykov V.A. A comparative analysis of mitochondrial DNA genetic variation and demographic history in populations of even and odd-year broodline pink salmon, Oncorhynchus gorbuscha (Walbaum, 1792), from Sakhalin Island // Environ. Biol. Fish. 2020. V. 103. P. 1553–1564. https://doi.org/10.1007/s10641-020-01040-0
Салменкова Е.А., Гордеева Н.В., Омельченко В.Т. и др. Генетическая дифференциация горбуши Oncorhynchus gorbuscha Walbaum в азиатской части ареала // Генетика. 2006. Т. 42. № 10. С. 1371–1388.
Beacham T.D., McIntosh B., MacConnachie C. et al. Population structure of pink salmon (Oncorhynchus gorbuscha) in British Columbia and Washington, determined with microsatellites // Fish Bull. 2012. V. 110. № 2. P. 242–256.
Гордеева Н.В. Высокие оценки дифференциации популяций горбуши Oncorhynchus gorbuscha по локусу главного комплекса гистосовместимости MHC_I A1 поддерживают гипотезу “локальных стад” // Вопр. ихтиологии. 2012. Т. 52. № 1. С. 72–81.
Tarpey C.M., Seeb J.E., McKinney G.J. et al. Single-nucleotide polymorphism data describe contemporary population structure and diversity in allochronic lineages of pink salmon (Oncorhynchus gorbuscha) // Can. J. Fisheries and Aquatic Sci. 2018. V. 75. № 6. P. 987–997. https://doi.org/10.1139/cjfas-2017-0023
Ricker W.E. Hereditary and environmental factors affecting certain salmonid populations // The Stock Concept in Pacific Salmon. H.R. MacMillan Lectures in Fisheries. Vancouver: Univ. Brit. Columbia Press, 1972. P. 19–160.
Алтухов Ю.П. Популяционная генетика рыб. М.: Пищевая промышленность, 1974. 245 с.
Коновалов С.М. Популяционная биология тихоокеанских лососей. Л.: Наука, 1980. 247 с.
Ivanova N.V., deWaard J., Hebert P.D.N. An inexpensive, automation-friendly protocol for recovering high-quality DNA // Mol. Ecol. Notes. 2006. V. 6. P. 998–1002. https://doi.org/10.1111/j.1471-8286.2006.01428.x
Сошнина В.А., Павлов С.Д., Зеленина Д.А. Генетическое разнообразие гольцов Командорских островов по результатам исследования митохондриальной ДНК // Генетика. 2016. Т. 52. № 11. С. 1336–1341.
Kearse M., Moir R., Wilson A. et al. Geneious Basic: An integrated and extendable desktop software platform for the organization and analysis of sequence data // Bioinformatics. 2012. V. 28. № 12. P. 1647–1649. https://doi.org/10.1093/bioinformatics/bts199
Leigh J.W., Bryant D. PopART: Full-feature software for haplotype network construction // Methods Ecol. Evol. 2015. V. 6. № 9. P. 1110–1116. https://doi.org/10.1111/2041-210X.12410
Clement M., Posada D., Crandall K.A. TCS: A computer program to estimate gene genealogies // Mol. Ecol. 2000. V. 9. P. 1657–1659.
Raymond M., Rousset F. An exact test for population differentiation // Evolution. 1995. V. 49. № 6. P. 1280–1283. https://doi.org/10.2307/2410454
Excoffier L., Lischer H.E.L. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Res. 2010. V. 10. P. 564–567. https://doi.org/10.1111/j.1755-0998.2010.02847.x
Животовский Л.А. Показатель сходства популяций по полиморфным признакам // Журн. общей биологии. 1979. Т. 40. № 4. С. 587–602.
Zhivotovsky L.A., Rosenberg N.A., Feldman M.W. Features of evolution and expansion of modern humans inferred from genome-wide microsatellite markers // Amer. J. Hum. Genet. 2003. V. 72. № 5. P. 1171–1186. https://doi.org/10.1086/375120
George D., Mallery P. SPSS for Windows Step by Step. Boston: Pearson, 2005. 386 p.
Зеленина Д.А., Сошнина В.А., Минеева Т.М., Стоклицкая Д.С. Внутривидовой митохондриальный полиморфизм и сравнительная филогеография тихоокеанских лососей рода Оncorhynchus // Водные биологические ресурсы России: состояние, мониторинг, управление. Сб. материалов Всерос. науч. конф. с международным участием, посвященной 85-летию Камчатского научно-исслед. ин-та рыбного хозяйства и океанографии (3–6 октября 2017 г., Петропавловск-Камчатский). Петропавловск-Камчатский: КамчатНИРО, 2017. С. 167–171. https://doi.org/10.15853/978-5-902210-51-1
Зеленина Д.А., Сошнина В.А., Сергеев А.А. Филогеография и митохондриальный полиморфизм кижуча азиатских стад // Мол. биология. 2020. Т. 54. № 6. С. 997–1005. https://doi.org/10.31857/S0026898420060166
Vernon E.H. Pink salmon populations of the Fraser River system // Symp. on Pink Salmon. Vancouver: Univ. Brit. Columbia Press, 1962. P. 53–58.
Neave F. Ocean migration of Pacific salmon // J. Fish. Res. Board Canada. 1964. V. 21. № 5. P. 1227–1244.
Каев А.М., Животовский Л.А. Новые данные к дискуссии о локальных и флуктуирующих стадах горбуши Oncorhynchus gorbuscha // Изв. ТИНРО. 2016. Т. 187. С. 122–144.
Каев А.М., Животовский Л.А. О вероятном перераспределении горбуши Oncorhynchus gorbuscha между районами воспроизводства разных стад // Вопр. ихтиологии. 2017. Т. 57. № 3. С. 264–274. https://doi.org/10.7868/S0042875217030080
Животовский Л.А., Глубоковский М.К. Дальневосточная горбуша: два взгляда – два решения // Рыбное хозяйство. 1989. № 7. С. 57–60.
Кагановский А.Г. Некоторые вопросы биологии и динамики численности горбуши // Изв. ТИНРО. 1949. Т. 31. С. 3–57.
Ishida T. Salmon of the North Pacific Ocean. 2. Pink salmon in the Far East // Bull. INPFC. 1967. № 23. P. 9–23.
Бирман И.Б. Морской период жизни и вопросы динамики стада тихоокеанских лососей. М.: Агропромиздат, 1985. 208 с.
Takagi K., An K.V., Haitt A.C., Dell M.B. Distribution and origin of pink salmon (Oncorhynchus gorbuscha) offshore waters of the North Pacific Ocean // Bull. INPFC. 1981. № 40. P. 1–196.
Иванков В.Н. О сезонных расах горбуши // Изв. ТИНРО. 1967. Т. 61. С. 143–151.
Иванков В.Н. Своеобразие популяционной структуры вида у горбуши и рациональное хозяйственное использование этого лосося // Биология моря. 1986. № 2. С. 44–49.
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т., Ефанов В.Н. Генетическая дифференциация и популяционная структура горбуши Сахалино-Курильского региона // Биология моря. 1983. Т. 9. № 2. С. 46–51.
Ионов А.В. Биологическая неоднородность горбуши Oncorhynchus gorbuscha (Walbaum) материкового побережья Охотского моря // Биология пресноводных рыб Дальнего Востока. Владивосток: ДВО АН СССР, 1987. С. 35–48.
Животовский Л.А., Глубоковский М.К., Викторовский Р.М. и др. Генетическая дифференциация горбуши // Генетика. 1989. Т. 25. № 7. С. 1261–1274.
Дополнительные материалы отсутствуют.


