Генетика, 2022, T. 58, № 3, стр. 247-266
Роль CAG- и GGC-полиморфизма гена рецептора андрогенов в мужской фертильности
Л. В. Осадчук 1, *, А. В. Осадчук 1
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
* E-mail: losadch@bionet.nsc.ru
Поступила в редакцию 06.08.2021
После доработки 02.09.2021
Принята к публикации 21.09.2021
- EDN: BJPUAW
- DOI: 10.31857/S0016675822020114
Аннотация
Вопрос о генетических причинах глобального снижения мужской фертильности, наблюдаемого в последние десятилетия во многих странах, находится в числе горячих точек репродуктивной генетики. Одной из причин мужского бесплодия и субфертильности является нарушение гормональной регуляции репродуктивных процессов. Андрогены, которые секретируются клетками Лейдига семенников, необходимы для половой дифференцировки, пубертатного развития, сперматогенеза и сексуального поведения. Многие физиологические функции андрогенов опосредованы андрогеновым рецептором (АR), который принадлежит к семейству рецепторов стероидных гормонов, а ген, кодирующий АR, локализован на длинном плече хромосомы Х (локус Xq12). Ген AR в экзоне 1 имеет два полиморфных тринуклеотидных повтора (CAG и GGC). Связь полиморфизма (CAG)n и (GGС)n гена AR с различными заболеваниями интенсивно изучается, включая мужское бесплодие и нарушение сперматогенеза. Цель настоящего обзора – обобщить современные взгляды на роль CAG- и GGC-полиморфизма гена АR в мужской фертильности, систематизировать результаты популяционных исследований по этнической изменчивости длины АR CAG- и GGС-повторов и ассоциации с мужским бесплодием, параметрами сперматогенеза и продукцией андрогенов. Имеющиеся данные подтверждают ассоциацию CAG- и GGC-повторов гена AR с риском мужского бесплодия и патозооспермией, а идентификация числа повторов может быть эффективным способом оценки риска мужского бесплодия и контроля гормональной терапии андрогенами.
В настоящее время глобальный демографический кризис в промышленно развитых странах, включая Россию, сочетается со снижением мужского репродуктивного потенциала, что выражается в уменьшении концентрации и доли подвижных и морфологически нормальных сперматозоидов в эякуляте, увеличении доли мужского фактора в бесплодных парах и росте врожденных аномалий мужской репродуктивной системы, приводящих к бесплодию [1–5]. Особенную озабоченность вызывает рост мужского бесплодия, распространенность которого в общей популяции по приблизительным оценкам достигает 7.0%, а доля известных генетических факторов, ассоциированных с мужским бесплодием, составляет около 20–25% [6].
Учитывая возрастающие риски, связанные с воспроизводством населения, в различных странах проводятся популяционные исследования мужской фертильности, которые привели к выводу, что регион проживания и этническая принадлежность являются важными детерминантами мужской фертильности [7–14]. Считается, что изменчивость параметров мужской фертильности могут определять экологические (загрязнение окружающей среды), социальные (индивидуальный образ жизни) и генетические факторы, однако 30–40% мужского бесплодия остается с невыясненными причинами и обозначается как идиопатическое бесплодие [15]. Хотя достижения в области диагностики бесплодия в последние годы постепенно снижают долю мужчин, страдающих идиопатическим бесплодием, предполагается, что вклад генетических факторов в идиопатическое мужское бесплодие остается значительным [6].
Вопрос о генетических причинах глобального снижения мужской фертильности находится в числе горячих точек репродуктивной генетики. Генетический фон мужского бесплодия очень сложен, и более 2300 генов вовлечены в генетический контроль сперматогенеза [16]. Известные к настоящему времени генетические факторы, влияющие на мужскую репродуктивную функцию, можно распределить на три этиологические категории: 1) гены, ассоциированные с качественными и количественными изменениями сперматогенеза; 2) гены, ассоциированные с дисфункцией гипоталамо-гипофизарной оси; 3) гены, ассоциированные с периферической обструкцией или дисфункцией [6]. Считается, что 10–15% случаев тяжелых нарушений мужской репродуктивной функции обусловлено генетическими причинами [17, 18]. Азооспермия (отсутствие сперматозоидов в эякуляте) представляет наиболее тяжелую форму мужского бесплодия, которая может быть связана как с приобретенными, так и с генетическими факторами. Азооспермия наблюдается приблизительно у 1% мужчин и имеет самый высокий риск генетических нарушений – 25% [6, 18]. Такая высокая частота генетических нарушений мужской репродуктивной функции свидетельствует о ее мультигенном контроле, поскольку единичные гены с выраженным фенотипическим проявлением должны быть подвержены сильному селективному давлению [17]. В мультифакторной патологии репродуктивных потерь генетические нарушения часто играют роль факторов, предрасполагающих к нарушению фертильности, и определяют генетический фон репродуктивного здоровья.
Генетическое тестирование при мужском бесплодии является неотъемлемой частью процесса диагностики и может играть решающую роль при принятии клинических решений. В настоящее время четко документированы следующие наиболее распространенные генетические причины мужского бесплодия: хромосомные аномалии [18, 19], микроделеции AZF локуса Y-хромосомы [18, 20–22], мутации гена трансмембранного регулятора проводимости CFTR [23, 24] и гена рецептора андрогенов AR [25–28]. Анализ ДНК сперматозоидов постепенно входит в клиническую диагностику, поскольку помогает идентифицировать некоторые формы идиопатического мужского бесплодия, причем все большее распространение получает метод оценки фрагментации ДНК сперматозоидов [29]. Медико-генетическое обследование бесплодных мужчин в случае гипогонадотропного гипогонадизма может включать анализ мутаций многих генов на базе NGS-панели [30].
У европейских мужчин с бесплодием частота хромосомных аномалий составляет 2–10%, AZF микроделеций Y-хромосомы – 5–10%, генных мутаций CFTR – 5%, AR – 2–3% [19]. Хромосомные аномалии обнаруживают у 5–6% мужчин с тяжелой формой олигозооспермии и у 12–15% мужчин с необструктивной формой азооспермии [21]. В популяции российских мужчин с бесплодием AZF микроделеции выявлены в 8.2% случаев, гетерозиготное носительство “тяжелых” мутаций гена CFTR обнаружено в 4.7% случаев, “мягкой” мутации (5Т) гена CFTR – 5.3% [31].
Показанием для тестирования бесплодных мужчин на хромосомные аномалии является концентрация сперматозоидов в эякуляте менее 5–10 млн/мл [18, 19]. Хромосомные аномалии у бесплодных мужчин могут быть обусловлены как нарушением числа (например, трисомия в случае синдрома Клайнфельтера), так и структуры хромосом (например, инверсии или транслокации), причем наибольшая частота выявления хромосомных аномалий отмечается у мужчин с азооспермией. По различным оценкам, частота синдрома Клайнфельтера среди бесплодных мужчин составляет около 3%, а в когорте пациентов с необструктивной азооспермией – до 10% [22].
Микроделеции длинного плеча Y-хромосомы – наиболее частая генетическая причина мужского бесплодия, встречается с частотой 1 на 1000–1500 мужчин, причем у 5–10% мужчин с азооспермией и 2–5% мужчин с тяжелой олигоспермией [20, 21]. Три региона локуса AZF Y-хромосомы – AZFа, AZFb и AZFс вовлечены в контроль сперматогенеза, однако выявление конкретных генов-кандидатов еще находится в начальной стадии [20]. Полные делеции субрегионов AZFa или/и AZFb связаны с “тяжелым” тестикулярным фенотипом, синдромом только клеток Сертоли и сперматогенным блоком, а делеции субрегиона AZFc приводят к различному фенотипу, варьируя от азооспермии до олигозооспермии; AZF делеции редко обнаруживаются у мужчин с концентрацией сперматозоидов больше 5 млн/мл.
Мутации гена CFTR – другая частая генетическая причина мужского бесплодия. Известно более 2000 мутаций гена CFTR, который локализован на коротком плече хромосомы 17 и кодирует белок – трансмембранный регулятор проводимости [18, 23, 24]. Пациенты с инактивацией обоих аллелей гена страдают муковисцидозом, причем у 97–98% мужчин наблюдается бесплодие вследствие обструктивной азооспермии, но у пациентов – носителей компаунд-гетерозигот по “тяжелой” и “мягкой” (5Т) мутациям CFTR без муковисцидоза наблюдается врожденное двустороннее отсутствие семявыносящего протока и бесплодие. Скрининг мутаций гена CFTR проводят у бесплодных мужчин с выявленным врожденным отсутствием семявыносящего протока.
Нарушение гормональной регуляции репродуктивных процессов, в частности андрогенами, может быть причиной мужского бесплодия и субфертильности. Многие физиологические эффекты андрогенов опосредованы андрогеновым рецептором (АR). В большинстве случаев нарушение функции АR имеет генетическую природу и проявляется резистентностью тканей-мишеней к андрогенам, поэтому андрогены, даже если они присутствуют в достаточном количестве, не вызывают ожидаемых физиологических эффектов. В гене АR обнаружено более чем 1100 мутаций, большинство из которых относится к заменам, приводящим к трансформациям белков, но описаны делеции всего гена, потери нескольких экзонов, отдельных пар оснований, различные точечные мутации [32]. Подавляющее большинство мутаций гена АR ассоциированы с синдромом тестикулярной феминизации разной степени выраженности, но многие, включая CAG- и GGС-полиморфизм, найдены у мужчин с бесплодием, раком простаты и семенников, а также с гипоспадиями, крипторхизмом, эректильной дисфункцией и нейродегенеративными заболеваниями [22, 26–28, 33, 34].
В настоящее время актуальным становится генетическое тестирование популяций мужчин, которое дает информацию о распространенности и влиянии определенных генетических факторов на мужскую фертильность, позволяет прогнозировать и планировать профилактическую, диагностическую и клиническую работу по репродуктивному здоровью населения в конкретном регионе. Установленный факт временных трендов снижения мужской фертильности предполагает увеличение со временем распространенности генетических факторов мужского бесплодия, что стимулирует и расширяет поиск генетических факторов этих изменений. Ввиду исключительной роли андрогенов и андрогенового рецептора в нормальной физиологии мужского организма, внимание исследователей все больше фокусируется на открытии новых и изучении уже известных мутаций гена AR, вызывающих широкий спектр патологических изменений органов- и тканей-мишеней андрогенов. В этом отношении интересной областью с противоречивыми результатами является выяснение связи CAG- и GGC-полиморфизма гена AR с нарушениями сперматогенеза и идиопатическим мужским бесплодием. Поскольку референсные значения длины CAG- и GGС-повторов гена AR все еще не определены, генотипирование полиморфизма гена AR обладает невысокой диагностической ценностью и поэтому редко используется в клинической диагностической практике. Предполагается, что в ближайшем будущем диагностическое значение этого анализа будет расти, учитывая необходимость оценки длины CAG- и GGС-повторов гена AR при выборе индивидуальной тактики заместительной гормональной терапии [35].
Тринуклеотидные CAG- и GGС-повторы относятся к большому классу повторяющихся последовательностей, широко представленных в геноме человека [36]. Их распределение в геноме показывает видоспецифические и региональные геномные различия. В межгенных областях ди-, тетра- и пентануклеотидные повторы встречаются чаще, чем тринуклеотидные, а три- и гексануклеотидные повторы (CAG, CGG, CCG, CTG и AGG) встречаются чаще в экзонах, кодирующих белки [37]. Особенностью этих коротких тандемных повторов является их генетическая нестабильность, способность к значительному расширению при передаче из поколения в поколение и запуску (провоцированию) ряда заболеваний, известных как болезни расширения триплетных повторов [38].
В данном обзоре мы обобщили современные взгляды на роль полиморфизма (CAG)n и (GGС)n гена AR в мужской фертильности, систематизировали результаты популяционных исследований по частотам распространенности аллелей и ассоциациям между длиной CAG- и GGС-повторов гена AR и мужским бесплодием, параметрами сперматогенеза и продукцией андрогенов в региональном и этническом контексте.
ФУНКЦИИ И СТРУКТУРА АНДРОГЕНОВОГО РЕЦЕПТОРА
У мужчин основная роль андрогенов и эффектов андрогенового рецептора состоит в онтогенетическом формировании и поддержании целостности мужского фенотипа, они необходимы для нормального процесса половой дифференцировки, пубертатного развития, формирования и поддержания вторичных половых признаков, сексуального поведения и продукции сперматозоидов [39–41]. Кроме репродуктивных эффектов андрогены влияют на функции нерепродуктивных тканей, включая костно-мышечную систему, кожные покровы и жировую ткань.
Андрогеновый рецептор – один из важнейших и интенсивно изучаемых стероидных рецепторов из-за его важных физиологических функций и участия в патогенезе многих заболеваний. Мутации гена АR, снижая чувствительность тканей-мишеней к андрогенам, ослабляют физиологические эффекты андрогенов, причем у мужчин из-за гемизиготного статуса гена мутации гена AR прямо влияют на половой созревание и фертильность, они могут происходить спонтанно и передаваться гетерозиготной матерью потомству. Следствием такого андрогенного дефицита являются нарушение сексуального развития, сексуальная дисфункция, заболевания простаты, гипоспадии, гипогонадизм, крипторхизм, недостаточное развитие костной и мышечной массы, а также роста волос на теле, и, наконец, снижение фертильности [26, 32, 33, 40]. Клинические фенотипы у носителей мутаций АR варьируют от нормального мужского фенотипа с мягким нарушением сперматогенеза до синдрома тестикулярной феминизации, т.е. полностью женского фенотипа [26–28, 32–34].
Андрогеновый рецептор принадлежит к семейству ядерных рецепторов стероидных и тиреоидных гормонов и, как и другие члены семейства, способен непосредственно взаимодействовать с ядерной ДНК. Является лиганд-зависимым ядерным транскрипционным фактором, который активируется при связывании с андрогенами (тестостероном и дигидротестостероном) и изменяет экспрессию АR-зависимых генов-мишеней [42]. В отсутствие лиганда АR находится в цитоплазме в комплексе с белком теплового шока и другими белками-шаперонами, но в присутствии лиганда, который диффундирует в клетки и связывается с рецептором, происходит диссоциация белка теплового шока и комплекс андроген–рецептор активно переносится в ядро транспортными белками. Взаимодействуя с определенными регуляторными областями, АR служит фактором транскрипции, регулируя синтез целого ряда белков. Транскрипционная активность андроген-связанных АR модулируется специфическими белками, известными как корегуляторы [43]. Корегуляторы присоединяются к активированному АR лиганд-зависимым способом, чтобы либо повысить (коактиватор), либо подавить (корепрессор) их способность к трансактивации гена-мишени через ремоделирование хроматина и модификацию гистонов. Отметим, что существуют и негеномные эффекты АR, не связанные с регуляцией экспрессии генов.
У мужчин тестостерон абсолютно необходим для инициации и поддержания сперматогенеза, но механизм, с помощью которого тестостерон регулирует процесс сперматогенеза, до конца пока не изучен. В половых клетках AR не экспрессируется и действие тестостерона на сперматогенез осуществляется через клетки Лейдига и Сертоли, перитубулярные миоидные клетки, сосудистые эндотелиальные и сосудистые гладкомышечные клетки, которые экспрессируют андрогеновый рецептор [32, 40]. Тестостерон, продуцируемый клетками Лейдига семенников (содержание тестостерона в семенниках приблизительно в 100 раз выше, чем в сыворотке крови), оказывает аутокринное воздействие на сами клетки Лейдига, а также паракринное воздействие на перитубулярные миоидные клетки, сосудистые эндотелиальные и сосудистые гладкомышечные клетки и клетки Сертоли. Основной клеточной мишенью для тестостерона являются клетки Сертоли (необходимы для развития и выживания мужских зародышевых клеток). Нарушения сперматогенеза могут быть обусловлены нарушением взаимодействия клеток Сертоли с андрогенами; например, при низком уровне андрогеновых рецепторов в клетках Сертоли. Показано, что экспрессия AR в клетках Сертоли зависит от ФСГ, а уровень экспрессии AR ассоциирован с активностью сперматогенеза. Специфические звенья процесса сперматогенеза, которые требуют участия АR, включают поддержание необходимого количества сперматогоний, гемато-тестикулярный барьер, завершение мейоза сперматоцитов, адгезию удлиненных сперматид к клеткам Сертоли, образование зрелых сперматозоидов, формирование просвета семенных канальцев [32, 40, 42]. В мужской репродуктивной системе, кроме семенников, АR экспрессируется в предстательной железе, придатках яичек, семенных пузырьках.
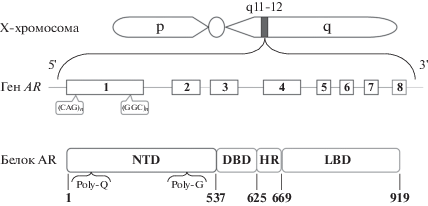
Однокопийный ген, кодирующий АR, локализован на длинном плече Х-хромосомы (локус Xq11-12) вблизи центромеры и содержит восемь экзонов и семь интронов (рис. 1). АR представляет собой фосфопротеин, включающий около 919 аминокислотных остатков и имеющий массу 110 кДа. В структуре АR выделяют три функциональных домена: N-терминальный трансактивационный домен (NTD, кодируется экзоном 1), который характеризуется значительной вариабельностью; ДНК-связывающий домен (DBD, кодируется экзонами 2 и 3), содержащий петлевой участок (HR) из двух цинковых пальцев, непосредственно взаимодействующих со специфическими последовательностями молекулы ДНК в промоторах или энхансерах генов; лиганд-связывающий домен (LBD, кодируется экзонами 4–8). Именно лиганд-связывающий домен запускает дальнейший геномный механизм [42].
Рис. 1.
Схематичное изображение хромосомной локализации (Xq11-12) и структуры гена андрогенного рецептора (АR), а также кодируемого геном белка АR. AR является лиганд-зависимым фактором транскрипции, состоящим из трех функциональных доменов: длинный N-терминальный трансактивационный (NTD), ДНК-связывающий (DBD), содержащий петлевой участок (HR) и C-концевой лиганд-связывающий (LBD). Два локуса полиморфных тринуклеотидных повторов (CAG)n и (GGC)n, расположенных в экзоне 1 гена АR, кодируют тракт полиглутамина (Poly-Q) и полиглицина (Poly-G) белка АR соответственно.
Ген AR в экзоне 1 имеет два тринуклеотидных полиморфных повтора CAG (цитозин–аденин–гуанин) и GGC (гуанин–гуанин–цитозин), которые транскрибируются в различное число аминокислот полиглутамина и полиглицина, т.е. изменчивость размера AR частично обусловлена этими тринуклеотидными повторами. У здоровых мужчин нормальный диапазон CAG-повторов составляет 11–31 триплета и трансактивационная активность AR обратно пропорциональна числу CAG-повторов [42]. Исследования in vitro и in vivo показали, что чем больше длина CAG-повторов, тем слабее трансактивационная способность AR и слабее эффекты андрогенов в тканях-мишенях. Возможные механизмы, лежащие в основе этого явления, могут быть связаны с разным сродством белков-коактиваторов к кодируемому полиглутаминовому тракту белка AR [44]. По-видимому, нормальная функция AR поддерживается в критическом и ограниченном диапазоне числа CAG-повторов. Молекулярное моделирование и анализ взаимосвязи между длиной CAG-тракта и функцией AR выявили критический размер в 16–29 триплетов для поддержания связи между доменами. Выдвинуто предположение, что поскольку большинство мужчин в популяции имеют диапазон CAG-аллелей от 16 до 29 триплетов, то число CAG-повторов за пределами этого диапазона может быть ассоциировано с различными заболеваниями, такими как болезнь Кеннеди, ослабленный сперматогенез, рак простаты [44].
К настоящему времени описаны наследственные заболевания, причиной которых является экспансия тандемных CAG-повторов в гене AR, приводящая к образованию нарушающих третичную структуру белка полиглутаминовых вставок. Примером может служить спинобульбарная мышечная атрофия (болезнь Кеннеди), генетической причиной которой является выраженная экспансия CAG-повторов гена AR, число которых варьирует от 40 до 74 [27, 28, 32, 34]. Степень экспансии повторов положительно коррелирует с выраженностью симптомов заболевания. Клинические признаки заболевания появляются у мужчин после 40 лет, начинаются со слабости рук и тремора пальцев с последующей слабостью жевательных и мимических мышц вплоть до дисфагии. Сниженная чувствительность AR к андрогенам, приводящая к ослабленным эффектам андрогенов, проявляется повышенным уровнем тестостерона и ЛГ, гинекомастией, снижением либидо, эректильной дисфункцией, атрофией яичек, патозооспермией, бесплодием. Вариабельность длины CAG- и GGC-повторов гена AR может сопровождаться различными андроген-зависимыми заболеваниями мужской репродуктивной системы, о которых будет сказано ниже, причем мужчины не только с длинными, но и с короткими CAG-повторами гена AR имеют повышенный риск нарушения сперматогенеза и репродуктивной функции.
Полиморфизм (CAG)n и (GGС)n гена AR, локализованного на Х-хромосоме, напрямую не передается потомству мужского пола, а передается потомству женского пола. Поэтому женские особи будут носителями мутаций (первое поколение), а их потомство мужского пола (второе поколение) будет иметь примерно 50%-ную вероятность наследования мутации полиморфной области.
ВАРИАБЕЛЬНОСТЬ CAG- И GGC-ПОЛИМОРФИЗМА ГЕНА АНДРОГЕНОВОГО РЕЦЕПТОРА В РАЗЛИЧНЫХ ПОПУЛЯЦИЯХ
Европейские популяции (европеоидная раса)
Интенсивные исследования по вариабельности CAG- и GGC-повторов в экзоне 1 гена AR начались в европейских странах в начале XXI столетия на небольших выборках мужчин. В группе французских фертильных мужчин (n = 50) диапазон CAG-повторов составил 17–27 триплетов со средним 22.2 ± 0.5 (mean ± SE) [45]. В группе немецких мужчин с нормоспермией, включая часть субъектов с доказанной фертильностью (n = 131), диапазон CAG-повторов составил 17–30 со средним 20.6 ± 3.0 (mean ± SD) [46]. Аналогичные результаты получены исследователями, которые сравнили количество CAG-повторов у немецких мужчин с доказанной фертильностью и нормальными параметрами эякулята (n = 62) и добровольцев (n = 69) [47]. Средняя длина CAG-повторов не различалась между добровольцами (19.4 ± 3.1, mean ± SD) и мужчинами с доказанной фертильностью (20.6 ± 3.0, mean ± SD). У итальянских мужчин с доказанной фертильностью или с нормальной спермограммой (n = 115) диапазон CAG- и GGC-повторов составлял 9–31 и 8–21, а среднее число повторов – 21.6 ± 3.3 и 17.0 ± 1.7 (mean ± SD) соответственно [48]. В представительной американской выборке здоровых мужчин преимущественно европеоидной расы (n = 527) среднее число CAG-повторов составило 22.0 ± 3.0 (mean ± SD), причем доля CAG ≤ 19 повторов была равна 17.8%, с длиной CAG 19–24 повтора – 65.9%, а с длиной ≥25 – 16.3% [49]. В бразильской группе фертильных мужчин в основном европеоидной расы (n = 88) длина CAG-повторов варьировала в диапазоне 16–30 триплетов с медианой 21.5 и средним 22.1 ± 2.9 (mean ± SD) [50].
Азиатские популяции (монголоидная и европеоидная расы)
Раннее исследование, проведенное на фертильных китайских мужчинах (n = 45), показало, что у них число CAG-повторов больше, чем у европейцев, оно варьировало от 16 до 30 со средним 23.0 ± 3.1 (mean ± SD) [51]. Близкие данные получены у китайских мужчин национальности хан с доказанной фертильностью и нормальной спермограммой (n = 96): число CAG-повторов варьировало от 13 до 31 со средним 22.5 ± 3.0 (mean ± SD) и медианой 23; а число GGC-повторов варьировало от 12 до 24 со средним 21.9 ± 2.5 (mean ± SD) и медианой 23 [52]. В группе фертильных японских мужчин (n = 51) диапазон CAG-повторов составлял от 17 до 28 со средним 23.7 ± 3.2 (mean ± SD) [53]. Аналогичные результаты получены у фертильных японских мужчин (n = 100): длина CAG-повторов варьировала от 16 до 31 со средним 23.3 ± ± 2.8 триплета (mean ± SD) [54].
У фертильных мужчин Иордании с нормоспермией (n = 145) длина CAG-повторов варьировала в диапазоне 12–27 триплетов с медианой 19, причем наиболее частый аллель (17.2%) содержал 18 повторов [55]. В выборке фертильных индийских мужчин (европеоидная раса, n = 201) диапазон CAG-повторов составил от 12 до 32 со средним значением 22.4 ± 0.2 (mean ± SE), причем наиболее частый аллель (17.4%) содержал 23 повтора [56].
Африканские популяции
У фертильных мужчин из Туниса (n = 98) диапазон длины CAG-повторов составлял 14–29 со средним 21.13 ± 0.31 триплета (mean ± SE) [57]. У нигерийских мужчин с доказанной фертильностью и нормоспермией диапазон числа CAG-повторов составил от 14 до 26 с медианой 19.5 [58]. У фертильных египетских мужчин (n = 52) диапазон длины CAG-повторов составил 8–26 со средним 18.2 ± 3.6 триплета (mean ± SD) и медианой 18 [59], что представляет наиболее короткую длину повтора этого триплета, характерную для африканских популяций. Следует отметить, что в других африканских популяциях найдена большая вариабельность длины и медианы CAG-повторов гена AR. Проведено изучение длины CAG-повторов гена AR у мужчин с неустановленной фертильностью из африканских популяций хадза (n = 210) и датога (n = 229), проживающих на северо-западе Танзании и существующих в настоящее время в условиях ограниченного контакта с западной цивилизацией [60]. Диапазон длины и медиана CAG-повторов составили для популяции хадза 17–30 и 22; для популяции датога – 15–31 и 21 соответственно. Самыми многочисленными в обеих популяциях оказались CAG-аллели, содержащие от 20 до 25 повторов. Интересно, что авторы установили отрицательную ассоциацию между агрессивностью мужчин и числом CAG-повторов, причем мужчины датога демонстрировали большую агрессию, чем хадза. В другой африканской популяции ариаал из Кении у мужчин с неустановленной фертильностью (n = 156) вариабельность длины CAG-повторов гена AR составила от 15 до 34 с медианой 22.5 триплета и средним 22.6 ± 3.1 (mean ± SD) [61]. У мужчин этой популяции длина CAG-повторов была ассоциирована с размерами тела (с ростом, окружностью талии, массой жировой ткани), что может отражать эволюционно сложившуюся связь между этими признаками в популяциях с хроническим недоеданием.
Этнические различия длины CAG- и GGC-повторов гена AR
Длина и распространенность CAG- и GGC-повторов гена AR изучались у мужчин разных этнических групп, проживающих в одной и той же климатической и географической зоне, что имеет особую ценность, так как в этом случае нивелируется влияние эколого-климатических условий. В ранней работе [62] число CAG-повторов различалось между мужчинами европеоидной и негроидной расы, проживающих в Луизиане, США. У 130 мужчин европеоидной расы диапазон длины CAG-повторов составил 9–28 с медианой 21 и средним 21.0 ± 3.0 (mean ± SD), а у 65 мужчин негроидной расы эти показатели были ниже: диапазон 13–26 с медианой 19 и средним 19.0 ± 3.0 (mean ± SD), что указывает на более короткую длину CAG-повторов у мужчин негроидной расы по сравнению с европеоидной. Считается, что более высокая частота встречаемости рака простаты у мужчин негроидной расы по сравнению с европеоидной связана с более короткой длиной CAG-повторов [63].
У здоровых мужчин в округе Лос-Анджелес определено число CAG- и GGC-повторов гена AR у здоровых мужчин – афроамериканцев (n = 45), белых (не испаноязычных, n = 39) и азиатов (китайцев и японцев, n = 39) [64]. Распространенность коротких аллелей CAG < 22 была самой высокой у афроамериканцев – 75%, промежуточной у белых – 62% и самой низкой у азиатов – 49% (различия достоверны), а распространенность коротких аллелей GGC < 16 была самой высокой у афроамериканцев – 61%, ниже у азиатов – 27% и самой низкой у белых – 11%. Таким образом, значительные расовые различия наблюдались в распространенности коротких CAG- и GGC-повторов гена AR, которые, как было доказано позднее, совпадали с расовыми различиями в распространенности рака простаты [65].
В дальнейшем этнические различия в длине и распространенности CAG- и GGC-полиморфизма гена AR подтвердили другие исследователи. В работе [66] число CAG- и GGC-повторов гена AR оценивали у мужчин 13 этнических групп (было включено небольшое количество женщин), проживающих в восьми странах Средиземноморья (n = 1187). Семь выборок было сформировано из жителей Южной Европы (Испания, Италия, Греция и Турция), пять выборок – из Северной Африки (Марокко, Алжир, Египет) и одна группа – из Западной Африки (Берег Слоновой Кости). Длина CAG-повторов у всей изученной популяции варьировала в диапазоне 10–31, средние значения варьировали от 19.1 до 22.6, а медиана – от 19 до 22 триплетов. Длина GGC-повторов у всей популяции варьировала в диапазоне 7–26, средние значения варьировали от 15.0 до 16.2, а медиана – от 15 до 16 триплетов. Медианные значения длины CAG-повторов значительно различались между африканскими и неафриканскими популяциями с наименьшими значениями у жителей Берега Слоновой Кости (негроидная раса, медиана 19) и наибольшими – у жителей Турции, Южной Испании и средней части Сардинии (европеоидная раса, медиана 22). Медианные значения длины GGC-повторов были ниже у берберов Египта и жителей Берега Слоновой Кости (медиана 15 триплетов) по сравнению с остальными изученными этносами Средиземноморья (медиана 16 триплетов). После стратификации участников по длине повторов на группы с короткими, средними и длинными аллелями, высокую частоту коротких CAG < 19 повторов демонстрировали жители Берега Слоновой Кости и берберы Египта, а высокую частоту коротких GGC < 15 повторов – жители Берега Слоновой Кости и берберы Марокко. Таким образом, в Средиземноморском регионе наблюдается высокая межпопуляционная этническая вариабельность длины CAG- и GGC-повторов, а распределение коротких, средних и длинных аллелей заметно различается между южными европейцами и субсахарскими африканцами, причем северные африканцы демонстрировали промежуточные частоты.
В другой работе [67] изучено распределение аллелей (CAG)n гена AR у четырех этнических групп. Генотипировали 3365 новорожденных мальчиков европейского происхождения (Великобритания, Австралия и Северная Америка), 1742 – тайских малышей (Таиланд), 1142 – афро-карибских (Барбадос), 770 – мексиканских (штат Калифорния, США). Распределение длины AR (CAG)n повторов по этническим группам было следующим: афро-карибский этнос – 19.6 ± 3.2 (mean ± SD, здесь и далее) (самый короткий повтор и, по-видимому, наибольшая активность AR), европейцы – 21.9 ± 2.9, испаноязычный этнос – 22.6 ± 3.1, тайский – 23.1 ± 3.3 (самый длинный повтор и, по-видимому, самая низкая активность AR). Значительные этнические различия в частотах CAG-аллелей гена AR предполагают потенциальные этнические различия в активности андрогенового рецептора и, следовательно, в чувствительности тканей-мишеней к андрогенам.
В этнически смешанных популяциях вариабельность числа AR CAG-повторов повышена. У мужчин (n = 340) из этнически смешанной бразильской популяции Сан-Паоло [68] диапазон CAG-повторов варьировал от 14 до 35, причем 37.6% мужчин имели менее 22 триплетов, 15.2% – 22, 22.4% – 23–24, 24.8% – более 24 триплетов.
Обзор имеющихся работ показал, что экспансия AR CAG-повторов у мужчин зависит от этнической принадлежности (генетического фона) и максимальный диапазон длины CAG-повторов гена AR по всей совокупности изученных этносов составляет от 6 до 40 триплетов. У мужчин негроидной расы максимальный диапазон CAG-повторов составляет 13–34, хотя некоторые популяции имеют более длинные CAG-повторы; у мужчин европеоидной расы, проживающих в различных регионах мира, – 9–31, у мужчин монголоидной расы, проживающих в восточной Азии, – 6–40 триплетов.
Оценка этнических различий по длине CAG- и GGC-повторов гена AR у мужчин важна для понимания вариабельности аллелей этого гена и различий в чувствительности к андрогенам. Популяционные исследования позволили выявить не только генетические различия между расами или этносами в частотах аллелей полиморфизма CAG гена AR, но и сопряженные с ними репродуктивные различия, включая мужское бесплодие, нарушенный сперматогенез и заболевания репродуктивной сферы (рассматриваются ниже). Однако человеческие популяции редко можно разграничить точными генетическими границами, обычно наблюдается существенное перекрытие этих границ.
АССОЦИАЦИЯ AR CAG- И GGC-ПОЛИМОРФИЗМА С МУЖСКОЙ ФЕРТИЛЬНОСТЬЮ
Связь AR CAG-повторов с мужским бесплодием и сперматогенезом
Эта связь является предметом интенсивной дискуссии, поскольку имеющиеся результаты противоречивы и часто ненадежны. В обзоре, основанном на серии из 16 ранних работ, выполненных с 1999 по 2002 г., в восьми из них отмечалось, что более длинные AR CAG-повторы ассоциированы с бесплодием и нарушением сперматогенеза различной степени тяжести [69]. Этот тренд наблюдался в выборках бесплодных мужчин с идиопатической азооспермией или олигозооспермией из Австралии, Японии, США, Великобритании, Франции и Сингапура. В целом эти данные согласуются с представлениями, что более длинные CAG-повторы снижают транскрипционную активность андрогенового рецептора, что приводит к ослабленному сперматогенезу и мужскому бесплодию, и подтверждают инвертированную корреляцию между длиной CAG-повторов и функцией AR. К примеру, в работе [45] исследовалась связь между экспансией CAG-повторов и нарушениями сперматогенеза у французских мужчин с идиопатическим бесплодием. Авторы установили, что длина CAG-повторов больше у бесплодных мужчин по сравнению с фертильными (mean ± SE: 23.9 ± 0.5 и 22.2 ± 0.4 соответственно). Таким образом, количество CAG-повторов в гене AR через изменение рецепторной функции способно модулировать эффекты андрогенов на сперматогенез. Однако в других исследованиях не было обнаружено взаимосвязи между экспансией CAG-повторов гена AR и дефективным сперматогенезом у мужчин с идиопатическим бесплодием из шведской, немецкой, голландской, бельгийской, датской и японской популяций [69]. Например, в работе [47] сравнили количество CAG-повторов гена AR у четырех групп немецких мужчин (численность групп варьировала от 14 до 69): с нормальной спермограммой; с доказанной фертильностью; бесплодных с азооспермией или с фамильным бесплодием, которые существенно различались по концентрации сперматозоидов в эякуляте, но не отличались по числу CAG-повторов, а также по уровню ЛГ, ФСГ и свободного тестостерона. У фертильных мужчин с нормальной спермограммой наблюдалась отрицательная корреляция между числом CAG-повторов и общим количеством или концентрацией сперматозоидов в эякуляте. Авторы предположили, что вариабельность длины полиглутаминового тракта AR может влиять на сперматогенез у мужчин с нормальной спермограммой, но она, по-видимому, не играет ведущей роли в мужском бесплодии.
В более позднем метаанализе [39], основанном на 33 публикациях, вышедших за период с 1997 по 2006 г., выяснялась роль AR CAG-полиморфизма в мужском бесплодии. В анализ были включены группы мужчин различной этнической принадлежности (европейские, китайские, индийские, австралийские, израильские), а также группы с неидентифицированной этничностью, что не позволило вычленить роль генетического фона в репродуктивных эффектах AR CAG-повторов. Однако метаанализ обеспечил поддержку гипотезы о тесной связи между длинными CAG-повторами и предрасположенностью к сниженной мужской фертильности и бесплодию.
В дальнейшем география исследований значительно расширилась. Более поздний метаанализ [25] содержал данные 44 опубликованных исследований с 1999 по 2014 г. и включил 3950 бесплодных и 3684 фертильных мужчин европеоидной, монголоидной и смешанной расы. Метаанализ подтвердил, что бесплодные мужчины и мужчины с азооспермией имеют более длинный CAG-тракт по сравнению с фертильными вне зависимости от расы. Установлено, что у мужчин только с азооспермией, но не с олигозооспермией, выявлены более длинные AR CAG-повторы по сравнению с контрольной группой, т.е. имеется связь между длиной AR CAG-повтора и тяжестью дефектов сперматогенеза. Однако последнее заключение не подтвердилось в недавней работе [70], в которой установлена достоверная ассоциация между длиной AR CAG-повторов и бесплодием у иорданских мужчин, а более длинные CAG > > 21 повторы были связаны с олигозооспермией и тератозооспермией. В контрольной (фертильной) группе мужчин вариабельность AR CAG-повторов составила 12–28 триплетов (среднее 19.3), а в группе бесплодных мужчин – 7–29 триплетов (среднее 20.3).
Аналогичные результаты получены в работе [71] на небольших, но свободных от хромосомных аномалий и мутаций AZF региона Y-хромосомы выборках фертильных с нормоспермией (n = 13) и бесплодных (n = 64) мужчин европеоидной расы. Среднее количество CAG-повторов составляло 19.3 ± 5 для фертильных и 22.2 ± 3 (mean ± SD) для бесплодных. Наблюдалась отрицательная корреляция между длиной CAG-повторов и параметрами спермограммы, мужчины с тяжелой олиго- и азооспермией имели более длинные CAG-повторы по сравнению с фертильным контролем.
Ассоциация между длиной AR CAG-повторов и мужским бесплодием была установлена у иранских мужчин [72]. Сравнение групп мужчин с идиопатическим бесплодием (n = 150) и фертильных (n = 150) показало достоверные различия в длине AR CAG-повторов (mean ± SD: 20.00 ± 5.06 и 17.53 ± 4.31 соответственно), указывая, что риск мужского бесплодия увеличивается с увеличением длины повтора. Наиболее частыми в фертильной и бесплодной группах были аллели CAG 20 и CAG 21 соответственно.
Аналогичные выводы сделаны при сравнении длины AR CAG-повторов у египетских мужчин [73] с необструктивной азооспермией, подтвержденной гистопатологией и TESE (n = 120), и фертильного контроля (n = 30). Диапазон и среднее значение длины AR CAG-повторов у мужчин с необструктивной азооспермией (15–36 и 25.77 соответственно) демонстрировали значительное увеличение по сравнению с контрольной группой (11–30 и 20.70 соответственно).
Статистически значимые различия в длине AR CAG-повторов у бесплодных и фертильных мужчин выявляются далеко не всегда. В израильской популяции мужчин смешанного этнического состава (евреи и арабы) длина AR CAG-повторов не различалась между группой с идиопатическим бесплодием и патозооспермией (n = 114) и группой контроля (n = 58) с нормальной спермограммой (mean ± SE: 21.7 ± 0.5 и 21.2 ± 0.7 соответственно), хотя существенные различия наблюдались в параметрах спермограммы. Однако в группе бесплодных мужчин более длинные AR CAG-повторы были ассоциированы с более высокой долей мужчин с тератозооспермией [74].
Не обнаружено значимой корреляции между длиной AR CAG-повторов и риском мужского бесплодия в этнически однородной популяции египетских мужчин [59]. Не обнаружено связи между длиной CAG-повторов гена AR и бесплодием у иранских мужчин при сравнении бесплодных с азооспермией или тяжелой олигоспермией (n = 72) и фертильных с нормоспермией (n = 72) [75]. Среднее число AR CAG-повторов у бесплодных и фертильных мужчин составляло 18.99 ± 0.35 и 19.96 ± 0.54 (mean ± SE) с диапазоном 11–26 и 12–25 триплетов соответственно, причем у бесплодных мужчин наиболее распространенный аллель состоял из 19 (26.38%), а у контрольных – из 25 (22.22%) триплетов. Не удалось обнаружить существенной связи между AR CAG-повторами и бесплодием в популяциях мужчин из Индии [56], Китая [52], Турции [76], Иордании [55].
Гетерогенность и противоречивость результатов представленных публикаций может быть вызвана несколькими факторами. Исследования проводились на этнически разнородных популяциях, которые могут отличаться генетическим бэкграундом, что может повлиять на функциональные свойства AR. Группы бесплодных мужчин, преселектированных для исследования, могут характеризоваться значительной гетерогенностью в отношении генетических, эпигенетических и приобретенных причин бесплодия, например, могут содержать другие чем AR CAG генетические мутации. Наконец, в разных исследованиях использовались различные критерии включения участников, которые часто разнородны по этническому составу, возрасту и статусу фертильности.
Связь AR CAG-повторов с репродуктивными гормонами
Публикации по ассоциации AR CAG-полиморфизма с мужской фертильностью нередко включают наряду с параметрами спермограммы уровни гормонов гипофизарно-тестикулярной оси. Например, в египетской популяции мужчин между первично бесплодными пациентами с олигоспермией (n = 44) и фертильными мужчинами (n = 20) найдены различия по числу CAG-повторов гена AR, концентрации и подвижности сперматозоидов в эякуляте, а также по уровню ФСГ в крови. В обеих группах мужчин наблюдалась отрицательная корреляция между длиной CAG-повторов и концентрацией сперматозоидов, и положительная – между длиной CAG-повторов и уровнем ФСГ [77]. В работе [59] длина AR CAG-повторов не различалась между бесплодными (n = 129) и фертильными (n = 52) египетскими мужчинами (mean ± SD: 18.30 ± 2.3 и 18.18 ± 3.6 соответственно), но наблюдалась положительная корреляция между длиной CAG-повторов и уровнем тестостерона в группе бесплодных мужчин, а уровни ФСГ, ЛГ, пролактина не были связаны с AR CAG-повторами. Аналогичные результаты получены у молодых европейцев, у которых найдены положительные корреляции между длиной AR CAG-повторов и уровнем ЛГ и свободного тестостерона [78].
В представительной популяции молодых мужчин добровольцев (n = 974) из балтийских стран длина AR CAG-повторов варьировала от 13 до 33, причем стратификация участников на три группы – с короткими повторами CAG ≤ 21 у 29.8%, средними 22 ≤ CAG ≤ 24 у 48.9% и длинными CAG ≥ 25 у 21.3% позволила выявить спермиологические и гормональные различия [79]. Длинные AR CAG-повторы были связаны с пониженным уровнем ФСГ, а мужчины с комбинацией длинных CAG ≥ 25 и длинных GGC ≥ 24 вариантов характеризовались повышенным уровнем ЛГ и тестостерона, пониженной концентрацией и общим количеством сперматозоидов в эякуляте.
В работе [80] установлено, что индивидуальная вариабельность уровня тестостерона у мужчин может быть частично объяснена AR CAG-полиморфизмом. На большой группе здоровых бельгийских мужчин (n = 1257) показана положительная ассоциация между длиной AR CAG-повторов и уровнем общего и свободного тестостерона, но не ЛГ или ГСПГ (глобулин, связывающий половые гормоны). Авторы предполагают, что у мужчин 6.0–8.5 и 10–14% индивидуальной изменчивости уровня общего и свободного тестостерона, соответственно, связано с AR CAG-полиморфизмом, однако мужчины с уровнем тестостерона выше нормальных значений не обязательно будут иметь более высокую чувствительность к андрогенам в тканях-мишенях по сравнению с мужчинами с пониженными уровнями тестостерона.
В работе [81] участников исследования в возрасте 40–79 лет рекрутировали из общей популяции восьми европейских стран (n = 2878); средняя длина AR CAG-повторов составляла 22.1 ± 3.1 (mean ± SD). В этой выборке выявлена положительная ассоциация между длиной AR CAG-повторов и уровнем общего и свободного тестостерона и отрицательная – с уровнем ФСГ и ЛГ, но не было установлено ассоциации с уровнем ГСПГ. Авторы полагают, что более длинные CAG-повторы ослабляют обратную связь андрогенов в гипоталамо-гипофизарно-тестикулярной системе и повышают уровень тестостерона. Поскольку с увеличением длины CAG-повторов происходит снижение функциональной активности AR, при длинных CAG-повторах повышение уровня тестостерона можно рассматривать как компенсаторный эффект для поддержания адекватного андрогенового статуса мужчины. С генетической точки зрения уровень тестостерона, несомненно, является полигенным признаком, а CAG-полиморфизм гена AR является лишь одним из многих генетических факторов, лежащих в основе генетического контроля этого признака.
У молодых китайских мужчин национальности хан (n = 253) оценивалась ассоциация AR CAG-полиморфизма с репродуктивными гормонами (ФСГ, ЛГ, пролактин, тестостерон, эстрадиол и прогестерон), причем число CAG-повторов варьировало в диапазоне от 13 до 30 со средним значением 20.55 и медианой 20 триплетов [82]. Длина CAG-повторов положительно коррелировала с уровнем общего тестостерона, но никаких корреляций не обнаружено с уровнем других гормонов.
Опубликованы данные об отрицательной корреляции между количеством CAG-повторов и уровнем ЛГ и ФСГ в группе здоровых добровольцев (n = 131) с нормальными показателями спермограммы [47]. Аналогичные данные получены на молодых филиппинских мужчинах (n = 722), у которых среднее число CAG-повторов гена AR составляло 21.1 ± 3.5 (mean ± SD) с диапазоном 8–38 и отрицательно коррелировало с уровнем ФСГ [83]. В исследовании польских мужчин добровольцев (n = 180) из общей популяции количество CAG- и GGС-повторов гена AR составляло 21.93 ± 2.79 и 23.2 ± 1.66 (mean ± SD) с диапазоном 16–31 и 16–29 соответственно; наблюдалась значительная положительная корреляция между длиной CAG- и GGС-повторов и уровнями ЛГ и ФСГ и отрицательная – с уровнем тестостерона и эстрадиола [84]. В то же время у пакистанских мужчин обнаружена отрицательная корреляция между длиной CAG-повторов и уровнем ФСГ и тестостерона, причем длинные CAG > 26 повторы были ассоциированы с пониженными уровнями ФСГ и тестостерона [85]. Имеются публикации, где не было выявлено ассоциации между длиной AR CAG-повторов и репродуктивными гормонами. Например, при исследовании двух групп немецких мужчин с бесплодием и различными формами патозооспермии (n = 217) и контроля с нормоспермией с доказанным или недоказанным отцовством (n = 131) не было выявлено достоверных корреляций между длиной CAG-повторов и параметрами спермограммы, уровнем ФСГ, ЛГ и тестостерона, хотя различия по уровню ФСГ, тестостерона и количеству CAG повторов между мужчинами с бесплодием и фертильными (mean ± SD: 21.5 ± 2.9 и 19.4 ± 3.1 соответственно) были достоверны [46].
Большое количество исследований указывают на влияние длинных AR CAG-повторов на эндокринную функцию гипофизарно-тестикулярной оси с повышением уровня тестостерона, что, по-видимому, является компенсаторным эффектом, поддерживающим адекватный гормональный уровень, необходимый для сперматогенеза. Возможно, что роль CAG- и GGC-полиморфизма гена AR состоит главным образом в модификации и регулировании обратной связи в эндокринной системе гипофиз–семенники и эффектов андрогенов на процесс сперматогенеза, а не в прямом и независимом влиянии на сперматогенез. Выявленная противоречивость результатов гормональных исследований связана, вероятно, с малой численностью и разнородным этническим составом исследуемых групп и, главным образом, с различными принципами подбора контингента.
Роль этноса в ассоциативных связях между длиной AR CAG-повторов и мужской фертильностью
Как уже упоминалось, длина CAG- и GGC-аллелей гена AR зависит от этнического фактора, и самые длинные аллели найдены у азиатов, средней длины – у европеоидов и самые короткие – у африканцев, поэтому предполагается, что число CAG-повторов может оказывать разное влияние на мужскую репродуктивную функцию в зависимости от этнической принадлежности (бэкграунда) и географического места проживания исследуемой группы.
Вариабельность длины AR CAG-аллелей сравнивалась в популяциях основных расовых групп [62, 64, 66, 67, 86, 87]. Если распределить имеющиеся экспериментальные работы по этническому составу участников, то ассоциация длинных AR CAG-аллелей с мужским бесплодием уверенно установлена для популяций европеоидной расы, но такие связи редки в азиатских и африканских популяциях, что подтверждается выводами нескольких метаанализов [25, 88]. Уже в ранних работах высказывалось предположение, что вариабельность CAG-аллелей с меньшей вероятностью связана с риском бесплодия у азиатских мужчин [46]. Справедливости ради отметим, что в группах мужчин европеоидной расы длинные CAG-аллели не всегда играют значительную роль в развитии бесплодия или коррелируют с плохим качеством спермы.
В российских популяциях мужчин проведено несколько исследований по распространенности AR CAG-аллелей и выявлению ассоциации с бесплодием и параметрами сперматогенеза. В работе [89] диапазон AR CAG-повторов у бесплодных российских мужчин (n = 200) варьировал от 7 до 31, среднее число повторов составило 22.2 ± 1.63, а наиболее часто встречающимся аллелем был CAG21 (13%). Не было обнаружено зависимости между количеством CAG-повторов и концентрацией сперматозоидов в эякуляте. Стратификация пациентов по длине CAG-аллелей на длинные CAG ≥ 26 (n = 40), короткие CAG ≤ 19 (n = 25) и условно нормальные варианты 20 ≤ CAG ≤ 25 (n = = 135) не выявила различий по параметрам спермограммы, включая концентрацию, долю прогрессивно подвижных и морфологически аномальных сперматозоидов. Поскольку более серьезные нарушения сперматогенеза отмечены у мужчин с короткими и длинными CAG-повторами, авторы поддерживают мнение о влиянии CAG-полиморфизма гена AR на сперматогенез, рассматривая длину AR CAG-повторов как дополнительный молекулярный маркер мужского бесплодия.
В более позднем исследовании [31], также проведенном на бесплодных российских мужчинах (n = 332), число AR CAG-повторов варьировало от 9 до 31, самым распространенным аллелем был CAG21 (21.6%), длинные аллели CAG ≥ 27 представлены у 7.5%, а короткие аллели CAG < 19 – у 5.1% исследуемой группы. К сожалению, в статье не было представлено данных о связи между длиной AR CAG-повторов и параметрами спермограммы. Авторы считают, что определение числа AR CAG-повторов у бесплодных мужчин мало информативно в клиническом отношении, поскольку не позволяет четко выделить группы риска и установить причину бесплодия, а в случае длинных аллелей дает информацию только о возможной генетической предрасположенности данного мужчины к бесплодию.
В работе [90] представлены результаты исследования полиморфизма CAG-повторов гена AR в выборке бесплодных российских мужчин, преимущественно русских, с патозооспермией (n = 591), с нормоспермией (контроль, n = 131), с доказанной фертильностью, но без анализа спермограммы (n = = 286). Количество CAG-повторов гена AR варьировало в группе патозооспермии от 7 до 37, а в контрольной группе от 18 до 31. Медианы длинных CAG-аллелей (≥26), средних (19–25) и коротких (≤18) не различались между группами мужчин с различными формами патозооспермии, контролем и группой с доказанной фертильностью. Однако количество длинных и коротких CAG-аллелей в группе с олигозооспермией было больше, чем в контроле, что свидетельствует о положительной связи коротких и длинных CAG-повторов с бесплодием, а также о неблагоприятном влиянии как длинных, так и коротких повторов на сперматогенез. Результаты этих и других исследований, проведенных на выборках русских, украинских и польских мужчин, свидетельствуют, что в славянском этносе наиболее распространенными являются CAG-аллели гена AR с 20–22 триплетами [31, 84, 89–91].
Имеются ли референсные значения длины CAG-повторов гена АR?
С точки зрения повышения информативности результатов анализа AR CAG-полиморфизма как фактора, предрасполагающего к мужскому бесплодию, вопрос выбора пороговой длины повторов для диагностических целей имеет принципиальное значение. В большинстве случаев такое деление проводится эмпирически или исходя из результатов ранее опубликованных работ. Например, в метаанализе [88], основанном на 40 публикациях, вышедших с 2000 по 2015 г., дается пороговая величина длины CAG-повторов гена АR как 21 триплет, поскольку авторы показали, что более длинные аллели CAG > 21 связаны с повышенным риском бесплодия. В другом метанализе [92], включающем 1831 фертильных и 2084 бесплодных мужчин, авторы предложили проводить стратификацию числа CAG-повторов гена АR по трем категориям CAG < 22, CAG = 22–23 и CAG > 23, принимая за референсное значение нормы число CAG-повторов, равное 22–23 триплетам. Такое деление основано на исследованиях in vitro, которые установили наивысшую активность AR при длине повторов, равной 22–23 триплета. Данный метаанализ позволил обосновать существование нелинейной ассоциации между длиной CAG-повторов гена AR и мужской фертильностью, поскольку субъекты с длиной повторов менее 22 и более 23 имели повышенный риск бесплодия.
Ряд авторов предлагает другие пороговые значения, например в российской популяции мужчин к группе условно длинных CAG-аллелей предлагается относить повторы длиной более 26 триплетов [31]. В работе [89] для российских мужчин в качестве критерия условно нормального количества CAG-повторов гена АR выбран интервал 20–25 повторов. Таким образом, в определении пороговых значений длины (CAG)n гена AR имеются разногласия, которые, по-видимому, необходимо устранить, по крайней мере для определенных этнических групп, что благотворно скажется на усовершенствовании алгоритма обследования мужчин с бесплодием и пониженной фертильностью.
Косвенное влияние длины AR CAG-повторов на мужскую фертильность
Вариабельность длины AR CAG-повторов может косвенно влиять на мужскую фертильность, играя роль предрасполагающего фактора бесплодия. Поскольку андрогеновый рецептор важен для нормального развития мужских наружных и внутренних гениталий, можно ожидать, что ослабление функции андрогенового рецептора вследствие удлинения CAG-повторов может приводить к незаконченной (неполной) маскулинизации мужских половых органов. Выявлена связь длинных AR CAG-повторов с идиопатической гипоспадией, которая является одним из наиболее распространенных врожденных пороков развития мужской репродуктивной системы [93]. В метаанализе [94] обоснована ассоциация между длинными AR CAG- и GGC-повторами и риском крипторхизма, однако упоминается, что эта ассоциация была ясно выражена в популяциях мужчин европеоидной расы, но практически не проявлялась у монголоидов (азиатов). Установлено влияние длинных AR CAG-повторов на сниженный объем яичек и функцию клеток Сертоли и, следовательно, на продукцию сперматозоидов у фертильных и бесплодных мужчин [95]. Как свидетельствуют результаты метаанализов [63, 96], более короткие AR CAG-повторы, сопровождаемые повышенной экспрессией гена AR, вовлечены в этиологию рака простаты и могут служить маркерами риска этого заболевания. Более длинные AR CAG- и GGC-повторы ассоциированы с повышенным риском рака семенников [97].
Снижение мужской фертильности наблюдается при нейрогенеративных генетических заболеваниях, вызванных значительным увеличением количества CAG-повторов в экзоне 1 гена AR, например при упоминавшейся ранее спинобульбарной мышечной атрофии, которая ассоциирована с эндокринными нарушениями, гинекомастией, олигозооспермией или азооспермией [34]. Вариабельность AR CAG-повторов может оказывать негативное влияние на сексуальную функцию мужчин, которая также может приводить к бесплодию, причем у мужчин более длинный AR CAG-тракт, по-видимому, предрасполагает к формированию сексуальной дисфункции [98, 99]. В то же время имеются работы, в которых не было выявлено ассоциации числа AR CAG-повторов с проявлениями эректильной дисфункции [66].
Ряд исследований указывает на важную роль AR CAG-полиморфизма в реализации терапевтических эффектов андрогенов, поскольку AR через прямую регуляцию транскрипции генов опосредует периферические эффекты тестостерона и дигидротестостерона. В клинической андрологии нередко применяется заместительная терапия андрогенами для индукции вторичных половых признаков, восстановления сперматогенеза у больных с гипогонадотропным гипогонадизмом, сексуальной дисфункцией, которая сопряжена с необходимостью контролировать ее эффективность [100]. Установление коррелятивной связи между длиной CAG-повторов гена AR и ответом на заместительную терапию андрогенами оказалось важным направлением, помогающим при диагностике гипогонадизма и выборе индивидуального протокола гормональной заместительной терапии андрогенами [35].
AR GGC-повторы и мужская фертильность
Связь между длиной GGC-повторов гена андрогенового рецептора и мужской фертильностью изучалась реже, но результаты также оказались противоречивыми. У китайских мужчин короткие GGC-повторы (<23) были связаны с нарушениями сперматогенеза, а длина GGC-повторов коррелировала с концентрацией сперматозоидов [52]. Результаты работы [85] на пакистанских мужчинах с бесплодием (астенозооспермия) и фертильных также подтвердили влияние (GGC)n полиморфизма гена AR на параметры спермограммы и профиль репродуктивных гормонов. Диапазон AR GGC-повторов составлял от 10 до 28. У бесплодных мужчин наиболее частым был аллель GGC22 (17.14%), а у фертильных – аллель GGC23 (27.2%), причем длинные GGC ≥ 25 повторы у бесплодных мужчин были связаны с пониженной концентрацией сперматозоидов в эякуляте.
Сравнение длины AR GGC-повторов у иранских мужчин с бесплодием (n = 72, азооспермия и олигозооспермия) и фертильного контроля (n = 72) показало связь между длиной AR GGC-повторов и фертильностью [101]. Диапазон GGC-повторов варьировал от 18 до 25 у мужчин с бесплодием и от 20 до 28 – у фертильных, причем у бесплодных наиболее частым был аллель GGC24 (58.3%), а у фертильного контроля – GGC25 (22.2%). Результаты указывают на связь аллеля GGC24 с проявлением мужского бесплодия. Авторы предполагают, что длина GGC-повторов влияет на функцию AR, ухудшая связывание андрогенов и оказывая негативное влияние на андроген-зависимые ткани.
На выборке мужчин из Балтийских стран установлено, что носители AR GGC ≥ 24 повторов характеризовались негативным трендом в отношении концентрации сперматозоидов в эякуляте [79]. Авторы обнаружили комбинаторный эффект коротких GGC-повторов (≤21) и длинных CAG-повторов (≥25) на уровень тестостерона, который значительно снижался у носителей этих вариантов. В большой когорте (n = 1476) здоровых бельгийских мужчин установлена положительная ассоциация между длиной AR GGC-повторов и уровнем общего и свободного тестостерона, но не ЛГ [102]. Поскольку этот же эффект установлен для AR CAG-повторов, можно считать, что оба тринуклеотидных повтора гена AR влияют на секрецию и периферическое действие андрогенов через модуляцию обратной связи в гипофизарно-тестикулярной системе [59, 78, 80, 81].
Имеются работы, не подтверждающие ассоциации между длиной AR GGC-повторов и мужским бесплодием. В работе [48] сравнивали длину GGC-повторов в группе фертильных мужчин с нормоспермией (n = 115) и идиопатическим бесплодием (n=163), однако не было найдено существенных различий как в средних, так и медианных значениях длины GGC-повторов, а также в распределении аллелей. В то же время, как оказалось, сочетание гаплотипов (CAG = 21/GGC = 18 и CAG > 21/GGC > 18) может увеличивать предрасположенность к мужскому бесплодию. У итальянских мужчин не найдено существенных различий в числе и распределении CAG- и GGC-аллелей гена AR между бесплодными мужчинами с ослабленным сперматогенезом и фертильным контролем с нормоспермией, однако сниженная подвижность сперматозоидов была связана с более длинными CAG- и GGC-повторами [103]. Не было выявлено связи между длиной GGC-повторов в гене AR и бесплодием у индийских мужчин при сравнении групп бесплодных с азооспермией, олигозооспермией или олиготератозооспермией и контроля с нормоспермией как по количеству GGC-повторов (21.51 vs 21.58), так и по диапазону изменчивости – 15–26 в обеих группах [104]. Аналогичные результаты представлены в работе [58], где показано, что у нигерийских мужчин полиморфизм по AR GGC-повторам не связан с бесплодием. Другая группа [105] показала, что у чилийских мужчин аллель AR GGC23 является преобладающим у мужчин контрольной группы c нормальным сперматогенезом (65%) и группы с бесплодием и азооспермией или олигозооспермией (62%); вторым распространенным аллелем в обеих группах был GGC24 (33 и 38% соответственно), но различий между группами по количеству и распределению этих аллелей не установлено. Авторы все же предполагают, что аллель GGC24 может способствовать нарушению функции гена AR и сперматогенной недостаточности.
Результаты исследований вариабельности CAG-повторов гена андрогенового рецептора у мужчин, проведенных в разных странах и в различных по расовому и этническому составу популяциях, суммированы в табл. 1.
Таблица 1.
Характеристики CAG-повторов гена андрогенового рецептора у мужчин из различных расовых и этнических популяций
| Страна | Раса/этнос | Фертильность | n | Mean ± SD | Диапазон | Ссылка |
|---|---|---|---|---|---|---|
| Франция | Европеоиды/французы | Ф | 50 | 22.2 ± 0.4 | 17–27 | [45] |
| Германия | Европеоиды/немцы | Ф | 62 | 20.6 ± 3.0 | 12–28 | [47] |
| Италия | Европеоиды/итальянцы | Ф, Н | 115 | 21.6 ± 3.3 | 9–31 | [48] |
| США | Преимущественно европеоиды (92%) | НД | 527 | 22.0 ± 3.0 | НД | [49] |
| Бразилия | Преимущественно европеоиды (82.3%) | НД | 88 | 22.1 ± 2.9 | 16–30 | [50] |
| Китай | Монголоиды/китайцы | Ф | 45 | 23.0 ± 3.1 | 16–30 | [51] |
| Китай | Монголоиды/китайцы национальности хан | Ф, Н | 96 | 22.5 ± 3.0 | 13–31 | [52] |
| Япония | Монголоиды/японцы | Ф | 51 | 23.7 ± 3.2 | 17–28 | [53] |
| Япония | Монголоиды/японцы | Ф | 100 | 23.3 ± 2.8 | 16–31 | [54] |
| Иордания | Индо-средиземноморская раса/арабы | Ф, Н | 145 | 19.0 ± 1.5 | 12–27 | [55] |
| Индия | Европеоиды/НД | Ф | 201 | 22.4 ± 0.2* | 12–32 | [56] |
| Тунис | Европеоиды/берберы | Ф | 98 | 21.13 ± 0.31 | 14–29 | [57] |
| Нигерия | Негроиды/мультиэтнос | Ф, Н | 38 | 19.5** | 17–26 | [58] |
| Египет | Смешание рас/египтяне | Ф, Н | 52 | 18.2 ± 3.6 | 18–26 | [59] |
| Танзания | Негроиды/хадза | НД | 210 | 22* | 17–30 | [60] |
| Танзания | Негроиды/датога | НД | 229 | 21* | 15–31 | [60] |
| Кения | Негроиды/ариаал | НД | 156 | 22.6 ± 3.1 | 15–34 | [61] |
| США | Европеоиды | НД | 130 | 21.0 ± 3.0 | 9–28 | [62] |
| США | Негроиды | НД | 65 | 19.0 ± 3.0 | 13–26 | [62] |
| Испания | Европеоиды/баски | НД | 62 | 21.4 | 15–27 | [66] |
| Греция | Европеоиды/греки | НД | 66 | 21.3 | 16–26 | [66] |
| Турция | Европеоиды/турки | НД | 149 | 22.6 | 14–31 | [66] |
| Египет | Смешение рас/берберы оазиса Сива | НД | 81 | 20.6 | 14–30 | [66] |
| Берег Слоновой Кости | Негроиды/ахизи | НД | 89 | 19.1 | 14–24 | [66] |
| Марокко | Европеоиды/берберы | НД | 117 | 21.0 | 12–28 | [66] |
| Великобритания, Канада, Австралия | Европеоиды/мультиэтнос | Дети | 3365 | 21.9 ± 2.9 | 6–40 | [67] |
| Тайланд | Монголоиды/тайцы | Дети | 1742 | 23.1 ± 3.3 | 6–40 | [67] |
| Барбадос (Вест-Индия) | Негроиды/афро-карибский этнос | Дети | 1142 | 19.6 ± 3.2 | 9–37 | [67] |
| США | Метисы (монголоиды + + европеоиды)/мексиканцы | Дети | 770 | 22.6 ± 3.1 | 12–37 | [67] |
| Бразилия | Мультиэтнос | НД | 340 | НД | 14–35 | [68] |
| Иордания | Индо-средиземноморская раса/арабы | Ф, Н | 169 | 19.3 ± 2.8 | 12–28 | [70] |
| США | Европеоиды/американцы | Ф | 13 | 19.3 ± 5.0 | 10–24 | [71] |
| Иран | Индоиранская раса/арии | Ф, Н | 150 | 17.53 ± 4.3 | 8–32 | [72] |
| Египет | Смешение рас/египтяне | Ф, Н | 30 | 20.73 ± 7.2 | 11–30 | [73] |
| Израиль | Мультиэтнос/арабы, евреи ашкенази и сефарды | Ф, Н | 58 | 21.22 ± 0.66 | 13–32 | [74] |
| Иран | Индоиранская раса/мультиэтнос | Ф, Н | 72 | 19.96 ± 0.54* | 12–25 | [75] |
| Турция | Европеоиды/турки | Ф, Н | 32 | 22.41 ± 0.54* | 16–29 | [76] |
| Египет | Смешение рас/египтяне | Ф, Н | 20 | 19.6 ± 2.1 | 17–25 | [77] |
| Швеция | Европеоиды/шведы | Н | 274 | 22.2 ± 3.0 | 12–30 | [78] |
| Европа (восемь стран)*** |
Европеоиды/мультиэтнос | НД | 2878 | 22.1 ± 3.1 | НД | [81] |
| Нигерия | Негроиды/этнос эдо | НД | 85 | 16.7 | 13–26 | [86] |
| США | Негроиды/афроамериканцы | НД | 516 | 17.8 | 9–13 | [86] |
| США | Европеоиды/американцы | НД | 90 | 19.7 | 13–26 | [86] |
| Тайвань | Монголоиды/тайцы | НД | 60 | 20.1 | 14–26 | [86] |
| США | Американоидная раса/индейцы | НД | 103 | 20.1 | 14–30 | [86] |
| Сьерра-Леоне | Негроиды/этнос менде | НД | 230 | 17.3 | 10–26 | [86] |
| Россия | НД (преимущественно европеоиды) | Ф | 286 | 21** | 13–31 | [90] |
| Украина | Европеоиды/мультиэтнос | Ф | 124 | НД | 11–31 | [91] |
| Италия | Европеоиды/итальянцы | Ф, Н | 60 | 23** | 15–27 | [103] |
ЗАКЛЮЧЕНИЕ
Часто мужское бесплодие характеризуется неспособностью производить сперматозоиды с нормальной морфологией и подвижностью в адекватном количестве. Генетическое тестирование пациентов с бесплодием позволяет выявить генетические дефекты, связанные с ослабленным сперматогенезом и бесплодием; преимущественно это хромосомные аномалии, микроделеции AZF региона Y-хромосомы, мутации гена муковисцидоза, а также гена андрогенового рецептора, который опосредует эффекты андрогенов на сперматогенез. Аккумуляция наших знаний о генетических причинах мужского бесплодия может способствовать улучшению профилактики, диагностики и лечения мужского бесплодия и играть решающую роль в предотвращении передачи генетических дефектов будущим поколениям.
Большинство представленных в обзоре исследований свидетельствуют о влиянии CAG- и GGC-полиморфизма гена AR на сперматогенез и уровень репродуктивных гормонов и на его возможную роль в этнических и региональных различиях мужской фертильности, причем мужчины не только с длинными, но и короткими повторами имеют ослабленную продукцию сперматозоидов и андрогенную недостаточность. Длина CAG-повторов в гене AR ассоциирована с предрасположенностью к мужскому идиопатическому бесплодию и дефектам сперматогенеза, таким образом CAG-полиморфизм гена AR может оказывать модулирующее влияние на нормальную функцию рецептора андрогенов. Несмотря на противоречивость имеющихся данных, считается подтвержденной связь между длинными AR CAG-повторами и нарушениями сперматогенеза, предполагая, что мужчины с более длинными CAG-повторами более склонны к развитию бесплодия в ответ на патогенные/ эпигенетические факторы. Имеющаяся вариабельность результатов различных исследований может быть обусловлена этническим фактором, небольшими выборками, а также различными критериями подбора участников, что связано с гетерогенностью причин ослабленного сперматогенеза и бесплодия. Следует ожидать дополнительных популяционных исследований, что позволит оценить распространенность CAG- и GGC-полиморфизма гена AR и его ассоциацию с мужской фертильностью в этнически различных популяциях.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 19-15-00075.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Skakkebaek N.E., Rajpert-De Meyts E., Buck Louis G.M. et al. Male reproductive disorders and fertility trends: Influences of environment and genetic susceptibility // Physiol. Rev. 2016. V. 96. № 1. P. 55–97. https://doi.org/10.1152/physrev.00017.2015
Levine H., Jørgensen N., Martino-Andrade A. et al. Temporal trends in sperm count: A systematic review and meta-regression analysis // Hum. Reprod. Update. 2017. V. 23. № 6. P. 646–659. https://doi.org/10.1093/humupd/dmx022
Sengupta P., Borges E., Jr., Dutta S., Krajewska-Kulak E. Decline in sperm count in European men during the past 50 years // Hum. Exp. Toxicol. 2018. V. 37. № 3. P. 247–255. https://doi.org/10.1177/0960327117703690
Mínguez-Alarcón L., Williams P.L., Chiu Y.H. et al. Secular trends in semen parameters among men attending a fertility center between 2000 and 2017: identifying potential predictors // Environ. Int. 2018. V. 121. P. 1297–1303. https://doi.org/10.1016/j.envint.2018.10.052
Mishra P., Negi M.P.S., Srivastava M. et al. Decline in seminal quality in Indian men over the last 37 years // Reprod. Biol. Endocrinol. 2018. V. 16. № 1. 103. https://doi.org/10.1186/s12958-018-0425-z
Krausz C., Riera-Escamilla A. Genetics of male infertility // Nat. Rev. Urol. 2018. V. 15. № 6. P. 369–384. https://doi.org/10.1038/s41585-018-0003-3
Swan S.H., Brazil C., Drobnis E.Z. et al. Geographic differences in semen quality of fertile U.S. males // Environ. Health Perspect. 2003. V. 111. № 4. P. 414–420. https://doi.org/10.1289/ehp.5927
Gao J., Gao E.S., Yang Q. et al. Semen quality in a residential, geographic and age representative sample of healthy Chinese men // Hum. Reprod. 2007. V. 22. № 2. P. 477–484. https://doi.org/10.1093/humrep/del383
Jørgensen N., Joensen U.N., Jensen T.K. et al. Human semen quality in the new millennium: A prospective cross-sectional population-based study of 4867 men // BMJ Open. 2012. V. 2. № 4. e000990. https://doi.org/10.1136/bmjopen-2012-000990
Iwamoto T., Nozawa S., Mieno M.N. et al. Semen quality of 1559 young men from four cities in Japan: a cross-sectional population-based study // BMJ Open. 2013. V. 3. № 4. e002222. https://doi.org/10.1136/bmjopen-2012-002222
Erenpreiss J., Punab M., Zilaitiene B. et al. Semen quality of young men from the general population in Baltic countries // Hum. Reprod. 2017. V. 32. № 6. P. 1334–1340. https://doi.org/10.1093/humrep/dex062
Elbardisi H., Majzoub A., Al Said S. et al. Geographical differences in semen characteristics of 13 892 infertile men // Arab. J. Urol. 2018. V. 16. № 1. P. 3–9. https://doi.org/10.1016/j.aju.2017.11.018
Osadchuk L., Tipisova E., Kleshchev M. et al. Study of semen quality, reproductive hormone levels, and lipid levels in men from Arkhangelsk, a city in North of European Russia // Am. J. Men’s Health. 2020. V. 14. № 4. 1557988320939714. https://doi.org/10.1177/1557988320939714
Osadchuk L.V., Shantanova L.N., Troev I.V. et al. Regional and ethnic differences in semen quality and reproductive hormones in Russia: A Siberian population-based cohort study of young men // Andrology. 2021. Apr 21. Epub ahead of print.https://doi.org/10.1111/andr.13024
Jungwirth A., Giwercman A., Tournaye H. et al. European Association of Urology guidelines on male infertility: the 2012 update // Eur. Urol. 2012. V. 62. № 2. P. 324–332. https://doi.org/10.1016/j.eururo.2012.04.048
Zhang Y., Zhong L., Xu B. et al. SpermatogenesisOnline 1.0: A resource for spermatogenesis based on manual literature curation and genome-wide data mining // Nucl. Acids Res. 2013. V. 41 (Database issue). D1055-62. https://doi.org/10.1093/nar/gks1186
Krausz C., Escamilla A.R., Chianese C. Genetics of male infertility: from research to clinic // Reproduction. 2015. V. 150. № 5. R159–R174. https://doi.org/10.1530/REP-15-0261
Cioppi F., Rosta V., Krausz C. Genetics of azoospermia // Int. J. Mol. Sci. 2021. V. 22. № 6: 3264. https://doi.org/10.3390/ijms22063264
Ferlin A., Raicu F., Gatta V. et al. Male infertility: Role of genetic background // Reprod. Biomed. Online. 2007. V. 14. № 6. P. 734–745. https://doi.org/10.1016/s1472-6483(10)60677-3
Krausz C., Casamonti E. Spermatogenic failure and the Y chromosome // Hum. Genet. 2017. V. 136. № 5. P. 637–655. https://doi.org/10.1007/s00439-017-1793-8
Черных В.Б., Соловова О.А. Мужское бесплодие: взгляд генетика на актуальную проблему // Consilium Medicum. 2019. Т. 21. № 7. С. 19–24. https://doi.org/10.26442/20751753.2019.7.190517
Михайленко Д.С., Соболь И.Ю., Ефремов Е.А. и др. Генетически обусловленные формы бесплодия у мужчин: основные характеристики и практические аспекты лабораторной диагностики // Эксперим. и клин. урология. 2020. Т. 1. С. 96–104. https://doi.org/10.29188/2222-8543-2020-12-1-96-104
De Souza D.A.S., Faucz F.R., Pereira-Ferrari L. et al. Congenital bilateral absence of the vas deferens as an atypical form of cystic fibrosis: reproductive implications and genetic counselling // Andrology. 2018. V. 6. № 1. P. 127–135. https://doi.org/10.1111/andr.12450
Bareil C., Bergougnoux A. CFTR gene variants, epidemiology and molecular pathology // Arch. Pediatr. 2020. V. 27. Suppl. 1. eS8–eS12. https://doi.org/10.1016/S0929-693X(20)30044-0
Pan B., Li R., Chen Y. et al. Genetic association between androgen receptor gene CAG repeat length polymorphism and male infertility: a meta-analysis // Medicine (Baltimore). 2016. V. 95. № 10. e2878. https://doi.org/10.1097/MD.0000000000002878
Shukla G.C., Plaga A.R., Shankar E., Gupta S. Androgen receptor-related diseases: what do we know? // Andrology. 2016. V. 4. № 3. P. 366–381. https://doi.org/10.1111/andr.12167
Batista R.L., Costa E.M.F., Rodrigues A.S. et al. Androgen insensitivity syndrome: a review // Arch. Endocrinol. Metab. 2018. V. 62. № 2. P. 227–235. https://doi.org/10.20945/2359-3997000000031
Меликян Л.П., Черных В.Б. Полиморфизм CAG-повторов гена андрогенного рецептора, болезнь Кеннеди и мужское бесплодие // Андрология и генитальная хирургия. 2019. Т. 20. № 2. С. 35–39. https://doi.org/10.17650/2070-9781-2019-20-2-35-39
Esteves S.C., Zini A., Coward R.M. et al. Sperm DNA fragmentation testing: Summary evidence and clinical practice recommendations // Andrologia. 2021. V. 53. № 2. e13874. https://doi.org/10.1111/and.13874
Butz H., Nyírő G., Kurucz P.A. et al. Molecular genetic diagnostics of hypogonadotropic hypogonadism: from panel design towards result interpretation in clinical practice // Hum. Genet. 2021. V. 140. № 1. P. 113–134. https://doi.org/10.1007/s00439-020-02148-0
Михайленко Д.С., Соболь И.Ю., Сафронова Н.Ю. и др. Частота выявления делеций AZF, мутаций CFTR и длинных аллелей CAG-повтора AR при первичной лабораторной диагностике в гетерогенной группе пациентов с мужским бесплодием // Урология. 2019. № 3. С. 101–107.
O’Hara L., Smith L.B. Androgen receptor roles in spermatogenesis and infertility // Best Pract. Res. Clin. Endocrinol. Metab. 2015. V. 29. № 4. P. 595–605. https://doi.org/10.1016/j.beem.2015.04.006
Takayama K.I. The biological and clinical advances of androgen receptor function in age-related diseases and cancer // Endocr. J. 2017. V. 64. № 10. P. 933–946. https://doi.org/10.1507/endocrj.EJ17-0328
Pennuto M., Rinaldi C. From gene to therapy in spinal and bulbar muscular atrophy: Are we there yet? // Mol. Cell. Endocrinol. 2018. V. 465. P. 113–121. https://doi.org/10.1016/j.mce.2017.07.005
Firouzi V., Borjian Boroujeni P., Rokhsat Talab Z. et al. Possible role of androgen receptor gene in therapeutic response of infertile men with hypogonadotropic hypogonadism // Syst. Biol. Reprod. Med. 2019. V. 65. № 4. P. 326–332. https://doi.org/10.1080/19396368.2019.1590478
Mirkin S.M. DNA structures, repeat expansions and human hereditary disorders // Curr. Opin. Struct. Biol. 2006. V. 16. № 3. P. 351–358. https://doi.org/10.1016/j.sbi.2006.05.004
Darling A.L., Uversky V.N. Intrinsic disorder in proteins with pathogenic repeat expansions // Molecules. 2017. V. 22. № 12. 2027. https://doi.org/10.3390/molecules22122027
Mirkin S.M. Expandable DNA repeats and human disease // Nature. 2007. V. 447. № 7147. P. 932–940. https://doi.org/10.1038/nature05977
Davis-Dao C.A., Tuazon E.D., Sokol R.Z., Cortessis V.K. Male infertility and variation in CAG repeat length in the androgen receptor gene: a meta-analysis // J. Clin. Endocrinol. Metab. 2007. V. 92. № 11. P. 4319–4326. https://doi.org/10.1210/jc.2007-1110
Aquila S., De Amicis F. Steroid receptors and their ligands: effects on male gamete functions // Exp. Cell Res. 2014. V. 328. № 2. P. 303–313. https://doi.org/10.1016/j.yexcr.2014.07.015
Pihlajamaa P., Sahu B., Jänne O.A. Determinants of receptor- and tissue-specific actions in androgen signaling // Endocr. Rev. 2015. V. 36. № 4. P. 357–384. https://doi.org/10.1210/er.2015-1034
Davey R.A., Grossmann M. Androgen receptor structure, function and biology: from bench to bedside // Clin. Biochem. Rev. 2016. V. 37. № 1. P. 3–15.
Heemers H.V., Tindall D.J. Androgen receptor (AR) coregulators: A diversity of functions converging on and regulating the AR transcriptional complex // Endocr. Rev. 2007. V. 28. № 7. P. 778–808. https://doi.org/10.1210/er.2007-0019
Buchanan G., Yang M., Cheong A. et al. Structural and functional consequences of glutamine tract variation in the androgen receptor // Hum. Mol. Genet. 2004. V. 13. № 16. P. 1677–1692. https://doi.org/10.1093/hmg/ddh181
Wallerand H., Rémy-Martin A., Chabannes E. et al. Relationship between expansion of the CAG repeat in exon 1 of the androgen receptor gene and idiopathic male infertility // Fertil. Steril. 2001. V. 76. № 4. P. 769–774. https://doi.org/10.1016/s0015-0282(01)01987-2
Asatiani K., von Eckardstein S., Simoni M. et al. CAG repeat length in the androgen receptor gene affects the risk of male infertility // Int. J. Androl. 2003. V. 26. № 5. P. 255–261. https://doi.org/10.1046/j.1365-2605.2003.00420.x
Von Eckardstein S., Syska A., Gromoll J. et al. Inverse correlation between sperm concentration and number of androgen receptor CAG repeats in normal men // J. Clin. Endocrinol. Metab. 2001. V. 86. № 6. P. 2585–2590. https://doi.org/10.1210/jcem.86.6.7608
Ferlin A., Bartoloni L., Rizzo G. et al. Androgen receptor gene CAG and GGC repeat lengths in idiopathic male infertility // Mol. Hum. Reprod. 2004. V. 10. № 6. P. 417–421. https://doi.org/10.1093/molehr/gah054
Kristal A.R., Price D.K., Till C. et al. Androgen receptor CAG repeat length is not associated with the risk of incident symptomatic benign prostatic hyperplasia: Results from the prostate cancer prevention trial // Prostate. 2010. V. 70. № 6. P. 584–590. https://doi.org/10.1002/pros.21092
Biolchi V., Silva Neto B., Koff W., Brum I.S. Androgen receptor CAG polymorphism and the risk of benign prostatic hyperplasia in a Brazilian population // Int. Braz. J. Urol. 2012. V. 38. № 3. P. 373–379. https://doi.org/10.1590/s1677-55382012000300010
Tse J.Y., Liu V.W., Yeung W.S. et al. Molecular analysis of the androgen receptor gene in Hong Kong Chinese infertile men // J. Assist. Reprod. Genet. 2003. V. 20. № 6. P. 227–233. https://doi.org/10.1023/a:1024107528283
Han T.T., Ran J., Ding X.P. et al. Cytogenetic and molecular analysis of infertile Chinese men: karyotypic abnormalities, Y-chromosome microdeletions, and CAG and GGN repeat polymorphisms in the androgen receptor gene // Genet. Mol. Res. 2013. V. 12. № 3. P. 2215–2226. https://doi.org/10.4238/2013.July.8.3
Sasagawa I., Suzuki Y., Ashida J. et al. CAG repeat length analysis and mutation screening of the androgen receptor gene in Japanese men with idiopathic azoospermia // J. Androl. 2001. V. 22. № 5. P. 804–808.
Nakabayashi A., Sueoka K., Matsuda N. et al. Incidental deviation of short and long CAG repeats in the androgen receptor gene for Japanese male infertility // Reprod. Med. Biol. 2003. № 2. P. 145–150.
Batiha O., Haifawi S., Al-Smadi M. et al. Molecular analysis of CAG repeat length of the androgen receptor gene and Y chromosome microdeletions among Jordanian azoospermic infertile males // Andrologia. 2018. V. 50. e12979. https://doi.org/10.1111/and.12979
Thangaraj K., Joshi M.B., Reddy A.G. et al. CAG repeat expansion in the androgen receptor gene is not associated with male infertility in Indian populations // J. Androl. 2002. V. 23. № 6. P. 815–818.
Hadjkacem L., Hadj-Kacem H., Boulila A. et al. Androgen receptor gene CAG repeats length in fertile and infertile Tunisian men // Ann. Genet. 2004. V. 47. № 3. P. 217–224. https://doi.org/10.1016/j.anngen.2004.03.010
Akinloye O., Gromoll J., Nieschlag E., Simoni M. Androgen receptor gene CAG and GGN polymorphisms in infertile Nigerian men // J. Endocrinol. Invest. 2009. V. 32. № 10. P. 797–804. https://doi.org/10.1007/BF03345748
Badran W.A., Fahmy I., Abdel-Megid W.M. et al. Length of androgen receptor-CAG repeats in fertile and infertile Egyptian men // J. Androl. 2009. V. 30. № 4. P. 416–425. https://doi.org/10.2164/jandrol.108.005843
Butovskaya M.L., Lazebny O.E., Vasilyev V.A. et al. Androgen receptor gene polymorphism, aggression, and reproduction in Tanzanian foragers and pastoralists // PLoS One. 2015. V. 10. № 8. e0136208. https://doi.org/10.1371/journal.pone.0136208
Campbell B.C., Gray P.B., Eisenberg D.T. et al. Androgen receptor CAG repeats and body composition among Ariaal men // Int. J. Androl. 2009. V. 32. № 2. P. 140–148. https://doi.org/10.1111/j.1365-2605.2007.00825.x
Sartor O., Zheng Q., Estham J.A. Androgen receptor gene CAG repeat length varies in a race-specific fashion in men without prostate cancer // Urology. 1999. V. 53. № 2. P. 378–380. https://doi.org/10.1016/s0090-4295(98)00481-6
Weng H., Li S., Huang J.Y. et al. Androgen receptor gene polymorphisms and risk of prostate cancer: a meta-analysis // Sci. Rep. 2017. V. 7. 40554. https://doi.org/10.1038/srep40554
Irvine R.A., Yu M.C., Ross R.K., Coetzee G.A. The CAG and GGC microsatellites of the androgen receptor gene are in linkage disequilibrium in men with prostate cancer // Cancer Res. 1995. V. 55. № 9. P. 1937–1940.
Eisermann K., Wang D., Jing Y. et al. Androgen receptor gene mutation, rearrangement, polymorphism // Transl. Androl. Urol. 2013. V. 2. № 3. P. 137–147. https://doi.org/10.3978/j.issn.2223-4683.2013.09.15
Esteban E., Rodon N., Via M. et al. Androgen receptor CAG and GGC polymorphisms in Mediterraneans: Repeat dynamics and population relationships // J. Hum. Genet. 2006. V. 51. № 2. P. 129–136. https://doi.org/10.1007/s10038-005-0336-7
Ackerman C.M., Lowe L.P., Lee H. et al. Ethnic variation in allele distribution of the androgen receptor (AR) (CAG)n repeat // J. Androl. 2012. V. 33. № 2. P. 210–215. https://doi.org/10.2164/jandrol.111.013391
Andersen M.L., Guindalini C., Santos-Silva R. et al. Androgen receptor CAG repeat polymorphism is not associated with erectile dysfunction complaints, gonadal steroids, and sleep parameters: data from a population-based survey // J. Androl. 2011. V. 32. № 5. P. 524–529. https://doi.org/10.2164/jandrol.110.012013
Yong E.L., Loy C.J., Sim K.S. Androgen receptor gene and male infertility // Hum. Reprod. Update. 2003. V. 9. № 1. P. 1–7. https://doi.org/10.1093/humupd/dmg003
Al Zoubi M.S., Bataineh H., Rashed M. et al. CAG repeats in the androgen receptor gene is associated with oligozoospermia and teratozoospermia in infertile men in Jordan // Andrologia. 2020. V. 52. № 9. e13728. https://doi.org/10.1111/and.13728
Katagiri Y., Neri Q.V., Takeuchi T. et al. Androgen receptor CAG polymorphism (Xq11-12) status and human spermatogenesis: a prospective analysis of infertile males and their offspring conceived by intracytoplasmic sperm injection // Int. J. Mol. Med. 2006. V. 18. № 3. P. 405–413.
Mobasseri N., Babaei F., Karimian M., Nikzad H. Androgen receptor (AR)-CAG trinucleotide repeat length and idiopathic male infertility: A case-control trial and a meta-analysis // EXCLI J. 2018. V. 17. P. 1167–1179. https://doi.org/10.17179/excli2018-1744
Mostafa T., El-Shahid L., El Azeem A. et al. Androgen receptor-CAG repeats in infertile Egyptian men // Andrologia. 2012. V. 44. № 3. P. 147–151. https://doi.org/10.1111/j.1439-0272.2010.01125.x
Milatiner D., Halle D., Huerta M. et al. Associations between androgen receptor CAG repeat length and sperm morphology // Hum. Reprod. 2004. V. 19. № 6. P. 1426–1230. https://doi.org/10.1093/humrep/deh251
Khatami S.R., Galehdari H., Rasekh A. et al. Assessment of correlation between androgen receptor CAG repeat length and infertility in infertile men living in Khuzestan, Iran // Int. J. Fertil. Steril. 2015. V. 9. № 2. P. 189–196. https://doi.org/10.22074/ijfs.2015.4239
Tufan A.C., Satiroglu-Tufan N.L., Aydinuraz B. et al. No association of the CAG repeat length in exon 1 of the androgen receptor gene with idiopathic infertility in Turkish men: implications and literature review // Tohoku J. Exp. Med. 2005. V. 206. № 2. P. 105–115. https://doi.org/10.1620/tjem.206.105
Mosaad Y.M., Shahin D., Elkholy A.A. et al. CAG repeat length in androgen receptor gene and male infertility in Egyptian patients // Andrologia. 2012. V. 44. № 1. P. 26–33. https://doi.org/10.1111/j.1439-0272.2010.01100.x
Giwercman Y.L., Richthoff J., Lilja H. et al. Androgen receptor CAG repeat length correlates with semen PSA levels in adolescence // Prostate. 2004. V. 59. № 3. P. 227–323. https://doi.org/10.1002/pros.10366
Grigorova M., Punab M., Kahre T. et al. The number of CAG and GGN triplet repeats in the androgen receptor gene exert combinatorial effect on hormonal and sperm parameters in young men // Andrology. 2017. V. 5. № 3. P. 495–504. https://doi.org/10.1111/andr.12344
Crabbe P., Bogaert V., De Bacquer D. et al. Part of the interindividual variation in serum testosterone levels in healthy men reflects differences in androgen sensitivity and feedback set point: Contribution of the androgen receptor polyglutamine tract polymorphism // J. Clin. Endocrinol. Metab. 2007. V. 92. № 9. P. 3604–3610. https://doi.org/10.1210/jc.2007-0117
Huhtaniemi I.T., Pye S.R., Limer K.L. et al. Increased estrogen rather than decreased androgen action is associated with longer androgen receptor CAG repeats // J. Clin. Endocrinol. Metab. 2009. V. 94. № 1. P. 277–284. https://doi.org/10.1210/jc.2008-0848
Ma Y.M., Wu K.J., Ning L. Relationships among androgen receptor CAG repeat polymorphism, sex hormones and penile length in Han adult men from China: a cross-sectional study // Asian J. Androl. 2014. V.16. № 3. P. 478–481. https://doi.org/10.4103/1008-682X.124560
Ryan C.P., McDade T.W., Gettler L.T. et al. Androgen receptor CAG repeat polymorphism and hypothalamic-pituitary-gonadal function in Filipino young adult males // Am. J. Hum. Biol. 2017. V. 29. № 1.https://doi.org/10.1002/ajhb.22897
Kamieniczna M., Fraczek M., Malcher A. et al. Semen quality, hormonal levels, and androgen receptor gene polymorphisms in a population of young male volunteers from two different regions of Poland // Med. Sci. Monit. 2015. V. 21. P. 2494–2504. https://doi.org/10.12659/MSM.893628
Khan H.L., Bhatti S., Abbas S. et al. Tri-nucleotide consortium of androgen receptor is associated with low serum FSH and testosterone in asthenospermic men // Syst. Biol. Reprod. Med. 2018. V. 64. № 2. P. 112–121. https://doi.org/10.1080/19396368.2017.1384080
Kittles R.A., Young D., Weinrich S. et al. Extent of linkage disequilibrium between the androgen receptor gene CAG and GGC repeats in human populations: implications for prostate cancer risk // Hum. Genet. 2001. V. 109. № 3. P. 253–261. https://doi.org/10.1007/s004390100576
Sasaki M., Kaneuchi M., Sakuragi N. et al. The polyglycine and polyglutamine repeats in the androgen receptor gene in Japanese and Caucasian populations // Biochem. Biophys. Res. Commun. 2003. V. 312. № 4. P. 1244–1247. https://doi.org/10.1016/j.bbrc.2003.11.075
Xiao F., Lan A., Lin Z. et al. Impact of CAG repeat length in the androgen receptor gene on male infertility – a meta-analysis // Reprod. Biomed. Online. 2016. V. 33. № 1. P. 39–49. https://doi.org/10.1016/j.rbmo.2016.03.012
Черных В.Б., Руднева С.А., Сорокина Т.М. и др. Влияние СAG-полиморфизма гена андрогенового рецептора (AR) на сперматогенез у мужчин с бесплодием // Андрология и генитальная хирургия. 2015. Т. 16. № 4. С. 55–61. https://doi.org/10.17650/2070-9781-2015-16-4-55-61
Melikyan L.P., Bliznetz E.A., Polyakov A.V. et al. Polymorphism of CAG repeats in exon 1 of the androgen receptor gene in Russian men with various forms of pathozoospermia // Rus. J. Genet. 2020. V. 56. P. 1000–1005. https://doi.org/10.1134/S1022795420080104
Фесай О.А., Кравченко С.А., Тыркус М.Я. и др. CAG-полиморфизм гена андрогенового рецептора у мужчин с азооспермией и олигозооспермией из Украины // Цитология и генетика. 2009. Т. 43. № 6. С. 45–51.
Nenonen H.A., Giwercman A., Hallengren E., Giwercman Y.L. Non-linear association between androgen receptor CAG repeat length and risk of male subfertility – a meta-analysis // Int. J. Androl. 2011. V. 34. № 4. P. 327–332. https://doi.org/10.1111/j.1365-2605.2010.01084.x
Huang G., Shan W., Zeng L., Huang L. Androgen receptor gene CAG repeat polymorphism and risk of isolated hypospadias: results from a meta-analysis // Genet. Mol. Res. 2015. V. 14. № 1. P. 1580–1588. https://doi.org/10.4238/2015.March.6.5
Wang Y., Wei Y., Tang X. et al. Association between androgen receptor polymorphic CAG and GGC repeat lengths and cryptorchidism: A meta-analysis of case-control studies // J. Pediatr. Urol. 2018. V. 14. № 5. 432.e1–432.e9. https://doi.org/10.1016/j.jpurol.2018.05.011
Giagulli V.A., Carbone M.D., De Pergola G. et al. Could androgen receptor gene CAG tract polymorphism affect spermatogenesis in men with idiopathic infertility? // J. Assist. Reprod. Genet. 2014. V. 31. № 6. P. 689–697. https://doi.org/10.1007/s10815-014-0221-4
Qin Z., Li X., Han P. et al. Association between polymorphic CAG repeat lengths in the androgen receptor gene and susceptibility to prostate cancer: A systematic review and meta-analysis // Medicine (Baltimore). 2017. V. 96. № 25. e7258. https://doi.org/10.1097/MD.0000000000007258
Jiang W., Zhang J., Zhou Q. et al. Predictive value of GGN and CAG repeat polymorphisms of androgen receptors in testicular cancer: a meta-analysis // Oncotarget. 2016. V. 7. № 12. P. 13754–13764. https://doi.org/10.18632/oncotarget.7337
Liu C.C., Lee Y.C., Tsai V.F. et al. The interaction of serum testosterone levels and androgen receptor CAG repeat polymorphism on the risk of erectile dysfunction in aging Taiwanese men // Andrology. 2015. V. 3. № 5. P. 902–908. https://doi.org/10.1111/andr.12068
Tirabassi G., Cignarelli A., Perrini S. et al. Influence of CAG repeat polymorphism on the targets of testosterone action // Int. J. Endocrinol. 2015. V. 2015. 298107. https://doi.org/10.1155/2015/298107
Tirabassi G., Corona G., Falzetti S. et al. Influence of androgen receptor gene CAG and GGC polymorphisms on male sexual function: a cross-sectional study // Int. J. Endocrinol. 2016. V. 2016. 5083569. https://doi.org/10.1155/2016/5083569
Moghadam M., Khatami S.R., Galehdari H. Association of androgen receptor GGN repeat length polymorphism and male infertility in Khuzestan, Iran // Iran J. Reprod. Med. 2015. V. 13. № 5. P. 305–310.
Bogaert V., Vanbillemont G., Taes Y. et al. Small effect of the androgen receptor gene GGN repeat polymorphism on serum testosterone levels in healthy men // Eur. J. Endocrinol. 2009. V. 161. № 1. P. 171–177. https://doi.org/10.1530/EJE-09-0123
Delli Muti N., Agarwal A., Buldreghini E. et al. Have androgen receptor gene CAG and GGC repeat polymorphisms an effect on sperm motility in infertile men? // Andrologia. 2014. V. 46. № 5. P. 564–569. https://doi.org/10.1111/and.12119
Rajender S., Rajani V., Gupta N.J. et al. No association of androgen receptor GGN repeat length polymorphism with infertility in Indian men // J. Androl. 2006. V. 27. № 6. P. 785–789. https://doi.org/10.2164/jandrol.106.000166
Castro-Nallar E., Bacallao K., Parada-Bustamante A. et al. Androgen receptor gene CAG and GGN repeat polymorphisms in Chilean men with primary severe spermatogenic failure // J. Androl. 2010. V. 31. № 6. P. 552–559. https://doi.org/10.2164/jandrol.109.008821
Дополнительные материалы отсутствуют.


