Генетика, 2022, T. 58, № 3, стр. 311-318
Клинальный рост числа точечных микро-В-хромосом в кариотипах Apodemus peninsulae (Mammalia, Rodentia) в Республике Тыва с юга на север
Ю. М. Борисов 1, *, И. А. Крищук 2, **, З. З. Борисова 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
2 Научно-практический центр Национальной академии наук Беларуси по биоресурсам
220072 Минск, Республика Беларусь
* E-mail: boriss-spb@yandex.ru
** E-mail: ikryshchuk@yandex.by
Поступила в редакцию 13.03.2021
После доработки 20.09.2021
Принята к публикации 22.09.2021
- EDN: IVEEWW
- DOI: 10.31857/S0016675822030043
Аннотация
Приведены новые данные по кариологической изменчивости мышей Apodemus peninsulae на территории Республика Тыва. По соотношению макро- и микро-В-хромосом у изученных ранее мышей в этом регионе и в настоящем исследовании стало возможным выделение нескольких географических популяций, объединяющих ряд исследованных пунктов отлова восточноазиатской мыши на территории бассейна р. Енисей в северном и южном направлениях от г. Кызыл (Республика Тыва). Наиболее значимый вклад в получение картины дифференциации популяций мышей с В-хромосомами по ареалу вносят частотные характеристики микро-В-хромосом.
Присутствие добавочных, или В-хромосом (Bs) является старейшим известным фактом хромосомного полиморфизма [1, 2], но тем не менее после почти столетних исследований биологическую важность добавочных хромосом еще предстоит определить [3, 4]. Известно, что B-хромосомы отличаются от A-хромосом своими размерами, структурой и имеют следующие признаки: 1) их наличие не является обязательным, т.е. они могут присутствовать у одних организмов и в то же время отсутствовать у других организмов той же популяции; в мейозе они не спариваются (не конъюгируют) и не рекомбинируют ни с одной хромосомой диплоидного (или полиплоидного) А-набора; 3) их наследование является неменделевским и нерегулярным [3, 4].
B-хромосомы обнаружены были у млекопитающих в 1965 г., среди которых можно отметить гигантского летучего кускуса (Petauroides volans) [5], лисицу (Vulpes vulpes) [6] и мышей Reithrodontomys megalotis [7]. На территории России в ранних исследованиях В-хромосомы были обнаружены у серебристо-черных лисиц Vulpes vulpes [8] и восточноазиатских (корейских) мышей Apodemus peninsulae [9–11].
В настоящее время установлено наличие добавочных В-хромосом у 85 видов млекопитающих, что составляет 1.94% всех кариотипически изученных видов [12]. Популяционным исследованиям широкоареальных видов с В-хромосомами пока не уделяется достаточного внимания, хотя у некоторых видов изменчивость числа и морфотипов В-хромосом существенна [11]. В род Apodemus включают 20 видов, среди них 30% несут B-хромосомы [12].
Как правило, у большинства видов млекопитающих, имеющих В-хромосомы, они представлены однотипными дополнительными хромосомами. Так, например, у Apodemus (Sylvaemus) flavicollis Melchior, 1834 – мелкие акроцентрические хромосомы [12], а у Rattus rattus Linnaeus, 1758 – метацентрические хромосомы [13].
В начале 70-х годов ХХ в. при изучении кариотипов корейских мышей Apodemus giliacus = A. peninsulae с о-ва Хоккайдо (Япония) были выявлены разные типы метацентрических хромосом – от мелких по размерам точечных до крупных. Таким образом, у корейской мыши (Apodemus peninsulae) было установлено многообразие морфотипов добавочных хромосом на о-ве Хоккайдо [14].
Исследования изменчивости кариотипа по числу В-хромосом у корейской мыши на территории России впервые были проведены в популяциях данного вида в Приморье [9]. В результате проведенных исследований было установлено, что почти все изученные особи A. peninsulae Приморья имели в своем кариотипе в основном 1–3 двуплечих макро-В-хромосом. Также следует отметить, что у исследуемых особей не было выявлено точечных микро-В-хромосом. Такая же картина с одной–тремя двуплечими макро-В-хромосомами в кариотипе у особей A. peninsulae наблюдалась и на побережье Телецкого озера (Горный Алтай) [15, 16]. Создавалось впечатление, что от Приморья до Алтая в континентальных популяциях A. peninsulae у всех мышей этого вида в кариотипе наблюдается однообразие морфотипа в виде двуплечих макро-В-хромосом. Однако дальнейшие исследования кариотипов сибирских мышей A. peninsulae позволили и в континентальных популяциях выявить разнообразные варианты системы В-хромосом [11]. Впоследствии в кариотипах в сибирской популяции A. peninsulae севернее г. Красноярска было выявлено множество точечных В-хромосом, число которых варьировало от 1 до 30 [17].
Согласно данным различных исследований было выявлено, что среди млекопитающих корейская мышь демонстрирует один из самых широких спектров вариабельности Bs как по числу (от 1 до 30) [17, 18], так и по морфологии хромосом [18]. Интересно, что у A. peninsulae наблюдается увеличение числа этих хромосом в половых клетках по сравнению с соматическими [19]. При изучении географической изменчивости кариотипов почти 600 особей A. peninsulae из 39 пунктов ее ареала было установлено, что все мыши из этой выборки имели дополнительные хромосомы [18]. Известно лишь две популяции восточноазиатской мыши, обитающие на островах Сахалин и Стенин, особи которых не имели в кариотипе B-хромосом [20]. В ряде работ было установлено, что для В‑хромосом характерна степень изменчивости на популяционном, индивидуальном и тканевом уровнях [11, 14, 18, 19]. Наиболее значимый вклад в получение картины дифференциации популяций мышей с В-хромосомами по ареалу вносят частотные характеристики микро-В-хромосом [18].
Результаты указанных исследований позволили высказать предположение о разнонаправленной клинальной изменчивости вариантов системы В-хромосом у вида A. peninsulae. Так, в ряде работ [21, 22] в различных регионах Сибири, в том числе и в Западных Саянах, была выявлена локальная клинальная изменчивость точечных В-хромосом. Определенный интерес представляло исследование кариологической изменчивости по числу добавочных хромосом у восточноазиатской мыши на территории Республики Тыва, что могло бы позволить сравнить эти данные с ранее полученными результатами из соседнего региона – Хакассии [23]. Ранее на территории Республики Тыва была предпринята попытка изучить кариотипы этого вида мыши, однако число исследованных животных было мало [24]. В связи с вышеизложенным цель настоящего исследования – дополнительное изучение кариотипов мышей из этого региона и сравнение их с данными работ [23, 24].
МАТЕРИАЛЫ И МЕТОДЫ
Материалом цитогенетического исследования послужили хромосомные препараты от 14 особей (восемь самцов и шесть самок) Apodemus peninsulae, отловленных в 2008 г. из трех пунктов удаленных локалитетов Республики Тыва (рис. 1). Кариологически изучены четыре особи из окрестностей пос. Туран, две – из окр. пос. Усть-Бурен и восемь – из окр. пос. Эрзин.
Рис. 1.
Пункты отлова Apodemus peninsulae на территории Республики Тыва: № 1 – Туран, № 2 – Усть-Бурен, № 3 – Эрзин.

Хромосомные препараты готовили прямым методом из клеток костного мозга мышей с предварительным введением внутрибрюшинно 0.5 мл 0.04%-ного раствора колхицина [25, 26]. Для характеристики кариотипа каждого животного мы использовали анализ не менее чем 20 метафазных пластинок. Работа с препаратами осуществлялась с помощью микроскопа Leica D-500. Подсчет хромосом выполняли в программе LAS V3.8. При обработке материала собственных и литературных данных мы учитывали только вариант с модальным числом В-хромосом мышей, отловленных в различных пунктах на территории Республики Тывы (табл. 1).
Таблица 1.
Формулы вариантов системы B-хромосом Apodemus peninsulae, отловленных в трех пунктах Республики Тыва
| Пункт отлова | Номер особи | Пол | 2n | Bs | Формула Bs | Индекс mВ |
|---|---|---|---|---|---|---|
| Туран | 1 | ♂ | 63 | 15 | 0.0.0.1.14 | 16 |
| 2 | ♂ | 62 | 14 | 2.0.02.0.10 | 14 | |
| 3 | ♀ | 69 | 21 | 0.1.0.0.20 | 24 | |
| 4 | ♀ | 66 | 18 | 1.2.0.2.13 | 17 | |
| Усть-Бурен | 1 | ♂ | 64 | 16 | 0.2.1.0.13 | 16 |
| 2 | ♀ | 60 | 12 | 0.2.0.0.10 | 14 | |
| Эрзин | 1 | ♀ | 51 | 3 | 0.2.0.0.01 | 9 |
| 2 | ♀ | 52 | 4 | 0.1.1.0.02 | 9 | |
| 3 | ♂ | 53 | 5 | 0.0.1.0.04 | 7 | |
| 4 | ♀ | 51 | 3 | 0.0.0.0.03 | 3 | |
| 5 | ♂ | 52 | 4 | 0.2.0.0.02 | 10 | |
| 6 | ♂ | 50 | 2 | 0.1.0.0.01 | 5 | |
| 7 | ♂ | 49 | 1 | 0.0.0.0.01 | 1 | |
| 8 | ♂ | 49 | 1 | 0.0.0.0.01 | 1 |
В настоящей работе нами использована система классификации В-хромосом и формула цифрового кодирования систем В-хромосом [18]. В формуле цифрового кодирования выделено пять классов В-хромосом по их размерам и морфологическим характеристикам. Согласно этой формуле первая цифра ‒ это В-хромосомы I класса: двуплечие, крупных размеров, равные по размерам 1–8 парам А-хромосом, вторая цифра – это В-хромосомы II класса: двуплечие, средних размеров, равные 9–16 парам А-хромосом, третья – это В-хромосомы III класса: двуплечие, мелкие, равные 17–23 парам А-хромосом, четвертая цифра – это составляющие IV класс В-акроцентрики, мелкие, равные 17–23 парам А-хромосом, наконец пятая цифра – это В-хромосомы V класса, точечные или микро-В-хромосомы, с неясным положением центромеры, в несколько раз мельче самых мелких А-хромосом набора. Основываясь на этой классификации, для каждой особи проведен анализ системы В-хромосом (табл. 1, рис. 2).
Рис. 2.
Кариограмма Apodemus peninsulae. а – 48 акроцентрических А-хромосом; б – I–V классов В-хромосом.
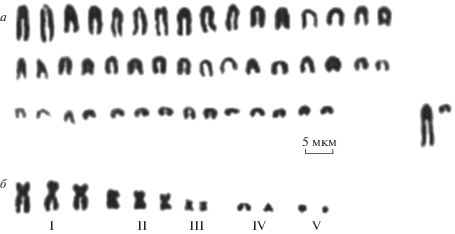
Для понимания специфики происхождения и существования дополнительных хромосом большое значение имеет не только соотношение числа В-хромосом различных морфотипов, но и изменчивость общего количества хроматина добавочных хромосом. Для этих целей использовали индекс условной массы В-хромосом в кариотипе особи (индекс mВ) [27]. В этом случае каждому размерному классу присваивается условный балл: точечным микро-B-хромосомам (V класс) – 1 балл, более крупным и относительно схожим по размерам хромосомам IV и III классов – 2 балла и далее по возрастающей: хромосомам II класса – 3 балла и I класам – 4 балла. Баллы суммируются, демонстрируя определенную характеристику условной массы В-хромосом особи.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У всех 14 особей A. peninsulae был определен основной стабильный набор А-хромосом данного вида. Он представлен 23 парами акроцентрических аутосом и двумя половыми хромосомами: крупной акроцентрической Х-хромосомой и мелкой акроцентрической Y-хромосомой (рис. 2).
Вариабельная часть кариотипа у этих мышей представлена 1–21 дополнительными В-хромосомами, среди которых 1–5 макро- и 1–14 микрохромосом (табл. 1).
Особи из окрестностей пос. Туран (пункт № 1, рис. 1) имели самые высокие диплоидные числа (2n = 62–69) и числа В-хромосом (14–21). Среднее число В-хромосом на особь у четырех исследуемых особей из Турана также было высокое (17) и выше, чем в окр. г. Кызыл, расположенного между пунктами 1 (Туран) и 2 (Усть-Бурен). Ранее в работе Г.В. Рослик и И.В. Картавцевой [24] для мышей из окр. г. Кызыл были приведены промежуточные числа точечных В-хромосом (13–17), т.е. их число меньше, чем в окр. Турана (14–20), расположенного севернее. Далее, на севере в окр. пос. Майна по данным В.Т. Волобуева и Н.Ю. Тиминой у мышей число В-хромосом доходило до 24 и в основном преобладали точечные добавочные хромосомы [23].
В самом южном из изученных нами пунктов № 3 было выявлено минимальное число В-хромосом – 1–5 и точечных – 1–4 (табл. 1).
Таким образом, при изучении кариотипов мыши Apodemus peninsulae в Республике Тыва нами выявлен локальный клинальный рост числа точечных микро-В-хромосом с юга (пункт № 3) на север (пункт № 1) и далее до окр. пос. Майна [23].
В работе [28] авторы документировали наличие клинального снижения частоты редких морфотипов добавочных хромосом у A. peninsulae с востока на северо-запад в исследуемой области Восточной Азии. При изучении добавочных хромосом желтогорлой мыши было выявлено присутствие Bs в 40 популяциях из Сербии, и частоты варьировали от 0.11 до 0.67; как правило, частота животных с Bs увеличивается с высотой в сторону более суровых климатологических условий [12].
Результаты работы [18] позволяют подвести итоги изменчивости морфотипов В-хромосом у мышей A. peninsulae в бассейне р. Енисей по всему Енисейскому меридиану, от истоков до северной части ареала этого вида в районе устья рек Ангары и Енисея. Всего нами в бассейне р. Енисей по всему Енисейскому меридиану кариологически изучено более 100 особей по соотношению макро- и микро-В-хромосом у изученных нами ранее мышей [18] и мышей настоящего исследования. Выделено несколько географических популяций, объединяющих ряд исследованных пунктов отлова восточноазиатской мыши на территории бассейна р. Енисей в северном и южном направлениях от г. Кызыл (Республика Тыва). На рис. 3 показаны метафазные пластинки A. peninsulae из трех пунктов отлова.
Интересные систематические выкладки были получены при изучении В-хромосом мышей рода Apodemus. Оказалось, что описание хромосомного полиморфизма у видов-синонимов A. speciosus [15] и A. giliacus [14] на самом деле относится к A. peninsulae [9] и только для этого вида характерно наличие В-хромосом [9, 18]. При этом на всем ареале мыши рода Apodemus имеют в кариотипе 2n от 48 до 78 хромосом. Шесть видов мышей данного рода несут добавочные хромосомы в своем кариотипе [12], а среди мышей вида A. peninsulae подавляющее большинство особей на протяжении всего своего ареала имеют В-хромосомы [18].
Восточноазиатская мышь населяет обширную территорию Сибири и Дальнего Востока (от Алтая до Тихого океана). Почти у всех кариологически изученных мышей этого вида обнаружены разнообразные варианты системы макро- и микро-В-хромосом, которые изменяются как по количеству, так и по морфологии [18]. Число В-хромосом у отдельных особей достигает до 30. Находки особей A. peninsulae без В-хромосом очень редки, что, по-видимому, так же, как и у черных крыс Rattus rattus [13], указывает на селективное преимущество восточноазиатских мышей с системой В-хромосом по сравнению с мышами этого вида без В‑хромосом. Действительно маловероятно, чтобы полиморфизм, который был создан отбором, увеличивающим разнообразие, приводил к видооб-разованию. Вид терял бы все преимущества, которые дает адаптивный полиморфизм, создающий возможность более совершенного использования среды, если бы он распадался на ряд узкоспециализированных видов. Поэтому виды с хромосомным полиморфизмом во многих отношениях являются идеальными объектами для изучения процессов становления адаптации к условиям среды на генетической базе естественного отбора [29].
Согласно исследованиям [30–32] система В‑хромосом хорошо сбалансирована и весьма устойчива и находится, видимо, под достаточно жестким генетическим контролем. Выше упоминалось, что для оценки суммарной “массы” добавочных хромосом в кариотипе A. peninsulae можно использовать относительный индекс условной массы В-хромосом (индекс mB) [33]. Данный индекс позволяет сравнить разные выборки по объему добавочного хроматина в клетках мышей разных популяций. Так, самые низкие средние показатели mB зарегистрированы в Приморье [18].
Значение индекса mB еще больше усиливает представление об адаптивности не просто наличия добавочных хромосом, а наличия определенной их массы в клетках восточноазиатских мышей. В популяциях редко встречаются мыши, имеющие как малое, так и очень большое значение индекса mB. Число добавочных точечных микрохромосом в разных регионах изменяется от 0 до 30 [19]. Доля зверьков A. peninsulae, имеющих большое число точечных микро-В-хромосом, прогрессивно падает, точно так же, как в случае с крупными добавочными хромосомами [19]. Вероятно, для каждой популяции существует оптимальное число макро- и микро-В-хромосом, которые и определяют цитогенетическую дифференциацию одной популяции от другой [18].
Эволюционная и популяционная судьба В‑хромосом зависит в первую очередь от особенностей их наследования. Будучи у многих видов неменделевским, оно является одним из основных факторов повышения частоты В-хромосом в природных популяциях. У большинства животных и растений, в геномах которых содержатся В-хромосомы, наблюдается увеличение их числа в герминативных клетках по сравнению с соматическими благодаря митотическому и/или мейотическому драйву различной природы, так что трансмиссионное отношение превышает 0.5 [30]. В отсутствие противодействующих факторов этот феномен привел бы к неограниченному распространению В-хромосом в природных популяциях. Поскольку такого распространения не наблюдается, ясно, что противодействующие факторы имеются. Среди них следует упомянуть прежде всего регуляцию драйва В-хромосом со стороны А-генома, показанную для некоторых растений и прямокрылых, и негативное влияние высоких чисел В-хромосом на фенотипические признаки их носителей [30].
Повышение компонентов приспособленности наблюдается у носителей небольшого числа В‑хромосом по сравнению с особями, у которых они отсутствуют, что подтверждает гипотезу об адаптивной природе полиморфизма по числу В‑хромосом [30].
В Хакасии на севере республики индекс mB составляет 23.0 ± 4.6 (n = 3), а на юге всего лишь 8.3 ± 0.7 (отличия достоверны, t = 5.5, р = 0.000005) [18].
Дальнейшие исследования популяционной изменчивости В-хромосом и их соотнесение с другими проявлениями хромосомной нестабильности последовательностей ДНК в A- и B-хромосомах позволят пролить свет на микроэволюционные процессы в популяциях млекопитающих.
Молекулярный состав Bs, известный в настоящее время для ряда видов млекопитающих [12, 31–35], подтверждает наличие кодирующих белок генов и транскрипционную активность для некоторых из них. Идея о том, что В-хромосомы инертны, устарела. Содержание их, очевидно, неодинаково для всех видов, поэтому современные модели должны быть адаптированы, учитывая, что В-хромосомы не являются неактивными, как считалось ранее [12].
Показанный в работе [35] феномен амплификации разнородных протяженных участков генома свидетельствует о новой форме эволюции кариотипа. Вариабельность по копийности дуплицированных сегментов разных Bs значительно усиливается полиморфизмом по числу добавочных хромосом, делая хромосомные сегментные дупликации гипервариабельными вариантами генома [35].
За последнее десятилетие выяснилось, что повторяющиеся последовательности ДНК – это не бессмысленный набор ДНК. Такая ДНК является хранилищем информации об эволюции и источником факторов, влияющих на функционирование генома [12, 31–35]. Популяционные исследования показывают, что у A. flavicollis B-хромосомы оказывают некоторое влияние на фенотип [12]. В частности, носители B-хромосом считаются лучше приспособленными к суровым условиям окружающей среды [12]. Подобные явления могут быть вызваны присутствием различных последовательностей генов, независимо от того, являются ли они полными и/или вырожденными, наряду с транскрипционной активностью некоторых из этих генов, отмеченной для B-хромосом отдельных видов [12, 31–35]. В целом это свидетельствует о том, что присутствие В-хромосом может обеспечить больший эволюционный потенциал для их носителей [8, 18, 35].
Авторы благодарны А.В. Сурову за предоставление мышей из пункта Усть-Бурен, а также М.Ю. Борисову за помощь в отлове мышей и техническую помощь при оформлении статьи.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Wilson E.B. Note on the chromosome-groups of Metapodius and Banasa // Biol. Bull. 1907. V. 12. № 5. P. 303.
Randolph L.F. Types of supernumerary chromosomes in maize // Anatomical Record. 1928. V. 41. P. 102.
Jones R.N. B chromosomes drive // Am. Naturalist. 1991. P. 430–442.
Борисов Ю.М., Мышлявкина Т.А. В-хромосомы // Усп. соврем. биологии. 2018. Т. 138. С. 336–351.
Hayman D.L., Martin P.G. Supernumerary chromosomes in the marsupial Schoinobates volans (Ker) // Aust. J. Biol. Sci. 1965. V. 18(5). P. 1081–1082. https://doi.org/10.1071/bi9651081
Moore J.W., Elder R.L. Chromosome of the fox // J. Hered. 1965. V. 56. P. 142–143. https://doi.org/10.1093/oxfordjournals.jhered.a107394
Shellhammer H.S. Supernumerary chromosomes of the harvest mouse, Reithrodontomys megalotis // Chromosoma. 1969. V. 27. P. 102–108. https://doi.org/10.1007/BF00326114
Беляев Д.К., Волобуев В.Т., Раджабли С.И., Трут Л.Н. Полиморфизм и мозаицизм по добавочным хромосомам у серебристо-черных лисиц // Генетика. 1974. Т. 10. № 2. С. 58–67.
Bekasova T.S., Vorontsov N.N., Korobitsyna K.V., Korablev V.P. B-chromosomes and comparative karyology of the mice of the genus Apodemus // Genetica. 1980. V. 52–53. P. 33–43.
Волобуев В.Т. Система В-хромосом азиатской лесной мыши Apodemus peninsulae (Rodentia, Muridae) // Генетика. 1980. Т. 16. № 7. С. 1277–1284.
Раджабли С.И., Борисов Ю.М. Варианты системы добавочных хромосом у континентальных форм Apodemus peninsulae (Rodentia, Muridae) // Докл. АН СССР. 1979. Т. 248. № 4. С. 979–981.
Vujosevic M., Rajicic M., Blagojevic J. B chromosomes in populations of mammals Revisited // Genes. 2019. V. 9(10). P. 487. https://doi.org/10.3390/genes9100487
Yosida T.H. Supernumerary chromosomes in the black rat (Rattus rattus) and their distribution in three geographic varatiants // Cytogenet. Cell Genet. 1977. V. 18. P. 149–155.
Hayata I. Chromosomal polymorphism caused by supernumerary chromosomes in the field mouse Apodemus giliacus // Chromosoma. 1973. V. 42. P. 403–414.
Kral B. Chromosome characteristics of certain murine rodents (Muridae) of the Asiatic part of the USSR // Zool. Listy. 1971. V. 20. № 4. P. 331–347.
Борисов Ю.М. Цитогенетическая структура популяции Apodemus peninsulae (Rodentia, Muridae) на побережье Телецкого озера (Алтай) // Генетика. 1990. Т. 26. № 7. С. 1212–1220.
Борисов Ю.М., Афанасьев А.Г., Лебедев Т.Т., Бочкарев М.Н. Множество микро-В-хромосом в сибирской популяции мышей Apodemus peninsulae // Генетика. 2010. Т. 46. № 6. С. 798–804.
Borisov Yu.M., Zhigarev I.A. B-chromosome system in the korean field mouse Apodemus peninsulae Thomas 1907 (Rodentia, Muridae) // Genes. 2018. V. 9. P. 147–158. https://doi.org/10.3390/genes9100472
Kolomiets O.L., Borbiev T.E., Safronova L.D. et al. Synaptonemal complex analysis of B-chromosome behavior in meiotic prophase I in the East-Asiatic mouse Apodemus peninsulae (Muridae, Rodentia) // Cytogenet. Cell Genet. 1988. V. 48. № 3. P. 183–187.
Kartavtseva I.V., Roslik G.V. A complex B chromosome system in the Korean field mouse Apodemus peninsulae // Cytogenet. Genome Res. 2004. V. 106. № 2–4. P. 271–278.
Борисов Ю.М. Изменчивость цитогенетической структуры популяций Apodemus peninsulae (Rodentia, Muridae) в Западных Саянах // Генетика. 1990. Т. 26. № 8. С. 1484–1491.
Борисов Ю.М., Малыгин В.М. Клинальная изменчивость системы В-хромосом восточноазиатской мыши Apodemus peninsulae из Бурятии и Монголии // Цитология. 1991. Т. 33. № 1. С. 106–111.
Волобуев В.Т., Тимина Н.Ю. Необычайно высокое число В-хромосом и мозаицизм по ним у азиатской лесной мыши Apodemus peninsulae (Rodentia, Muridae) // Цитология и генетика. 1980. Т. 14. № 13. С. 43–45.
Рослик Г.В., Картавцева И.В. Исследование добавочных хромосом восточноазиатской мыши Apodemus peninsulae Thomas, 1906 (Rodentia) из Сибири, Алтая, Тывы и Забайкалья // Эрдем Шинжилгээний Бутээл, Proc. Institute of Biology (Грызуны Монголии и прилежащих территорий). 2003. № 24. С. 133–139.
Ford C.F., Hamerton J.L. A colchicine hypotonic citrate squash preparation for mammalian chromosomes // Stain Technol. 1956. V. 31. P. 247–251. https://doi.org/10.3109/10520295609113814
Орлов В.Н. Кариосистематика млекопитающих. Цитогенетические методы в систематике млекопитающих. М.: Наука, 1974. 208 с.
Рослик Г.В., Картавцева И.В. Морфотипы B-хромосом Apodemus peninsulae (Rodentia) Дальнего Востока России // Цитология. 2012. Т. 54. № 1. С. 66–77.
Roslik G.V., Kartavtseva I.V. Geographic differentiation of B chromosomes in Apodemus peninsulae (Rodentia) from the east Asia // Modern Achievements in Population, Evolutionary, and Ecological Genetics: Intern. Symp. Vladivostok, September 3–8, 2017. P. 35.
Майр Э. Популяции, виды и эволюция. М.: Мир, 1974. 460 с.
Гилева Э.А. Система В-хромосом у копытных леммингов Dicrostonyx torquatus Pall., 1779 из природных и лабораторных популяций // Генетика. 2004. Т. 40. № 12. С. 1686–1694.
Trifonov V.A., Perelman P.L., Kawada S.I. Complex structure of B-chromosomes in two mammalian species: Apodemus peninsulae (Rodentia) and Nyctereutes procyonoides (Carnivora) // Chromosome Res. 2002. V. 10. P. 109–116. https://doi.org/10.1023/A:1014940800901
Rubtsov N.B., Karamysheva T.V., Andreenkova O.V. et al. Comparative analysis of micro and macro B chromosomes of Korean field mouse Apodemus peninsulae (Rodentia, Murinae) performed by chromosome microdissection and FISH // Cytogenet. Genome Res. 2004. P. 289–294. https://doi.org/10.1159/000056786
Rubtsov N.B., Borisov Yu.M. Review: Sequence composition and evolution of mammalian B chromosomes // Genes. 2018. V. 9. P. 91–109. https://doi.org/10.3390/genes9100490
Makunin A., Romanenko S., Beklemisheva V. et al. Sequencing of supernumerary chromosomes of red fox and raccoon dog confirms a non-random gene acquisition by B chromosomes // Genes. 2018. V. 9. https://doi.org/10.3390/genes9080405
Trifonov V.A., Dementyeva P.V., Beklemisheva V.R. et al. Supernumerary chromosomes, segmental duplications, and evolution // Rus. J. Genet. 2010. V. 46. № 9. P. 1094–1096. https://doi.org/10.1134/S1022795410090206
Дополнительные материалы отсутствуют.



