Генетика, 2022, T. 58, № 3, стр. 319-331
ДНК-баркодирование и морфологическая идентификация комаров рода Aedes (Diptera: Culicidae) подрода Stegomyia России и Северного Вьетнама
А. Бега 2, *, Т. Ву 1, И. И. Горячева 1, 2, А. В. Москаев 2, Б. В. Андрианов 1, 2, **
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Московский государственный областной университет
141014 Мытищи, Московская область, Россия
* E-mail: anni.miya@gmail.com
** E-mail: andrianovb@mail.ru
Поступила в редакцию 28.06.2021
После доработки 03.09.2021
Принята к публикации 13.09.2021
- EDN: HNLTOG
- DOI: 10.31857/S001667582203002X
Аннотация
Методом ДНК-баркодирования охарактеризована изменчивость комаров рода Aedes подрода Stegomyia на юге европейской части России и на Дальнем Востоке России: в Приморском и Хабаровском краях, Амурской области и в Еврейской автономной области и уточнены ареалы инвазивных и потенциально инвазивных видов комаров. Проведено сравнение митохондриальной изменчивости комаров из инвазивной популяции Aedes albopictus юга России с комарами из популяции Ae. albopictus Северного Вьетнама из области нативного ареала вида. На юге европейской части России обнаружено расширение ареала популяции инвазивного вида Ae. albopictus на территории полуострова Крым, на запад до г. Севастополя, и на территории Краснодарского края, на север до г. Тихорецка. В Приморском и Хабаровском краях обнаружен Aedes flavopictus, а также и Aedes galloisi. В Амурской области обнаружен Aedes galloisi. Северная и восточная границы ареала Ae. flavopictus совпадают с изотермами: июля +20°С и января –24°С. Впервые выявлены плотные синантропные популяции Ae. flavopictus и Ae. galloisi на Дальнем Востоке России. Анализ изменчивости BOLD-фрагмента митохондриального гена COI позволил выявить 9 новых митохондриальных гаплотипов у Ae. galloisi и 10 новых гаплотипов у Ae. flavopictus. Проведенный филогенетический анализ полученных нуклеотидных последовательностей выявляет точную кластеризацию гаплотипов, cо 100%-ной бутстреп-поддержкой, соответствующую видам Ae. flavopictus, Ae. galloisi, Ae. albopictus и Aedes aegypti. Случаев митохондриальной интрогрессии между Ae. flavopictus и Ae. galloisi в области симпатрического обитания этих видов нами не выявлено. Комары из синантропных популяций Ae. flavopictus, Ae. galloisi и Ae. albopictus близки к мономорфизму.
Комары рода Aedes подрода Stegomyia являются основными переносчиками арбовирусных лихорадок человека. К этому подроду относятся инвазивные виды комаров Aedes albopictus Skuse, 1895 и Aedes aegypti L., 1762, встречающиеся в тропической и субтропической зонах как Старого, так и Нового Света. Оба эти вида за последние 20 лет появились на юге европейской части России. Ae. aegypti после длительного отсутствия был обнаружен в 2001 г. на территории большого Сочи [1] и распространялся последующие десять лет вдоль Черноморского побережья Кавказа, после чего численность данного вида начала сокращаться. Снижение численности Ae. aegypti совпадает с появлением в 2011 г. Ae. albopictus на территории большого Сочи и расширением его ареала [2, 3]. На территории Дальнего Востока России эти виды не встречаются. Подрод Stegomyia на территории Дальнего Востока России представлен двумя видами: Aedes flavopictus Yamada, 1921 и Aedes galloisi Yamada, 1921. Данные виды комаров на Дальнем Востоке России ранее не образовывали популяции с высокой плотностью и обнаруживались в единичных экземплярах до начала XXI в. [4, 5]. С 2018 г. появились сообщения о больших популяциях кровососущих комаров, похожих на Ae. albopictus, в Хабаровске. Для идентификации видов Aedes подрода Stegomyia используются следующие методы: классическое определение имаго и личинок по морфологическим признакам [4, 6, 7], ПДРФ митохондриальной ДНК [8], изоферментный анализ [9], изменчивость ядерных рибосомных повторов ITS-1 и ITS-2 [10] и ДНК-баркодирование [11, 12]. Наиболее простым, экономичным и быстрым методом определения видовой принадлежности комаров является морфологический метод. Поэтому мы использовали его для первичной диагностики большого количества особей. Однако некоторые виды комаров подрода Stegomyia очень близки по морфологии, к тому же в литературе описана их гибридизация [13]. Поэтому часть особей была подвергнута повторному идентифицированию с помощью метода ДНК-баркодирования. Нами был выбран митохондриальный ген COI как локус, по которому в открытых базах имеется наибольший объем данных.
Популяционная изменчивость инвазивных комаров подрода Stegomyia была проанализирована в ряде работ [14, 15]. Отмечена значительная изменчивость Ae. albopictus на территории предполагаемого нативного ареала в субтропиках Старого Света [16]. На территории России изменчивость Ae. albopictus изучалась на территории Краснодарского края [17]. Комары подрода Stegomyia Северной Евразии изучены хуже. ДНК-баркодирование Ae. flavopictus и Ae. galloisi в России проведено нами впервые.
Цель данного исследования – характеристика изменчивости BOLD-фрагмента митохондриального гена COI комаров рода Aedes (Diptera: Culicidae) подрода Stegomyia, отловленных на территории России и Северного Вьетнама, и уточнение современных границ распространения инвазивных и потенциально инвазивных видов комаров подрода Stegomyia на юге европейской части России и на Дальнем Востоке России.
МАТЕРИАЛЫ И МЕТОДЫ
Сборы комаров
Имаго комаров рода Aedes собирали в июне и июле 2020 г. на территории 54 населенных пунктов юга европейской части России, п-ова Крым, Дальнего Востока России. Личинок комаров рода Aedes собирали на территории г. Ханой (Вьетнам). Количественные данные о сборах комаров представлены в табл. 1.
Таблица 1.
Количественные данные о сборах комаров
| Населенный пункт | Вид | Количество особей, определенных морфологически | Идентифицированные COI-гаплотипы | Количество нападающих самок в 2020 г. (шт./30 мин) |
|---|---|---|---|---|
| Хабаровский край | ||||
| г. Хабаровск | Ae. flavopictus | 150 | Fl_1 , Fl_2, Fl_3, Fl_4, Fl_5, Fl_8, Fl_10 | 122 |
| г. Вяземский | Ae. flavopictus | 15 | – | – |
| Ae. galloisi | 1 | Gal_1 | – | |
| г. Бикин | Ae. flavopictus | 15 | – | 14 |
| с. Маяк | Ae. flavopictus | 15 | – | – |
| с. Лидога | Ae. flavopictus | 15 | – | – |
| г. Комсомольск | Ae. flavopictus | 150 | Fl_1, Fl_2 | 89 |
| Приморский край | ||||
| пгт. Лучегорск | Ae. flavopictus | 15 | – | – |
| с. Пожарское | Ae. flavopictus | 15 | – | – |
| г. Дальнереченск | Ae. flavopictus | 15 | – | – |
| п. Горные ключи | Ae. flavopictus | 15 | – | – |
| с. Дмитриевка | Ae. flavopictus | 15 | – | – |
| Ae. galloisi | 1 | Gal_5 | – | |
| г. Уссурийск | Ae. flavopictus | 100 | – | 82 |
| г. Владивосток | Ae. flavopictus | 150 | – | 106 |
| п. Русский | Ae. flavopictus | 15 | – | 11 |
| г. Фокино | Ae. flavopictus | 15 | – | – |
| г. Находка | Ae. flavopictus | 150 | Fl_2, Fl_5, Fl_6, Fl_7, Fl_9 | 98 |
| г. Партизанск | Ae. flavopictus | 15 | – | – |
| с. Барабаш | Ae. flavopictus | 15 | – | – |
| Еврейская автономная область | ||||
| пгт. Теплозeрск | Ae. flavopictus | 15 | – | – |
| Амурская область | ||||
| г. Благовещенск | Ae. galloisi | 35 | Gal_1, Gal_2, Gal_3, Gal_6 | 68 |
| г. Свободный | Ae. galloisi | 26 | Gal_4, Gal_7, Gal_8, Gal_9 | – |
| Республика Крым | ||||
| г. Севастополь | Ae. albopictus | 50 | Alb_1 | 28 |
| г. Ялта | Ae. albopictus | 15 | Alb_1 | 14 |
| Краснодарский край и Республика Адыгея | ||||
| г. Тихорецк | Ae. albopictus | 100 | Alb_2 | 51 |
| пгт. Джубга | Ae. albopictus | 50 | – | 47 |
| пгт. Агой | Ae. albopictus | 15 | – | – |
| г. Туапсе | Ae. albopictus | 50 | – | 59 |
| с. Шепси | Ae. albopictus | 50 | – | – |
| с. Зубова Щель | Ae. albopictus | 300 | – | 41 |
| c. Детляжка | Ae. albopictus | 15 | – | – |
| с. Пластунка | Ae. albopictus | 15 | – | – |
| г. Адлер | Ae. albopictus | 50 | – | – |
| Ae. cretinus | 12 | – | – | |
| с. Эстодок | Ae. albopictus | 15 | – | – |
| г. Сочи | Ae. albopictus | 300 | – | 237 |
| Ae. cretinus | 42 | – | 6 | |
| ст. Ханская | Ae. albopictus | 15 | – | – |
| г. Белореченск | Ae. albopictus | 15 | – | – |
| г. Майкоп | Ae. albopictus | 300 | – | 110 |
| г. Апшеронск | Ae. albopictus | 15 | – | – |
| г. Хадыженск | Ae. albopictus | 15 | – | – |
| с. Гайдук | Ae. albopictus | 15 | – | – |
| г. Анапа | Ae. albopictus | 50 | – | 18 |
| г. Геленджик | Ae. albopictus | 15 | – | – |
| г. Абинск | Ae. albopictus | 50 | – | 21 |
| пгт. Ильский | Ae. albopictus | 15 | – | – |
| пгт. Яблоневский | Ae. albopictus | 15 | – | – |
| г. Краснодар | Ae. albopictus | 300 | – | 134 |
| г. Лабинск | Ae. albopictus | 15 | – | – |
| г. Армавир | Ae. albopictus | 15 | – | – |
| г. Кропоткин | Ae. albopictus | 15 | – | – |
| г. Кореновск | Ae. albopictus | 15 | – | – |
| г. Тимашевск | Ae. albopictus | 15 | – | – |
| г. Усть-Лабинск | Ae. albopictus | 15 | – | – |
| с. Цибанобалка | Ae. albopictus | 15 | – | – |
| ст. Ладожская | Ae. albopictus | 15 | – | – |
| Социалистическая Республика Вьетнам | ||||
| Вьетнам. г. Ханой | Ae. albopictus | 6 | Alb_3, Alb_4, Alb_5 | – |
| Ae. aegypti | 18 | Aeg_1, Aeg_2, Aeg_3, Aeg_4, Aeg_5 | – | |
Примечание. Следует отметить, что первичные сборы комаров проводились без разделения на виды. Собирались все комары, относящиеся к роду Aedes, и затем проводилась их видовая идентификация. Отсутствие определенного вида комаров в точке сбора означает его отсутствие, а не избирательность при сборах. В населенных пунктах Биробиджан, Смидович из Еврейской автономной области и Чегдомын, Берeзовый, Де-Кастри из Хабаровского края комаров подрода Stegomyia не обнаружено.
Имаго отлавливали “на себе” эксгаустером, а также в местах дневок и роения с помощью энтомологического сачка. Личинок комаров собирали в типичных местах выплода, естественного и искусственного происхождения. Отловленных насекомых помещали в 96%-ный спирт. Все собранные экземпляры комаров анализировались индивидуально.
Оценка плотности популяции комаров
Оценку плотности имаго проводили на основании активности нападения самок. Нападающих самок отлавливали “на себе” эксгаустером в вечерние часы (с 18:00 до 20:00). Во всех населенных пунктах учеты производили одни и те же три исследователя одновременно, находясь на некотором расстоянии друг от друга. Каждый исследователь садился на стул и обнажал ноги ниже колен. Мы подсчитывали сколько самок комаров нападет за 30 мин. Из полученных сборщиками данных вычислялась средняя величина. Для учета выбирали защищенные от ветра, умеренно затененные места, окруженные растительностью.
Идентификация комаров подрода Stegomyia на Дальнем Востоке России по морфологическим признакам
Определение видов проводили по ключам, опубликованным в определителях комаров [4, 6, 7]. На первом этапе имаго определяли по окраске среднеспинки. Половой диморфизм по этому признаку отсутствует. Ae. galloisi и Ae. sibiricuis различали по типу волосков на бородавке коксита [18].
Морфологическая дифференциация имаго Ae. flavopictus и Ae. albopictus проводилась по форме чешуек, образующих светлое пятно над основанием крыла самок, и строению гипопигия самцов. Морфологическая идентификация личинок Ae. albopictus и Ae. aegypti проводилась по типу чешуек щетки VIII членика брюшка и чешуек сифона [19].
Выделение ДНК и ПЦР
Для выделения тотальной ДНК из имаго и личинок каждую особь извлекали из спирта, просушивали и гомогенизировали в лизирующем растворе с протеиназой K. Тотальную ДНК выделяли фенол-хлороформным методом [20]. После очистки ДНК растворяли в деионизованной воде. Концентрация ДНК определялась спектрофотометрическим методом с использованием Implen NanoPhotometer NP80. Чистоту препарата ДНК тестировали по величине отношения 260/280 нм. Концентрацию ДНК в препаратах выравнивали до 4 нг/мкл. ПЦР проводили в конечном объеме 25 мкл с использованием наборов для амплификации EncycloPlus PCR kit (Евроген, Россия) в соответствии с инструкцией фирмы-производителя.
BOLD-фрагменты митохондриального гена COI получали с помощью стандартных фолмеровских праймеров LCO1490 и HCO2198 как описано в оригинальной работе [21]. Полученные фрагменты секвенировали.
Элюция продуктов амплификации
Фрагменты, полученные в результате амплификации, очищали в 1.5%-ном агарозном геле. Элюция фрагментов из геля проводилась с использованием набора для элюции Zymoclean™ Gel DNA Recovery Kit (Zymo Research, США) в соответствии с инструкцией фирмы-производителя.
Секвенирование
Нуклеотидную последовательность ПЦР-фрагментов определяли с прямого и обратного праймеров на приборе 3500 Genetic Analyzer с использованием реагентов BigDye®Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, США) согласно рекомендациям фирмы-производителя.
Биоинформационный анализ
Анализ хроматограмм проводили с помощью программы CromasPro 13.3 (Technelysium, Австралия). Выравнивание последовательностей, полученных в результате секвенирования, с последовательностями, размещенными в базах данных GenBank, было выполнено с использованием ресурсов NCBI (http://www.ncbi.nlm.nih.gov). Для построения дендрограммы применяли программу MEGA7 [22] c использованием метода ближайших соседей (NJ). Статистическую достоверность полученного дерева оценивали при помощи величины бутстреп-поддержки с числом репликаций 1000. Количественные данные о величине нуклеотидной изменчивости выборки и сравнение межгрупповой и внутригрупповой изменчивости проводили в программе MEGA7 [22]
Медианная сеть митохондриальных гаплотипов была построена в программе PopART [23] с применением алгоритма TCS [24].
Построение рисунков географического расположения точек отлова комаров
Приведенные рисунки являются оригинальными. Первичное построение проводилось в геоинформационной системе “Панорама 14.0.1”. Данные наблюдаемых температур были взяты из научно-прикладного справочника “Климат России” с шагом 2.5 мин. Изотермы построены методом интерполирования. Итоговый вариант рисунка оформлен в программе Adоbe Illustrator 2020.
РЕЗУЛЬТАТЫ
Места сборов комаров на территории Дальнего Востока России представлены на рис. 1. Описание сборов комаров дано в табл. 1.
Рис. 1.
Географическое расположение точек отлова комаров на территории Дальнего Востока России. Для рис. 1 и 2: линиями обозначены изотермы января и июля. Цифрами в квадратах указаны максимальные и минимальные температурные значения, отмеченные для данного региона. Серыми пунсонами отмечены точки сбора комаров, определенных только морфологическим методом; белыми пунсонами отмечены места сборов комаров, проанализированных морфологически и методом ДНК-баркодирования. Описание митохондриальных гаплотипов дано в табл. 2.

На территории Приморского края нами были обнаружены два вида комаров подрода Stegomyia – во всех точках сбора Ae. flavopictus и одна особь Ae. galloisi. В Хабаровском крае обитает Ae. flavopictus, а также было отловлено две особи Ae. galloisi. В более суровом климате и Амурской области встречался только Ae. galloisi. Граница, разделяющая ареалы видов, проходит в Еврейской автономной области.
Места сборов комаров на территории юга европейской части России представлены на рис. 2.
Рис. 2.
Географическое расположение точек отлова комаров на юге европейской части России и п-ове Крым.

На юге европейской части России нами было выявлено два вида комаров рода Aedes подрода Stegomyia: Ae. albopictus и Aedes cretinus Edwards, 1921. Мы выявили дальнейшее расширение инвазивной популяции Ae. albopictus на север до г. Тихорецка и продвижение комаров на п-ове Крым, на запад до г. Севастополя. На юге Черноморского побережья Кавказа был найден Ae. cretinus, который здесь обитал совместно с Ae. albopictus. Ae. aegypti обнаружен не был.
Нами также были изучены комары рода Aedes подрода Stegomyia г. Ханой, из Вьетнама. Были обнаружены Ae. albopictus и Ae. aegypti. Во всех местах сбора эти виды обитали совместно.
Для характеристики генетической изменчивости комаров мы определили митохондриальные гаплотипы по гену COI и провели анализ кластеризации митохондриальных гаплотипов Ae. albopictus, Ae. aegypti, Ae. flavopictus и Ae. galloisi. В литературе описаны тысячи зарегистрированных в GenBank последовательностей BOLD-фрагментов митохондриального гена COI Ae. albopictus и Ae. aegypti, зарегистрированных исследователями из многих стран. Среди такого количества последовательностей неизбежно встречаются определенные ошибочно как относящиеся к другому виду, тем более что морфологическая идентификация самок комаров подрода Stegomyia не проста. По этой причине мы использовали в качестве контролей последовательности наиболее сходные с нашими последовательностями, но представляющие максимально широкий охват ареала вида, включая как инвазивную часть ареала, так и нативный ареал видов в области тропиков Старого Света. Полученная кладограмма представлена на рис. 3. На этом рисунке систематизированы прежде всего наши собственные данные и мы не претендуем на решение проблемы реконструкции филогенетической истории комаров подрода Stegomyia и проблемы происхождения и экспансии инвазивных популяций Ae. albopictus и Ae. aegypti, которые в настоящее время довольно запутаны.
Рис. 3.
Кладограмма BOLD-фрагментов митохондриального гена COI комаров подрода Stegomyia. Темными значками отмечены нуклеотидные последовательности, полученные в данном исследовании и перечисленные в табл. 1 и 2; светлыми значками отмечены нуклеотидные последовательности Ae. albopictus, собранные на территории Краснодарского края и описанные в работе [17], но не зарегистрированные в GenBank. Нуклеотидные последовательности, взятые для сравнения, приведены с GenBank номером. В качестве внешней группы взят Aedes koreicus из группы Finlaya.

Мы выявили четкую кластеризацию каждого из видов комаров. Все выявленные видовые кластеры имеют высокие значения бутстреп-поддержки и точно соответствуют разным видам комаров, определенных по морфологическим признакам.
Внутригрупповая изменчивость для кластера Ae. galloisi равна 0.005, для кластера Ae. flavopictus – 0.005, для кластера Ae. albopictus – 0.004, для кластера Ae. aegypti – 0.013. Межгрупповая изменчивость равна 0.09.
Во всех случаях внутригрупповая изменчивость существенно меньше межгрупповой. Так как у изученных видов комаров при условии тщательного определения и исключения сомнительных случаев внутривидовая изменчивость всегда меньше межвидовой и выделение видовых кластеров имеет высокую достоверность, мы считаем видовую идентификацию комаров подрода Stegomyia на основании анализа изменчивости BOLD- фрагмента митохондриального гена COI надежным методом. Особым случаем является пара видов Ae. sibiricus и Ae. galloisi. Гаплотипы Ae. sibiricus кластеризуются вместе с Ae. galloisi.
Всего мы выявили 10 гаплотипов Ae. flavopictus, 9 гаплотипов Ae. galloisi, 5 гаплотипов Ae. albopictus и 5 гаплотипов Ae. aegypti. Гаплотип Alb_1 характеризуется мутацией, приводящей к замене изолейцина на валин в 21-й позиции продукта концептуальной трансляции контрольной последовательности BOLD-фрагмента Ae. albopictus (GenBank ID: MZ230337). Гаплотип Alb_4 Ae. albopictus характеризуется мутацией, приводящей к замене лейцина на фенилаланин в позиции 193. Две значимые мутации выявлены в гаплотипах Gal_2 и Gal_5 Ae. galloisi при сравнении с контрольной последовательностью BOLD-фрагмента Ae. galloisi (GenBank ID: MZ230351). Гаплотип Gal_2 характеризуется мутацией, приводящей к замене валина на изолейцин в позиции 112, а гаплотип Gal_5 характеризуется мутацией, приводящей к замене аденина на валин в позиции 125 продукта концептуальной трансляции. Количественные данные о гаплотипическом разнообразии изученных комаров приведены в табл. 2. Полученные в данной работе нуклеотидные последовательности BOLD-фрагментов комаров подрода Stegomyia перечислены в табл. 2.
Таблица 2.
Распространение митохондриальных COI гаплотипов комаров рода Aedes подрода Stegomyia
| Вид | Имя гаплотипа | GenBank ID | Приморский край | Хабаровский край | Амурская область | Краснодарский край и п-ов Крым | Вьетнам, г. Ханой |
|---|---|---|---|---|---|---|---|
| Ae. albopictus | Alb_1 | MZ230336 | – | – | – | 10 | – |
| Ae. albopictus | Alb_2 | MZ230337 | – | – | – | 10 | – |
| Ae. albopictus | Alb_3 | MZ230338 | – | – | – | – | 4 |
| Ae. albopictus | Alb_4 | MZ230339 | – | – | – | – | 1 |
| Ae. albopictus | Alb_5 | MZ230340 | – | – | – | – | 1 |
| Ae. flavopictus | Fl_1 | MZ230341 | – | 4 | – | – | – |
| Ae. flavopictus | Fl_2 | MZ230342 | 1 | 5 | – | – | – |
| Ae. flavopictus | Fl_3 | MZ230343 | – | 2 | – | – | – |
| Ae. flavopictus | Fl_4 | MZ230344 | – | 1 | – | – | – |
| Ae. flavopictus | Fl_5 | MZ230345 | 1 | 2 | – | – | – |
| Ae. flavopictus | Fl_6 | MZ230346 | 1 | – | – | – | – |
| Ae. flavopictus | Fl_7 | MZ230347 | 2 | – | – | – | – |
| Ae. flavopictus | Fl_8 | MZ230348 | – | 1 | – | – | – |
| Ae. flavopictus | Fl_9 | MZ230349 | 1 | – | – | – | – |
| Ae. flavopictus | Fl_10 | MZ230350 | – | 1 | – | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_1 | MZ230351 | – | 1 | 5 | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_2 | MZ230352 | – | – | 1 | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_3 | MZ230353 | – | – | 1 | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_4 | MZ230354 | – | – | 1 | – | – |
| Ae. galloisi | Gal_5 | MZ230355 | – | 1 | – | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_6 | MZ230356 | – | – | 1 | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_7 | MZ230357 | – | – | 1 | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_8 | MZ230358 | – | – | 1 | – | – |
| Ae. galloisi (Ae. sibiricus) | Gal_9 | MZ230359 | – | – | 1 | – | – |
| Ae. aegypti | Aeg_1 | MZ230360 | – | – | – | – | 11 |
| Ae. aegypti | Aeg_2 | MZ230361 | – | – | – | – | 6 |
| Ae. aegypti | Aeg_3 | MZ230362 | – | – | – | – | 2 |
| Ae. aegypti | Aeg_4 | MZ230363 | – | – | – | – | 1 |
| Ae. aegypti | Aeg_5 | MZ230364 | – | – | – | – | 3 |
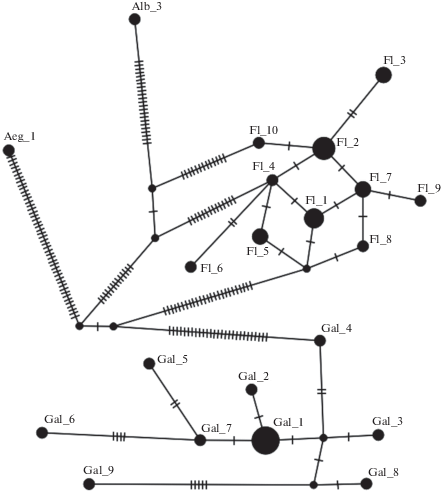
Для анализа генетической изменчивости по гену COI двух потенциально инвазивных популяций Дальнего Востока России Ae. galloisi и Ae. flavopictus была построена медианная сеть митохондриальных гаплотипов. Она представлена на рис. 4. Интересной особенностью Ae. galloisi и Ae. flavopictus является отсутствие четко выраженного предкового гаплотипа, что обычно хорошо видно в случае инвазивных популяций [25]. Тем не менее все гаплотипы образуют компактную группу.
Рис. 4.
Медианная сеть митохондриальных гаплотипов Ae. flavopictus (Fl) и Ae. galloisi (Gal) Дальнего Востока России, построенная с участием единичных гаплотипов Ae. aegipty (Aeg) и Ae. albopictus (Alb). Медианная сеть построена в программе PopArt на основании нуклеотидного полиморфизма фрагмента гена COI длиной 658 пн. Штрихи отмечают мутационные события. Размер кружков пропорционален числу синонимичных гаплотипов.
ОБСУЖДЕНИЕ
В Российской Федерации обитает большое количество видов комаров рода Aedes, из них шесть видов относятся к подроду Stegomyia. Среди разных аспектов биологии комаров подрода Stegomyia большое внимание привлекает межвидовая конкуренция и конкурентное исключение видов со сходной биологией. В ряде стран наблюдалось конкурентное исключение Ae. aegypti и Ae. albopictus в обоих направлениях [26]. Данные виды имеют близкие экологические ниши. Ae. albopictus предпочитает агроландшафты, но может обитать и в городах, тогда как Ae. aegypti имеет строгое предпочтение к населенным пунктам [27, 28]. Оба вида выбирают в качестве мест выплода небольшие емкости со стоячей водой, объемом от 100 мл, которые часто оказываются общими. На территории России описаны только инвазивные формы обоих видов. Мы полагаем, что одной из причин исчезновения Ae. aegypti на юге европейской части России стала его конкуренция с Ae. albopictus на личиночной стадии [29]. Третий вид комаров подрода Stegomyia, обитающий на юге европейской части России, – Ae. cretinus обнаруживается как в агроландшафте, так и в лесу, в удалении от населенных пунктов. Таким образом, лесная часть популяции почти не конкурирует с Ae. albopictus.
Существование конкурентного исключения возможно и в паре видов Ae. flavopictus и Ae. galloisi, что могло бы объяснить преимущественно раздельное обитание этих видов. Однако в данном случае более вероятно влияние климатических факторов. Ae. galloisi может обитать на территориях с существенно более суровым и континентальным климатом, чем Ae. flavopictus. Северная и восточная границы ареала Ae. flavopictus совпадают с изотермами: июля +20°С и января –24°С.
Отдельного внимания заслуживает уточнение видового статуса Ae. galloisi. Используемые нами определители комаров не включали новые данные о выделении вида Ae. sibiricus из ранее описанного Ae. galloisi [18]. В литературе приводятся ключи для идентификации данных видов по окраске лапок и по строению гипопигия самцов [5, 18], однако в наших сборах окраска лапок сильно варьировала, поэтому мы идентифицировали только самцов по строению гипопигия.
По результатам морфологического анализа все найденные самцы комаров из Амурской области и Хабаровского края были определены как Ae. sibiricus, а единственная особь, найденная нами в Приморском крае, – самец Ae. galloisi. Такое разделение соответствует экологическим предпочтениям видов. Ae. sibiricus обнаруживался в Томской, Новосибирской областях [5]. Ранее Ae. sibiricus был обнаружен в Приморском крае [18]. Ae. galloisi характерен для территорий со значительно более мягким климатом: Южной Кореи и Японии. Однако результаты ДНК-баркодирования не показали значимых различий между комарами, определенными как Ae. sibiricus, особью из Приморского края и Ae. galloisi из Японии, гаплотипы которых представлены в GenBank. Возможно, это объясняется тем, что Ae. sibiricus и Ae. galloisi недавно разделившиеся виды и митохондриальный ген COI не подходит для их идентификации.
В базе данных GenBank содержится большое количество данных по митохондриальным гаплотипам комаров подрода Stegomyia. Некоторые митохондриальные гаплотипы, зарегистрированные в GenBank как Ae. albopictus, кластеризуются с другими видами подрода. Так, гаплотипы с GenBank ID: HQ398902 [30], KY982363, KY982365 [31] кластеризуются с Ae. galloisi. Митохондриальные гаплотипы Ae. albopictus с GenBank ID: KY982343–KY982352, KY982361 [31], MF148257, MF148262, MF148266, MF148269, MF148272, MF148273, MF148294–MF148300, MF148302, MT434294 Viet Nam кластеризуются с Ae. aegypti. Если эти данные верны, то внутривидовая генетическая изменчивость Ae. albopictus почти равна изменчивости всего подрода Stegomyia. Альтернативным объяснением этих аномалий может являться ошибочное отнесение вышеуказанных образцов к Ae. albopictus в силу визуальной схожести комаров подрода Stegomyia. Если это так, то вывод о высокой изменчивости Ae. albopictus и соответственно о древности нативной популяции вида ошибочен. Существенно отметить, что аномальные последовательности Ae. albopictus не образуют уникальных клад, а кластеризуются вместе с известными видами. Мы полагаем, что если исключить случаи сомнительного определения Ae. albopictus, то логичным выводом из генетических данных будет представление о Ae. albopictus как о молодом виде, недавно прошедшем через период взрывного роста численности. Этот же вывод может быть справедлив и в отношении других видов комаров подрода Stegomyia.
Интересной особенностью стало наблюдение смены экологических предпочтений Ae. galloisi (Ae. sibiricus) и Ae. flavopictus на Дальнем Востоке России. Ранее эти виды описывались как лесные, почти никогда не нападающие на человека [5, 10], однако в настоящий момент мы выявили плотные популяции этих видов на территориях крупных городов. Самки Ae. galloisi и Ae. flavopictus активно питаются на человеке и выбирают в качестве мест для откладки яиц емкости антропогенного происхождения. Мы считаем, что наблюдается переход к синантропному существованию, что значительно повышает инвазивный потенциал этих видов. Инвазивный статус популяций Ae. galloisi и Ae. flavopictus подтверждается близким родством найденных нами в этих популяциях митохондриальных гаплотипов. Отсутствие единственного доминантного гаплотипа в случае этих видов может быть связано как с начальной стадией формирования инвазивной популяции, так и с другими причинами, например активными процессами миграции. Мы предполагаем дальнейшее расширение ареала и повышение плотности популяций Ae. galloisi и Ae. flavopictus в Сибири и на Дальнем Востоке Российской Федерации. В этих регионах Ae. galloisi и Ae. flavopictus могут представлять угрозу как потенциальные переносчики арбовирусных лихорадок человека [32].
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90192.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Все авторы статьи внесли равный вклад в исследование.
Список литературы
Рябова Т.Е., Юничева Ю.В., Маркович Н.Я. и др. Обнаружение комаров Aedes (Stegomyia) aegypti в г. Сочи // Мед. паразитол. 2005. № 3. С. 3–5.
Ганушкина Л.А., Таныгина Е.Ю., Безжонова О.В., Сергиев В.П. Об обнаружении комаров Aedes (Stegomyia) albopictus Skus. на территории Российской Федерации // Мед. паразитол. 2012. № 1. С. 3–4.
Коваленко И.С., Якунин С.Н., Абибулаев Д.Э. и др. Обнаружение Aedes (Stegomyia) albopictus (Skuse, 1895) в Крыму // Проблемы особо опасных инфекций. 2020. В. 2. С. 135–137. https://doi.org/10.21055/0370-1069-2020-2-135-137
Гуцевич В.А., Мончадский А.С., Штакельберг А.А. Насекомые двукрылые. Комары (семейство Culicidae). Фауна СССР. Т. 3. Вып. 4. Л.: Наука, 1970. 384 с.
Полторацкая Н.В., Мирзаева А.Г. О новых находках редкого для Западной Сибири вида комаров Aedes sibiricus Danilov et Filippova, 1978 (Diptera, Culicidae) // Евразиатский энтомол. журн. 2013. В. 12(2). С. 144–146.
Ree H. Taxonomic review and revised keys of the Korean mosquitoes (Diptera: Culicidae) // Korean J. Entomology. 2003. V. 33(1). P. 39–52. https://doi.org/10.1111/j.1748-5967.2003.tb00047.x
Tanaka K., Mizusawa K., Saugstad E.S. A revision of the adult and larval mosquitoes of Japan (including the Ryukyu Archipelago and the Ogasawara Islands) and Korea (Diptera: Culicidae) // Contrib. Am. Entomol. Inst. 1979. V. 16. P. 1–987.
Kambhampati S., Rai K.S. Variation in mitochondrial DNA of Aedes species (Diptera: Culicidae) // Evolution. 1991. V. 45. P. 120–129. https://doi.org/10.2307/2409487
Gaunt C.M.T., Mutebi J.P., Munstermann L.E. Biochemical taxonomy and enzyme electrophoretic profiles during development, for three morphologically similar Aedes species (Diptera: Culicidae) of the subgenus Stegomyia // J. Med. Entomol. 2004. V. 41(1). P. 23–32. https://doi.org/10.1603/0022-2585-41.1.23
Toma T., Miyagi I., Crabtree M.B., Miller B.R. Investigation of the Aedes (Stegomyia) flavopictus complex (Diptera: Culicidae) in Japan by sequence analysis of the internal transcribed spacers of ribosomal DNA // J. Med. Entomol. 2002. V. 39. P. 461–468. https://doi.org/10.1603/0022-2585-39.3.461
Maekawa Y., Ogawa K., Komagata O. et al. DNA barcoding for molecular identification of Japanese mosquitoes // Med. Entomol. Zool. 2016. V. 67. P. 183–198. https://doi.org/10.7601/mez.67.183
Taira K., Toma T., Tamashiro M., Miyagi I. DNA barcoding for identification of mosquitoes (Diptera: Culicidae) from the Ryukyu Archipelago // Med. Entomol. Zool. 2012. V. 63. P. 289–306. https://doi.org/10.7601/mez.63.289
Miyagi I., Toma T. Experimental crossing of Aedes albopictus, Aedes flavopictus downsi and Aedes riversi (Diptera: Culicidae) occurring in Okinawajima, Ryukyu Islands // Japanese J. Sanit Zool. 1989. V. 40. P. 87–95.
Battaglia V., Gabrieli P., Brandini S. et al. The worldwide spread of the tiger mosquito as revealed by mitogenome haplogroup diversity // Front Genet. 2016. V. 23. https://doi.org/10.3389/fgene.2016.00208
Ze-Ze L., Borges V., Osorio H.C. et al. Mitogenome diversity of Aedes (Stegomyia) albopictus: Detection of multiple introduction events in Portugal // PLoS Negl. Trop. Dis. 2020. PMID: 32997656. PMCID: PMC7549828https://doi.org/10.1371/journal.pntd.0008657
Minard G., Tran Van V., Tran F.H. et al. Identification of sympatric cryptic species of Aedes albopictus subgroup in Vietnam: new perspectives in phylosymbiosis of insect vector // Parasit. Vectors. 2017. V. 10(1). https://doi.org/10.1186/s13071-017-2202-9
Федорова М.В., Швец О.Г., Медяник И.М., Шайкевич Е.В. Генетический анализ популяции завозных кровососущих комаров Aedes (Stegomyia) albopictus (Skuse, 1895) (Diptera, Culicidae) в Краснодарском крае // Паразитология. 2019. Т. 53. № 6. С. 518–528. https://doi.org/10.1134/S0031184719060073
Данилов В.Н., Филиппова В.В. Новый вид комара Aedes (Stegomyia) sibiricus sp. n. (Culicidae) // Паразитология. 1978. Т. 12(2). С. 170–176.
Press M. Pictorial keys for the identification of mosquitoes (Diptera: Culicidae) associated with Dengue Virus Transmission // Zootaxa. 2004. 60 p.https://doi.org/10.5281/zenodo.169153
Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 479 с.
Folmer O., Black M., Hoeh W. et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. 1994. V. 3(5). P. 294–299.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets // Mol. Biol. Evol. 2016. V. 33(7). P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Leigh J.W., Bryant D., Nakagawa S. PopArt: full-feature software for haplotype network construction // Methods Ecol. Evol. 2015. V. 6(9). P. 1110–1116. https://doi.org/10.1111/2041-210x.12410
Clement M., Posada D., Crandall K.A. TCS: A computer program to estimate gene genealogies // Mol. Ecology. 2000. V. 9(10). P. 1657–1659. https://doi.org/10.1046/j.1365-294x.2000.01020.x
Андрианов Б.В., Романов Д.А., Горелова Т.В., Горячева И.И. Полиморфизм контрольного района митохондриальной ДНК нативных и инвазивных популяций Harmonia axyridis (Coleoptera, Coccinellidae) // Генетика. 2019. Т. 55. № 7. С. 819–825. https://doi.org/10.1134/S0016675819070038
Shragai T., Harrington L., Alfonso-Parra C., Avila F. Oviposition site attraction of Aedes albopictus to sites with conspecific and heterospecific larvae during an ongoing invasion in Medellín, Colombia // Parasites Vectors. 2019. V. 12. https://doi.org/10.1186/s13071-019-3710-6
Wilson-Bahun T.A., Kamgang B., Lenga A., Wondji C.S. Larval ecology and infestation indices of two major arbovirus vectors, Aedes aegypti and Aedes albopictus (Diptera: Culicidae), in Brazzaville, the capital city of the Republic of the Congo // Parasites Vectors. 2020. V. 13. https://doi.org/10.1186/s13071-020-04374-x
Farjana T., Tuno N., Higa Y. Effects of temperature and diet on development and interspecies competition in Aedes aegypti and Aedes albopictus // Med. Vet. Entomol. 2012. V. 26(2). https://doi.org/10.1111/j.1365-2915.2011.00971.x
Бега А.Г., Москаев А.В., Гордеев М.И. Экология и распространение инвазивного вида комаров Aedes albopictus (Skuse, 1895) на юге Eвропейской части России // РЖБИ. 2021. № 1. С. 27–38. https://doi.org/10.1134/S2075111721020041
Cook S., Lien N.G., McAlister E., Harbach R.E. Bothaella manhi, a new species of tribe Aedini (Diptera: Culicidae) from the Cuc Phuong National Park of Vietnam based on morphology and DNA sequence // Zootaxa. 2010. V. 266(1). P. 33–46. https://doi.org/10.11646/zootaxa.2661.1.2
Adilah-Amrannudin N., Hamsidi M., Ismail N.A. et al. Aedes albopictus in urban and forested areas of Malaysia: A study of mitochondrial sequence variation using the CO1 marker // Trop. Biomed. 2018. V. 3. P. 639–652.
Srisawat R., Phanitchat T., Komalamisra N. et al. Susceptibility of Aedes flavopictus miyarai and Aedes galloisi mosquito species in Japan to dengue type 2 virus // Asian Pac. J. Trop. Biomed. 2016. V. 6(5). P. 446–450. https://doi.org/10.1016/j.apjtb.2016.03.003
Дополнительные материалы отсутствуют.


