Генетика, 2022, T. 58, № 3, стр. 362-366
Митохондриальный геном Phylloscopus examinandus и гипотеза его происхождения
Л. Н. Спиридонова 1, *, О. П. Вальчук 1
1 Федеральный центр биоразнообразия Дальневосточного отделения
Российской академии наук
690022 Владивосток, Россия
* E-mail: spiridonova@biosoil.ru
Поступила в редакцию 15.07.2021
После доработки 17.08.2021
Принята к публикации 02.09.2021
- EDN: MLEMOI
- DOI: 10.31857/S0016675822030146
Аннотация
Впервые проведено секвенирование полного митохондриального генома трех гнездовых особей пеночки-таловки Phylloscopus examinandus (Stresemann, 1913) (Passeriformes, Phylloscopidae) с о-ва Сахалин. Структура митохондриального генома характерная для рода Phylloscopus с двумя контрольными регионами: функциональным CRI и частичным (псевдо-) CRII. Генетическая дивергенция мт-геномов Ph. examinandus и Ph. borealis (Генбанк), ранее считавшимися подвидами, по нашим данным составила более 4%, что значительно превышает межвидовые значения для птиц (примерно 2%). У одной особи Ph. examinandus наряду с таксон-специфичным мт-гаплотипом были обнаружены фрагменты ядерной копии мтДНК, сходные с митохондриальным гаплотипом Ph. borealis. Данный факт позволяет рассматривать гипотезу происхождения гаплотипа Ph. examinandus из ядерного генома Ph. borealis посредством межгеномной рекомбинации, ранее описанного для других воробьиных птиц.
Молекулярно-генетические исследования, проводимые для выявления дифференциации близкородственных таксонов, в большинстве случаев основаны на одном митохондриальном гене. Классическим стало использование таких маркеров как цитохром b, контрольный регион, реже цитохром-оксидаза 1 или NADH–дегидрогеназный комплекс. Как было показано ранее для рыбного филина [1], взгляды на систематическую принадлежность птиц по данным молекулярной биологии могут изменяться в зависимости от выбранного метода, исследованного фрагмента ДНК и его длины. Наиболее достоверные результаты для определения филогенетических связей близкородственных таксонов чаще всего бывают получены с применением полного митохондриального генома (митогенома).
Систематика форм, входящих в состав группировки пеночек-таловок Phylloscopus borealis (Blasius, JH, 1858) sensu lato, представляет собой один из наиболее сложных случаев среди пеночек Северной Палеарктики [2]. В настоящее время признанным результатом анализа гена цитохрома b митохондриальной ДНК (мтДНК) является разделение ранее сложного политипического вида Ph. borealis на три самостоятельных формы, при этом вопрос о номенклатурном положении двух выделенных видов был решен с помощью исследований типовых экземпляров examinandus и xanthodryas [3], для которых предложены следующие английские названия – Kamchatka Leaf Warbler для Ph. examinandus, распространенной в южной части Камчатки, на Курильских островах, Хоккайдо, Сахалине, Japanese Leaf Warbler для Ph. xanthodryas, населяющей о-в Хонсю и более южные Японские острова, а для оставшейся части Ph. borealis, распространенной в континентальный части Евразии (исключая Камчатку) и на Аляске, предлагается оставить прежнее название Arctic Warbler.
Внутривидовое разнообразие вновь выделенных таксонов до сих пор специально не изучалось, однако не исключено, что в состав Ph. examinandus входит несколько разных форм, хорошо отличающихся, по крайней мере, морфологически [4, наши данные], подобно тому, как это многократно отмечено для Ph. borealis, включающей до трех–четырех форм [2, 5]: Ph. b. talovka, Ph. b. borealis, Ph. b. transbaicalica, и Ph. b. kennicotti.
Время дивергенции между выявленными филогруппами митохондриальных гаплотипов таловки по гену цитохром b с прохождением “бутылочного горлышка” в результате сдвигов и сокращений ареалов популяций относят к плиоцену и плейстоцену [6]. Выполненные к настоящему времени генетические исследования представителей данных группировок [3, 6, 7] пока не позволяют выявить характер репродуктивных отношений между ними.
Исследования изменчивости морфологических признаков [4] показали, что таловки с “медленной” песней делятся на две группы, соответствующие также двум географическим расам: более крупную камчатскую (собственно Ph. b. examinandus Stresemann, 1913) и занимающую остальную часть гнездового ареала, более мелкую Ph. b. hylebata Swinhoe, 1860. По морфологическим данным гнездящаяся популяция сахалинских таловок имеет смешанные признаки и ближе к подвиду Ph. b. hylebata [5], однако по данным гена цитохрома b сахалинские птицы имеют митохондриальный гаплотип Ph. b. examinandus [6]. Интересным моментом является то, что через Восточный Сахалин в массе мигрируют явно камчатские таловки, крупные и имеющие более яркую зеленую окраску оперения. Эти птицы встречаются на побережье в зарослях кедрового стланика, где явно не гнездятся, но регулярно встречаются и после календарного завершения миграции в конце июня–первых числах июля. Поскольку таксономический статус сахалинского подвида до настоящего времени не решен, цель настоящей работы – описание полных митогеномов нескольких экземпляров гнездовых пеночек-таловок с о-ва Сахалин с целью уточнения таксономической принадлежности этой формы.
Материалом для анализа послужили три образца крови гнездовых птиц с о-ва Сахалин: самец от выводка на горе Пик (Ногликский р-н), самец и самка с яйцом в яйцеводе из окрестностей с. Кировское (Тымовский р-н). ДНК выделена с помощью кита DNeasy Blood and Tissue kit (Qiagen) по приложенной инструкции. Секвенирование митохондриальных геномов проведено методом пиросеквенирования на Roche GS Junior. Приготовление быстрой библиотеки с лигированными адаптерами, проведение эмульсионной ПЦР, секвенирование с реагентами GS JuniorTitaniumSeries выполнялось согласно инструкциям фирмы-изготовителя прибора и реактивов – 454 LifeScienceCorp., RocheCompany, Branford, CT 06405, USA. Покрытие составляло 300–650×. Нуклеотидные последовательности собирали с помощью программы GS De Novo Assembler (http://454.com/products/analysis-software/index.asp). Аннотирование проведено с помощью программ Sequin и tRNAscan-SE On-line [8]. Полученные последовательности депонированы в базу данных NCBI под номерами доступа: MK690473, MK695926 и MK695927.
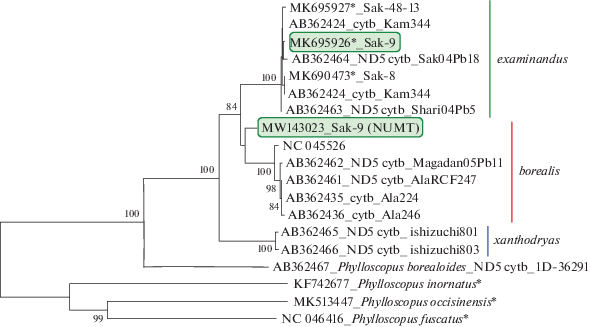
Впервые прочитаны полные митохондриальные геномы трех гнездовых особей с Сахалина. Все птицы имели гаплотип Ph. examinandus. Общая длина митогенома для двух птиц составила 16 884 пн, у одной из особей в контрольном регионе обнаружена делеция из трех нуклеотидов (16 881 пн). Нуклеотидное разнообразие анализируемых митогеномов составило Pi = 0.00137, а гаплотипическое – H = 1. Неожиданно оказалось, что одна птица имела две отличающиеся нуклеотидные последовательности. Одна из них была таксон-специфичным митохондриальным гаплотипом examinandus, а вторая последовательность оказалась ядерной копией мтДНК (NUMT), сходной с митохондриальным гаплотипом borealis. Филогенетический анализ по полученным данным полных митогеномов и обнаруженных фрагментов ядерной копии мтДНК общей длинной 3.3 тпн (номер доступа в Генбанке MW143023) проведен совместно с данными, взятыми из Генбанка: Ph. b. borealis AB362462; HQ608832; NC045526; Ph. b. kennicotti AB362461; Ph. b. examinandus AB362463; AB362464; Ph. b. xanthodryas AB362465; AB362466. В качестве внешней группы использовались Ph. borealoides AB362467; Ph. occisinensis MK513447 и Ph. fuscatus NC046416.
Филогенетическое дерево (рис. 1) сконструировано методом максимального правдоподобия (ML) по модели замен GTR + I (BIC = 93 686.154) в программе MEGA ver. 7 [9]. Для оценки достоверности ветвлений филогенетического дерева, построенного по методу ML, проводилось 500 репликаций [10]. Реконструкция филогенетических отношений выявила три филогруппы гаплотипов, соответствующие ранее установленным по цитохрому b и сгрупировала таловок о-ва Сахалин с Ph. examinandus. Обнаруженная ядерная копия мтДНК выделилась в отдельную ветвь, близкую кладе Ph. borealis. Причиной сходства ядерной копии мтДНК Ph. examinandus с митохондриальным геномом Ph. borealis может быть только общий источник их происхождения, т. е. мтДНК. Перенос митохондриальной последовательности в ядерный геном, в результате которого одинаковые последовательности оказались в геномах разных видов, произошел путем гомологичной рекомбинации, описанной ранее у других видов птиц [11–13]. Таким образом, глубокая дивергенция между таксон-специфичными гаплотипами borealis и examinandus связана с рекомбинационными процессами в ядерном геноме, а не со спонтанным накоплением мутаций в митохондриальном, как предполагалось ранее [3, 6, 7]. Дивергенция ядерной копии мтДНК Ph. examinandus с митохондриальным гаплотипом Ph. borealis может свидетельствовать о значительном времени пребывания митохондриальной копии в ядерном геноме и происходящих в ней мутациях.
Рис. 1.
Филогенетическое дерево, построенное по методу ML по полным митохондриальным геномам (*) и частичным фрагментам (ND5–cytb). В узлах ветвлений приведены значения бутстреп-поддержки при 500 повторах (%).
На рис. 2 показано расположение кодирующих генов в митогеноме одной из птиц (№ 8 MK690473). Стрелками обозначены неполные копии генов COX1, COX2, ND3, ATP6 и cyt b, находящихся на обратной цепи в транскрипционной ориентации, противоположной нормальным генам. Такие псевдогены не пригодны к транскрипции и свидетельствуют о том, что данный митохондриальный геном перешел из ядра в митохондрию, а не наоборот [14].
Рис. 2.
Схема расположения генов и их неполных копий на обратной цепи митохондриальной ДНК (указаны стрелками), аннотированные в программе GeSeq – Annotation of Organellar Genomes (https://chlorobox.mpimp-golm.mpg.de/geseq.html).

В настоящее время NUMT обнаружены во всех исследованных в этом отношении растениях и животных. С.Д. Гребельный с соавт. [14] провели анализ хранящихся в Генбанке последовательностей митохондриальных генов из работ по филогенетике разных таксонов и убедительно показали причину этих несоответствий – использование в анализе ядерных копий митохондриальных генов [14]. Сравнение митохондриальных генов и их ядерных копий может пролить свет на происхождение таксон-специфичных митохондриальных гаплотипов, как было показано нами ранее [11–13].
Еще одним свидетельством переноса гомологичной нуклеотидной последовательности именно из ядра в работающую митохондрию, а не наоборот, является, например, то, что у Hydra oligastis в ее линейной митохондриальной ДНК имеется непригодная к транскрипции неполная копия COX1. Она присутствует на одном конце молекулы, в транскрипционной ориентации, противоположной остальной части гена, входя в состав инвертированного терминального повтора, характерного для линейных мтДНК [15]. Sh. Song с соавт. [16] рассматривают появление интрон-содержащих NUMT как результат переноса в ядро участков мтДНК вместе с находящимися в них интронами. По другому предположению, более вероятно как раз противоположное движение. В процессе рекомбинации ядерного генома интроны ядерных генов попали в уже лежавшие в хромосомах NUMT, а затем благодаря своей гомологии с мтДНК попали в работающие митохондрии, доставив туда несвойственные митохондриальному геному фрагменты интронов, заимствованных из ядра [14].
Таким образом, нами обнаружен еще один факт гомологии между ядерными копиями митохондриального генома одного вида с собственно митохондриальным геномом другого вида, что указывает на существование обмена генетической информацией между ядром и митохондриями. Возникновение гаплотипа Ph. examinandus в результате гомологичной рекомбинации между ядерным и митохондриальным геномами у особи Ph. borealis проясняет причину существования в природе широкоареальных видов с глубокодивергированными митохондриальными гаплотипами, где имеют место случаи с межгеномной рекомбинацией (Calliope calliope s.l., Calliope pectoralis s.l.) и видами, не имеющими такой дивергенции (Motacilla alba s.l.), т.е. тех, у которых в истории не было межгеномной рекомбинации.
Работа выполнена при поддержке Программы Дальний Восток, проект 15I6079.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Спиридонова Л.Н., Сурмач С.Г. Полный митохондриальный геном рыбного филина Bubo (Ketupa) blakistoni (Strigiformes, Strigidae) свидетельствует в пользу его возвращения в род Ketupa // Генетика. Т. 54. № 3. С. 373–378. https://doi.org/10.7868/S0016675818030128
Глущенко Ю.Н., Нечаев В.А., Редькин Я.А. Птицы Приморского края: краткий фаунистический обзор. М.: Тов-во науч. изданий КМК, 2016. 523 с.
Alström P., Saitoh T., Williams D. et al. The Arctic warbler Phylloscopus borealis – three anciently separated cryptic species revealed // Ibis. 2011. V. 153. P. 395–410.
Red’kin Ya.A. Geographic variation and reproductive isolation in the eastern populations of arctic warbler // Avian Migrants in the Northern Pacific: Breeding and Stopover Sites in Changing Earth. Yuzhno-Sakhalinsk: 2013. 11 p.
Коблик Е.А., Редькин Я.А., Архипов В.Ю. Список птиц Российской Федерации. М.: Тов-во науч. изданий КМК, 2006. 256 с.
Saitoh T., Alstrom P., Nishiumi I. et al. Old divergences in a boreal bird supports long-term survival through the Ice Ages // BMC Evol. Biol. 2010. V. 10(1). № 35. https://doi.org/10.1186/1471-2148-10-35
Reeves A.B., Drovetski S.V., Fadeev I.V. Mitochondrial DNA data imply a stepping-stone colonizaiton of Beringia by arctic warbler Phylloscopus borealis // J. Avian Biol. 2008. V. 39. P. 567–575.
Lowe T.M., Chan P.P. tRNAscan-SE On-line: Search and contextual analysis of transfer RNA genes. // Nucl. Acids Res. 2016. V. 44. P. 54–57.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetics analysis, version 7.0 for bigger datasets // Mol. Biol. and Evol. 2016. V. 33. P. 1870–1874.
Felsenstein J. Confidence limits on phylogenies: An approach using the bootstrap // Evolution. 1985. V. 39. P. 783–791.
Спиридонова Л.Н., Редькин Я.А., Вальчук О.П., Крюков А.П. Ядерные копии митохондриальных генов – источник новых вариантов гаплотипов гена цитохрома b Luscinia calliope (Muscicapidae, Aves) // Генетика. 2016. Т. 52. № 9. С. 1069–1080. https://doi.org/10.7868/S0016675816090137
Спиридонова Л.Н., Вальчук О.П., Редькин Я.А. и др. Филогеография и демографическая история соловья-красношейки Luscinia calliope // Генетика. 2017. Т. 49. № 6. С. 735–742. https://doi.org/10.7868/S0016675817080100
Спиридонова Л.Н., Вальчук О.П., Редькин Я.А. Новый случай рекомбинации между ядерным и митохондриальным геномами в роде Calliope Gould, 1836 (Muscicapidae, Aves): гипотеза происхождения Calliope pectoralis Gould, 1837 // Генетика. 2019. Т. 55. № 1. С. 81–93. https://doi.org/10.1134/S0016675819010132
Гребельный С.Д., Иванова Н.Ю., Нефедова Е.А. Обмен между ядерным и митохондриальными геномами (по результатам анализа ядерных и цитоплазматических копий митохондриальных генов – numts и cymts) // Цитология. 2018. Т. 60. № 11. С. 899–902. https://doi.org/10.1134/S004137711811007X
Kayal E., Lavrov D.V. The mitochondrial genome of Hydra oligactis (Cnidaria, Hydrozoa) sheds new light on animal mtDNA evolution and cnidarian phylogeny // Gene. 2008. V. 410. P. 177–186. https://doi.org/10.1016/j.gene.2007.12.002
Song Sh., Jiang F., Yuan J. et al. Exceptionally high cumulative percentage of NUMTs originating from linear mitochondrial DNA molecules in the Hydra magnipapillata genome // BMC Genomics. 2013. V. 14. P. 447–259. https://doi.org/10.1186/1471-2164-14-447
Дополнительные материалы отсутствуют.


