Генетика, 2022, T. 58, № 4, стр. 419-428
Генетическая изменчивость сибирского чукучана Catostomus catostomus rostratus (Teleostei: Catastomidae) из водоемов Северо-Востока России
Л. Т. Бачевская 1, В. В. Переверзева 1, *, А. А. Примак 1, Г. А. Агапова 1
1 Институт биологических проблем Севера Дальневосточного отделения
Российской академии наук
685000 Магадан, Россия
* E-mail: vvpereverzeva@mail.ru
Поступила в редакцию 22.04.2021
После доработки 20.10.2021
Принята к публикации 11.11.2021
- EDN: AHKHXQ
- DOI: 10.31857/S0016675822040038
Аннотация
Впервые получены данные об изменчивости нуклеотидной последовательности гена цитохрома b мтДНК и аминокислотной последовательности кодируемого им полипептида у сибирского чукучана Catostomus catostomus rostratus (Tilesius, 1814) из оз. Дарпир (бассейн р. Колымы, северо-восток Сибири). Сигналы молекулярной адаптации у сибирского чукучана из водоемов Колымо-Индигирской низменности обнаружены в небольшом количестве и только в выборке из оз. Дарпир. Вероятно, это обусловлено высокой консервативностью аминокислотной последовательности митохондриальных белков. В то же время нельзя исключить, что адаптивные варианты белка цитохрома b были утрачены представителями этого вида в процессе изменения климата в голоцене. Отмечено, что длительная репродуктивная изоляция сибирского чукучана – подвида обыкновенного чукучана из Северной Америки привела к существенной внутривидовой дивергенции. Несмотря на дивергенцию гаплотипов, кодирующих Fch1 полипептида цитохрома b, эта форма энзима широко распространена на всем ареале вида и, вероятно, является наиболее функционально эффективной.
Сибирский чукучан Catostomus catostomus rostratus (Tilesius, 1814) – пресноводная рыба сем. Catostomidae (отр. Cypriniformes, Teleostei), эндемик водоемов северо-востока России. Он является подвидом обыкновенного чукучана Catostomus catostomus (Forster, 1773), широко распространенного в реках Северной Америки [1]. Ареал сибирского чукучана значительно удален от основного ареала вида. Он имеет ограниченное распространение в Азии и встречается только в реках Колымо-Индигирской низменности [2–7].Расселение этого вида из Америки в бассейны рек Азии произошло, по-видимому, в период одной из регрессий [6, 8]. Молекулярно-генетические исследования популяций сибирского чукучана из рек северо-востока России позволили обнаружить полиморфизм гена цитохрома b (cytb) мтДНК [9]. Сравнительный анализ нуклеотидных последовательностей указанного гена сибирского чукучана из рек этого региона и обыкновенного чукучана из североамериканских водоемов показал, что проникновение вида в Азию из Северной Америки произошло в раннем неоплейстоцене [9, 10]. Кроме того, обнаружена значительная доля межгрупповой изменчивости, которая, по-видимому, обусловлена длительным периодом изоляции сибирского и обыкновенного чукучанов [9–11].
Геологическая история формирования бассейнов рек Колымы и Индигирки, в которых обитает сибирский чукучан, весьма сложная [12, 13]. В результате геологических событий указанные бассейны рек, имевшие в прошлом связь, потеряли ее. Это привело к изоляции популяций сибирского чукучана из этих водоемов. Сравнительный анализ молекулярно-генетических данных, характеризующих сибирского чукучана из рек Колымского бассейна и р. Индигирки, позволил отметить, что последние более разнообразны. Вероятно, это обусловлено возрастом исследованных популяций C. catostomus rostratus [11].
Как известно, для пресноводных гидробионтов естественными барьерами, которые ограничивают миграции видов и обеспечивают их генетическую внутривидовую и внутрипопуляционную дифференциацию, являются участки суши между водными системами, а также водоемы, по комплексу условий непригодные для их существования.
В свою очередь озерные популяции, обитающие в существенной, а иногда и в полной изоляции от других субъединиц вида, подвержены воздействию микроэволюционных процессов, которые приводят к уникальности населения каждой из них. Генетические эффекты изоляции для озерных популяций сибирского чукучана до настоящего времени не изучены. В связи с этим была расширена география исследований и был изучен сибирский чукучан из оз. Дарпир (бассейн р. Колымы). Цель работы – определение полиморфизма гена цитохрома b мтДНК сибирского чукучана из оз. Дарпир и проведение сравнительного анализа его генетического разнообразия с генетической изменчивостью подвида из других водоeмов бассейнов рек Колымы и Индигирки.
МАТЕРИАЛЫ И МЕТОДЫ
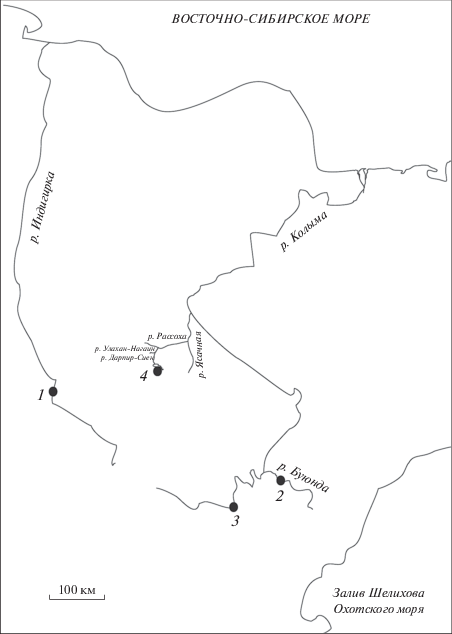
В 2019 г. собраны биологические пробы мышечной ткани (31 шт.) от сибирского чукучана из оз. Дарпир (северо-восточная часть Якутии). Для сравнительного анализа привлечены данные о нуклеотидных последовательностях полного гена cytb мтДНК (1140 пар нуклеотидов) чукучана (207 шт.) из бассейнов рек Колымы и Индигирки [11]. На карте-схеме обозначены места сбора материала (рис. 1). Выделение, очистку тотальной ДНК, амплификацию, элюцию продуктов полимеразной цепной реакции и секвенирование полной нуклеотидной последовательности гена cytb мтДНК проводили ранее описанными методами [11]. Выравнивание и анализ нуклеотидных последовательностей осуществляли с использованием пакета программ MEGA-6.0.2.74 [14] и ARLEQUIN ver. 3.0 [15]. Статистическую достоверность наблюдаемого отклонения в нуклеотидном составе гена cytb мтДНК сибирского чукучана определяли с помощью критерия χ2 [16]. Соответствие гипотезе нейтральности (для исследованного маркера) в изученных выборках чукучана устанавливали с помощью тестов D Таджимы и Fs Фу [17, 18]. Филогенетический анализ проводили с использованием метода “ближайшего соседа” (NJ-анализ) и 2-параметрической модели Кимуры MEGA 6.0.2.74 [14]. С помощью пакета программ TreeSAAP 3.2 [19] исследованы адаптивные изменения гена cytb мтДНК Проведена оценка аминокислотных замен с использованием восьми категорий значимости (mc). Данная программа, опираясь на предположение о случайном характере аминокислотных замен в условиях селективной нейтральности, дает возможность сопоставлять наблюдаемое и ожидаемое распределения изменений физико-химических свойств обнаруженных модификаций полипептида цитохрома b (Cytb) [19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ нуклеотидного состава гена cytb мтДНК сибирского чукучана показал, что в выборке из оз. Дарпир наблюдается отклонение в сторону тимина и аденина относительно цитозина и гуанина (29.16 и 25.17%; 28.13 и 17.55% соответственно). Однако проверка обнаруженного смещения с помощью критерия χ2 позволила отметить, что оно статистически недостоверно. Аналогичные результаты, полученные для исследованных ранее популяций сибирского чукучана [11], показали, что нуклеотидный состав гена cytb мтДНК этого подвида находится в пределах значений, наблюдаемых в митохондриальных геномах и других видов животных [20].
Несмотря на сравнительно небольшое количество исследованных озерных особей этого подвида, анализ обнаруженных нуклеотидных последовательностей гена cytb мтДНК позволил отметить их полиморфизм и выделить четыре варианта (CH1, CH15, CH16, CH17), которые были выявлены у 8, 18, 3, 2 особей-носителей соответствующих гаплотипов. Поскольку оз. Дарпир относится к водоемам Колымского бассейна, можно предположить, что заселение чукучана в озеро произошло через реки, относящиеся к этому бассейну. В то же время необходимо обратить внимание на биологические и экологические особенности этого вида. Чукучан в нативном ареале относится к числу лимнофильных рыб, обитающих в основном в низовьях рек, а в рассматриваемом случае мы имеем дело с популяцией, обитающей в озере горной системы Черского. Оз. Дарпир соединяется с р. Колымой через систему небольших рек, одной из которых является Рассоха. Возможно, расселению сибирского чукучана в высокогорный район способствовали климатические и географические перестройки, которые являются основными в современном распространении водных организмов. Кроме того, трансгрессирующие морские воды вызывали подпор стока рек, что приводило к уничтожению пресноводной фауны или стимулировало освоение ею верховьев рек и притоков, берущих начало в высокогорных районах [8, 21]. Вполне вероятно, что озерная популяция сибирского чукучана сформировалась под воздействием таких процессов.
Подобные популяции, как правило, происходят от нескольких индивидуумов, т.е. для них характерен “эффект основателя” (founder effect), в результате которого их генетическое разнообразие определяется генотипами той небольшой группы носителей, которые первоначально образовали данную популяцию [20]. На первом этапе исследования выборки сибирского чукучана из оз. Дарпир было отмечено, что три гаплотипа из четырех являются уникальными, так как не встречаются в исследованных ранее популяциях из рек Колымского бассейна. Эти гаплотипы также не обнаружены у особей из р. Индигирки, которая (в историческом прошлом) имела связь с р. Колымой [3, 12, 13]. Новые варианты нуклеотидных последовательностей гена cytb мтДНК, выявленные в процессе изучения сибирского чукучана из оз. Дарпир, депонированы в GenBank (MK999989–MK999991). Они представлены на рис. 2 наряду с обнаруженными ранее гаплотипами [9, 11]. Необходимо отметить, что наиболее распространенным во всех изученных ранее популяциях рек Колымского бассейна [11] является гаплотип CH1 (р = 0.969) и следовало бы ожидать, что он будет иметь высокую частоту распределения в озерной выборке, так как оз. Дарпир относится к водоемам этого бассейна. Однако этого не наблюдается. В озерной выборке гаплотип CH1 встречается с относительно невысокой частотой (р = 0.2632), что, по-видимому, связано с историей формирования этой популяции. Примечательно, что у сибирского чукучана из оз. Дарпир достаточно широко распространен гаплотип CH15 (р = 0.5789), который, как и CH16, CH17, отсутствует во всех ранее изученных локальностях. В отличие от гаплотипа CH15 последние варианты нуклеотидной последовательности гена cytb встречаются в выборке из оз. Дарпир с невысокой частотой (р = 0.1053 и р = = 0.0526). Известно, что в небольших озерных популяциях микроэволюционные процессы протекают значительно быстрее, чем в открытых локальностях. Изоляция может способствовать формированию уникальной генетической структуры популяции. В то же время такие популяции более уязвимы при колебании численности и подвержены эффекту “горлышка бутылки” (bottleneck effect) и дрейфу генов. После восстановления численности преобладают потомки небольшого числа особей, переживших неблагоприятный период. В результате этого могут значительно изменяться частоты гаплотипов, а также происходить быстрая утрата, или, наоборот, увеличение частоты редких вариантов [22]. Косвенным подтверждением высказанного предположения являются результаты теста на селективную нейтральность. Рассчитанные значения параметров D и Fs [17, 18] указывают (табл. 1) на возможность эффекта “горлышка бутылки” в изученной озерной популяции сибирского чукучана. При этом нельзя исключать и другие сценарии событий. Вполне возможно, что при формировании озерной популяции сибирского чукучана преобладали особи-носители гаплотипа CH1. Климатические и географические перестройки, происходившие в рассматриваемом регионе, могли оказать существенное влияние на мутационные процессы и в результате образовались новые, в том числе обнаруженные озерные гаплотипы, являющиеся производными от варианта CH1. Вероятно, в дальнейшем эта популяция подверглась дрейфу генов и часть гаплотипов была утрачена, а часть их, включая CH15, сохранилась. Благоприятный период для ее существования способствовал быстрому росту численности носителей CH15 и их преобладанию в озерной популяции. Возможно, наблюдаемый современный генофонд изолированной озерной популяции сибирского чукучана сформировался в результате синергии целого ряда процессов – эффекта основателя, дрейфа генов, бутылочного горлышка и отбора.
Рис. 2.
Сайты замен в гаплотипах гена cytb мтДНК обыкновенного чукучана из рек Северной Америки и его подвида сибирского чукучана из водоемов Колымо-Индигирской низменности.

Таблица 1.
Показатели разнообразия гена cytb мтДНК в исследованных популяциях сибирского чукучана
| Водоем | S | π ± sd | h ± sd | D | Fs |
|---|---|---|---|---|---|
| оз. Дарпир | 3 | 0.00070 ± 0.00059 | 0.614 ± 0.095 | –0.1997 | 0.581 |
| р. Индигирка | 8 | 0.00034 ± 0.00036 | 0.355 ± 0.096 | –2.1016** | –6.468** |
| р. Буюнда | 3 | 0.00011 ± 0.00019 | 0.119 ± 0.062 | –1.3103 | –2.539** |
| р. Колыма | 5 | 0.00021 ± 0.00027 | 0.176 ± 0.063 | –1.769 | –4.6184** |
| Колымский бассейн суммарно | 9 | 0.00027 ± 0.00031 | 0.256 ± 0.0455 | –1.882 | –2.501 |
Для сибирского чукучана из оз. Дарпир рассчитаны значения показателей нуклеотидного и гаплотипического разнообразия (табл. 1) и проведен сравнительный анализ с аналогичными данными, полученными ранее [11]. Как было отмечено выше, генофонд озерных популяций формируется небольшим количеством вселенцев и чаще всего характеризуется невысоким уровнем генетического разнообразия. Однако результаты исследований не соответствуют этому тезису и показывают, что выборка чукучана из оз. Дарпир имеет более высокий уровень генетического разнообразия, чем ранее зафиксированный в исследованных популяциях (табл. 1). Известно, что масштабы колебаний численности организмов разных видов варьируют, при этом изменение генофондов популяций происходит как на подъеме, так и на спаде популяционной волны. При росте численности организмов возможно слияние ранее разобщенных популяций и объединение их генофондов с соответствующим увеличением генетического разнообразия. Вероятно, отмеченное выше несоответствие объясняется демографическими процессами, которые, по-видимому, имели место в истории исследованной популяции из оз. Дарпир [23]. С другой стороны, нельзя исключать возможность сохранения более древних гаплотипов в популяции сибирского чукучана из этого озера, по сравнению с популяциями из рек Колымского бассейна, имевших весьма сложную геологическую историю формирования [6, 8, 12, 13, 23].
Так как оз. Дарпир относится к водоемам Колымского бассейна, то были рассчитаны показатели генетического разнообразия для объединенной колымской выборки и проведен сравнительный анализ с аналогичными данными, характеризующими индигирскую популяцию. Полученные результаты не противоречат опубликованным ранее [11]. Они показывают, что сибирский чукучан из р. Индигирки имеет более высокий уровень генетического разнообразия, чем зафиксированный в объединенной выборке из водоемов Колымского бассейна (табл. 1).
Исследование структуры белка Сytb сибирского чукучана из водоемов Колымского бассейна (в том числе из оз. Дарпир) и р. Индигирки показало, что вариабельные сайты в основном находятся в пределах трансмембранных доменов Cytb, что согласуется с результатами сравнительного анализа строения молекулы этого энзима у некоторых видов животных [24–26]. Обнаруженные аминокислотные замены представлены в табл. 2. В исследованных популяциях сибирского чукучана отмечены пять вариантов полипептида Cytb (рис. 3), частота распределения которых приведена в табл. 2.
Таблица 2.
Сайты нуклеотидных и аминокислотных замен и частота распределения модификаций белка Cytb сибирского и обыкновенного чукучанов
| Модификация полипептидной последовательности | Fch1 | Fch2 | Fch3 | Fch4 | Fch5 |
|---|---|---|---|---|---|
| Гаплотипы, кодирующие модификацию полипептида | CH1, CH3, CH5, CH6, CH8–CH16, KU761848*, KU761849*, EU676808*, KU697931*, KJ441284*, NC037013*, MG570441*, MG570442* | CH2 | CH4 | CH7 | CH17 |
| Нуклеотидная замена | – | Аденин на гуанин | Гуанин на аденин | Гуанин на цитозин | Гуанин на аденин |
| Сайт нуклеотидной замены | – | 577 | 1096 | 565 | 640 |
| Аминокислотная замена | – | Треонин на аланин | Аланин на треонин | Валин на лейцин | Аспарагиновая кислота на аспарагин |
| Сайт аминокислотной замены | – | 193 | 366 | 189 | 214 |
| Локальность (река, озеро) | Частота распределения модификаций полипептидной последовательности | ||||
| Колыма | 0.976 | 0.012 | 0.012 | – | – |
| Буюнда | 1.00 | – | – | – | – |
| Дарпир | 0.9474 | – | – | – | 0.0526 |
| Индигирка | 0.976 | – | – | 0.024 | – |
Рис. 3.
Аминокислотные замены в модификациях (Fch1–Fch5) фермента Сytb чукучана из водоемов северо-востока России и Северной Америки (AF454871). Цифры – сайты замен от начала полной аминокислотной последовательности полипептида Сytb Fch1.

Следует подчеркнуть, что полипептид Fch1, имеющий высокую частоту распределения (табл. 2) во всех исследованных колымских (в том числе в озерной), а также в индигирской популяциях подвида, кодируется целым рядом гаплотипов (CH1, CH3, CH5, CH6, CH8–CH16). Рассматриваемый вариант Cytb широко распространен не только у сибирского чукучана из рек исследованного региона (табл. 2), но и в популяциях обыкновенного чукучана из рек Северной Америки, GenBank (KU761848, KU761849, EU676808, KU697931, KJ441284, NC037013, MG570441, MG570442) [27, 28]. Гаплотипы, кодирующие Fch1 Cytb, различаются 22 нуклеотидными заменами (рис. 2). Мутационный процесс обеспечивает увеличение разнообразия генофонда исследованного подвида. В гене cytb мтДНК сибирского чукучана происходит накопление и закрепление синонимичных замен.
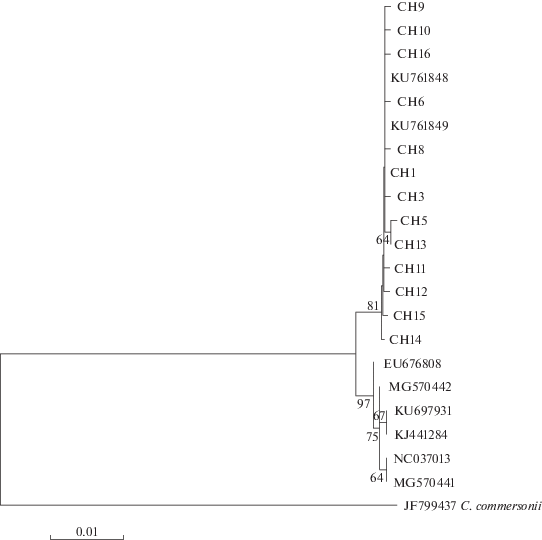
Для филогенетического анализа были использованы обнаруженные нами гаплотипы сибирского чукучана и привлечены из GenBank нуклеотидные последовательности гена cytb мтДНК чукучана обыкновенного из рек Северной Америки [27, 28], кодирующие вариант Fch1 полипептида Cytb. Филогенетические отношения между данными последовательностями нуклеотидов гена cytb отражены в дендрограмме, построенной методом ближайшего соседа на основании бипараметрической модели дистанций Кимуры [29]. Несмотря на то что все анализируемые гаплотипы кодируют одинаковую модификацию Fch1 Cytb, они группируются в два кластера (рис. 4). В первый объединяются все варианты гена cytb мтДНК чукучана из популяций северо-востока России. В этот кластер вошли также североамериканские образцы (KU761848, KU761849), что вполне объяснимо. Они идентичны митотипу CH1, распространенному в исследованных нами популяциях. Наблюдаемые субкластеры имеют (в абсолютном большинстве) бутстреп-поддержку менее 50%. Такая топология свидетельствует о монофилетическом происхождении этой линии гаплотипов. Второй кластер включает исключительно варианты гена cytb мтДНК обыкновенного чукучана из Северной Америки. Его субкластеры имеют более высокий паттерн родственных отношений (рис. 4), указывающий на достоверный уровень дивергенции гаплотипов исследованного гена. Важно подчеркнуть, что оба кластера обособлены (статистическая поддержка 97%), что подтверждает имеющиеся представления о происхождении вида и расселении его в реки Азии из Северной Америки, а также свидетельствует о длительной изоляции обыкновенного и сибирского чукучанов [1–7, 11]. Не противоречат им и данные анализа молекулярной изменчивости, полученные с помощью программы AMOVA (Analysis of Molecular Variance) [15], которая позволяет обнаружить достоверность различий между иерархическими структурами и определить их вклад на разных уровнях групповой вариабельности. В результате анализа было отмечено, что межгрупповая компонента составила 71.78% (при условии, что в первую группу были включены нуклеотидные последовательности гена cytb мтДНК сибирского чукучана из водоемов Колымо-Индигирского бассейна, а во вторую вошли гаплотипы, характеризующие обыкновенного чукучана из рек Северной Америки). Доли внутрипопуляционной (усредненной изменчивости выборок) и межпопуляционой (между популяциями в каждой группе) изменчивости достигли 18.17 и 10.05% соответственно.
Рис. 4.
NJ – филогенетическое дерево нуклеотидных последовательностей гена cytb мтДНК чукучанов из рек Северной Америки и Северо-Восточной Азии, кодирующих полипептид Fch1. На ветвях приведены бутстреп-индексы в %.
Несмотря на дивергенцию гаплотипов, кодирующих Fch1 Cytb, эта форма энзима является наиболее распространенной у вида на всем его ареале. По-видимому, ее можно отнести к наиболее функционально эффективной модификации исследованного фермента. Гаплотипы CH2, CH4, CH7, CH17 кодируют варианты Fch2, Fch3, Fch4, Fch5 белка Cytb соответственно. Они входят в число уникальных, так как встречаются только в одной из исследованных локальностей. Например, впервые найденная изоформа Fch5 Cytb зарегистрирована только в озерной популяции.
Изменения биоэнергетики митохондрий, связанные с адаптивной эволюцией митохондриальных белков, являются важным фактором в процессе внутривидовой дивергенции и видообразования [30]. В свою очередь дивергенция может быть следствием адаптаций в период значительных климатических колебаний. Эволюция митохондриальных белков сопровождается аминокислотными заменами, которые чаще всего происходят в результате одношаговых несинонимичных нуклеотидных замен. В полипептидах их может быть немного, но достаточно для изменения кинетики катализируемых ими реакций. Поэтому для исследования адаптивной эволюции митохондриальных белков в процессе дивергенции популяций или видов необходимо использовать подходы, позволяющие оценивать статистическую значимость изменений физико-химических свойств обнаруженных вариантов исследуемого полипептида [26]. Таким подходом является z-тест модели ММ01 в программе TreeSAAP 3.2 [19]. Он позволяет (с помощью определения степени радикальности или консервативности аминокислотных замен) ответить на вопрос о том, насколько они адаптивны. Нами проведен качественный анализ обнаруженных аминокислотных замен (табл. 2) с помощью программы TreeSAAP, определяющей селективное воздействие в процессе кладогенеза на 31 структурное, биохимическое и физико-химическое свойство аминокислот [19]. Это позволяет оценить замены аминокислот в восьми категориях значимости (mc). Консервативная аминокислотная замена, при которой исходная аминокислота в белке заменяется на другую со схожими физико-химическими свойствами, наблюдается при стабилизирующем отборе (mc = 1–3, z > 3.09, P < 0.001, z – значимость аминокислотных замен по Фишеру). Радикальная замена, при которой исходная аминокислота заменяется аминокислотой с другими физико-химическими свойствами, отмечается при движущем отборе (mc = 6–8, z > 3.09, P < 0.001). Результаты TreeSAAP-анализа показали, что изменения физико-химических свойств (в отмеченных нами позициях аминокислотных замен) оказались не столь значительными (z < 3.09, p = 0.001, mc = 3), за исключением одного варианта (Fch5). Гаплотип CH17 зафиксирован только в выборке из оз. Дарпир. Он кодирует изоформу Fch5 белка Cytb, который характеризуется наличием замены в аминокислотной последовательности исследованного полипептида в положении D214N. Изменения физико-химических свойств в этом случае имеют достоверно радикальный характер (z > 3.09, p < 0.001, mc = 6). Это позволяет предположить, что закрепление указанной замены в аминокислотной последовательности исследованного полипептида произошло под влиянием движущего отбора [19, 26]. Такой отбор свидетельствует о молекулярной адаптации. В то же время необходимо подчеркнуть, что во всех исследованных выборках сибирского чукучана сигналов адаптации очень мало. В первую очередь это обусловлено, по-видимому, высокой консервативностью аминокислотной последовательности митохондриальных белков (в том числе Cytb). Учитывая длительную историю освоения чукучаном рек северо-востока России [1, 6, 9], можно предположить, что адаптивные варианты белка Cytb, приобретенные в период похолодания, были утрачены в процессе климатических изменений совсем недавно, например в голоцене по мере потепления климата. Для подтверждения этого предположения требуется расширение географии исследований и использование других генетических маркеров, позволяющих отметить сигналы молекулярной адаптации.
Работа выполнена при частичной финансовой поддержке гранта Российского Географического Общества № 07/2018/Р.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Черешнев И.А. Пресноводные рыбы Чукотки. Магадан: СВНЦ ДВО РАН, 2008. 324 с.
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. М.; Л.: Изд-во АН СССР, 1949. Ч. 2. С. 469–925.
Новиков А.С. Рыбы реки Колымы. М.: Наука, 1966. 135 с.
Кириллов Ф.Я. Рыбы Якутии. М.: Наука, 1972. 358 с.
Новиков А.С., Простантинов В.С., Штундюк Ю.В. К вопросу о распространении сибирского чукучана // Гидробиологические исследования внутренних водоемов северо-востока СССР. Владивосток: ДВНЦ АН СССР, 1975. С. 303–308.
Черешнев И.А. Биогеография пресноводных рыб Дальнего Востока России. Владивосток: Дальнаука, 1998. 131 с.
Решетников Ю.С., Попова О.А., Соколов Л.И. и др. Атлас пресноводных рыб России. М.: Наука, 2002. Т. 1. 360 с.
Линдберг Г.У. Крупные колебания уровня океана в четвертичный период. Л.: Наука, 1972. 548 с.
Бачевская Л.Т., Переверзева В.В., Иванова Г.Д. и др. Генетическая структура сибирского чукучана (Сatostomus catostomus rostratus) по данным об изменчивости гена цитохрома b митохондриальной ДНК // Изв. РАН. Серия биол. 2014. № 4. С. 334–340. https://doi.org/10.7868/S000233291
Бачевская Л.Т., Переверзева В.В., Иванова Г.Д., Агапова Г.А. Нуклеотидная изменчивость гена цитохромоксидазы 1 митохондриальной ДНК сибирского чукучана (Catostomus catostomus rostratus) реки Колымы // Генетика. 2014. Т. 50. № 10. С. 1216–1221. https://doi.org/10.7868/S00166758141
Бачевская Л.Т., Переверзева В.В., Примак А.А., Агапова Г.А. Нуклеотидная изменчивость гена цитохрома b мтДНК сибирского чукучана Catostomus catostomus rostratus из рек Колымо-Индигирской низменности // Вестник Северо-Восточного научного центра ДВО РАН. 2019. № 3. С. 109–116.
Баранова Ю.П., Бискэ С.Ф. Северо-Восток СССР. М.: Наука, 1964. 350 с.
Дорт-Гольц Ю.Е., Терехова В.Е. История развития западной окраины Берингийской суши в кайнозое // Берингия в кайнозое. Сб. науч. тр. Владивосток, 1976. С. 54–59.
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0. 2013.
Excoffier L., Laval G., Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis // Evol. Bioinform. Online. 2005. V. 1. P. 47–50.
StatSoft Ink., 1984–2001.
Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism // Gen. Soc. Am. 1989. V. 123. P. 585–595.
Fu Y.-X. Statistical tests of neutrality of mutations against population growth, hitchhiking and background selection // Genetics. 1997. V. 147. P. 915–925.
Woolley S., Johnson M.J., Smith M.J. TreeSAAP: Selection on amino acid properties using phylogenetic trees // Bioinformatics. 2003. V. 19. P. 671–672.
Avise J.C. Molecular Markers, Natural History and Evolution. N.Y.; London: Chapman and Hall, 1994. 511 p.
Hopkins D.M. The paleogeography and climatic history of Beringia during late Cenozoic time // Internord. 1972. V. 12. P. 121–150.
Nei M. Molecular Evolutionary Genetics. N.Y.: Columb. Univ. Press, 1987. 512 p.
Важенин Б.П. Сценарии прорыва сейсмогенных, ледниковых и иных природных плотин в горных долинах // Вестник Томского гос. ун-та. 2015. № 394. С. 230–238.
Howell N. Evolutionary conservation of protein regions in the proton motive cytochrome b and their possible roles in redox catalysis // J. Mol. Evol. 1989. V. 29. P. 157–169.
Irwin D.M., Kocher T.D., Wilson A.C. Evolution of the cytochrome b gene of mammals // J. Mol. Evol. 1991. V. 32. P. 128–144.
McClellan D.A., Palfreyman E.J., Smith M.J. et al. Physicochemical evolution and molecular adaptation of the cetacean and artiodactyl cytochrome b proteins // Mol. Biol. Evol. 2005. V. 22. P. 437–455.
Harris P.M., Mayden R.L. Phylogenetic relationships of major clades of Catostomidae as inferred from mitochondrial SSU and LSU rDNA sequences // Mol. Phylogen. Evol. 2001. V. 20. P. 225–237.
Kettratad J. EU676808 // GenBank. 2010.
Kimura M. Estimation of evolutionary distances between homologous nucleotide sequences // Proc. Natl Acad. Sci. USA. 1981. V. 78. P. 5773–5777.
Gershoni M., Templeton A.R., Mishmar D. Mitochondrial bioenergetics as a major motive force of speciation // Bioessays. 2009. V. 31. P. 642–650.
Дополнительные материалы отсутствуют.