Генетика, 2022, T. 58, № 4, стр. 479-482
Усиление оксидом дейтерия экспрессии генов ada, alkA и luxA Escherichia coli, индуцированных метилметансульфонатом
Д. А. Свиридова 1, С. В. Смирнова 1, С. К. Абилев 1, 2, *
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: abilev@vigg.ru
Поступила в редакцию 23.11.2021
После доработки 29.11.2021
Принята к публикации 30.11.2021
- EDN: QRCSYB
- DOI: 10.31857/S0016675822040130
Аннотация
Изучали экспрессию генов ada и alkA E. coli, и гена luxA lux-оперона в составе плазмиды и находящегося под контролем промотора гена alkA, индуцированную метилметансульфонатом (ММС) в клетках дейтерированных и недейтерированных бактерий биосенсора E. coli K12 MG1655 (pAlkA–lux) с помощью метода ОТ-ПЦР. В качестве референсного был использован ген rrsA 16S РНК рибосомы, экспрессирующийся конститутивно. Дейтерирование бактериальной культуры проводили в среде, содержащей 7.5% оксида дейтерия (D2O). Показатели числа циклов ПЦР в клетках дейтерированных и недейтерированных бактерий отличались – при дейтерировании выход кривой зависимости уровня экспрессии исследуемых генов от числа циклов ПЦР на экспоненту происходил раньше, чем у недейтерированных бактерий. Эта разница в числе циклов (Сt) составила 4, 6 и 9, для генов luxA, alkA и ada соответственно.
Начиная со времени открытия тяжелой воды (1932 г.) началось изучение влияния больших концентраций ее на биологические объекты. Концентрированная тяжелая вода, в которой все атомы водорода заменены на дейтерий, отличается по своим физическим свойствам от обычной воды, в которой присутствие небольшого количества (0.0149%) тяжелой воды практически не влияет на ее физические свойства. Различаются соединения с обычным и тяжелым водородом и по химическим свойствам. Замена обычного водорода на тяжелый ведет прежде всего к снижению скоростей химических реакций (в 3–10 раз). Естественно, что замена в живом организме значительной части атомов водорода на атомы дейтерия поведет к замедлению многих химических реакций, определяющих сложные биологические процессы в клетках, тканях и в организме в целом. Таким исследованиям посвящена обширная литература [1–5].
Ранее нами были проведены исследования влияния оксида дейтерия (D2O) на индуцибельные процессы в бактериальной клетке с использованием lux-биосенсоров на основе штамма E. coli K12 MG1655. Биосенсоры содержат гибридную плазмиду, несущую luxCDABE-оперон фотобактерии Photorhabdus luminescens, поставленный под контроль промотора генов recA, сolD и alkA. Биосенсоры люминесцируют в результате активации указанных промоторов в ответ на повреждение ДНК химическими генотоксикантами и мутагенами [6–8]. Было показано, что предварительное культивирование клеток E. сoli в среде с D2O усиливает активацию SOS-регулона, индуцированную 4-нитрохинолин-1-оксидом, N-нитрозо-N-метилмочевиной (НММ) и митомицином С [7], а также ada-регулона, индуцированную алкилирующими соединениями нитрозометилмочевиной и метилметансульфонатом (ММС) [8]. В этой связи возникает вопрос о механизме влияния D2O на процессы активации индуцибельных регулонов в клетках E. coli. Возможной причиной в случае SOS-регулона может быть усиление ковалентных связей типа N–H, а также усиление связи генотоксикантов с ДНК в результате изотопного замещения легкого (протий) на тяжелый изотоп (дейтерий). В активации ada-регулона важную роль в качестве регулятора транскрипции играет алкилированный белок Ada. Показано, что метилирование N-домена белка Ada приводит к повышению аффинности к промоторным участкам ada-регулона и превращает его в сильный транскрипционный активатор [9–11]. Замена протия на дейтерий в этих последовательностях ДНК или в самом белке может быть одним из главных факторов стабилизации связи между промотором и алкилированным белком, следовательно, существенным фактором в изотопном эффекте D2O.
В настоящей работе с целью получения дополнительного доказательства влияния D2O на транскрипцию ada-регулона проведено исследование экспрессии хромосомных генов alkA и ada, входящих в ada-регулон E. coli, и плазмидного гена luxA, находящегося под контролем промотора гена alkA, с помощью метода ОТ-ПЦР.
Для сравнительного изучения индукции аda-регулона в дейтерированных и в недейтерированных (контрольных) культурах E. coli использовали биосенсор E. coli K12 MG1655 (pAlkA–lux), люминесцирующий в результате активации промотора гена alkA в ответ на алкилирование ДНК [12]. Дейтерирование бактериальной культуры проводили в среде с D2O (концентрация 7.5%) в течение 90 мин. Затем в контрольную и дейтерированную культуры добавляли ММС в концентрации 0.5 ммоль/л и инкубировали в течение 20 мин. Далее образцы центрифугировали, отбирали супернатант и осадок растворяли в 1 мл реагента для выделения РНК (ExtractRNA, Евроген). После ряда процедур, проведенных в соответствии с рекомендациями производителя реагента ExtractRNA, полученную РНК обрабатывали ДНКазой (Thermo Fisher Sci., США). Очищенные образцы РНК далее использовали для синтеза кДНК с помощью набора QuantiTect Rev. Transcription Kit (Qiagen, США). Брали до 100 нг очищенной от ДНК РНК, добавляли 1 мкл RT-Transferase, 1 мкл Primermix, 4 мкл буфера и доводили до 20 мкл RNA free водой. Смеси образцов инкубировали 17 мин при 42°С, далее – 3 мин при 95°С в амплификаторе QuantStudio 5 Real-Time PCR (Thermo Fisher Sci., США). Полученную кДНК использовали для ОТ-ПЦР с помощью набора SYBR Green PCR mix (Евроген, РФ) и праймеров:
Forward rrsA CAACGAGCGCAACCCTTATC
Revers rrsA AGGGCCATGATGACTTGACG
Forward luxA TGTTCTTCCCACCGCTCATC
Revers luxA CCGTACCAGCACTCCGTTAA
Forward alkA GCACAGCTTTATGGCGAACG
Revers alkA TTTCATCGCCTGCTCCACAT
Forward ada GACGATCAACGCTGGCAATC
Revers ada CGCTGGCATTTGCGTAGAAG
Результаты изучения экспрессии генов ada и alkA E. coli, и гена luxA lux-оперона в составе плазмиды биосенсора и находящегося под контролем промотора гена alkA, индуцированных ММС в клетках дейтерированных и недейтерированных бактерий биосенсора E. coli K12 MG1655 (pAlkA–lux) представлены в табл. 1. В качестве референсного был использован ген rrsA 16S РНК рибосомы, зкспрессирующийся конститутивно. Показатели числа циклов ПЦР в клетках дейтерированных и недейтерированных бактерий отличались – при дейтерировании выход кривой зависимости уровня экспрессии исследуемых генов от числа циклов ПЦР на экспоненту происходил раньше, чем у недейтерированных бактерий. Эта разница в числе циклов (Сt) составила 4, 6 и 9, для генов luxA, alkA и ada соответственно (табл. 1).
Таблица 1.
Показатели экспрессии генов ada-регулона E. coli, индуцированных ММС, число циклов ПЦР (Сt)
| Ген | Кол-во экспериментов |
Варианты экспериментов, число циклов ПЦР (Сt) | ||
|---|---|---|---|---|
| без дейтерирования | с дейтерированием | *референсный ген rrs | ||
| luxA | 5 | 36 ± 0.40 | 32 ± 1.27 | 22 ± 0.17 |
| alkA | 5 | 36.6 ± 0.32 | 30.8 ± 0.05 | 24 ± 0.27 |
| ada | 3 | 39 ± 0.33 | 30.3 ± 0.95 | 24.3 ± 0.13 |
Для наглядности первичные данные по всем вариантам экспериментов были подвергнуты анализу с помощью диаграмм “ящик с усами” (BoxPlot). Данный подход анализа данных экспрессии генов был использован в работах [13, 14]. На рис. 1 представлены распределения числовых значений показателя “циклы ПЦР, Сt” для трех исследуемых генов luxA, alkA и ada и одного референсного гена rss в дейтерированных и недейтерированных клетках бактерий E. coli.
Рис. 1.
Распределение показателей эспрессии генов luxA, alkA и ada в клетках дейтерированных и недейтерированных бактерий E. coli, индуцированных ММС.
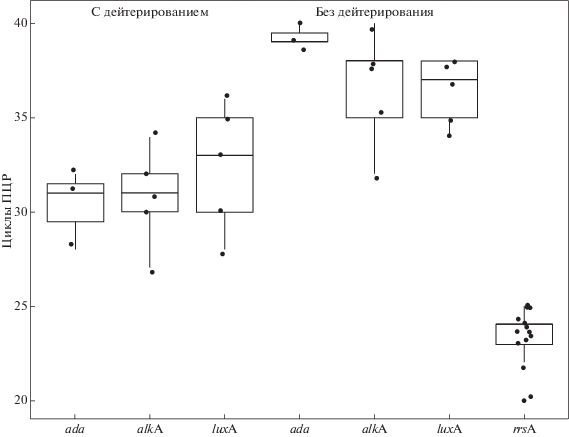
Диаграмма отображает диапазон данных, находящийся между первым и третьим квартилем, а медиана делит эту коробку на две части (межквартильный диапазон). Усы отображают данные первого квартиля – от второго квартиля до минимального значения, и четвертого квартиля – от третьего до максимального значения. Из рис. 1 видно, что референсный ген rss начинает экспрессироваться на 22–25 циклах, тогда как исследуемые гены – на 30–35 циклах, в случае дейтерированных, и на 35–39 циклах в случае недейтерированных бактерий. Все эти данные указывают на усиливающее действие дейтерия (7.5% D2O) на экспрессию генов ada-регулона E. coli, индуцированную алкилирующим агентом ММС.
Вопрос изучения молекулярного механизма влияния дейтерия на экспрессию генов является актуальной задачей. В нашем случае в качестве модели изначально были выбраны бактериальные биосенсоры, позволяющие по интенсивности их люминесценции регистрировать экспрессию индуцибельных генов E. сoli.
Ранее усиливающее действие дейтерия на SOS-ответ бактерий E. сoli на ДНК-повреждающее действие химических генотоксикантов (таких как: 4-нитрохинолин-1-оксид, N-нитрозо-N-метилмочевина и митомицин С) мы объясняли возможной повышенной прочностью связи генотоксикант–ДНК в дейтерированных участках взаимодействующих молекул и, соответственно, сдвигом баланса между скоростью накопления повреждений и скоростью восстановления исходной структуры ДНК ферментами репарационной системы [7, 9 ]. Для объяснения влияния дейтерия на активность алкилирующих агентов нитрозометил мочевины и ММС мы опирались на данные о вероятном механизме транскрипции генов ada-регулона E. сoli и роли в этом алкилированного белка Ada в качестве транскрипционного фактора [9–11]. Метилирование алкилирующим агентом N-домена белка Ada приводит к повышению аффинности к промоторным участкам ada-регулона. Следовательно, наличие дейтерированных оснований на промоторных последовательностях ДНК или в самом белке может быть одной из главных причин стабилизации связи между промоторами и алкилированным белком Ada, что может быть существенным фактором, при наблюдаемом нами эффекте дейтерия.
В изотопном эффекте дейтерия при изучении ДНК-повреждающего действия генотоксикантов, по-видимому, немаловажную роль играет не только усиление репарационных процессов, но ингибирование ряда ферментных систем, участвующих в биотрансформации генотоксикантов в клетке. Например было показано, что предварительное дейтерирование бактерий биосенсора E. coli (pRecA–lux) приводит к усилению экспрессии гена recA, индуцированной H2O2. Для объяснения выявленного феномена была изучена экспрессия гена каталазы в дейтерированных и недейтерированных культурах биосенсора E. сoli (pKatA–lux). Люминесценция этого биосенсора происходит в результате активации промотора гена katA в ответ на увеличение концентрации Н2О2 в клетке. Выявлено, что D2O снижает уровень экспрессии гена katA, что может привести к накоплению Н2О2, и, соответственно, увеличению уровня повреждений ДНК, регистрируемых по увеличению экспрессии гена recA [15].
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (№ 19-04-00200/21).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Czajka D.M., Finkel A.J., Fischer C.S., Katz J.J. Physiological effects of deuterium on dogs // Am. J. Physiol. 1961. V. 201. P. 357–362. https://doi.org/10.1152/ajplegacy.1961.201.2.357
Денько Е.И. Действие тяжелой воды (D2O) на клетки животных, растений и микроорганизмы // Успехи соврем. биологии. 1973. Т. 70. № 4. С. 41–49.
Лобышев В.Н., Калиниченко Л.П. Изотопные эффекты D2O в биологических системах. М.: Наука, 1978. 215 с.
Takeda H., Nio Y., Omori H. et al. Mechanisms of cytotoxic effects of heavy water (deuterium oxide: D2O) oncancer cells // Anticancer Drugs. 1998. V. 9. № 8. P. 715–725.
Altermatt H.J., Gebbers J.O., Laissue J.A. Heavy waterdelays growth of human carcinoma in nude mice // Cancer. 1988. V. 62. № 3. P. 462–466.
Котова В.Ю., Манухов И.В., Завильгельский Г.Б. Lux-биосенсоры для детекции SOS-ответа, теплового шока и окислительного стресса // Биотехнология. 2009. № 6. С. 16–25. https://doi.org/10.1134/S0003683810080089
Абилев С.К., Смирнова С.В., Игонина Е.В. и др. Оксид дейтерия усиливает SOS-ответ клеток Escherichia coli, индуцированный генотоксикантами // ДАН. 2018. Т. 480. № 2. С. 1–5.
Смирнова С.В., Абилев С.К., Игонина Е.В. и др. Влияние дейтерия на индукцию ada-регулона алкилирующими веществами в клетках Escherichia coli // Генетика. 2018. Т. 54. № 8. С. 915–921. https://doi.org/10.1134/S001667581808012X
Sakumi K., Igarashi K., Sekiguchi M., Ishihama A. The Ada protein is a class I transcription factor of Escherichia coli // J. Bacteriol. 1993. V. 175. P. 2455–2457.
Landini P., Volkert M.R. Regulatory responses of the adaptive response to alkylation damage: A simple regulon with complex regulatory features // J. Bacteriol. 2000. V. 182. № 23. P. 6543–6549. https://doi.org/10.1128/JB.182.23.6543-6549.2000
Mielecki D., Wrzesin’ski M., Grzesiuk E. Inducible repair of alkylated DNA in microorganisms // Mutat. Res. 2015. V. 763. P. 294–305. https://doi.org/10.1016/j.mrrev.2014.12.001
Горянин И.И., Котова В.Ю., Краснопеева Е.Д. и др. Определение генотоксического действия 1,1-диметилгидразина алкилирующими соединениями, возникающими при его окислении, и перекисью водорода // Тр. МФТИ. 2013. Т. 5. № 1. С. 103–110.
Bai B., Ren J., Bai F., Hao L. Selection and validation of reference genes for gene expression studies in Pseudomonas brassicacearum GS20 using real-time quantitative reverse transcription PCR // PLoS One. 2020. V. 15(1). e0227927. https://doi.org/10.1371/journal.pone.0227927
Peng S., Stephan R., Hummerjohannv J., Tasara T. Evaluation of three reference genes of Escherichia coli for mRNA expression level normalization in view of salt and organic acid stress exposure in food // FEMS Microbiol. Lett. 2014. V. 355. P. 78–82. https://doi.org/10.1111/1574-6968.12447
Абилев С.К., Игонина Е.В., Смирнова С.В., Рубанович А.В. Влияние дейтерия на экспрессию индуцибельных генов у Escherichia coli // Рад. биол. радиоэкология. 2019. Т. 59. № 3. С. 305–310.
Дополнительные материалы отсутствуют.


