Генетика, 2022, T. 58, № 4, стр. 438-449
Популяционная структура кеты Дальнего Востока России: биогеографическая классификация, генетическая дифференциация и экогеографические единицы вида
Л. А. Животовский 1, 2, *, Г. А. Рубцова 1, М. В. Шитова 1, Т. В. Малинина 1, В. Д. Прохоровская 1, Т. А. Ракицкая 1, К. И. Афанасьев 1, 2
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства
и океанографии (ВНИРО)
107140 Москва, Россия
* E-mail: levazh@gmail.com
Поступила в редакцию 09.11.2021
После доработки 30.11.2021
Принята к публикации 02.12.2021
- EDN: TXSVKU
- DOI: 10.31857/S0016675822040154
Аннотация
Кета, Oncorhynchus keta Walbaum, нерестящаяся в реках и озерах Дальнего Востока, подразделена на экогеографические единицы (ЭГЕ) на основе зоо- и физико-географического районирования ареала вида, биологических особенностей группировок, учитывающих районы нереста и экологические формы (экотипы), и генетических различий между ними. Каждая ЭГЕ имеет свои географические границы и может включать несколько нерестовых популяций кеты разных водоемов в пределах этих границ. Популяции кеты разных ЭГЕ генетически значительно отличаются друг от друга. Экогеографические единицы являются важными элементами внутривидовой структуры. В то же время они могут рассматриваться как базовые единицы запаса кеты, которые следует учитывать при разработке стратегии управления запасами водных биологических ресурсов. В частности, при искусственном воспроизводстве этого вида крайне нежелательны перевозки оплодотворенной икры между популяциями из разных ЭГЕ.
Чтобы эффективно воспроизводить, использовать и сохранить природные биологические ресурсы, важно подразделить исследуемый вид на естественно сложившиеся группировки популяций, определяемые географическим распространением и условиями обитания вида, ландшафтной структурой его ареала, а также биологическими особенностями данного вида: местами и сроками размножения, миграционными обменами и пр. Более того, важно отнести к каждой такой группировке свою часть ареала вида, на которой он воспроизводится и которая географически ясно очерчивала бы границы этой группировки как единицы запаса. Рассмотрим для примера такой важный объект водных биоресурсов Дальнего Востока как кета (Oncorhynchus keta Walbaum, 1792).
Кета – второй по численности вид тихоокеанских лососей (после горбуши) в азиатской части ареала, нагуливается в водах северных морей Тихого океана и заходит на нерест в реки азиатского и американского побережья [1–3], является основным объектом пастбищного лососеводства России [4–7]. В пределах российского Дальнего Востока выделяют от шести до семи основных региональных нерестовых группировок этого вида [8]. По характеру генетической дифференциации нерестовые популяции дальневосточной кеты подразделяются на пять больших генетических кластеров [9].
Для выделения крупных нерестовых группировок кеты, как базовых для определения единиц запаса этого вида, воспользуемся концепцией экогеографических единиц (ЭГЕ) [10–12]. Каждая ЭГЕ определяется как группа географически близких популяций, ареал которых характеризуется сходными условиями обитания, с возможным обменом между собой генными потоками, но значительно изолированных от других таких единиц, что выявляется с помощью генетических маркеров. Верификация ЭГЕ основана на предложенном ранее критерии [12, 13]: большие генетические различия между популяциями разных ЭГЕ и малые генетические различия между популяциями внутри ЭГЕ.
Цель данной работы – отчасти обзорная: свести воедино все опубликованные ранее материалы коллектива авторов по кете Дальнего Востока и взглянуть на ее популяционную структуру с позиции экогеографических единиц. Ранее это было сделано для трех районов Дальнего Востока: бассейна р. Амур и прилежащей территории, о. Сахалин и южных Курильских островов [13–15]. Кета является значительно подразделенным видом, поэтому можно выделить независимые нерестовые группировки в более или менее четких географических границах, чтобы их можно было применить в практической работе. Назначение данного исследования – использовать эколого-географические и генетические данные для определения экогеографических единиц кеты Дальнего Востока России с целью рационального использования запасов этого вида.
МАТЕРИАЛЫ И МЕТОДЫ
Согласно концепции ЭГЕ, процедура их выделения состоит из двух этапов. На первом этапе следует предварительно разбить ареал вида на географические районы по характеристикам местообитаний, и далее подразделить их с учетом биологии исследуемого вида – миграционных, репродуктивных и других характеристик, наличия разных экотипов. При этом важно осуществлять географическое подразделение вида по местам его воспроизводства, так как миграция производителей к местам размножения и ранний период развития их потомства – наиболее критические фазы жизненного цикла в формировании популяционной структуры вида. Такое, композитное, подразделение вида и его ареала, с одновременным учетом его экологии и географии, и образует экогеографические единицы (ЭГЕ). Каждая ЭГЕ может включать несколько популяций соседних нерестовых бассейнов. На втором этапе выделенные ЭГЕ проверяются на генетическую близость или отдаленность друг от друга, имея множественные выборки особей из популяций каждой ЭГЕ. Можно сказать, что “экогеографическая единица данного вида – это природное тело, скомпонованное из эколого-географических характеристик ареала и биологических признаков составляющих его популяций” [12, стр. 112].
Биогеографическое подразделение Дальнего Востока
Для выделения ЭГЕ кеты проведем вначале биогеографическое подразделение бассейнов рек побережья Дальнего Востока, используя следующий алгоритм [12, 14]. В качестве исходной сетки подразделения пресноводной части ареала группировок тихоокеанских лососей и других лососевых рыб дальневосточного региона, у которых критический период онтогенеза или вся жизнь проходят в реках и озерах, принимаем зоогеографическое районирование на основе распределения биоты пресноводных бассейнов по И.А. Черешневу [16]. Затем на эту сетку необходимо наложить подразделение ареала вида на основе других биогеографических и экологических описаний. Например, важным является бассейновый принцип подразделения территорий, так как водосборный бассейн реки – это целостная единица в организации ландшафта [17], а морские бассейны стока определяют особенности температурного режима и другие характеристики водоемов [18], в т. ч. важные для развития и роста молоди тихоокеанских лососей и других речных и озерных гидробионтов. Кроме этого, можно использовать другие сетки экологического и физико-географического районирования ареала вида (см. далее).
В результате мы получили подразделение лососевых нерестовых водоемов Дальнего Востока России на биогеографические районы (рис. 1), которые легли в основу экогеографических единиц кеты. Охарактеризуем их, начиная с анадырского зоогеографического района (номер 7 на рис. 1), так как оттуда были взяты наши наиболее северные выборки кеты для популяционно-генетических оценок. Анадырский зоогеографический район (7) не подразделяли, так как генетически была описана только кета бассейна р. Анадырь. Корякский (8) и южнокамчатский (9) районы были далее подразделены по Срединному хребту, а на юге полуострова – по Восточному хребту, образовав четыре биогеографических района п‑ова Камчатка: северо-западный (8W), северо-восточный (8E), юго-западный (9W) и юго-восточный (9E). В Амурском зоогеографическом районе (14) выделили Амуро-Амгуньский (14') и Амуро-Уссурийский (14'') биогеографические районы Нижнего Амура соответственно экологической классификации бассейна р. Амур Е.А. Симонова и Е.Г. Егидарева [19]. Здесь расположены основные нерестовые площади амурской кеты и оттуда собраны наши выборки [14, 20]. Северосахалинский зоогеографический район (15) далее подразделили, с учетом основных водоразделов и бассейнов морского стока, на северо-западный Сахалин (15W), северо-восточный Сахалин (15E) и зал. Терпения (15S). Североприморский район (16) разделили на северное Приморье (16P) и западный Сахалин (16S), а южноприморский район (17, с учетом классификации Г.Н. Курганского и В.Г. Марковцева [21]) – на южное Приморье, охватывающее зал. Петра Великого вместе с зал. Находка (17S), и центральное Приморье (17N), включая бассейн р. Аввакумовка (17N). Южносахалинский зоогеографический район (18) разделили на юго-западный Cахалин (18W) и юго-восточный Сахалин вместе с зал. Анива (18E). Кроме того, отдельно выделили п-ов Крильон (18S), климат которого определяется отчасти северной ветвью Цусимского течения и холодными пятнами западной части зал. Анива. Курильский зоогеографический район (19) разбили на кунаширский (19K) и итурупский (19I) биогеографические районы, так как по ландшафтной классификации островá Кунашир и Итуруп разделяются физико-географической границей, проходящей по проливу Екатерины между ними [22]. (Более дробное биогеографическое подразделение южнокурильских островов дано в [15] и здесь не обсуждается.)
Рис. 1.
Экогеографические единицы кеты и места сбора материала для исследования ДНК-маркеров. Зоогеографическое районирование (заштриховано) и номера зоогеографических районов (6–19) Дальнего Востока России даны по И.А. Черешневу (1998). Подразделение территории на ЭГЕ выполнено на основе зоогеографического районирования с дополнительным учетом бассейнового принципа и локальных эколого- и физико-географических классификаций территории (см. текст). Географические границы ЭГЕ выделены линиями и соответствующими номерами в овалах или в кружках. Точками указаны места сбора биологического материала для ДНК-исследования (см. текст).
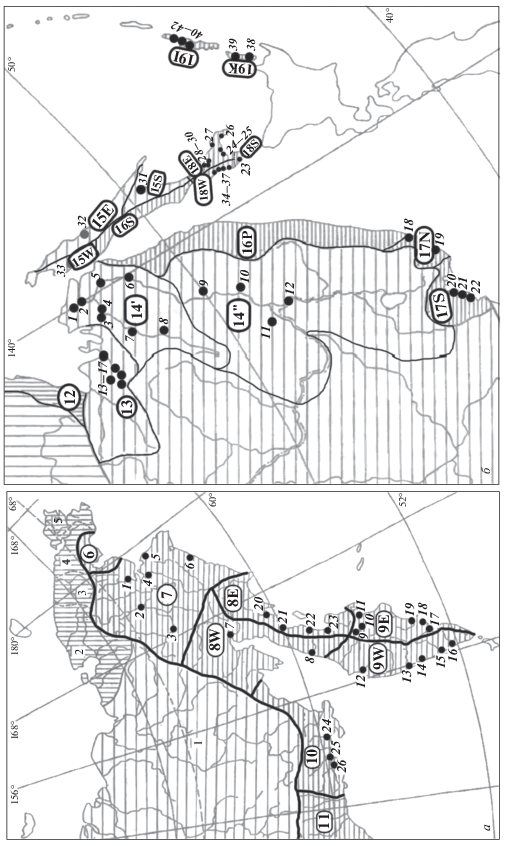
Выделенные на рис. 1 биогеографические районы принимаем за ЭГЕ кеты Дальнего Востока России, дополнительно учитывая в них разные экотипы вида. А именно, у кеты р. Поронай и р. Амур рассматриваем раздельно летнюю и осеннюю формы (по Л.С. Бергу [23] – яровая и озимая расы). В районах совместного обитания эти формы размножаются симпатрически в одних и тех же речных бассейнах, но на разных типах нерестилищ – с разными температурными режимами [24–27]. Эти формы отличаются друг от друга также временем нереста и по некоторым меристическим признакам, в т. ч. по среднему числу пилорических придатков, что является адаптивно важным признаком, связанным с инкубационной температурой (см. обзор [20]). Кета южных Курильских островов характеризуется наличием речной и озерной форм, нерестящихся, соответственно, на речных и озерных нерестилищах [28, 29] и отличающихся миграционным поведением при скате молоди в морские воды [30]. Уже раньше было высказано предположение, что рыбы речного и озерного экотипов кеты являются репродуктивно независимыми группировками этого вида [31–33] и показали это в специальном исследовании [15].
Популяционные выборки кеты для тестирования по ДНК-маркерам
Места взятия выборок кеты указаны на рис. 1. Из многих мест выборки брали многократно – в течение сезона или в разные годы. В подавляющем большинстве это были зашедшие на нерест производители, лишь малая часть выборок представлена молодью. В каждой выборке было по несколько десятков особей (30–40 или больше); лишь в редких случаях объемы выборок были меньшими. Для настоящего исследования мы свели вместе все опубликованные нами ранее материалы по кете разных районов Дальнего Востока, небольшая часть выборок генотипирована впервые в этой работе.
Рис. 1,а. Чукотка: р. Канчалан (1), р. Белая (2), р. Анадырь (Марково, ЛРЗ11, 3), р. Великая (4), р. Туманская (5), р. Хатырка (6) [данные: 34]. Камчатка: Пенжинская губа (7), р. Палана (8), р. Еловка (9), оз. Ушки (10), р. Камчатка (11), р. Хайрюзова (12), р. Коль (13), р. Утка (14), р. Большая (15), р. Опала (16), р. Авача (17), р. Налычева (18), р. Жупанова (19), р. Вывенка (20), р. Кичига (21), р. Дранка (22), р. Хайлюля (23) [данные: 9]. Североохотское побережье материка: р. Ола (24), р. Яна (25), р. Тауй (26) [данные: 35]. Кроме того, для сравнения были взяты выборки кеты из рек Аляски [данные: 34].
Рис. 1,б. Летняя кета Амура: оз. Орель (1), Пальвинская протока (2), р. Сомня (3), р. Амгунь (4), р. Гера (5), протока Ухта (6, оз. Удыль); осенняя кета Амура: р. Нимелен (7), р. Дуки (8), р. Гур (9, ЛРЗ Гурский), р. Анюй (10), р. Тунгуска (11), р. Уссури (12, Амурская протока); бассейн р. Тугур (13–17) [данные: 14, 20]. Приморье: р. Аввакумовка (18), р. Киевка (19), Барабашевский ЛРЗ (20), р. Нарва (21), Рязановский ЭПРЗ (22) [данные: 36]. Остров Сахалин: р. Обутонай (23), р. Таранай (24), р. Лютога (25), р. Островка (26, ЛРЗ “Монетка”), р. Ударница (27), р. Белая, Б. Такое, Залом (притоки р. Найба, 28–30), устье р. Поронай (31), устье р. Тымь (32, материал собирали на ЛРЗ “Тымовский”), устье р. Лангры (33), р. Сова, р. Калинка, р. Сокольники, р. Ясноморка (34–37, материал собирали на ЛРЗ этих рек) [данные: 13, 14, 37–39, настоящее исследование]. Южные Курильские острова: озерная и речная кета о. Кунашир (38, 39), речная кета бассейнов рек Курилка и Рейдовая о. Итуруп (40, 41), озерная кета оз. Сопочное (42) [данные: 15].
Популяционно-генетические статистики
Для оценки генетической подразделенности кеты и верификации ее ЭГЕ генотипировали взятые биологические образцы по десяти микросателлитным маркерам (Ssa197, Ssa20-19, Ogo2, Oke3, Oke11, One103, One109, Ots3, Oki1-1 и Oki1-2) по методике К.И. Афанасьева с соавт. [35]. Статистики θS и θP популяционной дифференциации и их бутстреп-доверительные интервалы (CI: confidence interval) определяли согласно руководству Б. Вейра [40] с использованием программы GDA [41]. Статистика θS характеризует двухфакторную иерархическую классификацию и оценивает средние различия между множественными выборками из двух (или более) популяционных группировок (разных ЭГЕ). Статистика θP оценивает тотальные различия между сравниваемыми ЭГЕ (как если бы все выборки в каждой группировке слить в одну) и приводится в тексте в сравнительных целях. Всегда θP < θS. В рамках однофакторной классификации статистика θS оценивает только различия между наборами выборок (популяций) из отдельной популяционной группировки. Поэтому критерием выделения популяционных группировок как отдельных ЭГЕ служат бóльшие значения θS-статистик между этими группировками и меньшие различия между популяциями внутри них [12, 13]. Для графического представления и выделения генетически близких групп выборок использовали два метода: 1) строили неукорененное дерево на основе генетических дистанций Рейнолдса и метода UPGMA [40, 41], 2) определяли собственные векторы (“главные оси”) корреляционной матрицы попарных генетических различий [9, 42] с дальнейшим вращением методом Varimax, с использованием компьютерного пакета SPSS [43]. В результате такой процедуры выявляли группы выборок, близких по профилю их расстояний до остальных выборок.
РЕЗУЛЬТАТЫ
Основные генетические кластеры кеты
Данное исследование подтверждает ранее высказанное утверждение [9], что имеются пять больших генетических кластеров азиатской кеты, отвечающих пяти географически разным частям ее ареала, но с существенными дополнениями по их структуре (рис. 2). Перечислим их: 1) южная кета, включающая нерестовые стада южных Курильских островов (в т. ч. редкую озерную кету, а также уникальную кету р. Рыбацкая на о. Итуруп) и Приморья; 2) кета юго-западного Сахалина, воспроизводящаяся на рыбоводных заводах; 3) кета охотоморского побережья о. Сахалин, образующая два генетических субкластера: кеты юго-восточного Сахалина вместе с зал. Анива (к ней примыкает кета р. Обутонай юго-западного побережья п-ва Крильон – ЭГЕ 18S на рис. 1,б) и кеты северного Сахалина (от зал. Терпения, включая летнюю кету р. Поронай, до кеты северо-западного Сахалина, включая р. Лангры, впадающую в Амурский лиман); 4) кета бассейна р. Амур, состоящая из двух темпоральных группировок – осенней и летней; 5) северная кета, включающая нерестовые группировки охотоморского побережья материка, п-овов Камчатка и Чукотка.
Рис. 2.
Схема дифференциации пяти больших генетических кластеров кеты (а) и их подразделенность на плоскости двух главных координат (б). СС и ЮС – субкластеры “северный Сахалин” и “южный Сахалин” охотоморской кеты Сахалина (разделены штриховой линией), крестики – выборки кеты р. Обутонай из юго-западной части п-ова Крильон (район 18S на рис. 1), звездочки – выборки из р. Лангры северо-западного Сахалина (район 15W на рис. 1); кета Аляски дана для сравнения. У нас нет надежных первичных данных по нерестовой кете Японских островов, однако наиболее вероятна ее кластеризация с южной кетой Дальнего Востока России.

Различия между всеми пятью генетическими кластерами азиатской кеты значительны: θS = = 0.0828 и θP = 0.0651 с 95%-ными доверительными интервалами соответственно (0.0577, 0.1210) и (0.0408, 0.1029). Статистики их попарных различий приведены в табл. 1.
Таблица 1.
Различия между азиатскими группировками кеты разных генетических кластеров, представленных на рис. 2
| Южная кета | Юго-западный Сахалин | Бассейн р. Амур | Охотоморская кета Сахалина | Северная кета | |
|---|---|---|---|---|---|
| Южная кета | 0.0235 (0.0190, 0.0281) |
0.1049 (0.0706, 0.1598) |
0.1551 (0.0925, 0.2524) |
0.0758 (0.0514, 0.1084) |
0.0881 (0.0501, 0.1475) |
| Юго-западный Сахалин | 0.0852 (0.0512, 0.1389) |
0.0016 (–0.0012, 0.0045) |
0.1679 (0.0966, 0.2638) |
0.0634 (0.0430, 0.0910) |
0.0947 (0.0645, 0.1390) |
| Бассейн р. Амур | 0.1371 (0.0737, 0.2371) |
0.1622 (0.0901, 0.2593) |
0.0091 (0.0056, 0.0118) |
0.0673 (0.0383, 0.1020) |
0.0675 (0.0431, 0.0916) |
| Охотоморская кета Сахалина | 0.0550 (0.0317, 0.0863) |
0.0472 (0.0290, 0.0725) |
0.0514 (0.0219, 0.0864) |
0.0196 (0.0158, 0.0238) |
0.0403 (0.0283, 0.0521) |
| Северная кета | 0.0698 (0.0308, 0.1302) |
0.0801 (0.0510, 0.1255) |
0.0525 (0.0294, 0.0749) |
0.0222 (0.0122, 0.0319) |
0.0177 (0.0124, 0.0229) |
Примечание. В верхне-правой части матрицы представлены средние генетические различия между выборками разных ЭГЕ (θS), в нижне-левой части – среднее тотальное различие между ними (θP); по диагонали (серым фоном) – среднее различие между выборками в пределах каждой ЭГЕ. Аналогичное размещение – в табл. 2–5. Различие между кетой Аляски и азиатской северной кетой: θP = 0.346 с 95% CI = (0.0290, 0.0816); минимальное различие – с кетой Чукотки (бассейн р. Анадырь): θP = = 0.0253 с 95% CI = (0.0103, 0.0472).
Выявленные генетические кластеры включают выборки кеты из нескольких ЭГЕ: южная кета (17S, 17N, 19K, 19I); юго-западный Сахалин (18W); бассейн Нижнего Амура (14', 14''); охотоморская кета Сахалина (15W, 15E, 15S, 18E, 18S); северная кета (7, 8W, 8E, 9W, 9E, 10–13). Рассмотрим теперь соответствие генетических субкластеров каждого из кластеров выделенным экогеографическим единицам кеты.
ЭГЕ южной кеты
Южная кета в нашем материале представлена четырьмя генетическими субкластерами, которые однозначно отвечают биогеографическому подразделению на ЭГЕ, указанному на рис. 1: кеты островов Кунашир (19K) и Итуруп (19I) и кеты южного (17S) и центрального (17N) Приморья. Генетические различия между ними значительны (табл. 2). Наличие речных и озерных экотипов у южнокурильской кеты диктует необходимость выделения у кеты о. Кунашир двух ЭГЕ – озерной и речной формы. У кеты о. Итуруп выделяем, как минимум, два ЭГЕ речной формы (рек Курилка и Рейдовая) и дополнительно генетически не верифицированную кету бассейна р. Куйбышевка, и ЭГЕ озерной формы из оз. Сопочное; кроме того как генетически уникальную выделяем в виде отдельной ЭГЕ р. Рыбацкая [15, 33]. У кеты Приморья выделяем две ЭГЕ – южноприморскую (17S) и центральноприморскую (17N). Укажем на большое отличие приморской кеты не только от кеты южных Курильских островов, но и на ее значительную гетерогенность в пределах Приморья (табл. 2, [36]). Отсутствие выборок из северного Приморья (16P) не позволяет верифицировать генетический статус стад кеты этого биогеографического района.
Таблица 2.
Генетические различия между группировками южной кеты
| Итуруп | Кунашир | Южное Приморье | Центральное Приморье | |
|---|---|---|---|---|
| Итуруп | 0.0104 (0.0084, 0.0129) |
0.0247 (0.0195, 0.0299) |
0.0422 (0.0310, 0.0555) |
0.0483 (0.0381, 0.0568) |
| Кунашир | 0.0135 (0.0089, 0.0184) |
0.0134 (0.0082, 0.0202) |
0.0321 (0.0228, 0.0419) |
0.0407 (0.0297, 0.0568) |
| Южное Приморье | 0.0342 (0.0224, 0.0462) |
0.0217 (0.0141, 0.0288) |
0.0028 (–0.0024, 0.0070) |
0.0417 (0.0190, 0.0785) |
| Центральное Приморье | 0.0382 (0.0285, 0.0460) |
0.0276 (0.0187, 0.0399) |
0.0367 (0.0138, 0.0768) |
0.0135 (0.0015, 0.0260) |
Кета юго-западного Сахалина
Кета ЭГЕ 18W стоит особняком. Отличается значительно от всей остальной кеты Дальнего Востока, в т. ч. от кеты Сахалина и кеты Приморья и Приамурья (табл. 1), что неоднократно отмечалось ранее [9, 38, 39, 44]. Популяционные корни этого стада неизвестны, оно целиком воспроизводится на рыбоводных заводах, из которых основным донором других заводов этого района и за его пределами является кета ЛРЗ “Калининский” на р. Калинка. Следует отметить наименьшее внутрипопуляционное разнообразие кеты этого района: средняя ожидаемая гетерозиготность исследованных выборок равна 0.571, в то время как у кеты других районов – выше: 0.658, 0.625, 0.670 и 0.657 у южной, амурской, северной и охотоморской кеты Сахалина соответственно. Вероятно, это связано с эффектом основателя, возникшим при формировании стада ЛРЗ “Калининский” [45], а затем распространившимся на другие заводские популяции юго-западного Сахалина. На малое генетическое разнообразие кеты этого района указывает также статистически незначимые отличия друг от друга выборок разных лет из разных мест этого района, что нехарактерно для других группировок кеты (табл. 1). Поэтому здесь выделяется единственная ЭГЕ – кета юго-западного Сахалина.
Кета п-ова Крильон
Этот район (18S) отличается микроклиматом от остальной части южного Сахалина благодаря северной ветви теплого Цусимского течения и, возможно, ее взаимодействием с пятнами холодной воды из западной части зал. Анива [46–48]. Была возможность собрать выборки за четыре года только из одной реки юго-западной части района – р. Обутонай, впадающей в Татарский пролив. Генетические различия между этими выборками незначимы: θP = 0.0005 с 95% CI = (–0.0093, 0.0084). В то же время, несмотря на географическую близость к ЛРЗ юго-западного Сахалина, генетические данные указывают на уникальность дикой кеты р. Обутонай: ее отличие от кеты этих ЛРЗ велико: θS = 0.0428 с 95% CI = (0.0275, 0.0634), а тотальное различие между ними: θP = 0.0411 с 95% CI = (0.0269, 0.0625). И гораздо меньше отличается от кеты юго-восточного Сахалина, входя с ней в единый генетический субкластер “Южный Сахалин” (рис. 2): θS = 0.0116 с 95% CI = (0.0055, 0.0165), θP = 0.0081 с 95% CI = (0.0022, 0.0132). Эту кету выделяем в виде отдельной уникальной ЭГЕ – южнокрильонской кеты. Следует отметить, что наши выборки из р. Обутонай были взяты до строительства там рыбоводного завода, куда сейчас завозят оплодотворенную икру кеты, разводимой на других ЛРЗ Сахалина.
Кета охотоморского побережья Сахалина
Кета этого района генетически гетерогенна и состоит из двух четко различающихся больших группировок, выделяемых как два генетических субкластера (рис. 2): северного Сахалина (зоогеографический район 15) и юго-восточного Сахалина (вместе с зал. Анива, 18E). Среднее генетическое различие между выборками из северного Сахалина и выборками из юго-восточного Сахалина равно θS = 0.0300 с 95% CI = (0.0236, 0.0380), а среднее тотальное различие между ними: θP = 0.0222 с 95% CI = (0.0152, 0.0309). Это сравнимо с различиями между кетой северного Сахалина и северной кетой: θS = 0.0346 с 95% CI = (0.0221, 0.0480) и θP = = 0.0192 с 95% CI = (0.0093, 0.0305). Последнее может быть аргументом для выделения северо- и южносахалинского субкластеров как двух отдельных генетических кластеров азиатской кеты.
Что касается экогеографических единиц, то четкое отличие выборок кеты из биогеографических районов северного Сахалина (табл. 3) позволяет выделить здесь четыре ЭГЕ: осенней кеты районов 15W, 15E и 15S и летней кеты р. Поронай, впадающей в зал. Терпения (15S). Кета северного Сахалина значительно гетерогенна, наиболее отличающаяся из них – кета р. Лангры района 15W северо-западного Сахалина (табл. 3). Кажущаяся генетическая близость выборок из р. Лангры к кластеру северной кеты (рис. 1), а точнее – к кете р. Тугур (зоогеографический район 13), вызвана, скорее всего, искажением при проекции на плоскость главных координат. Фактически же стада кеты этих двух рек значительно отличаются друг от друга: θP = 0.0218 с 95% CI = (0.0056, 0.0419), что гораздо больше, чем отличие кеты Лангры от кеты Тыми и даже от осенней кеты более географически далекой осенней кеты р. Поронай. Что касается южной части кеты охотоморского побережья Сахалина, то по изученным ДНК-маркерам кета собственно юго-восточной части Сахалина (до мыса Анива) незначимо отличается от кеты, нерестящейся в реках зал. Анива: θP = 0.0009 с 95% CI = (–0.0002, 0.0027). Так что здесь генетически верифицируется только одна ЭГЕ – 18E, включающая нерестовые реки юго-восточного побережья Сахалина и зал. Анива.
Таблица 3.
Генетические различия между группировками кеты северного Сахалина
| Северо-западный Сахалин | р. Тымь | Осенняя кета р. Поронай | Летняя кета р. Поронай | |
|---|---|---|---|---|
| Северо-западный Сахалин | 0.0040 (–0.0035, 0.0118) |
0.0132 (0.0073, 0.0197) |
0.0203 (0.0074, 0.0395) |
0.0309 (0.0107, 0.0657) |
| р. Тымь | 0.0097 (0.0050, 0.0162) |
0.0037 (–0.0009, 0.0083) |
0.0081 (0.0040, 0.0143) |
0.0186 (0.0111, 0.0287) |
| Осенняя кета р. Поронай | 0.0172 (0.0055, 0.0358) |
0.0049 (0.0019, 0.0084) |
0.0031 (–0.0002, 0.0082) |
0.0102 (0.0061, 0.0145) |
| Летняя кета р. Поронай | 0.0309 (0.0098, 0.0674) |
0.0178 (0.0100, 0.0290) |
0.0084 (0.0039, 0.0126) |
–0.0010 (–0.0026, 0.0004) |
Кета бассейна р. Амур
Согласно экологическим и генетическим данным, кету Амурского зоогеографического района относим к двум экогеографическим единицам. Одна из ЭГЕ – это летний экотип, другая – осенний экотип. Генетические данные указывают на их заметные отличия друг от друга: θS = 0.0138 с 95% CI = (0.0084, 0.0189), θP = 0.0101 с 95% CI = = (0.0045, 0.0158), что соответствует более раннему заключению [14, 20]. Летняя кета Амура была ранее выделена С.Ф. Золотухиным [49] как отдельная экогеографическая единица. Для территориальной определенности ограничиваем эту ЭГЕ Амуро-Амгуньским экорегионом (14') согласно экологическому районированию [19] – см. рис. 1, что практически совпадает с установленными границами нереста летней кеты [49]. Осенняя кета Амура более широко расселена по Амуру, но генетические данные не позволяют разделить осеннюю кету Амура на четко различимые пространственно или темпорально разделенные группировки. Поэтому в качестве второй экогеографической единицы амурской кеты рассматриваем осеннюю кету, нерестящуюся в пределах всего Нижнего Амура (по классификации Е.А. Симонова и Е.Г. Егидарева [19] – объединенные подрайоны 14' и 14'' [14]).
Северная кета
Соответственно рис. 2,a и 2,б выделяются три генетических субкластера кеты, которые подразделяем на три ЭГЕ: анадырского (7), североохотского (10) и шантарского (13) зоогеографических районов (табл. 4). Что касается кеты, нерестящейся в реках п-ова Камчатка, то она генетически более разнообразна, чем предыдущие три субкластера (табл. 4). Камчатская кета зоогеографически и генетически подразделяется далее еще на четыре ЭГЕ (табл. 5): северо-западная Камчатка (8W), северо-восточная Камчатка (8E), южнокамчатская (9W + 9E) и отдельно ЭГЕ кеты р. Камчатка (выборки 9–11 на рис. 1). Генетические различия между кетой юго-западной и юго-восточной Камчатки (районы 9W и 9E) статистически незначимы: θP = 0.0010 с 95% CI = (–0.0007, 0.0028), почему они и были объединены в одну единицу – ЭГЕ южнокамчатской кеты. Кета рек Палана и Пенжина сильно различаются: θP = = 0.0201 с 95% CI = (0.0051, 0.0371), что обусловило большую вариабельность в пределах ЭГЕ северо-западной Камчатки (табл. 5). Возможно ее следовало бы далее подразделить на дополнительные ЭГЕ, однако имеющихся данных недостаточно для их генетической верификации.
Таблица 4.
Генетические различия между группировками северной кеты
| Чукотка | Камчатка | Североохотский район | Шантарский район | |
|---|---|---|---|---|
| Чукотка | 0.0018 (–0.0016, 0.0046) |
0.0200 (0.0136, 0.0265) |
0.0101 (0.0047, 0.0143) |
0.0285 (0.0156, 0.0405) |
| Камчатка | 0.0099 (0.0061, 0.0137) |
0.0135 (0.0095, 0.0171) |
0.0214 (0.0137, 0.0313) |
0.0320 (0.0204, 0.0435) |
| Североохотский район | 0.0081 (0.0038, 0.0122) |
0.0096 (0.0028, 0.0186) |
0.0030 (–0.0023, 0.0082) |
0.0156 (0.0080, 0.0229) |
| Шантарский район | 0.0262 (0.0147, 0.0380) |
0.0206 (0.0107, 0.0306) |
0.0126 (0.0053, 0.0197) |
0.0032 (–0.0005, 0.0071) |
Таблица 5.
Генетические различия между группировками кеты п-ова Камчатка
| Бассейн р. Камчатка | Северо-западная Камчатка | Карагинский залив | Южная Камчатка |
|
|---|---|---|---|---|
| Бассейн р. Камчатка | 0.0101 (0.0030, 0.0195) |
0.0310 (0.0192, 0.0416) |
0.0155 (0.0092, 0.0217) |
0.0187 (0.0113, 0.0280) |
| Северо-западная Камчатка | 0.0203 (0.0102, 0.0291) |
0.0127 (0.0024, 0.0237) |
0.0169 (0.0091, 0.0249) |
0.0126 (0.0066, 0.0186) |
| Карагинский залив | 0.0078 (0.0040, 0.0123) |
0.0091 (0.0032, 0.0168) |
0.0055 (0.0027, 0.0084) |
0.0081 (0.0043, 0.0135) |
| Южная Камчатка |
0.0120 (0.0060, 0.0221) |
0.0072 (0.0026, 0.0129) |
0.0040 (0.0007, 0.0085) |
0.0033 (0.0022, 0.0046) |
ОБСУЖДЕНИЕ
Для разработки планов управления природными биологическими ресурсами (планов их воспроизводства, промысла, охраны) необходимо выделять единицы запаса. Как соотносятся между собой экогеографическая единица и единица запаса? Согласно В.И. Карпенко [50: стр. 49], под единицей запаса можно понимать популяцию, стадо, локальное стадо или иную группировку вида. С другой стороны, В.Н. Иванков и Е.В. Иванкова [51] полагают, что под ней может пониматься локальная популяция, являющаяся одновременно и единицей промысла. Л.А. Животовский [33, 52] определил единицу запаса как отдельную ЭГЕ со своими географическими и экологическими границами, популяции которой интегрированы единым планом управления (воспроизводства, промысла, охраны). Для кеты, как и для любых других видов, важно выделять единицы запаса, так как они дают биологически обоснованные соотношения норм вылова и регуляцию воспроизводства с учетом популяционной структуры вида и требований к эффективности воспроизводства как заводской, так и дикой рыбы [53].
Наличие четких пространственных границ между ЭГЕ, бóльшая эколого-географическая однородность ареала и генетическая близость популяций между собой в пределах одной ЭГЕ в сравнении с различиями между разными ЭГЕ – все это делает их удобными кандидатами на роль единиц запаса. Соответственно указанным свойствам, каждой ЭГЕ можно управлять независимо от других ЭГЕ данного вида. Принимая ЭГЕ в качестве базовых единиц воспроизводства, можно в их пределах рассматривать вопросы выбора рек и мест для лососевых рыбоводных заводов [54] с ориентацией на ключевые лососевые реки для обеспечения сохранения природных популяций лососевых [54, 55]. Кроме того, ЭГЕ позволяют дать ограничения на перевозки оплодотворенной икры между ЛРЗ, поскольку нередки бессистемные перевозки искусственно воспроизводимых популяций кеты. Это означает, что перевозки рыбы из популяций-доноров других единиц запаса нарушают сложившуюся эколого-генетическую структуру популяции-реципиента. Поэтому крайне нежелательны (вплоть до полного запрета) перевозки оплодотворенной икры или иного генетического материала между популяциями кеты разных ЭГЕ (заводскими или дикими).
Даже в пределах одного нерестового бассейна следует с предельной осторожностью осуществлять рыбоводную, хозяйственную или иную деятельность, если она может привести к перемешиванию озерного и речного экотипов, летней и осенней форм, так как они относятся к разным ЭГЕ. Однако перевозки могут осуществляться между популяциями кеты в пределах одной ЭГЕ. Исключение составляет искусственное воспроизводство в местах, где нет диких лососей или взамен исчезнувших популяций [54].
Если обращаться к ЭГЕ как к базовым единицам добычи (вылова) водных биоресурсов, то на их основе можно принимать решение о распределении допустимого улова между разными ЭГЕ или группами ЭГЕ. Если обращаться к ЭГЕ как к базовым единицам охраны, то имея географическую сетку ЭГЕ на ареале вида (рис. 1) можно соотнести их с рыбохозяйственными заповедными зонами [6] и ключевыми лососевыми реками [54, 55] и использовать для разработки стратегии сохранения редких видов и популяций [10, 12, 56]. В частности, в масштабах Дальнего Востока озерная кета южных Курильских островов, летняя кета р. Поронай, кета р. Рыбацкая на о. Итуруп и р. Обутонай на юго-западном Сахалине – генетически уникальные формы.
В целом основной результат настоящей работы, по нашему мнению, – показать на примере кеты, что важным уровнем популяционной структуры вида являются экогеографические единицы (ЭГЕ). Их можно выделять, используя информацию о географии, экологии и генетике вида. При этом ясно очерченные географические границы ЭГЕ и сформулированные экологические и генетические принципы их верификации позволяют рационально управлять ресурсами вида.
Авторы признательны профессору В.И. Карпенко (Камчатский гос. техн. ун-т) за полезные замечания и предложения.
Работа выполнена в рамках гостемы ГЗ 0112-2019-0002 (подтема “Эколого-генетическая структура вида”). Финансирование работы поддержано грантом РНФ 19-16-00101.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Salo E.O. Life history of chum salmon (Oncorhynchus keta) // Pacific Salmon Life Histories. Vancouver: UBC Press, 1991. P. 231–309.
Макоедов А.Н., Коротаев Ю.А., Антонов Н.П. Азиатская кета. Петропавловск-Камчатский: КамчатНИРО, 2009. 356 с.
Urawa Sh., Beacham T.D., Fukuwaka M.-A., Kaeriyama M. Ocean ecology of chum salmon // The Ocean Ecology of Pacific Salmon and Trout. Maryland, Bethesda: Am. Fisheries Society, 2018. P. 161–317.
Глубоковский М.К., Павлов Д.С., Леман В.Н. и др. Методические рекомендации по организации РХЗЗ на примере лососевых рыб Дальнего Востока России // Лососевые рыбохозяйственные заповедные зоны на Дальнем Востоке России. М.: Изд-во ВНИРО, 2010. С. 98–122.
Леман В.Н., Смирнов Б.П., Точилина Т.Г. Пастбищное лососеводство на Дальнем Востоке: современное состояние и существующие проблемы // Тр. ВНИРО. 2015. Т. 153. С. 105–120.
Каев А.М., Ромасенко Л.В., Каев Д.А. К вопросу об эффективности крупномасштабного разведения кеты Oncorhynchus keta (Walbaum, 1792) на острове Итуруп (Курильские острова) // Биол. моря. 2021. Т. 47. № 6. С. 411–420.
Klovach N., Leman V., Gordeev I. The relative importance of enhancement to the production of salmon on Iturup Island (Kuril Islands, Russia) // Reviews in Aquaculture. 2021. V. 13. P. 664–675.
Карпенко В.И., Рассадников О.А. Состояние запасов дальневосточных лососей (Salmonidae) в современный период (1972–2002) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. 2004. Вып. 7. С. 14–26.
Животовский Л.А., Рубцова Г.И., Шитова М.В. и др. База микросателлитных ДНК-данных по кете Дальнего Востока России // Реализация “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. Владивосток: Изд-во ТИНРО-центр, 2010. Бюл. № 5. С. 53–63.
Zhivotovsky L.A., Yurchenko A.A., Nikitin V.D. et al. Eco-geographic units, population hierarchy, and a two-level conservation strategy with reference to a critically endangered salmonid, Sakhalin taimen Parahucho perryi // Conserv. Genetics. 2015. V. 16. P. 431–441. https://doi.org/10.1007/s10592-014-0670-4
Животовский Л.А. Популяционная структура вида: эко-географические единицы и генетическая дифференциация популяций // Биол. моря. 2016. Т. 42. № 5. С. 323–333.https://doi.org/10.1134/S1063074016050114
Животовский Л.А. Генетика природных популяций. Йошкар-Ола: Типография “Вертикаль”, 2021. 600 с.
Животовский Л.А. Экогеографические единицы и единицы запаса вида в пресноводных экосистемах (на примере кеты о. Сахалин) // Принципы и способы сохранения биоразнообразия. Йошкар-Ола: Изд-во Марийского гос. ун-та, 2019. С. 276–278.
Животовский Л.А., Подорожнюк Е.В., Кульбачный С.Е. и др. Экогеографические единицы и единицы запаса кеты Oncorhynchus keta Амурской зоогеографической провинции // Вопр. ихтиологии. 2021. Т. 61. С. 432–440. https://doi.org/10.31857/S0042875221040214
Животовский Л.А., Рубцова Г.А., Каев А.М. и др. Эколого-географическая и генетическая дифференциация и единицы запаса кеты (Oncorhynchus keta) южных Курильских островов // Вопр. ихтиологии. 2022. В печати.
Черешнев И.А. Биогеография пресноводных рыб Дальнего Востока России. Владивосток: Дальнаука, 1998. 131 с.
Корытный Л.М. Бассейновая концепция: от гидрологии к природопользованию // География и природные ресурсы. 2017. № 2. С. 5–16.
Мартыненко А.Б., Бочарников В.Н. Экологическое районирование Дальнего Востока // Изв. РАН. Сер. геогр. 2008. № 2. С. 76–84.
Симонов Е.А., Егидарев Е.Г. Бассейн реки Амур: характеристика и особенности использования водных ресурсов // Комплексная эколого-экономическая оценка развития гидроэнергетики бассейна реки Амур. Всемирный фонд дикой природы. М., 2015. (30.12.2019). С. 21–32. https://amurinfocenter.org/upload/iblock/40f/kompleksnaya-ekologo_ekonomicheskaya-otsenka-razvitiya-gidroenergetiki-basseyna-reki-amur.pdf
Животовский Л.А, Лапшина А.Е., Михеев П.Б. и др. Дивергенция сезонных рас кеты (Oncorhynchus keta) рек Амур и Поронай: экология, генетика, морфология // Биология моря. 2017. Т. 43. С. 284–292. https://doi.org/10.1134/S1063074017040125
Курганский Г.Н., Марковцев В.Г. Биологические и технические основы разведения лососей в Приморском крае // Изв. ТИНРО. 2005. Т. 141. С. 225–334.
Ганзей К.С. Ландшафты и физико-географическое районирование Курильских островов. Владивосток: Дальнаука, 2010. 214 с.
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. М.; Л.: Изд-во АН СССР, 1949. Ч. 2. С. 469–925.
Бирман И.Б. Динамика численности и современное состояние запасов кеты и горбуши в бассейне Амура // Тр. совещ. по лососевому хозяйству Дальнего Востока. М.: АН СССР, 1954. С. 22–37.
Волобуев В.В., Рогатных А.Ю., Кузищин К.В. О внутривидовых формах кеты Oncorhynchus keta материкового побережья Охотского моря // Вопр. ихтиологии. 1990. Т. 30. Вып. 2. С. 221–228.
Рослый Ю.С. Динамика популяций и воспроизводство тихоокеанских лососей в бассейне Амура. Хабаровск, 2002. 210 с.
Волобуев В.В., Марченко С.Л. Тихоокеанские лососи континентального побережья Охотского моря (биология, популяционная структура, динамика численности, промысел). Магадан: СВНЦ ДВО РАН, 2011. 303 с.
Иванков В.Н. Экотипы лососевых рыб // Морфология и систематика лососевидных рыб. Л.: ЗИН АН СССР, 1985. С. 85–91.
Каев А.М. Особенности воспроизводства кеты в связи с ее размерно-возрастной структурой. Южно-Сахалинск: СахНИРО, 2003. 288 с.
Каев А.М., Ромасенко Л.В. Морфобиологические особенности речной и озерной форм кеты Oncorhynchus keta (Salmonidae) на южных Курильских островах // Вопр. ихтиологии. 2010. Т. 50. № 3. С. 318–327.
Каев А.М., Афанасьев К.И., Рубцова Г.А. и др. О генетической дифференциации кеты речного и озерного экотипов на о. Итуруп (Курильские острова) // Современное состояние водных биоресурсов. Владивосток: ТИНРО-центр. 2008. С. 372–374.
Животовский Л.А., Рубцова Г.А., Шитова М.В. и др. Генетические принципы экологической сертификации промысла тихоокеанских лососей // Реализация “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей” / Под ред. Шунтова В.П. Владивосток, ТИНРО-центр, 2009. Бюл. № 4. С. 117–125.
Животовский Л.А. Провизорное районирование единиц запаса кеты Дальнего Востока России // Изучение тихоокеанских лососей на Дальнем Востоке. Владивосток: ТИНРО-центр, 2016. Бюл. № 11. С. 193–198.
Шитова М.В., Хохлов Ю.Н., Никифоров А.И. и др. Дифференциация северной азиатской кеты (Oncorhynchus keta W.) по микросателлитным маркерам // Генетика. 2020. Т. 56. № 6. С. 677–689. https://doi.org/10.31857/S0016675820060119
Афанасьев К.И., Рубцова Г.А., Шитова М.В. и др. Популяционная структура кеты Oncorhynchus keta российского Дальнего Востока, выявленная по микросателлитным маркерам // Биол. моря. 2011. Т. 37. № 1. С. 39–47. https://doi.org/10.1134/S1063074011010032
Шитова М.В., Марковцев В.Г., Животовский Л.А. и др. Микросателлитная изменчивость кеты Приморья // Генетика. 2017. Т. 53. № 9. С. 1071–1076.
Афанасьев К.И., Рубцова Г.А., Шитова М.В. и др. Межрегиональная дифференциация кеты Сахалина и Южных Курил по микросателлитным локусам // Генетика. 2008. Т. 44. № 7. С. 956–963.
Рубцова Г.И., Афанасьев К.И., Малинина Т.В. и др. Дифференциация популяций кеты (Oncorhynchus keta Walbaum) по микросателлитным и аллозимным маркерам: сравнительный анализ // Генетика. 2008. Т. 44. № 7. С. 964–971.
Шитова М.В., Афанасьев К.И., Рубцова Г.А. и др. Микросателлитная изменчивость заводских популяций кеты (Oncorhynchus keta Walbaum) о. Сахалин // Вопр. рыболовства. 2009. Т. 10. № 1. С. 102–115.
Weir B.S. Genetic Data Analysis II: Methods for Discrete Population Genetic Data. Sunderland, MA: Sinauer Associates, 1996. 445 p.
Lewis P.O., Zaykin D. Genetic Data Analysis, Computer Program for the Analysis of Allelic Data. 2001. http://lewiseebuconnlewishome/softwarehtml
Zhivotovsky L.A., Rosenberg N.A., Feldman M.W. Features of evolution and expansion of modern humans inferred from genome-wide microsatellite markers // Am. J. Hum. Genet. 2003. V. 72. Iss. 5. P. 1171–1186. https://doi.org/10.1086/375120
George D., Mallery P. SPSS for Windows Step by Step. Boston: Pearson, 2005. 386 p.
Салменкова Е.А., Омельченко В.Т., Афанасьев К.И., Рубцова Г.А. Генетическое разнообразие азиатской кеты Oncorhynchus keta (Salmonidae, Salmoniformes) и динамика генофондов сахалинских популяций при искусственном воспроизводстве // Вопр. ихтиологии. 2008. Т. 48. № 3. С. 361–373.
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т. Популяционная генетика лососевых рыб. М.: Наука, 1997. 288 с.
Кантаков Г.А. Результаты биоокеанографических исследований в проливе Лаперуза в 1995–1998 гг. // Вестник Сахалинского музея. 1999. № 6. С. 305–311.
Дьяков Б.С. Межгодовая изменчивость циркуляции морских вод в Татарском проливе в летнее время // Изв. ТИНРО. 2006. Т. 144. С. 281–299.
Дьяков Б.С. О циркуляции вод в Татарском проливе в весеннее время // Изв. ТИНРО. 2006. Т. 146. С. 205–212.
Золотухин С.Ф. Внутривидовые группировки кеты Oncorhynchus keta (Salmonidae) реки Амур и их распределение по бассейну // Изв. ТИНРО. 2019. Т. 197. С. 21–34.
Карпенко В.И. Оценка состояния запасов и управление промыслом тихоокеанских лососей на Камчатке. Петропавловск-Камчатский: Камчат. гос. техн. ун-т, 2013. 64 с.
Иванков В.Н., Иванкова Е.В. Эколого-темпоральная дифференциация, единицы запаса и сохранение популяционного разнообразия анадромных рыб // Биол. моря. 2020. Т. 46. № 2. С. 85–90.
Животовский Л.А. Две ветви исследований популяционной структуры вида – экологическая и генетическая: история, проблемы, решения // Генетика. 2017. Т. 53. № 11. С. 1244–1253.
Животовский Л.А., Смирнов Б.П. Стратегия воспроизводства тихоокеанских лососей в Сахалинской области // Вопр. рыболовства. 2018. Т. 19. № 3. С. 285–299.
Зиничев В.В., Леман В.Н., Животовский Л.А., Ставенко Г.А. Теория и практика сохранения биоразнообразия при разведении тихоокеанских лососей. М.: Изд-во ВНИРО, 2012. 238 с.
Павлов Д.С., Букварева Е.Н., Савваитова К.А. Сеть ключевых лососевых рек. Российский подход. М.: Изд-во ИПЭЭ РАН, 2007. 17 с.
Животовский Л.А., Османова Г.О. Экогеографические единицы и охрана внутривидового разнообразия // Изв. РАН. Сер. биол. 2020. № 2. С. 124–136.
Дополнительные материалы отсутствуют.


