Генетика, 2022, T. 58, № 5, стр. 540-549
Тканеспецифичность активности гена AqE у желтого горбыля Larimichthys crocea
Л. В. Пузакова 1, *, М. В. Пузаков 1
1 Федеральный исследовательский центр Институт биологии южных морей им. А.О. Ковалевского
Российской академии наук
299011 Севастополь, Россия
* E-mail: kvluda@yandex.ru
Поступила в редакцию 19.11.2021
После доработки 13.12.2021
Принята к публикации 14.12.2021
- EDN: HNUKYF
- DOI: 10.31857/S0016675822050071
Аннотация
Изучение разнообразия метаболических путей является важным аспектом для понимания эволюционных связей между метаболическими путями и их биохимическими предшественниками. Недавно был описан сульфолактатдегидрогеназа-подобный белок, кодируемый у эукариот геном AqE, который у костистых рыб сохраняет высокую консервативность. Однако до сих пор остается неизвестной роль этого фермента в метаболизме. В настоящей работе изучалась транскрипционная активность гена AqE, а также других генов, связанных с энергообменом у большого желтого горбыля Larimichthys crocea. Количественный анализ экспрессии показал тканеспецифичность активности гена AqE у желтого горбыля. Ген активен в печени, коже и жабрах. Исходя из анализа экспрессии гена в различных органах в нормальных условиях и под воздействием стрессирующих факторов, предполагается, что фермент, кодируемый геном AqE, участвует в малат-аспартатном челноке или в выведении конечных метаболитов (сульфолактат) из организма.
Низкая растворимость кислорода в воде – один из основных факторов, обусловливающих особенности метаболизма организмов, обитающих постоянно или на какой-либо стадии онтогенеза в водной (жидкой) среде. Поскольку первые формы жизни появились и впоследствии эволюционировали в жидкой среде, “гипоксические” типы энергообмена появились раньше и, вероятно, более разнообразны. Известно, что активность NADH-зависимых оксидоредуктаз, таких как малатдегидрогеназа (МДГ) и лактатдегидрогеназа (ЛДГ), меняется в зависимости от концентрации кислорода в воде [1]. Эти белки катализируют восстановление 2-кетокарбоновых кислот через кофактор NADH и объединены в семейство ЛДГ/МДГ-оксидоредуктаз [2]. ЛДГ обеспечивает обратимое превращение лактата в пируват. МДГ катализирует взаимопревращения между малатом и оксалоацетатом. ЛДГ/МДГ-оксидоредуктазы были описаны и секвенированы у бактерий, архей и эукариот [2]. Позднее были выявлены другие NADH-зависимые оксидоредуктазы, некоторые представители которых также используют в качестве субстратов лактат или малат [3, 4]. Эти ферменты были объединены в семейство ЛДГ2/МДГ2-оксидоредуктазы (ЛДГ/МДГ-оксидоредуктазы типа 2) [5].
Преобладающая доля ЛДГ2/МДГ2-оксидоредуктаз была обнаружена только у архей и бактерий [5]. Однако гомологи гена comC, который у архей и бактерий кодирует сульфолактатдегидрогеназу (СЛДГ) [6–8], были обнаружены и у эукариот [9]. При этом было установлено, что гомологи гена comC присутствуют и в геномах грибов, растений, животных. Однако в царстве растений этот гомологичный ген обнаружен только у водорослей, тогда как у мхов и семенных растений отсутствует. У животных гомологи гена найдены у представителей большинства эволюционных групп, но утеряны у четвероногих (земноводных, рептилий, птиц и млекопитающих) [9]. Поскольку ген, кодирующий неизвестный фермент, встречается только в тех таксонах, образ жизни или стадии онтогенеза представителей которых связаны с водной (жидкой) средой, он был условно назван AqE (aquatic enzyme, водный фермент). В результате детального исследования гена AqE у костистых рыб было установлено, что у карпообразных (Cypriniformes) он был утерян полностью, а у представителей лососеобразных (Salmoniformes) претерпел значительные делеции. Тем не менее у преобладающего числа исследованных рыб (50 отрядов) ген AqE сохраняет высокую консервативность и следовательно кодируемый им фермент задействован в пока еще неизвестных метаболических путях [10]. Кроме того, было предположено, что продукт гена AqE участвует в анаэробном энергообмене и потеря гена у отдельных животных и растений связана с выходом на сушу и соответствующей перестройкой метаболизма, обусловленной насыщенностью среды кислородом и отсутствием естественной гипоксии, характерной для гидробионтов [9].
Экспериментально показано, что субстратами для СЛДГ бактерий и архей, кодируемой геном comC, могут быть сульфолактат, малат и α-кетоглутарат [5]. Некоторые исследователи [6] предполагают, что преобразование сульфолактата в сульфопируват у эукариот не имеет смысла, поскольку отсутствуют соответствующие метаболические процессы. Однако в более ранней работе описано опосредованное МДГ-обратимое превращение сульфопирувата в сульфолактат у мышей при метаболизме цистеата [11]. При этом сульфолактат является конечным метаболитом, преобладающая доля которого выводится из организма с мочой. Только 12% сульфолактата вновь преобразуется в сульфопируват, который затем метаболизируется в таурин и углекислый газ. Другие два субстрата малат и α-кетоглутарат являются ключевыми соединениями в малат-аспартатном челноке [12]. Этот биохимический механизм считается наиболее эффективным процессом, который позволяет водным организмам выживать в условиях гипоксии (аноксии) [1]. В связи с этим были предположения, что продукт гена AqE (СЛДГ-подобный белок) может быть вовлечен в малат-аспартатный челнок или сопряженные процессы [10].
Для того чтобы приблизиться к пониманию роли гена AqE в метаболизме эукариот мы изучили его транскрипционную активность, а также активность генов, кодирующих ферменты, участвующие в малат-аспартатном челноке и сопряженных процессах. В качестве объекта исследования был выбран большой желтый горбыль (Larimichthys crocea) – вид морских рыб из семейства горбылевых (Sciaenidae). Поскольку L. crocea является достаточно важным промысловым видом (и поэтому модельным объектом), его геном был секвенирован и аннотирован [13]. Ген AqE у L. crocea локализован на 21-й хромосоме и включает, как и у большинства костистых рыб, 11 экзонов [10]. В результате более десяти исследований на желтом горбыле для более 200 образцов были получены транскриптомы, которые и были использованы в настоящей работе.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования дифференциальной экспрессии генов из базы NCBI были выбраны первичные данные (архивы коротких фрагментов транскриптомов, SRA, sequence read archive), полученные в десяти исследованиях, направленных на изучение влияния гипоксии, голода, температуры и других воздействий на активность генов (табл. 1).
Таблица 1.
Транскриптомные данные, использованные в работе
| Идентификатор исследования в NCBI | Органы | Контрольные точки | Детали эксперимента (на основе данных, представленных в NCBI) |
|---|---|---|---|
| PRJNA246784 | Мозг | Контроль, 1 ч, 3 ч, 6 ч, 12 ч, 24 ч, 48 ч | Изучалось влияние гипоксии. Эксперименты проводились при 25°C. Содержание кислорода в резервуаре было снижено со 100% (7.8 мг/л) до 20% (1.6 ± 0.2 мг/л) в течение 30 мин. В соответствующие временные точки отбирали пробы и секвенировали мРНК. Пол не указан |
| PRJNA574876 | Селезенка, надпочечник | Контроль, 6 ч, 24 ч, 48 ч | |
| PRJNA576086 | Жабры, сердце | Контроль, 6 ч, 24 ч, 48 ч | |
| PRJNA296537 | Мышца | Контроль, 21 день | Изучалось влияние голодания. Секвенировали мРНК из двух образцов мышц, взятых у нормально кормящихся рыб и у рыб, подвергшихся 21-дневному голоданию. Пол не указан |
| PRJNA563184 | Печень (1) | Контроль, 6 ч, 24 ч, 48 ч, 96 ч, 120 ч | Изучалось влияние гипоксии. Использовали особей обоего пола |
| PRJNA280841 | Печень (2) | Контроль, 12 ч (тепло), 12 ч (холод), 21 день (голод) | Секвенировали мРНК из четырех образцов (по два повтора), взятых у контрольной группы рыб, у рыб, подвергшихся термическому стрессу (12 ч), у рыб, подвергшихся воздействию холодового стресса (12 ч), и у рыб, подвергшихся 21-дневному голоданию. Пол не указан |
| PRJNA326556 | Печень (3) | Контроль | Секвенировали мРНК печени в нормальных условиях. Пол не указан |
| PRJNA279244 | Печень (4) | Контроль | Секвенировали мРНК печени в нормальных условиях. Объединенные образцы особей обоего пола |
| PRJNA357970 | Эмбрион | 1 клетка, 2 клетки, 8 клеток, 16 клеток, 256 клеток, бластула, гаструла | Секвенировали мРНК из образцов, взятых на различных стадиях раннего развития. Пол не указан |
| PRJNA303096 | Кожа | Контроль, 0.5 ч, 2 ч | Изучение процессов регенерации. Были произведены повреждения кожи брюшной области. В соответствующие временные точки отбирали пробы и секвенировали мРНК. Пол не указан |
Экспрессию генов количественно оценивали с помощью совместного использования программ Kallisto и Sleuth. Количественная оценка была выполнена с помощью Kallisto (v0.46.1) [14], где на основе метода псевдо-выравнивания коротких фрагментов и транскриптов подсчитывается количество содержания РНК в образце и выражается в величине TPM (транскриптов на миллион пн). Для увеличения достоверности при подсчете было осуществлено 100 повторов (bootstrap 100). Для выравнивания использовалась сборка кДНК транскриптов (TSA) большого желтого горбыля L. crocea GBIF00000000. Последующая оценка дифференциальной экспрессии генов была выполнена с использованием пакета Sleuth R (v0.30.0) [15], в котором на основе предварительных количественных оценок, полученных с помощью Kallisto, создается нормализованная на уровне генов матрица TPM. Нормализованные значения были также скорректированы с учетом возможных погрешностей в данных РНК-секвенирования, полученных в результате применения различных методов определения последовательности нуклеотидов.
Для визуализации кластерного анализа использовалась функция Plot_transcript_heatmap в программе Sleuth. При построении тепловых карт учитывались данные оценки количественной экспрессии гена AqE, маркерных генов (actb, hprt1 и 18S-rRNA), генов ферментов метаболических путей, в которых предположительно задействован AqE (mdh1, mdh2, aat1 и aat2), и генов ферментов возможных сопряженных процессов (ldha, ldhb, ldhc и l2hgdh). Транскрибируемые мРНК перечисленных генов были выявлены в TSA желтого горбыля (GBIF00000000) с помощью tBLASTn (https:// blast.ncbi.nlm.nih.gov/Blast.cgi). Некоторые гены были представлены в TSA двумя последовательностями (табл. 2).
Таблица 2.
Соответствие транскриптов и генов, взятых в анализ
| Ген | Транскрипты | Ген | Транскрипты |
|---|---|---|---|
| AqE | GBIF01041602 | ldha | GBIF01031803 GBIF01031802 |
| actb | GBIF01031352 | ||
| hprt1 | GBIF01037543 GBIF01032011 |
ldhb | GBIF01048565 GBIF01029835 |
| aat1 | GBIF01018893 | ldhc | GBIF01007540 GBIF01049052 |
| aat2 | GBIF01033704 | ||
| mdh1 | GBIF01032153 | l2hgdh | GBIF01044688 GBIF01044690 |
| mdh2 | GBIF01033562 | ||
| 18S-rRNA | GBIF01045948 |
РЕЗУЛЬТАТЫ
Транскрипционная активность гена AqE
В данном исследовании был впервые проведен количественный анализ экспрессии гена AqE в различных органах желтого горбыля. Кроме того, была изучена динамика изменения уровня транскрипционной активности AqE в отдельных органах после воздействия на желтого горбыля различными стрессирующими факторами (гипоксия, тепловой/холодовой стресс, голодание), а также в ходе раннего развития и в процессе регенерации тканей. Также в анализ были включены маркерные гены (actb, hprt1, 18S-rRNA), гены некоторых ферментов малат-аспартатного челнока (mdh1, mdh2, aat1, aat2) и гены ферментов возможных сопряженных процессов (ldha, ldhb, ldhc и l2hgdh).
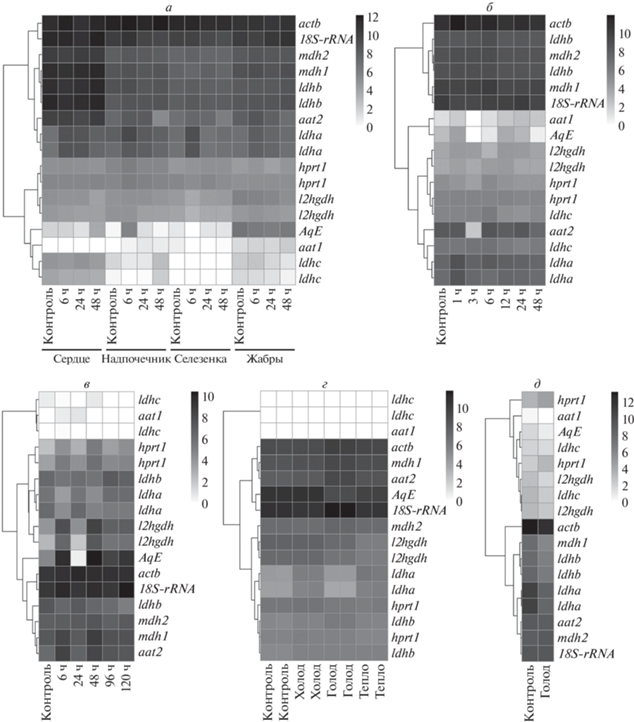
В экспрессии гена AqE в различных органах выявлена ярко выраженная неоднородность (рис. 1,а). Низкий уровень транскрипционной активности отмечен в мышце, надпочечнике, селезенке, мозге и сердце. Кожа и жабры демонстрируют средний уровень активности гена. В печени (в большинстве контрольных образцов) выявлен высокий уровень экспрессии (рис. 1,а). Активность в печени после теплового и холодового стресса осталась неизменной, тогда как зафиксировано некоторое снижение экспрессии в результате голодания (рис. 2,г). Также присутствует некоторое снижение уровня экспрессии AqE в мышцах после голодания (рис. 2,д). В процессе регенерации кожи явных изменений в активности не было выявлено (рис. 1,в). Замечено усиление транскрипционной активности на стадии бластулы и гаструлы во время раннего эмбриогенеза (рис. 1,б). Однако из-за отсутствия транскриптомных данных пока невозможно оценить на каком уровне поддерживается экспрессия в ходе последующего развития. При исследовании влияния гипоксии на транскрипционную активность гена AqE видимая неоднородность выявлена в сердце, надпочечнике, мозге и печени (рис. 2,а). При этом в сердце и надпочечниках показано пиковое повышение экспрессии через 48 и 6 ч после гипоксии соответственно (рис. 2,а). В мозге изменение уровня экспрессии носит волнообразный характер (рис. 2,б) от небольшого повышения (1 ч), последующего снижения (3 ч), очередного повышения (6 и 12 ч) и снижения (24 и 48 ч). В печени выявлено повышение уровня экспрессии после гипоксии относительно контроля, однако в одной точке (24 ч) уровень был снижен практически до нулевого значения (рис. 2,в). В селезенке и жабрах видимых изменений активности гена в результате гипоксии установлено не было (рис. 2,а).
Рис. 1.
Дифференциальная экспрессия генов большого желтого горбыля. а – активность генов в различных органах горбыля при нормальных условиях (PRJNA574876 (селезенка и надпочечник), PRJNA576086 (жабры и сердце), PRJNA246784 (мозг), PRJNA563184 (печень 1), PRJNA280841 (печень 2), PRJNA326556 (печень 3), PRJNA279244 (печень 4), PRJNA296537 (мышца), PRJNA303096 (кожа)); б – активность генов в ходе раннего развития горбыля (PRJNA357970); в – активность генов в процессе регенерации кожи горбыля (PRJNA303096).

Рис. 2.
Дифференциальная экспрессия генов после стрессовой индукции. а – активность генов в селезенке, надпочечнике, сердце и жабрах горбыля после 30-минутной гипоксии при комнатной температуре (PRJNA574876, PRJNA576086); б – активность генов в мозге горбыля после 30-минутной гипоксии при комнатной температуре (PRJNA246784); в – активность генов в печени горбыля (печень 1) после гипоксии (время воздействия не указано) (PRJNA563184); г – активность генов в печени горбыля (печень 2) после теплового и холодового стресса, а также 21-дневного голодания (PRJNA280841); д – активность генов в мышцах горбыля после 21-дневного голодания (PRJNA296537).
Транскрипционная активность генов actb, hprt1 и 18S-rRNA
Для оценки качества транскриптомов были выбраны гены actb, hprt1 и 18S-rRNA. Ген actb кодирует бета-актин (компонент цитоскелета). Актины участвуют в подвижности, структуре и целостности клеток. Ген hprt1 кодирует фермент гипоксантин-гуанинфосфорибозилтрансферазу (фермент пуринового обмена эукариот). Ген 18S-rRNA кодирует 18S рибосомную РНК, которая является частью эукариотической малой субъединицы рибосомы (40S) и, таким образом, одним из основных компонентов всех эукариотических клеток. Данные гены облигатно экспрессируются практически во всех тканях и поэтому используются в качестве маркеров экспрессии [16, 17].
Количественный анализ транскрипционной активности показал, что уровень экспрессии маркерных генов 18S-rRNA и actb во всех органах высокий, вне зависимости от условий и процессов, тогда как ген hprt1 в большинстве органов и в течение раннего эмбриогенеза экспрессируется на среднем уровне или несколько ниже среднего (рис. 1, 2). В печени уровень экспрессии заметно выше, чем в других исследованных органах (рис. 1,а). Наблюдается неоднородность активности в печени после гипоксии (повышение уровня экспрессии через 6 и 48 ч) (рис. 2,в). Есть заметное повышение активности в мышцах после голодания (рис. 2,д). В общем можно заключить, что все транскриптомы пригодны для анализа дифференциальной экспрессии, а некоторые флуктуации в активности hprt1 возможно связаны с тканеспецифичностью.
Транскрипционная активность генов ферментов малат-аспартатного челнока mdh1, mdh2, aat1 и aat2
Гены mdh1 и mdh2 кодируют фермент МДГ, который катализирует НАД/НАДН-зависимое обратимое окисление малата до оксалоацетата во многих метаболических путях, включая цикл лимонной кислоты. В эукариотических клетках существуют два основных изофермента: один находится в митохондриальном матриксе (ген mdh2), а другой – в цитоплазме (ген mdh1). Ген mdh1 кодирует цитозольный изофермент, который играет ключевую роль в малат-аспартатном челноке и позволяет малату проходить через митохондриальную мембрану и превращаться в оксалоацетат для дальнейших клеточных процессов. Белок, кодируемый геном mdh2, локализован в митохондриях, участвует в цикле лимонной кислоты и также может играть ключевую роль в малат-аспартатном челноке [12, 18].
Другие два ключевых гена малат-аспартатного челнока aat1 и aat2 кодируют аспартатаминотрансферазу (ААТ), которая катализирует взаимное превращение аспартата и α-кетоглутарата в оксалоацетат и глутамат. Этот фермент имеет решающее значение как для деградации аминокислот, так и для биосинтеза. Известны два изофермента: цитозольный (ген aat1) и митохондриальный (ген aat2) [19]. Кроме того, известно, что ААТ вместо аспартата в качестве альтернативного субстрата может эффективно использовать цистеин, обратимо превращая его в сульфопируват [11].
Активность генов mdh1 и mdh2 во всех образцах находится на среднем уровне или выше среднего (рис. 1, 2). В сердце зафиксирован наивысший уровень активности обоих генов (рис. 1,а). В жабрах, коже, мозге, сердце, селезенке и надпочечниках гены экспрессируются синхронно (рис. 1,а). Однако в печени и мышцах наблюдается асимметричная активность: в печени выше уровень экспрессии mdh1 (цитозольный изофермент), а в мышцах – mdh2 (митохондриальный изофермент) (рис. 1,а). В раннем развитии выявлено значительное повышение уровня экспрессии mdh2 на стадии гаструлы, тогда как повышение активности mdh1 на этой стадии менее интенсивное (рис. 1,б). Слабое повышение уровня активности обоих генов зафиксировано в печени после теплового стресса и голодания (рис. 2,г). Заметное повышение уровня экспрессии гена цитозольной малатдегидрогеназы отмечено в печени через 6 и 48 ч после гипоксии (рис. 2,в). В результате голодания снизился уровень активности mdh1 в мышцах (рис. 2,д).
В экспрессии генов aat1 и aat2 наблюдаются значительные отличия. Ген aat1 в большинстве органов и в течение раннего эмбриогенеза экспрессируется на низком или очень низком уровне (рис. 1, 2). В одном из образцов печени (4) уровень экспрессии находится на среднем уровне (рис. 1,а). Некоторая неоднородность (с тенденцией к повышению уровня экспрессии) наблюдается в печени спустя 6 и 24 ч после гипоксии с последующим возвращением к исходному уровню (рис. 2,в). Кроме того, в мозге выявлено снижение активности через 3 ч после гипоксии и последующее возвращение к исходному уровню (рис. 2,б). Ген aat2 демонстрирует высокий уровень транскрипционной активности в печени, сердце и мышцах, тогда как в остальных органах экспрессия на среднем уровне (рис. 1,а). В одном из образцов печени (4) активность aat2 не выявлена (рис. 1,а). Не было отмечено какой-либо динамики в экспрессии гена в ходе раннего развития и в процессе регенерации (рис. 1,б, в). После воздействия гипоксии отмечено снижение уровня экспрессии aat2 в надпочечниках, селезенке и жабрах по прошествии 48 ч. В сердце изменений отмечено не было. В мозге транскрипционная активность снизилась через 3 ч после гипоксии и затем вновь восстановилась (рис. 2,б). В печени выявлены пиковые повышения уровня экспрессии после гипоксии относительно контроля, в точках 6 и 48 ч (рис. 2,в). Отмечено некоторое снижение уровня активности aat2 в мышцах после голодания (рис. 2,д). Однако зафиксировано повышение уровня активности после голодания в печени (рис. 2,г).
Транскрипционная активность генов лактатдегидрогеназы и гидроксиглутаратдегидрогеназы
Гены ldha, ldhb и ldhc кодируют различные субъединицы ЛДГ. Этот фермент катализирует превращение лактата в пируват на последней стадии анаэробного гликолиза [20].
Ген l2hgdh кодирует L-2-гидроксиглутаратдегидрогеназу (ГГДГ), FAD-зависимый фермент, который окисляет L-2-гидроксиглутарат до α-кетоглутарата в различных тканях. L-2-гидроксиглутарат образуется из α-кетоглутарата в результате неспецифического действия МДГ и соответственно ГГДГ превращает бесполезный продукт обратно в ключевой метаболит цикла Кребса [21].
Активность генов, кодирующих субъединицы A, B и C фермента ЛДГ (ldha, ldhb и ldhc соответственно), имела различия как в зависимости от органов, так и от условий. Высокий уровень экспрессии ldha отмечен в мышцах. В надпочечниках, мозге, коже, жабрах выявлена средняя активность гена ldha, тогда как в селезенке и сердце ниже среднего (рис. 1,а). ldhb экспрессируется на высоком уровне в сердце, тогда как в надпочечниках, мозге, коже, жабрах, селезенке, печени и мышцах выявлена средняя активность гена. Активность гена субъединицы C заметно отличается. Средний уровень экспрессии ldhc зафиксирован в мозге, тогда как в мышцах и сердце ген экспрессируется на уровне ниже среднего, а в остальных органах активность очень низкая или отсутствует (рис. 1,а). Среди разных образцов печени наблюдается неоднородность уровня экспрессии как ldha, так и ldhb. В ходе раннего развития активность генов ЛДГ также имеет различия (рис. 1,б). Есть неоднородность в активности ldha в ходе раннего развития, однако явной закономерности не установлено. При этом экспрессия была на среднем уровне. Активность ldhb на стадии одной клетки заметно выше, чем на всех последующих исследованных стадиях. У гена ldhc отмечено повышение уровня экспрессии на стадии гаструлы. Изучение активности ldha, ldhb и ldhc после индукции регенеративных процессов в коже не выявило какой-либо существенной динамики (рис. 1,в).
При исследовании гипоксии выявлено повышение уровня транскрипционной активности ldha в сердце, надпочечниках, селезенке и жабрах (рис. 2,а). При этом в селезенке происходит возврат к исходному уровню уже к 24 ч, тогда как в сердце, надпочечниках и жабрах снижение более плавное. В мозге наблюдается точечное повышение экспрессии ldha через 1 ч после воздействия (рис. 2,б). Явного изменения уровня транскрипционной активности гена субъединицы B после гипоксии отмечено не было во всех органах (рис. 2,а, б). Ответ активности ldhc на гипоксию зафиксирован только в надпочечниках (увеличение уровня активности через 48 ч) и в жабрах (снижение через 48 ч). Активность генов ldha, ldhb и ldhc в печени после гипоксии имела неоднозначный волнообразный характер (рис. 2,в). Кроме того, в печени установлено повышение уровня экспрессии ldha в результате холодового и теплового стресса (рис. 2,г). Воздействие голода вызвало некоторое повышение активности ldhb. Влияние голода, а также теплового и холодового стресса на активность в печени гена ldhc не выявлено. Однако голодание вызвало снижение уровня экспрессии всех трех генов ЛДГ в мышце (рис. 3,д).
В надпочечниках, мозге, коже, жабрах, селезенке, сердце и мышцах выявлена средняя активность гена l2hgdh, тогда как в печени уровень экспрессии выше среднего (рис. 1,а). В ходе эмбриогенеза замечено некоторое возрастание транскрипционной активности (рис. 1,б), также выявлены повышение уровня экспрессии через 30 мин после индукции регенеративных процессов в коже и последующий возврат к контрольным значениям через 2 ч (рис. 1,в). Изучение влияния гипоксии не выявило очевидных изменений уровня активности l2hgdh ни в одном из исследуемых органов, за исключением печени (рис. 2,а, в). В печени наблюдается точечное повышение активности через 6 и 48 ч после воздействия. Кроме того, в печени выявлено снижение уровня экспрессии l2hgdh при тепловом стрессе (рис. 2,г).
ОБСУЖДЕНИЕ
При сопоставлении результатов количественной оценки транскрипционной активности мы выявили коэкспрессию гена AqE с mdh2 (повышение уровня в ходе раннего развития), с генами aat1 и aat2 (снижение активности в мозге через 3 ч после гипоксии и снижение активности в мышце в результате голодания). Дифференциальная экспрессия отмечена в печени, где в результате голодания уровень активности AqE снизился, тогда как уровень aat2 и mdh2 вырос.
Вызывают недоверие результаты анализа экспрессии в печени после воздействия гипоксии. Создается впечатление, что образцы были перепутаны, вследствие чего возник представленный на рис. 2,в мозаичный профиль экспрессии практически всех генов. Если бы такое явление было выявлено у одного гена, то его можно было бы отнести к особенностям транскрипционной активности, но в данном случае возникает подозрение на некорректность представленных образцов.
Поскольку белок СЛДГ, кодируемый геном сomC архей, помимо сульфолактата может использовать в качестве субстрата малат и α-кетоглутарат, есть гипотеза, что продукт гена AqE может быть включен в малат-аспартатный челнок [10]. Малат-аспартатный челнок, в котором ключевыми соединениями являются малат и α-кетоглутарат, принято считать наиболее эффективным процессом, позволяющим водным организмам выживать в условиях гипоксии (аноксии) [1].
МДГ катализирует обратимое окисление малата до оксалацетата, последней стадии цикла трикарбоновых кислот [22], а также участвует в глюконеогенезе и липогенезе и участвует в аэробном гликолизе в малат-аспартатном челноке [23]. Ключевым компонентом цикла трикарбоновых кислот является митохондриальная МДГ [24]. Другой компонент малат-аспартатного челнока это ААТ – фермент, переносящий аминогруппы, который используется для оценки стрессовой реакции, вызванной изменением температуры, низким содержанием кислорода, pH, аммиаком или тяжелыми металлами [25]. Более того, ААТ связывает метаболизм углеводов с метаболизмом аминокислот. У рыб аминокислоты представляют собой один из основных субстратов для производства энергии, который они получают либо с пищей, либо в результате распада тканевых белков [26]. Белки также могут стать источником энергии в стрессовых условиях, предоставляя аминокислоты, которые могут служить глюконеогенетическими или кетогенными предшественниками. Трансаминирование или дезаминирование аминокислот облегчает глюконеогенный путь. Производство энергии из промежуточных продуктов трансаминирования и дезаминирования происходит либо через цикл Кребса, либо через окисление [27].
Таким образом, если продукт гена AqE участвует в малат-аспартатном челноке, как альтернатива МДГ, то его экспрессия должна быть согласована с экспрессией генов других компонентов системы. В настоящем исследовании мы наблюдаем сопряженное изменение активности генов лишь в нескольких случаях. Так, например, выявлено синхронное повышение уровня активности генов AqE и mdh2 в ходе раннего развития, отмечено снижение активности AqE, aat1 и aat2 в мозге через 3 ч после гипоксии и в мышце в результате голодания. Однако отмечено разнонаправленное изменение экспрессии в печени, где в результате голодания уровень активности AqE снизился, тогда как уровень aat2 и mdh2 вырос. Следовательно, участие в малат-аспартатном челноке вызывает сомнения.
Малат-аспартатный челнок считается основным путем окисления NADH в тканях млекопитающих, таких как печень и сердце [12]. Высокая транскрипционная активность aat2 в печени и сердце согласуется с этим фактом. Однако установленная нами тканеспецифичность экспрессии гена AqE также ставит под сомнение участие этого фермента в малат-аспартатном челноке. Уровень активности AqE высок в печени, жабрах и коже, тогда как в других тканях он низкий. Жабры и кожа рыб участвуют в дыхании. Однако помимо этого кожа и жабры обладают выделительной функцией, кроме того, постоянно соприкасаются с внешней средой и имеют системы защиты от внешних химических воздействий. Также и у печени одной из важных функций является детоксикация организма [28, 29]. Поэтому вполне вероятно, что функция белка, кодируемого AqE, связана с выведением продуктов метаболизма. И если фермент рыб, подобно СЛДГ архей, преобразует сульфопируват в сульфолактат, а у эукариотических организмов нет известных метаболических процессов использования сульфолактата [6], то, возможно, он выводится из организма как конечный продукт.
Работа проведена в рамках Государственного задания ФИЦ ИнБЮМ “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом”, номер гос. регистрации 121041400077-1 и при финансовой поддержке РФФИ и города Севастополя в рамках научного проекта № 20-44-920006.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Hochachka P.W., Somero G.N. Biochemical adaptation: mechanisms and process of physiological evolution // N.Y.: Oxford Univesity Press, 2002.
Madern D. Molecular evolution within the L-malate and L-lactate dehydrogenase super-family // J. Mol. Evol. 2002. V. 54. № 6. P. 825–840.https://doi.org/10.1007/s00239-001-0088-812029364
Honka E., Fabry S., Niermann T. et al. Properties and primary structure of the L-malate dehydrogenase from the extremely thermophilic archaebacterium Methanothermus fervidus // Eur. J. Biochem. 1990. V. 188. № 3. P. 623-632. https://doi.org/10.1111/j.1432-1033.1990.tb15443.x2110059
Jendrossek D., Kratzin H.D., Steinbüchel A. The Alcaligenes eutrophus ldh structural gene encodes a novel type of lactate dehydrogenase // FEMS Microbiol. Lett. 1993. V. 112. № 2. P. 229–235.https://doi.org/10.1111/j.1574-6968.1993.tb06453.x8405966
Muramatsu H., Mihara H., Goto M. et al. A new family of NAD(P)H-dependent oxidoreductases distinct from conventional Rossmann-fold proteins // J. Biosci. Bioeng. 2005. V. 99. № 6. P. 541–547. https://doi.org/10.1263/jbb.99.54116233829
Irimia A., Madern D., Zaccaï G., Vellieux F.M. Methanoarchaeal sulfolactate dehydrogenase: prototype of a new family of NADH-dependent enzymes // EMBO J. 2004. V. 23. № 6. P. 1234–1244. https://doi.org/10.1038/sj.emboj.7600147
Denger K., Cook A.M. Racemase activity effected by two dehydrogenases in sulfolactate degradation by Chromohalobacter salexigens: purification of (S)-sulfolactate dehydrogenase // Microbiology (Reading). 2010. V. 156. № 3. P. 967–974. https://doi.org/10.1099/mic.0.034736-0
Zhang Y., Schofield L.R., Sang C. et al. Expression, purification, and characterization of (R)-sulfolactate dehydrogenase (ComC) from the rumen methanogen Methanobrevibacter millerae SM9 // Archaea. 2017. 5793620. https://doi.org/10.1155/2017/5793620
Puzakova L.V., Puzakov M.V., Soldatov A.A. Gene encoding a novel enzyme of LDH2/MDH2 family is lost in plant and animal genomes during transition to land // J. Mol. Evol. 2019. V. 87. № 1. P. 52–59.https://doi.org/10.1007/s00239-018-9884-2
Puzakova L.V., Puzakov M.V., Gostyukhina O.L. Newly discovered AqE gene is highly conserved in non-tetrapod vertebrates // J. Mol. Evol. 2021. V. 89. № 4–5. P. 214–224. https://doi.org/10.1007/s00239-021-09997-x
Weinstein C.L., Griffith O.W. Cysteinesulfonate and beta-sulfopyruvate metabolism. Partitioning between decarboxylation, transamination, and reduction pathways // J. Biol. Chem. 1988. V. 263. № 8. P. 3735–3743.
Borst P. The malate-aspartate shuttle (Borst cycle): How it started and developed into a major metabolic pathway // IUBMB Life. 2020. V. 72. № 11. P. 2241–2259.https://doi.org/10.1002/iub.2367
Wu C., Zhang D., Kan M. et al. The draft genome of the large yellow croaker reveals well-developed innate immunity // Nat. Communications. 2014. V. 5. P. 5227. https://doi.org/10.1038/ncomms6227
Bray N.L., Pimentel H., Melsted P., Pachter L. Near-optimal probabilistic RNA-seq quantification // Nat. Biotechnol. 2016. V. 34. № 5. P. 525–527.https://doi.org/10.1038/nbt.3519
Pimentel H., Bray N.L., Puente S. et al. Differential analysis of RNA-seq incorporating quantification uncertainty // Nat. Methods. 2017. V. 14. № 7. P. 687–690.https://doi.org/10.1038/nmeth.4324
Kessler Y., Helfer-Hungerbuehler A.K., Cattori V. et al. Quantitative TaqMan real-time PCR assays for gene expression normalisation in feline tissues // BMC Mol. Biol. 2009. V. 10. Р. 106. https://doi.org/10.1186/1471-2199-10-106
Leal M.F., Astur D.C., Debieux P. et al. Identification of suitable reference genes for investigating gene expression in anterior cruciate ligament injury by using reverse transcription-quantitative PCR // PLoS One. 2015. V. 10. № 7. Р. e0133323.https://doi.org/10.1371/journal.pone.0133323
Minárik P., Tomásková N., Kollárová M., Antalík M. Malate dehydrogenases–structure and function // Gen. Physiol. Biophys. 2002. V. 21. № 3. P. 257–265.
Otto-Ślusarczyk D., Graboń W., Mielczarek-Puta M. Aminotransferaza asparaginianowa–kluczowy enzym w metabolizmie ogólnoustrojowym człowieka [Aspartate aminotransferase–key enzyme in the human systemic metabolism] // Postepy Hig. Med. Dosw. (Online). 2016. V. 70. P. 219–230.https://doi.org/10.5604/17322693.1197373
Laganá G., Barreca D., Calderaro A., Bellocco E. Lactate dehydrogenase inhibition: biochemical relevance and therapeutical potential // Curr. Med. Chem. 2019. V. 26. № 18. P. 3242–3252.https://doi.org/10.2174/0929867324666170209103444
Steenweg M.E., Jakobs C., Errami A. et al. An overview of L-2-hydroxyglutarate dehydrogenase gene (L2HGDH) variants: a genotype-phenotype study // Hum. Mutat. 2010. V. 31. № 4. P. 380–390. https://doi.org/10.1002/humu.21197
Musrati R.A., Kollárová M., Mernik N., Mikulásová D. Malate dehydrogenase: distribution, function and properties // Gen. Physiol. Biophys. 1998. V. 17. № 3. P. 193–210.
Mitrakou A. Kidney: Its impact on glucose homeostasis and hormonal regulation // Diabetes Res. Clin. Pract. 2011. V. 93. Suppl. 1. P. S66–S72. https://doi.org/10.1016/S0168-8227(11)70016-X
Walsh K., Koshland D.E., Jr. Determination of flux through the branch point of two metabolic cycles. The tricarboxylic acid cycle and the glyoxylate shunt // J. Biol. Chem. 1984. V. 259. № 15. P. 9646–9654.
Pan Y., Chen H., Siu F., Kilberg M.S. Amino acid deprivation and endoplasmic reticulum stress induce expression of multiple activating transcription factor-3 mRNA species that, when overexpressed in HepG2 cells, modulate transcription by the human asparagine synthetase promoter // J. Biol. Chem. 2003. V. 278. № 40. P. 38402–38412.https://doi.org/10.1074/jbc.M304574200
Bever K., Chenoweth M., Dunn A. Amino acid gluconeogenesis and glucose turnover in kelp bass (Paralabrax sp.) // Am. J. Physiol. 1981. V. 240. № 3. P. 246–252. https://doi.org/10.1152/ajpregu.1981.240.3.R246
Kumar V., Sahu N.P., Pal A.K. Modulation of key enzymes of glycolysis, gluconeogenesis, amino acid catabolism, and TCA cycle of the tropical freshwater fish Labeo rohita fed gelatinized and non-gelatinized starch diet // Fish Physiol. Biochem. 2010. V. 36. № 3. P. 491–499. https://doi.org/10.1007/s10695-009-9319-5
Арцимович Н.Г., Настоящая Н.Н., Казанский Д.Б., Ломакин М.С. Печень как орган иммунобиологической системы гомеостаза // Успехи соврем. биологии. 1992. Т. 112. Вып. 1. С. 116–124.
Земков Г.В., Журавлева Г.Ф. Кинетика патологических изменений при кумулятивном токсикозе в организме как критерий сопротивляемости популяции рыб // Успехи соврем. естествознания. 2004. № 1. С. 41–47.
Дополнительные материалы отсутствуют.


