Генетика, 2022, T. 58, № 5, стр. 550-561
Функциональная значимость модуля токсин–антитоксин Mycolicibacterium smegmatis в устойчивости к антибиотикам и воздействию окислительного стресса
Н. И. Акимова 1, *, О. Б. Беккер 1, **, В. Н. Даниленко 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: akimovanata@mail.ru
** E-mail: obbekker@mail.ru
Поступила в редакцию 29.11.2021
После доработки 20.12.2021
Принята к публикации 28.12.2021
- EDN: NFCNIZ
- DOI: 10.31857/S0016675822050022
Аннотация
Системы токсин–антитоксин широко распространены у бактерий, включая такие патогены как Mycobacterium tuberculosis. Возможные функции систем токсин–антитоксин у разных групп бактерий могут быть различными и активно обсуждаются и уточняются в последние годы. Предметом настоящего исследования является изучение функции генов модуля токсин–антитоксин vapBC2 M. smegmatis. Были получены и исследованы мутанты M. smegmatis с делецией модуля vapBC2 и штамм с дополнительной копией гена токсина. Было показано, что экспрессия дополнительной копии гена токсина приводила к замедлению скорости роста, но не ингибировала его полностью. Эти данные могут указывать на слабую РНКазную активность токсина. Обнаружено, что введение дополнительной копии гена токсина приводит к повышению чувствительности M. smegmatis к воздействию окислительного стресса. Инактивация модуля vapBC2 приводила к увеличению чувствительности к канамицину. Введение дополнительной копии гена токсина с использованием интегративного вектора pKW08-MCS-Int приводило к повышению чувствительности к канамицину, тетрациклину и эритромицину. Определение точного механизма участия модуля vapBC2 в природной лекарственной устойчивости/чувствительности является предметом наших дальнейших исследований.
Системы токсин–антитоксин (ТА) представляют собой оперон, состоящий, как правило, из двух генов, один из которых кодирует токсин, а другой – его антагонист, антитоксин [1, 2]. Токсин характеризуется высокой стабильностью, в отличие от антитоксина, который лабилен и быстро разрушается при стрессовых воздействиях [3].
Системы токсин–антитоксин обнаружены в геномах большинства видов бактерий и архей [4, 5]. В зависимости от механизма взаимодействия токсина и антитоксина системы токсин–антитоксин делятся на восемь типов [6, 7]. Наиболее распространенными и хорошо изученными являются системы токсин–антитоксин II типа, у которых взаимодействующие токсин и антитоксин – белки [5]. Системы токсин–антитоксин играют важную роль в регуляции роста и деления бактериальных клеток [4, 8]. В нормальных условиях роста антитоксин подавляет активность токсина путем формирования с ним комплекса [9]. При стрессовых воздействиях активируются клеточные протеазы, которые расщепляют белок антитоксина, что приводит к высвобождению и последующей активации токсина [10]. Активный токсин способен воздействовать на различные клеточные процессы, среди которых – репликация, транскрипция, трансляция, синтез клеточной стенки [3] и деление клетки [2].
Активация систем ТА при воздействии стрессовых факторов среды может привести к переходу бактерий из активной фазы роста в дормантное (покоящееся) состояние, для которого характерно выраженное замедление метаболических процессов, а также практически полное прекращение клеточных делений [11–13]. В таком состоянии бактериальные клетки становятся невосприимчивыми (толерантными) к действию большинства известных антимикробных агентов [14]. Это является причиной возникновения персистирующих форм патогенных бактерий, которые при прекращении стрессовых воздействий способны вернуться в метаболически активное состояние, что приведет к реактивации заболевания [15]. Однако чрезмерная активация систем токсин–антитоксин может привести к накоплению высоких концентраций токсина и, как следствие, к гибели бактериальной клетки [7]. В связи с этим системы токсин–антитоксин рассматриваются в качестве одной из наиболее перспективных биомишеней [16]. Системы токсин–антитоксин участвуют в формировании природной лекарственной устойчивости [10]. Кроме того, системы ТА участвуют в формировании приобретенной лекарственной устойчивости у патогенных бактерий [2]. Также системы токсин–антитоксин могут быть ассоциированы с шаперонами. Существуют трехкомпонентные системы токсин–антитоксин, содержащие шаперон, который связывается с антитоксином и защищает его от деградации в условиях стресса [17]. В некоторых системах токсин–антитоксин с шапероном взаимодействует токсин [18].
В геномах различных видов бактерий и архей содержится разное число генов, кодирующих системы токсин–антитоксин [2]. Наибольшее число модулей зафиксировано в геноме M. tuberculosis – 88 [19]. У M. smegmatis – модельного объекта для изучения молекулярной генетики возбудителя туберкулеза M. tuberculosis – обнаружено пять пар систем токсин–антитоксин II типа. Одна из них – Msmeg_6760-6762 (VapBC2) была впервые описана в 2016 г. Bajaj et al. [20]. Исследователями были проведены биоинформатический и рентгеноструктурный анализы белка токсина (Msmeg_6760, или VapC2) [20]. Система токсин–антитоксин VapBC2 является вторым представителем семейства VapBC у M. smegmatis с биоинформатически предсказанной функцией и составленной методом рентгеноструктурного анализа 3D-модели белка токсина. Интересен тот факт, что помимо свойственного системам VapBC PIN-домена и РНКазной активности VapC2, предположительно, может регулировать активность шаперонного белка DnaK [16]. DnaK – один из главных шаперонных белков микобактерий [21]. Кроме того, было обнаружено, что белки VapC2 и VapB2 M. smegmatis являются структурными гомологами белков M. tuberculosis – Rv2035 и Rv2034 соответственно. Показано, что гомолог антитоксина – Rv2034 активирует экспрессию оперона dosR, который индуцирует переход бактерии в состояние покоя (ключевой регулятор адаптации M. tuberculosis к гипоксии при нахождении бактерий внутри макрофагов). Поэтому наиболее высокие уровни экспрессии оперона Rv2034–Rv2035 отмечаются у антибиотико-резистентных персистирующих бактерий M. tuberculosis [22]. В связи с вышеперечисленными особенностями данная система токсин–антитоксин M. smegmatis представляет особый интерес для изучения и понимания возможных механизмов, лежащих в основе формирования лекарственной устойчивости и толерантности. В настоящей статье обсуждается предполагаемая роль системы токсин–антитоксин VapBC2 M. smegmatis как компонента системы природной лекарственной устойчивости, а также роль модуля vapBC2 в ответе на окислительный стресс.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы бактерий и условия инкубации
Клетки E. coli DH5α [23] выращивали в жидкой среде Лурия Бертани (LB) при 37°С с перемешиванием (200 rpm) и на агаризованной среде LB (Amresco). Твердая среда содержала 2% агара. Клетки M. smegmatis штамм mc2155 [24] выращивали в жидкой среде Middlebrook 7H9 (Himedia) с добавлением OADC (олеиновая кислота, альбумин, декстроза, каталаза), 0.05% Tween 80, 0.4% глицерина в жидкой среде Lemco-Tween. Состав среды Lemco-Tween (на 1 л): 5 г пептона (Oxoid), 5 г LabLemco (Oxoid), 5 г NaCl, 0.05% Tween 80. Для проведения окислительного стресса в среду добавляли перекись водорода (H2O2) до достижения конечной концентрации 0.5 мM. Трансформантов M. smegmatis выращивали при T 37°С. Селективные среды содержали канамицин (50 мкг/мл для E. coli, 20 мкг/мл для M. smegmatis), гигромицин (200 мкг/мл для E. coli, 50 мкг/мл для M. smegmatis), X-gal (50 мкг/мл для E. coli и M. smegmatis), 10%-ный раствор сахарозы.
Получение мутанта M. smegmatis, несущего делецию модуля vapBC2
Для получения конструкции с модулем vapBC2 и фланкирующим его участком длиной около 1000 пн, геномная ДНК M. smegmatis mc2155 была амплифицирована по праймерам MSMEG_6760-62 nF и MSMEG_6760-62 del R (левое плечо) и по праймерам MSMEG_6760-62 del F и MSMEG_6760-62 nR (правое плечо). Праймеры MSMEG_6760-62 del F и MSMEG_6760-62 del R содержат участки, перекрывающиеся друг с другом, длиной 18 пн (см. табл. 1).
Таблица 1.
Олигонуклеотиды, использованные в работе
| Праймеры | Название | 5'–3'-последовательность |
|---|---|---|
| Использованные для клонирования | MSMEG_6760 F | TTT TGA TAT CAT GCC CGT GAC CGA TGT GA |
| MSMEG_6760 R | TTT TAA GCT TTC GAT GAT TAC ACC GCG GAC | |
| Использованные для мутагенеза | MSMEG_6760-62 nF | TTT TAA GCT TTG CCC CCG GGA AAA TGG TGG |
| MSMEG_6760-62 nR | TTT TGG TAC CCT GGG CCG TGC AAG GAC ACT | |
| MSMEG_6760-62 del F | CGA CAT CAT GAG AAG TAC GCC GGC TAC | |
| MSMEG_6760-62 del R | GTA CTT CTC ATG ATG TCG CGC CTC GTG | |
| Использованные для ПЦР в режиме реального времени | polA-F | GGT CTG GTT GAA CGT CGT GTG GAT G |
| polA-R | GCT GGA GAT GCC GAA GAC CAA GAA G | |
| MSMEG_6760-6762 F | GTG ACC GTG ATC GAC GAG GA | |
| MSMEG_6760-6762 R | CAG CTC GAT GAT TAC ACC GC | |
| MSMEG_6762 F | TTT TGA TAT CGT ACG TTG TGT GGG TGA CCG | |
| MSMEG_6762 R | TTT TAA GCT TTT CAC ATC GGT CAC GGG CAT | |
| MSMEG_6760 F | TTT TGA TAT CAT GCC CGT GAC CGA TGT GA |
Полученные фрагменты (левое и правое плечи) использовали во втором этапе амплификации с праймерами MSMEG_6760-62 nF и MSMEG_6760-62 nR для получения ПЦР-продукта, содержащего фланкирующие участки и модуль vapBC2, в котором 60% генов делетированы. Столь протяженная делеция приводит к тому, что неизменным остается лишь небольшой участок с N-конца антитоксина (24 аминокислоты), в состав которого не входят функционально значимые домены. Кроме того, делеция приводит к сдвигу рамки считывания, в результате которого образуется стоп-кодон, что приводит к преждевременной терминации синтеза белка, синтезируемого по остатку нуклеотидной последовательности гена токсина и к полной замене аминокислот (рис. 1).
Рис. 1.
Нуклеотидная и аминокислотная последовательности модуля vapBC2 M. smegmatis до (а) и после (б) внесения делеции. На рис. а цветом выделен делетированный участок, на рис. б цветом выделены аминокислоты, которые сохранились после делеции; аминокислоты, не выделенные цветом, изменились из-за сдвига рамки считывания в результате делеции.

Значительную часть составляют несинонимичные замены. Все вышеизложенное приводит к тому, что происходит потеря функциональной активности модуля даже без его полной делеции. Далее была проведена очистка полученного ПЦР-продукта методом вырезания из геля с использованием набора для выделения ДНК из агарозного геля (Евроген). Далее было осуществлено клонирование полученной конструкции в плазмиду p2NIL по сайтам рестрикции KpnI и HindIII (Fast digest, Thermo Scientific, США). Для наработки полученной конструкции осуществляли трансформацию компетентных клеток E. coli (как уже было описано ранее) с последующим выделением конструкции. Оценка наличия целевой вставки нужной длины проводилась методом ПЦР-скрининга колоний. Далее осуществлялось выделение целевой конструкции с помощью набора для выделения плазмидной ДНК (Евроген). После этого обрабатывали рестриктазой PacI (Thermo Scientific) полученную конструкцию и плазмиду pGOAL19. Данный этап необходим для вырезания из pGOAL19 дополнительного селективного маркера: кассеты устойчивости к гигромицину длиной 2500 пн. Далее с помощью Т4-ДНК-лигазы (Thermo Scientific) осуществлялось лигирование маркерной кассеты, состоящей из гена устойчивости к гигромицину (hygR), гена чувствительности к сахарозе (sacB), гена (lacZ) для сине-белой селекции на среде с X-gal, с плазмидой p2NIL, содержащей модуль ТА, несущий делецию. Для наработки полученной конструкции трансформировали компетентные клетки E. coli с последующим выделением плазмидной ДНК. Для получения делеционных мутантов осуществляли трансформацию компетентных клеток M. smegmatis mc2155 конструкцией с модулем vapBC2, несущим делецию. Перед трансформацией конструкцию подвергали УФ-облучению с длиной волны 250 нм в течение 45 с. Данный этап был необходим для получения одноцепочечных разрывов в молекуле ДНК и активации первого акта рекомбинации. Дальнейший отбор трансформантов M. smegmatis, несущих делецию, осуществлялся по методике [25].
Клонирование гена токсина vapC2
Ген токсина M. smegmatis vapC2 был амплифицирован с геномной ДНК M. smegmatis mc2155 по праймерам, подобранным с помощью primer BLAST (см. табл. 1). Оптимальная температура отжига праймеров была подобрана с помощью градиентной ПЦР на приборе Bio-Rad T100 (США). Для амплификации использовали набор Tersus Plus PCR kit (Евроген). Амплифицированный фрагмент был клонирован в челночный интегративный вектор pKW08-MCS-Int [26, 27] по сайтам рестрикции EcoRV и HindIII (Fast digest, Thermo Scientific). Векторная плазмида pKW08-MCS-Int является модификацией pKW08-Lx, в которую добавлен полилинкер (множественный сайт клонирования). Для лигирования использовали Т4-ДНК-лигазу (Thermo Scientific). Полученными конструкциями трансформировали компетентные клетки E. coli по стандартной методике [28]. Данный этап необходим для наработки необходимой конструкции, так как плазмида pKW08-MCS-Int малокопийна. Из клеток E. coli конструкции со вставкой гена vapC2 выделяли с помощью набора для выделения плазмидной ДНК (Евроген). Полученные конструкции были трансформированы в компетентные клетки M. smegmatis mc2155 методом электропорации по методике [25].
Проведение транскрипционного анализа модуля vapBC2 M. smegmatis
После инкубации клетки M. smegmatis осаждали центрифугированием (10 мин, 4000*g, 4°C), добавляли Trizol (Invitrogen) и выделяли РНК по методике [25]. Для удаления контаминирующей геномной ДНК использовали ДНКазу I (TURBO DNA-free™ Kit, Ambion) согласно рекомендациям производителя. Реакцию обратной транскрипции проводили на приборе Thermal Cycler T 100 (Bio-Rad) с использованием набора iScript Select cDNA Synthesis kit, следуя рекомендациям фирмы-производителя. Реакцию амплификации в режиме реального времени осуществляли на приборе Bio-Rad CFX96, применяя набор iTaq Universal SYBR Green Supermix (Bio-Rad) согласно рекомендациям производителя. Была использована следующая программа амплификации: 95°C – 30 с, далее 40 циклов 95°C – 10 с, 65.2°C – 30 с, затем – градиент температур плавления 65–95°C – 5 с. Праймеры для амплификации в режиме реального времени представлены в табл. 1. В качестве референсного гена для нормализации уровня экспрессии использовали ген polA (кодирует ДНК-полимеразу I типа). Все эксперименты проводили в трех независимых повторах. Вычисление относительного нормализованного уровня экспрессии модуля vapBC2 осуществляли по методу ∆∆Cq [29].
Анализ скорости роста M. smegmatis в жидкой среде
Для оценки скорости роста все штаммы M. smegmatis инкубировали в среде Lemco-Tween до OD600 = 1.5–1.8, после чего культуры разбавляли свежей средой Lemco-Tween до OD600 ~ 0.05 и инкубировали при 37°С и 250 rpm. В среду добавляли гигромицин (селективный маркер, 50 мкг/мл) и тетрациклин (индуктор транскрипции, 20 нг/мл). Каждые 3 ч осуществляли измерение оптической плотности. Общее время инкубации составляло 60 ч.
Определение минимальной ингибирующей концентрации антибиотиков (МИК)
Оценку величины МИК осуществляли в жидкой среде с использованием 96-луночных планшетов с низкоадгезивным покрытием. Были использованы антибиотики класса аминогликозидов (канамицин), макролидов (эритромицин) и тетрациклинов (тетрациклин). Инкубацию осуществляли до проявления видимого роста культуры. Анализ роста штаммов осуществляли после 24, 48 и 72 ч инкубации. В качестве МИК рассматривалась наименьшая концентрация антибиотика, при которой отсутствовал видимый рост культуры.
Статистическая обработка данных
Статистическую обработку данных проводили с использованием метода ANOVA (дисперсионный анализ). Показаны статистически значимые отличия штаммов с делецией модуля vapBC2 и с дополнительной копией гена vapC2 от штамма дикого типа.
Постановка окислительного стресса
Клетки M. smegmatis выращивали в жидкой среде Lemco-Tween-80 до OD600 ~ 1.0, после чего культуру разбавляли в 100 раз свежей средой Lemco-Tween-80 и инкубировали до OD600 ~ 0.3. К штаммам M. smegmatis добавляли гигромицин (50 мкг/мл) и тетрациклин (20 нг/мл). Затем к культуре клеток M. smegmatis добавляли перекись водорода до достижения конечной концентрации 0.5 мM. В качестве контроля использовали культуру, в которую не добавляли перекись водорода. В работе не были использованы более высокие концентрации перекиси водорода в связи с выраженным бактерицидным эффектом, который наблюдался даже при кратковременной инкубации при добавлении высоких концентраций перекиси водорода. Далее осуществляли инкубацию 37°С и 250 rpm в течение двух часов. Более длительная инкубация не является целесообразной, так как происходит разрушение перекиси водорода. После 15 мин, 1 и 2 ч инкубации осуществляли измерение оптической плотности и отбор проб для приготовления разведений и последующего засева на агаризованную среду M290 для подсчета числа колониеобразующих единиц (КОЕ).
РЕЗУЛЬТАТЫ
Получение мутантных штаммов M. smegmatis
С помощью двустадийного ПЦР-мутагенеза была получена делеция модуля vapBC2. Далее было проведено получение делеционных мутантов M. smegmatis по методике Parish, Brown (2009) [25].
Для получения штамма с дополнительной копией гена токсина ген vapC2 был клонирован в челночный интегративный вектор pKW08-MCS-Int. Таким образом, в исследовании использовали штамм с дополнительной копией гена токсина (2*vapC2), штамм дикого типа с пустой векторной плазмидой (mc2155) и штамм с делецией модуля vapBC2, несущий пустую плазмиду pKW08-MCS-Int (∆vapBC2). Штаммы с пустыми плазмидами использовали для более точного сопоставления результатов.
Анализ транскрипционной активности генов модуля vapBC2 в полученных штаммах M. smegmatis методом ПЦР в реальном времени
Для того чтобы проверить наличие делеции модуля vapBC2 в штамме ∆vapBC2 M. smegmatis и экспрессии дополнительной копии гена токсина в штамме 2*vapC2 M. smegmatis, методом ПЦР в реальном времени была проанализирована транскрипционная активность генов антитоксина (vapB2), токсина (vapC2) и целого модуля vapBC2. РНК была выделена из штамма дикого типа и штаммов ∆vapBC2 и 2*vapC2 на поздней логарифмической стадии роста. Праймеры, использованные для транскрипционного анализа, представлены в табл. 1. Анализ транскрипционной активности генов модуля показал двукратное повышение уровня транскрипции гена vapC2 в штамме 2*vapC2 (рис. 2).
Рис. 2.
Экспрессия генов модуля vapBC2 в штаммах M. smegmatis. Экспрессия нормализована относительно гена polA. На диаграммах представлен относительный уровень экспрессии: а – по праймерам к модулю vapBC2, б – по праймерам к гену антитоксина vapB2, в – по праймерам к гену токсина vapC2. Предел погрешности – стандартное отклонение. * – результаты, статистически достоверно отличающиеся от показателей штамма дикого типа, согласно статистическому критерию ANOVA. Под диаграммами представлены схемы, иллюстрирующие сайты посадки праймеров.

Кроме того, было показано отсутствие экспрессии гена токсина в делеционном штамме M. smegmatis. Уровни экспрессии гена антитоксина примерно одинаковы в штамме дикого типа и в штамме с дополнительной копией гена токсина. При этом ген антитоксина, так же, как и ген токсина, не экспрессируется в делеционном штамме M. smegmatis.
Таким образом, было показано, что дополнительная копия гена токсина экспрессируется в штамме 2*vapC2, однако его экспрессия не влияет на транскрипционную активность гена антитоксина.
Анализ скорости роста штаммов M. smegmatis
Штаммы M. smegmatis с делецией модуля vapBC2, с дополнительной копией гена токсина vapC2 и штамм M. smegmatis дикого типа инкубировали в течение 2.5 сут до достижения поздней стационарной стадии роста. Каждые 3 ч осуществляли измерение оптической плотности (OD600). По результатам измерений была построена кривая роста. В качестве контроля использовали штамм дикого типа. Анализ кривых роста показал, что делеция модуля vapBC2 приводила к замедлению роста клеток M. smegmatis на поздней логарифмической стадии роста (рис. 3). Статистическая значимость полученных различий была проверена с помощью критерия ANOVA.
Рис. 3.
Кривая роста культуры M. smegmatis штамма дикого типа mc2155, делеционного мутанта ∆vapBC2 и штамма с дополнительной копией гена vapC2 M. smegmatis. Предел погрешности – стандартное отклонение. * – статистически достоверные отличия от показателей штамма дикого типа, согласно критерию ANOVA.

Замедление скорости роста делеционного мутанта в отсутствие стрессовых воздействий в совокупности с наличием экспрессии модуля vapBC2 на поздней логарифмической стадии роста может указывать на возможное участие данной системы ТА в переходе клеток M. smegmatis в стационарную фазу роста. Вставка дополнительной копии гена приводила к замедлению роста, начиная с ранней логарифмической стадии роста до ранней стационарной фазы роста (рис. 3).
Оценка минимальных ингибирующих концентраций антибиотиков (МИК)
Для определения МИК были использованы следующие антибиотики: эритромицин (макролиды), канамицин (аминогликозиды) и тетрациклин (тетрациклины). Как было указано выше, оценка МИК осуществлялась для трех штаммов M. smegmatis: mc2155, 2*vapC2 и ∆vapBC2. Штамм дикого типа (mc2155) использовали в качестве контроля для остальных штаммов. Для определения динамики изменения МИК в процессе инкубации измерение МИК осуществлялось несколько раз: после 24, 48 и 72 ч инкубации (табл. 2).
Таблица 2.
Минимальные ингибирующие концентрации антибиотиков (мкг/мл) для штаммов M. smegmatis после 24, 48 и 72 ч инкубации
| Штамм | После 24 ч | После 48 ч | После 72 ч | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Ery | Km | Tet | Ery | Km | Tet | Ery | Km | Tet | |
| ∆vapBC2 | 17.3 ± 4.6 | 0.07 ± 0.03 | 0.12 ± 0.03 | 34.7 ± 4.6 | 0.12 ± 0.03* | 0.13 ± 0.03 | 34.7 ± 4.6 | 0.13 ± 0.06 | 0.13 ± 0.03 |
| mc2155 | 16 ± 4 | 0.12 ± 0.02 | 0.13 ± 0.06 | 28 ± 6.9 | 0.18 ± 0.2 | 0.13 ± 0.03 | 32 ± 0.001 | 0.2 ± 0.001 | 0.15 ± 0.05 |
| 2*vapC2 | 7.33 ± 1.15* | 0.03 ± 0.01* | 0.04 ± 0.01 | 10 ± 2* | 0.05 ± 0.006* | 0.05 ± 0.001* | 12.7 ± 3.05* | 0.05 ± 0.006* | 0.08 ± 0.03 |
Анализ полученных данных показал, что делеция модуля vapBC2 приводила к снижению МИК канамицина в 1.5 раза, но не влияла на МИК тетрациклина и эритромицина. Экспрессия дополнительной копии гена vapC2 приводила к 2–4 кратному снижению МИК эритромицина, канамицина и тетрациклина на протяжении 72 ч инкубации с антибиотиками (табл. 2).
Анализ влияния модуля vapBC2 на устойчивость к окислительному стрессу
Измерение оптической плотности культуры M. smegmatis после 15 мин, 1 и 2 ч инкубации в присутствии 0.5 мM перекиси водорода показало отсутствие различий между штаммами с делецией и вставкой дополнительной копии гена токсина относительно контроля на протяжении всего периода инкубации (рис. 4).
Рис. 4.
Динамика изменения оптической плотности штаммов M. smegmatis в среде без перекиси водорода (а), в присутствии 0.5 мM перекиси водорода (б). Предел погрешности – стандартное отклонение.

Кроме того, отсутствует выраженное снижение оптической плотности культуры на протяжении всего периода инкубации. Таким образом, ни делеция vapBC2, ни экспрессия дополнительной копии гена vapC2 не влияют на скорость роста культуры M. smegmatis в присутствии 0.5 мM H2O2.
Анализ выживаемости штаммов M. smegmatis в условиях воздействия различных концентраций перекиси водорода показал снижение выживаемости у всех исследуемых штаммов при воздействии окислительного стресса (рис. 5).
Рис. 5.
Число колониеобразующих единиц M. smegmatis при инкубации в среде без перекиси водорода и в присутствии 0.5 мM перекиси водорода в различные периоды инкубации: в начальный момент времени (а), после 15-минутной инкубации (б), после 1 ч инкубации (в), после 2 ч инкубации (г). Предел погрешности – стандартное отклонение. * – статистически достоверные отличия от показателей штамма дикого типа, согласно критерию ANOVA.
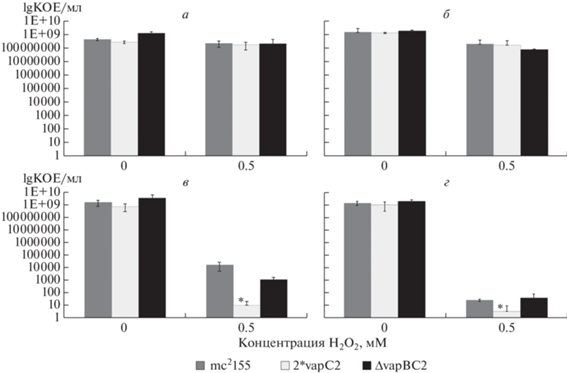
Показано, что вставка дополнительной копии гена токсина приводит к повышению чувствительности клеток M. smegmatis к воздействию окислительного стресса.
ОБСУЖДЕНИЕ
Одной из хорошо известных функций систем токсин–антитоксин II типа является участие в формировании лекарственной устойчивости. Для исследований в настоящей работе использовали M. smegmatis – достаточно популярную суррогатную модель [30] для изучения отдельных проблем молекулярной генетики возбудителя туберкулеза M. tuberculosis. M. smegmatis содержит только пять модулей токсин–антитоксин, один из которых (vapBC2) является объектом настоящих исследований. Его гомолог Rv2034-2035 в геноме M. tuberculosis играет важную роль в персистенции и устойчивости к антибиотикам.
В данной работе введение дополнительной копии гена токсина приводило лишь к замедлению роста при благоприятных условиях, но не к его полному ингибированию. Это может указывать на слабую РНКазную активность токсина, которая была предсказана in silico в более ранних работах [20].
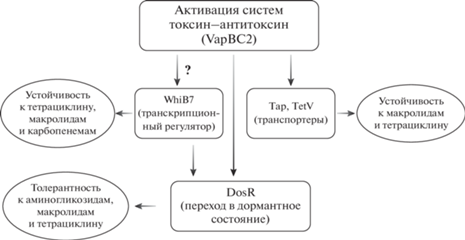
Результаты, полученные на штаммах M. smegmatis с делецией vapBC2 и с экспрессией дополнительной копии гена vapC2, позволяют предположить об участии модуля vapBC2 в формировании природной лекарственной устойчивости (чувствительности) M. smegmatis. Введение дополнительной копии гена токсина приводило к изменению устойчивости к эритромицину, канамицину и тетрациклину. Схема, описывающая предполагаемые механизмы участия модуля vapBC2 в формировании природной лекарственной устойчивости, представлена на рис. 6.
Природная лекарственная устойчивость обеспечивается за счет сложной сети взаимодействий между белками. Эта сеть включает в себя эффекторные белки, регуляторные белки и индукторы [31]. Одним из важнейших транскрипционных регуляторов является WhiB7. Он активируется в ответ на стрессовые воздействия различной природы и участвует в регуляции экспрессии различных генов, в числе которых erm, eis, tap и оперон dosR [32]. Оперон dosR играет важную роль в регуляции перехода клеток в дормантное состояние. В геноме M. smegmatis обнаружено 25 гомологов оперона dosR [33]. Существуют различные пути активации этого оперона. В частности, предполагается, что одним из таких активаторов может служить антитоксин VapB2 (у M. smegmatis) или его гомолог Rv2035 у M. tuberculosis. Учитывая это, на наш взгляд, наиболее вероятным механизмом влияния vapBC2 является его взаимодействие с системой dosR.
На основании анализа доменной структуры белка VapC2 можно предположить наличие взаимодействий между белками VapC2 и DnaK. DnaK является главным шаперонным белком микобактерий, обеспечивающим фолдинг белков в условиях стресса, включая воздействие антибиотиков.
Штамм M. smegmatis с дополнительной копией гена токсина становится более чувствительным к трем классам антибиотиков: аминогликозиды (канамицин), тетрациклины (тетрациклин) и макролиды (эритромицин). Такой широкий спектр изменения чувствительности указывает на то, что VapC2, вероятно, взаимодействует с системами транспорта антибиотиков. Наиболее распространенным способом защиты у патогенных микроорганизмов от проникающих внутрь клетки антибиотиков является их обратный транспорт, осуществляемый клеточными транспортерами [31]. В физиологическом отношении функцией этих белков является транспорт нутриентов, метаболитов, токсинов или сигнальных молекул [34]. У микобактерий описано по меньшей мере 18 транспортеров. Все они обеспечивают фоновый уровень устойчивости к антибиотикам [35]. Устойчивость к тетрациклину у M. smegmatis обеспечивается за счет белка TetV (рис. 6), который осуществляет транспорт тетрациклина из бактериальной клетки. Еще одним транспортером, обеспечивающим устойчивость к тетрациклину и аминогликозидам, является белок Tap [35].
Другая немаловажная функция систем токсин–антитоксин II типа – участие в формировании устойчивости бактериальной клетки на стрессовые воздействия, в частности на оксидативный стресс, вызываемый перекисью водорода [36]. Перекись водорода H2O2 является одним из важных агентов процессов в бактериальной клетке, приводящих к повреждению липидных, белковых, мембранных компонентов и ее ДНК и РНК и в конечном счете к ее гибели [36]. В клетке существует целый набор генов и их продуктов, обеспечивающих ее антиоксидантный потенциал [37, 38].
Показано, что введение дополнительной копии гена токсина приводит к повышению чувствительности к воздействию 0.5 мM перекиси водорода после 1 ч инкубации.
Сопоставление кривых, описывающих динамику изменения оптической плотности и выживаемости штаммов M. smegmatis в условиях воздействия окислительного стресса, позволяет сделать вывод о том, что при воздействии перекиси водорода происходит не лизис клеток, а активация системы токсин–антитоксин и накопление токсина, что приводит к переходу клеток в дормантное состояние. Выход из дормантного состояния осуществляется лишь в небольшом количестве покоящихся клеток. Поэтому клетки после воздействия перекиси водорода образуют мало колоний на твердой среде.
Для более точного определения механизмов участия модуля в формировании природной лекарственной устойчивости в дальнейших исследованиях будет проведен анализ транскриптома M. smegmatis. Также в дальнейшей работе предполагается изучение механизмов активации шаперонного белка DnaK.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-34-90124 от 20.08.2020.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Le Roux M., Culviner P., Liu Y. Stress induces the transcription of toxin–antitoxin systems, but does not activate toxin// Mol. Cell. 2020. V. 79. № 2. P. 1–35. https://doi.org/10.1016/j.molcel.2020.05.028
Sala A., Bordes P., Genevaux P. Multiple toxin–antitoxin systems in Mycobacterium tuberculosis // Toxins. 2014. V. 6. № 3. P. 1002–1020. https://doi.org/10.3390/toxins6031002
Chandra B., Ramisetty M. Regulation of type II toxin–antitoxin systems: the translation-responsive model // Front. Microbiol. 2020. V. 11. № 895. P. 1–6. https://doi.org/10.3389/fmicb.2020.00895
Fernandes-Garcia L., Blasco L., Lopez M. et al. Toxin–antitoxin systems in clinical pathogens // Toxins. 2016. V. 8. № 227. P. 1–23. https://doi.org/10.3390/toxins8070227
Peltier J., Hamiot A., Garneau J.R. et al. Type I toxin–antitoxin systems contribute to the maintenance of mobile genetic elements in Clostridioides difficile // Commun. Biol. 2020. V. 3. № 718. P. 1–13. https://doi.org/10.1038/s42003-020-01448-5
Wang X., Yao J., Sun Y.C. Type VII toxin/antitoxin classification system for antitoxins that enzymatically neutralize toxins // Trends Microbiol. 2021. V. 29. № 5. P. 388–393. https://doi.org/10.1016/j.tim.2020.12.001
Choi J.C., Kim W., Suk S. et al. The small RNA, SdsR, acts as a novel type of toxin in Escherichia coli // RNA Biol. 2018. V. 15. № 10. P. 1319–1335. https://doi.org/10.1080/15476286.2018.1532252
Mikheecheva N.E., Zaychikova M.V., Melerzanov A.V., Danilenko V.N. A nonsynonymous SNP catalog of Mycobacterium tuberculosis virulence genes and its use for detecting new potentially virulent sublineages // Genome Biol. Evol. 2017. V. 9. № 4. P. 887–899. https://doi.org/10.1093/gbe/evx053
Rownicki M., Lasek R., Trylska J., Bartosik D. Targeting type II toxin–antitoxin systems as antibacterial strategies // Toxins. 2020. V. 12. № 568. P. 1–16. https://doi.org/10.3390/toxins12090568
Chan W.T., Balsa D., Espinosa M. One cannot rule them all: are bacterial toxins–antitoxins druggable? // FEMS Microbiol. Rev. 2015. V. 39. P. 522–540. https://doi.org/10.1093/femsre/fuv002
Gupta A., Venkataraman B., Vasudevan M., Bankar K.G. Co-expression network analysis of toxin–antitoxin loci in Mycobacterium tuberculosis reveals key modulators of cellular stress // Sci. Rep. 2017. V. 7. № 5868. P. 1–14. https://doi.org/10.1038/s41598-017-06003-7
Song S., Wood T.K. A primary physiological role of toxin/antitoxin systems is phage inhibition // Front. Microbiol. 2020. V. 11. № 1895. P. 1–7. https://doi.org/10.3389/fmicb.2020.01895
Прозоров А.А., Федорова И.А., Беккер О.Б., Даниленко В.Н. Факторы вирулентности Mycobacterium tuberculosis: генетический контроль, новые концепции // Генетика. 2014. Т. 50. № 8. С. 885–909.
Fraikin N., Goormaghtigh F., Van Melderen L. Type II toxin–antitoxin systems: evolution and revolutions // J. Bacteriol. 2020. V. 202. № 7. P. 1–14. https://doi.org/10.1128/JB.00763-19
Wood T.K. Combatting bacterial persister cells // Biotechnol. Bioeng. 2016. V. 113. № 3. P. 476–483. https://doi.org/10.1002/bit.25721
Jurenas D., Van Melderen L. The variety in the common theme of translation inhibition by type II toxin–antitoxin systems // Front. Genet. 2020. V. 11. № 262. P. 1–19. https://doi.org/10.3389/fgene.2020.00262
Bordes P., Sala A.J., Ayala S. Chaperone addiction of toxin–antitoxin systems // Nat. Commun. 2016. V. 7. № 13339. P. 1–12. https://doi.org/10.1038/ncomms13339
Rosendahl S., Ainelo A., Horak R. The disordered C‑terminus of the chaperone DnaK increases the competitive fitness of Pseudomonas putida and facilitates the toxicity of GraT // Microorganisms. 2021. V. 9. № 375. P. 1–17. https://doi.org/10.3390/microorganisms9020375
Yu X., Gao X., Zhu K. et al. Characterization of a toxin-antitoxin system in Mycobacterium tuberculosis suggests neutralization by phosphorylation as the antitoxicity mechanism // Commun. Biol. 2020. V. 3. № 216. P. 1–15. https://doi.org/10.1038/s42003-020-0941-1
Bajaj R.A., Arbing M.A., Shin A. et al. Crystal structure of the toxin Msmeg_6760, the structural homolog of Mycobacterium tuberculosis Rv2035, a novel type II toxin involved in the hypoxic response // Acta Crystallogr. F. Struct. Biol. Commun. 2016. V. 72. P. 863–869. https://doi.org/10.1107/S2053230X16017957
Fay A., Glickman M.S. An essential nonredundant role for Mycobacterial DnaK in native protein folding // PLoS Genet. 2014. V. 10. № 7. P. 1–17.https://doi.org/10.1371/journal.pgen.1004516
Keren I., Minami S., Rubin E., Lewis K. Characterization and transcriptome analysis of Mycobacterium tuberculosis persisters // mBio. 2011. V. 2. № 3. P. 1–10. https://doi.org/10.1128/mBio.00100-11
Inoue H., Nojima H., Okayama H. High efficiency transformation of Escherichia coli with plasmids // Gene. 1990. V. 96. № 1. P. 23–28. https://doi.org/10.1016/0378-1119(90)90336-p
Snapper S.B., Melton R.E., Mustafa S. et al. Isolation and characterization of efficient plasmid transformation mutants of Mycobacterium smegmatis // Mol. Microbiol. 1990. V. 4. № 11. P. 1911–1919. https://doi.org/10.1111/j.1365-2958.1990.tb02040.x
Parish T., Brown A.C. Mycobacteria Protocols. Methods in Molecular Biology. Second ed. N.Y.: Humana Press, 2009. 456 p.
Williams K.J., Joyce G., Robertson B.D. Improved mycobacterial tetracycline inducible vectors // Plasmid. 2010. V. 64. № 2. P. 69–73. https://doi.org/10.1016/j.plasmid.2010.04.003
Lewis J.A., Hatfull G.F. Control of directionality in L5 integrase-mediated site-specific recombination // J. Mol. Biol. 2003. V. 326. № 3. P. 805–821. https://doi.org/10.1016/s0022-2836(02)01475-4
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1659 p.
Haimes J., Kelley M. Demonstration of a ΔΔCq Calculation Method to Compute Relative Gene Expression from qPCR Data. Lafayette: A Horizon Discovery Group Comp., 2018. 4 p.
Sundarsingh J.A., Ranjitha J., Rajan A., Shankar V. Features of the biochemistry of Mycobacterium smegmatis, as a possible model for Mycobacterium tuberculosis // J. Infect. Public Health. 2020. V. 13. № 9. P. 1255–1264. https://doi.org/10.1016/j.jiph.2020.06.023
Шур К.В., Маслов Д.А., Михеечева Н.Е. и др. WhiB7 и Tар – модуляторы природной лекарственной устойчивости микобактерий к β-лактамным антибиотикам, макролидам и фторхинолонам // Генетика. 2017. Т. 53. № 9. С. 1061–1070.
Maarsingh J.D., Yang S., Park J.G., Haydel S.E. Comparative transcriptomics reveals PrrAB mediated control of metabolic, respiration, energy-generating, and dormancy pathways in Mycobacterium smegmatis // BMC Genomics. 2019. V. 20. № 942. P. 1–16. https://doi.org/10.1186/s12864-019-6105-3
Nguen L. Antibiotic resistance mechanisms in M. tuberculosis: an update // Arch. Toxicol. 2016. V. 90. № 7. P. 1585–1604. https://doi.org/10.1007/s00204-016-1727-6
Ebbensgaard A.E., Olesen A.L., Moller J.F. The role of efflux pups in the transition from low-level to clinical antibiotic resistance // Antibiotics. 2020. V. 9. № 12. P. 1–7. https://doi.org/10.3390/antibiotics9120855
Viveiros M., Martins M., Rodriges L. Inhibitors of mycobacterial efflux pumps as potential boosters for anti-tubercular drugs // Expert Rev. Anti Infect. Ther. 2012. V. 10. № 9. P. 983–998. https://doi.org/10.1586/eri.12.89
Marsova M., Abilev S., Poluektova E. et al. A bioluminescent test system reveals valuable antioxidant properties of lactobacillus strains from human microbiota // World J. Microbiol. Biotechnol. 2018. V. 34. № 27. P. 1–9. https://doi.org/10.1007/s11274-018-2410-2
Culotta V.C., Daly M.J. Manganese complexes: Diverse metabolic routes to oxidative stress resistance in prokaryotes and yeast // Antioxid. Redox Signal. 2013. V. 19. № 9. P. 933–944. https://doi.org/10.1089/ars.2012.5093
Imlay J.A. Cellular defenses against superoxide and hydrogen peroxide // Annu. Rev. Biochem. 2008. V. 77. P. 755–776. https://doi.org/10.1146/annurev.biochem.77.061606.161055
Дополнительные материалы отсутствуют.