Генетика, 2022, T. 58, № 6, стр. 642-660
Фитопатогены и молекулярная мимикрия
И. Е. Додуева 1, *, М. А. Лебедева 1, Л. А. Лутова 1
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: Wildtype@yandex.ru
Поступила в редакцию 29.11.2021
После доработки 30.11.2021
Принята к публикации 12.01.2022
- EDN: TWWPCA
- DOI: 10.31857/S0016675822060030
Аннотация
Коэволюция растений и их патогенов является примером “гонки вооружений” между факторами вирулентности патогенов и иммунной системой растения-хозяина. При этом патогены используют разнообразные стратегии, в том числе – основанные на молекулярной мимикрии. В геномах фитопатогенных организмов разных групп идентифицированы гены, продукты которых сходны с определенными группами белков растений – ферментами дестабилизации клеточных стенок, предшественниками пептидных фитогормонов и т.д. В частности, способность продуцировать эффекторы, которые используются для изменения роста растения-хозяина и подавления его защитных реакций, получила широкое распространение среди фитопатогенов из разных царств живого мира – бактерий, грибов и животных (а именно нематод). В настоящем обзоре мы рассмотрим основные примеры молекулярной мимикрии, обнаруженные в патогенах растений.
Молекулярная мимикрия – стратегия выживания паразитов, при которой молекулярная структура белков паразитов воспроизводит структуру определенных белков хозяина. В случае животных речь идет, как правило, о мимикрии патогенами иммунорегуляторных белков хозяина; кроме того, поверхностные антигенные детерминанты паразита могут совпадать с антигенами хозяина. Сходство аминокислотных последовательностей и/или конформации между белками хозяина и патогена (так называемая перекрестная реактивность) вызывает аутоиммунный ответ. За последние годы было показано, что такая молекулярная мимикрия является одним из основных механизмов развития аутоиммунных заболеваний. Например, вирус Эпштейна–Барра (EBV) считается основным инфекционным агентом, связанным с рассеянным склерозом – аутоиммунным заболеванием у людей, которое приводит к прогрессирующему разрушению миелиновых оболочек аксонов. Наличие структурной гомологии между основным белком миелина и определенными пептидами EBV приводит к перекрестным реактивным аутоиммунным ответам, что способствует развитию заболевания [1].
Вместе с тем молекулярная мимикрия также широко распространена среди патогенов высших растений. Наземные растения живут в постоянном взаимодействии с другими организмами, преимущественно с микроорганизмами, с разнообразными жизненными стратегиями (от симбиоза до некротрофного патогенеза), при этом между растением-хозяином и взаимодействующими с ним организмами происходит постоянный обмен сигналами [2]. Известно, что некоторые группы фитопатогенных бактерий, грибов, нематод продуцируют и секретируют в ткани растения-хозяина белки, имитирующие белки растений с разными функциями, например ферменты-дестабилизаторы клеточной стенки [3], предшественники пептидных фитогормонов разных групп [4] и т.д. Более того, молекулярная мимикрия в случае фитопатогенов не ограничивается только белками: в частности, целый ряд взаимодействующих с растениями организмов (как “вредных”, так и “полезных”) может продуцировать фитогормоны и другие регуляторы роста растений небелковой природы [5–8].
По-видимому, способность к молекулярной мимикрии возникала независимо у разных групп взаимодействующих с растениями организмов, причем для ряда примеров можно с высокой вероятностью предположить ее возникновение за счет конвергентной эволюции патогена и хозяина или же за счет горизонтального переноса генов (ГПГ) [9, 10]. Так, обширный филогенетический анализ показал, что не менее 3.5% генов фитопаразитических нематод, в особенности – гены, связанные с регуляцией паразитизма, имеют неживотное происхождение и могли быть приобретены путем ГПГ от бактерий или грибов [10–12].
Некоторые варианты молекулярной мимикрии распространены очень широко: к примеру, способность к биосинтезу индолил-3-уксусной кислоты (ИУК) и цитокининов (ЦК) очень широко распространена у разных групп прокариот и эукариот и используется многими из них для взаимодействия с растениями [5, 6, 13]. С другой стороны, у некоторых фитопатогенов имеются свои уникальные варианты молекулярной мимикрии: например, наличие хоризматмутаз и ферментов гидролиза клеточной стенки среди нематод характерно только для видов, паразитирующих на растениях [9, 14].
Зачастую один и тот же фитопатоген использует для колонизации организма хозяина сразу несколько стратегий молекулярной мимикрии: к примеру, те же фитопаразитические нематоды могут продуцировать ЦК [15], эффекторы, взаимодействующие с белками полярного транспорта ИУК [16] и ответа на ИУК [17], ферменты-модификаторы клеточной стенки [3] и, наконец, пептидные фитогормоны трех разных семейств [18]. В табл. 1 представлены примеры молекулярной мимикрии, характерные для разных групп организмов, взаимодействующих с растениями.
Таблица 1.
Примеры молекулярной мимикрии у фитопатогенов
| Группа фитопатогенов | Вид | Эффекторы | Функции | Ссылка |
|---|---|---|---|---|
| Нематоды | Все виды | Цитокинины | Деление клеток растения, подавление иммунитета | [15] |
| Heterodera schachtii | Белок 19C07 | Усиление импорта ИУК при связывании с белком LAX3, усиление роста клеток растения | [16] | |
| Heterodera schachtii | Белок 10А07 | Снятие репрессии ответа на ИУК при связывании с белком IAA16, усиление роста клеток растения | [17] | |
| Все виды | Ферменты хоризматмутазы | Снижение уровня биосинтеза салициловой кислоты, облегчение заражения растения | [39–42] | |
| Все виды | Целлюлазы, ксиланазы, пектатлиазы, полигалактуроназы, экспансин-подобные белки | Дестабилизация клеточной стенки растения | [3] | |
| Heterodera schachtii | Белок HgCBP | Активация пектинметилэстеразы, дестабилизация клеточной стенки растения | [58] | |
| Heterodera spp. Globodеra spp. |
Пептиды CLE | Деление клеток растения | [69, 72] | |
| Meloidogyne spp. | Пептиды CLE | Деление клеток растения | [82] | |
| Rotylenchulus spp. | Пептиды CLE | Деление клеток растения | [68] | |
| Meloidogyne spp. | Пептиды CEP | Подавление деления клеток растения | [20] | |
| Rotylenchulus spp. | Пептиды CEP | Подавление деления клеток растения | [71] | |
| Meloidogyne spp. | Пептиды IDA | Дестабилизация клеточной стенки растения | [81] | |
| Грибы | Все виды | Цитокинины | Деление клеток растения, подавление иммунитета | [6] |
| Все виды | ИУК | Деление клеток растения, подавление иммунитета | [5] | |
| Ustilago maydis | Фермент хоризматмутаза | Снижение уровня биосинтеза салициловой кислоты, облегчение заражения растения | [44] | |
| Phytophthora soja, Verticillium dahlia |
Ферменты изохоризматазы | Снижение уровня биосинтеза салициловой кислоты, облегчение заражения растения | [48] | |
| Fusarium graminearum | Целлюлазы, экспансин-подобные белки | Дестабилизация клеточной стенки растения | [54] | |
| Fusarium oxysporum | RALF | Замедление роста растения, снижение устойчивости к грибу | [91, 93] | |
| Tilletia spp., 19 видов Ascomycota | PSK | Неизвестны | [63] | |
| Melampsora larici-populina, Colletotrichu mfructicola | IDA | Неизвестны | [63] | |
| Бактерии | Все виды | Цитокинины | Деление клеток растения, подавление иммунитета | [6, 13] |
| Все виды | ИУК | Деление клеток растения, подавление иммунитета | [5] | |
| Pseudomonas syringae | Белок AvrRpt2 | Снятие репрессии ответа на ИУК путем стимуляции протеасомной деградации белков AUX/IAA | [36] | |
| Pseudomonas syringae | Коронатин (аналог жасмонатов) | Усиление ответа на жасмоновую кислоту и снижение ответа на салициловую кислоту | [8] | |
| Pseudomonas syringae | Белок HopZ1a | Усиление ответа на жасмоновую кислоту через ацетилирования репрессоров ответа JAZ | [7] | |
| Xanthomonas oryzae pv. oryzae, Xanthomonas arboricola pv. juglandis | Фермент хоризматмутаза | Снижение уровня биосинтеза салициловой кислоты, подавление гиперинфицирования растения | [45, 46] | |
| Все виды | Целлюлазы, ксиланазы, пектатлиазы, полигалактуроназы, экспансин-подобные белки | Дестабилизация клеточной стенки растения | [52] | |
| Xanthomonas oryzae pv. oryzae | Пептид RaxX | Усиление роста растения, снижение устойчивости к бактерии | [86, 87] | |
| 9 видов Аctinobacteria | RALF | Неизвестны | [93] |
Различные стратегии молекулярной мимикрии помогают фитопатогенам и другим взаимодействующим с растениями организмам преодолеть защитную систему растения и/или модулировать его физиологию, способствуя более успешной колонизации растения-хозяина. В обзоре мы рассмотрим примеры молекулярной мимикрии у разных групп фитопатогенов, их роль во взаимодействии патогенов с растениями-хозяевами и возможное эволюционное происхождение.
ОСНОВНЫЕ СТРАТЕГИИ МОЛЕКУЛЯРНОЙ МИМИКРИИ У ФИТОПАТОГЕНОВ
В соответствии с тем, какие именно молекулы растения-хозяина воспроизводятся фитопатогеном, можно выделить несколько направлений молекулярной мимикрии, используемой фитопатогенами для колонизации растений. Ниже мы более подробно охарактеризуем основные из этих направлений.
Одними из наиболее известных фитопатогенных организмов, которые часто используют разные варианты молекулярной мимикрии для заражения растений, являются нематоды, паразитирующие на корнях растений. Поскольку их примеры молекулярной мимикрии наиболее разнообразны и хорошо изучены на сегодняшний день, в настоящем обзоре им будет уделено наибольшее внимание.
Среди фитопаразитических нематод есть экто- и эндопаразиты, которые могут быть мигрирующими или сидячими [14]. Типичная жизненная стратегия фитопаразитических нематод заключается в формировании так называемых сайтов кормления (feeding sites) – крупных клеток с высоким уровнем метаболизма, которые обеспечивают питание нематод. Две группы малоподвижных эндопаразитарных нематод, цистовые (cyst nematodes) – представители родов Globodera и Hetero-dera и галловые (root-knot nematodes) – виды рода Meloidogyne, вызывают неоплазию тканей корня хозяина – образование галлов за счет повышения скорости деления и быстрого расширения клеток. Давно известно, что этот эффект вызывается секретом пищеводных желез нематоды, который впрыскивается в ткани растения-хозяина через ее ротовой аппарат (стилет) [14, 19]. За этим событием следуют усиленная пролиферация и рост клеток, формирующих в дальнейшем сайт кормления нематоды. Цистовые и галловые нематоды используют разные стратегии для создания сайтов кормления: в случае цистовых происходит слияние сотен клеток в синцитий, в то время как галловые нематоды вызывают повторяющиеся циклы эндоредупликации и роста клеток в отсутствие цитокинеза, что приводит к образованию гигантских клеток. Формирование сайтов кормления синцитиального типа характерно также для группы почковидных нематод (виды рода Rotylenchulus) – эндопаразитов, не вызывающих образования галлов на корнях [14, 20].
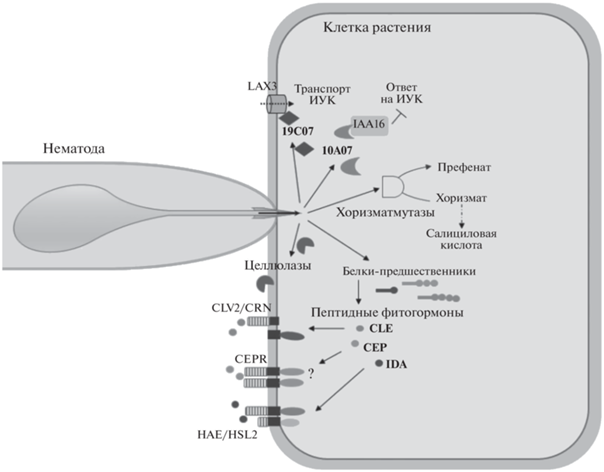
Формирование сайтов кормления цистовых, галловых и почковидных нематод сопровождается резким усилением экспрессии генов клеточного цикла [21]. По всей видимости, такое усиление деления клеток вызывается разнообразными эффекторами, содержащимися в секрете пищеводных желез фитопаразитических нематод: ЦК, пептидными фитогормонами, белками, влияющими на транспорт и сигналинг ИУК, ферментами, вызывающими перестройки клеточных стенок (рис. 1).
Рис. 1.
Примеры эффекторов паразитических нематод, имитирующих различные белки растения-хозяина. Белок 19С07 усиливает транспорт ИУК в клетку растения, взаимодействуя с транспортным белком LAX3; белок 10А07 связывается с репрессором транскрипции белком IAA16, активируя ответ на ИУК. Секретируемые хоризматмутазы стимулируют синтез префената из хоризмата, тем самым снижая уровень основного гормона системного иммунитета – салициловой кислоты. Секретируемые целлюлазы и другие ферменты дестабилизации клеточных стенок повышают лабильность клеточных стенок растения, облегчая продвижение нематоды в растении и способствуя растяжению. Предшественники пептидных фитогормонов CLE, CEP и IDA, секретируемые нематодой, претерпевают созревание за счет ферментов растения-хозяина и связываются с рецепторами соответствующих пептидных фитогормонов растения-хозяина, вызывая ростовые ответы.
Молекулярная мимикрия, направленная на изменение баланса “гормонов роста”
Стратегии колонизации растений патогенами часто направлены на изменение параметров их роста. Особенно ярко это проявляется у фитопатогенов, которые индуцируют новообразования (галлы и опухоли) у растения-хозяина для того, чтобы обеспечить себе источник пищи и среду обитания [22]. Одним из способов достижения этих целей является изменение баланса основных гормонов, регулирующих деление клеток и рост растения, – ИУК и ЦК в организме растения-хозяина. Помимо изменения роста тканей растений повышение уровня ИУК и ЦК может ослабить передачу сигнала салициловой кислоты – основного гормона системного иммунитета растений [23, 24].
В свою очередь, изменение баланса ИУК и ЦК в тканях растения-хозяина может быть достигнуто патогеном разными способами: за счет способности патогена синтезировать и секретировать эти фитогормоны, а также за счет его белков-эффекторов, которые могут изменять транспорт или передачу сигнала ИУК или ЦК.
Гены, кодирующие ферменты биосинтеза ИУК и ЦК, были задолго до их идентификации у растений идентифицированы у амебы Dictyostelium [25], а также в вирулентной плазмиде фитопатогенной бактерии Agrobacterium tumefaciens, которая способна переносить часть этой плазмиды в геном растения-хозяина, что приводит к увеличению содержания ИУК и ЦК в растительных тканях и индукции опухоли [26, 27].
В настоящее время считается, что ИУК и ЦК – эволюционно консервативные молекулы, впервые появившиеся у прокариот, в то время как эукариоты могли получить гены биосинтеза ИУК и ЦК как в процессе эволюции от своих прокариотных предков, так и путем ГПГ [28, 29]. Помимо регуляции роста растений эти ферменты могут использоваться у разных живых организмов и для других целей.
Так, самые распространенные из ферментов биосинтеза ЦК тРНК-изопентенилтрансферазы (tRNA-IPT), которые выявлены у бактерий, растений, грибов и животных, включая человека [30], важны для эффективности и точности трансляции белка рибосомой [31]. Другие ферменты этой группы, изопентенилтрансферазы (IPT), синтезирующие ЦК из свободных аденозинфосфатов, а также ферменты катаболизма ЦК цитокининоксидазы (СКХ), помимо растений и взаимодействующих с ними организмов, были идентифицированы у цианобактерий и других бактерий [32]. Это позволяет предположить, что гены метаболизма ЦК у растений были приобретены путем ГПГ через хлоропласты, которые имеют цианобактериальное происхождение [29].
Считается, что ИУК, продуцируемая бактериями и грибами, является вторичным метаболитом, возникающим в процессе метаболизма триптофана, а также используется в качестве сигнала для регуляции генов у некоторых бактерий [28]. Биоинформатические данные свидетельствуют о том, что некоторые ферменты биосинтеза ИУК могли независимо возникнуть у бактерий, водорослей, грибов и высших растений. Кроме того, филогенетический анализ семейств генов, кодирующих ферменты триптофанаминотрансферазы (ТАА) и флавинмонооксигеназы (YUC), задействованные в основном пути производства ИУК у растений, показал, что они могли быть приобретены предками наземных растений от бактерий путем ГПГ [33].
На сегодняшний день гены биосинтеза ИУК и/или ЦК обнаружены у множества видов бактерий и грибов, включая патогенные, симбиотические и свободноживущие виды, а также у нематод, паразитирующих на растениях [5, 6].
Для фитопатогенов разных групп была продемонстрирована важная роль генов биосинтеза ИУК и ЦК во взаимодействии с растением-хозяином. Так, у спорыньи ржи (Claviceps purpurea) в биосинтезе ЦК задействованы как ферменты tRNA-IPT, имеющиеся у всех групп живых организмов, так и уникальный для грибов гибридный фермент IPT-LOG, который катализирует обе последовательные реакции биосинтеза ЦК de novo [34]. Мутанты по любому из генов, кодирующих эти два фермента, способны к заражению ржи, но не образуют плодовых тел, тогда как штаммы с нокаутом обоих генов tRNA-IPT и IPT-LOG неспособны к заражению растений, вероятно, из-за неспособности ослабить иммунитет хозяина или обеспечить эффективное снабжение внедряющихся в растение гиф питательными веществами [34].
Помимо биосинтеза ИУК и ЦК некоторые фитопатогены способны также влиять на транспорт или передачу сигнала этих гормонов за счет определенных белков-эффекторов.
Примеры таких эффекторов изучены у паразитических нематод. Один из них, белок 19C07 свекловичной цистовой нематоды Heterodera schachtii, будучи впрыснут в ткани растения-хозяина через ротовой аппарат (стилет) нематоды в составе секрета ее пищеводных желез, может связываться на поверхности растительных клеток с белком LAX3, функцией которого является транспорт ИУК в клетку [16]. По всей видимости это обеспечивает приток ИУК в клетки, которые образуют так называемый сайт кормления нематоды, способствуя их разрастанию, делению и последующему слиянию в синцитий.
Другой эффектор H. schachtii, белок 10А07, в клетках арабидопсиса взаимодействует с регулятором ответа на ИУК – белком IAA16 [17]. Белок IAA16 относится к семейству белков AUX/IAA, которые являются репрессорами транскрипции ИУК-регулируемых генов, образуя гетеродимеры с ИУК-регулируемыми ТФ ARF [35], – таким образом, связывание 10A07 с IAA16 может привести к снятию репрессии ответа на ИУК. Действительно, растения, сверхэкспрессирующие ген 10A07, демонстрируют повышенную экспрессию ARF6-8 и ARF19 и более восприимчивы к H. schachtii, чем контрольные растения [17]. Более того, белок 10А07, как оказалось, использует растительную регуляторную систему для доставки в ядро: в цитоплазме клеток арабидопсиса он взаимодействует с протеинкиназой, получившей название IPK (interacting plant kinase), которая фосфорилирует 10А07 по консервативным остаткам серина, опосредуя его доставку в ядро. Гены IPK и IAA16 активно экспрессируются в синцитиях, индуцированных H. schachtii [17].
Способностью к взаимодействию с белками AUX/IAA обладают и некоторые бактериальные эффекторы. Например, эффектор AvrRpt2 биотрофной фитопатогенной бактерии Pseudomonas syringae позитивно регулирует передачу сигнала ИУК, стимулируя протеасомную деградацию AUX/IAA [36].
Молекулярная мимикрия, направленная на изменение баланса “гормонов иммунитета”
Салициловая кислота (СК) и жасмоновая кислота (ЖК) с ее производными (вместе называемые жасмонатами) считаются основными гормонами, регулирующими системный иммунитет растений. В регуляции защиты растений от патогенов СК и ЖК могут действовать в одном направлении или быть антагонистами; в целом считается, что СК играет центральную роль в защите от биотрофных патогенов, тогда как ЖК подавляет некротрофные микроорганизмы и предотвращает поедание растений насекомыми [37].
Известно, что некоторые фитопатогены могут снижать выработку СК в организме растения-хозяина, секретируя в качестве белков-эффекторов ферменты хоризматмутазы. Эти ферменты относятся к шикиматному пути, который является одним из древнейших эволюционно консервативных метаболических путей. Хоризматмутазы катализируют превращение хоризмата в префенат, предшественник синтеза тирозина и фенилаланина, и предотвращают образование изохоризмата – предшественника СК.
Первые из обнаруженных примеров секреции хоризматмутаз фитопатогенами были выявлены у паразитических цистовых и галловых нематод [38]. В дальнейшем оказалось, что гены, кодирующие хоризматмутазы, имеются у большого количества видов фитопаразитических нематод, как способных, так и неспособных к индукции галлов на корнях [39–42]. В то же время гены хоризматмутаз отсутствуют у свободноживущей нематоды Caenorhabditis elegans и нематод, паразитирующих на животных, что свидетельствует об их важной роли именно для фитопаразитов [43]. Во многих случаях было получено подтверждение важной роли хоризматмутаз в способности нематод к заражению растений. Так, у галловой нематоды Meloidogyne incognita была подробно изучена роль одного из трех ее генов хоризматмутаз, MiCM3, во взаимодействии с растениями Nicotiana benthamiana. Конститутивная экспрессия MiCM3 у растений подавляла рост корней и повышала восприимчивость к инфекции M. incognita. Кроме того, экспрессия MiCM3 вызвала у растений снижение уровней СК и мРНК гена, кодирующего защитный белок PR1. С помощью конфокальной микроскопии было показано, что белок MiCM3 локализуется в цитоплазме и ядре трансфицированных клеток листьев N. benthamiana, но не в пластидах, где проходят первые этапы биосинтеза СК из хоризмата [42].
Помимо снижения уровня СК экспрессия “нематодных” хоризматмутаз может влиять также на уровень ИУК, поскольку основная масса ИУК в растении синтезируется из триптофана, предшественником которого также является хоризмат. Например, сверхэкспрессия гена хоризматмутазы MjCM-1 галловой нематоды Meloidogyne javanica у сои вызывала подавление формирования боковых корней, и этот эффект компенсировался синтетическими ауксинами [39].
В дальнейшем секреция хоризматмутаз была обнаружена у многих других фитопатогенов. В частности, хоризматмутаза играет важную роль в вирулентности биотрофного патогенного гриба Ustilago maydis, возбудителя пузырчатой головни – широко распространенного заболевания кукурузы, характеризующегося развитием опухолей у пораженных растений. Репертуар эффекторов U. maydis включает в себя множество белков, гены которых экспрессируются исключительно на стадии биотрофии, в том числе ген Cmu1, кодирующий хоризматмутазу. Было показано, что Cmu1 секретируется в месте контакта заражающих гиф с растительными клетками, попадая в их цитоплазму, а также может распространяться в соседние клетки и ткани, изменяя метаболический статус этих клеток посредством метаболического прайминга [44].
У бактерий, в том числе фитопатогенных, также были выявлены гены хоризматмутаз. Так, бактерия Xanthomonas oryzae pv. oryzae, возбудитель бактериального ожога риса (rice leaf blight disease), содержит ген хоризматмутазы СМ, который экспрессируется при заражении растений [45]. Как ни странно, нокаут этого гена резко повышает вирулентность X. oryzae. Аналогичные данные о гипервирулентности мутанта с потерей функции гена хоризматмутазы были получены для близкородственной бактерии X. arboricola pv. juglandis, вызывающей заболевание грецкого ореха [46]. Эти данные позволяют предположить роль хоризматмутаз как супрессоров вирулентности ксантомонад: они могут участвовать в подавлении гиперинфицирования, которое может привести к преждевременной гибели растения-хозяина [45].
Широкое распространение секретируемых хоризматмутаз и их роль в вирулентности фитопатогенных нематод, грибов и бактерий свидетельствуют о том, что этот эволюционно древний путь может быть в числе высоко консервативных, общих для разных патогенов инструментов манипуляции с метаболизмом растения-хозяина. В то же время филогенетический анализ показал, что по крайней мере некоторые из генов секретируемых хоризматмутаз фитопаразитических нематод с высокой вероятностью могли быть приобретены в результате ГПГ от почвенных бактерий Burkholderia [47].
Помимо хоризматмутаз некоторые фитопатогены могут секретировать также другие ферменты шикиматного пути, снижающие уровень СК в растении, например изохоризматазы. Так, изохоризматазы, секретируемые оомицетами Phytophthora sojae и Verticillium dahlia, повышают вирулентность этих патогенов, снижая уровень СК в тканях растений-хозяев [48].
В основе другого известного пути подавления СК-опосредованного иммунитета растений лежит активация передачи сигнала ЖК и жасмонатов, поскольку в системном иммунитете антагонизм СК и ЖК играет важную роль, по крайней мере, на начальных этапах его развития [37].
Этот путь используется патогенными биотрофными бактериями P. syringae [49]. Во-первых, P. syringae в качестве фитотоксина (вторичного метаболита, негативно влияющего на жизнедеятельность растительных клеток) секретирует коронатин, структурный и функциональный аналог производного ЖК жасмонил-1-изолейцина. Коронатин, как и жасмонаты, в растительной клетке может взаимодействовать с рецептором ЖК – белком CORONATINE INSENSITIVE 1 (COI1) и активировать нижележащий сигнальный каскад, приводя к репрессии СК-зависимого защитного ответа растений [8]. Коронатин продуцируется разными патоварами P. syringae, и способность к его синтезу определяет ее вирулентность по отношению к разным видам растений, а также коррелирует с проявлением симптомов, вызываемых P. syringae – диффузными хлорозами [49].
Кроме того, белок-эффектор HopZ1a той же P. syringae напрямую взаимодействует с белками JAZ (Jasmonate ZIM-domain), репрессорами транскрипции ЖК-регулируемых генов [7]. Известно, что убиквитин-зависимая протеасомная деградация белков JAZ запускается при связывании ЖК с рецептором COI1, который является субъединицей убиквитин-лигазного комплекса [50]. Эффектор HopZ1а активирует этот процесс: при взаимодействии с HopZ1a имеет место ацетилирование белков JAZ за счет предполагаемой ацетилтрансферазной активности этого бактериального эффектора, что способствует деградации взаимодействующих с HopZ1 JAZ и активирует передачу сигнала ЖК. Более того, HopZ1a может частично устранить дефект вирулентности у мутанта P. syringae, неспособного к синтезу коронатина [7]. Эффектор HopZ1a на сегодняшний день нельзя считать примером молекулярной мимикрии, так как никакого его аналога у растений выявлено не было. Тем не менее кооперация двух эффекторов P. syringae, нацеленных на активацию сигналинга ЖК, свидетельствует о чрезвычайной важности этого пути для вирулентности этого бактериального фитопатогена [8].
Молекулярная мимикрия, направленная на дестабилизацию клеточной стенки растения
Стенка растительной клетки – первое препятствие, с которым сталкиваются фитопатогены в ходе заражения растений. В связи с этим патогены используют ферменты дестабилизации клеточных стенок как для своего роста и продвижения в тканях растения-хозяина, так и для получения доступа к питанию через разрушение растительных клеток. У разнообразных фитопатогенных организмов – бактерий, грибов, простейших, паразитических нематод был выявлен целый ряд ферментов, разрушающих клеточную стенку растений, включая целлюлазы, ксиланазы, пектатлиазы, полигалактуроназы, а также экспансин-подобные белки, сходные с таковыми у растений.
Более того, наличие ферментов этой группы присуще не только фитопатогенам. Например, целлюлазы как индуцибельные ферменты, синтезируемые различными микроорганизмами, включая бактерии и грибы, во время их роста на целлюлозных материалах, нашли широкое применение в промышленности [51]. Экспансины – небольшие белки без каталитической активности, которые ослабляют связь между целлюлозными фибриллами в стенках растительных клеток, также выявлены у многих бактерий и грибов, которые взаимодействуют с растениями в патогенных и мутуалистических сообществах, а также у микробов, питающихся растительными останками [52].
Наличие активности белков, вызывающих дестабилизацию и/или гидролиз клеточной стенки растений, важно для вирулентности многих фитопатогенных микроорганизмов. Например, у Clavibacter michiganensis, актиномицета, вызывающего кольцевую бактериальную гниль картофеля и томатов, основные гены вирулентности сосредоточены на плазмидах, потеря которых превращает этого биотрофного патогена в эндофита. К потере вирулентности C. michiganensis ведет также потеря функции локализованного на одной из вирулентных плазмид гена CelA, кодирующего целлюлазу с экспансин-подобным доменом [53]. Целлюлазы и экспансин-подобные белки играют важную роль в вирулентности Fusarium graminearum – грибного патогена, вызывающего фузариоз колоса пшеницы: их активность необходима для продвижения патогена в тканях растения и коррелирует с интенсивностью вызываемых симптомов [54].
Ферменты дестабилизации клеточных стенок играют важную роль в жизненном цикле различных видов нематод, паразитирующих на растениях [3]. Первые из ферментов этой группы, выявленные у животных, – целлюлазы цистовых нематод Globodera rostochiensis и Heterodera glycines – были идентифицированы еще в 1998 г. [55], в дальнейшем у каждого из изученных видов фитопаразитических нематод были выявлены целые группы этих ферментов [56]. Такие ферменты секретируются в клетки растений через прокалывающий их стилет в составе секрета пищеводных желез фитопаразитических нематод и играют роль как в продвижении нематоды по растительным тканям, так и в формировании синцитиев в сайтах кормления цистовых и галловых нематод [3]. Например, РНК-интерференция гена целлюлозосинтазы G. rostochiensis снижает эффективность проникновения нематод в корень, а также количество синцитиев и их размеры [57].
Помимо “своих” нематоды могут использовать и растительные белки, влияющие на стабильность клеточной стенки: для этого у ряда нематод тоже есть соотвествующие эффекторы. Так, пектинметилэстераза арабидопсиса PME3 взаимодействует с целлюлозосвязывающим белком HgCBP, который секретируется H. schachtii на ранних этапах развития синцития. Трансгенные растения, сверхэкспрессирующие ген PME3, были более восприимчивы к инфекции H. schachtii, в то время как нокаут-мутант показал противоположный эффект, что указывает на важность PME3 для паразитизма нематод. При этом сверхэкспрессия HgCBP у арабидопсиса резко повышает активность фермента PME3 in planta [58].
В то же время нематоды, не паразитирующие на растениях, обычно не нуждаются в ферментах дестабилизации клеточной стенки, и соответствующие гены не были идентифицированы в их геномах [10, 11]. Считается, что гены ферментов дестабилизации клеточной стенки появились у фитопаразитических нематод в результате ГПГ. Действительно, белковые последовательности этих ферментов демонстрируют высокий уровень сходства с соответствующими бактериальными белками: например, ближайшие “родственники” полигалактуроназ GH28 видов Meloidogyne обнаружены у Ralstonia solanacearum – патогенной почвенной бактерии, которая заражает те же растения-хозяева, что и Meloidogyne. В то же время пектатлиазы Meloidogyne PL3 кластерируются с соответствующими ферментами C. michiganensis [10, 12].
В свою очередь, несмотря на наличие у бактерий и грибов “своих” генов целлюлаз, полигалактуроназ, пектатлиаз и т.д., их экспансин-подобные белки были, возможно, приобретены с помощью ГПГ от растений, а в дальнейшем могли передаваться через ГПГ между микроорганизмами. Об этом свидетельствует нерегулярное таксономическое распределение генов, кодирующих экспансины, у микроорганизмов [52].
Молекулярная мимикрия, направленная на имитацию пептидных фитогормонов
Пептидные фитогормоны – обширная группа регуляторов роста растений белковой или пептидной природы. В настоящее время у растений идентифицировано более двадцати классов пептидных фитогормонов с очень разнообразными функциями в развитии: от контроля деления клеток и органогенеза до регуляции ответов на факторы окружающей среды и защиты от патогенов [59]. Изучение пептидных фитогормонов – очень быстро развивающаяся область биологии растений, при этом постоянно идет идентификация не только новых компонентов их сигнальных путей, но и выявление новых групп пептидных регуляторов роста, в том числе – за пределами растительного царства [4].
Большинство классов пептидных фитогормонов кодируются большими генными семействами у каждого вида высших растений. Пептидные фитогормоны синтезируются в виде белков-предшественников, которые обычно включают в себя N-концевой сигнальный домен, направляющий пептид по секреторному пути, вариабельную область и функционально значимый C-концевой домен, который отщепляется от белка-предшественника во время протеолитического процессинга и претерпевает модификации некоторых консервативных аминокислотных остатков [60]. Зрелые пептидные фитогормоны, последовательности которых соответствуют C-концевым доменам белков-предшественников с внесенными пост-трансляционными модификациями, секретируются в апопласт, где взаимодействуют на поверхности растительных клеток со своими рецепторами – как правило, ими являются серин-треониновые протеинкиназы с внеклеточным доменом, содержащим лейцин-богатые повторы (LRR-RLK, Leucine-Rich Repeats Receptor Like Kinase) [61, 62].
В настоящее время вне растительного царства гены, кодирующие пептидные фитогормоны, были выявлены у ряда бактерий и грибов (как правило, фитопатогенных, но также у некоторых симбиотических и других ассоциированных с растениями организмов, таких как грибы арбускуллярной микоризы и ризосферные бактерии), а также у паразитических нематод. Некоторые из “нерастительных” пептидных фитогормонов подробно изучены, например у паразитических нематод [18], другие же были выявлены совсем недавно, и их роль во взаимодействии патогенов с растениями не выяснена [63].
Скорее всего способность синтезировать эффекторы, имитирующие пептидные фитогормоны, развивалась независимо у разных групп организмов, взаимодействующих с растениями. Важный вопрос – как появились гены пептидных фитогормонов у растительных паразитов и симбионтов: произошло ли это в результате длительной совместной эволюции паразита/симбионта и хозяина или в результате ГПГ. С одной стороны, гипотеза конвергентной эволюции кажется более логичной, чем ГПГ, поскольку отсутствуют доказательства, необходимые для принятия гипотезы ГПГ (например, филогенетическое несоответствие между происхождением видов и деревьями генов). С другой стороны, относительно короткие последовательности генов, кодирующих пептидные фитогормоны, обладают ограниченным филогенетическим сигналом, что затрудняет получение данных о происхождении таких пептидов [9].
В случае “нерастительных” пептидных фитогормонов конвергентная эволюция, скорее всего, имела место для наиболее изученного случая пептидно-фитогормональной мимикрии у бактерий, а именно PSY1-подобных пептидов RaxX видов Xanthomonas (см. ниже).
В то же время для пептидных фитогормонов паразитических нематод гипотеза ГПГ также представляется весьма вероятной, учитывая, что такие необходимые факторы паразитизма как гены белков-дестабилизаторов клеточной стенки были приобретены нематодами от бактерий и грибов [11]. Совсем недавно гены, кодирующие пептидные фитогормоны тех же семейств, что играют роль в паразитизме у нематод, были выявлены у некоторых видов бактерий и грибов, взаимодействующих с растениями, что также может быть косвенным подтверждением гипотезы ГПГ [63].
Пептидные фитогормоны нематод: регуляторы деления клеток
К настоящему времени пептидные фитогормоны идентифицированы у нескольких групп фитопаразитических нематод, а именно цистовых (представители родов Globodera и Heterodera) и галловых (род Meloidogyne), образующих галлы на корнях растений-хозяев, а также у близких к цистовым почковидных нематод (род Rotylenchulus), неспособных к галлообразованию, но также индуцирующих синцитиальные сайты кормления. У паразитических нематод обнаружены пептидные фитогормоны семейств CLAVATA3/EMBRYO SURROUNDING REGION-RELATED (CLE), C‑TERMINALLY ENCODED PEPTIDES (CEP) и INFLORESCENCE DEFICIENT IN ABSCISSION (IDA) [18].
Пептиды CLE – первые из идентифицированных и наиболее хорошо изученные пептидные гормоны растений – играют важную роль в таких процессах как контроль активности меристем, эмбриогенез, ответ на абиотические факторы среды (содержание нитратов, доступность воды) и растительно-микробные взаимодействия (развитие азотфиксирующих клубеньков при взаимодействии с ризобиями) [59, 64]. Пептиды СЕР – регуляторы роста стебля и корня, а также развития боковых корней и клубеньков и ответа на абиотический стресс, в особенности – на дефицит азота [59, 65]. Пептиды IDA опосредованно регулируют дестабилизацию клеточной стенки при таких процессах как формирование отделительного слоя опадающих листьев, цветков и плодов, рост примордия бокового корня через слои клеток эндодермы и коры, а также взаимодействие с патогенами [59, 66].
При этом у галловых нематод имеются гены, кодирующие пептиды всех трех семейств (а также близкие к ним пептиды МАР, см. ниже), у цистовых – только гены CLE, а у почковидных – CLE и СЕР. Более того, последовательности и доменная структура соответствующих пептидов различаются у разных групп нематод, особенно у цистовых и галловых. Как и пептидные гормоны растений, предшественники пептидных фитогормонов нематод помимо функционального С-концевого домена (CLE-, CEP- или IDA-домена, соответственно) содержат N-концевой сигнальный домен, который предположительно направляет их к упаковке в секреторные гранулы в клетках пищеводных желез [18]. Также предшественники пептидных фитогормонов всех цистовых и почковидных нематод, но не галловых нематод, включают в себя центральный вариабельный домен [18, 67, 68]. Некоторые виды нематод (как и некоторые виды растений) имеют мультидоменные предшественники пептидных фитогормонов, содержащие от двух до девяти функциональных С‑концевых доменов: например, все CLE картофельной цистовой нематоды Globodera rostochiensis [69], CLE-подобные белки MAP (Meloidogyne Avirulense Proteins) галловых нематод [70] и СЕР почковидных нематод рода Rotylenchulus [71].
Как и прочие эффекторы фитопаразитических нематод, предшественники пептидных фитогормонов секретируются в клетки корня растения-хозяина в составе секрета пищеводных желез [20, 72, 73]. В клетках растений они подвергаются процессингу, в результате которого получаются зрелые пептиды. В частности, на примере мультидоменных CLE G. rostochiensis было показано, что для протеолитического процессинга и гликозилирования предшественников пептидных фитогормонов нематод используются соответствующие ферменты растения-хозяина [69].
Зрелые пептиды, полученные в результате процессинга “нематодных” предшественников пептидных фитогормонов в растительной клетке, способны взаимодействовать с рецепторами соответствующих пептидных гормонов растения и активировать нижележащие сигнальные пути. Например, было показано, что на поверхности клеток арабидопсиса пептиды CLE свекловичной нематоды H. schachtii (HsCLE) могут связываться с рецепторами растительных CLE: CLAVATA1 (CLV1), CLAVATA2/CORYNE (CLV2/CRN) BARELY ANY MERISTEM 1 и 2 (BAM1, BAM2), RECEPTOR PROTEIN KINASE 2 (RPK2) и TDIF RECEP-TOR (TDR) [74–78], тогда как пептиды GrCLE золотистой картофельной нематоды G. rostochiensis способны связываться с рецептором StCLV2 картофеля [79]. Гены, кодирующие рецепторы CLV1, CLV2-CRN и RPK2, экспрессируются в синцитиях, индуцированных H. schachtii в корнях арабидопсиса [76], а РНК-интерференция генов, кодирующих эти же рецепторы у сои, повышает устойчивость растений к соевой нематоде Heterodera glycines [80].
Связывание с растительными рецепторами HAESA (HAE) и HAESA-LIKE 2 (HSL2) предполагается также для IDA пептидов галловых нематод MiIDL1 и MiIDL2 (M. incognita IDA-Like): мутанты арабидопсиса с потерей функции этих рецепторов не способны к ростовому ответу на MiIDL и “растительные” IDA [81].
Помимо рецепторов пептидных гормонов растений некоторые из “нематодных” пептидных фитогормонов могут взаимодействовать c другими белками в растительных клетках. Так, пептид CLЕ M. incognita, он же белок-эффектор 16D10, в клетках растений напрямую взаимодействует с ядерными белками SCL6/HAM3 и SCL2 (SCARECROW-LIKE6 и 2) из семейства ТФ GRAS [82]. Известно, что SCL6/HAM3 принимает участие в спецификации апикальной меристемы корня [83], однако механизм и значение взаимодействия 16D10 с ТФ SCL остаются неясным.
Пептидные фитогормоны паразитических нематод в экспериментах по экзогенной обработке и сверхэкспрессии соответствующих генов вызывали у растений ростовые ответы, сходные с теми, которые вызываются аналогичными семействами пептидных фитогормонов растительного происхождения. Например, экзогенная обработка растений арабидопсиса разными группами пептидов CLE нематод (имеющих сходство с разными группами пептидов CLE растений) вызывает массивную пролиферацию клеток в корнях, что позволяет предположить, что обе группы пептидов CLE нематод могут способствовать пролиферации клеток во время формирования сайта кормления [75]. Сверхэкспрессия гена 16D10 M. incognita вызывает ускоренный рост корней у арабидопсиса [82]. Сверхэкспрессия генов H. schachtii HsCLE1 и HsCLE2 восстанавливает нормальный фенотип у мутанта clv3 [78], а сверхэкспрессия гена MiIDL1 M. incognita – у мутанта ida [81]. Напротив, пептиды CEP нематод, по-видимому, ограничивают размер сайтов кормления, так как обработка корней арабидопсиса пептидом RrCEP1 из Rotylenchulus reniformis вызывает уменьшение размера синцитиев при заражении нематодами [71].
Очевидно, что ростовые реакции, вызываемые пептидными фитогормонами нематодного происхождения, вносят вклад в способность нематод заражать корни растений. Так, активация экспрессии генов, кодирующих пептидные фитогормоны, на паразитарных стадиях развития нематод [20, 69, 71–73, 84, 85] наряду с тем фактом, что трансгенные растения, экспрессирующие двухцепочечную РНК, комплементарную CLE нематод, устойчивы к нематодному заражению [85], указывают на важную роль этих пептидов в паразитизме. Об этом же свидетельствует тот факт, что РНК-интерференция гена 16D10 M. incognita у картофеля повышает устойчивость растений к пяти видам Meloidogyne [82].
Пептидные фитогормоны бактерий: сигнал для иммунитета растений (и не только)
Наиболее изученным примером бактериальных эффекторов, имитирующих пептидные фитогормоны, является пептид RaxX, продуцируемый бактерией Xanthomonas oryzae pv. oryzae. Этот белок является гомологом белков PLANT PEPTIDES CONTAINING SULFATED TYROSINE (PSY) растений [86, 87].
В геноме арабидопсиса имеются два гена, кодирующие пептиды-предшественники PSY: наиболее высокий уровень их экспрессии имеет место в апикальной меристеме побега и зоне элонгации корня. Рецептор PSY1 – рецепторная киназа PSY1R (PSY1 RECEPTOR) – при связывании лиганда образует гетеродимер с корецептором SERK1 (SOMATIC EMBRYOGENESIS RECEPTOR KINASE1). Мишенью ее действия является мембранная H+-АТФаза 2: фосфорилируя и активируя ее, киназа PSY1R способствует закислению межклеточного пространства и повышению лабильности клеточной стенки, что способствует росту клеток растяжением [88].
Изучение бактериального эффектора RaxX началось с открытия гена Xa21 риса, который кодирует рецепторную киназу семейства LRR-RLK и придает устойчивость растения к X. oryzae pv. оryzae [89]. Поиск генов X. oryzae, необходимых для активации Xa21 (генов Rax, от Required for Activation of Xa21), привел к идентификации гена RaxX. В дальнейшем гены RaxX были обнаружены у многих видов Xanthomonas. Высокая консервативность последовательностей генов RaxX у разных видов свидетельствует об их важной биологической функции [86, 87].
Продукт другого Xa21-активирующего гена X. oryzae, кодирующего бифункциональную протеазу/переносчик RaxB, необходим для протеолитического процессинга и созревания пептида RaxX. Кроме того, для функционирования RaxX важно его сульфатирование по консервативному остатку тирозина тирозинсульфотрансферазой RaxST. Таким образом, Xanthomonas самостоятельно обеспечивает созревание пептида RaxX в бактериальной клетке и секретирует его в виде протеолитически процессированного и сульфатированного зрелого пептида [90]. Это отличается от ситуации с фитопатогенными грибами и нематодами, которые секретируют только предшественники пептидных фитогормонов и используют ферменты растения-хозяина для их созревания [79, 91].
Пептид RaxX из различных видов Xanthomonas, как и пептид AtPSY1 арабидопсиса, стимулирует рост корней. В то же время пептид AtPSY1, в отличие от RaxX, не может активировать Xa21-опосредованный иммунитет у растений риса [86]. Наконец, было показано, что пептиды RaxX и AtPSY взаимодействуют с разными рецепторами: RaxX, но не AtPSY1, напрямую и с высокой аффинностью связывается с LRR-RLK Xa21 риса [90].
На сегодняшний день Xanthomonas – единственный известный фитопатоген, который секретирует готовый пептидный фитогормон. Кроме того, уникальной является ситуация со специфичностью рецептора этого пептида: только RaxX взаимодействует с рецептором Xa21 риса, который, следовательно, является не рецептором растительного гормона, а специализированным рецептором для бактериального эффектора. В связи с этим предполагается, что система RaxX–Xa21, судя по всему, представляет собой частный случай иммунитета растения, запускаемого эффектором (Effector-Triggered Imunity, ETI). Эта система включает в себя бактериальные эффекторы и связывающие их высокоспецифичные поверхностные или внутриклеточные LRR-содержащие иммунные рецепторы растения, которые возникли в результате длительной коэволюции патогенов и их хозяев [92]. Пептид RaxX используется бактерией для облегчения заражения растений, однако иммунная система растений “обманула” Xanthomonas, поскольку захват эффектора RaxX рецептором Xa21, ставшим частью системы ETI, останавливает распространение бактерии [86, 87].
Недавно у фитопатогенных бактерий были выявлены также пептидные фитогормоны семейств СЕР и RAPID ALKALINIZATION FACTOR (RALF), но биологические функции этих пептидов пока не выяснены. Так, девять видов актинобактерий, большинство из которых являются патогенными для растений, например Streptomyces acidiscabies, возбудитель парши картофеля, продуцируют белки, содержащие С-концевой домен RALF. Уникальной особенностью бактериальных белков RALF является домен, гомологичный субъединице S1 коклюшного токсина, который отсутствует в RALF растений и грибов и может свидетельствовать о различиях функций бактериальных и прочих RALF белков [93]. Бактериальный гомолог CEP был обнаружен у Ralstonia syzygii subsp. syzygii – патогена, вызывающего болезнь Суматры у гвоздичных деревьев в Индонезии [63].
Пептидные фитогормоны грибов: неясные функции
Фитопатогенные грибы растений могут манипулировать развитием и иммунным ответом растений-хозяев с помощью сложных и разнообразных механизмов, включая выработку ИУК и ЦК [5, 6], а также секрецию белковых эффекторов – гомологов пептидных гормонов растений (см. ниже).
На сегодняшний день у фитопатогенных грибов выявлены эффекторы, имитирующие пептидные фитогормоны семейств RAPID ALKALINIZATION FACTOR (RALF), фитосульфокины (PSK) и IDA: пептиды RALF и PSK широко распространены в царстве грибов и были идентифицированы более чем у 20 фитопатогенных видов аскомицетов и базидиомицетов [63, 91, 93], в то время как пептиды IDA были обнаружены только у двух видов грибов [63].
Ген, кодирующий близкий гомолог растительных пептидов RALF, был впервые идентифицирован у Fusarium oxysporum – распространенного фитопатогенного гриба с широким кругом хозяев, гифы которого распространяются по сосудистой системе растений, вызывая дефицит воды и увядание – фузариозный вилт [94].
Пептиды RALF у растений впервые были обнаружены как факторы, повышающие рН среды при их добавлении в культуру клеток табака: конечной мишенью их действия, по-видимому, является H+-АТФаза 2, активность которой негативно регулируют RALF. Благодаря такому действию пептиды RALF являются негативными регуляторами ИУК: обработка растений пептидами RALF вызывает снижение скорости удлинения корней. Кроме того, пептиды RALF известны как регуляторы повышения уровня активных форм кислорода (ROS, Reactive Oxygen Species) при биотическом и абиотическом стрессе [95].
Белок-предшественник RALF, кодируемый геном F. oxysporum (F-RALF), как и соответствующие белки растений, содержит консервативный домен RALF, соответствующий зрелому пептиду, и N-концевой сигнальный домен, необходимый для секреции. В дальнейшем гены RALF были идентифицированы в геномах 26 видов биотрофных и некротрофных фитопатогенных грибов: некоторые из этих видов грибов имеют по нескольку RALF-подобных генов. Все виды грибов, которые обладают генами RALF, являются патогенами растений, что указывает на роль RALF в патогенезе грибов. По всей видимости, RALF F. oxysporum взаимодействует с растительным рецептором пептидов RALF – протеинкиназой FERONIA: мутант арабидопсиса с потерей функции этого рецептора не проявляет ингибирования роста в ответ на заражение F. oxysporum [91, 93].
Интересно, что у близкого вида фитопатогенных грибов, Fusarium graminearum, пептид RALF, по-видимому, не важен для вирулентности: мутантные штаммы с потерей функции своего единственного гена FgRALF проявляют нормальную способность к заражению растений [96]. Таким образом, консервативная роль пептидов RALF в патогенезе грибов остается под вопросом.
Также среди грибов довольно широко распространены гомологи пептидов PSK, которые были идентифицированы у пяти видов базидиомицетов (виды рода Tilletia) и 19 видов аскомицетов (но не у F. oxysporum и близких к нему видов) [63]. Фитосульфокины (PSK) растений, в отличие от пептидов RALF, являются активаторами роста и деления клеток, играя роль в контроле активности меристем, росте пыльцевой трубки и реакции на патогенез [97]. Все грибы, содержащие гомологи генов PSK, также являются фитопатогенными, что позволяет предположить роль “грибных” фитосульфокинов во взаимодействии с растением-хозяином. Тем не менее роль генов PSK фитопатогенных грибов в настоящее время не была изучена в связи с совсем недавним их открытием [63].
Совершенно не изучены также функции пептидов IDA, выявленных у двух видов фитопатогенных грибов – базидиомицета Melampsora larici-populina и аскомицета Colletotrichum fructicola [63].
Другие примеры молекулярной мимикрии у фитопатогенов
Помимо вышеописанных примеров молекулярной мимикрии, у разных групп фитопатогенов описано довольно много частных случаев эффекторов, которые имитируют определенные белки растений-хозяев и способствуют повышению эффективности заражения, осуществляя определенные функции в клетке растений. Поскольку таких примеров множество, мы остановимся только на нескольких наиболее интересных эффекторах, обнаруженных у фитопаразитических нематод.
Нематоды рода Heterodera в числе прочих эффекторов секретируют в ткани корня растений аннексин-подобные белки, которые демонстрируют функциональное сходство с аннексинами растений [98, 99]. Аннексины – консервативные для эукариот белки, которые связывают ионы кальция и фосфолипиды и участвуют во множестве клеточных процессов, в том числе – в ответе на абиотический стресс и патогенез у растений. Предполагается, что аннексины нематод могут играть роль в подавлении иммунной реакции растений: так, экспрессия гена, кодирующего секретируемый аннексин H. avenae, вызывает подавление местной иммунной реакции сверхчувствительности (Hypersensitivity response, HR) на различные бактериальные индукторы, такие как флагеллин. Нокаут этого же гена у нематоды резко снижает ее способность к заражению растений [99].
Другой пример – нематодные эффекторы, вызывающие убиквитинирование белков растения-хозяина. У цистовых (но не у галловых) нематод были выявлены эффекторы из семейства белков удлинения цепей убиквитина (Ubiquitin Extension Protein, UEP). Было показано, что белки из этого семейства HsUBI1 H. schachtii и GrUBCEP12 G. rostochiensis могут быть важны для развития успешного паразитизма на растениях, так как их РНК-интерференция снижала восприимчивость растений к нематодам [100]. Мишени этих белков в растительных клетках неизвестны.
Наконец, некоторые эффекторные белки, секретируемые фитопатогенными нематодами, могут регулировать экспрессию генов растения-хозяина, выступая в качестве транскрипционных факторов. Так, эффектор M. incognita 7H08 имеет домены ядерной локализации и после секреции доставляется в ядро растительной клетки. Более того, было показано, что этот белок может активировать транскрипцию репортерных генов как в дрожжевой системе, так и in planta [101].
ОБСУЖДЕНИЕ
Итак, для различных групп фитопатогенов в настоящее время выявлено множество примеров молекулярной мимикрии, направленной на достижение одной цели – повышение эффективности патогенеза, но реализуемой разными путями. Более того, распространение молекулярной мимикрии не ограничивается фитопатогенами: ее примеры есть и среди других организмов, взаимодействующих с растениями, в том числе – симбионтов.
Как и фитопатогены, симбиотические и полезные микробы также способны изменять процессы развития растений, производя различные эффекторы. Поскольку полезные микробы изначально воспринимаются растениями как потенциальные захватчики, вмешательство в иммунную систему растений, направленное на модулирование системы “защитных” фитогормонов, является фундаментальным для их выживания и установления отношений с растением-хозяином. Например, микоризные грибы могут модулировать передачу сигналов этилена – фитогормона, регулирующего ответ на биотические и абиотические стрессовые факторы и играющего важную роль в развитии первичной (местной) иммунной реакции. Во время колонизации растений грибом арбускулярной микоризы Glomus intraradice его эффекторный белок SP7 напрямую взаимодействует с этилен-зависимым ТФ Ethylene Response Factor 19 (ERF19) [102]. На снижении этилен-зависимых реакций “играют” также ризосферные бактерии рода Rhizobacteria, которые обладают АЦК-дезаминазой, ферментом, который разрушает предшественник этилена аминоциклопропанкарбоксилат (АЦК) и таким образом снижает уровень биосинтеза этилена в растении-хозяине [103].
Бактерии Rhizobium, способные к образованию азотфиксирующего симбиоза с бобовыми растениями, грибы арбускулярной микоризы, а также некоторые ризосферные бактерии и грибы способны к синтезу ЦК и ИУК, что важно для установления их взаимодействия с растением-хозяином [104–109]. Способность продуцировать ИУК и ЦК делает эти микроорганизмы важными регуляторами развития растений [107, 108].
Также у симбиотических и полезных микробов существуют примеры мимикрии пептидных фитогормонов. У некоторых видов эндофитных, эпифитных и ризосферных бактерий были идентифицированы гены, кодирующие возможные гомологи пептидов CLE, CEP и PSK [63]. Гомологи растительных пептидных фитогормонов выявлены также у грибов арбускулярной микоризы: в геномах четырех видов рода Rhizophagus и одного вида рода Gigasporа идентифицированы гены, продукты которых имеют высокое сходство с некоторыми пептидами CLE арабидопсиса и люцерны. Более того, для Rhizophagus irregularis и Gigaspora rosea показана активация генов CLE (RiCLE1 и GrCLE1) при развитии симбиоза. Обработка растений люцерны синтетическим пептидом RiCLE1 влияла на развитие корневой системы: подавляла рост первичных корней и стимулировала образование боковых корней. Этот эффект был менее выраженным у мутантов clv2, что позволяет предположить, что рецептор CLV2 может быть ответственным за восприятие RiCLE1. Экзогенная обработка проростков RiCLE1 перед инокуляцией R. irregularis усиливала дальнейшую микоризацию корня, что свидетельствует о роли пептидов CLЕ микоризных грибов в установлении симбиоза с растениями [110].
В литературе последних лет активно обсуждается происхождение разных вариантов молекулярной мимикрии у фитопатогенов [4, 14, 18]. Некоторые молекулы, используемые фитопатогенами, являются очень древними и консервативными (например, ИУК, ЦК, бактериальные целлюлазы) и могут использоваться разными группами организмов для разных целей, тогда как фитопатогены “научились” применять их для колонизации растений-хозяев. Более поздними приобретениями являются, например, гены, кодирующие пептидные фитогормоны нерастительного происхождения, которые могли возникнуть как в результате ГПГ, так и в результате конвергентной эволюции.
В последние годы идет активное накопление знаний о примерах молекулярной мимикрии у фитопатогенов и механизмах ее действия [13, 63]. Эти знания позволяют сделать выводы о происхождении таких примеров, а также о роли молекулярного диалога растений с его симбионтами и паразитами в установлении взаимоотношений растения-хозяина с полезными микроорганизмами и защитных реакций против патогенов.
Обзор написан при поддержке гранта РНФ 21-66-00012.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rojas M., Restrepo-Jiménez P., Monsalve D.M. et al. Molecular mimicry and autoimmunity // J. Autoimmun. 2018. V. 95. P. 100–123. https://doi.org/10.1016/j.jaut.2018.10.012
Nobori T., Mine A., Tsuda K. Molecular networks in plant-pathogen holobiont // FEBS Lett. 2018. V. 592. № 12. P. 1937–1953. https://doi.org/10.1002/1873-3468.13071
Bohlmann H., Sobczak M. The plant cell wall in the feeding sites of cyst nematodes // Front Plant Sci. 2014. V. 5. P. 89. https://doi.org/10.3389/fpls.2014.00089
Dodueva I., Lebedeva M., Lutova L. Dialog between Kingdoms: enemies, allies and peptide phytohormones // Plants (Basel). 2021. V. 10. № 11. P. 2243. https://doi.org/10.3390/plants10112243
Ludwig-Müller J. Bacteria and fungi controlling plant growth by manipulating auxin: balance between development and defense // J. Plant Physiol. 2015. V. 172. P. 4–12.
Spallek T., Gan P., Kadota Y., Shirasu K. Same tune, different song-cytokinins as virulence factors in plant-pathogen interactions? // Curr. Opin. Plant Biol. 2018. V. 44. P. 82–87. https://doi.org/10.1016/j.pbi.2018.03.002
Jiang S., Yao J., Ma K.W. et al. Bacterial effector activates jasmonate signaling by directly targeting JAZ transcriptional repressors // PLoS Pathog. 2013. V. 9. № 10. P. e1003715. https://doi.org/10.1371/journal.ppat.1003715
Geng X., Jin L., Shimada M. et al. The phytotoxin coronatine is a multifunctional component of the virulence armament of Pseudomonas syringae // Planta. 2014. V. 240. № 6. P. 1149–1165. https://doi.org/10.1007/s00425-014-2151-x
Bird D.M., Jones J.T., Opperman C.H. et al. Signatures of adaptation to plant parasitism in nematode genomes // Parasitology. 2015. V. 142. Suppl. 1. P. S71–S84. https://doi.org/10.1017/S0031182013002163
Danchin E.G.J. What Nematode genomes tell us about the importance of horizontal gene transfers in the evolutionary history of animals // Mob. Genet. Elements. 2011. V. 1. № 4. P. 269–273. https://doi.org/10.4161/mge.18776
Danchin E.G.J., Rosso M.N., Vieira P. et al. Multiple lateral gene transfers and duplications have promoted plant parasitism ability in nematodes // Proc. Natl Acad. Sci. USA. 2010. V. 107. № 41. P. 17651–17656. https://doi.org/10.1073/pnas.1008486107
Paganini J., Campan-Fournier A., Da Rocha M. et al. Contribution of lateral gene transfers to the genome composition and parasitic ability of root-knot nematodes // PLoS One. 2012. V. 7. № 11. P. e50875. https://doi.org/10.1371/journal.pone.0050875
Frébortová J., Frébort I. Biochemical and structural aspects of cytokinin biosynthesis and degradation in bacteria // Microorganisms. 2021. V. 9. № 6. P. 1314. https://doi.org/10.3390/microorganisms9061
Ali M.A., Azeem F., Li H., Bohlmann H. Smart parasitic nematodes use multifaceted strategies to parasitize plants // Front. Plant Sci. 2017. V. 8. P. 1699. https://doi.org/10.3389/fpls.2017.01699
Siddique S., Radakovic Z.S., De La Torre C.M. et al. A parasitic nematode releases cytokinin that controls cell division and orchestrates feeding site formation in host plants // Proc. Natl Acad. Sci. USA. 2015. V. 112. № 41. P. 12669–12674. https://doi.org/10.1073/pnas.15036571
Lee C., Chronis D., Kenning C. et al. The novel cyst nematode effector protein 19C07 interacts with the Arabidopsis auxin influx transporter LAX3 to control feeding site development // Plant Physiol. 2011. V. 155. № 2. P. 866–880. https://doi.org/10.1104/pp.110.16719
Hewezi T., Juvale P.S., Piya S. et al. The cyst nematode effector protein 10A07 targets and recruits host posttranslational machinery to mediate its nuclear trafficking and to promote parasitism in Arabidopsis // Plant Cell. 2015. V. 27. № 3. P. 891–907. https://doi.org/10.1105/tpc.114.135327
Gheysen G., Mitchum M.G. Phytoparasitic nematode control of plant hormone pathways // Plant Physiol. 2019. V. 179. № 4. P. 1212–1226. https://doi.org/10.1104/pp.18.01067
Haegeman A., Mantelin S., Jones J.T., Gheysen G. Functional roles of effectors of plant-parasitic nematodes // Gene. 2012. V. 492. № 1. P. 19–31. https://doi.org/10.1016/j.gene.2011.10.040
Bobay B.G., DiGennaro P., Scholl E. et al. Solution NMR studies of the plant peptide hormone CEP inform function // FEBS Lett. 2013. V. 587. № 24. P. 3979–3985. https://doi.org/10.1016/j.febslet.2013.10.033
de Almeida Engler J., Kyndt T., Vieira P. et al. CCS52 and DEL1 genes are key components of the endocycle in nematode-induced feeding sites // Plant J. 2012. V. 72. № 2. P. 185–198. https://doi.org/10.1111/j.1365-313X.2012.05054.x
Dodueva I.E., Lebedeva M.A., Kuznetsova K.A. et al. Plant tumors: a hundred years of study // Planta. 2020. V. 251. № 4. P. 82. https://doi.org/10.1007/s00425-020-03375-5
Chen Z., Agnew J.L., Cohen J.D. et al. Pseudomonas syringae type III effector AvrRpt2 alters Arabidopsis thaliana auxin physiology // Proc. Natl Acad. Sci. USA. 2007. V. 104. № 50. P. 20131–20136. https://doi.org/10.1073/pnas.0704901104
Choi J., Huh S.U., Kojima M. et al. The cytokinin-activated transcription factor ARR2 promotes plant immunity via TGA3/NPR1-dependent salicylic acid signaling in Arabidopsis // Dev. Cell. 2010. V. 19. № 2. P. 284–295. https://doi.org/10.1016/j.devcel.2010.07.011
Taya Y., Tanaka Y., Nishimura S. 5'-AMP is a direct precursor of cytokinin in Dictyostelium discoideum // Nature. 1978. V. 271. № 5645. P. 545–547. https://doi.org/10.1038/271545a0
Barry G.F., Rogers S.G., Fraley R.T., Brand L. Identification of a cloned cytokinin biosynthetic gene // Proc. Natl Acad. Sci. USA. 1984. V. 81. № 15. P. 4776–4780. https://doi.org/10.1073/pnas.81.15.4776
Kemper E., Wafenschmidt S., Weiler E.W. et al. T‑DNA-encoded auxin formation in crown-gall cells // Planta. 1985. V. 163. № 2. P. 257–262. https://doi.org/10.1007/BF00393516
Fu S.-F., Wei J.Y., Chen H.W. et al. Indole-3-acetic acid: A widespread physiological code in interactions of fungi with other organisms // Plant Signal. Behav. 2015. V. 10. № 8. P. e1048052. https://doi.org/10.1080/15592324.2015.1048052
Spíchal L. Cytokinins – recent news and views of evolutionally old molecule // Funct. Plant Biol. 2012. V. 39. № 4. P. 267–284. https://doi.org/10.1071/FP11276
Takei K., Sakakibara H., Sugiyama T. Identification of genes encoding adenylate isopentenyltransferase, A cytokinin biosynthesis enzyme, in Arabidopsis thaliana // J. Biol. Chem. 2001. V. 276. № 28. P. 26405–26410. https://doi.org/10.1074/jbc.M102130200
Persson B.C., Esberg B., Olafsson O., Björk G.R. Synthesis and function of isopentenyl adenosine derivatives in tRNA // Biochimie. 1994. V. 76. № 12. P. 1152–1160. https://doi.org/10.1016/0300-9084(94)90044-2
Frébort I., Kowalska M., Hluska T. et al. Evolution of cytokinin biosynthesis and degradation // J. Exp. Bot. 2011. V. 62. № 8. P. 2431–2452. https://doi.org/10.1093/jxb/err004
Yue J., Hu X., Huang J. Origin of plant auxin biosynthesis // Trends Plant Sci. 2014. V. 19. № 12. P. 764–770. https://doi.org/10.1016/j.tplants.2014.07.004
Hinsch J., Galuszka P., Tudzynski P. Functional characterization of the first filamentous fungal tRNA-isopentenyltransferase and its role in the virulence of Claviceps purpurea // New Phytol. 2016. V. 211. № 3. P. 980–992. https://doi.org/10.1111/nph.13960
Chapman E.J., Estelle M. Mechanism of auxin-regulated gene expression in plants // Annu. Rev. Genet. 2009. V. 43. P. 265–285. https://doi.org/10.1242/dev.131870
Cui F., Wu S., Sun W. et al. The Pseudomonas syringae type III effector AvrRpt2 promotes pathogen virulence via stimulating Arabidopsis auxin/indole acetic acid protein turnover // Plant Physiol. 2013. V. 162. № 2. P. 1018–1029. https://doi.org/10.1104/pp.113.219659
Pieterse C.M.J., Van der Does D., Zamioudis C. et al. Hormonal modulation of plant immunity // Annu. Rev. Cell. Dev. Biol. 2012. V. 28. P. 489–521. https://doi.org/10.1146/annurev-cellbio-092910-154055
Lambert K.N., Allen K.D., Sussex I.M. Cloning and characterization of an esophageal-gland-specific chorismate mutase from the phytoparasitic nematode Meloidogyne javanica // Mol. Plant Microbe Interact. 1999. V. 12. № 4. P. 328–336. https://doi.org/10.1094/MPMI.1999.12.4.328
Doyle E.A., Lambert K.N. Meloidogyne javanica chorismate mutase 1 alters plant cell development // Mol. Plant Microbe Interact. 2003. V. 16. № 2. P. 123–131. https://doi.org/10.1094/MPMI.2003.16.2.123
Huang G., Dong R., Allen R. et al. Two chorismate mutase genes from the root-knot nematode Meloidogyne incognita // Mol. Plant Pathol. 2005. V. 6. № 1. P. 23–30. https://doi.org/10.1111/j.1364-3703.2004.00257.x
Vanholme B., Kast P., Haegeman A. et al. Structural and functional investigation of a secreted chorismate mutase from the plant-parasitic nematode Heterodera schachtii in the context of related enzymes from diverse origins // Mol. Plant Pathol. 2009. V. 10. № 2. P. 189–200. https://doi.org/10.1111/j.1364-3703.2008.00521.x
Wang X., Xue B., Dai J., Qin X. A novel Meloidogyne incognita chorismate mutase effector suppresses plant immunity by manipulating the salicylic acid pathway and functions mainly during the early stages of nematode parasitism // Plant Pathology. 2018. V. 67. № 6. P. 1436–1448. https://doi.org/10.111/ppa/12841
Parkinson J., Whitton C., Guiliano D. et al. 200 000 nematode expressed sequence tags on the Net // Trends Parasitol. 2001. V. 17. № 8. P. 394–396. https://doi.org/10.1016/s1471-4922(01)01954-7
Djamei A., Schipper K., Rabe F. et al. Metabolic priming by a secreted fungal effector // Nature. 2011. V. 478. № 7369. P. 395–398. https://doi.org/10.1038/nature10454
Degrassi G., Devescovi G., Bigirimana J., Venturi V. Xanthomonas oryzae pv. oryzae XKK.12 contains an AroQgamma chorismate mutase that is involved in rice virulence // Phytopathology. 2010. V. 100. № 3. P. 262–270. https://doi.org/10.1094/PHYTO-100-3-0262
Assis R. de A.B., Sagawa C.H.D., Zaini P.A. et al. A secreted chorismate mutase from Xanthomonas arboricola pv. juglandis attenuates virulence and walnut blight symptoms // Int. J. Mol. Sci. 2021. V. 22. № 19. P. 10374. https://doi.org/10.3390/ijms221910374
Noon J.B., Baum T.J. Horizontal gene transfer of acetyltransferases, invertases and chorismate mutases from different bacteria to diverse recipients // BMC Evol. Biol. 2016. V. 16. P. 74. https://doi.org/10.1186/s12862-016-0651-y
Liu T., Song T., Zhang X. et al. Unconventionally secreted effectors of two filamentous pathogens target plant salicylate biosynthesis // Nat. Commun. 2014. V. 5. P. 4686. https://doi.org/10.1038/ncomms5686
Brooks D.M., Bender C.L., Kunkel B.N. The Pseudomonas syringae phytotoxin coronatine promotes virulence by overcoming salicylic acid-dependent defences in Arabidopsis thaliana // Mol. Plant Pathol. 2005. V. 6. № 6. P. 629–639. https://doi.org/10.1111/j.1364-3703.2005.00311.x
Thines B., Katsir L., Melotto M. et al. JAZ repressor proteins are targets of the SCF(COI1) complex during jasmonate signalling // Nature. 2007. V. 448. № 7154. P. 661–665. https://doi.org/10.1038/nature05960
Ejaz U., Sohail M., Ghanemi A. Cellulases: From bioactivity to a variety of industrial applications // Biomimetics (Basel). 2021. V. 6. № 3. P. 44. https://doi.org/10.3390/biomimetics6030044
Cosgrove D.J. Microbial Expansins // Annu. Rev. Microbiol. 2017. V. 71. P. 479–497. https://doi.org/10.1146/annurev-micro-090816-093315
Jahr H., Dreier J., Meletzus D. et al. The endo-beta-1,4-glucanase CelA of Clavibacter michiganensis subsp. michiganensis is a pathogenicity determinant required for induction of bacterial wilt of tomato // Mol. Plant Microbe Interact. 2000. V. 13. № 7. P. 703–714. https://doi.org/10.1094/MPMI.2000.13.7.703
Quarantin A., Castiglioni C., Schäfer W. et al. The Fusarium graminearum cerato-platanins loosen cellulose substrates enhancing fungal cellulase activity as expansin-like proteins // Plant Physiol. Biochem. 2019. V. 139. P. 229–238. https://doi.org/10.1016/j.plaphy.2019.03.025
Smant G., Stokkermans J.P., Yan Y. et al. Endogenous cellulases in animals: Isolation of beta-1, 4-endoglucanase genes from two species of plant-parasitic cyst nematodes // Proc. Natl Acad. Sci. USA. 1998. V. 95. № 9. P. 4906–4911. https://doi.org/10.1073/pnas.95.9.4906
Ali S., Magne M., Chen S. et al. Analysis of putative apoplastic effectors from the nematode, Globodera rostochiensis, and identification of an expansin-like protein that can induce and suppress host defenses // PLoS One. 2015. V. 10. № 1. P. e0115042. https://doi.org/10.1371/journal.pone.0115042
Chen Q., Rehman S., Smant G., Jones J.T. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi // Mol. Plant Microbe Interact. 2005. V. 18. № 7. P. 621–625. https://doi.org/10.1094/MPMI-18-0621
Hewezi T., Howe P., Maier T.R. et al. Cellulose binding protein from the parasitic nematode Heterodera schachtii interacts with Arabidopsis pectin methylesterase: cooperative cell wall modification during parasitism // Plant Cell. 2008. V. 20. № 11. P. 3080–3093. https://doi.org/10.1105/tpc.108.063065
Ганчева М.С., Маловичко Ю.В., Полюшкевич Л.О. и др. Пептидные гормоны растений // Физиол. растений. 2019. Т. 66. № 2. С. 83–103. https://doi.org/0.1134/S001533031901007X
Stührwohldt N., Schaller A. Regulation of plant peptide hormones and growth factors by post-translational modification // Plant Biol. (Stuttg). 2019. V. 21. Suppl 1. P. 49–63. https://doi.org/10.1111/plb.12881
Полюшкевич Л.О., Ганчева М.С., Додуева И.Е., Лутова Л.А. Рецепторы пептидов CLE у растений // Физиол. растений. 2020. Т. 67. № 1. С. 3–19. https://doi.org/0.31857/S0015330320010285X
Chakraborty S., Nguyen B., Wasti S.D., Xu G. Plant Leucine-Rich Repeat Receptor kinase (LRR-RK): structure, ligand perception, and activation mechanism // Molecules. 2019. V. 24. № 17. P. E3081. https://doi.org/10.3390/molecules24173081
Yuan N., Furumizu C., Zhang B., Sawa S. Database mining of plant peptide homologues // Plant Biotechnol. (Tokyo). 2021. V. 38. № 1. P. 137–143. https://doi.org/10.5511/plantbiotechnology.20.0720a
Willoughby A.C., Nimchuk Z.L. WOX going on: CLE peptides in plant development // Curr. Opin. Plant Biol. 2021. V. 63. P. 102056. https://doi.org/10.1016/j.pbi.2021.1020
Taleski M., Imin N., Djordjevic M.A. CEP peptide hormones: key players in orchestrating nitrogen-demand signalling, root nodulation, and lateral root development // J. Exp. Bot. 2018. V. 69. № 8. P. 1829–1836. https://doi.org/10.1093/jxb/ery037
Aalen R.B., Wildhagen M., Stø I.M., Butenko M.A. IDA: A peptide ligand regulating cell separation processes in Arabidopsis // J. Exp. Bot. 2013. V. 64. № 17. P. 5253–5261 https://doi.org/10.1093/jxb/ert338
Wang J., Joshi S., Korkin D., Mitchum M.G. Variable domain I of nematode CLEs directs post-translational targeting of CLE peptides to the extracellular space // Plant Signal. Behav. 2010. V. 5. № 12. P. 1633–1635. https://doi.org/10.4161/psb.5.12.13774
Wubben M.J., Gavilano L., Baum T.J., Davis E.L. Sequence and spatiotemporal expression analysis of CLE-motif containing genes from the reniform nematode (Rotylenchulus reniformis Linford & Oliveira) // J. Nematol. 2015. V. 47. № 2. P. 159–165.
Lu S.-W., Chen S., Wang J. et al. Structural and functional diversity of CLAVATA3/ESR (CLE)-like genes from the potato cyst nematode Globodera rostochiensis // Mol. Plant Microbe Interact. 2009. V. 22. № 9. P. 1128–1142. https://doi.org/10.1094/MPMI-22-9-112
Rutter W.B., Hewezi T., Maier T.R. et al. Members of the Meloidogyne avirulence protein family contain multiple plant ligand-like motifs // Phytopathology. 2014. V. 104. № 8. P. 879–885. https://doi.org/10.1094/PHYTO-11-13-0326-R
Eves-Van Den Akker S., Lilley C.J., Yusup H.B. et al. Functional C-TERMINALLY ENCODED PEPTIDE (CEP) plant hormone domains evolved de novo in the plant parasite Rotylenchulus reniformis // Mol. Plant Pathol. 2016. V. 17. № 8. P. 1265–1275. https://doi.org/10.1111/mpp.12402
Wang X., Allen R., Ding X. et al. Signal peptide-selection of cDNA cloned directly from the esophageal gland cells of the soybean cyst nematode Heterodera glycines // Mol. Plant Microbe Interact. 2001. V. 14. № 4. P. 536–544. https://doi.org/10.1094/MPMI.2001.14.4.53
Tucker M.L., Yang R. A gene encoding a peptide with similarity to the plant IDA signaling peptide (AtIDA) is expressed most abundantly in the root-knot nematode (Meloidogyne incognita) soon after root infection // Exp. Parasitol. 2013. V. 134. № 2. P. 165–170. https://doi.org/10.1016/j.exppara.2013.03.019
Guo Y., Ni J., Denver R. et al. Mechanisms of molecular mimicry of plant CLE peptide ligands by the parasitic nematode Globodera rostochiensis // Plant Physiol. 2011. V. 157. № 1. P. 476–484. https://doi.org/10.1104/pp.111.180554
Guo X., Wang J., Gardner M. et al. Identification of cyst nematode B-type CLE peptides and modulation of the vascular stem cell pathway for feeding cell formation // PLoS Pathog. 2017. V. 13. № 2. P. e1006142. https://doi.org/10.1371/journal.ppat.1006142
Replogle A., Wang J., Bleckmann A. et al. Nematode CLE signaling in Arabidopsis requires CLAVATA2 and CORYNE // Plant J. 2011. V. 65. № 3. P. 430–440. https://doi.org/10.1111/j.1365-313X.2010.04433.x
Replogle A., Wang J., Paolillo V. et al. Synergistic interaction of CLAVATA1, CLAVATA2, and RECEPTOR-LIKE PROTEIN KINASE 2 in cyst nematode parasitism of Arabidopsis // Mol. Plant Microbe Interact. 2013. V. 26. № 1. P. 87–96. https://doi.org/10.1094/MPMI-05-12-0118-F
Wang J., Replogle A., Hussey R. et al. Identification of potential host plant mimics of CLAVATA3/ESR (CLE)-like peptides from the plant-parasitic nematode Heterodera schachtii // Mol. Plant Pathol. 2011. V. 12. № 2. P. 177–186. https://doi.org/10.1111/j.1364-3703.2010.00660.x
Chen S., Lang P., Chronis D. et al. In planta processing and glycosylation of a nematode CLAVATA3/ENDOSPERM SURROUNDING REGION-like effector and its interaction with a host CLAVATA2-like receptor to promote parasitism // Plant Physiol. 2015. V. 167. № 1. P. 262–272. https://doi.org/10.1104/pp.114.251637
Guo X., Chronis D., De La Torre C.M. et al. Enhanced resistance to soybean cyst nematode Heterodera glycines in transgenic soybean by silencing putative CLE receptors // Plant Biotechnol. J. 2015. V. 13. № 6. P. 801–810. https://doi.org/10.1111/pbi.12313
Kim J., Yang R., Chang C. et al. The root-knot nematode Meloidogyne incognita produces a functional mimic of the Arabidopsis INFLORESCENCE DEFICIENT IN ABSCISSION signaling peptide // J. Exp. Bot. 2018. V. 69. № 12. P. 3009–3021. https://doi.org/10.1093/jxb/ery135
Huang G., Dong R., Allen R. et al. A root-knot nematode secretory peptide functions as a ligand for a plant transcription factor // Mol. Plant Microbe Interact. 2006. V. 19. № 5. P. 463–470. https://doi.org/10.1094/MPMI-19-046
Zhou Y., Liu X., Engstrom E.M. et al. Control of plant stem cell function by conserved interacting transcriptional regulators // Nature. 2015. V. 517. № 7534. P. 377–380. https://doi.org/10.1038/nature13853
Gao B., Allen R., Maier T. et al. The parasitome of the phytonematode Heterodera glycines // Mol. Plant Microbe Interact. 2003. V. 16. № 8. P. 720–726. https://doi.org/10.1094/MPMI.2003.16.8.720
Dinh P.T.Y., Zhang L., Mojtahedi H. et al. Broad meloidogyne resistance in potato based on RNA interference of effector gene 16D10 // J. Nematol. 2015. V. 47. № 1. P. 71–78.
Pruitt R.N., Joe A., Zhang W. et al. A microbially derived tyrosine-sulfated peptide mimics a plant peptide hormone // New Phytol. 2017. V. 215. № 2. P. 725–736. https://doi.org/10.1111/nph.14609
Pruitt R.N., Schwessinger B., Joe A. et al. The rice immune receptor XA21 recognizes a tyrosine-sulfated protein from a Gram-negative bacterium // Sci. Adv. 2015. V. 1. № 6. P. e1500245. https://doi.org/10.1126/sciadv.1500245
Oehlenschlæger C.B., Gersby L.B.A., Ahsan N. et al. Activation of the LRR receptor-like kinase PSY1R requires transphosphorylation of residues in the activation loop // Front. Plant Sci. 2017. V. 8. P. 2005. https://doi.org/10.3389/fpls.2017.02005
Wang G.L., Song W.Y., Ruan D.L. et al. The cloned gene, Xa21, confers resistance to multiple Xanthomonas oryzae pv. oryzae isolates in transgenic plants // Mol. Plant Microbe Interact. 1996. V. 9. № 9. P. 850–855. https://doi.org/10.1094/mpmi-9-085
Luu D.D., Joe A., Chen Y. et al. Biosynthesis and secretion of the microbial sulfated peptide RaxX and binding to the rice XA21 immune receptor // Proc. Natl Acad. Sci. USA. 2019. V. 116. № 17. P. 8525–8534. https://doi.org/10.1073/pnas.181827511
Masachis S., Segorbe D., Turrà D. et al. A fungal pathogen secretes plant alkalinizing peptides to increase infection // Nat. Microbiol. 2016. V. 1. № 6. P. 16043. https://doi.org/10.1038/nmicrobiol.2016.43
Cui H., Tsuda K., Parker J.E. Effector-triggered immunity: from pathogen perception to robust defense // Annu. Rev. Plant Biol. 2015. V. 66. P. 487–511. https://doi.org/10.1146/annurev-arplant-050213-040012
Thynne E., Saur I.M.L., Simbaqueba J. et al. Fungal phytopathogens encode functional homologues of plant rapid alkalinization factor (RALF) peptides // Mol. Plant Pathol. 2017. V. 18. № 6. P. 811–824. https://doi.org/10.1111/mpp.12444
Gordon T.R. Fusarium oxysporum and the Fusarium wilt syndrome // Annu. Rev. Phytopathol. 2017. V. 55. P. 23–39. https://doi.org/10.1146/annurev-phyto-080615-095919
Blackburn M.R., Haruta M., Moura D.S. Twenty years of progress in physiological and biochemical investigation of RALF peptides // Plant Physiol. 2020. V. 182. № 4. P. 1657–1666. https://doi.org/10.1104/pp.19.0131
Wood A.K.M., Walker C., Lee W.S. et al. Functional evaluation of a homologue of plant rapid alkalinisation factor (RALF) peptides in Fusarium graminearum // Fungal Biol. 2020. V. 124. № 9. P. 753–765. https://doi.org/10.1016/j.funbio.2020.05.001
Sauter M. Phytosulfokine peptide signalling // J. Exp. Bot. 2015. V. 66. № 17. P. 5161–5169. https://doi.org/10.1093/jxb/erv071
Patel N., Hamamouch N., Li C. et al. A nematode effector protein similar to annexins in host plants // J. Exp. Bot. 2010. V. 61. № 1. P. 235–248. https://doi.org/10.1093/jxb/erp293
Chen C., Liu S., Liu Q. et al. An ANNEXIN-like protein from the cereal cyst nematode Heterodera avenae suppresses plant defense // PLoS One. 2015. V. 10. № 4. P. e0122256. https://doi.org/10.1371/journal.pone.0122256
Chronis D., Chen S., Lu S. et al. A ubiquitin carboxyl extension protein secreted from a plant-parasitic nematode Globodera rostochiensis is cleaved in planta to promote plant parasitism // Plant J. 2013. V. 74. № 2. P. 185–196. https://doi.org/10.1111/tpj.12125
Zhang L., Davies L.J., Elling A.A. A Meloidogyne incognita effector is imported into the nucleus and exhibits transcriptional activation activity in planta // Mol. Plant Pathol. 2015. V. 16. № 1. P. 48–60. https://doi.org/10.1111/mpp.12160
Kloppholz S., Kuhn H., Requena N. A secreted fungal effector of Glomus intraradices promotes symbiotic biotrophy // Curr. Biol. 2011. V. 21. № 14. P. 1204–1209. https://doi.org/10.1016/j.cub.2011.06.044
Shaharoona B., Arshad M., Zahir Z.A. Effect of plant growth promoting rhizobacteria containing ACC-deaminase on maize (Zea mays L.) growth under axenic conditions and on nodulation in mung bean (Vigna radiata L.) // Lett. Appl. Microbiol. 2006. V. 42. № 2. P. 155–159. https://doi.org/10.1111/j.1472-765X.2005.01827.x
Frugier F., Kosuta S., Murray J.D. et al. Cytokinin: secret agent of symbiosis // Trend. Plant Sci. 2008. V. 13. № 3. P. 115–120. https://doi.org/10.1016/j.tplants.2008.01.003
Kisiala A., Laffont C., Emery R.J., Frugier F. Bioactive cytokinins are selectively secreted by Sinorhizobium meliloti nodulating and nonnodulating strains // Mol. Plant Microbe Interact. 2013. V. 26. № 10. P. 1225–1231. https://doi.org/10.1094/MPMI-02-13-0054-R
Crafts C.B., Miller C.O. Detection and identification of cytokinins produced by mycorrhizal fungi // Plant Physiol. 1974. V. 54. № 4. P. 586–588. https://doi.org/10.1104/pp.54.4.586
Fu S.-F., Wei J.Y., Chen H.W. et al. Indole-3-acetic acid: A widespread physiological code in interactions of fungi with other organisms // Plant Signal. Behav. 2015. V. 10. № 8. P. e1048052. https://doi.org/10.1080/15592324.2015.1048052
Duca D.R., Glick B.R. Indole-3-acetic acid biosynthesis and its regulation in plant-associated bacteria // Appl. Microbiol. Biotechnol. 2020. V. 104. № 20. P. 8607–8619. https://doi.org/10.1007/s00253-020-10869-5
Pons S., Fournier S., Chervin C. et al. Phytohormone production by the arbuscular mycorrhizal fungus Rhizophagus irregularis // PLoS One. 2020. V. 15. № 10. P. e0240886. https://doi.org/10.1371/journal.pone.0240886
Marquer M.L., Bécard G., Frey N.F. Arbuscular mycorrhizal fungi possess a CLAVATA3/embryo surrounding region-related gene that positively regulates symbiosis // New Phytol. 2019. V. 222. № 2. P. 1030–1042. https://doi.org/10.1111/nph.1564
Дополнительные материалы отсутствуют.


