Генетика, 2022, T. 58, № 7, стр. 838-845
Делеции AZFс региона Y-хромосомы у российских фертильных мужчин
В. Б. Черных 1, 2, *, О. П. Рыжкова 1, И. А. Кузнецова 1, М. С. Казарян 1, Т. М. Сорокина 1, Л. Ф. Курило 1, О. А. Щагина 1, А. В. Поляков 1
1 Медико-генетический научный центр им. академика Н.П. Бочкова
115522 Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, Россия
* E-mail: chernykh@med-gen.ru
Поступила в редакцию 22.12.2021
После доработки 13.01.2022
Принята к публикации 28.02.2022
- EDN: VCCRMO
- DOI: 10.31857/S0016675822070049
Аннотация
Микроделеции Y-хромосомы являются одними из частых вариаций числа копий (CNV), связанных с нарушением фертильности и бесплодием у мужчин. Исследованы частота и спектр делеций в регионе AZFc (локус Yq11.223) у российских фертильных мужчин (n = 436). Полные делеции региона AZFc (b2/b4) не выявлены в исследованной выборке, частичные AZFc-делеции обнаружены у 77 (17.7%) индивидуумов. Наиболее частыми типами из них являлись делеции b2/b3 и gr/gr, которые детектированы у 64 (14.7%) и 10 (2.3%) пациентов и составили 72.8 и 23.3% всех выявленных микроделеций Y-хромосомы соответственно. Другие (редкие) типы частичных делеций AZFc детектированы у 3 (0.7%) мужчин. Полученные данные свидетельствуют, что у российских фертильных мужчин частичные делеции региона AZFc являются распространенными микроделеционными вариантами (CNV) Y-хромосомы, при этом делеция b2/b3, характерная для N1-гаплогруппы, является наиболее частым их типом.
Микроделеции Y-хромосомы являются одной из частых генетических причин нарушения репродуктивной функции у мужчин. Патогенные делеции эухроматиновой области длинного плеча Y-хромосомы (локусы Yq11.221-q11.223) приводят к нарушению сперматогенеза и мужской фертильности [1–6]. Данный участок региона MSY (the Male Specific region of the human Y chromosome) содержит ряд генов, имеющих тестис-специфичную экспрессию и контролирующих сперматогенез [7]. В нем картирован локус (регион) AZF (Azoospermia Factor, “фактор азооспермии”), в котором согласно локализации крупных повторяющихся микроделеций выделены три (суб)региона: AZFa, AZFb и AZFc [1]. Цитогенетически идентифицируемые несбалансированные структурные перестройки с вовлечением Y-хромосомы (кольцевые и изодицентрические хромосомы, транслокации, терминальные делеции и др.) и микроделеции ее длинного плеча (Yq) могут приводить к потере всего локуса AZF (Yq11.2) или каких-либо его частей [2–4].
Наиболее часто микроструктурные перестройки Y-хромосомы возникают в регионе AZFc (локус Yq11.223), что связано с присутствием в нем множества протяженных повторов (ампликонов), имеющих высокую степень гомологии (более 99.9%) (рис. 1) [7–10]. Межхроматидная и внутрихроматидная неаллельная гомологичная рекомбинация (NAHR) приводит к образованию несбалансированных микроструктурных перестроек – микроделеций и дупликаций (вариаций числа копий – copy number variation, CNV) Y-хромосомы [6, 8–10]. Все полные AZF-делеции, т. е. удаляющие целиком один регион или более протяженные, являются патогенными мутациями de novo и вызывают выраженное нарушение сперматогенеза, приводя к мужскому бесплодию вследствие азооспермии или олигозооспермии тяжелой степени [1–6]. Крайне редко у некоторых пациентов с олигозооспермией, имеющих “нетяжелые” типы патогенных микроделеций Y-хромосомы, например, делеции региона AZFc, отмечают сохранение фертильности, но бесплодие у их сыновей [1, 11, 12]. Полные делеции региона AZFc (делеции b2/b4) являются наиболее частым типом патогенных микроделеций Y-хромосомы, составляющих 65–70% всех клинически значимых AZF-делеций, и приводят к необструктивной азооспермии или выраженной олигозооспермии [1–6, 9, 13]. Проведение процедуры экстракорпорального оплодотворения методом ИКСИ (от англ. ICSI – IntraCytoplasmic Sperm Injection, введение сперматозоида в цитоплазму, интрацитоплазматическая инъекция сперматозоида) позволяет решить проблему мужского бесплодия у большинства пациентов с полными AZFc делециями [14].
Рис. 1.
Схематичное изображение AZFc-региона Y-хромосомы человека, располагающихся в нем палиндромов и ампликонов, а также частых типов его делеций. Сверху показана протяженность региона AZFc. Далее, сверху вниз: палиндромы (P1, P2 и P3), ампликоны (показаны стрелками различного цвета) гены данного региона Y-хромосомы и исследованные STS-маркеры (маркеры sY254 и sY255 присутствуют в каждой копии гена DAZ), ниже представлены основные типы делеций (полная AZFc – b2/b4, частичные – b1/b2, b2/b3, gr/gr делеции и подтипы gr/gr делеции g1/g2, r1/r3, r2/r4).
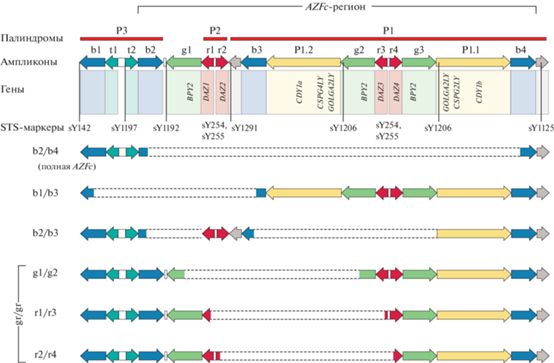
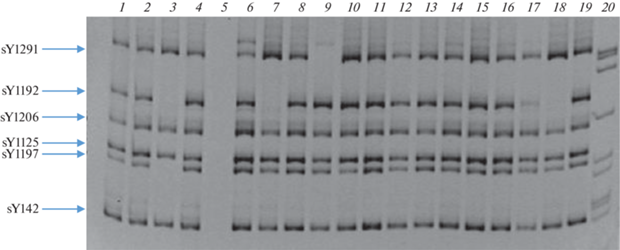
Рис. 2.
Электрофореграмма продуктов мультиплексной ПЦР в 7%-ном полиакриламидном геле (ПААГ). Сверху указан номер дорожек (1–20), слева – STS-маркеры. Дорожки 1, 2, 6, 8, 10–17, 19 – норма (отсутствие делеций); дорожка 3 – делеция sY1192, sY1197 (делеция в пределах палиндрома P3); дорожка 4 – положительный контроль; дорожка 5 – отрицательный контроль (без ДНК); дорожка 7 – делеция маркера sY1192 (b2/b3), дорожки 9 и 18 – делеция маркера sY1291 (gr/gr), дорожка 20 – маркер молекулярного веса.
В отличие от полных неполные (частичные) делеции региона AZFc или в его проксимальной границе – области, также относящемуся к региону AZFb (частично перекрывающемуся с ним) встречаются как у мужчин с бесплодием, так и у фертильных мужчин. При этом они часто являются микроструктурными полиморфизмами (непатогенными CNV) Y-хромосомы, которые наследуются по мужской линии [2, 4, 6–10]. Это обусловлено ди-/мультикопийностью генов данного региона (DAZ, BPY2, CDY1, CSPG4LY, GOLG2ALY) [7–10], поэтому при частичных делециях данного региона Y-хромосомы теряется только часть копий его генов, но сохраняется их функция, при этом размер делеций может достигать 1.6–2.2 млн пн [15–20]. Роль многих частичных делеций региона AZFс в нарушении сперматогенеза и мужской фертильности окончательно не установлена. По крайней мере для некоторых их типов, например делеций gr/gr, показано, что они могут являться генетическими факторами нарушения мужской фертильности, предрасполагающими к снижению количества и качества сперматозоидов у мужчин различных национальностей [9, 19, 21]. Частота и спектр частичных AZFс-делеций варьируют в разных популяциях и клинических группах мужчин (фертильные, с нормозооспермией, бесплодием и различными формами патозооспермии), при этом данные исследований свидетельствуют об определенных этнических различиях по частоте и типам делеций, а также о связи многих микроструктурных перестроек Y-хромосомы с ее гаплотипом [2, 9, 10, 16–20].
Цель исследования – определение частоты и спектра делеционных нарушений AZFc региона Y-хромосомы у российских фертильных мужчин.
МАТЕРИАЛЫ И МЕТОДЫ
Исследованная выборка состояла из 436 неродственных российских мужчин с доказанной фертильностью, являющихся биологическими отцами не менее одного ребенка от беременностей, наступивших естественным путем. Факт биологического отцовства подтвержден результатами ДНК-исследования по поводу определения биологического родства.
Кровь получали методом венепункции в одноразовые пластиковые пробирки с консервантом (0.5 М раствор ЭДТА) в соотношении консервант/кровь – 1 : 10. Геномную ДНК выделяли с помощью наборов DNA prep 100 (“Diatom”, Россия) и Wizard genomic purification kit (“Promega”, США).
Для детекции микроделеций Y-хромосомы использовали метод мультиплексной полимеразной цепной реакции (мПЦР). Для выявления делеций региона AZFc анализировали наличие/отсутствие шести STS (sequence-tagged site)-локусов (ДНК-маркеров): sY1192, sY1291 и sY1206, а также его границ: проксимальная – sY142, sY1197 граница (палиндром Р3) и дистальная – sY1125 (табл. 1). Для полных AZFс-делеций (делеций b2/b4) характерно отсутствие амплификации следующих STS-локусов Y-хромосомы: sY1192, sY1291, sY1206, для делеций b2/b3 – отсутствие локуса sY1192, для делеций gr/gr – отсутствие локуса sY1291, для делеций b1/b3 – одновременное отсутствие локусов sY1192, sY1197 и sY1291.
Таблица 1.
Характеристика различных типов делеций AZFc-региона Y-хромосомы по наличию STS-локусов, размеру делеции, числу утраченных и сохраненных генов
| Делеция | Наличие STS-локусов | Всего утраченных генов | Число присутствующих копий генов и транскрипционных единиц | Размер делеции, млн пн | |||||
|---|---|---|---|---|---|---|---|---|---|
| sY142 | sY1197 | sY1192 | sY1291 | sY1206 | sY1125 | ||||
| P3a, P3b, P3c | +/– | – | +/– | + | + | + | 6–9 | 23–26 | 1.0–1.3 |
| P3d | + | – | + | + | + | + | 1 | 31 | 0.03 |
| b1/b3 | + | – | – | – | + | + | 12 | 20 | 1.6 |
| b2/b3 (g1/g3) | + | + | – | + | + | + | 12 | 20 | 1.8 (2.2) |
| gr/gr | + | + | + | – | + | + | 9 | 23 | 1.6 |
| b2/b4 (полная делеция AZFc) | + | + | – | – | – | + | 21 | 11 | 3.5 |
| Нет делеций (референсная Y-хромосома) | + | + | + | + | + | + | – | 32 | – |
Амплификацию ДНК выполняли на программируемом термоциклере МС2 (“ДНК-технология”, Россия) с использованием Taq-полимеразы. Реакционная смесь включала: 3 мкл геномной ДНК, 2.5 мкл каждого dNTP в 2.5 мкл однократного буфера для ПЦР (67 мМ Tris-HCl, pH 8.8, 16.6 мМ (NH4)2SO4, 0.01% Twin-20), добавляли 0.3 мкл термофильной ДНК-полимеразы с антителами, 20–30 мкл минерального масла. ПЦР проводили в следующем режиме: первоначальная денатурация t = 95°С – 2 мин, t = 94°С – 45 с, t = = 65°С – 45 с, t = 72°С – 45 с, финальная достройка t = 72°С – 7 мин. Результаты амплификации оценивали методом электрофореза в 7%-ном полиакриламидном геле (ПААГ) с последующим окрашиванием в растворе бромистого этидия (0.1 мкг/мл в 1× TBE). Оценку полученных результатов и запись изображений полученных гелей проводили с использованием станции гель-документирования GEL DOC 2000 и пакета программ “QUANTITY ONE ®” фирмы “BIORAD” (Италия).
РЕЗУЛЬТАТЫ
Микроделеции Y-хромосомы обнаружены у 77 (17.7%) из 436 фертильных мужчин (табл. 2, рис. 1). Среди обследованных индивидуумов не обнаружено делеций, целиком захватывающих AZFc-регион, т.е. полных делеций AZFc (b2/b4). Все детектированные микроделеции удаляли только часть региона AZFc или его проксимальной границы (палиндром P3), т.е. являлись неполными/частичными делециями данного региона. Наиболее частыми типами из них являлись делеции b2/b3 и gr/gr, детектированные у 64 (14.7%) и 10 (2.3%) мужчин соответственно. Данные вариации числа копий составили 83.1 и 13.0% от всех выявленных микроделеций Y-хромосомы соответственно. Другие (редкие) типы частичных делеций AZFc детектированы у 3 (0.7%) индивидуумов. Среди них одна делеция (с утратой локусов sY1192 и sY1197) располагалась в проксимальной области региона AZFc и захватывала палиндром Р3, а две другие делеции частично захватывали палиндромы Р2 или Р1 (sY1192, sY1206, n = 1; sY1291, sY1206, n = 1) (табл. 2).
Таблица 2.
Делеции AZFc-региона Y-хромосомы, обнаруженные у российских фертильных мужчин
| Тип делеции AZFс-региона | Делетированные STS-маркеры |
Число обнаруженных делеций, n (частота делеций, %) |
|---|---|---|
| Полная делеция региона AZFc (del ‘b2/b4’) | sY1192, sY1291, sY1206 | 0 (0.0) |
| del b1/b3 | sY1192, sY1197, sY1291 | 0 (0.0) |
| del b2/b3 | sY1192 | 64 (14.7) |
| del gr/gr | sY1291 | 10 (2.3) |
| del P3a/b/c | sY1192, sY1197 | 1 (0.2) |
| del P3d | sY1197 | 0 (0.0) |
| Другие типы частичных делеций региона AZFc |
sY1192, sY1206 | 1 (0.2) |
| sY1291, sY1206 | 1 (0.2) | |
| sY1206 | 0 (0.0) | |
| Всего делеций: | 77 (17.7) | |
Вероятно, что все обнаруженные микроделеции характеризовались потерей двух копий генов семейства DAZ, представленных на референсной Y-хромосоме в четырех копиях (DAZ1-4). Среди мужчин исследованной выборки не обнаружена делеция b1/b3, при которой также утрачиваются две из четырех копий гена DAZ, а также отсутствуют локусы sY1192, sY1197 и sY1291. Также ни у одного пациента не отмечено делеций, захватывающих только локусы sY142 и sY1125, располагающиеся в проксимальной и дистальной границах региона AZFc соответственно.
ОБСУЖДЕНИЕ
Многими авторами показана выраженная вариабельность по частоте и спектру микроделеций длинного плеча Y-хромосомы в различных группах мужчин [2, 4, 5]. В значительной мере они зависят от критериев формирования исследуемой выборки. Основными факторами, влияющими на частоту и типы делеций в локусе AZF (Yq11.2), являются наличие фертильности, мужского бесплодия и его причин (в том числе не связанных с микроделециями Y-хромосомы), наличие и степень нарушения сперматогенеза и выраженность сперматологических изменений (форма патозооспермии). Наиболее высокую частоту (в среднем около 10%) клинически значимых микроделеций в локусе Yq11.2 регистрируют среди мужчин с необструктивной (секреторной) азооспермией и олигозооспермией тяжелой степени неясного генеза [4–6, 9]. При этом частота патогенных микроделеций Y-хромосомы (большинство из которых являются полными “классическими”) AZF-делециями, у мужчин с нарушением фертильности существенно не зависит от региона мира/страны, т.е. от этнического состава исследуемой выборки [22].
Наиболее частым типом патогенных микроделеций Y-хромосомы является полная делеция региона AZFc (b2/b4), доля которой составляет 65–75% всех полных AZF-делеций [1–6, 9]. Ее частота у российских мужчин с бесплодием, связанным с азооспермией или олигозооспермией тяжелой степени, составляет 8.2% [3]. Данная делеция имеет размер 3.5 млн пн и возникает в результате несбалансированной рекомбинации между ампликонами b2 (blue2) и b4 (blue 4), располагающимися в дистальных областях палиндромов P3 и P1 соответственно (рис. 1) и приводит к потере 21 из 32 генов и транскрибирующихся последовательностей данного региона (табл. 1) [8]. В исследованной нами выборке фертильных мужчин не обнаружено полных делеций региона AZFc (делеций b2/b4 и других более протяженных делеций), все детектированные делеции являлись частичными.
В литературе сообщались единичные случаи сохранной фертильности у мужчин, имевших патогенные микроделеции Y-хромосомы, в том числе полные делеции региона AZFc [1, 11, 12]. Данные случаи, как правило, были выявлены при обследовании их сыновей, которые обращались для медицинской помощи в связи с бесплодием в браке. У мужчин с полными делециями региона AZFc может встречаться не только азооспермия или олигозооспермия тяжелой степени (сниженное количество сперматозоидов в эякуляте, менее 1–2 млн/мл), но и менее тяжелые формы олигозоспермии, что может быть совместимо с сохранением фертильности при отсутствии тяжелой астено-/тератозооспермии помимо олигозооспермии [1, 4, 11–14].
У мужчин с частичными делециями региона AZFc в отличие от полных AZFс-делеций, напротив, отмечается широкая вариабельность в показателях спермограммы (от нормозооспермии до различных по тяжести форм патозооспермии вплоть до азооспермии). У них отмечается выраженная гетерогенность по состоянию сперматогенеза, отсутствию или наличию и выраженности нарушений репродуктивной функции (от полностью сохранной фертильности, до субфертильности и бесплодия) [2, 4–6, 9, 13].
У мужчин исследованной нами выборки не выполнялось исследование эякулята, поэтому невозможно оценить их сперматологические диагнозы. Наличие фертильности не равнозначно нормозооспермии (нормальным количественным и качественным показателям сперматозоидов) и наоборот. Частота нормозооспермии в супружеских парах с бесплодием в браке составляет 11–30% [23]. Вероятно, что только часть обследованных имели нормозооспермию, другая часть – патозооспермию. Кроме того, следует учитывать, что могут как количественные, так и качественные характеристики эякулята существенно изменяться со временем, и для их оценки у фертильных мужчин следует их анализировать на момент наступления беременности/родов, а не спустя длительного срока, поскольку это может не отражаться на показателях спермограммы. Сперматологические исследования, которые оценивали бы сперматологические показатели в динамике, у мужчин с микроделециями Y-хромосомы не проводились.
Зависимость частоты и типов частичных микроделеций в локусе AZF от этнического происхождения и гаплотипа Y-хромосомы показана во многих исследованиях [16–20]. Так, у мужчин из западноевропейских популяций наиболее распространенным типом частичных делеций региона AZFc является делеция gr/gr [19, 21, 23]. Она заняла второе место по частоте AZF-делеций у российских фертильных мужчин (2.3%). Частота делеции gr/gr варьирует среди мужчин из различных регионов мира, так в США она составляет 2.1, в Польше – 2.5, Индии – 6.7, Тунисе – 7.1, Вьетнаме – 15% [19]. Делеция gr/gr приводит к потере 9 из 32 генов и транскрибирующихся последовательностей AZFc-региона, и имеет размер около 1.6 млн пн (табл. 1). Делеция gr/gr является наиболее частой микроделецией Y-хромосомы у мужчин различных этнических групп, при этом распространенность делеций gr/gr варьирует от 2.1 до 12.5% среди у индивидуумов из общей популяции [24]. Исследование крупных выборок мужи от 0 до 10.2% среди мужчин с нормозооспермиейчин из различных популяций и мета-анализ исследований позволили установить, что наличие gr/gr увеличивает вероятность сниженного количества сперматозоидов в эякуляте, т.е. является фактором риска снижения мужской фертильности в среднем в два раза [19, 21]. Однако тестирование на наличие частичных делеций региона AZFc не является обязательным для диагностики причин мужского бесплодия [22, 24].
Следует отметить, что некоторые распространенные частичные микроделеции Y-хромосомы, в частности делеции gr/gr представляют собой не одинаковые вариации числа копий (CNV). Они имеют различные подтипы (g1/g2, r1/r3, r2/r4 и другие) размер и генный состав, вследствие различий в механизме формирования [2, 9, 10, 20]. Определение подтипов (субтипирование) делеций, а также наличия микроинверсий и частичных дупликаций AZFc-региона требует дополнительного молекулярно-генетического исследования. Их субтипирование так же как и Y-гаплотипирование не было выполнено в данном исследовании, так как это не входило в задачи исследования. Y-гаплотипирование и определение копий утраченных генов региона AZFc не используется широко в ДНК-диагностике мужского бесплодия [22].
В исследованной группе российских фертильных мужчин наиболее частой частичной AZFc-делецией является b2/b3 (g1/g3). Данный вариант числа копий (CNV) в локусе Yq11.223 приводит к потере 12 из 32 генов и транскрибирующихся последовательностей AZFc-региона, и имеет размер около 1.8 млн пн (табл. 1). Она является микроделеционным полиморфизмом, характерным для N1-гаплогруппы Y-хромосомы [17, 18]. Наибольшую частоту делеции b2/b3 отмечают у мужчин из Cеверной Евразии, а также в Прибалтийских регионах. Частота данной гаплогруппы Y-хромосомы у российских мужчин составляет в среднем около 15% [17, 25]. Ее влияние на сперматологические показатели и мужскую фертильность не доказана у мужчин разных этнических групп [19, 26]. Полученные данные свидетельствуют о том, что делеция ‘b2/b3’ не оказывает существенного влияния на сперматогенез и мужскую фертильность.
Делеция ‘b1/b3’, имеющая размер 1.6 млн пн (табл. 1), в исследованной выборке не обнаружена. Данная микроделеция Y-хромосомы является редкой, ее частота у мужчин из общей популяции составляет примерно 0.1% [19]. Поскольку другие типы частичных делеций региона AZFc (помимо делеций b2/b3, gr/gr) описаны в небольшом количестве случаев, их фенотипическое влияние на сперматогенез и мужскую фертильность изучено недостаточно. Очевидно, что их наличие не вызывает мужское бесплодие, поскольку не приводит к выраженным нарушениям сперматогенеза и оплодотворяющей способности сперматозоидов [19].
Помимо рассмотренных описанных выше вариантов числа копий в данном исследовании и другими авторами описаны другие типы микроделеций и микродупликаций, располагающихся в палиндромах 1, 2 и 3 [2, 9, 10, 15, 27, 28] Y‑хромосомы. Некоторые из них обнаружены неоднократно, т.е. являются рекуррентными, например, делеции палиндрома P3 (P3a-d), другие – описаны в единичных публикациях. Наличие некоторых типов микроструктурных перестроек в палиндромной области Y-хромосомы, их высокая частота рекомбинаций/мутаций в регионе AZFс может оказывать влияние на “стабильность” хромосомы и предрасполагать к возникновению ее дополнительных микроструктурных вариантов и структурных аномалий Y-хромосомы, влияя на мужскую фертильность и эволюцию [9, 10, 20, 28].
Для некоторых вариаций числа копий (CNV), в частности частичных AZF-делеций, предполагают не снижение, а повышение концентрации сперматозоидов в эякуляте. Очевидно, что их микроструктурные варианты Y-хромосомы, связанные с ее гаплотипом, определяют количество (копийность и соотношение копий) Y-сцепленных (и других) генов, контролирующих сперматогенез. Это может быть как фактором, снижающим активность сперматогенеза, приводя к олигозооспермии, так и одним из факторов повышения его активности, предрасполагающим к полизооспермии [27, 28].
Таким образом, полученные результаты свидетельствуют о том, что частичные делеции региона AZFc Y-хромосомы являются распространенными микроделеционными полиморфизмами и часто встречаются у российских фертильных мужчин. Наиболее частая из них делеция ‘b2/b3’ характерна для N-гаплогруппы Y-хромосомы, часто встречающейся среди мужчин Северной Евразии. Очевидно, что данная микроделеция Y-хромосомы не является причиной мужского бесплодия и нарушения сперматогенеза. Вторая по частоте делеция – ‘gr/gr’, в настоящее время рассматривается как фактор снижения мужской фертильности. Влияние других редких типов делеции редких AZF-микроделеций на сперматогенез, и риск развития его нарушений и снижения мужской фертильности остается недостаточно изученным и требует дальнейшего исследования.
Работа выполнена в рамках проекта “Многоцентровая исследовательская биоресурсная коллекция “Репродуктивное здоровье человека” № 15.БРК.21.0008 Министерства науки и высшего образования РФ.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Vogt P.H., Edelmann A., Kirsch S. et al. Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11 // Hum. Mol. Genet. 1996. V. 5. № 7. P. 933–943. https://doi.org/10.1093/hmg/5.7.933
Vogt P.H. AZF deletions and Y chromosomal haplogroups: History and update based on sequence // Hum. Reprod. Update. 2005. V. 11. № 4. P. 319–336. https://doi.org/10.1093/humupd/dmi017
Черных В.Б., Чухрова А.Л., Бескоровайная Т.С. и др. Типы делеций Y-хромосомы и их частота у мужчин с бесплодием // Генетика. 2006. Т. 42. № 8. P. 1130–1136.
Черных В.Б. AZF-делеции – частая генетическая причина бесплодия у мужчин: современное состояние исследований // Проблемы репродукции. 2009. Т. 15. № 1. С. 10–15.
Krausz C., Casamonti E. Spermatogenic failure and the Y chromosome // Hum. Genet. 2017. V. 136. № 5. P. 637–655. https://doi.org/10.1007/s00439-017-1793-8
Черных В.Б. Гоносомные аномалии и CNV и их диагностика // Мед. генетика. 2018. Т. 17. № 10. С. 8–14. https://doi.org/10.25557/2073-7998.2018.10.8-14
Skaletsky H., Kuroda-Kawaguchi T., Minx P.J. et al. The male-specific region of the human Y chromosome is a mosaic of discrete sequence classes // Nature. 2003. V. 423. № 6942. P. 825–837. https://doi.org/10.1038/nature01722
Kuroda-Kawaguchi T., Skaletsky H., Brown L.G. et al. The AZFc region of the Y chromosome features massive palindromes and uniform recurrent deletions in infertile men // Nat. Genet. 2001. V. 29. № 3. P. 279–286. https://doi.org/10.1038/ng757
Navarro-Costa P., Gonçalves J., Plancha C.E. The AZFc region of the Y chromosome: at the crossroads between genetic diversity and male infertility // Hum. Reprod. Update. 2010. V. 16. № 5. P. 525–542. https://doi.org/10.1093/humupd/dmq005
Repping S., van Daalen S.K., Brown L.G. et al. High mutation rates have driven extensive structural polymorphism among human Y chromosomes // Nat. Genet. 2006. V. 38. № 4. P. 463–467. https://doi.org/10.1038/ng1754
Chang P.L., Saver M.W., Brown S. Y chromosome microdeletion in a father and his infertile sons // Hum. Reprod. 1999. V. 14. № 11. P. 2689–2694. https://doi.org/10.1093/humrep/14.11.2689
Calogero A.E., Garofalo M.R., Barone N. et al. Spontaneous transmission from a father to his son of a Y chromosome microdeletion involving the deleted in azoospermia (DAZ) gene // J. Endocrinol. Invest. 2002. V. 25. № 7. P. 631–634. https://doi.org/10.1007/BF03345088
Черных В.Б., Руднева С.А., Сорокина Т.М. и др. Характеристика состояния сперматогенеза у мужчин с бесплодием, имеющих различные типы делеций AZFc-региона // Андрология и генитальная хирургия. 2014. Т. 15. № 2. С. 48–57. https://doi.org/10.17650/2070-9781-2014-2-48-57
Oates R.D., Silber S., Brown L.G., Page D.C. Clinical characterization of 42 oligospermic or azoospermic men with microdeletion of the AZFc region of the Y chromosome, and of 18 children conceived via ICSI // Hum. Reprod. 2002. V. 17. № 11. P. 2813–2824. https://doi.org/10.1093/humrep/17.11.2813
Jobling M.A., Samara V., Pandya A. et al. Recurrent duplication and deletion polymorphisms on the long arm of the Y chromosome in normal males // Hum. Mol. Genet. 1996. V. 5. № 11. P. 1767–1175. https://doi.org/10.1093/hmg/5.11.1767
Repping S., Skaletsky H., Brown L. et al. Polymorphism for a 1.6-Mb deletion of the human Y chromosome persists through balance between recurrent mutation and haploid selection // Nat. Genet. 2003. V. 35. № 3. P. 247–251. https://doi.org/10.1038/ng1250
Repping S., van Daalen S.K., Korver C.M. et al. A family of human Y chromosomes has dispersed throughout northern Eurasia despite a 1.8-Mb deletion in the azoospermia factor c region // Genomics. 2004. V. 83. № 6. P. 1046–1052. https://doi.org/10.1016/j.ygeno.2003.12.018
Fernandes S., Paracchini S., Meyer L.H. et al. A large AZFc deletion removes DAZ3/DAZ4 and nearby genes from men in Y haplogroup N // Am. J. Hum. Genet. 2004. V. 74. № 1. P. 180–187. https://doi.org/10.1086/381132
Rozen S.G., Marszalek J.D., Irenze K. et al. AZFc deletions and spermatogenic failure: A population-based survey of 20.000 Y chromosomes // Am. J. Hum. Genet. 2012. V. 91. № 5. P. 890–896. https://doi.org/10.1016/j.ajhg.2012.09.003
Teitz L.S., Pyntikova T., Skaletsky H., Page D.C. Selection has countered high mutability to preserve the ancestral copy number of Y chromosome amplicons in diverse human lineages // Am. J. Hum. Genet. 2018. V. 103. № 2. P. 261–275. https://doi.org/10.1016/j.ajhg.2018.07.007
Bansal S.K., Jaiswal D., Gupta N. et al. Gr/gr deletions on Y-chromosome correlate with male infertility: an original study, meta-analyses, and trial sequential analyses // Sci. Rep. 2016. V. 6. № 19798. P. 1–14. https://doi.org/10.1038/srep19798
Krausz C., Hoefsloot L., Simoni M., Tüttelmann F. EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: State-of-the-art 2013 // Andrology. 2014. V. 2. №1. P. 5–19. https://doi.org/10.1111/j.2047-2927.2013.00173.x
Андреева М.В., Хаят С.Ш., Сорокина Т.М. и др. Формы патозооспермии у мужчин с бесплодием в браке и/или с нарушениями репродуктивной системы // Андрология и генитальная хирургия. 2017. Т. 18. № 2. С. 33–38. https://doi.org/10.17650/2070-9781-2017-18-2-33-38
Stouffs K., Tournaye H., Van der Elst J. et al. Do we need to search for gr/gr deletions in infertile men in a clinical setting? // Hum. Reprod. 2008. V. 23. № 5. P. 1193–1199. https://doi.org/10.1093/humrep/den069
Ilumäe A.M, Reidla M., Chukhryaeva M. et al. Human Y chromosome haplogroup N: A non-trivial time-resolved phylogeography that cuts across language families // Am. J. Hum. Genet. 2016. V. 99. № 1. P. 163–173. https://doi.org/10.1016/j.ajhg.2016.05.025
Eloualid A., Rhaissi H., Reguig A. et al. Association of spermatogenic failure with the b2/b3 partial AZFc deletion // PLoS One. 2012. V. 7. № 4. e34902. https://doi.org/10.1371/journal.pone.0034902
Noordam M.J., van Daalen S.K., Hovingh S.E. et al. A novel partial deletion of the Y chromosome azoospermia factor c region is caused by non-homologous recombination between palindromes and may be associated with increased sperm counts // Hum. Reprod. 2011. V. 26. № 3. P. 713–723. https://doi.org/10.1093/humrep/deq386
Vaszkó T., Papp J., Krausz C. et al. Discrimination of deletion and duplication subtypes of the deleted in azoospermia gene family in the context of frequent interloci gene conversion // PLoS One. 2016. V. 11. № 10. e0163936. https://doi.org/10.1371/journal.pone.0163936
Дополнительные материалы отсутствуют.


