Генетика, 2023, T. 59, № 1, стр. 5-17
Факторы, влияющие на прорастание зерна на корню у мягкой пшеницы (Triticum aestivum L.), и методы их оценки
А. В. Федяева 1, 2, *, Е. А. Салина 1, 3, В. К. Шумный 1
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
2 Сибирский институт физиологии и биохимии растений Сибирского отделения
Российской академии наук
664033 Иркутск, Россия
3 Курчатовский геномный центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
* E-mail: fedyaeva.anna@mail.ru
Поступила в редакцию 04.02.2022
После доработки 24.05.2022
Принята к публикации 07.07.2022
- EDN: CMAFYB
- DOI: 10.31857/S0016675823010058
Аннотация
Обзор посвящен предуборочному прорастанию зерна (прорастание зерна на корню) у мягкой пшеницы (Triticum aestivum L.) ‒ одной из основных проблем, с которой сталкиваются специалисты в области генетики и селекции зерновых культур. Прорастание зерна на корню приводит к снижению урожая и экономическим потерям. В настоящей работе описаны приводящие к запуску этого процесса у зерновых культур внутриклеточные факторы, а также факторы окружающей среды, и их взаимосвязь. Дана характеристика эффективности и особенностей использования физиолого-биохимических и молекулярно-генетических методов для оценки устойчивости к предуборочному прорастанию зерна мягкой пшеницы.
При предуборочном прорастании зерна, или так называемом прорастании зерна на корню, происходит произрастание зерна в колосе родительского растения на поле перед сбором урожая, которое часто случается за счет воздействия повышенной влажности воздуха и температуры ниже нормы на финальных стадиях созревания злаковых, а также неустойчивости сортов к данным факторам внешней среды. Исследователи полагают, что это может быть связано с экстремальными и непредсказуемыми изменениями погоды, вызванными переменой климатических условий по всему Земному шару [1]. Прорастание зерна на корню является очень большой проблемой при выращивании зерновых, которое непосредственно влияет на качество муки, приводя к ухудшению ее хлебопекарных качеств, и соответственно к большим экономическим потерям [2–7].
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОРАСТАНИЕ ЗЕРНА НА КОРНЮ
Прорастание зерна контролируется как факторами окружающей среды, так и молекулярно-генетическими и биохимическими внутриклеточными факторами, а также их совместным влиянием [1, 8]. Само по себе прорастание зерна является важным этапом жизненного цикла растения, напротив сохранение состояния покоя зерна предотвращает всхожесть и тем самым позволяет избежать потерь из-за несвоевременного прорастания зерна [1, 9]. С одной стороны, состояние покоя зерна регулируется рядом генов, а с другой, – находится под влиянием определенных факторов окружающей среды [1]. К числу таких факторов относятся обильные и продолжительные дожди, повышенная влажность воздуха, а также температура ниже нормы, воздействующие на растения после периода физиологической зрелости зерна [6, 10–12] (рис. 1). Засуха и высокая температура при наливе зерна влияют на проявление устойчивости к прорастанию зерна на корню [13]. Среди внутриклеточных факторов, влияющих на процесс предуборочного прорастания зерна, выделяют следующие: состояние покоя зерна; цвет и проницаемость оболочки зерна; α-амилазная активность; уровень эндогенных гормонов (гиббереллинов, абсцизовой кислоты, индолуксусной кислоты, этилена, жасмоновой кислоты, брассиностероидов) [2, 8, 14–21] (рис. 2). Было показано, что абсцизовая кислота (АБК) поддерживает состояние покоя в семенах, а гибберелловая кислота (ГК), наоборот, стимулирует выход из покоя и прорастание семян [22, 23]. Уровень АБК в зерне регулируется за счет ее синтеза и катаболизма [1, 8, 24]. Синтез АБК происходит за счет зеаксантинэпоксидазы и 9-цис-эпоксикаратиноиддиоксигеназы [8, 19]. Катаболизм АБК в основном является результатом гидроксилирования посредством AБК 8'-гидроксилазы [25]. Намбара с соавт. сообщили о трех компонентах передачи сигналов АБК в семенах – это протеинфосфатаза 2Cs, SNF-1-подобная протеинкиназа и пирабактин- устойчивые/регуляторные компоненты АБК рецепторов [26]. Катаболизм АБК снижает ее содержание в зерне во время набухания и способствует его прорастанию [24]. В развивающемся зерне фиксируется большое содержание АБК, которое снижается при сушке зрелого зерна [27, 28]. Позже Сузуки с соавт. установили, что у пшеницы наблюдаются два пика уровня АБК, один через 25 дней после опыления, а второй через 35–45 дней [29]. К числу ферментов, участвующих в метаболизме ГК, относятся такие как энт-кауренсинтаза, энт-кауреноксидаза, оксидаза энт-кауреновой кислоты, ГК 20-оксидаза, ГК 2-оксидаза [19]. DELLA-белки в растениях являются еще одним важным элементом сигнального пути ГК, которые функционируют как репрессоры ГК [8]. Создание низкорослых и устойчивых к полеганию сортов пшеницы приводит к появлению мутации в генах, которые кодируют DELLA-белки, формируется нечувствительность к ГК и, как следствие, увеличение периода покоя и повышение устойчивости к предуборочному прорастанию зерна [30]. Другие фитогормоны также участвуют в регуляции покоя/прорастания зерна пшеницы [8]. В статье Рамаих с соавт. [31] сообщается о взаимосвязи между индолилуксусной кислотой, состоянием покоя зерна и предуборочным прорастанием. На настоящий момент влиянию таких гормонов как брассиностероиды, этилен, цитокинин, салициловая кислота, ауксины на регуляцию покоя зерна у зерновых культур посвящено много исследований, однако до сих пор до конца не изучены все их механизмы регуляции у пшеницы [8, 20]. Кроме того, необходимо отметить, что при прорастании зерна пшеницы происходит повышение содержания активных форм кислорода в растительных клетках [32–34].
Рис. 1.
Факторы окружающей среды, влияющие на предуборочное прорастание зерна озимой пшеницы в поле после периода физиологической зрелости зерна.
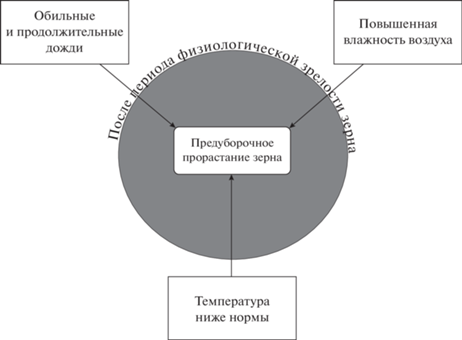
Рис. 2.
Внутриклеточные и генетические факторы, влияющие на предуборочное прорастание зерна озимой пшеницы в поле после периода физиологической зрелости зерна.
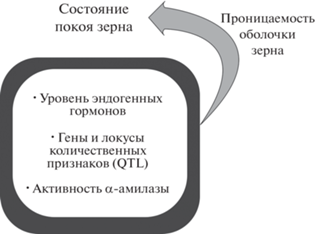
Показано влияние различных генетических факторов на проявление признака “предуборочное прорастание зерна” [1, 7, 35].
МЕТОДЫ ОЦЕНКИ УСТОЙЧИВОСТИ ЗЕРНА К ПРОРАСТАНИЮ
На настоящий момент существует достаточно большое количество морфологических, физиолого-биохимических и молекулярно-генетических методов оценки устойчивости к предуборочному прорастанию зерна у озимой и яровой пшеницы [1, 7, 8, 36, 37].
Морфологические методы
Один из методов – оценка комплекса морфофизиологических признаков [1, 3, 28], что предполагает изучение архитектоники колоса на предмет остистости, плотности колоса, степени раскрытия чешуй колоса, цвета колосковых чешуй, степени закрытия зерна цветковыми чешуями, толщины цветковой чешуи, трудности обмолота; а также оцениваются цвет и проницаемость семенной оболочки зерна [2, 38–42].
Известно, что цвет семенной оболочки зерна является еще одним фактором, коррелирующим с состоянием покоя зерна и устойчивостью к предуборочному прорастанию у пшеницы [2, 43–46]. Краснозерные сорта пшеницы более устойчивы к предуборочному прорастанию зерна, чем сорта с белым цветом зерна [47–49]. По большей части белозерные сорта пшеницы имеют более высокую скорость набухания и более высокую скорость прорастания, чем сорта пшеницы с зерном красного цвета [14]. Это может быть вызвано дефицитом олигомерных проантоцианидинов у белозерных сортов, что вызывает быстрое поглощение воды и их прорастание [2].
Структура воска, как и его количество, является важным фактором отталкивания воды в колосе [50]. В работе Йи с соавт. проведены исследования по выявлению влияния остистости на устойчивость к прорастанию; как предполагают авторы, безостые сорта обладают большей устойчивостью к прорастанию, чем остистые, однако этот признак менее очевиден, чем признак “цвет зерна” [51].
Физиолого-биохимические методы
Оценка устойчивости к данному признаку у пшеницы может проводиться в два временных периода: в предуборочный период [52] и в послеуборочный период [3, 53]. Поскольку сохранение состояния покоя зерна считается основным фактором, определяющим устойчивость пшеницы к предуборочному прорастанию [54, 55], наиболее распространенным методом оценки устойчивости зерновых является прямой провокационный способ оценки зерна [1, 52]. В научных работах провокационный прямой способ оценки в основном используется наряду с другими способами оценки устойчивости к предуборочному прорастанию зерна [1, 3].
На настоящий момент существуют две вариации проведения данного метода:
1) провокация прорастания зерна в колосьях во влажной камере [3, 56];
2) провокация прорастания зерна в чашках Петри [38, 52, 53, 56, 57].
Результатом двух вариаций прямого провокационного метода является определение индекса прорастания (ИП), с использованием формулы, описанной в работе Валкера–Симмонса [58].
ИП = $\frac{{7{{n}_{1}} + 6{{n}_{2}} + 5{{n}_{3}} + 4{{n}_{4}} + ... + 1{{n}_{7}}}}{{DN}},$ где n1, n2, …, n7 – число проросших зерен за первые, вторые и последующие сутки; N – общее число зерен, проросших за семь дней эксперимента; D – общее число дней испытания; 7, 6, …, 1 – заданные цифры к зернам, которые проросли в первый, второй и последующие дни проведения эксперимента. Максимальный ИП = 1.0 [56, 58].
Ряд исследователей [59, 60] считают, что оценка прорастания зерна в целых колосьях является более точной в определении общей устойчивости к предуборочному прорастанию по сравнению с провокацией зерна в чашках Петри, поскольку оценка проводится в условиях близких к естественным. Из особенностей применения прямого провокационного способа с использованием колоса необходимо учитывать климатические условия. Во влажные годы, в том числе и при интенсивно выпадающих осадках в послеуборочный период, желательно проводить оценку после перестоя на корню в течение 3–4 недель. Если осадки во второй половине вегетации выпадают неравномерно, а также в засушливые годы использование метода перестоя на корню можно заменить методом проращивания колосьев во влажной камере. Этот метод используется для определения устойчивости к послеуборочному прорастанию зерна и в сухие годы [38].
Физиологическим способом определения устойчивости к предуборочному прорастанию зерна у зерновых можно считать определение проницаемости оболочки зерна. Определить проницаемость оболочки зерна можно несколькими способами, при использовании трифенилтетразолия хлорида [42] и раствора NaOH [40].
Наиболее распространенным технологическим методом определения устойчивости к предуборочному прорастанию у злаков является определение числа падения (ЧП), данный способ признан Американской ассоциацией химиков-зерновиков (American Association of Cereal Chemists, AACC, Method 56 – 81.03) [6, 38, 61]. Для детекции используется специальное оборудование ‒ прибор для определения числа падения (ПЧП) с применением методики Хагберга [62] или Пертена [57, 63]. Измерение ЧП позволяет оценить уровень амилазной активности в зерне, при этом величина ЧП имеет обратно пропорциональную криволинейную связь с активностью α-амилазы [64]. Следует отметить, что метод определения числа падения требует наличия дорогостоящего оборудования; исследователи полагают [63], что его можно заменить как провокационным прямым методом оценки, описанным ранее, так и методом определения уровня α-амилазной активности. В работе [65] была выявлена достоверная корреляция (r = –0.56) между методом проращивания зерен и методом определения ЧП.
Изучение содержания и активности α-амилазы “позднего созревания” (late maturity α-amylase, LMA) является относительно новой областью исследований и связано с несвоевременным синтезом α-амилазы на средних стадиях развития зерна, генетическими дефектами, которые приводят к уменьшению ЧП и ухудшению качества зерна [41, 61, 66]; мука, полученная из такого зерна, имеет невысокую загущающую способность и считается непригодной для выпечки хлебобулочных изделий [67]. Кроме того, такая мука имеет не только плохую текстуру, но и происходит ее чрезмерное окрашивание во время выпечки [66]. Для α-амилазы были выявлены три изофермента (α-амилаза-1; α-амилаза-2; α-амилаза-3), которые влияют на предуборочное прорастание зерна [2, 68]. В работе Жанга и Ли указывается, что α-амилаза пшеницы состоит из четырех подсемейств, обозначаемых amy1, amy2, amy3 и amy4 [69]. Изоферменты α-амилазы контролируются семействами генов a-Amy1 и α-Amy2, расположенными в хромосомах 6-й и 7-й гомеологических групп соответственно [70–72]. При оценке относительных профилей экспрессии генов было показано, что пик α-Amy2 приходится на начальные стадии развития зерна, а уровень a-Amy1 повышается при созревании зерна. Кроме того, авторы отмечают, что относительная экспрессия гена a-Amy1 была выше у сортов неустойчивых к предуборочному прорастанию зерна по сравнению с устойчивыми по данному признаку сортами [72]. Механизм действия α‑амилазы заключается в расщеплении альфа 1–4 гликозидных связей повторяющихся глюкозных единиц крахмала, тем самым данный фермент разбивает молекулу крахмала на более мелкие единицы [35, 73]. Экспрессия α-амилазы строго контролируется фитогормонами – АБК и ГК [1, 69].
Для измерения α-амилазной активности в зерне на настоящий момент применяются различные методики [74, 75]. В последние годы очень часто исследователями используется метод Цералпха (Ceralpha method, AACC Method 22-02.01), который применяется для измерения активности α‑амилазы из неочищенных экстрактов цельномолотых семян [76, 77]. В ходе этой процедуры в качестве субстрата используются определенный олигосахарид – блокированный п-нитрофенилмальтогептаозид (BPNPG7) и избыточный уровень термостабильной α-глюкозидазы. П-нитрофенилмальтогептаозид за счет эндоактивации α‑амилазы, а затем α-глюкозидазы расщепляется до глюкозы и свободного п-нитрофенола. Далее реакция останавливается добавлением слабощелочного раствора и измеряется оптическая плотность при 400 нм, активность α-амилазы при этом измеряется в единицах цералпха. Одна единица цералпха определяется как количество фермента, необходимого для образования одного микромоля п-нитрофенола из BPNPG7 за одну минуту при условии наличия избытка термостабильной α-глюкозидазы [78]. Необходимо отметить, что метод Цералпха имеет ряд ограничений. Процедура требует определенного, одинакового для всех образцов, времени инкубации с BPNPG7 – 20 мин, и поскольку п-нитрофенол нестабилен, измерение показателя на спектрофотометре должно быть проведено в течение последующих двух часов. При большом количестве α-амилаз п‑нитрофенол становится сильно концентрированным, тогда его необходимо перед измерением разбавлять, при его малой концентрации также существует вероятность большой погрешности измерения [35].
Помимо метода Цералпха существует колориметрическая методика определения α-амилазной активности с использованием таблеток Пхадедас (Phadedas tablets), субстрат которых представляет собой нерастворимый в воде сшитый полимер крахмала, несущий в себе синий краситель. Данный субстрат гидролизуется α-амилазой с образованием водорастворимых синих фрагментов и измеряется оптическая плотность раствора [75, 79–81]. Другими способами оценки α-амилазной активности в образцах зерновых является использование приборов амилографа и миксолаба [74, 82–84], а также применение крахмально-йодометрического метода [75, 77].
Молекулярно-генетические методы
К числу современных методов исследования устойчивости к предуборочному прорастанию зерна относятся молекулярно-генетические методы исследования [1, 7, 35, 85–89], которые базируются, во-первых, на идентификации генов и генетических локусов, контролирующих данный признак, и, во-вторых, на подбор маркеров к этим генам и локусам для дальнейшего их использования в маркер-ориентированной селекции.
Идентификация генетических локусов, определяющих устойчивость к предуборочному прорастанию зерна. Известно, что отдельные локусы, которые контролируют количественный признак, называются полигенами или локусами количественных признаков QTL (quantitative trait loci) [90]. В последние годы для обнаружения и подтверждения QTL и генов к различным признакам, характеризующим предуборочное прорастание зерна, проводятся полногеномные ассоциативные исследования (Genome-wide association studies, GWAS) [43]. QTL, отвечающие за период покоя и предуборочное прорастание зерна, были обнаружены почти на всех хромосомах (1A, 1B, 2A, 2B, 2D, 3A, 3B, 3D, 4A, 4B, 5B, 5D, 6A, 6B, 6D, 7A, 7B и 7D) [2]. В одной из работ сообщается, что насчитывается порядка 250 QTL, которые связаны с предуборочным прорастанием у пшеницы (Triticum aestivum L.) [88]. В настоящий момент требуются уточнение количества и участков локализации QTL на хромосомах, а также более детальный анализ структуры, функции и механизмов регуляции генов, входящих в состав генетических локусов, определяющих устойчивость к предуборочному прорастанию зерна [2, 5, 35]. В то же время следует отметить, что главный QTL, обозначенный как Qphs.ocs.1, Phs, Phs1 или Phs-A1, локализован на хромосоме 4А и контролирует порядка 40% фенотипических вариаций устойчивости к предуборочному прорастанию зерна (pre-harvest sprouting – PHS) у пшеницы [91–93]. Впоследствии методом позиционного клонирования в данном локусе был выделен ген-кандидат ‒TaMKK3-A (митоген-активированная протеинкиназа 3), влияние которого на продолжительность покоя зерна было подтверждено на популяции от скрещивания линий, различающихся по наличию указанного гена и устойчивости к прорастанию зерна на корню [5, 94].
Несколько локусов, контролирующих состояние покоя зерна, было выявлено на длинном плече третьей гомеологичной группы хромосом. Так, на хромосоме 3DL с использованием Aegilops tauschii–Triticum aestivum замещенных линий выявлено три локуса, контролирующих состояние покоя зерна (dormancy), QDor.3D.1, QDor.3D.2 и QDor.3D.3 [53]. Ранее Кулвал с соавт. установили, что два стабильных и важных QTL находятся в непосредственной близости от генов, участвующих в контроле состояния покоя, на хромосомах 3BL и 3DL, а третий QTL – на хромосоме 3B, в непосредственной близости от генов красной окраски зерна, которая, как известно, способствует устойчивости к прорастанию зерна на корню [60].
Влияние генов, локализованных на длинном плече третьей гомеологичной группы хромосом, на состояние покоя зерна и его прорастание также подтверждено и другими исследованиями. Так, например, ген Viviparous-1 (Vp-1) является одним из важных регуляторов позднего эмбриогенеза у мягкой пшеницы. Транскрипционный фактор Vp-1 функционирует как активатор для генов, участвующих в созревании зерна, а также подавляет транскрипцию генов, необходимых для прорастания зерна и выхода из состояния покоя, в частности α-амилазы [95–97]. Три гомеологичных гена Vp-1 пшеницы (Vp-1A, Vp-1B, Vp-1D) расположены на длинном плече хромосом 3A, 3B и 3D соответственно. Для каждого гена идентифицировано несколько аллельных вариантов [2, 16, 98, 99]. Показано, что аллели Vp-1Ab и Vp-1Ad распределены в генотипах пшеницы, имеющих более “глубокий” период покоя семян, индекс прорастания которых был равен 0.19–0.26, и имевших повышенную устойчивость к предуборочному прорастанию зерна [99]. Напротив, у аллельного варианта Vp-1Ba наблюдались слабый период покоя семян и восприимчивость к предуборочному прорастанию зерна [98]. Также было обнаружено, что гены Vp-1 регулируются через некоторые другие гены, которые принимают участие в созревании зародышей зерна, покое зерна и его прорастании [2]. Регуляторный элемент – ABRE (abscisic acid responsive element), чувствительный к дегидратации элемент-связывающий фактор – DREB (dehydration responsive element binding protein), гомолог вирусного онкогена миелобластоза птиц v-myb – MYB (v-myb avian myeloblastosis viral oncogene homolog), гиббереллин-отвечающий элемент – GARE (gibberellin responding element) и четыре элемента в промоторных последовательностях Vp-1B вовлечены в регуляцию как состояния покоя зерна, так и его прорастания [2, 100].
Показано, что для более устойчивых на корню краснозерных сортов мягкой пшеницы, по сравнению с белозерными сортами, характерно присутствие доминантных аллелей генов R [101, 102], которые локализованы на длинном плече третьей группы гомеологичных хромосом, на расстоянии 30 сМ от Vp-1 локуса [1, 102, 103]. В недавнем исследовании Мареса и Хими было установлено, что ген R, контролирующий цвет в гене Tamyb10-A1b у красной пшеницы, является транскрипционным фактором Tamyb10 [104]. Мутация Tamyb10-A1 приводит к появлению белой оболочки зерна и снижению периода покоя, выходом из состояния покоя во время созревания зерна. Транскрипционные факторы Myb-типа – Tamyb10-1 – контролируют биосинтез антоцианов и красный пигмент зерна пшеницы посредством активации структурных генов, которые кодируют халконсинтазу, халконизомеразу, флаванон-3-гидроксилазу, дигидрофлаванол-4-редуктазу, участвующие в биосинтезе флавоноидов [8].
Отмечено, что температура во время развития и созревания семян сильно влияет на период покоя семян у пшеницы (Triticum aestivum L.), при этом более низкие температуры приводят к более высокому уровню покоя семян. Клонированы и охарактеризованы гены пшеницы, участвующие в этом процессе, гомологи MFT (MOTHER OF FT AND TFL1), входящие в состав локуса количественного признака пшеницы (Qphs.pseru-3AS) на коротком плече хромосомы 3A [34, 105, 106].
Клонированы гены TaSdr-A1, TaSdr-B1, являющиеся ортологами гену риса OsSdr, контролирующему состояние покоя семян. Гены TaSdr-A1 и TaSdr-B1 локализуются на хромосомах 2А и 2В соответственно, в районе QTL, вклад которого в проявление устойчивости к предуборочному прорастанию зерна оценивается как 6–8% [107, 108].
ДНК-маркеры к генам, влияющим на устойчивость к прорастанию зерна на корню, или к районам их локализации. Использование молекулярно-генетических методов для изучения хозяйственно ценных признаков сопровождается разработкой ДНК-маркеров, которые могут быть использованы для генотипирования сортов мягкой пшеницы по генам, определяющим устойчивость к предуборочному прорастанию зерна, и создания устойчивых к прорастанию сортов методом маркер-ориентированной селекции. Для маркирования генов и локусов количественных признаков, влияющих на предуборочное прорастание зерна, используются следующие маркеры: SNP (single-nucleotide polymorphism) – однонуклеотидные полиморфные маркеры и разработанные на их основе KASP (Kompetitive allele-specific PCR) маркеры; SSR (simple sequence repeats) – маркеры на основе простых повторяющихся последовательностей ДНК (микросателлитов); STS (sequence tagged site) – сайт/локус, маркированный нуклеотидной последовательностью; CAPS (cleaved amplified polymorphic sequences) – амплифицированные последовательности ДНК после обработки рестриктазой [53, 86, 91–94, 106, 108–122] (табл. 1).
Таблица 1.
Характеристика маркеров к генам, определяющим предуборочное прорастание зерна у пшеницы
| Признак | Ген/QTL/(хромосома) | Тип маркера |
Маркер | Ссылка |
|---|---|---|---|---|
| Состояние покоя; устойчивость к предуборочному прорастанию зерна |
Vp-1Bb, Vp-1Bc (3BL) | STS | Vp1B3 (Vp-1B3F/R)* | [110] |
| TaVp-1A (3A), TaVp-1D (3D) | STS | Vp1A3 | [111] | |
| /QTL/(4A) | SSR | Wmc513, wmc048, gwm397, gwm269, barc170, wmc468, gwm258, wmc161, wmc262 Gwm610, wmc048, gwm397, gwm269, barc170, wmc468, wmc258, wmc161, barc347, wmc262 |
[91] [92] |
|
| /QPhs.dpivic.4A.1, QPhs.dpivic.4A.2/(4A) | SSR | Xgwm937, Xgwm894 | [93] | |
| /QTL/(4A) | SSR | Xbarc170, Xgwm397 | [112] | |
| /QTL/(4A) | SSR | Xhbe03, Xgwm637, Xgwm397 | [92] [113] |
|
| /QTL/(4A) | STMS | Xwmc468 Wmc104 |
[113] [114] |
|
| /QTL/(3A) | SSR | Xgwm155 | [114] | |
| Устойчивость к предуборочному прорастанию зерна | TaPHS1(3A) | SNP | TaPHS1-SNP1** | [115] |
| TaSdr-A1(2A) | CAPS | Sdr2A | [116] | |
| /QDor.3D.1, QDor.3D.2, QDor.3D.3/(3DL) | SSR | Xgpw5094, xcfd152, xcfd223, xgwm383b | [53] | |
| KASP | A007500, A009175, A009353, A009352, A009177, A009711, A009180, A009715, A009725, A009716 | |||
| /QTL/(3B, 4A, 7B, 7D) | KASP | Kasp3B_wsnp_Ku_rep_c72700_72370664, Kasp3B_RAC875_rep_c116515_181, Kasp3B_BobWhite_rep_c64944_264, Kasp3B_wsnp_Ex_c16378_24870688, Kasp3B_RAC875_c530_354, Kasp4A_BS00072025_51, Kasp4A_Kukri_c12563_52, Kasp4A_RAC875_c21369_425, Kasp4A_wsnp_Ex_c16175_24619793, Kasp7B_wsnp_Ex_c908_1754208, Kasp7B_RFL_Contig124_558, Kasp7B_RAC875_c1638_165, Kasp7B_wsnp_Ex_rep_c69639_68590556, Kasp7B_Ku_c32389_1009, Kasp7D_Excalibur_c22419_460, Kasp7D_RAC875_c1829_321, Kasp7D_Kukri_c32845_116, Kasp7D_wsnp_CAP8_rep_c9647_4198594 |
[86] | |
| Vp-1B(3BL) | SSR | Vp1-b2 | [117] | |
| Состояние покоя | Tamyb10-D1(3D) | STS | Tamyb10D | [118] |
Так, для маркирования QTL (QDor.3D.1, QDor.3D.2 и QDor.3D.3) у растений популяции F2 от скрещивания мягкой пшеницы с Aegilops tauschii–Triticum aestivum замещенной линией были использованы 4 SSR-маркера и 10 маркеров KASP [53]. QTL на хромосоме 4AL, влияющий как на длительный период покоя семян, так и на повышенную устойчивость к предуборочному прорастанию, эффективно маркируется фланкирующими SSR-маркерами (Xbarc170 и Xgwm397) [112]. Для определения устойчивости к предуборочному прорастанию зерна у различных сортов и анализа аллельных вариаций по гену Vp-1 были использованы STS-маркеры Vp1B3 и MST101, SSR-маркеры Vp1-b2, Xgwm937, Xgwm894 и Xgwm155, Xgwm397, STMS-маркеры Xwmc468 и wmc104 [2, 94, 110, 113, 114, 117, 119, 123–125]. Ванг с соавт. разработали маркер STS Tamyb10D для гена Tamyb10-D1, который может быть использован для оценки состояния покоя у генотипов мягкой пшеницы [118].
Десять лет назад практическое применение молекулярных маркеров для создания коммерческих сортов пшеницы имело ограниченный характер [126]. Необходимо учитывать, что из-за большого количества QTL и генетической изменчивости структуры сортов, используемых в селекционных центрах из различных агроэкологических районов, разработанные маркеры к генам, определяющим устойчивость к прорастанию на корню, часто полезны только для тех сортов, которые использовались для подбора и разработки маркеров. Помимо этого при выявлении различий по устойчивости к предуборочному прорастанию зерна у сортов пшеницы в полевых условиях необходимо учитывать климатический прогноз. Так, засуха при наливе зерновых увеличивает период покоя, поэтому для выявления корректных генетических различий на предмет устойчивости к предуборочному прорастанию необходимо избегать засухи в этот период [13].
Следует отметить, что без применения комплекса современных методов оценки фенотипа и генотипа у сельскохозяйственных культур невозможно проводить высокопроизводительный отбор сортов по заданным хозяйственно ценным признакам. Как отмечено выше, прорастание зерна на корню может приводить к снижению урожая и экономическим потерям. Обзор литературных данных указывает на то, что в настоящий момент есть физиолого-биохимические и генетические подходы, которые требуют дальнейшего совершенствования с целью создания эффективных инструментов отбора сортов зерновых культур, устойчивых к предуборочному прорастанию зерна.
Исследование выполнено за счет гранта Российского научного фонда (проект № 21-76-30003).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Singh C., Kamble U.R., Gupta V. et al. Pre-harvest sprouting in wheat: current status and future prospects // J. Cereal Research. 2021. V. 13. P. 1–22. https://doi.org/10.25174/2582-2675/2021/114484
Gao X., Hu C.H., Li H.Z. et al. Factors affecting pre-harvest sprouting resistance in wheat (Triticum aestivum L.): a review // J. Anim. Plant Sci. 2013. V. 23. № 2. P. 556–565.
Kocheshkova A.A., Kroupin P.Y., Bazhenov M.S. et al. Pre-harvest sprouting resistance and haplotype variation of ThVp-1 gene in the collection of wheat-wheatgrass hybrids // PLoS One. 2017. V. 12. № 11. P. e0188049. https://doi.org/10.1371/journal.pone.0188049
Домаш В.И., Иванов О.А., Гордей И.А. и др. Роль гидролитических ферментов в устойчивости злаковых культур к прорастанию зерна в колосе // Изв. Национ. академии наук Беларуси. Серия биол. наук. 2017. № 1. С. 77–83.
Nakamura S. Grain dormancy genes responsible for preventing pre-harvest sprouting in barley and wheat // Breed. Sci. 2018. V. 68. P. 295–304. https://doi.org/10.1270/jsbbs.17138
Olaerts H., Courtin C.M. Impact of preharvest sprouting on endogenous hydrolases and technological quality of wheat and bread: A review // Comprehensive Reviews in Food Science and Food Safety. 2018. V. 17. № 3. P. 698–713.
Vetch J.M., Stougaard R.N., Martin J.M., Giroux M.J. Review: Revealing the genetic mechanisms of pre-harvest sprouting in hexaploid wheat (Triticum aestivum L.) // Plant Sci. 2019. V. 281. P. 180–185. https://doi.org/10.1016/j.plantsci.2019.01.004
Ali A., Cao J., Jiang H. et al. Unraveling molecular and genetic studies of wheat (Triticum aestivum L.) resistance against factors causing pre-harvest sprouting // Agronomy. 2019. V. 9. № 3. P. 117. https://doi.org/10.3390/agronomy9030117
Nonogaki H., Barrero J.M., Li C. Editorial: Seed dormancy, germination, and pre-harvest sprouting // Frontiers in Plant Science. 2018. V. 9. № 1783. https://doi.org/10.3389/fpls.2018.01783
Reddy L.V., Metzger R.J., Ching T.M. Effect of temperature on seed dormancy of wheat // Crop Sci. 1985. V. 25. № 3. P. 455–458. https://doi.org/10.2135/cropsci1985.0011183X00250-0030007x
Smith G., Gooding M. Models of wheat grain quality considering climate, cultivar and nitrogen effects // Agricultural and Forest Meteorology. 1999. V. 94. № 3–4. P. 159–170. https://doi.org/10.1016/s0168-1923(99)00020-9
Крупнова О.В. О сопоставлении качества зерна яровой и озимой пшеницы в связи с делением на рыночные классы (обзор) // С.-х. биология. 2013. Т. 48. № 1. С. 15–25.
Biddulph T.B., Mares D.J., Plummer J.A., Setter T.L. Drought and high temperature increases pre-harvest sprouting tolerance in a genotype without grain dormancy // Euphytica. 2005. V. 143. P. 277–283. https://doi.org/10.1007/s10681-005-7882-0
Himi E., Mares D.J., Yanagisawa A., Noda K. Effect of grain colour gene (R) on grain dormancy and sensitivity of the embryo to abscisic acid (ABA) in wheat // J. Exp. Bot. 2002. V. 53. № 374. P. 1569–1574. https://doi.org/10.1093/jxb/erf005
Jacobsen J.V., Pearce D.W., Poole A.T. et al. Abscisic acid, phaseic acid and gibberellin contents associated with dormancy and germination in barley // Physiol. Plant. 2002. V. 115. № 3. P. 428–441. https://doi.org/10.1034/j.1399-3054.2002.1150313.x
Yang Y., Zhang C.L., Chen X.M. et al. Identification of wheat genotypes with preharvest sprouting tolerance by combinated analysis of spike germination rate, germination index and molecular marker Vp1B3 // J. Triticeae Crops. 2007. V. 27. P. 577–582.
Linkies A., Leubner-Metzger G. Beyond gibberellins and abscisic acid: How ethylene and jasmonates control seed germination // Plant Cell Rep. 2012. V. 31. P. 253–270. https://doi.org/10.1007/s00299-011-1180-1
Barrero J.M., Mrva K., Talbot M.J. et al. Genetic, hormonal and physiological analysis of late maturity alpha-amylase (LMA) in wheat // Plant Physiol. 2013. V. 161. P. 1265–1277. https://dx.doi.org/10.1104%2Fpp.112.209502
Liu A., Gao F., Kanno Y. et al. Regulation of wheat seed dormancy by after-ripening is mediated by specific transcriptional switches that induce changes in seed hormone metabolism and signaling // PLoS One. 2013. V. 8. № 2. P. e56570. https://doi.org/10.1371/journal.pone.0056570
Chitnis V.R., Gao F., Yao Z. et al. After-ripening induced transcriptional changes of hormonal genes in wheat seeds: The cases of brassinosteroids, ethylene, cytokinin and salicylic acid // PLoS One. 2014. V. 9. № 1. P. e87543. https://doi.org/10.1371/journal.pone.0087543
Shu K., Liu X.D., Xie Q., He Z.H. Two faces of one seed: Hormonal regulation of dormancy and germination // Mol. Plant. 2016. V. 9. №. 1. P. 34–45. https://doi.org/10.1016/j.molp.2015.08.010
Kucera B., Cohn M.A., Leubner-Metzger G. Plant hormone interactions during seed dormancy release and germination // Seed Sci. Res. 2005. V. 15. P. 281–307. https://doi.org/10.1079/SSR2005218
Kermode A.R. Role of abscisic acid in seed dormancy // J. Plant Growth Regul. 2005. V. 24. P. 319–344. https://doi.org/10.1007/s00344-005-0110-2
Chono M., Matsunaka H., Seki M. et al. Isolation of a wheat (Triticum aestivum L.) mutant in ABA8'-hydroxylase gene: Effect of reduced ABA catabolism on germination inhibition under field condition // Breeding Science. 2013. V. 63. № 1. P. 104–115. https://dx.doi.org/10.1270%2Fjsbbs.63.104
Okamoto M., Kuwahara A., Seo M. et al. CYP707A1 and CYP707A2, which encode abscisic acid 8′-hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis // Plant Physiol. 2006. V. 141. № 1. P. 97–107. https://doi.org/10.1104/pp.106.079475
Nambara E., Okamoto M., Tatematsu K. et al. Abscisic acid and the control of seed dormancy and germination // Seed Sci. Res. 2010. V. 20. P. 55–67. https://doi.org/10.1017/S0960258510000012
King R.W. Abscisic acid in seed development // The Physiology and Biochemistry of Seed Development, Dormancy and Germination / Ed. Khan A.A. Amsterdam: Elsevier Biomedical Press, 1982. P. 157–181.
Walker-Simmons M. ABA levels and sensitivity in developing wheat embryos of sprouting resistant and susceptible cultivars // Plant Physiol. 1987. V. 84. № 1. P. 61–66. https://dx.doi.org/10.1104%2Fpp.84.1.61
Suzuki T., Matsuura T., Kawakami N., Noda K. Accumulation and leakage of abscisic acid during embryo development and seed dormancy in wheat // Plant Growth Regul. 2000. V. 30. P. 253–260. https://doi.org/10.1023/A:1006320614530
van de Velde K., Chandler P.M., van der Straeten D., Rohde A. Differential coupling of gibberellin responses by Rht-B1c suppressor alleles and Rht-B1b in wheat highlights a unique role for the DELLA N-terminus in dormancy // J. Experim. Botany. 2017. V. 68. № 3. P. 443–455. https://doi.org/10.1093/jxb/erw471
Ramaih S., Guedira M., Paulsen G.M. Relationship of indoleacetic acid and tryptophan to dormancy and preharvest sprouting of wheat // Funct. Plant Biol. 2003. V. 30. № 9. P. 939–945. https://doi.org/10.1071/FP03113
Caliskan M., Cuming A.C. Spatial specificity of H2O2-generating oxalate oxidase gene expression during wheat embryo germination // Plant J. 1998. V. 15. № 2. P. 165–171. https://doi.org/10.1046/j.1365-313x.1998.00191.x
Bykova N.V., Hoehn B., Rampitsch C. et al. Thiol redox-sensitive seed proteome in dormant and non dormant genotypes of wheat // Phytochemistry. 2011. V. 72. № 10. P. 1162–1172. https://doi.org/10.1016/j.phytochem.2010.12.021
Graeber K.A.I., Nakabayashi K., Miatton E. et al. Molecular mechanisms of seed dormancy // Plant Cell Environ. 2012. V. 35. № 10. P. 1769–1786. https://doi.org/10.1111/j.1365-3040.2012.02542.x
Patwa N., Penning B.W. Environmental impact on cereal crop grain damage from pre-harvest sprouting and late maturity alpha-amylase // Sustainable Agriculture in the Era of Climate Change. 2020. P. 23–41. https://doi.org/10.1007/978-3-030-45669-6_2
Skerritt J.H., Heywood R.H. A five-minute field test for on-farm detection of pre-harvest sprouting in wheat // Crop Science. 2000. V. 40. № 3. P. 742–756. https://doi.org/10.2135/cropsci2000.403742x
Gavazza M.I.A., Bassoi M.C., de Carvalho T.C. et al. Methods for assessment of pre-harvest sprouting in wheat cultivars // Pesquisa Agropecuária Brasileira. 2012. V. 47. № 7. P. 928–933. https://doi.org/10.1590/S0100-204X2012000700008
Рубец В.С., Нгуен Т.Т.Л., Пыльнев В.В. Система селекционной оценки устойчивости озимой тритикале к прорастанию на корню // Изв. ТСХА. 2012. № 1. С. 132–141.
King R.W., von Wettstein-Knowles P. Epicuticular waxes and regulation of ear wetting and pre-harvest sprouting in barley and wheat // Euphytica. 2000. V. 112. P. 157–166. https://doi.org/10.1023/A:1003832031695
Ram M.S., Dowell F.E., Seitz L., Lookhart G. Development of standard procedures for a simple, rapid test to determine wheat color class // Cereal Chem. 2002. V. 79. № 2. P. 230–237. https://doi.org/10.1094/CCHEM.2002.79.2.230
Mares D.J., Mrva K. Wheat grain preharvest sprouting and late maturity alpha-amylase // Planta. 2014. V. 240. P. 1167–1178. https://doi.org/10.1007/s00425-014-2172-5
Lang J., Fu Y., Zhou Y. et al. Myb10-D confers PHS-3D resistance to pre-harvest sprouting by regulating NCED in ABA biosynthesis pathway of wheat // New Phytologist. 2021. V. 230. P. 1940–1952. https://doi.org/10.1111/nph.17312
Lin M., Zhang D., Liu S. et al. Genome-wide association analysis on pre-harvest sprouting resistance and grain color in U.S. winter wheat // BMC Genomics. 2016. V. 17. P. 794. https://doi.org/10.1186/s12864-016-3148-6
Gfeller F., Svejda F. Inheritance of post-harvest seed dormancy and kernel colour in spring wheat lines // Can. J. Plant Sci. 1960. V. 40. № 1. P. 1–6. https://doi.org/10.4141/cjps60-001
De Pauw R.M., McCaig T.N. Recombining dormancy and white seed color in a spring wheat cross // Can. J. Plant Sci. 1983. V. 63. № 3. P. 581–589. https://doi.org/10.4141/cjps83-074
He Z.T., Chen X.L., Han Y.P. Progress on preharvest sprouting resistance in white // J. Triticeae Crops. 2000. V. 20. № 2. P. 84–87.
McEwan J.M. The sprouting reaction of stocks with single genes for red grain colour derived from hilgendorf 61 wheat // Cereal Res. Communications. 1980. V. 8. № 1. P. 261–264.
Warner R.L., Kudrna D.A., Spaeth S.C., Jones S.S. Dormancy in white-grain mutations of Chinese Spring wheat (Triticum aestivum L.) // Seed Sci. Res. 2000. V. 10. № 1. P. 51–60. https://doi.org/10.1017/S0960258500000064
Groos C., Gay G., Perretant M.R. et al. Study of the relationship between pre-harvest sprouting and grain color by quantitative trait loci analysis in a whitexred grain bread-wheat cross // Theor. Appl. Genet. 2002. V. 104. № 1. P. 39–47. https://doi.org/10.1007/s001220200004
King R.W. Physiology of sprouting resistance // Pre-Harvest Field Sprouting in Cereals / Ed. Derera N.F. CRC Press Inc, Boca Raton, 1989. P. 27–60.
Ji T., Penning B., Baik B.K. Pre-harvest sprouting resistance of soft winter wheat varieties and associated grain characteristics // J. Cereal Science. 2018. V. 83. P. 110–115. https://doi.org/10.1016/j.jcs.2018.08.006
Gerjets T., Scholefield D., Foulkes M.J. et al. An analysis of dormancy, ABA responsiveness, after-ripening and pre-harvest sprouting in hexaploid wheat (Triticum aestivum L.) caryopses // J. Experim. Botany. 2010. V. 61. № 2. P. 597–607.
He J., Zhang D., Chen X. et al. Identification of QTLs and a candidate gene for reducing pre-harvest sprouting in Aegilops tauschii–Triticum aestivum chromosome segment substitution lines // Int. J. Mol. Sci. 2021. V. 22. P. 3729. https://doi.org/10.3390/ijms22073729
Lan X.J., Wei Y.M., Liu D.C. et al. Inheritance of seed dormancy in Tibetan semiwild wheat accession Q1028 // J. Applied Genet. 2005. V. 46. № 2. P. 133–138.
Sun Y.W., Jones H.D., Yang Y. et al. Haplotype analysis of viviparous-1 gene in CIMMYT elite bread wheat germplasm // Euphytica. 2012. V. 186. P. 25–43. https://doi.org/10.1007/s10681-011-0482-2
Баженов М.С., Дивашук М.Г., Пыльнев В.В. и др. Изучение образцов озимой тритикале на наличие хромосомных замещений и их связь с устойчивостью к прорастанию на корню // Изв. ТСХА. 2011. № 2. С. 20–26.
Biddulph T.B., Plummer J.A., Setter T.L., Mares D.J. Seasonal conditions influence dormancy and preharvest sprouting tolerance of wheat (Triticum aestivum L.) in the field // Field Crops Res. 2008. V. 107. № 2. P. 116–128. https://doi.org/10.1016/j.fcr.2008.01.003
Walker-Simmons M. Enhancement of ABA responsiveness in wheat embryos by high temperature // Plant Cell Environ. 1988. V. 11. № 8. P. 769–775. https://doi.org/10.1111/j.1365-3040.1988.tb01161.x
Hagemann M.G., Ciha A.J. Evaluation of methods used in testing winter wheat susceptibility to preharvest sprouting // Crop Sci. 1984. V. 24. № 2. P. 249–254. https://doi.org/10.2135/cropsci1984.0011183X00240-0020010x
Kulwal P.L., Mir R.R., Kumar S., Gupta P.K. QTL analysis and molecular breeding for seed dormancy and pre-harvest sprouting tolerance in bread wheat // J. Plant Biol. 2010. V. 37. № 1. P. 59–74.
Perten H. Application of the falling number method for evaluating α-amylase activity // Cereal Chemistry. 1964. V. 41. № 3. P. 127–140.
Hagberg S. A rapid method for determining alpha-amylase activity // Cereal Chem. 1960. V. 37. P. 218.
Martinez S.A., Godoy J., Huang M. et al. Genome-wide association mapping for tolerance to pre-harvest sprouting and low falling numbers in wheat // Front. Plant Sci. 2018. V. 9. 141. https://doi.org/10.3389/fpls.2018.00141
Lunn G.D., Major B.J., Kettlewell P.S., Scott R.K. Mechanisms leading to excess alpha-amylase activity in wheat (Triticum aestivum L.) grain in the U.K // J. Cereal Sci. 2001. V. 33. P. 313–329. https://doi.org/10.1006/jcrs.2001.0369
Trethowan R.M. Evaluation and selection of bread wheat (Triticum aestivum L.) for preharvest sprouting tolerance // Aust. J. Agric. Res. 1995. V. 46. № 3. P. 463–474. https://doi.org/10.1071/AR9950463
Olaerts H., Vandekerckhove L., Courtin C.M. A closer look at the bread making process and the quality of bread as a function of the degree of preharvest sprouting of wheat (Triticum aestivum) // J. Cereal Science. 2018. V. 80. P. 188–197. https://doi.org/10.1016/j.jcs.2018.03.004
Kottearachchi N.S., Uchino N., Kato K., Miura H. Increased grain dormancy in white-grained wheat by introgression of preharvest sprouting tolerance QTLs // Euphytica. 2006. V. 152. P. 421–428. https://doi.org/10.1007/s10681-006-9231-3
Gale M.D., Ainsworth C.C. The relationship between α-amylase species found in developing and germinating wheat grain // Biochem. Genet. 1984. V. 22. P. 1031–1036. https://doi.org/10.1007/bf00499629
Zhang Q., Li C. Comparisons of copy number, genomic structure, and conserved motifs for α-amylase genes from barley, rice and wheat // Frontiers in Plant Sci. 2017. V. 8. 1727. https://doi.org/10.3389%2Ffpls.2017.01727
Gale M.D., Law C.N., Chojecki A.J., Kempton R.A. Genetic control of a-amylase production in wheat // Theor. Appl. Genet. 1983. V. 64. P. 309–316. https://doi.org/10.1007/bf00274170
Mrva K., Wallwork M., Mares D.J. α-Amylase and programmed cell death in aleurone of ripening wheat grains // J. Experim. Botany. 2006. V. 57. № 4. P. 877–885. https://doi.org/10.1093/jxb/erj072
Laethauwer S.D., Riek J.D., Stals I. et al. α-Amylase gene expression during kernel development in relation to pre-harvest sprouting in wheat and triticale // Acta Physiol. Plant. 2013. V. 35. P. 2927–2938. https://doi.org/10.1007/s11738-013-1323-9
van der Maarel M.J.E.C., van der Veen B., Uitdehaag J.C.M. et al. Properties and applications of starch-converting enzymes of the α-amylase family // J. Biotechnology. 2002. V. 94. № 2. P. 137–155. https://doi.org/10.1016/S0168-1656(01)00407-2
Szafrańska A. Comparison of alpha-amylase activity of wheat flour estimated by traditional and modern techniques // Acta Agrophysica. 2014. V. 21. № 4. P. 493–505.
Antoņenko K., Duma M., Kreicbergs V., Kunkulberga D. The influence of microelements selenium and copper on the rye malt amylase activity and flour technological properties // Agronomy Research. 2016. V. 14. № S2. P. 1261–1270.
Newberry M., Zwart A.B., Whan A. et al. Does late maturity alpha-amylase impact wheat baking quality // Front Plant Sci. 2018. V. 9. № 1356. https://doi.org/10.3389/fpls.2018.01356
Visvanathan R., Qader M., Jayathilake C. et al. Critical review on conventional spectroscopic α-amylase activity detection methods: Merits, demerits, and future prospects // J. Science of Food and Agriculture. 2020. V. 100. № 7. P. 2836–2847. https://doi.org/10.1002/jsfa.10315
AACC I. The approved methods of analysis // Method 22–0201 measurement of alpha-amylase in plant and microbial materials using the Ceralpha method, 11th ed. St. Paul, MN: AACC International. https://doi.org/10.1094/AACCIntMethod-22-02.01
Amylase Test. Instructions for Use. Sweden, 2021. www.phadebas.com.
Mathewson P.R., Pomeranz Y. Detection of sprouted wheat by a rapid colormetric determination of alpha-amylase // J. Association of Oficial Analytical Chemists. 1977. V. 60. № 1. P. 16–20. https://doi.org/10.1093/jaoac/60.1.16
Trethowan R.M., Pena R.J., Pfeiffer W.H. Evaluation of pre-harvest sprouting in triticale compared with wheat and rye using a line source rain gradient // Aust. J. Agric. Res. 1994. V. 45. № 1. P. 65–74. https://doi.org/10.1071/AR9940065
Ichinose Y., Kuwabara T., Hakoyama S. Germination of wheat grains at various temperatures in relation to the activities of a-amylase and endoprotease // Plant Prod. Sci. 2002. V. 5. № 2. P. 110–116. https://doi.org/10.1626/pps.5.110
Stanojeska M., Sokoloski B. Creating the correlation model at flour T-400 among Amylograph units and γ slope of Mixolab curve // J. Hygienic Engineering and Design. 2012. V. 1. P. 247–250.
Wiwart M., Szafranska A., Wachowska U., Suchowilska E. Quality parameters and rheological dough properties of fifteen spelt (Triticum spelta L.) varieties cultivated today // Cereal Chem. 2017. V. 94. № 6. P. 1037–1044. https://doi.org/10.1094/CCHEM-05-17-0097-R
Flintham J., Adlam R., Bassoi M. et al. Mapping genes for resistance to sprouting damage in wheat // Euphytica. 2002. V. 126. P. 39–45. https://doi.org/10.1023/A:1019632008244
Cabral A.L., Jordan M.C., McCartney C.A. et al. Identification of candidate genes, regions and markers for pre-harvest sprouting resistance in wheat (Triticum aestivum L.) // BMC Plant Biol. 2014. V. 14. № 340. https://doi.org/10.1186/s12870-014-0340-1
Fakthongphan J., Bai G., Amand P.S. et al. Identification of markers linked to genes for sprouting tolerance (independent of grain color) in hard white winter wheat (HWWW) // Theor. Appl. Genet. 2016. V. 129. P. 419–430. https://doi.org/10.1007/s00122-015-2636-4
Gupta P.K., Balyan H.S., Sharma S., Kumar R. Genetics of yield, abiotic stress tolerance and biofortification in wheat (Triticum aestivum L.) // Theor. Appl. Genet. 2020. V. 133. P. 1569–1602. https://doi.org/10.1007/s00122-020-03583-3
Tai L., Wang H.J., Xu X.J. et al. Pre-harvest sprouting in cereals: genetic and biochemical mechanisms // J. Experim. Botany. 2021. V. 72. № 8. P. 2857–2876. https://doi.org/10.1093/jxb/erab024
Tanksley S.D. Mapping polygenes // Annu. Rev. Genet. 1993. V. 27. P. 205–233. https://doi.org/10.1146/annurev.ge.27.120193.001225
Mares D., Mrva K., Cheong J. et al. A QTL located on chromosome 4A associated with dormancy in white- and red-grained wheats of diverse origin // Theor. Appl. Genet. 2005. V. 111. P. 1357–1364. https://doi.org/10.1007/s00122-005-0065-5
Torada A., Ikeguchi S., Koike M. Mapping and validation of PCR-based markers associated with a major QTL for seed dormancy in wheat // Euphytica. 2005. V. 143. P. 251–255. https://doi.org/10.1007/s10681-005-7872-2
Ogbonnaya F.C., Imtiaz M., Ye G. et al. Genetic and QTL analyses of seed dormancy and preharvest sprouting resistance in the wheat germplasm CN10955 // Theor. Appl. Genet. 2008. V. 116. P. 891–902. https://doi.org/10.1007/s00122-008-0712-8
Torada A., Koike M., Ogawa T. et al. Causal gene for seed dormancy on wheat chromosome 4A encodes a map kinase kinase // Current Biology. 2016. V. 26. № 6. P. 782–787. https://doi.org/10.1016/j.cub.2016.01.063
Hoecker U., Vasil I.K., McCarty D.R. Integrated control of seed maturation and germination programs by activator and repressor functions of Viviparous-1 of maize // Genes Devel. 1995. V. 9. P. 2459–2469. https://doi.org/10.1101/gad.9.20.2459
Paek N.C., Lee B.M., Bai D.G., Smith J.D. Inhibition of germination gene expression by Viviparous-1 and ABA during maize kernel development // Mol. Cells. 1998. V. 8. P. 336–342.
Wilkinson M.D., McKibbin R.S., Bailey P.C. et al. Use of comparative molecular genetics to study pre harvest sprouting in wheat // Euphytica. 2002. V. 126. P. 27–33. https://doi.org/10.1023%2FA%3A1019627807335
Chang C., Zhang H.P., Feng J.M. et al. Identifying alleles of Viviparous-1B associated with pre-harvest sprouting in micro-core collections of Chinese wheat germplasm // Mol. Breeding. 2010. V. 25. P. 481–490. https://doi.org/10.1007%2Fs11032-009-9346-z
Chang C., Zhang H.-P., Zhao Q.-X. et al. Rich allelic variations of Viviparous-1A and their associations with seed dormancy/pre-harvest sprouting of common wheat // Euphytica. 2011. V. 179. P. 343–353. https://doi.org/10.1007/s10681-011-0348-7
Sun Y.W., Nie L.N, Ma Y.Z. et al. Cloning and functional analysis of Viviparous-1 promoter in wheat // Acta. Agronomica Sinica. 2011. V. 37. № 10. P. 1743–1751. https://doi.org/10.3724/SP.J.1006.2011.01743
Flintham J.E. Different genetic components control coat-imposed and embryo-imposed dormancy in wheat // Seed Sci. Res. 2000. V. 10. № 1. P. 43–50. https://doi.org/10.1017/S0960258500000052
Santos L.T., Pinto R.J.B., Franco F.A., Schuster I. Inheritance and potential use of grain color in the identification of genotypes resistant to pre-harvest sprouting in wheat // Crop Breed Appl. Biotechnol. 2010. V. 10. № 3. P. 218–224. https://doi.org/10.1590/S1984-70332010000300006
Metzger R.J., Silbaugh B.A. Locations of genes for seed coat colour in hexaploid wheat, Triticum aestivum L. // Crop Science. 1970. V. 10. № 5. P. 495–496. https://doi.org/10.2135/cropsci1970.0011183X00100-0050012x
Mares D., Himi E. The role of TaMYB10-A1 of wheat (Triticum aestivum L.) in determining grain coat colour and dormancy phenotype // Euphytica. 2021. V. 217. № 89. https://doi.org/10.1007/s10681-021-02826-8
Nakamura S., Abe F., Kawahigashi H. et al. A wheat homolog of MOTHER OF FT AND TFL1 acts in the regulation of germination // Plant Cell. 2011. V. 23. № 9. P. 3215–3229. https://doi.org/10.1105/tpc.111.088492
Liu S., Sehgal S.K., Li J. et al. Cloning and characterization of a critical regulator for pre-harvest sprouting in wheat // Genetics. 2013. V. 195. № 1. P. 263–273. https://doi.org/10.1534/genetics.113.152330
Zhang Y., Miao X., Xia X., He Z. Cloning of seed dormancy genes (TaSdr) associated with tolerance to pre-harvest sprouting in common wheat and development of a functional marker // Theor. Appl. Genet. 2014. V. 127. P. 855–866. https://doi.org/10.1007/s00122-014-2262-6
Zhang Y., Xia X., He Z. The seed dormancy allele TaSdr-A1a associated with pre-harvest sprouting tolerance is mainly present in Chinese wheat landraces // Theor. Appl. Genet. 2017. V. 130. P. 81–89. https://doi.org/10.1007/s00122-016-2793-0
Roy J.K., Prasad M., Varshney R.K. Identification of a microsatellite on chromosomes 6B and a STS on 7D of bread wheat showing an association with pre-harvest sprouting tolerance // Theor. Appl. Genet. 1999. V. 99. P. 336–340.
Yang Y., Zhao X.L., Xia L.Q. et al. Development and validation of a Viviparous-1 STS marker for pre-harvest sprouting tolerance in Chinese wheats // Theor. Appl. Genet. 2007. V. 115. P. 971–980. https://doi.org/10.1007/s00122-007-0624-z
Yang Y., Zhang C.L., Liu S.X. et al. Characterization of the rich haplotypes of Viviparous-1A in Chinese wheats and development of a novel sequence-tagged site marker for pre-harvest sprouting resistance // Mol. Breed. 2014. V. 33. P. 75–88. https://doi.org/10.1007/s11032-013-9935-8
Chen C.X., Cai S.B., Bai G.H. A major QTL controlling seed dormancy and pre- harvest sprouting resistance on chromosome 4A in a Chinese wheat landrace // Mol. Breed. 2007. V. 21. P. 351–358. https://doi.org/10.1007/s11032-007-9135-5
Yang Y., Zhang C.L., Chen X.M. et al. Identification and validatation of molecular markers for PHS tolerance in red-grained spring wheat // J. Triticeae Crops. 2011. V. 31. № 1. P. 54–59.
Yang Y., Zhao X.L., Zhang Y. et al. Evaluation and validation of four molecular markers associated with pre-harvest sprouting tolerance in Chinese wheats // Acta. Agronomica Sinica. 2008. V. 34. P. 17–24. https://doi.org/10.3724/SP.J.1006.2008.00017
Liu S., Sehgal S.K., Li J. et al. Cloning and characterization of a critical regulator for pre-harvest sprouting in wheat // Genetics. 2013. V. 195. № 1. P. 263–273. https://doi.org/10.1534/genetics.113.152330
Zhang Y., Xia X., He Z. The seed dormancy allele TaSdr-A1a associated with pre-harvest sprouting tolerance is mainly present in Chinese wheat landraces // Theor. Appl. Genet. 2017. V. 130. P. 81–89. https://doi.org/10.1007/s00122-016-2793-0
Zhang H.P., Chang C., You G.X. et al. Identification of molecular markers associated with seed dormancy in mini core collections of Chinese wheat and landraces // Acta. Agronomica Sinica. 2010. V. 36. № 10. P. 1649–1656. https://doi.org/10.1016/S1875-2780(09)60077-8
Wang Y., Wang X.L., Meng J.Y. et al. Characterization of Tamyb10 allelic variants and development of STS marker for pre-harvest sprouting resistance in Chinese bread wheat // Mol. Breed. 2016. V. 36. № 148. https://doi.org/10.1007/s11032-016-0573-9
Xia L.Q., Yang Y., Ma Y.Z. et al. What can the Viviparous-1 gene tell us about wheat pre-harvest sprouting // Euphytica. 2009. V. 168. P. 385–394. https://doi.org/10.1007/s10681-009-9928-1
Беспалова Л.А., Васильев А.В., Аблова И.Б. и др. Применение молекулярных маркеров в селекции пшеницы в Краснодарском НИИСХ им. П.П. Лукьяненко // Вавилов. журн. генетики и селекции. 2012. Т. 16. № 1. С. 37−43.
Vanzetti L.S., Yerkovich N.Y., Chialvo E. et al. Genetic structure of Argentinean hexaploid wheat germplasm // Genet. Mol. Biol. 2013. V. 36. № 3. P. 391–399.
Rasheed A., Wen W., Gao F. et al. Development and validation of KASP assays for functional genes underpinning key economic traits in wheat // Theor. Appl. Genet. 2016. V. 129. P. 1843–1860. https://doi.org/10.1007/s00122-016-2743-x
Guo F.Z., Liang W.G., Fan Q.Q. et al. The distribution and evolution of allelic variation of Vp1B3 in Shandong Wheat // J. Triticeae Crops. 2009. V. 29. P. 575–578.
Zhao B., Wan Y.X., Wang R. Screening of wheat cultivar resources with pre-harvest sprouting resistance // J. Anhui Agric. Sci. 2010. V. 38. P. 8900–8902.
Miao X.L., Wang D.S., Xia L.Q. et al. Analysis on the mechanism of pre-harvest sprouting resistance in white-grain wheat // J. Triticeae Crops. 2011. V. 31. P. 741–746.
Леонова И.Н. Молекулярные маркеры: использование в селекции зерновых культур для идентификации, интрогрессии и пирамидирования генов // Вавилов. журн. генетики и селекции. 2013. Т. 17. № 2. С. 314–325.
Дополнительные материалы отсутствуют.


