Генетика, 2023, T. 59, № 1, стр. 18-25
nm-ТЕСТ – усовершенствованная версия альфа-теста для дрожжей Saccharomyces cerevisiae, обладающая более высокой чувствительностью по отношению к генотоксическим факторам
Е. И. Степченкова 1, 2, *, Ю. В. Андрейчук 1, Д. В. Афанасова 2, С. П. Задорский 1, 2, С. Г. Инге-Вечтомов 1, 2
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук,
Санкт-Петербургский филиал
199034 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: stepchenkova@gmail.com
Поступила в редакцию 11.01.2022
После доработки 10.03.2022
Принята к публикации 04.05.2022
- EDN: CLAKAN
- DOI: 10.31857/S0016675822120128
Аннотация
Одной из актуальных проблем генетической токсикологии является разработка новых и совершенствование существующих тест-систем для своевременного выявления и оценки уровня мутагенной и канцерогенной активности различных факторов. Особое место среди тест-систем генетической токсикологии занимает альфа-тест, основанный на использовании особенностей жизненного цикла дрожжей Saccharomyces cerevisiae. Его главное отличие от существующих тест-систем заключается в возможности выявлять широкий спектр генетических изменений, таких как генные мутации, конверсия, рекомбинация, потеря правого плеча и целой III хромосомы, а также первичные повреждения генетического материала до их устранения системами репарации. В рамках данной работы были намечены и апробированы способы генетической модификации используемых в альфа-тесте штаммов, направленные на повышение чувствительности и эффективности тест-системы. Полученные нами результаты позволили заключить, что предложенная нами модификация тестерного штамма привела к повышению разрешающей способности тест-системы на порядок.
Разработка новых методов выявления мутагенов и изучения механизмов их действия не теряет своей актуальности в связи с постоянным расширением спектра потенциальных генотоксических факторов, с которыми человек может столкнуться в повседневной жизни. Уникальное положение среди известных тест-систем занимает альфа-тест, разработанный нами ранее на модельном организме – дрожжах Saccharomyces cerevisiae и успешно применявшийся для изучения различных аспектов мутагенеза [1–7]. Отличительной особенностью альфа-теста является то, что с его помощью можно выявлять фенотипическое проявление первичных повреждений генетического материала до их устранения системами репарации, а также отличать первичные повреждения от генных или хромосомных мутаций [8]. Благодаря таким свойствам использование альфа-теста может быть весьма перспективно для первичного скрининга мутагенных факторов, а возможность выявления разных по своей природе генетических нарушений может стать полезной в фундаментальных исследованиях при изучении молекулярных механизмов мутагенеза.
При разработке альфа-теста были использованы особенности генетического контроля типа спаривания почкующихся дрожжей S. cerevisiae [9]. Жизненный цикл S. cerevisiae состоит из гаплоидной и диплоидной фаз. Гаплоидные клетки дрожжей противоположных типов спаривания (a и α) могут скрещиваться с образованием диплоидных гибридов, которые в свою очередь способны вступать в мейоз с образованием тетрады гаплоидных спор (2a : 2α). Культуры гетероталличных штаммов дрожжей сохраняют гаплоидное состояние в течение длительного времени. Напротив, гомоталличные штаммы быстро диплоидизуются, поскольку у них с высокой частотой происходит генетически детерминированное переключение типа спаривания, в результате которого в чистой культуре гомоталличного штамма дрожжей появляются клетки противоположного типа. В результате гибридизации исходных клеток и клеток, переключивших тип спаривания на противоположный, доля диплоидных клеток в культуре гомоталличного штамма быстро нарастает.
Тип спаривания дрожжевой клетки определяется локусом MAT [9]. Переключение типа спаривания у гомоталличных штаммов происходит в результате конверсии генетической информации из молчащих кассет HMRa или HMLα в локус MAT. У гомоталличных штаммов переключение типа спаривания генетически детерминировано и происходит регулярно при каждом делении благодаря активности эндонуклеазы Ho, которая вносит разрыв в определенном сайте локуса MAT и таким образом стимулирует конверсию. У гетероталличных штаммов отсутствует эндонуклеаза Ho. Поэтому у таких штаммов переключение типа спаривания может происходить в результате более редких событий: конверсии, индуцированной случайными разрывами в локусе MAT, и мутаций или повреждений генетического материала в локусе MATα [1–3].
Локус MAT может быть представлен альтернативными последовательностями – МАТа или MATα. Альтернативные варианты локуса MAT имеют разное происхождение, а их нуклеотидные последовательности существенно различаются, поэтому MATa и MATα называют идиоморфами, в отличие от аллелей, которые обычно имеют большее сходство [10]. Идиоморф MATα содержит две открытые рамки считывания – MATα1 и MATα2, экспрессия которых регулируется общим двусторонним промотором [11]. В локусе MATa также имеются две открытые рамки считывания – MATa1 и MATa2. Гены, содержащиеся в локусе MAT, кодируют транскрипционные факторы, которые регулируют экспрессию специфичных для каждого типа спаривания генов. Так, Matα1 совместно с белком Mcm1 активирует альфа-специфичные гены αsg (α-specific genes), а Matα2 в комплексе с Mcm1 является репрессором а-специфичных генов asg (a-specific genes), экспрессирующихся конститутивно [12–14]. В диплоидных клетках, в которых одновременно присутствуют MATα и МАТа, белки Matα2 и Mata1 подавляют экспрессию гаплоид-специфичных генов hsg и активируют диплоид-специфичные гены, что необходимо для споруляции, диплоидные клетки не способны к дальнейшему скрещиванию. Нарушение экспрессии одновременно обоих генов MATα1 и MATα2 в результате мутации или повреждения ведет к тому, что клетка, исходно имевшая тип спаривания α, переключает его на тип спаривания а. Мутанты, у которых отсутствует экспрессия одновременно обоих генов MATα1 и MATα2, способны скрещиваться с клетками α-типа спаривания. Гибриды от такого скрещивания имеют тип спаривания α, поэтому фенотип двойных мутантов matα1 matα2 является рецессивным. При появлении мутаций только в одном из двух генов (MATα1 или MATα2) клетки дрожжей теряют способность к спариванию и приобретают фенотип, условно обозначаемый nm (non-mating), поскольку при инактивации гена MATα2 одновременно экспрессируются как asg, так и αsg, а при инактивации MATα1 отсутствуют продукты αsg и asg.
Альфа-тест получил свое название в связи с тем, что показателем генетической активности тестируемого фактора является частота переключения типа спаривания α → а у гетероталличных штаммов дрожжей. Если какой-либо фактор приводит к статистически-значимому возрастанию частоты переключения типа спаривания α → а, то такой фактор является мутагеном. Частоту переключения типа спаривания оценивают по частоте образования “незаконных” гибридов двух штаммов α-типа спаривания. Для этого клетки двух штаммов высевают совместно на селективную среду для отбора гибридов, а затем определяют соотношение числа выросших “незаконных” гибридов к числу высеянных клеток. Эффективность альфа-теста была подтверждена в целом ряде научных исследований, кроме того были опубликованы работы, в которых альфа-тест был использован в качестве основного метода для изучения различных аспектов мутагенеза [1–7]. Опыт использования альфа-теста, накопленный к настоящему времени, позволяет наметить пути совершенствования тест-системы, которые будут способствовать повышению ее чувствительности и эффективности. Перспективным подходом к повышению чувствительности альфа-теста может стать модификация тестерного штамма путем инактивации одной из двух открытых рамок считывания локуса MATα. Мы полагаем, что использование мутанта по одному из двух генов локуса MATα в качестве тестерного штамма могло бы существенно повысить чувствительность тест-системы, поскольку в отличие от переключения типа спаривания α → а, переключение nm → a должно происходить чаще. В последнем случае для приобретения клеткой типа спаривания а необходимо появление лишь одной мутации (или первичного повреждения) во втором гене локуса MATα, а при скрещивании α × α для переключения α → а требуется осуществление двух событий, одновременно инактивирующих MATα1 и MATα2. В настоящей работе мы проверили эту гипотезу и оценили частоту переключения типа спаривания nm → a в сравнении с α → а.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы дрожжей Saccharomyces cerevisiae, среды и условия культивирования. В работе использовали штаммы дрожжей: Д926 (MATα // MATα leu2Δ // leu2Δ lys2Δ // lys2Δ ura3Δ // ura3Δ his4Δ // his4Δ thr4Δ // thr4Δ) и K5-35В-Д924 (MATα ura3Δ leu2Δ lys5::KanMX met15Δ) [15]; A-K5-35В-Д924 (matα2 ura3Δ leu2Δ lys5::kanMX met15Δ) (получен в данной работе); 78А-П2345 (MATα his5) и 2Г-П2345 (MATа his5) (Петергофская генетическая коллекция). Для внесения мутации matα2, представляющей собой замену глутаминового кодона на преждевременный стоп-кодон TАА (C37T), мы использовали метод двухшагового замещения. Для этого штамм K5-35В-Д924 трансформировали интегративной плазмидой pRS306-MATα2-STOP, несущей полноразмерный локус MATα c мутантным аллелем matα2. Перед трансформацией плазмида была гидролизована рестриктазой SpeI по сайту, находящемуся в MATα. Трансформантов отбирали на среде без урацила. Затем отобранных трансформантов высевали на среду с 5-фтороротовой кислотой (ФОК) для селекции клонов, у которых произошло выщепление плазмиды из хромосомы. Среди клонов Ura– отбирали те, которые обладали фенотипом nm, что является следствием успешного замещения аллеля MATα2 дикого типа на мутантный matα2. Полученный таким образом штамм с мутацией matα2 получил название A-K5-35В-Д924. Наличие мутации в гене MATα2 штамма A-K5-35В-Д924 подтверждали секвенированием.
Дрожжи выращивали на полных средах: жидкой и твердой среде YEPD [16, 17] и минимальной среде MD (минимальная дрожжевая среда по рецепту Yeast Nitrogen Base), содержащей необходимые аминокислоты, азотистые основания, витамины и микроэлементы [17]. Среду для отбора гибридов готовили на основе MD с добавлением урацила, гистидина, лейцина и треонина в стандартных концентрациях. Для отбора штаммов с мутацией по гену URA3 использовали минимальную среду, которая содержала 1 г/л ФОК, а также все необходимые аминокислоты в стандартной концентрации и урацил (50 мг/л). Дрожжи выращивали при температуре 30°С.
Альфа-тест. Для каждого исследуемого штамма (тестерный штамм) выращивали 10 независимых культур в жидкой среде YEPD в течение 16 ч при 30°С на качалке. При тех же условиях растили культуру штамма-партнера для скрещивания. Для проведения теста на “незаконную” гибридизацию аликвоты из каждой культуры тестерного штамма и ночной культуры штамма-партнера для скрещивания высевали совместно на селективную среду для отбора “незаконных” гибридов. Параллельно подходящие разведения клеток тестерного штамма высевали на среду YEPD для оценки выживаемости. В экспериментах с использованием УФ-излучения сначала проводили облучение клеток тестерного штамма ультрафиолетовым светом с длиной волны 264 нм на твердых селективной и полной средах, а затем к тестерному штамму на среду для отбора гибридов подсевали штамм-партнер для скрещивания Д926. Доза облучения составляла 10 Дж/м2. Чашки инкубировали трое суток при 30°С, затем подсчитывали число выросших колоний на каждой чашке. Общую частоту “незаконной” гибридизации в каждой культуре вычисляли как отношение числа колоний, выросших на среде для отбора “незаконных” гибридов, к числу колоний, выросших на полной среде, с учетом соответствующих факторов разведения.
Для каждого варианта экспериментальных условий (тестерный штамм и доза УФ) было отобрано и проверено не менее 500 “незаконных” гибридов с целью анализа их фенотипа. Для определения типа спаривания отобранные “незаконные” гибриды скрещивали с тестерными штаммами 2Г-П2345 и 78А-П2345 а и α типов спаривания соответственно. По способности “незаконных” гибридов скрещиваться с тестерными штаммами идентифицировали тип спаривания α или некопулирующий (nm). Отобранных “незаконных” гибридов распределяли по классам в соответствии с их фенотипом: типом спаривания и наличием ауксотрофностей по гистидину и треонину, являющихся маркерами левого и правого плеча хромосомы III соответственно (табл. 1). На основе полученных данных определяли частоту гибридов каждого класса.
Таблица 1.
Генетические события, выявляемые в тесте на “незаконную” гибридизацию, и фенотип соответствующих “незаконных” гибридов при использовании тестерного штамма MATα HIS4 THR4 и штамма-партнера для скрещивания MATα his4 thr4
| Генетическое событие | Фенотип “незаконного” гибрида |
|---|---|
| Конверсия кассеты HMRa в локус MATα | nm His+ Thr+ |
| Реципрокная рекомбинация между локусом МАТα и кассетой HMRa | nm His+ Thr– |
| Потеря правого плеча хромосомы III | α His+ Thr– |
| Потеря хромосомы III | α His– Thr– |
| Мутация в локусе MATα (в MATα1 или MATα2) | α His+ Thr+ |
| Мутации в MATα (одновременно в MATα1 и MATα2 или в двустороннем промоторе, делеции МАТα) | |
| Временные (первичные) повреждения в локусе MATα (одновременно в MATα1 и MATα2 или в двустороннем промоторе), устраняемые репарацией безошибочно после скрещивания |
Для попарного сравнения значений общей частоты “незаконной” гибридизации и частоты отдельных классов “незаконных” гибридов использовали непараметрические статистические методы: определяли медиану по 10 независимым измерениям и 95%-ный доверительный интервал для медианы. Верхнюю и нижнюю границы доверительного интервала определяли стандартным методом, описанным в ГОСТ Р 50779.24-2005 (https://docs.cntd.ru/document/1200039763, дата обращения 07.02.2022). Оценку статистической значимости отличий проводили с использованием непараметрического критерия Манна–Уитни.
РЕЗУЛЬТАТЫ
Для того чтобы оценить влияние мутации matα2 на эффективность теста на “незаконную” гибридизацию мы сравнили частоту и спектр генетических нарушений, выявляемых при использовании тестерного штамма matα2 и изогенного ему штамма дикого типа. При проведении тестов на “незаконную” гибридизацию мы оценивали частоту как спонтанных нарушений генетического материала, так и нарушений, индуцированных УФ-излучением. Для регистрации событий, приводящих к переключению типа спаривания nm → a и α → a, в качестве штамма-партнера для скрещивания использовали диплоидный штамм Д926, гомозиготный по MATα и маркерам хромосомы III (his4Δ и thr4Δ). Процедура проведения теста описана в разделе “Материалы и методы”.
Согласно полученным нами данным наличие мутации matα2 в геноме тестерного штамма приводит к 10-кратному увеличению общей частоты “незаконной” гибридизации, как спонтанной, так и индуцированной УФ-излучением, по сравнению со штаммом дикого типа (рис. 1).
Рис. 1.
Частота “незаконной” гибридизации в скрещивании штаммов K5-35В-Д924 (MATα2) × Д926 и А-K5-35В-Д924 (matα2) × Д926. На диаграмме с логарифмической шкалой представлены медиана и доверительный интервал (n = 10). Различия между штаммами MATα2 и matα2 статистически значимы по критерию Манна–Уитни (p-значение < 0.0001).
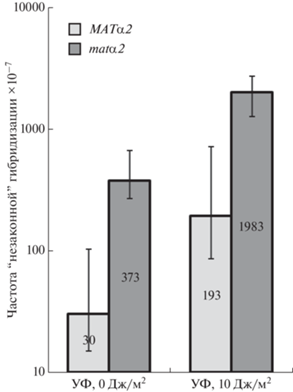
Для того чтобы выявить генетические события, за счет которых увеличивается частота “незаконной” гибридизации на фоне мутации matα2, мы проверили фенотип не менее 500 “незаконных” гибридов, возникших в скрещивании штаммов matα2 или MATα2 со штаммом-партнером для скрещивания Д926. Затем мы определили частоту всех классов событий, учитываемых в тесте на “незаконную” гибридизацию и перечисленных в табл. 1. Результаты этого анализа представлены в табл. 2. Мы показали, что частота возникновения “незаконных” гибридов фенотипического класса “мутации и первичные повреждения в локусе MATa” возрастает приблизительно в 63 раза без воздействия УФ и при облучении УФ приблизительно в 6 раз. Изменения частот остальных учитываемых в альфа-тесте генетических событий у мутанта matα2 по сравнению с wt незначительны, хотя статистически значимы: происходит небольшое (в 1.5 раза) повышение частоты конверсии кассеты HMRа в MATα, а также небольшое (по сравнению с изменениями в частоте класса “мутации и временные повреждения”) снижение частоты потери правого плеча хромосомы III и частоты рекомбинации HMRа и MATα. Полученные нами данные о влиянии мутации matα2 на общую частоту “незаконной” гибридизации и частоту отдельных классов “незаконных” гибридов соответствуют ожидаемым и укладываются в модель, согласно которой за счет временных повреждений и генных мутаций переключение типа спаривания α → a происходит реже, чем переключение типа спаривания nm → a, поскольку в первом случае необходима одновременная инактивация обоих генов локуса МАТ, а во втором случае только одного из двух генов. Частота хромосомных нарушений, учитываемых в альфа-тесте, не зависит от наличия в геноме тестерного штамма мутации в одном из генов MATα, что также соответствует ожидаемым результатам.
Таблица 2.
Частота различных генетических событий, учитываемых в альфа-тесте, при скрещивании штаммов K5-35В-Д924 (MATα2) × Д926 и А-K5-35В-Д924 (matα2) × Д926
| Штамм | УФ, Дж/м2 | Частота генетических событий, учитываемых в альфа-тесте, ×10–7 (медиана и доверительный интервал) |
||||
|---|---|---|---|---|---|---|
| мутации и первичные повреждения в локусе MATα | потеря правого плеча III хромосомы | потеря III хромосомы | конверсия кассеты HMRa в локус МАТα | рекомбинация MATα и HMRa | ||
| K5-35В-Д924 | 0 | 7.33 (5.4–12.0) |
36.2 (26.9–59.6) |
15.6 (11.5–25.6) |
1.0 (0.7–1.7) |
0.9 (0.7–1.5) |
| 10 | 105.8 (58.2–137.1) |
91.7 (50.4–118.8) |
20.2 (11.1–26.2) |
3.2 (1.8–4.3) |
8.9 (4.9–11.5) |
|
| A-K5-35В-Д924 | 0 | 463.6*** (281.5–599.9) |
26.3* (15.9–34.1) |
18 (10.9–23.3) |
5.2*** (3.2–6.8) |
0 |
| 10 | 676.5*** (478.7–955.6) |
55.1* (38.9–77.8) |
13.2 (9.3–18.6) |
5.9** (4.2–8.4) |
2.4*** (1.7–3.4) |
|
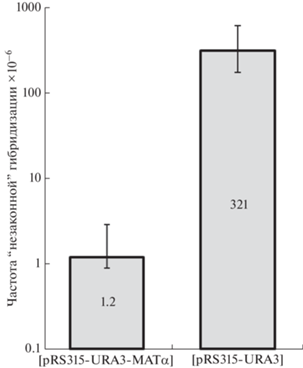
Для дополнительной проверки нашего предположения о причинах более высокой частоты гибридизации в скрещивании nm × α, чем в скрещивании α × α, мы провели дополнительный эксперимент, в котором оценили влияние дополнительной копии локуса МАТα на эффективность “незаконной” гибридизации. Мы использовали штамм K5-35B-Д924, трансформированный центромерной плазмидой pRS315-URA3-MATα, несущей полноразмерный локус МАТα. В качестве контроля использовали трансформанты штамма K5-35B-Д924, несущие вектор pRS315-URA3 без MATα. Данные, представленные на рис. 2, указывают на то, что введение дополнительной копии локуса МАТα на плазмиде значительно снижает частоту “незаконной” гибридизации (приблизительно в 155 раз). Полученные результаты подтверждают нашу гипотезу о том, что подавляющее большинство событий, приводящих к переключению типа спаривания, представляют собой изменения в локусе типа спаривания MATα.
Рис. 2.
Влияние дополнительной копии локуса MATα на частоту “незаконной” гибридизации. На диаграмме с логарифмической шкалой представлены медиана и доверительный интервал (n = 10). Различия между значениями частоты “незаконной” гибридизации статистически значимы по критерию Манна–Уитни (p-значение < 0.0001).
ОБСУЖДЕНИЕ
С целью повышения чувствительности тест-системы мы инактивировали ген MATα2 у тестерного штамма, который при проведении альфа-теста подвергается обработке мутагенными факторами и переключение типа спаривания которого служит индикатором мутагенной активности исследуемых факторов. Мы показали, что мутация matα2 в тестерном штамме на порядок повышает частоту “незаконной” гибридизации и таким образом способствует увеличению чувствительности тест-системы. Частота различных генетических событий, учитываемых в альфа-тесте, на фоне мутации matα2 изменяется неравномерно (табл. 2). Поскольку вероятность инактивации одного гена выше, чем вероятность одновременной инактивации двух генов, переключение типа спаривания nm → a происходит с большей частотой, чем α → a. Частота хромосомных нарушений, учитываемых в альфа-тесте, не зависит от наличия в геноме тестерного штамма мутации matα2, что также соответствует ожидаемым результатам. Дополнительное подтверждение данной модели мы получили при изучении влияния дополнительной копии MATα на частоту “незаконной” гибридизации. Так, мы показали, что при внесении дополнительного локуса MATα на центромерной плазмиде частота образования “незаконных” гибридов снижается приблизительно в 155 раз. Этот результат согласуется с данными, опубликованными ранее, о том, что при проведении тестов на “незаконную” гибридизацию и “незаконную” цитодукцию с использованием штаммов-дисомиков по третьей хромосоме и диплоидов, т.е. штаммов, содержащих две копии локуса МАТα, частота образования “незаконных” гибридов и цитодуктантов снижается настолько, что невозможно отобрать колонии в количестве, достаточном для определения значения частоты [3].
Таким образом, результаты, полученные нами в рамках настоящей работы, позволили выявить такие способы изменения генотипа штаммов, используемых в альфа-тесте, которые повышают чувствительность и эффективность тест-системы. Эти модификации были апробированы, а их эффективность проверена экспериментально. Использование полученного нами штамма A-K5-35В-Д924, несущего мутацию matα2, значительно повышает разрешающую способность альфа-теста в отношении генных мутаций и временных повреждений MATα. В отличие от классического варианта альфа-теста, когда скрещивают два штамма одинакового альфа-типа спаривания, в предлагаемом нами варианте тест-системы с использованием мутанта matα2 используют скрещивание стерильного штамма nm со штаммом α‑типа спаривания. В последнем варианте, который мы предлагаем назвать nm-тест, учитывают генетические нарушения, приводящие к переключению типа спаривания nm → а.
Для дальнейшего повышения чувствительности тестерного штамма перспективным может стать использование мутантов по генам различных систем репарации или генам, ответственным за биосинтез клеточной стенки, а также использование сверхэкспрессии генов ДНК-полимераз, способных осуществлять синтез на поврежденной матрице. Подобные модификации используются в тесте Эймса, являющемся “золотым стандартом” генетической токсикологии [18, 19]. Использование мутантов по генам, контролирующим структуру клеточной стенки, может увеличить чувствительность к мутагенным агентам за счет повышения ее проницаемости для химических веществ и физических факторов, а внося дефекты систем репарации и устойчивости к повреждениям ДНК, можно повысить чувствительность к факторам, вызывающим повреждения ДНК или генные мутации.
Авторы благодарны ресурсному центру СПбГУ “Развитие молекулярных и клеточных технологий” за содействие в проведении исследования.
Работа выполнена при поддержке гранта РФФИ № 20-04-00663.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Inge-Vechtomov S.G., Pavlov Y.I., Noskov V.N. et al. Tests for genetic activity in the yeast Saccharomyces cerevisiae: Study of forward and reverse mutation, mitotic recombination and illegitimate mating induction // Progress in Mutation Research. Evaluation of short-term tests for carcinogens: Report of the International Programme on Chemical Safety’s collaborative study on in vitro assays. Amsterdam: The Netherlands Elsevier, 1985. P. 243–255.
Инге-Вечтомов С.Г., Репневская М.В., Карпова Т.С. Изучение скрещивания клеток одинакового типа спаривания у дрожжей сахаромицетов // Генетика. 1986. Т. 22. № 11. С. 2625–2636.
Репневская М.В. Наследуемые и ненаследуемые изменения типа спаривания у дрожжей Saccharomyces cerevisiae: Дис. … канд. биол. наук., Л.: ЛГУ, 1989. 210 с.
Lemoine F.J., Degtyareva N.P., Lobachev K., Petes T.D. Chromosomal translocations in yeast induced by low levels of DNA polymerase: A model for chromosome fragile sites // Cell. 2005. V. 120. P. 587–598. https://doi.org/10.1134/S000629791101007X
Kochenova O.V., Soshkina Y.V., Stepchenkova E.I. et al. Participation of translesion synthesis DNA polymerases in the maintenance of the chromosome integrity in yeast Saccharomyces cerevisiae // Biochemistry (Moscow). 2011. V. 76. № 1. P. 49–60. https://doi.org/10.1134/S000629791101007X
Novoa C.A., Ang J.S., Stirling P.C. The A-like faker assay for measuring yeast chromosome III stability // Methods Mol. Biol. 2018. V. 1672. P. 1–9. https://doi.org/10.1007/978-1-4939-7306-4_1
Жук А.С., Степченкова Е.И., Инге-Вечтомов С.Г. Выявление модификаций первичной структуры ДНК, возникших под действием аналога азотистых оснований 6-N-гидроксиламинопурина, в альфа-тесте у дрожжей Saccharomyces cerevisiae // Экол. генетика. 2020. Т. 18. № 3. С. 357–367. https://doi.org/10.17816/ecogen34581
Репневская М.В., Кашкин П.К., Инге-Вечтомов С.Г. Модификационные изменения генетического материала у дрожжей сахаромицетов // Генетика. 1989. Т. 25. № 3. С. 425–436.
Haber J.E. Mating-type genes and MAT switching in Saccharomyces cerevisiae // Genetics. 2012. V. 191. P. 33–64. https://doi.org/10.1534/genetics.111.134577
Herskowitz I. Life cycle of the budding yeast Saccharomyces cerevisiae// Microbiol. Reviews. 1989. V. 52. P. 536–553. https://doi.org/10.1128/MR.52.4.536-553.1988
Siliciano P.G., Tatchell K. Transcription and regulatory signals at the mating-type locus in yeast // Cell. 1984. V. 37. P. 969–978. https://doi.org/10.1016/0092-8674(84)90431-8
Kassir Y., Simchen G. Regulation of mating and meiosis in yeast by the mating-type region // Genetics. 1976. V. 82. P. 187–206. https://doi.org/10.1093/genetics/82.2.187
Hagen D.C., Bruhn L., Westby C.A., Sprague G.F. Jr. Transcription of alpha-specific genes in Saccharomyces cerevisiae: DNA sequence requirements for activity of the coregulator alpha 1 // Mol. Cell. Biol. 1993. V. 13. P. 6866–6875. https://doi.org/10.1128/mcb.13.11.6866-6875.1993
Bruhn L., Sprague G.F. Jr. MCM1 point mutants deficient in expression of alpha-specific genes: Residues important for interaction with alpha 1 // Mol. Cell. Biol. 1994.V. 14. P. 2534–2544. https://doi.org/10.1128/MCB.14.4.2534
Степченкова Е.И., Коченова О.В., Инге-Вечтомов С.Г. “Незаконная” гибридизация и “незаконная” цитодукция у гетероталличных дрожжей Saccharomyces cerevisiae как система для анализа генетической активности экзогенных и эндогенных факторов в “альфа-тесте” // Вестник Санкт-Петербургского ун-та. Сер. 3. 2009. Вып. 4. С. 129–140.
Инге-Вечтомов С.Г. Идентификация некоторых групп сцепления у Петергофских генетических линий дрожжей // Генетика. 1971. Т. 7. № 9. С. 113–123.
Rose M.D., Winston F., Hieter P. Methods in Yeast Genetics. CSHL Press, 1990. 198 c.
Maron D.M., Ames B.N. Revised methods for the Salmonella mutagenicity test // Mutat. Res. 1983. V. 113. P. 173–215. https://doi.org/10.1016/0165-1161(83)90010-9
Mortelmans K., Zeiger E. The ames Salmonella/microsome mutagenicity assay // Mutat. Res. 2000. V. 455. P. 29–60. https://doi.org/10.1016/S0027-5107(00)00064-6
Дополнительные материалы отсутствуют.


