Генетика, 2023, T. 59, № 1, стр. 115-122
Роль rs2238296 гена митохондриальной ДНК-полимеразы гамма в сочетании с полиморфными вариантами генов антиоксидантной защиты организма в развитии постинфарктной аневризмы левого желудочка
Е. А. Кужелева 1, *, А. А. Гарганеева 1, О. В. Тукиш 1, А. К. Несова 1, М. В. Голубенко 2, С. Л. Андреев 1, В. М. Шипулин 1
1 Научно-исследовательский институт кардиологии, Томский национальный исследовательский
медицинский центр Российской академии наук
634012 Томск, Россия
2 Научно-исследовательский институт медицинской генетики, Томский национальный исследовательский медицинский центр Российской академии наук
634050 Томск, Россия
* E-mail: kea@cardio-tomsk.ru
Поступила в редакцию 25.02.2022
После доработки 30.03.2022
Принята к публикации 12.04.2022
- EDN: CMPIIW
- DOI: 10.31857/S0016675823010071
Аннотация
Изучали связь полиморфного варианта гена митохондриальной ДНК-полимеразы гамма (POLG rs2238296) в совокупности с однонуклеотидными полиморфными вариантами генов антиоксидантной системы организма (митохондриального фактора транскрипции А (TFAM rs1937), супероксиддисмутазы (SOD2 rs4880), глутатионпероксидазы (GPX1 rs1050450), каталазы (CAT rs1001179), параоксоназы 1 (PON1 rs854560) и НАДФ-Н оксидазы (CYBA rs4673)) с особенностями постинфарктного ремоделирования левого желудочка (ЛЖ). Были обследованы 153 пациента с ишемической болезнью сердца (137 мужчины и 16 женщин) в возрасте 56 (50; 60.5) лет. Генотипирование осуществляли с помощью полимеразной цепной реакции с последующим анализом полиморфизма длин рестрикционных фрагментов. При анализе распределения частот генотипов вариантов исследуемых генов не было обнаружено существенной разницы по генам SOD2, GPX1, CAT, PON1, TFAM в исследуемых группах. В отношении генов POLG и CYBA были установлены значимые различия: генотип СС rs2238296 гена POLG встречался у каждого третьего пациента с аневризмой ЛЖ (30.3%), тогда как в группе без аневризмы – только в каждом восьмом случае (12.3%, р = 0.006). Генотип СС rs4673 гена CYBA встречался у каждого второго пациента с аневризмой (51.8%) и у 32% – без аневризмы ЛЖ (р = 0.01). Пациенты с сочетанием генотипов СС (POLG) и СС (CYBA) были представлены исключительно мужчинами более молодого возраста, которые характеризовались менее отягощенным коморбидным фоном, в сравнении с больными, имеющими другой генотип указанных генов. При этом величина фракции выброса ЛЖ у таких пациентов была существенно ниже (40 (27; 52) и 50 (40; 61), р = 0.006), а развитие аневризмы ЛЖ регистрировалось в 73% случаев.
Перенесенный инфаркт миокарда (ИМ) представляет собой одну из основных причин развития хронической сердечной недостаточности (ХСН) и регистрируется у 15–30% больных ХСН [1, 2]. Процесс постинфарктного ремоделирования сердца, клинически проявляющийся как изменение размера, формы и функции сердца [3], во многом детерминируется экспрессией определенного набора генов, приводящей к молекулярным, клеточным и интерстициальным изменениям.
В настоящее время стратегия ведения пациентов с острым инфарктом миокарда предусматривает в первую очередь реперфузионное лечение (первичное чрескожное коронарное вмешательство или фармакоинвазивная стратегия) [4], что обусловливает значительное снижение частоты развития постинфарктной аневризмы сердца согласно данным популяционных исследований [5]. Вместе с тем осуществление анализа ретроспективных данных, собранных до широкого внедрения реперфузионной стратегии лечения острого ИМ, позволило сформировать репрезентативную группу больных с постинфарктной аневризмой левого желудочка в когорте пациентов с обструктивным многососудистым атеросклерозом коронарных артерий.
Как известно, основными механизмами постинфарктного ремоделирования сердца являются клеточная гибель, нарушение энергетического и ионного обмена, воспаление, дисбаланс синтеза и распада коллагена, нейрогормональная активация и оксидативный стресс. В результате острого ишемического повреждения происходит нарушение функции митохондрий, что приводит к усилению процессов апоптоза кардиомиоцитов за счет накопления свободных радикалов, которые адекватно не утилизируются [6]. В процессах синтеза и утилизации свободных радикалов большое значение имеют ферменты антиоксидантной системы организма, такие как каталаза, супероксиддисмутаза, глутатионпероксидаза, параоксоназа и другие [7], в свою очередь активность указанных ферментов во многом детерминирована генетическими факторами [8, 9].
Цель настоящего исследования – оценка взаимосвязи полиморфного варианта С/Т (rs2238296) гена митохондриальной ДНК-полимеразы гамма в совокупности с однонуклеотидными полиморфными вариантами (ОНП) генов антиоксидантной системы организма с особенностями постинфарктного ремоделирования левого желудочка.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено ретроспективное исследование по типу случай–контроль больных с обструктивным многососудистым поражением коронарного русла, перенесших в анамнезе инфаркт миокарда. Все пациенты подписали добровольное информированное согласие до начала процедур исследования. Протокол исследования одобрен локальным этическим комитетом.
Критериями включения явились: факт перенесенного ИМ не ранее шести месяцев до включения в исследование и многососудистое атеросклеротическое поражение коронарных артерий как показание к хирургической реваскуляризации миокарда [10].
Критерии исключения: инфаркт миокарда или прогрессирующая стенокардия в течение шести предыдущих месяцев, отказ пациента от участия в исследовании.
В исследование включено 153 пациента (137 мужчин и 16 женщин), в возрасте 56 (50; 60.5) лет. Все пациенты были обследованы по единому алгоритму, включающему сбор жалоб и анамнеза заболевания, клинический осмотр с определением индекса массы тела, симптомов и признаков хронической сердечной недостаточности. Инструментальное обследование включало электрокардиографию (ЭКГ), эхокардиографию (ЭхоКГ) с использованием ультразвуковой системы Philips HD 15. Проведены лабораторные анализы крови. Коронароангиография выполнялась по клиническим показаниям на ангиографическом комплексе “Siemens Axion Aptos” не ранее чем за 2 мес. до включения в исследование. Пациенты были разделены на две группы в зависимости от особенностей постинфарктного ремоделирования левого желудочка (ЛЖ): 1-я группа – больные без аневризмы ЛЖ (n = 97); 2-я группа – пациенты с развившейся аневризмой ЛЖ после перенесенного ИМ (n = 56).
Материалом для генетического анализа явились образцы геномной ДНК пациентов, хранящиеся в биоколлекции Томского НИМЦ “Биобанк населения Северной Евразии”. Геномная ДНК была выделена из лейкоцитов венозной крови пациентов методом фенол-хлороформной экстракции. Генотипирование осуществляли с помощью полимеразной цепной реакции с последующим анализом полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ). В рамках работы проводили генотипирование восьми ОНП семи генов: митохондриальной ДНК-полимеразы гамма (POLG (rs2238296 – T/C)), митохондриального фактора транскрипции А (TFAM (rs1937 – Ser12Thr)), супероксиддисмутазы (SOD2 (rs4880 – Ala16Val)), глутатионпероксидазы (GPX1 (rs1050450 – Pro198Leu)), каталазы (CAT (rs1001179 – C-262T)), параоксоназы 1 (PON1 (rs854560 – Leu55Met, rs662 – Gln192Arg)) и НАДФН-оксидазы (CYBA (rs4673 – His72Tyr)). Последовательность праймеров, условия генотипирования и рестрикции могут быть предоставлены авторами по запросу.
Статистическую обработку данных проводили с помощью программы STATISTICA 10.0. Описание количественных данных осуществлялось в виде медианы и интерквартильного размаха (Me (Q25; Q75)), учитывая ненормальное распределение признаков при проверке распределения с использованием критерия Шапиро–Уилка. Качественные значения представлены в абсолютных и относительных величинах (n (%)). Для сравнения количественных данных в двух независимых выборках использовался U-критерий Манна–Уитни. Для определения статистической значимости различий номинальных признаков использовали анализ таблиц сопряженности (критерий χ2 Пирсона, а также двусторонний точный тест Фишера). Для анализа ассоциации изучаемых полиморфных вариантов с постинфарктным ремоделированием ЛЖ производился расчет отношения шансов с 95%-ным доверительным интервалом (ОШ; 95%ДИ). Критический уровень значимости при проверке статистических гипотез принимался равным 0.05 (р – достигнутый уровень значимости). Распределение частот генотипов исследуемых полиморфных вариантов соответствовало равновесию Харди–Вайнберга (p > 0.05).
РЕЗУЛЬТАТЫ
Исследуемые группы были представлены преимущественно мужчинами в возрасте 50–60 лет. Сахарный диабет 2-го типа, ожирение, периферический атеросклероз, хроническая обструктивная болезнь легких (ХОБЛ), перенесенное в анамнезе острое нарушение мозгового кровообращения (ОНМК) встречались одинаково часто в обеих группах (р > 0.05). Характер поражения коронарного русла был сопоставим, так как многососудистый коронарный атеросклероз явился одним из критериев включения в исследование. Количество перенесенных в прошлом ИМ, а также время, прошедшее после последнего ИМ, не различались среди больных с развитием и без развития аневризмы левого желудочка (р > 0.05) (табл. 1).
Таблица 1.
Клинико-анамнестическая характеристика пациентов
| Анализируемый признак | Группа 1 (аневризмы нет; n = 97) | Группа 2 (аневризма есть; n = 56) | р |
|---|---|---|---|
| Пол, муж/жен, n (%) | 85/12 (87.6/12.4) | 52/4 (92.9/7.1) | 0.3 |
| Средний возраст, Ме (Q25; Q75), годы | 55 (50; 60.5) | 57 (50;60) | 0.8 |
| ФК ИБС, n (%) | |||
| I | 10 (10.3) | 11 (19.6) | 0.1 |
| II | 53 (54.6) | 27 (48.2) | 0.4 |
| III | 34 (35.1) | 18 (32.1) | 0.7 |
| ФК ХСН (NYHA), n (%) | |||
| I | 6 (6.2) | 2 (3.6) | 0.4 |
| II | 43 (44.3) | 15 (26.7) | 0.03 |
| III | 46 (47.4) | 38 (67.9) | 0.01 |
| IV | 2 (2.1) | 1 (1.8) | 0.9 |
| Сахарный диабет, n (%) | 19 (19.6) | 8 (14.3) | 0.4 |
| Ожирение, n (%) | 40 (41) | 20 (38.5) | 0.3 |
| Периферический атеросклероз, n (%) | 58 (59.8) | 27 (49.1) | 0.18 |
| Острое нарушение мозгового кровообращения, n (%) | 8 (8.2) | 5 (9) | 0.4 |
| Хроническая обструктивная болезнь легких, n (%) | 28 (28.8) | 13 (23.2) | 0.5 |
| Нарушения ритма сердца, n (%) | 13 (13.4) | 14 (25) | 0.04 |
| Индекс массы тела, Ме (Q25; Q75), кг/м2 | 28 (25.75; 31) | 27 (24; 31) | 0.15 |
| Возраст на момент первого инфаркта миокарда, Ме (Q25; Q75), мес. | 51.3 (44.7; 56.7) | 52.2 (47.6; 58) | 0.2 |
| Время от последнего инфаркта миокарда до включения в исследование, Ме (Q25; Q75), мес. | 12.5 (7.5; 51) | 13.5 (8.5; 47.5) | 0.38 |
| Число перенесенных инфарктов миокарда, n (%) | >0.05 | ||
| 1 | 66 (68) | 36 (64) | |
| 2 | 25 (25.8) | 15 (26.8) | |
| 3 | 3 (3.1) | 3 (5.4) | |
| 4 | 3 (3.1) | 2 (3.6) | |
| Конечный диастолический объем, Ме (Q25; Q75), мл | 134 (104; 175) | 189 (140; 229) | 0.001 |
| Конечный систолический объем, Ме (Q25; Q75), мл | 58 (39; 100.5) | 112 (67.25; 162.25) | 0.001 |
| Масса миокарда, Ме (Q25; Q75), г | 223 (181.25; 281.5) | 250 (205; 298.5) | 0.053 |
| Фракция выброса левого желудочка, Ме (Q25; Q75), % | 54.5 (44; 64) | 43 (30; 53.5) | <0.001 |
Таким образом, группы не различались по гендерно-возрастным параметрам и коморбидному фону. Функциональный класс стенокардии напряжения также был сопоставим в исследуемых группах (р > 0.05). Тогда как симптомы хронической сердечной недостаточности были наиболее выражены в когорте больных с аневризмой левого желудочка, среди которых преобладал третий функциональный класс ХСН по классификации NYHA. Пациенты, у которых развилась постинфарктная аневризма, имели, соответственно, меньшую фракцию выброса левого желудочка по данным ЭхоКГ (54.5 (44; 64) и 43 (30; 53.5), р < 0.001), большие диастолический и систолический объемы (р = 0.001), а также у них чаще диагностировались желудочковые нарушения ритма сердца высоких градаций (13.4 и 25%, р = 0.06), что может объясняться наличием аритмогенных очагов в измененном миокарде.
Медикаментозная терапия пациентов обеих исследуемых групп в большинстве случаев не соответствовала современным клиническим рекомендациям (табл. 2), что было обусловлено отсутствием четких рекомендательных документов на период включения пациентов в исследование (2006–2008 гг.). По этой же причине большинству больных не проводилась реваскуляризация миокарда на момент развития ИМ: только 2% пациентов из первой группы было выполнено стентирование инфаркт-связанной артерии.
Таблица 2.
Медикаментозная терапия пациентов на момент включения в исследование
| Группа препаратов | Группа 1 (аневризмы нет; n = 97) | Группа 2 (аневризма есть; n = 56) | р |
|---|---|---|---|
| Статины, n (%) | 53 (55) | 34 (60.7) | 0.5 |
| иАПФ, n (%) | 26 (27) | 12 (21.4) | 0.5 |
| АРА, n (%) | 1 (1) | 3 (5.4) | 0.14 |
| БАБ, n (%) | 28 (29) | 22 (39.3) | 0.19 |
| Диуретики, n (%) | 25 (25.8) | 22 (39.3) | 0.08 |
| Антагонисты альдостерона, n (%) | 23 (23.7) | 14 (25) | 0.86 |
| Нитраты, n (%) | 11 (11.3) | 6 (10.7) | 0.9 |
| Аспирин, n (%) | 41 (42.2) | 32 (57) | 0.08 |
При анализе распределения частот генотипов вариантов исследуемых генов не было обнаружено существенной разницы по генам SOD2, GPX1, CAT, PON1 и TFAM в исследуемых группах (рис. 1). Тогда как в отношении генов POLG и CYBA были установлены значимые различия. Так, генотип СС rs2238296 гена POLG встречался у каждого третьего пациента с аневризмой ЛЖ (30.3%), тогда как в группе без аневризмы – только в каждом восьмом случае (12.3%; р = 0.006). Шанс развития аневризмы левого желудочка при наличии генотипа СС полиморфного варианта rs2238296 был выше в 3 раза (ОШ 3.1; 95%ДИ 1.3–7.0).
Рис. 1.
Распределение частот генотипов полиморфных вариантов генов в группах пациентов с аневризмой и без аневризмы левого желудочка после перенесенного инфаркта миокарда.
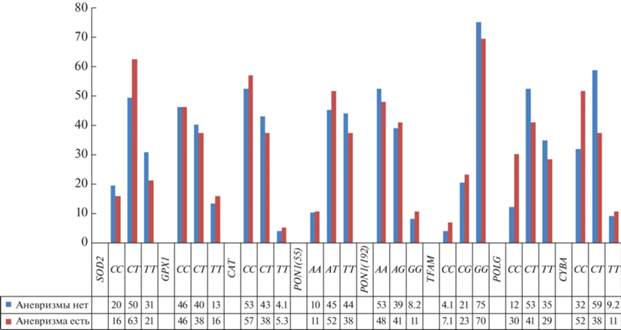
Генотип СС rs4673 гена CYBA встречался у каждого второго пациента с аневризмой (51.8%) и у 32% – без аневризмы левого желудочка. При этом отношение шансов развития аневризмы при наличии варианта СС гена CYBA составило 2.3 (95%ДИ 1.16–4.5) (р = 0.01). Таким образом, генотип СС rs2238296 гена POLG и генотип СС rs4673 гена CYBA были ассоциированы с развитием постинфарктной аневризмы левого желудочка у больных с обструктивным коронарным атеросклерозом.
Учитывая полученные результаты, отдельный интерес представляет группа с сочетанием указанных полиморфных вариантов (n = 11; табл. 3). Особенности исследуемой группы были изучены в сравнении с пациентами, имеющими отличный от исследуемого генотип (n = 142). Из 11 пациентов у восьми была диагностирована аневризма ЛЖ (73%), тогда как в группе сравнения – только у 34% (р = 0.01). Таким образом, шанс развития постинфарктной аневризмы у пациентов с сочетанием полиморфных вариантов СС rs2238296 гена POLG и CC rs4673 гена CYBA был увеличен в 5.6 (95%ДИ 1.4–22) раз. При этом пациенты с анализируемым генотипом были представлены исключительно мужчинами более молодого возраста (50 (46; 59) и 56 (50; 61) лет, р = 0.06), без сахарного диабета 2-го типа (р = 0.1) и значительно реже страдающими ожирением (р = 0.03) и артериальной гипертонией (р = 0.1) в сравнении с пациентами, имеющими другой генотип указанных генов. Только у половины из них диагностировалась артериальная гипертония (54.5%), тогда как в группе сравнения – у 84% пациентов (р = 0.1). Частота регистрации ХОБЛ, периферического атеросклероза, количество перенесенных инфарктов миокарда в анамнезе, возраст на момент первого ИМ и время от последнего ИМ до включения в исследование не различались. Выраженность клинических проявлений стенокардии напряжения и ХСН была сопоставима в исследуемых группах. Тем не менее при более легком коморбидном фоне фракция выброса ЛЖ у пациентов с анализируемым генотипом была существенно ниже (40 (27; 52) и 50 (40; 61), р = 0.006).
Таблица 3.
Клинико-анамнестическая характеристика пациентов с сочетанием генотипов СС rs2238296 гена POLG и CC rs4673 гена CYBA в сравнении с другими больными
| Признак | Группа 1 (ССPOLG + ССCYBA; n = 11) | Группа 2 (n = 142) | р |
|---|---|---|---|
| Пол, муж/жен, n (%) | 11/0 (100/0) | 126/16 (88.7/11.3) | 0.3 |
| Возраст, Ме (Q25; Q75), годы | 50 (46; 59) | 56 (50; 61) | 0.06 |
| ФК ИБС, n (%) | |||
| I | 3 (27.3) | 18 (12.7) | 0.2 |
| II | 7 (63.6) | 73 (51.4) | 0.4 |
| III | 1 (9.1) | 51 (35.9) | 0.4 |
| ФК ХСН (NYHA), n (%) | |||
| I | 1 (9.1) | 7 (4.9) | 0.5 |
| II | 4 (36.4) | 54 (38) | 0.9 |
| III | 6 (45.5) | 78 (55) | 0.9 |
| IV | 0 | 3 (2.1) | 0.8 |
| Фракция выброса левого желудочка, Ме (Q25; Q75), % | 40 (27; 52) | 50 (40; 61) | 0.006 |
| Сахарный диабет, n (%) | 0 | 27 (19) | 0.1 |
| Ожирение, n (%) | 1 (10) | 59 (41.5) | 0.03 |
| Артериальная гипертония, n (%) | 6 (54.5) | 119 (84) | 0.1 |
| Периферический атеросклероз, n (%) | 5 (45.5) | 80 (56.3) | 0.5 |
| Острое нарушение мозгового кровообращения, n (%) | 6 (54) | 52 (36.6) | 0.2 |
| Хроническая обструктивная болезнь легких, n (%) | 6 (54) | 76 (53.2) | 0.9 |
| Нарушения ритма сердца, n (%) | 3 (27.3) | 14 (9.8) | 0.1 |
| Возраст на момент первого инфаркта миокарда, Ме (Q25; Q75), годы | 47.7 (44.7; 54.4) | 51.4 (46.6; 57) | 0.3 |
| Время от последнего инфаркта миокарда до включения в исследование, Ме (Q25; Q75), мес. | 25 (11; 49) | 15 (8.5; 48.7) | 0.2 |
| Число перенесенных инфарктов миокарда, n (%) | |||
| 1 | 7 (64) | 95 (67) | 0.8 |
| 2 | 3 (27) | 14 (10) | 0.1 |
| 3 | 0 | 6 (4.2) | 0.6 |
| 4 | 1 (10) | 4 (2.8) | 0.3 |
ОБСУЖДЕНИЕ
Острая гипоксия, которой подвергаются клетки миокарда во время ишемии, приводит к развитию дисфункции клеточных органелл, в большей степени митохондрий, что является причиной недостаточной утилизации активных форм кислорода в дыхательной цепи переноса электронов. Как известно, отличительной особенностью митохондрий является наличие собственной ДНК, кодирующей компоненты дыхательной цепи. Мутации митохондриальной ДНК вызывают нарушения нормального функционирования органелл и клеток и потенцируют процессы запрограммированной клеточной гибели [11, 12].
Способность митохондрий противостоять ишемическому повреждению во многом определяется генетическими факторами. ДНК-полимераза гамма отвечает как за репликацию, так и за репарацию ДНК. Ранее было показано, что при выраженном окислительном стрессе (в частности, обработка перекисью водорода) формируются дефектные молекулы ДНК-полимеразы, функциональная активность которых существенно снижена: репликация в 2 раза, а репарация – до 20 раз [11]. В результате несовершенства фермента образуются копии мтДНК с большим количеством ошибок из-за нарушения процессов репарации. При этом в различных исследованиях продемонстрировано, что большое число копий мтДНК, а также делеции мтДНК ассоциированы с развитием сердечно-сосудистых осложнений после кардиохирургических вмешательств [13, 14].
Таким образом, кодирующий каталитическую субъединицу ДНК-полимеразы гамма ген POLG может являться одним из генов, определяющих предрасположенность к патологическому постинфарктному ремоделированию с развитием аневризмы ЛЖ. Однако данные по ассоциации изучаемого ОНП гена POLG с постинфарктными изменениями отсутствуют, как для российских, так и для зарубежных популяций. Согласно имеющимся публикациям, лейкоциты крови с мутациями в гене POLG более чувствительны к апоптозу, вызванному окислительным стрессом [15].
В настоящей работе проанализирован полиморфный маркер, расположенный во втором интроне гена POLG. Этот вариант потенциально может влиять на регуляцию транскрипции. В частности, согласно базе данных проекта GTEx, посвященного изучению тканеспецифичной генной экспрессии, этот полиморфный вариант может влиять на экспрессию данного гена в разных тканях [16]. Популяционные исследования показали, что генотип СС rs2238296 POLG встречается примерно у 17% русских, а в популяциях коренного населения Сибири его частота несколько ниже – 12–14% [17]. Таким образом, полученные данные, в том числе по распространенности генотипа СС в популяции пациентов без аневризмы левого желудочка, не противоречат немногочисленным имеющимся литературным данным.
Другим геном антиоксидантной системы организма, ОНП которого ассоциирован с развитием постинфарктной аневризмы ЛЖ у больных обструктивным коронарным атеросклерозом, согласно полученным данным, является CYBA. Данный ген кодирует регуляторную субъединицу (p22phox) НАДФН-оксидазы, которая поддерживает окислительно-восстановительное равновесие в клетках и в кровеносных сосудах. Наши результаты показывают, что генотип СС полиморфного варианта rs4673 гена CYBA ассоциирован с развитием аневризмы левого желудочка. В литературе встречаются сведения об ассоциации аллеля Т с долгожительством, а также о наличии ассоциаций генотипа СС с развитием неблагоприятных событий у больных ишемической болезнью сердца в связи с повышением активности фермента НАДФ-Н – оксидазы и продукции активных форм кислорода [9, 18].
Таким образом, на основании проведенного исследования установлено, что генотипы СС rs2238296 гена POLG и СС rs4673 гена CYBA ассоциированы со значительным повышением риска развития постинфарктной аневризмы ЛЖ у больных с обструктивным атеросклерозом коронарных артерий. Полученные результаты являются уникальными, в зарубежной и отечественной литературе аналогичных данных не представлено. Сочетание двух генетических маркеров может повысить предсказательную точность генетических исследований в прогнозировании постинфарктного ремоделирования левого желудочка.
Основные ограничения исследования – ретроспективный дизайн, небольшая численность группы пациентов с сочетанием генотипов СС POLG и CC CYBA.
Постинфарктное ремоделирование левого желудочка с развитием его аневризмы ассоциировано с генотипом СС rs2238296 гена POLG и генотипом СС rs4673 гена CYBA. При сочетании неблагоприятных генотипов, которое встречается у 7% пациентов с обструктивным коронарным атеросклерозом, шанс развития постинфарктной аневризмы сердца увеличен в 5.6 раз, несмотря на более молодой возраст и меньшую коморбидность пациентов.
Исследование проведено в рамках госзадания, тема ФНИ № 122020300045-5.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Фомин И.В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать // Рос. кардиол. журн. 2016. № 8. С. 7–13. https://doi.org/10.15829/1560-4071-2016-8-7-13
Гарганеева А.А., Кужелева Е.А., Кузьмичкина М.А. и др. Изменения характеристик и лечения больных с хронической сердечной недостаточностью, поступивших в кардиологический стационар в 2002 и 2016 годах // Кардиология. 2018. Т. 58. № 12S. С. 18–26. https://doi.org/10.18087/cardio.2605
Cohn J.N., Ferrari R., Sharpe N. Cardiac remodeling–concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. Behalf of an International Forum on Cardiac Remodeling // J. Am. College Cardiology. 2000. V. 35. № 3. P. 569–582. https://doi.org/10.1016/s0735-1097(99)00630-0
Российское кардиологическое общество, Ассоциация сердечно-сосудистых хирургов России. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020 // Рос. кардиол. журн. 2020. Т. 25. № 11. С. 4103. https://doi.org/10.15829/1560-4071-2020-4103
Гарганеева А.А., Округин С.А., Борель К.Н. и др. Инфаркт миокарда на рубеже двух столетий: демографические и социальные тенденции // Клинич. медицина. 2016. Т. 94. № 6. С. 463–467. https://doi.org/10.18821/0023-2149-2016-94-6-463-467
Li Y., Liu X. Novel insights into the role of mitochondrial fusion and fission in cardiomyocyte apoptosis induced by ischemia/reperfusion // J. Cellular Physiology. 2018. V. 233. № 8. P. 5589–5597. https://doi.org/10.1002/jcp.26522
Doğan A., Özşensoy Y., Türker F.S. MnSOD, CAT and GPx-3 genetic polymorphisms in coronary artery disease // Mol. Biology Reports. 2019. V. 46. № 1. P. 841–845. https://doi.org/10.1007/s11033-018-4539-3
Жейкова Т.В., Голубенко М.В., Буйкин С.В. и др. Ассоциация полиморфизма Thr12Ser гена митохондриального фактора транскрипции А TFAM с ишемической болезнью сердца // Бюл. сиб. медицины. 2012. Т. 11. № 6. С. 47–50. https://doi.org/10.20538/1682-0363-2012-6-47-50
Жейкова Т.В., Голубенко М.В., Буйкин С.В. и др. Анализ ассоциаций полиморфного локуса 242C > T гена субъединицы p22phox НАДФН-оксидазы (CYBA) с долгожительством в российской популяции // Генетика. 2013. Т. 49. № 3. С. 410–414.
Neumann F.J., Sousa-Uva M., Ahlsson A. et al. ESC/EACTS guidelines on myocardial revascularization // Rossijskij kardiol. zhurnal. 2019. № 8. P. 151–226. https://doi.org/10.15829/1560-4071-2019-8-151-226
Anderson A.P., Luo X., Russell W., Yin Y.W. Oxidative damage diminishes mitochondrial DNA polymerase replication fidelity // Nucl. Acids Res. 2020. № 1. P. 817–829. https://doi.org/10.1093/nar/gkz1018
Kujoth G.C., Hiona A., Pugh T.D. et al. Mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging // Science. 2005. V. 309. № 5733. P. 481–484. https://doi.org/10.1126/science.1112125
Zhang J., Xu S., Xu Y. et al. Relation of mitochondrial DNA copy number in peripheral blood to postoperative atrial fibrillation after isolated off-pump coronary artery bypass grafting // Am. J. Cardiology. 2017. V. 119. № 3. P. 473–477. https://doi.org/10.1016/j.amjcard.2016.10.017
Levitsky S., Laurikka J., Stewart R.D. et al. Mitochondrial DNA deletions in coronary artery bypass grafting patients // Eur. J. Cardio-Thoracic Surgery. 2003. V. 24. № 5. P. 777–784. https://doi.org/10.1016/S1010-7940(03)00501-3
Formichi P., Radi E., Branca C. et al. Oxidative stress-induced apoptosis in peripheral blood lymphocytes from patients with POLG-related disorders // J. Neurological Sciences. 2016. № 368. P. 359–368. https://doi.org/10.1016/j.jns.2016.07.047
The Genotype-Tissue Expression (GTEx) project. Accessed September 6, 2021. https://www.gtexportal.org/home/snp/rs2238296
Буйкин С.В., Голубенко М.В., Погребенкова В.В. и др. Ген POLG митохондриальной γ-полимеразы: частота и анализ сцепления двух единичных нуклеотидных замен (SNP) в популяциях народов Сибири // Мол. биология. 2006. Т. 40. № 6. C. 1081–1083.
Racis M., Sobiczewski W., Stanisławska-Sachadyn A. et al. NADPH oxidase gene polymorphism is associated with mortality and cardiovascular events in 7-year follow-up // J. Clin. Medicine. 2020. V. 9. № 5. P. 1475. https://doi.org/10.3390/jcm9051475
Дополнительные материалы отсутствуют.


