Генетика, 2023, T. 59, № 1, стр. 80-88
Изучение популяционно-генетической структуры африканской скумбрии Scomber colias Gmelin, 1789 (Scombridae) в Центрально-Восточной Атлантике
А. Н. Строганов 1, *, А. И. Никитенко 2, Т. А. Ракицкая 3, В. А. Беляев 4
1 Московский государственный университет им. М.В. Ломоносова, кафедра ихтиологии
119234 Москва, Россия
2 Филиал по пресноводному рыбному хозяйству Всероссийского научно-исследовательского института рыбного хозяйства и океанографии (ВНИРО)
141821 Московская обл., пос. Рыбное, Россия
3 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
4 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии (ВНИРО)
107140 Москва, Россия
* E-mail: andrei_str@mail.ru
Поступила в редакцию 09.02.2022
После доработки 01.04.2022
Принята к публикации 12.04.2022
- EDN: CNJWFH
- DOI: 10.31857/S0016675823010113
Аннотация
Проведено исследование генетического разнообразия в группировках африканской скумбрии из акваторий Центрально-Восточной Атлантики на основании семи микросателлитных локусов. Все локусы были полиморфны, оценки ожидаемой гетерозиготности варьировали от 0.021 до 0.914. Для всех исследовавшихся выборок выявлен дефицит гетерозиготности, связанный с присутствием нуль-аллелей в четырех из семи исследовавшихся микросателлитных локусов. Получено низкое, но достоверное значение генетической дифференциации, рассчитанное по всем локусам (θ = 0.0052), что предположительно, в том числе, может быть связано с нарушением панмиксии за счет формирования отдельных субпопуляций в результате неравномерного воздействия промысла в различных локальностях.
Африканская скумбрия Scomber colias Gmelin, 1789 [1] – пелагическая стайная рыба, широко распространенная в прибрежных акваториях Атлантического океана от Бискайского залива на севере до юга Африки (включая Черное и Средиземное моря), являющаяся традиционным объектом тралового и кошелькового лова. Как хозяйственно ценный объект, представляющий собой важную составляющую пелагической экосистемы, африканская скумбрия является объектом различного рода исследовательских работ, направленных как на развитие общебиологического фундаментального знания, так и мониторинговые сырьевые исследования, в цели которых входит создание условий для рационального, “предосторожного” использования рыбных ресурсов. Важный материал как для фундаментальных, так и прикладных работ дают результаты популяционных исследований, проводимых с применением спектра морфо-биологических, поведенческих, физиологических, генетических методологий. Так, с использованием анализа морфометрических характеристик и формы отолита выявлена популяционная структурированность африканской скумбрии прибрежных вод Португалии и островных акваторий Центрально-Восточной Атлантики (ЦВА) [2]. По результатам определения биологических характеристик (пол, длина, общая масса, масса порки и др.) выявлена изменчивость скумбрии из акваторий центральной части Средиземного моря [3]. На основе анализа морфометрических и меристических признаков выявлена определенная структурированность группировки африканской скумбрии из прибрежных вод Туниса [4]. На основе анализа полиморфизма ядерной и митохондриальной ДНК проводили анализ видового состава рода Scomber [5, 6]. На основе анализа изменчивости контрольного региона митохондриальной ДНК рассматривали генетическую структурированность скумбрии прибрежных вод Португалии и северных акваторий средиземноморского региона. Если скумбрия атлантических вод характеризовалась как панмиктическая группировка, то в средиземноморье выявлен определенный уровень генетической структурированности [7]. На основе анализа изменчивости SNP-маркеров анализировали популяционно-генетическую структуру скумбрии прибрежных вод Канады, Бискайского залива и Средиземного моря [8].
Из вышеизложенного следует, что при значительном объеме проведенных популяционных исследований для представителей рода Scomber районов Индо-Пацифики и Атлантики, практически отсутствуют популяционно-генетические исследования африканской скумбрии из акваторий ЦВА.
Цель данной работы – исследование популяционно-генетической структуры африканской скумбрии акваторий ЦВА на основе изучения полиморфизма микросателлитных локусов ядерной ДНК.
МАТЕРИАЛЫ И МЕТОДЫ
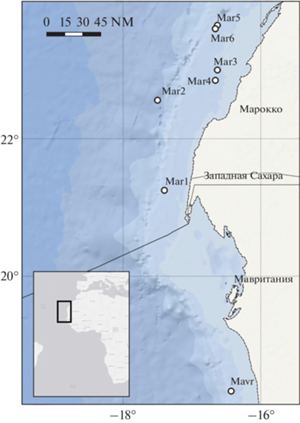
Материалом для выполнения данной работы послужили сборы африканской скумбрии, полученные в рамках программы мониторинга комплексных исследований мелких пелагических рыб на рыболовных судах в марокканско-мавританских экономических водах (табл. 1, рис. 1).
Таблица 1.
Характеристика анализируемого в работе материала
| Индекс выборки | Место и время взятия выборок | Координаты | Число рыб, экз. | |
|---|---|---|---|---|
| широта | долгота | |||
| Mar1 | ЦВА, Зап. Африка 21.09.2017 | 21°15′ N | 17°24′ W | 50 |
| Mar2 | ЦВА, Зап. Африка 29.09.2017 | 22°34′ N | 17°30′ W | 50 |
| Mar3 | ЦВА, Зап. Африка 14.10.2017 | 23°0′ N | 16°38′ W | 50 |
| Mar4 | ЦВА, Зап. Африка 20.10.2017 | 23°39′ N | 16°38′ W | 50 |
| Mar5 | ЦВА, Зап. Африка 22.10.2017 | 23°39′ N | 16°38′ W | 50 |
| Mar6 | ЦВА, Зап. Африка 23.09.2017 | 23°36′ N | 16°40′ W | 50 |
| Mavr | ЦВА, Зап. Африка 27.09.2016 | 18°2′ N | 16°26′ W | 50 |
В качестве маркеров использовали секвенированные для восточной скумбрии микросателлитные локусы SJT5, SJT25, SJT36, SJNT66, SJT205, SJT142, SJT175 [9]. Для ПЦР-амплификации использовали наборы Gene Pak PCR Core (ООО “ИзоГен”, Россия), к которым добавляли 5 мкл смеси праймеров (конечная концентрация 0.5 мкМ) и 5 мкл исследуемой ДНК (100 нг). Амплификацию микросателлитных локусов проводили в термоциклере “MJ Research PTC 100” при следующем режиме: сначала 4 мин разрушение ДНК при температуре 95°С, затем 35 циклов дальнейшей денатурации ДНК матрицы, отжиг праймеров и синтез новых цепей. Продукты амплификации разделяли путем электрофореза в 6%-ном неденатурирующем полиакриламидном геле в ТБЕ-буфере [10] при 300 В в течение 2–3 ч, окрашивали бромистым этидием и фотографировали в УФ-свете. Размеры аллелей по каждому локусу определяли с использованием программы “1D Image Analysis Software Version 3.5” (“Kоdak”).
Частоты аллелей, равновесие Харди–Вайнберга, гетерозиготности ожидаемая (He) и наблюдаемая (Ho), коэффициент дифференциации популяций θ (аналог FST-статистики) [11] и другие показатели определяли с использованием программного пакета GDA [12]. Генетическую идентичность (I) рассчитывали по методу Нея [13] в GDA. Достоверность отличий He и Ho оценивали с помощью F-критерия Фишера [14]. Для снижения эффекта множественных сравнений проводили процедуру внесения поправки Бонферрони [15]. Программный пакет GENEPOP 4.2 [16] использовали при оценке частот неамплифицирующихся нуль-аллелей и определении показателя интенсивности генных потоков (Nm). Для оценки возможного влияния демографических изменений (снижения эффективной численности, так называемое “горлышко бутылки”) на генетическое разнообразие в популяциях скумбрии использовали программу BOTTLENECK ver. 1.2.02 [17] со стандартными параметрами. Для проверки качества данных и наличия неамплифицируемых нуль-аллелей использовали программу Micro-Checker 2.2.3 [18]. Для оценки степени влияния предполагаемых ноль-аллелей на показатели генетической дифференциации FST проводили корректировку их значений с использованием программы FreeNA [19]. Представление графической проекции выборок на основе многомерного шкалирования матрицы генетических дистанций Кавалли–Сфорца проводили в программе STATISTICA 10.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследовавшиеся микросателлитные локусы демонстрировали полиморфизм различного уровня с некоторыми отличиями в выборках африканской скумбрии. Локус SJT36 был наименее полиморфен (от 2 до 3 аллелей в интервале размеров 122–128 пн). Наибольший уровень полиморфизма выявлен в локусах SJNT66 (от 13 до 19 аллелей в интервале размеров 104–146 пн), SJT25 (от 7 до 12 аллелей в интервале размеров 105–156 пн), SJT5 (от 13 до 19 аллелей в интервале размеров 80–126 пн). Средний уровень полиморфизма демонстрировали локусы SJT205 (от 6 до 9 аллелей в интервале размеров 152–168 пн), SJT142 (от 3 до 6 аллелей в интервале размеров 126–136 пн), SJT175 (от 5 до 8 аллелей в интервале размеров 144–158 пн) (табл. 2).
Таблица 2.
Частоты неамплифицирующихся нуль-аллелей в исследованных выборках африканской скумбрии
| Локус | Выборки | ||||||
|---|---|---|---|---|---|---|---|
| Mar1 | Mar2 | Mar3 | Mar4 | Mar5 | Mar6 | Mavr | |
| SJT5 | 0.0781 | 0.0424 | 0.1056 | 0.1239 | 0.1470 | 0.0550 | 0.0075 |
| SJT25 | 0.0000 | 0.0458 | 0.0000 | 0.0000 | 0.0000 | 0.0000 | 0.0000 |
| SJT36 | 0.0000 | 0.0121 | 0.0000 | 0.0000 | 0.0168 | 0.0444 | 0.0000 |
| SJNT66 | 0.0132 | 0.0292 | 0.0433 | 0.0351 | 0.0328 | 0.0380 | 0.0000 |
| SJT205 | 0.1225 | 0.0992 | 0.0552 | 0.0965 | 0.0000 | 0.0964 | 0.0596 |
| SJT142 | 0.1462 | 0.0773 | 0.1136 | 0.1273 | 0.1043 | 0.1280 | 0.1412 |
| SJT175 | 0.1572 | 0.1444 | 0.1783 | 0.1437 | 0.1332 | 0.1264 | 0.1245 |
В семи выборках скумбрии рассчитаны оценки внутрипопуляционного генетического разнообразия (табл. 2). Значения He изменялись в выборках скумбрии от 0.021 до 0.914. Максимальные значения He, как и наибольшее число аллелей, показаны в локусе SJT5. Средние оценки He во всех изученных выборках варьировали от 0.625 до 0.662. После проведения тестирования на соответствие равновесию Харди–Вайнберга (HWE), порядка половины тестов продемонстрировали отклонение от ожидаемой величины (P < 0.05). Проведение процедуры введения поправки Бонферрони для множественных сравнений снизило объем отклонений от HWE до 35%. Несоответствие около третьей части выполненных тестов распределению Харди–Вайнберга не позволяют отнести это обстоятельство к области случайных. Проведенное (в рамках определения причин масштабного отклонения от HWE) тестирование на возможное сокращение группировки скумбрии в недалеком прошлом не выявило ситуации с прохождением “горлышка бутылки” группировкой африканской скумбрии ЦВА, в том числе на фоне дефицита гетерозиготности.
Из результатов ранее проведенных исследований известно, что достаточно часто тестируемое в популяционных исследованиях отклонение от равновесия Харди–Вайнберга [20] при использовании считающихся селективно нейтральными микросателлитных локусов формируется в условиях присутствия нуль-аллелей в исследуемых локусах [21–24].
Применение нами программы Micro-Checker выявило присутствие нуль-аллелей в четырех из семи исследовавшихся микросателлитных локусов. Практически сходные результаты дала оценка частот неамплифицирующихся нуль-аллелей в исследованных выборках африканской скумбрии с применением программного пакета GENEPOP 4.2. Частоты нуль-аллелей в выборках скумбрии варьировали в довольно широких пределах: от 0.0075 до 0.1783 (табл. 2). Высокая доля локусов с нуль-аллелями в выборках беспозвоночных и рыб отмечалась и в ранее проводившихся популяционных исследованиях как российских, так и зарубежных авторов. Так, при изучении популяций японского гребешка (Chlamys farreri) выявлено 56% локусов с нуль-аллелями [25]. В работах с минтаем (Theragra chlalcogramma) Берингова и Охотского морей в четырех микросателлитных локусах из десяти исследовавшихся предполагалось наличие нуль-аллеля [26]. В исследованиях выборок тихоокеанских лососей также были обнаружены нулевые аллели [27]. Что касается частоты нуль-аллелей, то значение ее для динуклеотидных повторов может достигать 0.30 [28].
Присутствие нуль-аллелей может быть связано с ошибками генотипирования в связи с накоплением мутаций в последовательностях, комплементарных праймерным, у анализируемого вида по сравнению с видом/популяцией для которого/которой эти праймеры были разработаны, что, например, было показано при исследованиях выборки голомянки [29]. Применения праймера атлантической трески Gmo3 в популяционных исследованиях минтая сопровождалось обнаружением нуль-аллелей в 44% локус-тестов [22]. В нашем случае для исследования популяционной структуры скумбрии из акваторий ЦВА были использованы микросателлитные локусы, секвенированные для скумбрии из центрально-западной части Тихого океана. Если более ранние работы относили эти группировки к одному виду с подвидами, то в современных работах эти подвиды получили видовой статус [1, 30, 31]. Таким образом, дивергенция фланкирующих микросателлитный повтор последовательностей на видовом уровне могла стать причиной проблем с отжигом праймеров при амплификации ДНК.
Выполнена оценка с применением критерия Фишера значимости различий ожидаемой и наблюдаемой гетерозиготностей в выборках скумбрии. Показано достоверное отличие средних значений He и Ho во всех исследовавшихся выборках африканской скумбрии (табл. 3). Полученные результаты продемонстрировали наличие дефицита гетерозиготности, что может быть связано с присутствием нуль-аллелей, провоцирующих ошибки детекции гомо- и гетерозигот [32]. Проверка влияния возможных нуль-аллелей на оценки генетической дифференциации продемонстрировала изменения FST по исследовавшимся микросателлитным локусам в среднем на 17.9%.
Таблица 3.
Показатели генетического разнообразия в выборках скумбрии
| Локус | Показатель | Выборки | ||||||
|---|---|---|---|---|---|---|---|---|
| Mar1 N = 47 |
Mar2 N = 48 |
Mar3 N = 48 |
Mar4 N = 48 |
Mar5 N = 48 |
Mar6 N = 48 |
Mavr N = 48 |
||
| SJT5 | A/Ap | 13/13 | 15/15 | 16/16 | 16/16 | 19/19 | 15/15 | 14/14 |
| He/Ho | 0.859/0.723 | 0.858/0.770 | 0.872/0.666 | 0.884/0.625 | 0.914/0.625 | 0.860/0.750 | 0.854/0.791 | |
| SJT25 | A/Ap | 10/10 | 12/12 | 9/9 | 10/10 | 7/7 | 10/10 | 8/8 |
| He/Ho | 0.731/0.829 | 0.776/0.687 | 0.763/0.895 | 0.802/0.812 | 0.730/0.770 | 0.753/0.812 | 0.667/0.791 | |
| SJT36 | A/Ap | 2/2 | 3/3 | 2/2 | 2/2 | 2/2 | 3/3 | 2/2 |
| He/Ho | 0.021/0.021 | 0.225/0.208 | 0.061/0.062 | 0.099/0.104 | 0.188/0.166 | 0.155/0.083 | 0.205/0.229 | |
| SJNT66 | A/Ap | 16/16 | 19/19 | 17/17 | 17/17 | 13/13 | 13/13 | 16/16 |
| He/Ho | 0.907/0.872 | 0.875/0.791 | 0.882/0.791 | 0.909/0.833 | 0.861/0.791 | 0.849/0.770 | 0.858/0.895 | |
| SJT205 | A/Ap | 6/6 | 9/9 | 7/7 | 8/8 | 8/8 | 7/7 | 7/7 |
| He/Ho | 0.582/0.382 | 0.646/0.458 | 0.679/0.541 | 0.620/0.458 | 0.624/0.666 | 0.620/0.458 | 0.646/0.541 | |
| SJT142 | A/Ap | 4/4 | 5/5 | 5/5 | 3/3 | 6/6 | 5/5 | 5/5 |
| He/Ho | 0.550/0.319 | 0.541/0.416 | 0.557/0.375 | 0.388/0.208 | 0.540/0.375 | 0.579/0.354 | 0.484/0.270 | |
| SJT175 | A/Ap | 8/8 | 8/8 | 6/6 | 7/7 | 5/5 | 7/7 | 7/7 |
| He/Ho | 0.724/0.446 | 0.711/0.458 | 0.680/0.375 | 0.685/0.437 | 0.641/0.416 | 0.700/0.479 | 0.741/0.500 | |
| Среднее значение |
A/Ap | 8.42/8.42 | 10.14/10.14 | 8.85/8.85 | 9.00/9.00 | 8.57/8.57 | 8.57/8.57 | 8.42/8.42 |
| He/Ho | 0.625/0.513 | 0.662/0.541 | 0.642/0.529 | 0.627/0.497 | 0.643/0.544 | 0.645/0.529 | 0.636/0.574 | |
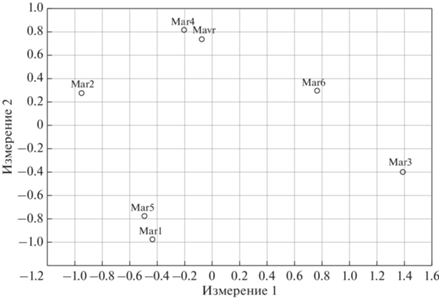
Диаграмма рассеяния была построена на основе процедуры многомерного шкалирования в пространстве двух координат в соответствии со скорректированными с точки зрения влияния нуль-аллелей генетическими дистанциями Кавалли–Сфорца. Полученные значения показателя Юнга (0.08) и коэффициента отчуждения (0.14) свидетельствуют о хорошем соответствии модели исходным данным [33]. Соответствующие проанализированным выборкам точки формировали на диаграмме – общее облако, при этом наиболее близко были расположены две пары выборок: Mar4-Mavr и Mar1-Mar5 (рис. 2). Можно предположить, что образование пар с аналогичными генетическими характеристиками могло быть связано со взятием материала из сходных (несмотря на пространственную разобщенность), но активно перемещающихся группировок африканской скумбрии. Также необходимо отметить, что коррекция значений генетических дистанций с точки зрения влияния нуль-аллелей не оказывала кардинального влияния на характер диаграммы рассеяния. Наряду с влиянием нуль-аллелей пониженный уровень гетерозигот может быть также связан и с нарушением панмиксии за счет присутствия и смешения отдельных субпопуляций [25, 34]. Если в популяции существуют определенные группы, между которыми обмен генами происходит с меньшей интенсивностью (чем в пределах самих этих групп), может иметь место разделение популяции на субпопуляции и, в определенной степени, изоляция.
Рис. 2.
Расположение точек, соответствующих выборкам африканской скумбрии из акваторий ЦВА, в пространстве двух координат в соответствии со скорректированными (с точки зрения влияния нуль-аллелей) генетическими дистанциями Кавалли–Сфорца (обозначения как в табл. 1).
При оценке генетической подразделенности группировки африканской скумбрии получены демонстрировавшие высокую степень сходства исследовавшихся выборок попарные значения показателя генетической идентичности Нея (I = 0.975–1.003). При этом при глобальной оценке генетической дифференциации, рассчитанной по всем локусам, получены низкие, но достоверные значения θ (0.0052 c 95%-ным бутстреп-интервалом 0.0015–0.0091). Наибольший вклад в оценку θ вносят локусы SJT36 (θ = 0.0146), SJT5 (θ = 0.0118), SJNT66 (θ = 0.0072), SJT25 (θ = 0.0058). Понимая, что на формирование значения θ могут оказывать связанные с нуль-аллелями погрешности, все же возможно допущение и того, что полученные оценки в определенной степени могут свидетельствовать в пользу структуры со слабой генетической подразделенностью [35, 36] в анализируемой группировке африканской скумбрии ЦВА.
Показатель интенсивности генных потоков (Nm) [37] может характеризовать особенности структурированности исследуемой группировки. Так, например, для атлантической трески показано, что, если в рамках акваторий Северо-Восточной Атлантики интенсивность генных потоков высокая (Nm = 37.06), то между Северо-Восточной Атлантикой и Северо-Западной Атлантикой, в силу особенностей гидрологических характеристик, интенсивность генных потоков падает (Nm = 8.27), что способствует формированию определенного уровня генной подразделенности [38]. Сходная ситуация показана для европейского анчоуса Азово-Черноморского бассейна, демонстрирующего слабую генетическую подразделенность на фоне высокой интенсивности генных потоков (Nm = 86.58).
Что касается анализируемой в нашей работе группировки африканской скумбрии ЦВА, то оценка этого показателя в программе GENEPOP 4.2 дала усредненное довольно низкое значение Nm = 13.20, что, соответственно, сопровождается отклонением от гомогенной структуры с панмиксией. Учитывая относительно небольшую протяженность района сбора используемого в нашей работе экспериментального материала африканской скумбрии (в пределах 500 км), ее пелагический образ жизни, значительный период времени денатантных миграций в раннем развитии, высокую мигрантность половозрелых особей скумбрии, следовало бы ожидать гораздо более высокий показатель интенсивности генных потоков. Не забывая о возможном определенном отклонении значения Nm из-за смещения аллельных частот, мы также можем допустить и влияние антропогенного фактора на ограничение интенсивности генных потоков и формирование определенного (невысокого) уровня структурированности в анализируемой группировке африканской скумбрии.
Дело в том, что как хозяйственно ценный объект африканская скумбрия находится под прессом рыболовного промысла. При этом, несмотря на существующие ограничения невозможно обеспечить равномерное распределение промыслового усилия по всей акватории. Неминуемо, рыболовные суда концентрируются в участок ареала с максимальной плотностью объекта вылова. В результате этого одни субпопуляции перелавливаются, другие недолавливаются. В связи с этим происходит нарушение естественно сложившихся каналов миграционной связи между элементами системы, в некоторой степени нарушается сложившаяся генетическая структура популяции [39, 40]. Предположить в нашем случае другие возможные механизмы дифференциации в группировках морских рыб (как то: океанические фронты, зоны апвеллинга, течения и др.) довольно сложно в связи с ограниченностью акваторий взятия выборок и биологическими характеристиками африканской скумбрии.
Исходя из вышеизложенного можно отметить, что впервые с помощью селективно нейтральных генетических маркеров – микросателлитных локусов ядерной ДНК проведен анализ уровня популяционно-генетической структурированности группировки африканской скумбрии акваторий ЦВА. Выявлено устойчивое отклонение от HWE, одной из основных причин которого может быть присутствие нуль-аллелей почти в половине исследовавшихся микросателлитных локусов. Это может быть связано в том числе с применением праймеров, секвенированных ранее для сестринского вида из рода Scomber [9]. Выявлена слабая структурированность группировки африканской скумбрии на акваториях ЦВА, где был собран исследуемый материал. Поводом к этому может быть интенсивный (с неравномерным распределением нагрузки) промысел запасов пелагических рыб в марокканско-мавританских экономических водах.
Полученные в настоящем исследовании первичные данные предполагают полезность и необходимость развития популяционно-генетических исследовательских работ для дальнейшего изучения и мониторинга группировки африканской скумбрии ЦВА. Одним из направлений исследовательских работ является совершенствование методической исследовательской базы, направленное на обнаружение альтернативных праймеров для выявления нуль-аллелей. Практическая составляющая развития исследований состоит в отработке методологий применения получаемых результатов для мониторинга и совершенствования промысла, направленных на восстановление нативной популяционной структуры африканской скумбрии акваторий ЦВА.
Авторы выражают благодарность за консультации и помощь при подготовке материалов статьи: К.И. Афанасьеву, (ИОГен РАН), А.М. Хрусталевой (ИБГ РАН), А.В. Семеновой, И.М. Полушкиной (каф. ихтиологии МГУ).
Сбор материала осуществлялся в экспедициях ВНИРО, а обработка и анализ проводились в рамках плановых исследований по основным гостемам без привлечения финансирования по грантам.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Парин Н.В., Евсеенко С.А., Васильева Е.Д. Рыбы морей России: аннотированный каталог. М.: Тов-во науч. изданий КМК, 2014. 733 с.
Muniz A.A., Moura A., Triay-Portella R. et al. Population structure of the chub mackerel (Scomber colias) in the North-east Atlantic inferred from otolith shape and body morphometrics // Marine and Freshwater Res. 2020. V. 72. № 3. P. 341–352. https://doi.org/10.1071/MF19389
Allaya H., Hattour A., Hajjej G., Trabelsi M. Biologic characteristics of Scomber japonicus (Houttuyn, 1782) in Tunisian waters (central Mediterranean Sea) // African J. Biotechnol. 2013. V. 12. P. 3040–3048. https://doi.org/10.5897/AJB12.2723
Allaya H., Ben Faleh A., Rebaya M. et al. Identification of Atlantic chub mackerel Scomber colias population through the analysis of body shape in Tunisian waters // Cah. Biol. Mar. 2016. V. 57. P. 195–207.
Scoles D.R., Collette B.C., Graves J.E. Global phylogeography of mackerels of the genus Scomber // Fisheries Bulletin. 1998. V. 96. P. 823–842.
Catanese G., Manchado M., Infante C. Evolutionary relatedness of mackerels of the genus Scomber based on complete mitochondrial genomes: Strong support to the recognition of Atlantic Scomber colias and Pacific Scomber japonicus as distinct species // Gene. 2010. V. 452. P. 35–43. https://doi.org/10.1016/j.gene.2009.12.004
Zardoya R., Castilho R., Grande C. et al. Differential population structuring of two closely related fish species, the mackerel (Scomber scombrus) and the chub mackerel (Scomber japonicus), in the Mediterranean Sea // Mol. Ecol. 2004. V. 13. P. 1785–1798.
Rodríguez-Ezpeleta N., Bradbury I.R., Mendibil I. et al. Population structure of Atlantic mackerel inferred from RAD-seq-derived SNP markers: Effects of sequence clustering parameters and hierarchical SNP selection // Mol. Ecol. Resources. 2016. V. 16. I. 4. P. 991–1001. https://doi.org/10.1111/1755-0998.12518
Zeng L., Cheng Q. Thirty novel microsatellite markers for the coastal pelagic fish, Scomber japonicus (Scombridae) // J. Genet. 2012. V. 91. P. e64–e68.
Маниатис Т., Фрич Э., Cэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 480 с.
Weir B.S. Genetic Data Analysis II. Methods for Discrete Population Genetic Data. Massachusets: Sinauer Ass. Sunderland, 1996. 445 p.
Lewis P.O., Zaykin D. Genetic Data Analysis: Computer program for the analysis of allelic data. Version 1.0 (d 16c). 2001. Free program distributed by the authors over the internet from. http://lewis.eeb.unconn.edu/lewishome/software.html
Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals // Genetics. 1978. V. 89(3). P. 583–590.
Ивантер Э.В., Коросов А.В. Введение в количественную биологию. Петрозаводск: Петр. ГУ, 2003. 304 с.
Rice W.R. Analyzing tables of statistical tests // Evolution. 1989. V. 43. P. 223–225.
Rousset F. Genepop 007: A complete reimplementation of the genepop software for Windows and Linux // Mol. Ecol. Res. 2008. V. 8. P. 103–106. https://doi.org/10.1111/j.1471-8286.2007.01931.x
Piry S., Luikart G., Conuet J.M. Bottleneck: A computer program for detecting recent reduction in the effective population size using allele frequency data // J. Hered. 1999. V. 90. P. 502–503.
Van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. MICROCHECKER: Software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538.
Chapuis M.P., Estoup A. Microsatellite null alleles and estimation of population differentiation // Mol. Biol. Evol. 2007. V. 24. P. 621–631. https://doi.org/10.1093/molbev/msl191
Кордичева С.Ю., Рубцова Г.А., Шитова М.В. и др. Выявление нуль-аллелей в микросателлитном локусе кеты (Onсorhynсhus keta Walbaum) // Генетика. 2010. Т. 46. № 8. С. 1143–1147.
Смирнова М.А., Орлова С.Ю., Калчугин П.В. и др. Особенности популяционной структуры тихоокеанской трески Gadus macrocephalus южной части ареала на основе микросателлитного анализа // Генетика. 2018. Т. 54. № 6. С. 661–670.
Савенков В.В., Шпигальская Н.Ю., Варкентин А.И. и др. Дифференциация минтая (Theragra chalcogramma) Охотского моря по микросателлитным локусам // Исследов. водных биол. ресурсов Камчатки и северо-западной части Тихого океана. 2018. Вып. 48. С. 5–18.
Семенова А.В., Строганов А.Н., Афанасьев К.И. и др. Микросателлитная изменчивость тихоокеанской сельди Clupea pallasii Valenciennes 1847 Охотского и Берингова морей // Генетика. 2018. Т. 54. № 3. С. 349–360.
Семенова А.В., Строганов А.Н., Бугаев А.В. и др. Анализ изменчивости микросателлитных локусов в популяциях азиатской зубастой корюшки Osmerus dentex Восточной и Западной Камчатки // Генетика. 2019. Т. 55. № 1. С. 70–80. https://doi.org/10.1134/S0016675819010041
Zhan A., Hu J., Hu X. et al. Construction of microsatellite-based linkage maps and identification of size-related quantitative trait loci for Zhikong scallop (Chlamys farreri) // Animal Genet. 2009. № 40. P. 821–831. https://doi.org/10.1111/j.1365-2052.2009.01920.x
Шубина Е.А., Пономарева Е.В., Глубоков А.И. Популяционно-генетический анализ минтая Theragra chalcogramma (Teleostei, Gadidae) из Беренгового и Охотского морей // Мол. биология. 2009. Т. 43. № 5. С. 918–930. https://doi.org/10.1134/S0026898409050164
Кордичева С.Ю. Нуль-аллели в микросателлитных локусах кеты (Oncorhynchus keta Walbaum). Дис. … канд. биол. наук. М.: ИОГен РАН. 2011. 120 с.
Ellegren H. Microsatellites: Simple sequences with complex evolution // Nature Rev. Genet. 2004. V. 5. P. 435–445.
Тетерина В.И., Суханова Л.В., Кирильчик С.В. Полиморфизм микросателлитной ДНК эндемичного рода рыб оз. Байкал – голомянок (Comephorus lacepede, 1801) // Экол. генетика. 2007. Т. 5. № 2. С. 50–57.
Collette B.B., Nauen C.E. FAO Species Catalogue. Scombrids of the World. An Annotated and Illustrated Catalogue of Tunas, Mackerels, Bonitos and Related Species Known to Date. FAO Fish. Synop. № 125. Italy, Rome: FAO, 1983. V. 2. 137 p.
Collette B.B. Family Scombridae Rafinesque 1815 – Mackerels, Tunas, and Bonitos. Calif. Acad. Sci. Annotated Check lists of Fishes. № 19. USA, San Francisco: California Acad. of Sci., 2003. 28 p.
Галинская Т.В., Щепетов Д.М., Лысенков С.Н. Предубеждения о микросателлитных исследованиях и как им противостоять // Генетика. 2019. Т. 55. № 6. С. 617–632. https://doi.org/10.1134/S0016675819060043
Толстова Ю.Н. Основы многомерного шкалирования: учебное пособие. М.: КДУ, 2006. 157 с.
Хрусталева А.М., Кловач Н.В. О морфологической и генетической гетерогенности нерки Oncorhynchus nerka (Salmonidae) крупных озерно-речных систем Восточной и Западной Камчатки // Вопр. ихтиологии. 2019. Т. 59. № 6. С. 640–650. https://doi.org/10.1134/S0042875219060055
Животовский Л.А. Популяционная биометрия. М.: Наука, 1991. 276 с.
Кузнецов В.М. F-статистики Райта: оценка и интерпретация // Пробл. биол. продуктивных животных. 2014. Т. 4. С. 80–104.
Slatkin M. Gene flow in natural populations // Ann. Rev. Ecol. Syst. 1985. V. 16. P. 393–430.
Строганов А.Н., Орлов А.М., Семенова А.В., Орлова С.Ю. Формирование популяционной структуры атлантической трески Gadus morhua Linnaeus, 1758 в четвертичном периоде // Биология моря. 2019. Т. 45. № 1. С. 17–24. https://doi.org/10.1134/S0134347519010091
Алтухов Ю.П. Генетические процессы в популяциях. М.: Наука, 1989. 328 с.
Алтухов Ю.П. Динамика генофондов при антропогенных воздействиях // Вестник ВОГиС. 2004. Т. 8. № 2. С. 40–59.
Дополнительные материалы отсутствуют.