Генетика, 2023, T. 59, № 2, стр. 184-195
Генетическая дифференциация четырехрогого керчака Myoxocephalus quadricornis (Linnaeus, 1758) и его положение в трибе Myoxocephalini Taranetz (Cottidae: Myoxocephalinae)
И. Н. Морева 1, 2, *, О. А. Радченко 2, А. В. Петровская 2
1 Национальный научный центр морской биологии им. А.В. Жирмунского
Дальневосточного отделения Российской академии наук
690041 Владивосток, Россия
2 Институт биологических проблем Севера Дальневосточного отделения
Российской академии наук
685000 Магадан, Россия
* E-mail: irruz@yandex.ru
Поступила в редакцию 14.03.2022
После доработки 27.04.2022
Принята к публикации 11.05.2022
- EDN: KXUTDG
- DOI: 10.31857/S0016675823020066
Аннотация
Проведено молекулярно-генетическое и кариологическое исследование четырехрогого керчака Myoxocephalus quadricornis (Linnaeus, 1758). Впервые изучен кариотип и приведены результаты Ag-окрашивания хромосом экземпляров вида из Восточно-Сибирского моря. Кариотип M. quadricornis стабилен, содержит 32 (10 метацентриков, 2 субметацентрика, 20 субтелоцентриков) хромосомы, число хромосомных плеч – 44. Ядрышковые организаторы выявлены в теломерных районах коротких плеч двух гомологичных субтелоцентриков среднего размера. Обнаружена изменчивость по числу ядрышкообразующих хромосом и окрашиваемых блоков ядрышковых организаторов. Общие признаки в хромосомных наборах M. quadricornis и Megalocottus platycephalus указывают на их более значительную близость по сравнению с видами рода Myoxocephalus. Результаты кариологического анализа согласуются с молекулярно-генетическими данными о сестринских отношениях M. quadricornis и Megalocottus platycephalus. Выявлен комплекс кариологических и молекулярно-генетических признаков, позволяющих надежно отличать M. quadricornis от видов трибы Myoxocephalini и свидетельствующих о необходимости его выведения из рода Myoxocephalus.
Арктический циркумполярный вид Myoxocephalus quadricornis – один из наиболее широко распространенных представителей подсемейства Myoxocephalinae. Кроме арктических морей он обитает в Северной Пацифике и Атлантике, южнее Берингова пролива до Анадырского лимана и залива Нортон, по атлантическому побережью Северной Америки до Лабрадора [1–3]. Рогатка встречается в хорошо прогреваемых водах с соленостью не выше 24‰, преимущественно 5–12‰, на глубинах от 0 до 50 м, а также в эстуариях и верховьях рек до 150 км от моря [4–6]. В отличие от видов подсемейства Myoxocephalinae, ведущих морской образ жизни, рогатка обитает в ряде крупных озер Евразии и Северной Америки, часть из которых не имеет сообщения с морем [7]. В озерах этот бычок образует реликтовые жилые формы. По мнению специалистов, реликтовые формы из озер Северной Америки и Европы произошли от арктических морских M. quadricornis, вытесненных на юг, в пресноводные места обитания, в результате наступления ледников в раннем и среднем плейстоцене [5, 8–10]. Пресноводные рогатки, в отличие от морских, глубоководные, обитают при очень низкой температуре в хорошо насыщенной кислородом воде [4, 5]. В двух крупнейших озерах Канады этот бычок обнаружен на глубине около 366 м [11]. Несмотря на то что жилые формы считаются пресноводными, они способны обитать в солоноватых и сильно соленых водах [5].
Разнообразные условия обитания и географическая изоляция пресноводных жилых форм, морских и пресноводных популяций стали причиной возникновения значительной изменчивости морфологических признаков вида. Например, различия в числе позвонков; наличие/отсутствие заглазничных и затылочных бугров, бугорков ниже боковой линии; различия размеров и формы заглазничных и затылочных бугров [12–14]. В результате исследования мтДНК обнаружены генетические отличия североамериканской континентальной глубоководной рогатки от арктических морских и не имеющих выхода к морю популяций [9]. Вследствие разных точек зрения на значимость обнаруженных различий единое мнение о видовой и внутривидовой систематике рогаток отсутствует [1, 6].
До настоящего времени не решен вопрос о том, к какому роду относится рогатка. На основании изучения морфологических признаков, преимущественно сейсмосенсорной системы, этих бычков относят к роду Triglopsis Girard, 1851 [1]. В результате ДНК-штрихкодирования рогатка была включена в род Myoxocephalus Tilesius, 1811 [15]. Последующее изучение мтДНК видов рода Myoxocephalus показало, что M. quadricornis и остальные его виды принадлежат к разным филогенетическим группам [16]. Установлена близость четырехрогого керчака с Megalocottus platycephalus (Pallas, 1814), предложено включить M. quadricornis в состав рода Megalocottus Gill, 1861 [17].
Для решения вопроса о положении четырехрогого керчака в системе подсемейства Myoxocephalinae необходимы дальнейшие исследования, в том числе генетическими методами. До настоящего времени самостоятельные работы по кариологической и молекулярно-генетической дифференциации этого вида отсутствовали. Цель нашей работы – с помощью рутинного и Ag-окрашиваний изучить хромосомный набор Myoxocephalus quadricornis, сравнить его с кариотипами видов родов Myoxocephalus и Megalocottus, сопоставить кариологические результаты с данными анализа изменчивости генов COI, цитохрома b, 16S рРНК мтДНК, определить степень генетической дифференциации и родственные связи рогатки. В настоящем исследовании состав трибы Myoxocephalini (роды Myoxocephalus и Megalocottus) приведен по Неелову (1979), исключая род Triglopsis. В соответствии с каталогом рыб Мирового океана Triglopsis quadricornis является младшим синонимом Myoxocephalus quadricornis [18].
МАТЕРИАЛЫ И МЕТОДЫ
Объем исследованного материала приведен в табл. 1. Рыбы выловлены сетями в июле 2021 г., в устье р. Пучевеем (бассейн Чаунской губы Восточно-Сибирского моря). Видовая принадлежность экземпляров определена по морфологическим признакам [1]. Часть материала для молекулярно-генетического анализа (№ 2260, 2271, 2274, 2273) любезно предоставлена Валентиной Сиделевой (лаборатория ихтиологии Зоологического института РАН).
Таблица 1.
Список исследованных экземпляров Myoxocephalus quadricornis, видов трибы Myoxocephalinii и внешней группы (* – образцы изучены кариологически)
| Вид (№ образца) | Район сбора | Номер в GenBank | ||
|---|---|---|---|---|
| COI | 16S рРНК | цит. b | ||
| Myoxocephalus quadricornis (2079) | Восточно-Сибирское море, Чаунская губа, устье р. Пучевеем | MN877736 | MN871888 | MN877761 |
| M. quadricornis (2167) | » | MN877737 | MN871889 | MN877762 |
| M. quadricornis (2308)* | » | OM758098 | OM758108 | OM801278 |
| M. quadricornis (2309)* | » | OM758099 | OM758109 | OM801279 |
| M. quadricornis (2310)* | » | OM758100 | OM758110 | OM801280 |
| M. quadricornis (2311)* | » | OM758101 | OM758111 | OM801281 |
| M. quadricornis* | » | – | – | – |
| M. quadricornis* | » | – | – | – |
| M. quadricornis* | » | – | – | – |
| M. quadricornis* | » | – | – | – |
| M. quadricornis* | » | – | – | – |
| M. quadricornis* | » | – | – | – |
| M. quadricornis* | » | – | – | – |
| M. quadricornis (2260) | Белое море, Кандалакшский з. | OM758102 | OM758112 | OM801282 |
| M. quadricornis (2271) | » | OM758103 | OM758113 | OM801283 |
| M. quadricornis (2274) | » | OM758104 | OM758114 | OM801284 |
| M. scorpius (2273) | » | OM758105 | OM758115 | OM801285 |
| M. stelleri (1754)* | Японское море, з. Восток | KY062754 | KY062665 | MH595735 |
| M. jaok (1772)* | Охотское море, б. Шестакова | MN877722 | MN871874 | MN877747 |
| M. polyacanthocephalus (1745)* | О-в Шикотан, б. Горобец | MN115338 | MN097194 | MN115374 |
| M. ochotensis (1900)* | Охотское море, з. Одян | MH595733 | MH588265 | MH595734 |
| M. brandtii (1988)* | Татарский пролив, з. Шебунина | MN877732 | MN871884 | MN877757 |
| Megalocottus platycephalus (1790) | Охотское море, б. Шестакова | MH016197 | MH012123 | MH016217 |
| Microcottus sellaris (2157)* | Японское море, о-в Русский | MN877738 | MN871890 | MN877763 |
| Porocottus minutus (1934)* | Охотское море, о-в Недоразумения | MH172269 | MH167465 | MH172287 |
| Argyrocottus zanderi (1734) | О-в Шикотан, б. Крабовая | MN877739 | MN871891 | MN877764 |
| Alcichthys elongatus (2000) | Японское море, з. Восток | MH172282 | MH167478 | MH172300 |
Кариологический анализ
Изучены кариотипы восьми самок, трех самцов Myoxocephalus quadricornis. Хромосомные препараты приготовлены из суспензии клеток переднего отдела почки рыб методом воздушного высушивания [19]. Для первичного анализа кариотипа хромосомы окрашивали 4%-ным раствором красителя Гимза (Giemsa). После просмотра под микроскопом и съемки лучших метафазных пластинок препараты отмывали в 70%-ном этиловом спирте. Затем для выявления активных ЯО на тех же препаратах проводили Ag-окрашивание [20].
Использовали общепринятую в цитогенетических исследованиях классификацию хромосом [21]. Равноплечие метацентрические (М) и неравноплечие субметацентрические (СМ) хромосомы относили к двуплечим, субтелоцентрические (СТ) с очень коротким вторым плечом и акроцентрические (А) с невидимым вторым плечом – к одноплечим хромосомам.
Для сравнительного анализа привлечены данные о кариотипах шести видов рода Myoxocephalus и Megalocottus platycephalus (северной Megalocottus platycephalus platycephalus (Pallas, 1814) и южной M. p. taeniopterus (Kner, 1868) дальневосточных широколобок) [22–25]. Хромосомные наборы Megalocottus p. platycephalus и M. p. taeniopterus сходны (2n = 42, NF = 44 + 2). В кариотипах изученных видов пара хромосом с изменчивой морфологией обозначена как субмета-субтелоцентрик (СМ-СТ) [16].
Молекулярно-генетический анализ
Проведен анализ изменчивости нуклеотидных последовательностей генов COI, цитохрома b и 16S рРНК мтДНК Myoxocephalus quadricornis и видов трибы Myoxocephalini. Четыре вида семейства Cottidae из подсемейств Myoxocephalinae (Microcottus sellaris (Gilbert, 1895), Porocottus minutus (Pallas, 1814), Argyrocottus zanderi (Herzenstein, 1892)) и Pseudoblenniinae (Alcichthys elongatus Steindachner, 1881) использованы как внешняя группа. Геномная ДНК выделена из мышечной ткани по стандартной методике, включающей лизис ткани 1% SDS в присутствии протеиназы К (0.2 мг/мл) и депротеинизацию фенолом [26]. Условия амплификации и секвенирования ДНК, последовательности олигонуклеотидных праймеров использованы из предшествующей работы: COI – F-33 и R-1421; цитохром b – L14795 и H15844; 16S рРНК – L2510 и H3080 [27]. Секвенирование ДНК выполнено на автоматическом секвенаторе ABI Prism 3500xL Genetic Analyzer (Applied Biosystems, США) в лаборатории генетики Института биологических проблем Севера ДВО РАН, Магадан, Россия.
Попарные генетические дистанции рассчитаны для объединенных последовательностей генов COI, цитохрома b, 16S рРНК мтДНК в программе MEGA Х методом максимального правдоподобия (ML) с учетом гетерогенности скорости нуклеотидных замен (гамма-распределение G). Оптимальные модели нуклеотидных замен выбраны с использованием информационного критерия BIC (Bayesian Information Criterion) в программе M-EGA Х. Филогенетический анализ выполнен методом байесовского анализа в программе MrBayes v3.2.1 [28]. Для контроля динамики байесовского анализа использована программа Tracer v1.7 [29]. Установки для анализа МСМС были следующие: четыре цепи, 1 000 000 генераций и отбор деревьев через каждые 100 генераций. Значения вероятности достигли плато в течение 12 000–15 000 генераций. Значения логарифмической вероятности увеличились с менее чем –6976.890 до примерно ‒3843.392 в первых 5000 генераций, затем примерно до –3787.602 после 500 000 генераций. Из 10 001 дерева первые 1001 с нестабильными параметрами моделей нуклеотидных замен были отброшены, а остальные использовались для получения консенсусных деревьев и апостериорных вероятностей их ветвления. Узлы ветвления с оценками вероятности ≥95% приняты как достоверные [30].
РЕЗУЛЬТАТЫ
Кариологический анализ
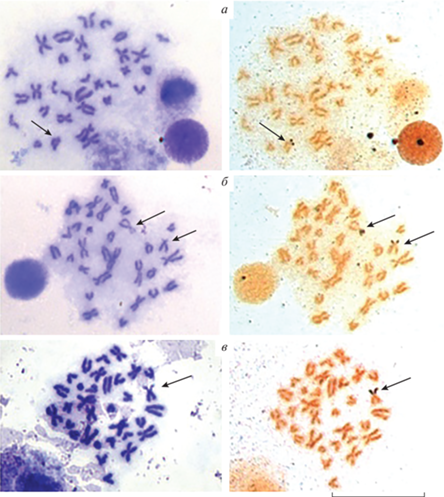
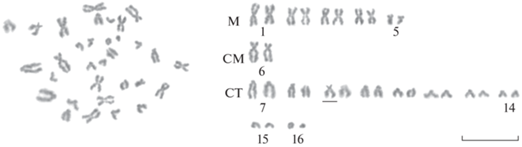
Описание кариотипа Myoxocephalus quadricornis составлено по результатам анализа 300 рутинно окрашенных метафазных пластинок. Кариотип состоит из 32 хромосом (2n), число хромосомных плеч (NF) – 44 (рис. 1 ). Двуплечие хромосомы представлены парой крупных метацентриков (пара 1). Следующие три пары метацентриков (пары 2, 3, 4) – среднего размера. Метацентрики пятой пары среди двуплечих хромосом (пары 1–6) имеют самые мелкие размеры. Субметацентрики вида (пара 6) соответствуют по размерам его крупным метацентрикам (пара 1). Ряд одноплечих хромосом состоит из пары крупных субтелоцентриков (пара 7), короткие плечи которых, независимо от степени их спирализации, всегда хорошо выражены. Размеры этих субтелоцентриков сходны с размерами крупных метацентриков и субметацентриков (пары 1, 6) вида. У остальных девяти пар субтелоцентриков (пары 8–16), в разных метафазных пластинках, короткие плечи могут быть выражены в разной степени, но достаточной для того чтобы выделить их в отдельный, плавно уменьшающийся по размерам ряд. Пять пар метацентриков, пара крупных субметацентриков и пара крупных субтелоцентриков хорошо идентифицируются во всех исследованных метафазных пластинках и рассматриваются нами как маркерные в кариотипе M. quadricornis. Изменчивость по числу хромосом не обнаружена, различий по 2n и NF между кариотипами самцов и самок не выявлено.
Установлены общие признаки кариотипов M. quadricornis и изученных видов трибы Myoxocephalini. Четырехрогий керчак имеет одинаковое число хромосомных плеч (44) с M. jaok (Cuvier, 1829) и M. scorpius (Linnaeus, 1758) (рис. 1; рис. 2 ,а, б). У M. quadricornis так же, как у Megalocottus p. taeniopterus, при рутинном окрашивании наблюдается вариабельность размера короткого плеча одного из гомологов пары субтелоцентриков (рис. 1: пара 9; рис. 3 ,а: пара 5). В кариотипах видов можно выделить сходные по морфологии и размерам маркерные хромосомы.
Рис. 1.
Метафазная пластинка и кариограмма M. quadricornis – 2n = 32, NF = 44. Цифры (здесь и на рис. 2, 3) – порядковые номера пар хромосом в кариограмме. Хромосома изменчивой морфологии подчеркнута. Масштабная линейка: 10 мм.
Крупные метацентрики (рис. 1: пара 1) M. quadricornis соответствуют крупным метацентрикам M. jaok (рис. 2,а: пара 1); вторая и третья пары метацентриков четырехрогого керчака (рис. 1) – второй паре метацентриков у M. jaok (рис. 2,а); метацентрики 4-й пары (рис. 1) вида – метацентрикам M. jaok (рис. 2,а: пара 3), M. scorpius (рис. 2,б: пара 1), M. stelleri Tilesius, 1811 (рис. 2,в: пара 1) и M. polyacanthocephalus (Pallas, 1814) (рис. 2,г: пара 1). Мелкие метацентрики M. quadricornis (рис. 1: пара 5) сходны с таковыми у M. jaok (рис. 2,а: пара 8), M. polyacanthocephalus (рис. 2,г: пара 2), M. ochotensis Schmidt, 1929 (рис. 2,е: пара 1) и Megalocottus platycephalus (рис. 3,а: пара 1). Субметацентрики рогатки (рис. 1: пара 6) соответствуют по размеру субметацентрикам M. jaok (рис. 2,а: пары 9, 10), M. scorpius (рис. 2,б: пара 2) и M. stelleri (рис. 2,в: пара 2).
Рис. 2.
Слева: кариограмма Myoxocephalus jaok – 2n = 24, NF = 44 (a) и фрагменты кариограмм M. scorpius – 2n = 36, NF = 44 (б, по: Васильев, 1985, с изменениями), M. stelleri – 2n = 40, NF = 44 + 2 (в), M. polyacanthocephalus – 2n = 40, NF = 44 + 2 (г), M. brandtii – 2n = 44, NF = 46 + 2 (д), M. ochotensis – 2n = 42, NF = 44 + 2 (е) и M. stelleri – 2n = 44, NF = = 44 + 2 (ж); справа: ЯО-хромосомы видов (по: Морева, Борисенко, 2017). Прочерк – СТ и А хромосомы среднего и мелкого размера пропущены. Масштабная линейка: 10 мм.

Рис. 3.
Кариограмма – 2n = 42, NF = 44 + 2 (а) и фрагменты кариограмм с ЯО-хромосомами с одинарными и двойными блоками ЯО у M. platycephalus taeniopterus (б); с одинарными, двойными и тройными блоками ЯО у Megalocottus p. platycephalus (в) (по: Морева, Борисенко, 2015, с изменениями). ЯО-хромосомы подчеркнуты. Масштабная линейка: 10 мм.

С помощью Ag-окрашивания проанализированы 210 метафазных пластинок вида. Активные ЯО локализованы в теломерных районах коротких плеч гомологичных субтелоцентриков средних размеров (рис. 4 ). В метафазных пластинках наблюдалась изменчивость в виде разного числа (одна или две) ядрышкообразующих хромосом (ЯО-хромосом) и по числу окрашиваемых блоков ЯО в хромосоме (рис. 4). В 45% метафазных пластинок окрашивались одинарные, в 40% – двойные и в 15% – тройные блоки ЯО. Число окрашиваемых ядрышек в интерфазных ядрах – одно или два.
Молекулярно-генетический анализ
Нуклеотидные последовательности участков генов COI, цитохрома b и 16S рРНК размещены в GenBank/NCBI (www.ncbi.nlm.nih.gov), их регистрационные номера указаны в табл. 1. Обнаружены следующие показатели генетической изменчивости видов трибы Myoxocephalini. Для гена COI (1008 пар нуклеотидов, пн) идентифицировано 154 нуклеотидные замены и 149 полиморфных сайтов, 94 (9.3%) из которых филогенетически информативные. Из 336 кодируемых аминокислотных остатков вариабельных нет. Для гена цитохрома b (747 пн) идентифицировано 142 нуклеотидные замены и 131 полиморфный сайт, 90 (12.1%) из которых филогенетически информативные. Из 249 кодируемых аминокислотных остатков пять вариабельных. Для гена 16S рРНК (600 пн) идентифицировано 15 нуклеотидных замен и 12 полиморфных сайтов, 11 (1.8%) из которых филогенетически информативные.
Показатели генетической изменчивости M. quadricornis следующие. Для гена COI идентифицировано 11 нуклеотидных замен и 11 полиморфных сайтов, шесть (0.6%) из которых филогенетически информативные. Для гена цитохрома b идентифицировано 16 нуклеотидных замен и 16 полиморфных сайтов, 10 (1.4%) из которых филогенетически информативные; из 249 кодируемых аминокислотных остатков четыре вариабельных. Для гена 16S рРНК идентифицировано три нуклеотидные замены и три полиморфных сайта, два (0.3%) из которых филогенетически информативные. У рогатки обнаружено восемь гаплотипов.
Во всех исследованных генах обнаружены мутации, маркирующие вид M. quadricornis и отличающие его от видов рода Myoxocephalus: 40, 30 и 4 замены нуклеотидов для генов COI, цитохрома b и 16S рРНК. В соответствии с данными табл. 2 значения ML-дистанций между мтДНК M. quadricornis и внешней группы варьируют от 7.06% (M. quadricornis/Microcottus sellaris) до 12.7% (M. quadricornis/Alcichthys elongatus). Между M. quadricornis и видами рода Myoxocephalus минимальное значение составило 6.93% (с M. stelleri, M. polyacanthocephalus и M. ochotensis), максимальное – 7.54% (с M. brandtii). Генетические дистанции между M. quadricornis и Megalocottus platycephalus варьируют от 2.75 до 2.88%. Среднее значение ML-дистанций в пределах M. quadricornis составило 0.45%.
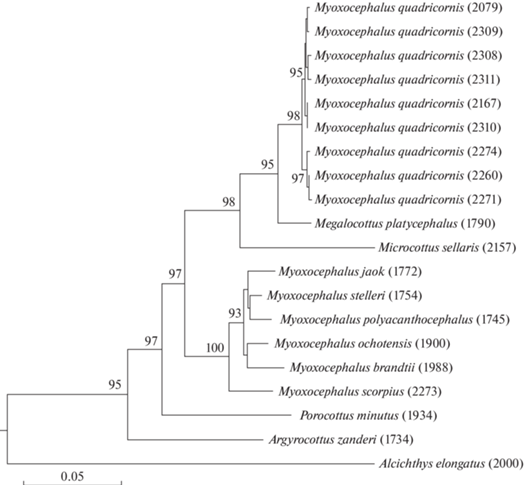
По данным об объединенных последовательностях мтДНК реконструировано байесовское филогенетическое дерево (рис. 5 ). В основании находятся ДНК видов внешней группы, исключая Microcottus sellaris. Триба Myoxocephalini разделяется на кластер видов Myoxocephalus и кластер M. quadricornis вместе с Megalocottus platycephalus. К последнему кластеру присоединяется Microcottus sellaris. Оценки апостериорной вероятности (РР ≥ 0.95) подтверждают достоверность ассоциаций типов ДНК.
ОБСУЖДЕНИЕ
В Восточно-Сибирском море рогатка – один из обычных видов морских прибрежных рыб [31, 32]. Так же как экземпляры вида от арктического побережья Аляски бычок из этой части ареала характеризуется сильным развитием на голове губчатых заглазничных и затылочных бугров, имеющих грибовидную форму. По мнению специалистов северная форма – подвид рогатки и должна иметь название Triglopsis quadricornis polaris (Sabine, 1821) [6]. Цитогенетические исследования особей вида из Восточно-Сибирского моря не проводились. В литературных источниках есть формула кариотипа M. quadricornis (Triglopsis quadricornis) из Белого моря [33]. Исходя из формулы кариотипа – 2n = 32 (12M/СМ + 20СТ), NF = 44 [33: по 34] и полученных нами результатов, морские представители M. quadricornis, как и большинство изученных ранее видов рода Myoxocephalus и Megalocottus platycephalus, стабильны по числу хромосом. Исключением являются M. scorpius и M. stelleri, для которых описан полиморфизм по центрическому слиянию [22, 27].
Дифференциация бычков по основным признакам кариотипов
На основе проведенных исследований установлено, что M. quadricornis по 2n отличается от всех изученных видов Myoxocephalus (рис. 2) и Megalocottus platycephalus (рис. 3,a). Обнаруженное отличие может являться следствием разного числа робертсоновских транслокаций, произошедших в процессе эволюции хромосомных наборов бычков. Изучение рыб подсемейства Myoxocephalinae показало, что робертсоновские транслокации – это основной механизм эволюционного изменения кариотипов не только видов трибы Myoxocephalini, но и представителей триб Microcottini Neelov и Enophryini Taranetz [22, 35].
В кариотипах бычков рода Myoxocephalus (кроме M. jaok, M. scorpius) и Megalocottus platycephalus есть пара мелких субмета-субтелоцентриков (рис 2,в, г: пара 3,д, е: пара 2,ж: пара 1; рис. 3,а: пара 2). В разных клетках бычков в зависимости от длины коротких плеч они могут выглядеть как двуплечие или как одноплечие хромосомы, поэтому в NF указаны два дополнительных хромосомных плеча: 46 + 2 и 44 + 2 [16]. M. jaok резко отличается от всех видов рода Myoxocephalus. Его кариотип преимущественно представлен двуплечими хромосомами (рис. 2,а). При этом уровень дифференциации мтДНК M. jaok и остальных видов соответствует межвидовым различиям в этом роде [16]. У M. scorpius выделить субмета-субтелоцентрики не представляется возможным из-за сильной спирализации хромосом в представленной автором кариограмме [22]. У M. quadricornis эта пара хромосом отсутствует. Большинство хромосом в метафазных пластинках вида хорошо идентифицируется. Исключением является один из гомологов пары субтелоцентриков (рис. 1: пара 9). В исследованных метафазных пластинках (55%) M. quadricornis эта хромосома имеет второе плечо бóльшего размера, чем у субтелоцентриков.
В отличие от большинства видов рода Myoxocephalus и Megalocottus platycephalus (рис. 2,б: пары 5, 6,в, г: пары 4, 5, д, е: пары 3, 4, ж: пары 2, 3; рис. 3,а: пары 3, 4), M. quadricornis имеет только одну пару крупных субтелоцентриков (рис. 1: пара 7). Возможно, причиной отсутствия у него второй пары маркерных хромосом этой морфологии является вовлечение их в робертсоновскую транслокацию. Размеры маркерных субтелоцентриков рогатки крупнее размеров маркерных субтелоцентриков видов рода Myoxocephalus и Megalocottus platycephalus. В отличие от четырехрогого керчака у M. stelleri, M. polyacanthocephalus, M. brandtii и Megalocottus platycephalus можно выделить еще одну пару крупных одноплечих хромосом (рис. 2,в, г: пара 6, д: пара 12,ж: пара 4; рис. 3,а: пара 18) маркерную для этих видов. У M. quadricornis остальные субтелоцентрические хромосомы – среднего и мелкого размера. В хромосомном наборе M. quadricornis отсутствуют акроцентрики, имеющиеся в кариотипах всех изученных видов Myoxocephalus и Megalocottus.
Дифференциация кариотипов бычков по числу и локализации активных ЯО
В кариотипах большинства исследованных видов рода Myoxocephalus активные ЯО расположены в двух и более парах хромосом (рис. 2,в, д, е, ж). В отличие от них у M. quadricornis ЯО имеются лишь в одной паре субтелоцентриков. ЯО в субтелоцентриках средних размеров, как один из вариантов локализации, встречается в кариотипах M. ochotensis и M. stelleri (при 2n = 44). Однако ЯО-хромосомы M. stelleri (рис. 2,ж: пара 8) мельче, чем у M. quadricornis. Четырехрогий керчак и M. ochotensis различаются по локализации ЯО (рис. 2,е: пара 5; рис. 4). У M. jaok и у M. polyacanthocephalus так же, как и у M. quadricornis, ЯО расположены в одной паре хромосом, но у всех трех видов морфология ЯО-хромосом различна (рис. 2,a: пара 9,г: пара 2; рис. 4).
Несмотря на сходство хромосомных наборов Megalocottus platycephalus platycephalus и M. p. taeniopterus, они хорошо дифференцируются по числу и локализации активных ЯО (рис. 3). M. quadricornis отличается от Megalocottus p. taeniopterus по числу ЯО (рис. 3,б: пары 5, 18). Размеры ЯО-хромосом четырехрогого керчака (рис. 1: пара 9) и субтелоцентрических ЯО-хромосом Megalocottus p. taeniopterus (рис. 3,а: пара 5) сходны. У Megalocottus p. platycephalus так же, как и у M. quadricornis, ЯО локализованы в одной паре хромосом. Однако у северной дальневосточной широколобки ЯО окрашиваются в крупных субтелоцентриках (рис. 3,в: пара 3). У четырехрогого керчака, северной и южной дальневосточных широколобок наблюдается изменчивость морфологии ЯО-хромосом. У M. quadricornis и Megalocottus p. platycephalus ЯО выявляются в виде одинарных, двойных и тройных хорошо различимых блоков; у Megalocottus p. taeniopterus – в виде одинарных и двойных блоков. В зависимости от числа блоков ЯО длина коротких плеч заметно изменяется, а хромосомы могут выглядеть (как при рутинном, так и при Ag-окрашивании) у Megalocottus p. taeniopterus как субтело-, субметацентрики (рис. 3,б), у Megalocottus p. platycephalus и M. quadricornis как субтело-, субмета- или даже метацентрики, (рис. 3,в; рис. 4). Идентификация данных пар хромосом у бычков возможна только после Ag-окрашивания.
Генетическая дифференциация Myoxocephalus quadricornis
Единое мнение о статусе вида M. quadricornis отсутствует. Его относят к роду Triglopsis [1, 36, 37], рассматривают в составе рода Myoxocephalus [2, 3], объединяют с M. thompsonii в комплекс видов или разделяют на подвиды M. quadricornis quadricornis и M. q. thompsonii [9, 38, 39].
Сравнительный кариологический анализ показал, что, несмотря на наличие общих признаков, M. quadricornis значительно отличается от видов рода Myoxocephalus по числу и морфологии хромосом, от большинства видов этого рода по числу хромосомных плеч. Самые значительные различия между ними заключаются в числе и локализации активных ЯО. Полученные данные полностью согласуются с результатами молекулярно-генетического исследования этих рыб. В предшествующей работе был проведен молекулярно-генетический анализ рода Myoxocephalus, в котором использовано два экземпляра четырехрогого керчака из восточной части Арктики – Восточно-Сибирского моря [16]. В настоящей работе расширение выборки до девяти экземпляров и привлечение M. quadricornis из западной части Арктики (Белое море) подтвердило ранее полученные данные о значительных генетических отличиях M. quadricornis от остальных видов рода Myoxocephalus.
Значения ML-дистанций между видами рода Myoxocephalus варьируют в широких пределах – от 1.53 до 7.54% (табл. 2). Большой вклад в столь высокий уровень генетической дифференциации внутри рода вносят отличия мтДНК M. quadricornis, величина которых составляет в среднем 7.13%. Такая оценка соответствует различиям между видами близкородственных родов подсемейства Myoxocephalinae, но никак не различиям между видами одного рода. Например, ML-дистанции между Microcottus sellaris и M. quadricornis, которые принадлежат к близким родам, составляют 7.06–7.37%. Напротив, дистанции между M. scorpius и остальными видами рода Myoxocephalus, исключая M. quadricornis, составляют 3.36–3.97%, что в среднем в 2 раза ниже дистанций между видами разных родов.
Таблица 2.
Значения ML-дистанций (в %) для объединенных последовательностей генов COI, цитохрома b, 16S рРНК мтДНК Myoxocephalus quadricornis, видов трибы Myoxocephalini и внешней группы
| Вид | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. Myoxocephalus quadricornis (2079) | |||||||||||||||||||
| 2. M. quadricornis (2167) | 0.22 | ||||||||||||||||||
| 3. M. quadricornis (2308) | 0.31 | 0.26 | |||||||||||||||||
| 4. M. quadricornis (2309) | 0.09 | 0.13 | 0.22 | ||||||||||||||||
| 5. M. quadricornis (2310) | 0.22 | 0 | 0.26 | 0.13 | |||||||||||||||
| 6. M. quadricornis (2311) | 0.31 | 0.26 | 0.17 | 0.22 | 0.26 | ||||||||||||||
| 7. M. quadricornis (2260) | 0.70 | 0.65 | 0.74 | 0.61 | 0.65 | 0.74 | |||||||||||||
| 8. M. quadricornis (2271) | 0.78 | 0.74 | 0.83 | 0.70 | 0.74 | 0.83 | 0.09 | ||||||||||||
| 9. M. quadricornis (2274) | 0.70 | 0.65 | 0.74 | 0.61 | 0.65 | 0.74 | 0.26 | 0.35 | |||||||||||
| 10. M. scorpius (2273) | 7.15 | 7.11 | 7.28 | 7.15 | 7.11 | 7.28 | 7.11 | 7.11 | 7.19 | ||||||||||
| 11. M. stelleri (1754) | 6.97 | 6.93 | 7.02 | 6.97 | 6.93 | 7.02 | 7.02 | 7.11 | 7.02 | 3.36 | |||||||||
| 12. M. jaok (1772) | 7.15 | 7.11 | 7.19 | 7.15 | 7.11 | 7.19 | 7.24 | 7.32 | 7.24 | 3.79 | 1.79 | ||||||||
| 13. M. polyacanthocephalus (1745) | 6.97 | 6.93 | 7.02 | 6.97 | 6.93 | 7.02 | 6.93 | 7.02 | 7.02 | 3.71 | 1.53 | 2.05 | |||||||
| 14. M. ochotensis (1900) | 6.97 | 6.93 | 7.02 | 6.97 | 6.93 | 7.02 | 6.93 | 7.02 | 6.93 | 3.49 | 1.74 | 2.44 | 2.31 | ||||||
| 15. M. brandtii (1988) | 7.45 | 7.41 | 7.50 | 7.45 | 7.41 | 7.50 | 7.45 | 7.54 | 7.54 | 3.97 | 2.44 | 2.66 | 2.62 | 2.57 | |||||
| 16. Megalocottus platycephalus (1790) | 2.75 | 2.79 | 2.88 | 2.75 | 2.79 | 2.88 | 2.79 | 2.88 | 2.79 | 7.24 | 7.19 | 7.32 | 7.02 | 7.19 | 7.50 | ||||
| 17. Microcottus sellaris (2157) | 7.19 | 7.06 | 7.24 | 7.11 | 7.06 | 7.24 | 7.28 | 7.37 | 7.19 | 8.81 | 8.24 | 8.89 | 8.46 | 8.33 | 8.81 | 7.11 | |||
| 18. Porocottus minutus (1934) | 8.50 | 8.37 | 8.54 | 8.50 | 8.37 | 8.46 | 8.63 | 8.72 | 8.59 | 7.72 | 7.19 | 7.41 | 7.24 | 7.28 | 7.32 | 9.37 | 8.98 | ||
| 19. Argyrocottus zanderi (1734) | 8.98 | 8.85 | 9.02 | 8.89 | 8.85 | 8.94 | 8.81 | 8.89 | 8.85 | 8.59 | 8.41 | 8.41 | 8.41 | 8.24 | 8.24 | 9.68 | 8.89 | 9.24 | |
| 20. Alcichthys elongatus (2000) | 12.77 | 12.64 | 12.77 | 12.69 | 12.64 | 12.77 | 12.60 | 12.69 | 12.47 | 13.12 | 13.08 | 13.21 | 12.95 | 13.21 | 12.90 | 13.51 | 12.60 | 12.82 | 13.12 |
На филогенетическом дереве (рис. 5) кластер мтДНК M. quadricornis располагается отдельно от кластера видов рода Myoxocephalus. Он образует общую группу с видами из других родов подсемейства Myoxocephalinae. При этом M. quadricornis наиболее близок с Megalocottus platycephalus. Генетические дистанции между ними соответствуют различиям между видами одного рода (среднее значение 2.8%). Достоверность положения M. quadricornis, обособленного от рода Myoxocephalus и ассоциированного с видами других родов, подтверждается высокими оценками вероятности. Большее сходство четырехрогого керчака с Megalocottus platycephalus, чем с видами рода Myoxocephalus, обнаружено в результате сравнительного кариологического анализа. Их общие признаки: пара мелких метацентриков; одиночные ЯО-хромосомы сходной морфологии (c Megalocottus p. platycephalus); локализация у M. quadricornis и Megalocottus p. taeniopterus ЯО в субтелоцентриках сходных размеров; изменчивость числа блоков ЯО.
Рис. 5.
Байесовское дерево видов трибы Myoxocephalini по данным об объединенных последовательностях генов COI, цитохрома b и 16S рРНК митохондриального генома. Числа в основаниях кластеров – оценки апостериорной вероятности. Ваучерные номера показаны в скобках.
Сравнительный анализ полученных молекулярно-генетических данных и результатов аналогичных исследований показывает определенное сходство положения M. quadricornis. В работе Kontula, Väinöla (2003) комплекс M. quadricornis находится внутри клады рода Myoxocephalus [9]. По мнению авторов, признание валидности рода Triglopsis сделало бы остальных Myoxocephalus парафилетической группой. Исследование Knope (2013) показало, что Triglopsis quadricornis и Megalocottus platycephalus объединяются в общую кладу [37]. Вместе с Myoxocephalus scorpioides и Microcottus sellaris они образуют отдельную группу, родственную с видами Myoxocephalus. Mecklenburg с соавт. (2016) определяют M. quadricornis и Megalocottus platycephalus как сестринские виды, находящиеся в кладе рода Myoxocephalus [3]. Генетические дистанции между M. quadricornis и видами Myoxocephalus (5.1–9.2%) совпадают с различиями в пределах рода Myoxocephalus (2.1–10.5%), что, по мнению авторов, не подтверждает существования рода Triglopsis. Однако авторы не обсуждают загадочное положение одного рода в кладе другого и не проводят сравнительный анализ дистанций между близкими родами семейства Cottidae. Все приведенные выше молекулярно-генетические результаты определенно свидетельствуют о близком родстве M. quadricornis с Megalocottus platycephalus, но не с видами рода Myoxocephalus, и следовательно о необходимости пересмотра таксономического статуса четырехрогого керчака.
Таким образом, сравнительный кариологический анализ M. quadricornis показал, что хромосомные наборы этого вида и керчаков трибы Myoxocephalini имеют общие признаки, доказывающие их родство. Наибольшее число общих признаков кариотипов обнаружено у M. quadricornis и Megalocottus platycephalus, что подтверждает их более значительную близость по сравнению с видами рода Myoxocephalus. Выявлен комплекс кариологических и молекулярно-генетических маркерных признаков, позволяющих проводить идентификацию вида M. quadricornis. Обнаруженные существенные различия позволяют надежно дифференцировать M. quadricornis и виды трибы Myoxocephalini. Они доказывают принадлежность M. quadricornis и видов рода Myoxocephalus к разным филогенетическим линиям. Результаты кариологического и молекулярно-генетического исследования соответствуют данным сравнительного анализа сейсмосенсорной системы и морфологических признаков, на основании которых была обоснована родовая самостоятельность четырехрогого керчака, целесообразность его выделения из рода Myoxocephalus и включения, согласно правилу приоритета, в отдельный род Triglopsis [1].
Работа выполнена при бюджетной поддержке в рамках НИР “Фауна, систематика и экология морских и пресноводных гидробионтов Северо-Востока России” (Гос. Российская Федерация, № 0290-2019-0004), Институт биологических проблем Севера ДВО РАН, Россия.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют о том, что у них нет конфликта интересов.
Список литературы
Неелов А.В. Сейсмосенсорная система и классификация керчаковых рыб (Cottidae: Myoxocephalinae, Artediellinae). Л.: Наука, 1979. 208 с.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. Рыбы морей России: аннотированный каталог. М.: Тов-во науч. изд. КМК, 2014. 733 с.
Mecklenburg C.W., Mecklenburg T.A., Sheiko B.A. et al. Pacific Arctic Marine Fishes. CAFF Monitoring Series Report № 23. Akureyri, Iceland: Conserv. Arctic Flora and Fauna, 2016. 406 p.
McAllister D.E. Atlas of North American Freshwater Fishes, Queen’s Printer. Onawa, Canada, 1978. 826 p.
Dickman M. An isolated population of fourhorn sculpins (Myoxocephalus quadricornis, family Cottidae) in a hypersaline high arctic Canadian lake // Hydrobiologia. 1995. V. 12. P. 27–35.
Неелов А.В. Рыбы Чаунской губы Восточно-Сибирского моря // Арктика и Антарктика. М.: Наука, 2008. С. 154–184.
Kottelat M., Freyhof J. Handbook of European Freshwater Fishes. Publ. Kottelat, Cornol and Freyhof, Berlin, 2007. 646 p.
Dadswell M.J. Post-glacial dispersal of four freshwater fishes on the basis of new distribution records from eastern Ontario and western Quebec // J. Fish. Res. Board Can. 1972. V. 29. P. 545–553.
Kontula T., Väinöla R. Relationships of Palearctic and Nearctic ‘glacial relict’ Myoxocephalus sculpins from mitochondrial DNA data // Mol. Ecol. 2003. V. 12. P. 3179–3184.
Sheldon T.A., Mandrak N.E., Lovejoy N.R. Biogeography of the deepwater sculpin (Myoxocephalus thompsonii), a Nearctic glacial relict // Can. J. Zool. 2008. № 86. P. 108–115.
Scott W.B., Crossman E.J. The freshwater fishes of Canada // Bull. Fish. Res. Board Can. 1973. № 184. P. 842–848.
McAllister D.E., Aniskowicz J. Vertebral number in North American sculpins of the Myoxocephalus quadricornis – complex // J. Fish. Res. Board Can. 1976. V. 33. P. 2792–2799.
Morrow J.E. The Freshwater Fishes of Alaska. Alaska Northwest Publishing Alaska: Company: Anchorage, 1980. 248 p.
Fallis B.W., Harbicht S.M., MacKenzie B.J. A Preliminary Study of the Limnology and Biology of Garrow Lake, Northwest Territories, an Arctic Meromictic Lake. Department of Fisheries and Oceans: Winnipeg, MB, 1987. 55 p.
Mecklenburg C.W., Møller P.R., Steinke D. Biodiversity of Arctic marine fishes: taxonomy and zoogeography // Mar. Biodivers. 2011. V. 41. P. 109–140.
Радченко О.А., Морева И.Н., Петровская А.В. Кариологическая и молекулярно-генетическая дивергенция керчаков рода Myoxocephalus Gill, 1859 (Cottidae) // Генетика. 2020. Т. 56. № 10. С. 1171–1183.
Balakirev E.S., Kravchenko A.Yu., Semenchenko A.A. Genetic evidence for a mixed composition of the genus Myoxocephalus (Cottoidei: Cottidae) necessitates generic realignment // Genes. 2020. V. 11. P. 1071. https://doi.org/10.3390/genes11091071
Fricke R., Eschmeyer W.N., van der Laan R. (eds) Eschmeyer’s catalog of fishes: Genera, species, references. 2022. (http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp). Electronic version accessed March 01, 2022.
Kligerman A.D., Bloom S.E. Rapid chromosome preparations from solid tissues of fishes // J. Fish. Res. Board Can. 1977. V. 34. P. 266–269.
Howell W.M., Black D.A. Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer: A 1-step method // Experientia. 1980. V. 36. P. 1014–1015.
Levan A., Fredga K., Sandberg A.A. Nomenclature for centromeric position on chromosomes // Hereditas. 1964. V. 52. P. 201–220.
Васильев В.П. Эволюционная кариология рыб. М.: Наука, 1985. 299 с.
Морева И.Н., Борисенко С.А. Кариотип северной дальневосточной широколобки Megalocottus platycephalus platycephalus (Pallas, 1814) (Pisces: Cottidae) из залива Одян Охотского моря // Биология моря. 2014. Т. 40. № 2. С. 137–142.
Морева И.Н., Борисенко С.А. Кариотип южной дальневосточной широколобки Megalocottus platycephalus taeniopterus (Kner, 1868) (Pisces: Cottidae) из залива восток Японского моря // Биология моря. 2015. Т. 41. № 6. С. 425–429.
Морева И.Н., Борисенко С.А. Кариотип многоиглого керчака Myoxocephalus polyacanthocephalus (Pallas, 1814) (Pisces: Cottidae) из российской части ареала // Биология моря. 2017. Т. 43. № 1. С. 64–69.
Maniatis T., Fritsch E.F., Sambrook J. Molecular Cloning, A Laboratory Manual. N.Y.: Cold Spring Harbor Lab., 1982. 480 p.
Moreva I.N., Radchenko O.A., Petrovskaya A.V. Differentiation of the frog sculpin Myoxocephalus stelleri Tilesius, 1811 (Actinopterygii, Cottidae) based on mtDNA and karyotype analyses // Comp. Cytogenet. 2021. V. 15. № 2. P. 179–197. https://doi.org/10.3897/CompCytogen.v15.i2.63207
Ronquist F., Teslenko M., Van Der Mark P. et al. M-rBayes 3.2: Efficient Bayesian phylogenetic inference and model choice across a large model space // Syst. Biol. 2012. V. 61. P. 539–542.
Rambaut A., Drummond A.J., Xie D. et al. Posterior summarisation in Bayesian phylogenetics using tracer 1.7 // Syst. Biol. 2018. V. 67. P. 901–904.
Leache A.D., Reeder T.W. Molecular systematics of the eastern fence lizard (Sceloporus undulatus): A comparison of parsimony, likelihood, and Bayesian approaches // Syst. Biol. 2002. V. 51. P. 44–68.
Кириллов А.Ф., Апсолихова О.Д., Жирков Ф.Н. и др. Аннотированный список рыбообразных и рыб бассейна Восточно-Сибирского моря // Исслед. водн. биол. ресурсов водоемов Камчатки и сев.-зап. части Тихого океана. 2016. Вып. 42. С. 78–87.
Черешнев И.А., Кириллов А.Ф. Рыбообразные и рыбы морских и пресных вод бассейнов морей Лаптевых и Восточно-Сибирского // Вестн. СВНЦ ДВО РАН. 2007. № 2. С. 95–100.
Лайус Д.Л. Хромосомные наборы 13 видов рыб Белого моря // Проблемы изучения, рационального использования, охраны природных ресурсов Белого моря. Регулярная конф. Тез. докл. Петрозаводск, 1992. С. 179–180.
Arai R. Fish Karyotypes. A Check List. Tokyo; Berlin; Heindelberg; N.Y.: Springer, 2011. 347 p. https://doi.org/10.1007/978-4-431-53877-6
Radchenko O.A., Moreva I.N., Petrovskaya A.V. The subfamily Myoxocephalinae of cottid fishes (Cottidae): Genetic divergence and phylogenetic relationships // J. Fish Biol. 2021. V. 99. P. 1857–1868. https://doi.org/10.1111/jfb.14886
Богуцкая Н.Г., Насека А.М. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: КМК, 2004. 389 с.
Knope M.L. Phylogenetics of the marine sculpins (Teleostei: Cottidae) of the North American Pacific Coast // Mol. Phylogenet. Evol. 2013. V. 66. P. 341–349. https://doi.org/10.1016/j.ympev.2012.10.008
Page L.M., Espinoza-Perez H., Findley L.T. et al. Common and Scientific Names of Fishes from the United States, Canada, and Mexico, 7th ed. American Fisheries Society. Special Publ. 34. Bethesda, 2013. 243 p.
Goto A., Yokoyama R., Sideleva V.G. Evolutionary diversification in freshwater sculpins (Cottoidea): A review of two major adaptive radiations // Environ. Biol. Fish. 2014. V. 98. P. 307–335. https://doi.org/10.1007/s10641-014-0262-7
Дополнительные материалы отсутствуют.