Генетика, 2023, T. 59, № 2, стр. 176-183
Долговременная и сезонная динамика инверсионного полиморфизма малярийного комара Anopheles messeae Fall. (Diptera: Culicidae) в популяции центральной части видового ареала (Западная Сибирь, Томская область)
А. К. Сибатаев 1, И. Э. Вассерлауф 1, К. Е. Усов 1, С. С. Алексеева 1, Г. М. Абылкасымова 2, В. Н. Стегний 1, *
1 Томский государственный университет
634050 Томск, Россия
2 Институт генетики и физиологии
050060 Алматы, Казахстан
* E-mail: stegniy@res.tsu.ru
Поступила в редакцию 14.03.2022
После доработки 12.05.2022
Принята к публикации 31.05.2022
- EDN: KYGMNK
- DOI: 10.31857/S0016675823020121
Аннотация
Была проведена оценка уровня генетической изменчивости с 1974 по 2020 гг. в популяции малярийного комара Anopheles messeae Fall. п. Коларово (Томская обл.) на основе цитогенетического анализа политенных хромосом. Анализ динамики инверсионного полиморфизма малярийного комара Anopheles messeae Fall. в период с 1974 по 2020 гг. по частотам инверсионных вариантов хромосом и гамет в популяции п. Коларово показал замещение “северных” вариантов в период 90-х гг. прошлого столетия “южными” вариантами и стабилизацию этих перемен до 2020 г. Была выявлена корреляция частотного распределения хромосомных инверсий с 1972 по 2020 гг. с годовой температурой, включающей в себя полугодовую среднюю апрель–сентябрьскую и полугодовую среднюю октябрь–мартовскую температуру. Полученные результаты позволили вскрыть характер динамических процессов в течение длительного периода в связи с потеплением климата. Пространственно-временная стационарность (динамическая устойчивость) адаптивного инверсионного полиморфизма – свидетельство отсутствия тенденций к видообразованию.
Малярийные комары (Diptera, Culicidae) являются одним из представителей гнуса и переносчиком разнообразных трансмиссивных болезней, одной из которых является наиболее опасная – малярия [1–4]. В настоящее время эта проблема становится актуальной, что связано не только с потеплением климата, но и с миграцией народов из южных регионов [1, 5, 6] в Россию. В связи с этим необходимо проводить популяционно-генетический мониторинг в популяциях малярийных комаров [7]. Одним из широко распространенных видов малярийных комаров является Anopheles messeae представитель комплекса “maculipennis”, занимающий гигантский ареал, охватывающий разнообразные ландшафтно-климатические зоны Палеарктики [8].
В популяциях An. messeae выявлено пять широко распространенных по ареалу инверсий, существующих в гетеро- и гомозиготном состояниях [9]. Эти инверсии расположены: две в половой хромосоме (XL1, XL2) и по одной в аутосомах 2R1, 3R1, 3L1 [10]. Анализ частот встречаемости отдельных инверсий, проведенный в 1974–1979 гг., показал наличие клинальных закономерностей распределения инверсий. Для инверсий XL1 и 3R1 характерна четкая (для 3L1 несколько менее четкая) клинальная изменчивость частот в долготном направлении, а для инверсии 2R1 – в широтном [7]. An. messeae отличается высокой адаптивной пластичностью, занимает всю Центральную и Северную Европу, прекрасно переносит резко континентальный климат Сибири и Казахстана. На востоке распространение An. messeae ограничено Зейско-Буреинской низменностью, северная граница ареала совпадает с 65° с.ш., а южная проходит на уровне 42° ю.ш. [8]. В пределах ареала сильно изменяются сроки зимовки и длительность диапаузы, фенологические показатели [11]. Число летних генераций у вида колеблется от двух на севере ареала до пяти-семи на юге. Естественно, что в разных географических районах изменяются и экологические условия существования как личиночных, так и имагинальной стадии развития [8]. Границы ареала An. messeae в основном определяются климатическими факторами [12]. Исходя из имеющихся доказательств адаптивной природы полиморфизма [13, 14], было высказано предположение [10, 15], что инверсионные генокомплексы играют важную роль в видовой системе генетической адаптации An. messeae [16–21]. В большинстве случаев инверсионный полиморфизм структурно организован по ареалу и частично коррелирует с градиентами климатических факторов среды обитания [14, 22–24].
Таблица 1.
Сезонная динамика частот инверсионных генотипов в популяции An. messeae п. Коларово в 2020 г.
| Вариант хромосомы | Частоты хромосомных вариантов (%) | |||
|---|---|---|---|---|
| 05/2020 | 06/2020 | 07/2020 | 08/2020 | |
| Самцы | ||||
| XL0 | 30.0 ± 14.5 | 33.3 ± 12.6 | 7.1 ± 6.8 | 20.0 ± 10.3 |
| XL1 | 70.0 ± 14.5 | 66.6 ± 12.6 | 92.9 ± 6.8 | 80.0 ± 10.3 |
| n | 10 | 21 | 14 | 15 |
| Самки | ||||
| XL00 | 10.3 ± 4.8 (0.18) |
12.3 ± 4.7 (0.51) |
6.5 ± 5.9 (0.06) |
15.1 ± 6.2 (0.18) |
| XL01 | 56.4 ± 7.9 (0.48) |
77.5 ± 5.9 (0.41) |
38.7 ± 11.8 (0.38) |
48.5 ± 8.7 (0.49) |
| XL11 | 33.3 ± 7.5 (0.33) |
8.2 ± 3.9 (0.08) |
54.8 ± 12.0 (0.55) |
33.3 ± 8.2 (0.32) |
| XL12 | 0 | 0 | 0 | 3.0 ± 3.0 |
| XL14 | 0 | 2.0 ± 2.0 | 0 | 0 |
| n | 39 | 49 | 31 | 33 |
| Самцы и самки | ||||
| 2R00 | 100.0 | 100.0 | 100.0 | 97.9 ± 2.0 (0.98) |
| 2R01 | 0 | 0 | 0 | 2.1 ± 2.0 (2) |
| 2R11 | 0 | 0 | 0 | 0 (0.0001) |
| 3R00 | 75.5 ± 6.1 (0.75) |
74.3 ± 5.2 (0.74) |
75.6 ± 6.4 (0.76) |
77.1 ± 6.0 (0.76) |
| 3R01 | 18.4 ± 5.5 (0.23) |
17.1 ± 4.5 (0.24) |
22.2 ± 6.2 (0.22) |
16.7 ± 5.4 (0.23) |
| 3R11 | 6.1 ± 3.4 (0.02) |
8.6 ± 3.3 (0.02) |
2.2 ± 2.2 (0.02) |
6.2 ± 3.5 (0.01) |
| 3L00 | 98.0 ± 2.0 (0.98) |
100 | 91.1 ± 4.2 (0.90) |
91.7 ± 4.0 (0.92) |
| 3L01 | 2.0 ± 2.0 (0.02) |
0 | 8.9 ± 4.2 (0.095) |
8.3 ± 4.0 (0.077) |
| 3L11 | 0 (0.0001) |
0 | (0.0025) | 0 (0.0016) |
| n | 49 | 70 | 45 | 48 |
Многолетние наблюдения за распределением инверсий комаров в 70-х гг. ХХ в. в популяции центральной части ареала (Западная Сибирь, Томск) показали наличие межгодовых [7] и сезонных [17, 25, 26] флуктуаций частот инверсий, коррелирующих с периодическим изменением условий обитания и особенно температурных режимов.
Цель настоящей работы – анализ результатов долговременного и сезонного мониторинга генетической структуры в популяции п. Коларово Томской обл. в плане оценки адаптивного характера генетической изменчивости в связи с потеплением климата.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для работы послужили личинки An. messeae четыре возраста, собранные в Томской обл. (п. Коларово, 59°19′45′′ N 84°56′53′′ E) в период генерации комаров с мая по август 2020 г. включительно (29.05.2020, 21.06.2020, 29.07.2020, 08.08.2020).
Личинок фиксировали спирт-уксусной смесью 3 : 1 (раствор Карнуа). Готовили лактоацеторсеиновые препараты по модифицированной методике [9]. Цитогенетический анализ инверсионного состава малярийных комаров проводили по картам хромосом An. messeae [7, 10]. Сравнивали частоты инверсий в популяциях методом χ2, уровень значимости р = 0.05.
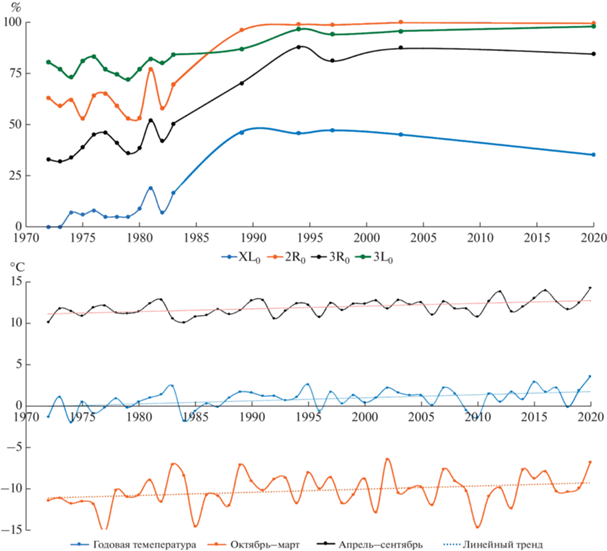
Для анализа температуры были взяты параметры годового хода температуры, апрель–сентябрь и октябрь–март с 1971 по 2020 гг. [27]. Годовой ход температуры воздуха с апреля по сентябрь оказывает влияние во время размножения комаров An. messeae, а температура с октября по март оказывает влияние во время зимовки имаго. Температурные данные холодного периода получены сложением средних температур октября–декабря 1971 г. и января–марта 1972 г. и т.д. (рис. 1).
Рис. 1.
Частотное распределение (десятилетний период) хромосомных инверсий и среднегодовых (по сезонам) температурных режимов в популяции An. messeae из п. Коларово (Томская обл.). На верхнем графике – частоты хромосомных последовательностей XL0, 2R0, 3R0, 3L0; на нижних – среднегодовые (по сезонам) температуры воздуха, апрель–сентябрь и октябрь–март.
РЕЗУЛЬТАТЫ
Полученные данные по уровню инверсионного полиморфизма An. messeae в популяции п. Коларово Томской обл. в 2020 г. показывают значительное изменение частот инверсий по сравнению с данными, полученными в 70-х гг. ХХ в. (рис. 2).
Рис. 2.
Долговременная динамика инверсионного полиморфизма малярийного комара Anopheles messeae Fall. в популяции центральной части видового ареала (Западная Сибирь, Томская обл.). а – динамика популяций малярийных комаров по инверсионным вариантам по годам (0, 1 – варианты инверсий XL0, XL1, 0, 1 – инверсионные варианты аутосом – 2R, 3R, 3L); б – динамика частот инверсионных вариантов хромосом по годам (00, 01, 11, 12, 15 – инверсионные варианты половой хромосомы XL; 00, 01, 11 – инверсионные варианты аутосом – 2R, 3R, 3L). Вертикальными линиями указан доверительный интервал (p < 0.05).

В популяции комаров An. messeae в 2020 г. по ХL-хромосоме в июне гетерозиготность (XL01) резко возросла за счет снижения частоты гомозигот XL00. Остальные хромосомы (2R, 3R, 3L) сохраняли равновесные частоты гомо- и гетерозигот в течение всего летнего периода (табл. 1).
Анализ динамики инверсионного полиморфизма малярийного комара Anopheles messeae в период с 1974 по 2020 гг. показал следующие результаты:
Х хромосома – XL плечо. Динамика частот инверсионных вариантов XL хромосомы варьирует в течение анализируемого периода, было выявлено увеличение доли особей XL0 с 3.6 ± 1.5% в 1974 г. до 35.2 ± 2.3% в 2020 г. (p < 0.05) и уменьшение особей с XL1. В период 90-х годов ХХ века менялось соотношение доли особей с инверсиями XL0 и XL1 (рис. 2,а). Анализ частот инверсионных вариантов хромосомы XL, показал резкое снижение доли вариантов XL11 c 60.8 ± 4.1% в 1979 г. до 30.1 ± 2.1% в 1992 г. (рис. 2,б). Увеличение частот “южных” вариантов XL00 наблюдалось: с 2.17 ± ± 1.2% в 1979 г. до 20.2 ± 2.1% в 1992 г. (p < 0.05) и в дальнейшем снижается к 2020 г. С 1979 по 2020 гг. постепенно увеличивается и доля гетерозигот XL01 (рис. 2,б; p < 0.05). Также в данной популяции комаров снижалась доля гетерозиготных особей XL12 с 31.1 ± 3.4% в 1974 г. до 1.1 ± 0.7% 2020 г. (рис. 2,б; р < 0.001).
Хромосома 2 – 2R плечо. С 1974 по 1979 гг. доля комаров с разными частотами инверсионных вариантов хромосомы 2R варьировала. Доля особей с “южными” вариантами 2R00 увеличилась с 30.1 ± 3.6% в 1979 г. до 100% в 2003 г. (рис. 2,б; р < 0.001), которая осталась стабильной же до 2020 г. (98.9 ± 0.7%). В это же время произошло снижение доли “северных” вариантов 2R11 с 22.6 ± ± 2.6% и вариантов 2R01 с 47.2 ± 3.1% в 1979 г., далее они изменились до 0% в 2003 г. (рис. 2,б; р < 0.001). В 2020 г. в популяции комаров п. Коларово было выявлено всего лишь 1.1 ± 0.7% особей с вариантами 2R01.
Хромосома 3. С 1979 г. доля особей с вариантами 3R11 c 41.7 ± 3.1% постепенно снизилась до 8.0 ± 2.0% в 2020 г., доля особей с вариантами 3R00 увеличилась с 13.5 ± 2.1% в 1974 г. до 72.9 ± 3.3% в 2020 г. (рис. 2,б; р < 0.001). Сходная картина отмечена и по хромосомному плечу 3L. С 1979 г. доля особей с инверсиями 3L1 c 25.9 ± 2.4% постепенно снизилась до 1.9 ± 0.5% в 2020 г. (рис. 2,а; р < 0.05). Доля особей с вариантами хромосом 3L11 в 2020 г. снизилась до 0% (рис. 2,б), такая же тенденция отмечена с гетерозиготами 3L01. Также наблюдалось увеличение доли особей вариантов 3L00 с 51.8 ± 3.9% в 1974 г. до 95.7 ± 1.5% в 2020 г. (p < 0.05).
Анализ динамики инверсионного полиморфизма малярийного комара Anopheles messeae Fall. в период с 1974 по 2020 гг. по частотам инверсионных вариантов хромосом в популяции п. Коларово (рис. 2) показал замещение “северных” вариантов в период 90-х гг. прошлого столетия “южными” вариантами и стабилизацию этих перемен до 2020 г.
Была проведена корреляция частотного распределения хромосомных инверсий с 1972 по 2020 гг. с годовой температурой, с полугодовой средней температурой с апреля по сентябрь и с полугодовой средней температурой с октября по март (рис. 1). Нами была выявлена корреляция частотного распределения хромосомных инверсий с 1972 по 2020 гг. с годовой температурой, включающей в себя полугодовую среднюю апрель–сентябрьскую и полугодовую среднюю октябрь–мартовскую температуру (рис. 1).
Все хромосомные последовательности XL0, 2R0, 3R0, 3L0 коррелируют с годовой и с полугодовой средней апрель–сентябрьской температурой (соответственно коэффициент корреляции rXL = 0.6, r2R = 0.58, r3R = 0.64, r3L = 0.67, p < 0.05) (апрель–сентябрь). Полугодовая средняя октябрь–мартовская температура коррелирует только с вариантами 3L0 (p < 0.05), с остальными корреляция не была выявлена (октябрь–март, рис. 1).
Частоты инверсионных вариантов хромосомы XL0 с начала 1972 г. наблюдались на уровне 5–10% до 1980 г., и только в 1981 г. отмечено резкое возрастание частоты XL0 до 21%, а затем увеличение до 46.1% в 1989 г. В 2020 г. отмечено снижение частоты XL0 до 33%, и при этом идет увеличение гетерозигот XL01 (рис. 2, табл. 1).
С 1972 по 1980 гг. частоты инверсионных вариантов хромосомы XL0 наблюдались на уровне 5–10%, и только в 1981 г. было выявлено резкое возрастание частоты XL0 до 21%, а затем в 1989 г. наблюдалось увеличение до 46.1%. В 2020 г. выявилось снижение частоты XL0 до 33%, параллельно с этим, произошло увеличение гетерозигот XL01 (рис. 2, табл. 1).
Частоты инверсионных вариантов хромосомы 2R0 показали межгодовые колебания от 54 до 67%, а в 1981 г. ее концентрация достигла 78%, а в 2020 г. достигла уже 99.5%.
Также были обнаружены межгодовые частотные колебания от 54 до 67% инверсий хромосомы 2R0, в 1981 г. ее концентрация достигла 78%, а в 2020 г. достигла уже 99.5%. Аналогичная ситуация выявилась и для хромосомы 3R0: обычные колебания – от 33 до 46%, в 1981 г. – скачок до 54%, и продолжила увеличиваться до 2020 г. – 84.4%. Последовательность хромосомы 3L0 встречается в довольно высоких концентрациях (от 73 до 84%) до 1983 г., а затем возросла до уровня 96% в 1994 г., которая не снижалась с этого уровня до 2020 г.
ОБСУЖДЕНИЕ
В популяции An. messeae выявлено пять широко распространенных по ареалу инверсий. Определенные сочетания инверсий в кариотипах An. messeae встречаются гораздо чаще и формируют адаптивные комплексы:
1. XL112R113R11(01)3L00(01,11) (север);
2. XL22(12)2R11(01)3R11(01)3L00(01,11) (северо-восток);
3. XL112R013R00(01,11)3L00(01,11) (центр);
4. XL00(01)2R003R00(01)3L00(01) (юго-запад);
5. XL112R003R00(01,11)3L00(01,11) (юго-восток).
В скобках после кариотипов указаны области ареала, где такие сочетания доминируют или встречаются с 100% частотой. Весь кариофонд условно делят на две группы: “северные” хромосомные сочетания (1), (2) и “южные” (4), (5) [25]. Рекомбинанты (3) встречаются относительно редко и образуются при скрещивании особей с “северными” и “южными” вариантами. Сочетания хромосом обусловлены ассортативным скрещиванием [25]. При этом хромосомный полиморфизм в популяциях An. messeae вероятно поддерживается не за счет сверхдоминирования, а в результате различной приспособленности комаров с разными хромосомными сочетаниями на разных этапах сезонного цикла [28–30]. Комары с альтернативными кариотипами отличаются по физиологии, пищевому поведению, скорости развития, плодовитости и другим характеристикам [7, 15, 29, 30]. При этом гомозиготы имеют селективное преимущество.
Сопоставление частотной динамики инверсий с среднесезонными температурными режимами за весь период наблюдения популяции показывает корреляцию изменений частот хромосомных инверсий с потеплением климата. Для комаров An. messeae температура является основным абиотическим фактором, лимитирующим процессы жизнедеятельности на всех стадиях развития. Характер кривых температур за 49 лет наблюдений позволяет заключить, что наиболее теплым был 2020 г. Минимальные температуры отмечены в период 1974, 1983 и 2010 гг. Повышение температуры (особенно в зимний период) привело к резкому снижению гетерозиготности изученной популяции п. Коларово Томской обл., что свидетельствует о направленной гомозиготизации в пользу хромосомных вариантов, доминирующих на юге и юго-западе ареала. Существенная частотная реорганизация хромосомных инверсий имеет явный адаптивный характер и, как показали эксперименты [7], связана с тепловым режимом обитания. Экспериментальный анализ развития личинок при разных температурах воды показал, что выживаемость гомозигот XL00 и 3R00 выше при оптимальных температурах развития (23°C), чем при крайне низких и высоких. Частоты гетерозигот XL01 и 3R01, наоборот, в оптимальных условиях развития сильно падают.
Изменение частот инверсионных вариантов хромосомы 2R было впервые зарегистрировано в п. Коларово Томской обл. С 1975 г. частоты вариантов 2R0 начали существенно увеличиваться в выборках личинок. Важным следствием потепления является резкое снижение частоты хромосомы 2R1 в Сибирском регионе (п. Коларово) в период с 1992 г. по настоящее время (рис. 1, 2). Эта инверсия имеет клинальное распределение в широтном направлении [8]. На юге ареала встречаются только гомозиготы 2R00, на севере таежной зоны – только гомозиготы 2R11. В центре ареала происходит гибридизация комаров с альтернативными хромосомными последовательностями, но наблюдается дефицит гетерозигот 2R01. Инверсия 2R11 в составе генокомплекса (1) и (2) ранее доминировала на севере ареала и связана с высокой разовой плодовитостью самок, что важно в условиях короткого летнего репродуктивного периода [28]. Очевидно, что удлинение лета в северных областях (особенно в Сибири) способствует повышению частоты хромосомы 2R0, которая связана с низкой разовой плодовитостью.
Изменение частот инверсионных вариантов хромосом резко нарастало к концу 80-х–началу 90-х гг. и затем стабилизировалось. “Скачок потепления” зимой 1981–1982 гг. привел к коррелированному с ним “частотному скачку” группы “юго-западных” хромосом в томской популяции (рис. 1). Последние 20 лет частоты хромосом практически не изменялись.
Таким образом, исключительность 1981 г. по тепловому режиму и скачок частоты инверсий XL0, 2R0 и 3R0 являются коррелированными. Как было ранее отмечено, эти варианты хромосом доминируют в популяциях западной части ареала An. messeae в условиях относительно мягкого климата Европы. В азиатской части преобладают альтернативные инверсии XL1(XL2), 2R1, 3R1 и 3L1, причем замена первых на вторые идет клинально в связи с климатическими градиентами Палеарктики. По-видимому, зимняя и летняя высокие температуры 1981 г. оказали существенное влияние как фактор естественного отбора на томскую популяцию An. messeae и благоприятствовали “юго-западному” генокомплексу.
Построенная линия тренда на основе среднегодовых температур на графике с 1971 по 2020 гг. показывает увеличение температур (рис. 1). Рассчитанная средняя скорость роста среднегодовой температуры воздуха на территории Российской Федерации с 1976 по 2018 гг. составила 0.47°С/10 лет при скорости роста глобальной температуры за тот же период: 0.17–0.18°С/10 лет [31]. Очевидно, что направленная перестройка кариотипической структуры An. messeae в Западной Сибири обусловлена климатическими изменениями общими для всего региона. Такие же перестройки кариотипической структуры были показаны и в п. Тегульдет, расположенном в 215 км на северо-восток от г. Томск [32].
Анализ сезонных колебаний частот инверсий, проведенный с 1974 по 1976 гг., показал некоторое повышение частоты “юго-западных” вариантов (XL0, 2R0, 3R0, 3L0) в период летнего “расцвета” популяции от середины июля до середины августа и снижение частоты гетерозигот 3R01 [17]. Эта тенденция сохранилась в течение последних 30 лет.
Таким образом, в ходе настоящей работы проведена оценка уровня генетической изменчивости с 1974 г. по 2020 г. в популяции малярийного комара An. messeae, которая позволила вскрыть характер динамических процессов в связи с потеплением климата. Динамическая устойчивость адаптивного инверсионного полиморфизма – свидетельство отсутствия тенденций к видообразованию.
Исследование выполнено в рамках государственного задания Министерства науки и высшего образования Российской Федерации (проект № FSWM-2020-0019), а также при поддержке Программы развития Томского государственного университета (Приоритет-2030).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ревич Б.А. Изменение здоровья населения России в условиях меняющегося климата // Демография. 2008. С. 140−150.
Tolle M.A. Mosquito-borne Diseases // Curr. Problems in Pediatric and Adolescent Health Care. 2009. V. 39. I. 4. P. 97–140. https://doi.org/10.1016/j.cppeds.2009.01.001
Юрченко Ю.А., Белевич О.Э. Малярия и малярийные комары (Anopheles, Culicidae) Новосибирской области // Сиб. экол. журнал. 2010. Т. 17. № 5. С. 733−737.
Всемирная Организация Здравоохранения Европейское региональное бюро г. Копенгаген. Региональная стратегия: от борьбы к элиминации малярии в Европейском регионе ВОЗ (2006–2015 гг.). 2006. 44 с.
Новиков Ю.М. Эффекты глобального потепления: направленная динамика пропорции видов Anopheles и цитогенетической структуры таксона Anopheles messeae Fall. в Западной Сибири // Пробл. эвол. цитогенетики, селекции и интродукции. Матер. Научных чтений, посвященных 100-летию профессора В.П. Чехова. 2–5 декабря 1997 г. Томск: 1997. С. 73−86.
Ежов М. Европейская региональная программа “Обратим малярию вспять”. Результаты ее выполнения и взгляд в будущее. Переносчики малярии и мероприятия по борьбе с ними // Матер. Совещ. стран Европейского Региона ВОЗ, столкнувшихся с возвратом малярии. Алма-Ата: 2001. С. 19−22.
Стегний В.Н. Популяционная генетика и эволюция малярийных комаров. Томск: Изд-во Томского ун-та, 1991. 136 с.
Беклемишев В.Н. Экология малярийного комара. М.: Медгиз, 1944. 299 с.
Кабанова В.М., Карташова Н.Н., Стегний В.Н. Кариологическое исследование природных популяций малярийного комара в Среднем Приобье. 1. Характеристика кариотипа Anopheles maculipennis messeae Fall. // Цитология. 1972. Т. 14. № 5. С. 630–636.
Стегний В.Н., Кабанова В.М., Новиков Ю.М., Плешкова Г.Н. Инверсионный полиморфизм малярийного комара Anopheles messeae. I. Распространение инверсий по ареалу вида // Генетика. 1976. Т. 12. № 4. С. 47–55.
Шипицина Н.К., Дылдина З.М. Влияние географических факторов на ход весенне-летнего развития // Сезонные явления в жизни малярийных комаров в Советском Союзе. М.: Издательство Минздрава СССР, 1957. С. 259–305.
Беклемишев В.Н., Желоховцев А.Н. Ареалы некоторых видов Anopheles в СССР и причины, их обусловливающие // Бюлл. МОИП. 1945. Т. 50. Вып. 1–2. С. 56–73.
Cunha A. Chromosomal variation and adaptation in insects // Ann. Rev. Entomol. 1960. V. 5. P. 85–110. https://doi.org/10.1146/ANNUREV.EN.05.010160.000505
Баклушинская И.Ю. Хромосомные перестройки, реорганизация генома и видообразование // Зоол. журнал. 2016. Т. 95. № 4. С. 376–393. doi: 7868/S0044513416040036
Гордеев М.И., Москаев А.В. Хромосомный полиморфизм в популяциях малярийного комара Anopheles messeae (Diptera, Culicidae) в Поволжье // Генетика. 2016. Т. 52. № 6. С. 685–692.
Дубинин Н.Д., Тиняков Г.Г. Климат и распространение инверсий по ареалу вида Drosophila funebris // Докл. АН СССР. 1947. Т. 56. № 9. С. 965–968.
Плешкова Г.Н., Стегний В.Н., Новиков Ю.М., Кабанова В.М. Инверсионный полиморфизм малярийного комара Anopheles messeae. Сообщение III. Временная динамика концентраций инверсий в популяции центра ареала // Генетика. 1978. Т. 14. № 12. С. 2169–2176.
Перевозкин В.П. Научно-практическое руководство по малярии. Томск: Изд-во Томского ун-та, 2007. С. 105.
Ayala D., Guerrero R.F., Kirkpatrick M. Reproductive isolation and local adaptation quantified for a chromosome inversion in a malaria mosquito // Evolution. 2013. 67(4). P. 946–958. https://doi.org/10.1111/j.1558-5646.2012.01836.x
Ayala D., Ullastres A., González J. Adaptation through chromosomal inversions in Anopheles // Frontiers in Genetics. 2014. V. 5. P. 129. https://doi.org/10.3389/fgene.2014.00129
Ayala D., Acevedo P., Pombi M. et al. Chromosome inversions and ecological plasticity in the main African malaria mosquitoes // Evolution. 2017. V. 71(3). P. 686–701. https://doi.org/10.1111/evo.13176
Чубарева Л.А. Хромосомный полиморфизм в природных популяциях кровососущих мошек и некоторых других двукрылых насекомых // Цитология. 1974. Т. 6. № 3. С. 267–280.
Русакова А.М., Артемов Г.Н., Стегний В.Н. Инверсионный полиморфизм природных популяций малярийного комара (Anopheles messeae Fall.) Восточной части ареала // Вестник Томского гос. ун-та. Биология. 2011. № 2 (14). С. 117–121.
Ayala D., Costantini C., Ose K. et al. Habitat suitability and ecological niche profile of major malaria vectors in Cameroon // Malaria J. 2009. V. 8. P. 307. https://doi.org/10.1186/1475-2875-8-307
Новиков Ю.М., Кабанова В.М. Адаптивная ассоциация инверсий в природных популяциях малярийного комара Anopheles messeae Fall. // Генетика. 1979. Т. 15. № 6. С. 1033–1045.
Стегний В.Н., Пищелко А.О., Сибатаев А.К., Абылкасымова Г. Пространственно-временные изменения частот хромосомных инверсий по ареалу малярийного комара Anopheles messeae Fall. (Culicidae) за 40-летний период мониторинга // Генетика. 2016. Т. 52. № 6. С. 664−671.
http://www.pogodaiklimat.ru/history/29430.htm (дата обращения: 04.02.2022).
Стегний В.Н., Кабанова В.М. Инверсионный полиморфизм малярийного комара Anopheles messeae. Сообщение IV. Локальный отбор и пространственная дифференциация инверсионных генокомплексов по плодовитости // Генетика. 1985. Т. 21. № 12. С. 1970−1973.
Бурлак В.А., Сибатаев А.К., Перевозкин В.П., Гордеев М.И. Взаимосвязь скорости поглощения пищи личинками двух видов малярийных комаров (Diptera; Culicidae) с их инверсионными генотипами // Экология. 1999. № 5. С. 379−381.
Перевозкин В.П., Гордеев М.И., Бондарчук С.С. Хромосомный полиморфизм и закономерности формирования субпопуляционной организации малярийных комаров Anopheles (Diptera, Culicidae) в местообитаниях Томской области // Генетика. 2009. Т. 45. № 4. С. 478−487.
Бардин М.Ю., Егоров В.И., Николаева А.М. и др. Доклад об особенностях климата на территории Российской Федерации за 2019 год. М.: Росгидромет, 2020. 97 с.
Стегний В.Н., Кабанова В.М., Новиков Ю.М. Кариотипическое исследование малярийного комара // Цитология. 1976. Т. 18. № 6. С. 760–766.
Дополнительные материалы отсутствуют.


