Генетика, 2023, T. 59, № 4, стр. 460-473
Информативность 11 микросателитных локусов для экспертной ДНК-идентификации диких и фермерских норок американских (Mustela vison) в Беларуси
О. Н. Лукашкова 1, *, Е. А. Спивак 1, С. А. Котова 1
1 Научно-практический центр Государственного комитета судебных экспертиз
Республики Беларусь
220114 Минск, Республика Беларусь
* E-mail: l22805@tut.by
Поступила в редакцию 30.06.2022
После доработки 24.08.2022
Принята к публикации 30.08.2022
- EDN: AVXYCL
- DOI: 10.31857/S0016675823040069
Аннотация
Норка американская включена в хозяйственно-экономическую деятельность Республики Беларусь, относится к ресурсным охотничьим видам, а также разводится на зверофермах для производства пушнины. Для расследования случаев незаконного промысла и хищений зверьков ради ценного меха нами предложена идентифицирующая тест-система из 11 микросателлитных локусов ДНК. Информативность тест-системы исследована на двух выборках фермерских норок и выборке из территориально удаленной от зверохозяйств дикой популяции Mustela vison. Показано, что между дикими и фермерскими норками имеются значимые генетические различия (Fst = 0.04397, P < 0.005), а вероятности случайного совпадения 11-локусных генотипов, рассчитанные с учетом и без учета коэффициента Fst, различаются на два порядка (1.84 × 10–8 и 1.39 × 10–10 соответственно). В разрезе криминалистического ДНК-анализа это требует формирования референтных баз данных для каждой из двух групп – отдельной базы для диких животных и отдельной базы для животных, разводимых в фермерских хозяйствах.
Американская норка Neovison vison Schreber, 1777 (syn.: Mustela vison, Neogale vison) – полуводный хищник семейства Куньи, естественный ареал которого занимает большую часть Северной Америки. В Европу этот вид был завезен в начале ХХ в., прежде всего для разведения на звероводческих фермах с целью получения меха.
Вселение и акклиматизация норки американской на территории Беларуси началась в 1953 г., и в течение последующих пяти лет в различные водные экосистемы страны было выпущено более 800 американских норок, которые со временем расселились почти повсеместно и дали начало современной дикой популяции [1]. По данным Министерства лесного хозяйства Республики Беларусь по состоянию на 2021 г. численность этого нового для нашей фауны вида составляет 24 475 особей [2].
Кроме того, американская норка разводится в зверохозяйствах для получения пушно-мехового сырья, при этом в настоящее время у белорусских производителей клеточной пушнины в разведении преобладают породы скандинавской норки, шкурки которых пользуются повышенным спросом.
Таким образом, можно констатировать, что в Беларуси популяция американкой норки представлена двумя искусственно изолированными друг от друга сообществами (или субпопуляциями): 1) дикими животными, завезенными с целью развития охотничьего промысла и имеющими самостоятельную историю расселения и естественное воспроизводство, и 2) “домашними” (фермерскими), включающими зверьков, происходящих от близкородственных маточных стад и содержащихся в неволе на зверофермах, при разведении которых используются специальные селекционные программы. С учетом результатов исследования A.A. Valnisty et al. [3], в котором было установлено, что мигранты с норковых ферм не вносят существенного вклада в генофонд дикой популяции, можно ожидать, что каждое из этих двух изолированных сообществ будет иметь специфичную популяционно-генетическую структуру.
Применительно к экспертному ДНК-анализу при необходимости идентификации образцов тканей от незаконно добытых или похищенных норок для достоверного сравнения генотипов образцов, относящихся к одной из двух групп (дикой или домашней), наиболее целесообразно использовать соответствующие ей частоты аллелей для расчета вероятности случайного совпадения генотипов (МР, Match Probability) [4]. Расчет МР проводится на основе референтных баз данных, содержащих сведения о частотах встречаемости аллелей идентифицирующих ДНК-маркеров в исследованных популяциях. В конечном счете достоверность и сила индивидуальной идентификации будут зависеть от наличия репрезентативной базы данных и информативности использованной панели локусов.
Исследования американской норки в контексте экспертной ДНК-идентификации в Республике Беларусь ранее не проводились. В связи с этим нашей целью была разработка эффективной и надежной криминалистической панели на основе ДНК-маркеров, обладающих достаточным уровнем полиморфизма и высокой разрешающей способностью при проведении идентификационных исследований биологических образцов животных вида Mustela vison. В ходе разработки решались задачи по отбору кандидатных маркерных локусов, формированию на их основе мультилокусной тест-системы для генотипирования и определению стандартных популяционно-статистических показателей, характеризующих идентификационный потенциал тест-системы. Для обоснования подходов к формированию референтных баз данных и проведению вероятностных расчетов особенности распределения частот аллелей исследованных локусов изучали в двух группах животных: диких, происходящих из свободно живущей дикой популяции, и домашних, происходящих из двух фермерских зверохозяйств. Дикая выборка преимущественно включала образцы норок из гомельской популяции, географически максимально удаленной от звероферм, являвшихся источником образцов в домашней выборке.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы биологического материала и выделение ДНК
Коллекция биологического материала (N = 101) была представлена образцами животных из природных популяций M. vison Гомельской (N = 19), Гродненской (N = 1), Минской (N = 2) и Витебской (N = 2) областей и образцами разводимых в неволе животных из двух зверохозяйств: Молодечненского сельскохозяйственного отделения производственного унитарного предприятия “Белкоопмех”, Минская область (N = 27); зверохозяйства торгового унитарного предприятия “Белкоопвнешторг Белкоопсоюза”, Гродненская область (N = 50).
Микросателлитные локусы
Микросателлитные (или STR) локусы отбирали на основании анализа литературных данных, в которых сообщалось о популяционно-генетических исследованиях представителей семейства Куньи (Mustelidae). Всего было апробировано четыре группы STR-локусов: девять локусов, разработанных для норки американской (Mustela vison) [5, 6], шесть – для выдры речной (Lutra lutra) [7], восемь – для барсука обыкновенного (Meles meles) [8] и семь – для ласки обыкновенной (Mustela nivalis) [9]. Скрининг проводили по следующим основным критериям: температура отжига праймеров, тип тандемного повтора (предпочтение отдавали микросателлитам с простыми тандемными повторами), уровень аллельного разнообразия, гетерозиготность (H). Также учитывали диапазоны размеров аллелей микросателлитов для возможности их плексирования в одной ПЦР. Для оценки информативности при включении в тест-систему каждый из кандидатных локусов сначала проверяли на небольшой тестовой выборке образцов M. vison (N = 5) в монолокусной реакции, и при условии ее успешности далее оценивали их совместную амплифицируемость в мультилокусной ПЦР (мПЦР).
Оптимизация ПЦР и амплификация
Оптимизацию мПЦР проводили с использованием контрольных образцов, которые были протестированы в монолокусных ПЦР при отборе микросателлитных локусов. Прямые праймеры для всех локусов были модифицированы в 5'-положении флуоресцентными метками (6FAM, R6G, TMR или ROX, АО “ГенТерра”, РФ). Праймеры смешивали в различных пропорциях и амплифицировали при различных диапазонах температур отжига и количестве циклов ПЦР до достижения оптимальной интенсивности пиков и гетерозиготного баланса. Успешность мПЦР оценивали по конкордантности генотипов контрольных образцов, исследованных ранее в одноименных локусах в моноплексной ПЦР. После оптимизации тест-системы амплификацию проводили в следующих условиях: 1× ПЦР-буфер-Б, 1.5 мM MgCl2, 0.2 мM dNTPs, 1 ед. акт. SynTaq-полимеразы (НПК “Синтол”, РФ), смесь праймеров (АО “ГенТерра”, РФ), 1 нг ДНК.
Мультилокусную ПЦР проводили на термоциклере С1000 (Bio-Rad, США) со следующими параметрами циклирования: 1 цикл (95°C, 10 мин), 34 цикла (95°C, 30 с → 61°С, 30 с → 72°C, 30 с), 1 цикл (72°C, 30 мин → 4°C, t = ∞).
Капиллярный электрофорез
Амплифицированные продукты мПЦР детектировали методом капиллярного электрофореза на генетическом анализаторе АВ3500 (Thermo Fischer Scienific, США). Для разделения продуктов мПЦР использовали полимер POP-4 и капилляры 36 см (Thermo Fisher Scientific), время инъекции 15 с при 1.2 кВ для всех образцов. Размер фрагментов определяли относительно внутреннего размерного стандарта Orange500DNA Size Standard (NimaGen, Нидерланды). Генотипы образцов определяли с использованием программного обеспечения GeneMapper ID-X 1.4 (Thermo Fisher Scientific). Чтобы предотвратить ошибки генотипирования из-за возможного загрязнения и смещений бинов, в каждый анализ включали один положительный и один отрицательный контроль ПЦР.
Создание маркерной панели для идентификации аллелей
Маркерную панель для аллелей каждого локуса создавали с использованием опции Panel Manager специализированной программы GeneMapper ID-X v1.4 на основе результатов электрофоретического разделения продуктов ПЦР, полученных генотипированием тестовой группы образцов M. vison. На основе анализа пиков выявляемых аллелей для каждого маркера формировался набор “бинов”, который позволял бы идентифицировать все возможные варианты аллелей. Назначение “бинов” для идентификации аллелей проводилось в соответствии с их молекулярным размером, определенным относительно Orange500DNA Size Standard (NimaGen, Нидерланды).
Характеристика локусов и популяционные исследования
Всех исследованных американских норок (N = 101) изначально рассматривали как единую региональную популяционную выборку Mustela vison (MV_R). Для того, чтобы оценить уровень молекулярно-генетического разнообразия белорусской популяции норки американской, популяционные параметры рассчитывали суммарно для всех животных и отдельно для каждой из трех локальных выборок, сформированных с учетом 1) отнесения животных к дикой или фермерской популяции и 2) административной принадлежности фермерского хозяйства. Таким образом, одна локальная выборка включала 24 норки, добытые из дикой популяции (MV_W); вторая локальная выборка включала 27 фермерских животных из Минской области (MV_F1); третья локальная выборка включала 50 фермерских животных из Гродненской области (MV_F2).
Базовые статистические параметры популяционной генетики, включая количество аллелей на локус, количество аллелей на выборку, наблюдаемую (Ho) и ожидаемую (He) гетерозиготность, коэффициент инбридинга (F), количество приватных аллелей, частоты встречаемости аллелей маркеров для каждой выборки, соответствие наблюдаемого распределения генотипов для каждого отдельного локуса равновесию Харди–Вайнберга (HWE), рассчитывали с использованием программы GeneAlEx 6.5 [10]. Неравновесие по сцеплению (LD) между парами локусов оценивали с помощью программного пакета Arlequin v3.5.1.3 [11]. Уровень генетической подразделенности популяции (Fst) вычисляли методом анализа молекулярной дисперсии (Analysis of Мolecular Variance, AMOVA). Генетические взаимоотношения популяций дополнительно исследовали с использованием принципа главных компонент (Principal Component Analysis, PCoA) с использованием программы GeneAlEx 6.5 [12]. Ожидаемые частоты нулевых аллелей рассчитывали с помощью программы Micro-Checker v2.2.3 [13]. Результаты множественных сравнений корректировали с использованием поправки Бонферрони [14].
Вероятности случайного совпадения профилей двух образцов (Random Match Probability, MP) рассчитывали с использованием правила умножения частот генотипов, рассчитанных двумя методами на основе рекомендаций 4.1 и 4.2 Национального исследовательского совета США (NRCII, US National Research Council) [4]. Расчет МР с учетом субструктуры популяции проводили в программном пакете MS Excel 2016 на основе эмпирически установленного значения Fst.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выбор микросателлитных локусов
Всего для разработки системы ДНК-анализа нами было исследовано 30 микросателлитных локусов на тестовой группе из 24 американских норок.
В ходе апробации девяти маркеров норки американской – Mvi1321, Mvi1341, Mvi1354, Mvi1381, Mvi1271, Mvis002, Mvis022, Mvis072, Mvis075 установлено, что рекомендуемые в литературе для каждого из маркеров условия ПЦР обеспечивают достаточное для успешной регистрации количество нарабатываемого ПЦР-продукта и стабильную воспроизводимость результатов генотипирования. Все девять локусов были полиморфными и имели от четырех (Mvis002) до восьми (Mvi1321, Mvi1341, Mvis075) аллелей у животных, представляющих белорусскую популяцию норки американской. Выявляемые аллельные диапазоны исследованных локусов соответствовали описанным в литературе [5, 6].
Из шести протестированных локусов выдры речной три локуса – Lut604, Lut457 и Lut818 были полиморфными, при этом максимальное количество аллелей было выявлено для локуса Lut604 (семь аллелей). В трех локусах (Lut833, Lut717 и Lut615) все животные исследованной выборки имели гомозиготные генотипы (123, 150, 217 пн соответственно). Выявленный в нашем исследовании характер проявления микросателлитных маркеров выдры речной при их переносе на норку американскую согласуется с данными исследования [7], авторы которого наблюдали существенно более низкий полиморфизм локусов L. lutra у четырех видов куньих – куницы лесной, норки американской, барсука и росомахи.
Уровень полиморфизма микросателлитных локусов барсука обыкновенного (Meles meles) Mel16, Mel246, Mel15, Mel538, Mel09, Mel203, Mel522, Mel08 при переносе на норку американскую также был невысоким. Так, из восьми исследованных локусов в трех – Mel15, Mel16 и Mel538, в тестовой выборке было обнаружено от трех до четырех аллелей; локусы Mel09 и Mel522 проявлялись как мономорфные (у всех норок амплифицировались одним фрагментом с размерами 161 и 196 пн соответственно); локусы Mel246, Mel08 и Mel203 не амплифицировались у целевого вида. Ни один из шести исследованных микросателлитных локусов ласки обыкновенной (Mustela nivalis) – Mn6.9, Mn1.27, Mn3.6, Mn6.14, Mn1.6, Mn4.14 не амплифицировался специфически у норки американской: наблюдалось либо полное отсутствие ампликонов, либо большое количество неспецифических фрагментов.
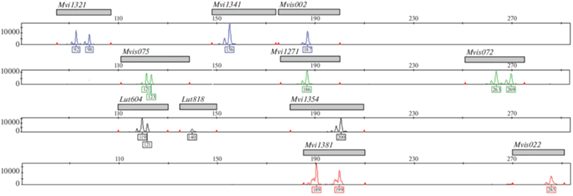
По результатам проведенного скрининга в разработку криминалистической панели для генотипирования белорусской популяции норки американской из 30 кандидатных локусов включены следующие 15: Mvi1321, Mvi1341, Mvi1354, Mvi1381, Mvi1271, Mvis002, Mvis022, Mvis072, Mvis075, Lut604, Lut457, Lut818, Mel15, Mel16 и Mel538, базовыми среди них были Mvi- и Mvis-локусы. В ходе предварительного тестирования 15 локусов в различных мультилокусных композициях четыре кандидатных локуса Lut457, Mel15, Mel16 и Mel538 были исключены из панели по причине перекрывания аллельных диапазонов, несовместимости с базовыми локусами по условиям ПЦР и температурным параметрам амплификации или высокого гетерозиготного дисбаланса. Сформированная финальная тест-система включала 11 микросателлитных локусов (девять базовых Mvi- и Mvis-локусов, разработанных непосредственно для норки американской, и два дополнительных Lut-локуса, видом-источником которых является речная выдра). Характеристики входящих в тест-систему локусов приведены в табл. 1. Все 11 локусов соответствовали установленным критериям качества, успешно амплифицировались в составе одной мультиплексной ПЦР, характеризовались относительно высокой гетерозиготностью и большим количеством аллелей в исследованной выборке. При использовании четырех различных флуоресцентных красителей 6FAM, R6G, TMR и ROX для мечения праймеров и NimaGen для размерного стандарта продукты амплификации всех локусов детектировались в четырех спектральных каналах генетического анализатора без перекрывания аллельных диапазонов (рис. 1).
Таблица 1.
Характеристика 11 микросателлитных локусов в белорусской популяции норки американской (N = 101)
| Локус | Номер в GenBank | Тандемный повтор | Флуоресцентная метка | Размерный диапазон | Na | Ne | Ho | He | F | PHWE | NAF |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mvi1321 | AF480847 | (CA)n | 6FAM | 88–106 | 10 | 4.56 | 0.743 | 0.787 | 0.01 | 0.6519 | 0.00 |
| Mvi1341 | AF480850 | (CA)n | 6FAM | 150–170 | 10 | 4.04 | 0.653 | 0.778 | 0.15 | 0.0196 | 0.07 |
| Mvis002 | AF132100 | (CA)n | 6FAM | 175–189 | 6 | 1.58 | 0.297 | 0.315 | –0.01 | 0.7093 | 0.00 |
| Mvis075 | AF132105 | (CA)n | R6G | 116–133 | 9 | 4.66 | 0.792 | 0.832 | –0.02 | 0.4973 | 0.00 |
| Mvi1271 | AF480844 | (CA)n | R6G | 182–192 | 6 | 3.96 | 0.683 | 0.768 | 0.08 | 0.0916 | 0.00 |
| Mvis072 | AF132104 | (CA)n | R6G | 257–271 | 7 | 2.99 | 0.604 | 0.677 | 0.03 | 0.0015 | 0.00 |
| Lut604 | Y16300 | *(CA)n | TAMRA | 111–127 | 7 | 3.48 | 0.644 | 0.739 | 0.11 | 0.0419 | 0.05 |
| Lut818 | Y16295 | *(GATA)n | TAMRA | 140–146 | 3 | 2.66 | 0.495 | 0.652 | 0.16 | 0.0036 | 0.11 |
| Mvi1354 | AF480852 | (CA)n | TAMRA | 184–202 | 10 | 3.10 | 0.584 | 0.672 | 0.10 | 0.0391 | 0.05 |
| Mvi1381 | AF421188 | (AC)n | ROX | 189–201 | 7 | 3.33 | 0.733 | 0.743 | –0.05 | 0.4205 | 0.00 |
| Mvis022 | AF132102 | (CA)n | ROX | 189–289 | 5 | 2.89 | 0.554 | 0.657 | 0.12 | 0.0517 | 0.06 |
| Среднее (S.D.) |
7.272 (0.689) |
3.386 (0.270) |
0.617 (0.041) |
0.693 (0.042) |
0.062 (0.022) |
0.03 (0.01) |
Примечание. Na – количество аллелей на локус; Ne – количество эффективных аллелей на локус; Ho – наблюдаемая гетерозиготность; He – ожидаемая гетерозиготность; F – коэффициент инбридинга; PHWE– уровень значимости отклонения от равновесия Харди–Вайнберга (α = 0.0045); NAF – ожидаемая частота нулевых аллелей; * повтор у вида-источника – выдры речной (L. lutra).
Генетический полиморфизм 11 микросателлитных локусов
Параметры генетического разнообразия 11 микросателлитных локусов, такие как количество аллелей на локус (Na), количество эффективных аллелей на локус (Ne), наблюдаемая (Ho) и ожидаемая (He) гетерозиготность, коэффициент инбридинга (F), рассчитанные в среднем на всю региональную популяционную выборку M. vison (N = 101), представлены в табл. 1.
Суммарно у исследованных американских норок в 11 локусах было идентифицировано 80 аллелей. Количество аллелей варьировало от трех до 11 и в среднем по всем локусам составило 6.24. Локальные выборки практически не различались между собой по среднему числу аллелей на локус (Na) и суммарному количеству выявленных аллелей, а наблюдаемые незначительные различия, вероятно, являлись результатом несовпадения численности животных в каждой из группировок (табл. 2). В локальной выборке MV_F2 с максимальной численностью (N = 50) идентифицирован 71 аллель, в двух других – MV_W (N = 24) и MV_F1 (N = 27) выявлено 67 и 68 аллелей соответственно.
Таблица 2.
Генетическое разнообразие трех локальных выборок норки американской (M. vison) в Беларуси
| Популяция | Локус | Na | Ne | Ho | He | F | PHWE | NAF |
|---|---|---|---|---|---|---|---|---|
| MV_W (дикая) N = 24 |
Mvi1321 | 8 | 6.857 | 0.917 | 0.854 | –0.073 | 0.6123 | 0.00 |
| Mvi1341 | 8 | 4.608 | 0.625 | 0.783 | 0.202 | 0.0154 | 0.08 | |
| Mvis002 | 4 | 2.129 | 0.542 | 0.530 | –0.021 | 0.1903 | 0.00 | |
| Mvis075 | 8 | 4.000 | 0.792 | 0.750 | –0.056 | 0.6052 | 0.00 | |
| Mvi1271 | 6 | 4.085 | 0.750 | 0.755 | 0.007 | 0.6141 | 0.00 | |
| Mvis072 | 6 | 3.388 | 0.875 | 0.705 | –0.241 | 0.6946 | 0.00 | |
| Lut604 | 7 | 3.182 | 0.625 | 0.686 | 0.089 | 0.3260 | 0.00 | |
| Lut818 | 3 | 2.083 | 0.500 | 0.520 | 0.038 | 1.0000 | 0.00 | |
| Mvi1354 | 7 | 4.721 | 0.667 | 0.788 | 0.154 | 0.3673 | 0.00 | |
| Mvi1381 | 5 | 3.470 | 0.750 | 0.712 | –0.054 | 0.5230 | 0.00 | |
| Mvis022 | 5 | 3.866 | 0.708 | 0.741 | 0.044 | 0.0856 | 0.00 | |
| Среднее (S.D.) |
6.091 (0.513) |
3.855 (0.397) |
0.705 (0.039) |
0.711 (0.031) |
0.008 (0.036) |
|||
| MV_F1 (фермерская F1) N = 27 |
Mvi1321 | 8 | 2.751 | 0.593 | 0.636 | 0.069 | 0.1370 | 0.00 |
| Mvi1341 | 8 | 3.383 | 0.593 | 0.704 | 0.159 | 0.1387 | 0.00 | |
| Mvis002 | 3 | 1.395 | 0.259 | 0.283 | 0.085 | 0.5443 | 0.00 | |
| Mvis075 | 9 | 4.658 | 0.815 | 0.785 | –0.038 | 0.4505 | 0.00 | |
| Mvi1271 | 6 | 3.673 | 0.630 | 0.728 | 0.135 | 0.0369 | 0.00 | |
| Mvis072 | 6 | 2.514 | 0.556 | 0.602 | 0.077 | 0.4706 | 0.00 | |
| Lut604 | 7 | 3.306 | 0.593 | 0.698 | 0.150 | 0.1416 | 0.00 | |
| Lut818 | 3 | 2.922 | 0.593 | 0.658 | 0.099 | 0.5125 | 0.00 | |
| Mvi1354 | 7 | 1.701 | 0.333 | 0.412 | 0.191 | 0.0205 | 0.00 | |
| Mvi1381 | 6 | 3.122 | 0.704 | 0.680 | –0.035 | 0.9861 | 0.00 | |
| Mvis022 | 5 | 1.976 | 0.407 | 0.494 | 0.175 | 0.1192 | 0.00 | |
| Среднее (S.D.) |
6.182 (0.585) |
2.855 (0.283) |
0.552 (0.049) |
0.607 (0.046) |
0.097 (0.023) |
|||
| MV_F2 (фермерская F2) N = 50 |
Mvi1321 | 9 | 4.082 | 0.740 | 0.755 | 0.020 | 0.5209 | 0.00 |
| Mvi1341 | 8 | 4.125 | 0.700 | 0.758 | 0.076 | 0.1380 | 0.00 | |
| Mvis002 | 4 | 1.226 | 0.200 | 0.185 | –0.083 | 1.0000 | 0.00 | |
| Mvis075 | 9 | 5.325 | 0.780 | 0.812 | 0.040 | 0.4294 | 0.00 | |
| Mvi1271 | 6 | 4.125 | 0.680 | 0.758 | 0.102 | 0.3295 | 0.00 | |
| Mvis072 | 6 | 3.081 | 0.500 | 0.675 | 0.260 | 0.0006 | 0.01 | |
| Lut604 | 7 | 3.943 | 0.680 | 0.746 | 0.089 | 0.0361 | 0.00 | |
| Lut818 | 3 | 2.985 | 0.440 | 0.665 | 0.338 | 0.0014 | 0.17 | |
| Mvi1354 | 8 | 2.887 | 0.680 | 0.654 | –0.040 | 0.3175 | 0.00 | |
| Mvi1381 | 6 | 3.394 | 0.740 | 0.705 | –0.049 | 0.0386 | 0.00 | |
| Mvis022 | 5 | 2.828 | 0.560 | 0.646 | 0.134 | 0.1113 | 0.00 | |
| Среднее (S.D.) |
6.455 (0.593) |
3.455 (0.317) |
0.609 (0.052) |
0.669 (0.051) |
0.081 (0.039) |
В общей региональной выборке самое низкое и самое высокое количество эффективных аллелей (Ne) имели локусы Mvis002 и Mvis075 – 1.58 и 4.66 соответственно. Во всех трех группах эффективное число аллелей было в 1.5–2 раза ниже, чем наблюдаемое, при этом самое низкое среднее значение Ne (2.85) зарегистрировано в локальной выборке MV_F1 (фермерские животные), а самые высокие средние показатели генетической изменчивости отмечены в локальной выборке MV_W, представляющей дикую популяцию амерканской норки в Беларуси (Ne = 3.86). Для диких животных также характерны наиболее высокие средние значения наблюдаемой (Ho) и ожидаемой (He) гетерозиготности по исследованным 11 микросателлитным локусам, при том что эти показатели во всех выборках были выше 50%. В среднем Ho составила 0.622 и варьировала от 0.552 в популяции MV_F1 до 0.705 в дикой выборке MV_W, He изменялась от 0.607 (MV_F1) до 0.711 (MV_W). Таким образом, все рассчитанные генетические параметры демонстрируют, что выборка диких норок характеризуется большим генетическим разнообразием по сравнению с двумя локальными группами фермерских норок.
Значения коэффициента инбридинга (F) на уровне вида варьировали от –0.05 у локуса Mvi1381 до 0.16 у локуса Lut818 и составили в объединенной выборке 0.062 (табл. 2). Положительное среднее значение F указывает на недостаток гетерозигот в каждой из групп американской норки. Основной вклад в редукцию средней гетерозиготности вносят фермерские животные – дефицит гетерозигот в выборках MV_F1 и MV_F2 составил 9.7 и 8.1% соответственно, что на порядок выше, чем в дикой выборке MV_W (0.08%). Высокий положительный уровень инбридинга у норок из фермерских хозяйств может быть связан с эффектом генетического дрейфа, который обусловлен недостаточным числом производителей, используемых в процессе разведения и/или родственным спариванием.
Всего у исследованных американских норок выявлено 20 приватных аллелей, 13 из которых присутствовали только у фермерских животных (“домашние аллели”) и семь – только у диких (“дикие аллели”). Максимальное число приватных аллелей детектировано в локусе Mvi1354 – 5.
Распределение приватных аллелей внутри двух локальных выборок фермерских животных различалось незначительно. В выборке MV_F1 из 13 “домашних аллелей” идентифицировано девять, в выборке MV_F2 – 12. Восемь аллелей являются общими для обеих фермерских выборок (Mvi1321-88, Mvi1321-106, Mvi1341-162, Mvi1341-168, Mvis075-133, Mvis072-265, Mvi1354-196, Mvi1354-198). Четыре аллеля Mvis002-175, Mvis002-189, Mvi1354-186, Mvi1381-191 обнаружены только в MV_F2, один Mvi1381-195 – только в MV_F1.
Информация о частотах встречаемости приватных аллелей в исследованных выборках суммирована в табл. 3. Из 20 приватных аллелей восемь (40%) имеют частоту встречаемости выше 0.05. Наиболее информативными маркерными аллелями для животных из зверохозяйств являются два – Mvi1341-162 (средняя частота в домашней выборке 0.149) и Mvis072-265 с частотой 0.162, которые в совокупности встречаются у 30% домашних норок. Хорошим маркерным аллелем “дикой” группы является Mvi1354-194, характерный для 27% американских норок из природной популяции. Приватные аллели с высокой частотой встречаемости могут быть использованы в дальнейшем для идентификации биологических образцов по их принадлежности дикому или домашнему животному. Высокая пропорция приватных аллелей (10.4% от их общего числа у диких норок и 17.8% – у домашних) указывает на то, что дикие и фермерские американские норки в Беларуси имеют специфичные генофонды.
Таблица 3.
Частоты встречаемости приватных аллелей в исследованных выборках норки американской (M. vison)
| Локус | Аллели | Дикие животные N = 24 |
Все фермерские животные N = 77 |
Фермерские (F1) N = 27 |
Фермерские (F2) N = 50 |
|---|---|---|---|---|---|
| Mvi1321 | 88 | 0.0195 | 0.0185 | 0.0400 | |
| 104 | 0.0208 | ||||
| 106 | 0.0325 | 0.0370 | 0.0100 | ||
| Mvi1341 | 150 | 0.0625 | |||
| 160 | 0.0208 | ||||
| 162 | 0.1494 | 0.2037 | 0.1200 | ||
| 168 | 0.0844 | 0.0926 | 0.0800 | ||
| Mvi002 | 175 | 0.0130 | 0.0200 | ||
| 185 | 0.0417 | ||||
| 189 | 0.0065 | 0.0100 | |||
| Mvi075 | 133 | 0.0130 | 0.0185 | 0.0100 | |
| Mvi072 | 261 | 0.0625 | |||
| 265 | 0.1623 | 0.1296 | 0.1800 | ||
| Mvi1354 | 186 | 0.0065 | 0.0100 | ||
| 188 | 0.0625 | ||||
| 194 | 0.2708 | ||||
| 196 | 0.0390 | 0.0370 | 0.0400 | ||
| 198 | 0.0584 | 0.0185 | 0.0800 | ||
| Mvi1381 | 191 | 0.0065 | 0.0100 | ||
| 195 | 0.0065 | 0.0185 | |||
| Число приватных аллелей | 20 | 7 | 13 | 9* | 12* |
| % от общего числа аллелей | 25.0 | 10.4 | 17.8 | 13.2 | 16.9 |
Распределение аллелей и генотипов в популяционных выборках
В объединенной выборке американской норки в пяти локусах – Mvi1341, Lut604, Lut818, Mvi1354, Mvis022 отмечено достоверное отклонение (P < 0.05) распределения частот генотипов от равновесия Харди–Вайнберга (HWE). При введении поправки Бонферрони на множественность сравнений (для набора из 11 тестов фактический уровень значимости равен 0.0045) статистически достоверное отклонение от HWE сохраняется для двух локусов – Mvis072 и Lut818 (данные представлены в табл. 1). Две локальные популяции – дикая и одна фермерская MV_F1 находятся в равновесии по всем локусам. Для второй фермерской популяции MV_F2 зарегистрировано отклонение от HWE в четырех локусах (Mvis072, Lut604, Lut818, Mvi1381). После введения поправки Бонферрони для этой фермерской популяции достоверное отклонение от HWE сохранилось для двух локусов – Mvis072 и Lut818. Одной из наиболее вероятных причин отклонения двух локусов от HWE в популяционной выборке MV_F2 является высокая ожидаемая частота нулевых аллелей. Так, для локуса Mvis072 зарегистрирован недостаток гетерозигот всех типов (гетерозиготы, включающие все зарегистрированные для выборки аллельные варианты), при этом ожидаемая доля нулевых аллелей в локусе может достигать 11%. Для локуса Lut818 количество предполагаемых нулевых аллелей достигает 17%, также для этого локуса отмечен недостаток гетерозигот, аллельные варианты которых различаются на один тандем, что может свидетельствовать о наличии ошибок генотипирования, связанных со статтер-эффектом. При пересчете на общую региональную выборку ожидаемая популяционная частота нулевых аллелей для всех локусов <12%, что согласно исследованиям A.C. Kelly et al. [15] является приемлемым уровнем, который существенно не влияет на популяционные частоты аллелей, но может приводить к ложному исключению родства. Таким образом, экспертам рекомендуется с осторожностью интерпретировать гомозиготные генотипы в локусах Mvis072 и Lut818, особенно при генотипировании образцов ДНК плохого качества, являющихся дополнительным источником ошибок. Рассчитанные для общей выборки ожидаемые частоты нулевых аллелей (NAF, Null Allele Frequency) для каждого локуса приведены в табл. 1.
Анализ неравновесия по сцеплению (LD) для 11 локусов в совокупной региональной выборке Mustela показал вероятное наличие 23 пар сцепленных локусов. Чтобы проверить это предположение, анализ на сцепленность был выполнен отдельно для каждой из локальных групп, как было описано в работе [16] при разработке микросателлитной панели для белохвостых оленей. При оценке LD на локальном уровне количество вероятных групп сцепления существенно снижалось – до пяти в дикой популяции (MV_W), трех в фермерской MV_F1 и 14 в фермерской MV_F2, при этом ни один из блоков сцепленных локусов не был общим для всех трех популяций. Это наблюдение позволяет предположить, что вероятнее всего в геноме норки американской все 11 локусов наследуются независимо. Для достоверного исключения неравновесного сцепления локусов требуются дополнительные исследования семейных групп, однако получить такие данные очень сложно, особенно для диких животных.
Генетическая дифференциация исследованных выборок
Поскольку наблюдаемое достоверное отклонение от HWE в объединенной выборке американской норки может быть обусловлено ее подразделенностью, был проведен анализ генетических различий между локальными группировками методом молекулярной дисперсии (AMOVА). Согласно полученным данным 4.4% генетического разнообразия в совокупной выборке норки американской обеспечиваются различиями между локальными популяциями (Fst = 0.04397, P < 0.005). При объединении норок двух ферм в одну группу индекс Fst, характеризующий различия между группами дикой и домашней норки, достоверно увеличивался до 0.05617 (P < 0.005), при этом на различия между двумя популяциями фермерских животных приходилось около 1% всего генетического разнообразия (Fst = 0.01109, P < 0.005), что свидетельствует о том, что дикие и домашние норки различаются между собой в большей степени, чем две локальные популяции животных, выращенных в неволе. Эти наблюдения подтверждаются данными парных сравнений Fst для трех локальных выборок (табл. 4), а также данными визуализации генетических расстояний методом анализа главных компонент PCoA (рис. 2). Кластеризация выборок норки американской по 11 микросателлитным локусам показывает, что в массиве генотипов выделяются генотипы диких норок, образующие достаточно компактную группу в нижней части диаграммы, ограниченно перекрывающуюся с единым облаком генотипов двух фермерских популяций, занимающих верхнюю часть поля диаграммы.
Рис. 2.
Данные визуализации генетических расстояний между дикими и фермерскими норками, полученные методом анализа главных компонент PCoA. Голубые круги – дикие норки; красные квадраты и зеленые треугольники – две фермерские группы.

Анализ различий в распределении генетических признаков между исследованными популяционными выборками норки американской позволил выявить статистически достоверную разницу между частотами аллельных вариантов дикой и домашней групп в восьми из 11 локусов – Mvi1341, Mvis002, Mvis075, Lut604, Lut818, Mvi1354, Mvi1381, Mvis022 (P < 0.0045 с учетом поправки Бонферрони), при этом распределение аллелей в двух популяциях фермерских норок (MV_F1 и MV_F2) достоверно не различалось.
Таким образом, с использованием различных статистических подходов по результатам изучения полиморфизма 11 микросателлитных локусов установлена невысокая, но достоверная генетическая дифференциация между дикими и фермерскими норками, что с учетом наличия приватных аллелей указывает на неоднородность генетической структуры белорусской популяции M. vison, обусловленную существованием этого вида в “дикой” и “домашней” формах.
Следует отметить, что похожие результаты были получены при изучении американских норок, обитающих в других регионах. Так, A. Michalska-Parda et al. [17] установили, что в Польше дикие и домашние норки принадлежат к двум генетически близким, но отдельным группам (88% норок, отобранных из дикой популяции, были отнесены к дикой группе, тогда как остальные 12% – к норкам, разводимым в фермерских хозяйствах). В работе K.Y. Morris et al. [18] были обнаружены существенные различия между дикими и фермерскими американскими норками в Канаде, в частности содержащиеся в неволе животные по сравнению с дикими имели другие частоты и меньшее количество аллелей как в нейтральных, так и в функциональных локусах.
В разрезе криминалистического ДНК-анализа выявленная генетическая дифференциация популяции M. vison требует формирования отдельных баз частот аллелей для диких и фермерских животных. В случае, когда принадлежность животного к одной из групп известна, для расчета вероятности случайного совпадения генотипов (МР) должна использоваться соответствующая референтная база. Когда же происхождение животного неизвестно, корректно применять консервативную процедуру расчета МР с использованием поправки на генетическую дифференциацию популяций, руководствуясь рекомендациями Национального исследовательского совета США (NRCII) [4]. Средние значения вероятности случайного совпадения генотипов двух неродственных особей американской норки были рассчитаны нами каждым из двух подходов и для сравнения представлены в табл. 5. Как видно, средние значения МР, рассчитанные для всех 11 локусов сформированной тест-системы с учетом и без учета коэффициента Fst, различаются на два порядка (1.84 × 10–8 и 1.39 × 10–10 соответственно). Таким образом, не используя корректирующее Fst при оценке вероятности случайного совпадения генотипов в подразделенной популяции мы будем недооценивать МР, получая кажущуюся более низкую вероятность случайного совпадения двух профилей. Средние значения МР, рассчитанные на основе генотипов диких и домашних животных, отличаются более чем на один порядок, также наглядно демонстрируя, что использование неадекватной референтной базы данных при идентификационных исследованиях может привести к снижению дискриминирующей способности метода.
Таблица 5.
Средние значения вероятности случайного совпадения (МР) генотипов двух неродственных особей норки американской
| Локус | MP | МРдик. | МРдом. | MPF (Fst = 0.044) |
|---|---|---|---|---|
| Mvi1321 | 0.0711 | 0.0729 | 0.1007 | 0.1402 |
| Mvi1341 | 0.0856 | 0.1146 | 0.1017 | 0.1458 |
| Mvis002 | 0.5067 | 0.3229 | 0.6168 | 0.5834 |
| Mvis075 | 0.0548 | 0.1076 | 0.0632 | 0.1109 |
| Mvi1271 | 0.0952 | 0.1146 | 0.1020 | 0.1546 |
| Mvis072 | 0.1413 | 0.1528 | 0.1766 | 0.2229 |
| Lut604 | 0.1120 | 0.1563 | 0.1233 | 0.1706 |
| Lut818 | 0.1818 | 0.3056 | 0.1763 | 0.2541 |
| Mvi1354 | 0.1669 | 0.0868 | 0.2262 | 0.2272 |
| Mvi1381 | 0.1091 | 0.1493 | 0.1334 | 0.1755 |
| Mvis022 | 0.1656 | 0.1458 | 0.2157 | 0.2337 |
| CMP | 1.39 × 10–10 | 4.59 × 10–10 | 1.02 × 10–9 | 1.84 × 10–8 |
| 1 из… | 7 164 613 059 | 2 179 968 313 | 982 841 075 | 54 318 664 |
С учетом представленных выше фактических данных для корректного использования идентифицирующей тест-системы из 11 микросателлитных локусов в экспертной практике в Республике Беларусь частоты встречаемости аллелей данных локусов были рассчитаны для общей региональной популяции американской норки и для каждой из групп (“дикой” и “фермерской”) (табл. 6). Для учета популяционной стратификации при невозможности отнесения исследуемых образцов к одной из групп частоты генотипов могут быть рассчитаны с поправкой на эмпирически установленный коэффициент Fst = 0.044, что, как было показано, позволит учитывать максимально возможные различия между двумя группами американских норок.
Таблица 6.
Частоты встречаемости аллелей 11 микросателлитных локусов в дикой (MV_W, N = 24), фермерской (MV_F, N = 77) и в общей региональной (MV_R, N = 101) популяции норки американской (M. vison)
| Локус | Популяция | Локус | Популяция | Локус | Популяция | Локус | Популяция | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mvis075 | MV_W | MV_F | MV_R | Mvi1271 | MV_W | MV_F | MV_R | Lut818 | MV_W | MV_F | MV_R | Mvi1321 | MV_W | MV_F | MV_R |
| 117 | 0.1250 | 0.0260 | 0.0495 | 182 | 0.0417 | 0.0520 | 0.0495 | 140 | 0.6042 | 0.3636 | 0.4208 | 88 | – | 0.0325 | 0.0248 |
| 119 | 0.0625 | 0.0649 | 0.0643 | 184 | 0.3541 | 0.2078 | 0.2426 | 142 | 0.3333 | 0.3507 | 0.3465 | 90 | 0.2083 | 0.0260 | 0.0693 |
| 121 | 0.2083 | 0.2792 | 0.2624 | 186 | 0.2291 | 0.3571 | 0.3267 | 146 | 0.0625 | 0.2857 | 0.2327 | 92 | 0.1250 | 0.1234 | 0.1238 |
| 123 | 0.4167 | 0.0909 | 0.1683 | 188 | 0.2292 | 0.2078 | 0.2129 | Mvi 1354 | MV_W | MV_F | MV_R | 94 | 0.1459 | 0.4805 | 0.4010 |
| 125 | 0.0417 | 0.0520 | 0.0495 | 190 | 0.1042 | 0.1623 | 0.1485 | 184 | 0.0833 | 0.0195 | 0.0346 | 96 | 0.1459 | 0.0649 | 0.0842 |
| 127 | 0.0208 | 0.1039 | 0.0842 | 192 | 0.0417 | 0.0130 | 0.0198 | 186 | – | 0.0065 | 0.0050 | 98 | 0.1250 | 0.1169 | 0.1188 |
| 129 | 0.1042 | 0.2662 | 0.2277 | Mvis072 | MV_W | MV_F | MV_R | 188 | 0.0625 | – | 0.0149 | 100 | 0.0833 | 0.0389 | 0.0495 |
| 131 | 0.0208 | 0.1039 | 0.0842 | 257 | 0.0625 | 0.0195 | 0.0297 | 190 | 0.0833 | 0.0584 | 0.0644 | 102 | 0.1458 | 0.0974 | 0.1089 |
| 133 | – | 0.0130 | 0.0099 | 261 | 0.0625 | – | 0.0148 | 192 | 0.1458 | 0.1883 | 0.1782 | 104 | 0.0208 | – | 0.0049 |
| Mvis022 | MV_W | MV_F | MV_R | 263 | 0.4792 | 0.5130 | 0.5049 | 194 | 0.2709 | – | 0.0643 | 106 | – | 0.0195 | 0.0148 |
| 281 | 0.1667 | 0.0260 | 0.0594 | 265 | – | 0.1623 | 0.1238 | 196 | – | 0.0390 | 0.0297 | Mvi 1341 | MV_W | MV_F | MV_R |
| 283 | 0.1042 | 0.1169 | 0.1139 | 267 | 0.0833 | 0.0389 | 0.0495 | 198 | – | 0.0584 | 0.0445 | 150 | 0.0625 | – | 0.0149 |
| 285 | 0.3958 | 0.5714 | 0.5297 | 269 | 0.1875 | 0.2338 | 0.2228 | 200 | 0.3125 | 0.6039 | 0.5347 | 154 | 0.2084 | 0.0974 | 0.1238 |
| 287 | 0.2292 | 0.0584 | 0.0990 | 271 | 0.1250 | 0.0325 | 0.0545 | 202 | 0.0417 | 0.0260 | 0.0297 | 156 | 0.3125 | 0.4481 | 0.4158 |
| 289 | 0.1042 | 0.2273 | 0.1980 | Lut604 | MV_W | MV_F | MV_R | Mvi 1381 | MV_W | MV_F | MV_R | 158 | 0.2500 | 0.0649 | 0.1089 |
| Mvis002 | MV_W | MV_F | MV_R | 111 | 0.1875 | 0.0455 | 0.0792 | 189 | 0.0625 | 0.4026 | 0.3218 | 160 | 0.0208 | – | 0.0050 |
| 175 | – | 0.013 | 0.0099 | 115 | 0.1042 | 0.0389 | 0.0544 | 191 | – | 0.0065 | 0.0049 | 162 | – | 0.1493 | 0.1138 |
| 177 | 0.0625 | 0.0065 | 0.0198 | 117 | 0.0417 | 0.1039 | 0.0891 | 193 | 0.3958 | 0.3312 | 0.3465 | 164 | 0.0417 | 0.0325 | 0.0347 |
| 183 | 0.2708 | 0.0974 | 0.1386 | 119 | 0.5000 | 0.4350 | 0.4505 | 195 | – | 0.0065 | 0.0050 | 166 | 0.0833 | 0.0390 | 0.0495 |
| 185 | 0.0417 | – | 0.0099 | 121 | 0.1250 | 0.1234 | 0.1238 | 197 | 0.0417 | 0.0844 | 0.0743 | 168 | – | 0.0844 | 0.0643 |
| 187 | 0.625 | 0.8766 | 0.8168 | 123 | 0.0208 | 0.2143 | 0.1683 | 199 | 0.2708 | 0.0584 | 0.1089 | 170 | 0.0208 | 0.0844 | 0.0693 |
| 189 | ‒ | 0.0065 | 0.0050 | 127 | 0.0208 | 0.0390 | 0.0347 | 201 | 0.2292 | 0.1104 | 0.1386 | ||||
Необходимость формирования надежных референтных баз данных для видов животных, попадающих в сферу судебно-экспертных исследований, и выбора адекватных методов статистических расчетов, которые целесообразно использовать для оценки МР, широко обсуждается в работах зарубежных авторов. Например, были разработаны тест-системы и обоснованы подходы к расчету МР с использованием референтных баз для косуль в Шотландии [19], подвидов североамериканских белохвостых и чернохвостых оленей в Канаде [20, 21], популяций благородных оленей в Венгрии [22]. Ранее нами также были разработаны репрезентативные базы данных частот аллелей STR-локусов, учитывающие генетическую дифференциацию диких кабанов и домашних свиней [23] и региональную структуру популяций диких парнокопытных – лосей и косуль Беларуси [24]. В настоящей работе на примере норки американской (M. vison) продемонстрировано влияние структуры популяции на вероятность случайного совпадения профилей ДНК и обоснована значимость включения Fst в расчет МР.
Идентификационный потенциал 11 микросателлитных локусов в белорусской популяции норки американской
Рассчитанная на основе частот встречаемости аллелей 11 STR-локусов в “дикой” популяции средняя вероятность того, что две выбранные случайным образом особи норки американской будут иметь одинаковый мультилокусный генотип, равна 4.59 × 10–10 (т.е. случайное совпадение генотипа возможно с одной из 2 × 109 норок). С учетом численности дикой популяции М. vison в Республике Беларусь, составляющей по состоянию на 2021 г. 24 475 особей [2], идентифицирующая способность 11 STR-локусов разработанной тест-системы более чем достаточна для применения в экспертном ДНК-анализе.
По результатам апробации 30 микросателитных локусов, разработанных для представителей семейства Куньи, сформирована 11-локусная панель, которая обладает достаточным уровнем полиморфизма и высокой разрешающей способностью при проведении идентификационных исследований биологических образцов животных вида норка американская (M. vison) Республики Беларусь. Суммарно в исследованных выборках из белорусской популяции американских норок для 11 локусов идентифицировано 80 аллелей, при этом в среднем на локус приходится 6.24 аллеля, а наблюдаемая гетерозиготность варьирует от 30 до 80%. Исследованная выборка из дикой популяции американской норки генетически более разнообразна по сравнению с фермерскими животными. Установленные параметры генетического разнообразия девяти базовых Mvi- и Mvis-локусов разработанной тест-системы существенно не отличаются от значений, полученных на популяциях американских норок из Канады [6] и США [5].
Показано, что, несмотря на генетическую близость диких и фермерских норок, формирующих популяцию животных вида M. vison в Беларуси, для каждой из этих двух исследованных групп характерна специфичная популяционно-генетическая структура. Применительно к криминалистическому ДНК-анализу это требует при расчете МР использовать либо частоты аллелей, специфичные для соответствующей группы (дикой или фермерской), либо частоты для всей популяции с корректировкой на эмпирически установленное значение Fst. На значимость учета происхождения биологических образцов от одной из групп при оценке МР указывают выявленные различия в распределении аллельных частот в исследованных выборках диких и фермерских норок. Все рассчитанные значения МР в дикой и домашней популяциях норки американской на несколько порядков превышают установленный в настоящее время уровень дискриминационного потенциала (выше, чем один из 1 млн), обеспечивая убедительную поддержку в суде гипотезы о неслучайном совпадении сравниваемых генотипов [25].
Проведенное исследование ориентировано в первую очередь на судебно-экспертный анализ биологических образцов животных вида норка американская; сформированная панель идентифицирующих ДНК-маркеров может быть использована для изучения генетического разнообразия и мониторинга диких популяций Mustela vison, а также для генетической паспортизации фермерских животных, установления достоверности происхождения потомства и оценки эффективности ведения селекционной работы в фермерских хозяйствах.
Данная работа тематически продолжает и развивает проводимые в Республике Беларусь исследования в области судебного ДНК-анализа объектов животного происхождения, способствуя стандартизации подходов к статистическому анализу данных и приведению их в соответствие с международной практикой [26].
Целью дальнейших исследований является поиск наиболее информативных микросателлитных маркеров для создания тест-систем, адаптированных к работе с “криминалистическими” образцами, и подбор ДНК-маркеров для видовой идентификации и установления половой принадлежности Mustela vison.
Авторы выражают благодарность всем охотоведам и охотникам за сбор образцов, а также персонально В.В. Козловскому (заместителю начальника управления охоты, рыболовства и туризма республиканского государственно-общественного объединения “Белорусское общество охотников и рыболовов”), И.С. Юрченко (заведующему отделом экологии фауны государственного природоохранного научно-исследовательского учреждения “Полесский государственный радиационно-экологический заповедник”) и Г.В. Попову (директору республиканской ассоциации по звероводству и переработке пушно-мехового сырья “Белпушнина”) за помощь в формировании коллекции биологических образцов.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Сидорович В.Е., Ставровский Д.Д. Норка американская // Звери: популярный энциклопедический справочник (животный мир Беларуси). Минск, 2003. С. 217–222.
Министерство лесного хозяйства Республики Беларусь. Отчет о ведении охотничьего хозяйства за 2021 год. Минск, 2022. 6 с.
Valnisty A.A., Homel K.V., Kheidorova E.E. et al. Molecular genetic polymorphism of American mink populations (Neovison vison) in model fur farms and on the adjacent territories in Belarus // Dokl. Natl Acad. Sci. Belarus. 2020. V. 64. № 6. P. 685–693. https://doi.org/10.29235/1561-8323-2020-64-6-685-693
The Evaluation of Forensic DNA Evidence. Committee on DNA Forensic Science: an update. Washington (D.C.): Natl Acad. Press, 1996. 272 p.https://doi.org/10.17226/5141
Fleming M.A., Ostrander E.A., Cook J.A. Microsatellite markers for American mink (Mustela vison) and ermine (Mustela erminea) // Mol. Ecol. 1999. V. 8. P. 1351–1362. https://doi.org/10.1046/j.1365-294x.1999.00701_2.x
Vincent I.R., Farid A., Otieno C.J. Variability of thirteen microsatellite markers in American mink // Can. J. Anim. Sci. 2003. V. 83. P. 597–599. https://doi.org/10.4141/A03-001
Dallas J.F., Piertney S.B. Microsatellite primers for the Eurasian otter // Mol. Ecol. 1998. V. 7. P. 1248–1250.
Annavi G., Dawson D.A., Horsburgh G.J. et al. Characterization of twenty-one European badger (Meles meles) microsatellite loci facilitates the discrimination of second-order relatives // Conservation Genet. Resour. 2011. V. 3. P. 515–518. https://doi.org/10.1007/s12686-011-9392-9
Rodrigues M., Santos-Reis M., Elmeros M. et al. Markers for genetic studies in the weasel (Mustela nivalis) // Eur. J. Wildl. Res. 2012. V. 58. P. 507–510. https://doi.org/10.1007/s10344-011-0583-1
GeneAlEx 6.5: Genetic Analysis in Excel [Электронный ресурс]. URL: https://biology-assets.anu.edu.au/GenAlEx/Welcome.html (дата обращения 20.04.2022).
Arlequin: An Integrated Software for Population Genetics Data Analysis [Электронный ресурс]. URL: http://cmpg.unibe.ch/software/arlequin3 (дата обращения 02.05.2022).
Peakall R., Smouse P.E. GENEALEX 6: genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. 2006. V. 6. P. 288–295. https://doi.org/10.1093/bioinformatics/bts460
Hutchinson W.F.D., Wills D., Shipley P. MICRO-CHECKER: Software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. № 3. P. 535–538. https://doi.org/10.1111/j.1471-8286.2004.00684.x
Rice W.R. Analyzing tables of statistical tests // Evolution. 1989. V. 43. P. 223–225. https://doi.org/10.1111/j.1558-5646.1989.tb04220.x
Kelly A.C., Mateus-Pinilla N.E., Douglas M. et al. Microsatellites behaving badly: empirical evaluation of genotyping errors and subsequent impacts on population studies // Genet. Mol. Research. 2011. V. 10. № 4. P. 2534–2553. https://doi.org/10.4238/2011.October.19.1
Miller W.L., Edson J., Pietranrea P et al. Identification and evaluation of core microsatellite panel for use in white-tailed deer (Odocoileus virginianus) // BMC Genetics. 2019. V. 20. № 49. P. 1–14.
Michalska-Parda A., Brzeziñski M., Zalewski A. et al. Genetic variability of feral and ranch American mink Neovison vison in Poland // Acta Theriologica. 2009. V. 54. P. 1–10. https://doi.org/10.1007/BF03193132
Morris K.Y., Bowman J., Schulte-Hostedde A. et al. Functional genetic diversity of domestic and wild American mink (Neovison vison) // Evol. Appl. 2020. V. 13. P. 2610–2629. https://doi.org/10.1111/eva.13061
Morf N.V., Kopps A.M., Nater A. et al. STRoe deer: A validated forensic STR profiling system for the European roe deer (Capreolus capreolus) // Forensic Sci. Intern.: Animals and Environments. 2021. V. 1. P. 1–10. https://doi.org/10.1016/j.fsiae.2021.100023
Jobin R.M., Patterson D., Zhang Y. DNA typing in populations of mule deer for forensic use in the Province of Alberta // Forensic Sci. Intern.: Genetics. 2008. V. 2. P. 190–197. https://doi.org/10.1016/j.fsigen.2008.01.003
Hamlin B.C., Erin P., Meredith E.P. et al. OdoPlex: An STR multiplex panel optimized and validated for forensic identification and sex determination of North American mule deer (Odocoileus hemionus) and white-tailed deer (Odocoileus virginianus) // Forensic Sci. Intern.: Animals and Environments. 2021. V. 1. P. 11–21. https://doi.org/10.1016/j.fsiae.2021.100026
Szabolcsi Z., Egyed B., Zenke P. et al. Constructing STR multiplexes for individual identification of Hungarian red deer // J. Forensic Sci. 2014. V. 59. № 4. P. 1090–1099. https://doi.org/10.1111/1556-4029.12403
Rębała K., Nedzvetskaya D.E., Kotova S.A. Forensic STR typing of European elk (moose) and European roe deer reveals contrasting patterns of genetic structure of the two cervids in Belarus // Russ. J. Genet. 2022. in press.
Rębala K., Rabtsava A.A., Kotova S.A. et al. STR profiling for discrimination between wild and domestic swine specimens and between main breeds of domestic pigs reared in Belarus // PLoS One. 2016. V. 11. № 11. P. 1–14. https://doi.org/10.1371/journal.pone.0166563
SWGDAM, Scientific Working Group on DNA Analysis Methods, Recommendations of the SWGDAM Ad Hoc Working Group on Genotyping Results Reported as Likelihood Ratios, SWGDAM, 2018. P. 1–6. https://doi.org/1ecb9588-ea6f-4feb
Ogden R., Linacre A. Wildlife forensic science: A review of genetic geographic origin assignment // Forensic Sci. Intern. Genet. 2015. V. 18. P. 152–159. https://doi.org/10.1016/j.fsigen.2015.02.008
Дополнительные материалы отсутствуют.