Генетика, 2023, T. 59, № 4, стр. 448-459
Генетическая интрогрессия в популяциях двух близких видов Adalia frigida (Schneider, 1792) и Adalia bipunctata (Linnaeus, 1758) (Coleoptera: Coccinellidae) в зоне симпатрии
Д. А. Романов 1, *, Е. В. Шайкевич 1, И. А. Захаров 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119333 Москва, Россия
* E-mail: dromanov_16@mail.ru
Поступила в редакцию 22.06.2022
После доработки 15.09.2022
Принята к публикации 20.09.2022
- EDN: AWMQFP
- DOI: 10.31857/S0016675823040100
Аннотация
Изучено гаплотипическое разнообразие мтДНК циркумполярного вида божьих коровок Adalia frigida, собранных в Якутске и Салехарде. На основе анализа нуклеотидных последовательностей гена cox1 выявлено 18 митохондриальных гаплотипов, из них 14 новых. Из 18 гаплотипов A. frigida два (H32 и H9) являются наиболее распространенными. В районе Салехарда происходит перекрывание ареала A. frigida с ареалом другого близкого вида – A. bipunctata. Величина дивергенции по гену cox1 между A. frigida и A. bipunctata достигает 4.1–4.3% и соответствует уровню различий, характерному для близких видов. Эти виды способны скрещиваться между собой, доля гибридных особей (A. frigida и A. bipunctata) в Салехарде составляет 56.5%. Гибридизация между A. frigida и A. bipunctata привела к взаимной митохондриальной интрогрессии, результатом которой стало приобретение гаплотипа H1 жуками A. frigida и гаплотипа H9 жуками A. bipunctata.
Божьи коровки рода Adalia (Coleoptera: Coccinellidae) остаются популярным объектом для генетических (гибридологических и популяционных) исследований на протяжении уже почти 100 лет [1–6]. У представителей этого рода наиболее видное место среди таксономических признаков, по которым осуществляется определение видов, занимают окраска и рисунок различных частей тела – головы, переднеспинки, надкрылий, нижней стороны тела и ног. Однако рисунок надкрылий и переднеспинки этих жуков, особенно A. bipunctata, характеризуется высоким разнообразием. У светлых форм A. bipunctata надкрылья красные, обычно с одним черным пятном на каждом, реже с несколькими; у темных форм надкрылья обычно черные с двумя-тремя красными пятнами на каждом. Переднеспинка у светлых форм беловатая, обычно с черным пятном М-образной или трапециевидной формы, у темных форм – черная, с желтоватыми боками. Низ тела и ноги черные. A. bipunctata – голарктический вид, обитающий в Западной Европе, Северной Африке, в России (европейская часть, Кавказ, Сибирь, Дальний Восток), в Передней Азии, Закавказье, Казахстане, Средней Азии, Афганистане, Монголии, Китае, Японии, Северной Америке [2, 7, 8].
По краям ареала A. bipunctata встречаются резко различающиеся по фенотипу формы: A. b. revelierei, A. b. turanica и A. b. fasciatopunctata, которые первоначально рассматривали в качестве самостоятельных видов [9]. Однако гибридологический анализ [2] и сравнительный анализ мтДНК (ген cox1) и ядерной ДНК (ITS2 – второй внутренний транскрибируемый спейсер кластера рибосомных генов) показали, что эти формы являются географическими разновидностями одного вида – A. bipunctata [10, 11].
Для характеристики разнообразия гаплотипов у божьих коровок рода Adalia на протяжении 20 лет используется средняя часть гена cox1 [12]. По выбранному участку уже описано 23 митохондриальных гаплотипа у A. bipunctata [13, 14]. Самым распространенным у A. bipunctata является гаплотип H1 [10, 12, 15].
Среди жуков рода Adalia наиболее близким видом к A. bipunctata является A. frigida [16]. У этого вида каждое надкрылье с двумя поперечными черными перевязями; передняя перевязь состоит из трех, задняя – из двух черных пятен, которые нередко полностью сливаются. Иногда пятна имеют светлую кайму. Такой рисунок никогда не встречается в европейских популяциях A. bipunctata. Переднеспинка с М-образным черным пятном посередине и часто с одной черной точкой у каждого бокового края. Реже переднеспинка черная, с узкой белой каймой вдоль боков. Низ тела и ноги черные, усики коричневые, с затемненной вершиной. Вышеописанный узор на надкрыльях A. frigida характерен только для этого вида. Этот рисунок наследуется как простой хромосомный аллель и используется как диагностический признак вида. A. frigida – циркумполярный вид, обитающий на Скандинавском полуострове (Норвегия, Швеция), севере европейской части России, севере и востоке Сибири, на севере Приморского края, Сахалине, Итурупе, Кунашире и в Северной Америке [7, 9, 17, 18].
Таксономическое положение A. frigida долгое время вызывало противоречивые заключения. Изначально описанный как отдельный вид A. frigida был лишен этого статуса американским энтомологом Ч.В. Лэнгом, который объединил его с A. bipunctata [19]. Этот взгляд на таксономическое положение A. frigida сохранился среди американских исследователей и в дальнейшем [20]. Таким образом, после объединения ранее описанного вида A. annectans с A. bipunctata [21] все разнообразие коровок рода Adalia в Северной Америке оказалось сведено к одному виду – A. bipunctata. В Европе же шли дискуссии о том, является ли A. frigida самостоятельным видом или же подвидом A. bipunctata. Я.Я. Лусис описал частичную репродуктивную изоляцию A. frigida и A. bipunctata, хотя ему удалось получить гибриды первого поколения, а нарушение процессов размножения он наблюдал лишь со второго поколения. Тем не менее он признал A. frigida самостоятельным видом [22]. Но некоторые исследователи рассматривали A. frigida в качестве подвида A. bipunctata [7, 17, 18, 23]. Проведенное ранее сравнение относительно небольшого количества образцов A. frigida с A. bipunctata по генетическим маркерам (cox1 и ITS2) позволило предположить, что A. frigida имеет статус близкого к A. bipunctata вида [10, 11, 16].
Целями данного исследования было уточнение отношений между A. frigida и A. bipunctata, для чего было изучено разнообразие мтДНК A. frigida на территориях, где этот вид встречается совместно с A. bipunctata и где A. frigida является единственным представителем рода Adalia. Были проведены сборы жуков в Салехарде (2021 г.), в зоне совместного обитания A. frigida с A. bipunctata, и в Якутске (2015 г.), где встречается только A. frigida, и был выполнен анализ разнообразия последовательностей митохондриального гена cox1 собранных жуков A. frigida и A. bipunctata в сравнении с ранее полученными последовательностями A. frigida, A. bipunctata, A. tetraspilota, A. conglomerata и A. decempunctata. Также выполнена проверка зараженности A. frigida и A. bipunctata из Салехарда и Якутска симбиотическими бактериями Spiroplasma, Rickettsia и Wolbachia, которые широко распространены в европейских популяциях A. bipunctata.
МАТЕРИАЛЫ И МЕТОДЫ
В Якутске в 2015 г. было собрано 36 имаго A. frigida. В 2021 г. в Салехарде были собраны имаго A. frigida (23 экз.) и A. bipunctata (3 экз.). Определение видов кокцинеллид осуществляли визуально по характерному для каждого вида рисунку надкрылий жуков.
Выделение тотальной ДНК из имаго кокцинеллид проводили методом фенол-хлороформной экстракции по стандартному протоколу [24].
Реакцию амплификации с каждым препаратом ДНК проводили в объеме 25 мкл с использованием универсального набора Encyclo Plus PCR kit (Евроген, Россия, Москва) в соответствии с протоколом фирмы-производителя. Все ПЦР выполнялись на амплификаторе MiniAmp Plus (Applied Biosystems, США).
Для ПЦР на митохондриальный ген cox1 применялись две пары праймеров: праймеры C1-jF (5'-GCTGGAATTTCATCAATTTTAGG-3') и C1-nR (5'-GGAAATCAATGAATAAATCCTGCT-3'), подобранные к мтДНК A. bipunctata, а также универсальные праймеры LCO1490 (5'-GGTCAACAAATCATAAAGATATTGG-3') и HCO2198 (5'-TAAACTTCAGGGTGACCAAAAAATCA-3') [25]. Праймеры LCO1490 и HCO2198 амплифицируют фрагмент cox1 длиной 709 пн с позиции 20 по 728, а праймеры C1-jF и C1-nR амплифицируют фрагмент гена cox1 длиной 737 пн с позиции 454 по 1190 (нумерация дана в соответствии с полной последовательностью митохондриального гена cox1 A. bipunctata – GenBank ID: AJ313070). Условия амплификации (с праймерами C1-jF и C1-nR): начальная денатурация – 4 мин при 94°C; затем 35 циклов: денатурация – 20 с при 94°C, отжиг – 20 с при 58°C и полимеризация – 50 с при 72°C. ПЦР завершалась заключительной полимеризацией в течение 5 мин 72°C. Условия амплификации (с праймерами LCO1490 и HCO2198): начальная денатурация – 4 мин при 94°C; затем пять циклов: денатурация – 20 с при 94°C, отжиг – 20 с при 45°C и полимеризация – 45 с при 72°C; затем 30 циклов: денатурация – 20 с при 94°C, отжиг – 20 с при 55°C и полимеризация – 45 с при 72°C. ПЦР завершалась заключительной полимеризацией в течение 5 мин 72°C.
Определение зараженности божьих коровок A. frigida и A. bipunctata симбиотическими бактериями (Spiroplasma, Rickettsia, Wolbachia) проводили с помощью ПЦР со специфичными к генам бактерий праймерами. Для идентификации Spiroplasma по гену dnaA использовали праймеры Sp_ApDnaA_F1 (5'-ATTCTTCAGTAAAAATGCTTGGA-3') и Sp_ApDnaA_R1 (5'-ACACATTTACTTCATGCTATTGA-3'), позволяющие амплифицировать фрагмент длиной 447 пн. Обнаружение Rickettsia осуществляли с применением праймеров RicF141 (5'-TCGGTTCTCTTTCGGCATTTTA-3') и RicR548 (5'-GCATATTTATCACCGCTTCATT-3'), специфичных к последовательности гена gltA. Размер ПЦР-продукта составляет 407 пн. Поиск Wolbachia по гену fbpA проводили с праймерами fbpA-F1ms (5'-GCTGCTCCACTTGGTATGAT-3') и fbpA-R1ms (5'-CCACCAGAAAAAACTACTATTC-3'), амплифицирующими фрагмент длиной 509 пн. Условия амплификации (для всех праймеров на бактерии): начальная денатурация – 4 мин при 94°C; затем 35 циклов: денатурация – 20 с при 94°C, отжиг – 20 с при 57°C и полимеризация – 35 с при 72°C. ПЦР завершалась заключительной полимеризацией в течение 5 мин 72°C.
Анализ результатов ПЦР осуществляли методом электрофореза в 1.5%-ном агарозном геле. Элюцию фрагментов ДНК из геля проводили с использованием набора для выделения ДНК из агарозных гелей Cleanup Mini (Евроген, Москва) в соответствии с инструкциями фирмы-производителя. Очищенные фрагменты ДНК передавали в компанию Евроген для секвенирования.
Хроматограммы нуклеотидных последовательностей фрагмента митохондриального гена cox1 анализировали с помощью комплекта программ DNASTAR Lasergene 6 [26, 27]. Последовательности, полученные в результате секвенирования, зарегистрированы в базе данных GenBank под номерами ON025611–ON025630 и ON564976–ON564983.
Расчет генетических дистанций (по модели Кимуры) и создание филогенетических деревьев (методом Neighbor-Joining, эволюционная модель Кимуры) проводили в программе MEGA6 v6.0 [28]. Для построения дендрограммы представителей рода Adalia по митохондриальному гену cox1 использовали базу данных GenBank. Из нее были выбраны все последовательности подходящего размера, общее число которых достигло 125. Затем провели отсев идентичных последовательностей: из группы одинаковых оставляли одну с сохранением упоминания о географическом происхождении отсеянных последовательностей. Количество оставшихся последовательностей уменьшилось до 33.
РЕЗУЛЬТАТЫ
Для изучения гаплотипического разнообразия мтДНК божьих коровок A. frigida и A. bipunctata были определены нуклеотидные последовательности средней части гена cox1. Все полученные новые последовательности были сравнены с ранее описанными 23 гаплотипами A. bipunctata.
У 36 имаго A. frigida из Якутска было обнаружено 10 митохондриальных гаплотипов, из них восемь новых (табл. 1). Поскольку некоторые гаплотипы, характерные для A. frigida, встречаются также и у A. bipunctata, для обозначения новых гаплотипов A. frigida была продолжена нумерация, использующаяся для обозначений гаплотипов A. bipunctata.
Таблица 1.
Митохондриальные гаплотипы A. frigida из Якутска
| Гаплотип | GenBank ID | Тип мтДНК | Количество имаго | Обозначение образцов |
|---|---|---|---|---|
| H1 | AJ313070 | A. bipunctata | 2/36 | Y-19, Y-33 |
| H9 | AJ313067 | A. frigida | 7/36 | Y-5, Y-7, Y-10, Y-18, Y-27, Y-28, Y-36 |
| H25 | ON025622 | A. frigida | 1/36 | Y-16 |
| H28 | ON564977 | A. frigida | 1/36 | Y-35 |
| H29 | ON564978 | A. frigida | 2/36 | Y-23, Y-24 |
| H30 | ON564979 | A. frigida | 1/36 | Y-3 |
| H32 | ON564980 | A. frigida | 18/36 | Y-1, Y-4, Y-6, Y-8, Y-9, Y-14, Y-15, Y-17, Y-20, Y-21, Y-22, Y-25, Y-26, Y-29, Y-30, Y-31, Y-32, Y-34 |
| H33 | ON564981 | A. frigida | 2/36 | Y-11, Y-12 |
| H34 | ON564982 | A. frigida | 1/36 | Y-2 |
| H35 | ON564983 | A. frigida | 1/36 | Y-13 |
Наиболее распространенными гаплотипами у коровок в Якутске оказались H32, обнаруженный у 18 особей, и H9, найденный у семи особей. Последовательности H9 образуют отдельный кластер внутри группы гаплотипов A. frigida (рис. 1). Гаплотип H9, первоначально описанный у A. bipunctata, может свидетельствовать о митохондриальной интрогрессии от A. frigida к A. bipunctata, так как часто встречается именно у A. frigida (табл. 1). Интрогрессия митохондриальных геномов носила взаимный характер, о чем свидетельствует обнаружение в Якутске двух имаго A. frigida с гаплотипом H1, который является самым распространенным гаплотипом A. bipunctata (рис. 1).
Рис. 1.
Дендрограмма сходства нуклеотидных последовательностей фрагмента гена cox1 длиной 610 пн (с позиции 506 по 1115) божьих коровок A. frigida, собранных в Якутске (Y-1–Y-36), и A. bipunctata, представленных последовательностями 10 митохондриальных гаплотипов (GenBank ID: AJ313060–AJ313070). События митохондриальной интрогрессии у A. frigida обозначены черными треугольниками, у A. bipunctata – черным кружком. Последовательность гена cox1 A. decempunctata использована в качестве внешней группы.

В Салехарде было собрано 26 имаго божьих коровок, ДНК была выделена из 23 из них, из которых 20 фенотипически (по рисунку надкрыльев) соответствовали A. frigida, а три – A. bipunctata. Оказалось, что среди A. frigida 10 имаго имеют мтДНК своего вида, тогда как у других 10 имаго мтДНК соответствует мтДНК A. bipunctata (рис. 2). МтДНК всех трех особей A. bipunctata из Салехарда соответствует A. frigida (рис. 2).
Рис. 2.
Дендрограмма сходства нуклеотидных последовательностей фрагмента гена cox1 длиной 610 пн (с позиции 506 по 1115) божьих коровок A. bipunctata и A. frigida. Коровки, собранные в Салехарде (S-1–S-23), обозначены как A. frigida и A. bipunctata в соответствии с фенотипом. На дендрограмме также представлены последовательности 10 митохондриальных гаплотипов A. bipunctata (GenBank ID: AJ313060–AJ313070). События митохондриальной интрогрессии у A. frigida обозначены черными треугольниками, у A. bipunctata – черными кружками. Последовательность гена cox1 A. decempunctata использована в качестве внешней группы.
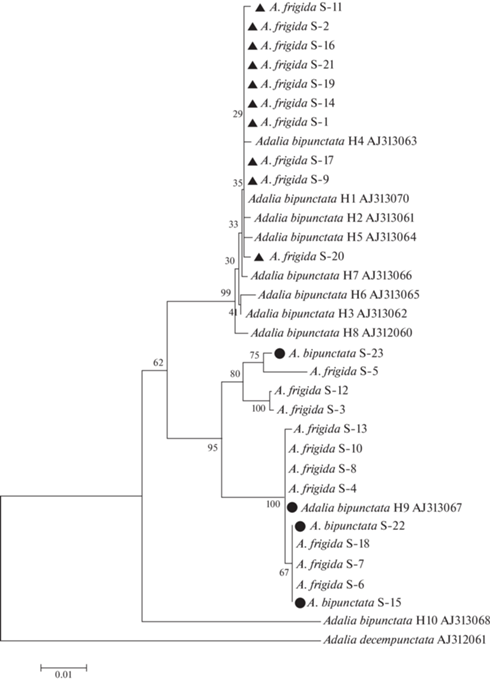
Среди 20 имаго A. frigida из Салехарда было выявлено 11 митохондриальных гаплотипов, из них семь новых. У трех особей A. bipunctata обнаружены два новых гаплотипа: H27 и H38 (табл. 2).
Таблица 2.
Митохондриальные гаплотипы A. frigida и A. bipunctata из Салехарда
| Гаплотип | GenBank ID | Тип мтДНК | Количество имаго | Обозначение образцов |
|---|---|---|---|---|
| H1 | AJ313070 | A. bipunctata | 8/23 | S-1, S-2, S-9, S-14, S-16, S-17, S-19, S-21 |
| H9 | AJ313067 | A. frigida | 2/23 | S-8, S-10 |
| H19 | KY765912 | A. bipunctata | 1/23 | S-20 |
| H24 | ON025621 | A. bipunctata | 1/23 | S-11 |
| H25 | ON025622 | A. frigida | 1/23 | S-12 |
| H26 | ON025613 | A. frigida | 1/23 | S-3 |
| H27 | ON564976 | A. frigida | 1/23 | S-23 |
| H31 | ON025615 | A. frigida | 1/23 | S-5 |
| H36 | ON025614 | A. frigida | 1/23 | S-4 |
| H37 | ON025623 | A. frigida | 1/23 | S-13 |
| H38 | ON025616 ON025617 ON025628 |
A. frigida | 5/23 | S-6, S-7, S-15, S-18, S-22 |
Образец S-4 отличается от образца S-10 единственной нуклеотидной заменой A225G, которая находится вне участка, выбранного для построения дендрограммы, поэтому на рис. 2 они идентичны, а в табл. 2 отнесены к разным гаплотипам (H36 и H9 соответственно). Последовательность гена cox1 образца S-12 оказалась идентична полученной ранее последовательности cox1 A. frigida (JQ757049) из Архангельска [16], этот гаплотип обозначен как H25 (табл. 1). На рис. 1 и 2 последовательность JQ757049 отсутствует из-за недостаточной длины секвенированного участка (не хватает 61 пн для выравнивания с остальными последовательностями).
Мы рассчитали значения генетических дистанций между 17 гаплотипами, выявленными у A. frigida в Якутске и Салехарде (табл. 3). Различие между часто встречающимися гаплотипами мтДНК A. frigida (H9 и H32) и A. bipunctata (H1) составляет 4.1 и 4.3%. Разнообразие мтДНК A. frigida можно разделить на два кластера, один из которых образован гаплотипами H25–H35, другой образован гаплотипами H9–H38. Различие между гаплотипами внутри первого и второго кластеров составляет 0.2–1.9 и 0.2–0.3% соответственно. Различие между кластерами составляет от 2.3 до 3.1%.
Таблица 3.
Значения генетических дистанций между последовательностями митохондриальных гаплотипов, обнаруженных у A. frigida
| № | Гаплотип | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H1 | ||||||||||||||||
| 2 | H24 | 0.002 | |||||||||||||||
| 3 | H25 | 0.037 | 0.039 | ||||||||||||||
| 4 | H26 | 0.039 | 0.041 | 0.002 | |||||||||||||
| 5 | H27 | 0.036 | 0.037 | 0.013 | 0.014 | ||||||||||||
| 6 | H28 | 0.039 | 0.041 | 0.013 | 0.014 | 0.006 | |||||||||||
| 7 | H29 | 0.044 | 0.046 | 0.014 | 0.016 | 0.010 | 0.006 | ||||||||||
| 8 | H30 | 0.043 | 0.044 | 0.013 | 0.014 | 0.006 | 0.003 | 0.006 | |||||||||
| 9 | H31 | 0.048 | 0.049 | 0.018 | 0.019 | 0.011 | 0.008 | 0.011 | 0.005 | ||||||||
| 10 | H32 | 0.043 | 0.044 | 0.013 | 0.014 | 0.008 | 0.005 | 0.005 | 0.002 | 0.006 | |||||||
| 11 | H33 | 0.044 | 0.046 | 0.014 | 0.016 | 0.010 | 0.006 | 0.006 | 0.003 | 0.008 | 0.002 | ||||||
| 12 | H34 | 0.044 | 0.046 | 0.014 | 0.016 | 0.010 | 0.006 | 0.006 | 0.003 | 0.008 | 0.002 | 0.003 | |||||
| 13 | H35 | 0.046 | 0.048 | 0.016 | 0.018 | 0.011 | 0.008 | 0.008 | 0.005 | 0.010 | 0.003 | 0.005 | 0.005 | ||||
| 14 | H9 | 0.041 | 0.043 | 0.026 | 0.024 | 0.026 | 0.023 | 0.027 | 0.026 | 0.027 | 0.026 | 0.027 | 0.027 | 0.029 | |||
| 15 | H36 | 0.041 | 0.043 | 0.026 | 0.024 | 0.026 | 0.023 | 0.027 | 0.026 | 0.027 | 0.026 | 0.027 | 0.027 | 0.029 | 0.000 | ||
| 16 | H37 | 0.043 | 0.044 | 0.027 | 0.026 | 0.027 | 0.024 | 0.029 | 0.027 | 0.029 | 0.027 | 0.029 | 0.029 | 0.031 | 0.002 | 0.002 | |
| 17 | H38 | 0.043 | 0.044 | 0.027 | 0.026 | 0.027 | 0.024 | 0.029 | 0.027 | 0.029 | 0.027 | 0.029 | 0.029 | 0.031 | 0.002 | 0.002 | 0.003 |
Поскольку в многочисленных исследованиях для идентификации видов используется 5'-область гена cox1, мы выбрали восемь различающихся между собой образцов A. frigida из Салехарда (№ 1, 3, 4, 5, 6, 10, 11, 13) (рис. 2) для проведения сравнительного анализа со всеми зарегистрированными в международной базе данных GenBank последовательностями божьих коровок рода Adalia (рис. 3).
Рис. 3.
Дендрограмма сходства нуклеотидных последовательностей фрагмента гена cox1 длиной 537 пн (с позиции 85 по 621) божьих коровок рода Adalia. Коровки, собранные в Салехарде, отмечены черными ромбами. Последовательности, взятые из базы данных GenBank, приведены с указанием их регистрационных номеров и стран, в которых они были отмечены, а также с указанной авторами видовой принадлежностью. Квадратные скобки объединяют группы гаплотипов, относящихся к A. bipunctata и A. frigida. Последовательность гена cox1 Harmonia quadripunctata использована в качестве внешней группы.

Топология дендрограммы, построенной по 5'-области гена cox1 (рис. 3), соответствует дендрограммам, построенным по средней части этого гена (рис. 1 и 2). Гаплотипы A. bipunctata, сходные с H1–H8, образуют один кластер, объединяющий варианты мтДНК собственно A. bipunctata. Множество гаплотипов A. bipunctata из Финляндии, Германии, Китая, Канады и США кластеризуются с мтДНК A. frigida. Последовательности 5'-области cox1 A. frigida, так же как и на рис. 1 и 2, разделяются на два кластера, что подтверждает достоверность такой топологии. Отдельно группируются гаплотипы, сходные с H10, а также последовательность A. bipunctata из Оулу, Финляндия, зарегистрированная под номером MZ659941.
Проведенный поиск симбионтов у 20 имаго A. frigida и трех имаго A. bipunctata, собранных в Салехарде, позволил выявить зараженность бактерией Spiroplasma у двух имаго A. frigida (S-5 и S-19). В Якутске Spiroplasma была найдена у трех имаго A. frigida (Y-11, Y-14 и Y-31). Бактерии Rickettsia и Wolbachia не были обнаружены.
ОБСУЖДЕНИЕ
Скрещивания двух разных видов могут привести к митохондриальной интрогрессии – замене собственной митохондриальной ДНК (мтДНК) у одного вида на мтДНК другого вида. С развитием молекулярно-генетических методов анализа количество работ, посвященных событиям интрогрессий, стало неуклонно расти [29]. Такие процессы происходят не только между разными видами [30–32], но и между близкими родами [33].
В лабораторных условиях Я.Я. Лусис получал гибриды от скрещивания A. bipunctata с A. frigida [2, 22]. По нашим данным (результаты не представлены) фенотип A. frigida, имеющий характерный для этого вида рисунок из двух полос на надкрыльях, является рецессивным по отношению к обычным рисункам A. bipunctata и определяется аллелем того же гена, что и другие рисунки надкрылий. Проведенный нами сравнительный анализ мтДНК (рис. 1, 2) выявил множество случаев, когда у одного вида обнаруживается мтДНК другого вида. Это указывает на то, что гибридизация между этими видами происходит и в природных популяциях. Коровки A. bipunctata ведут относительно оседлый образ жизни, мигрируя по небольшой территории в поисках пищи либо мест для зимовки [3]. Коровки A. frigida, вероятно, ведут себя сходным образом. Поскольку гаплотип H9, соответствующий мтДНК A. frigida, был обнаружен в ряде мест, где A. frigida не встречается: в Англии, Дании, Германии, России (Москва, Санкт-Петербург), Армении (табл. 4), а гаплотип H1 был найден в Якутске, где не обитает A. bipunctata, их носителями могли быть лишь потомки от межвидовых гибридов. Это свидетельствует о возникновении взаимной митохондриальной интрогрессии. Для объяснения широкого распространения гаплотипа H9 можно предположить, что ранее A. frigida обитал на обширной территории, где неоднократно происходила гибридизация двух видов, либо что A. bipunctata приобрел гаплотип Н9 однократно, а затем носители этого гаплотипа расселились очень широко по современному ареалу вида.
Хотя A. frigida сравнительно недавно считался циркумполярным видом, мы предполагаем, что к настоящему времени ареал этого вида значительно сократился. Во время сборов кокцинеллид на севере Норвегии в 2016 г. И.А. Захаровым был обнаружен только один вид – A. bipunctata [5]. A. frigida отмечался на севере Швеции как редкий вид божьих коровок и был внесен в список Красной книги Швеции в 2000–2005 гг. С 2010 г. A. frigida перестал упоминаться в Красной книге Швеции, которая переиздается каждые 5 лет [34]. В Архангельске A. frigida присутствовал еще в 2005 г., но уже с 2010 г. там удается найти лишь A. bipunctata [16, 35]. Я.Я. Лусис со ссылкой на американские работы 1903–1910 гг. указывает, что A. frigida в Северной Америке распространяется на юг до Огайо, Канзаса, Миссури и Небраски [2]. Однако в Канаде и в США (Аляска) в ходе выполнения работ по проектам, направленным на изучение биоразнообразия членистоногих [36, 37], вид A. frigida, в отличие от A. bipunctata (рис. 3), не был отмечен. К сожалению, американские исследователи часто считали A. frigida синонимом A. bipunctata [20]. Так что отсутствие упоминания о A. frigida и выявление множества митохондриальных гаплотипов этого вида у A. bipunctata в Северной Америке может означать как исчезновение A. frigida и интрогрессию мтДНК этого вида, так и объединение A. frigida с A. bipunctata при сборах. В Европе ареал A. frigida сокращается, вероятно, в связи с глобальным потеплением. Та же причина способствует продвижению A. bipunctata в северном и северо-восточном направлениях. Обживая новые территории, жуки A. bipunctata скрещиваются с A. frigida, что приводит к поглощению вида A. frigida более активным в условиях потепления A. bipunctata. A. frigida пока сохранился на севере России и в Сибири, но значительная часть оставшегося ареала представляет собой зону гибридизации с A. bipunctata.
Салехард находится как раз в зоне гибридизации этих видов божьих коровок. Несмотря на то что A. frigida численно преобладает над A. bipunctata (в соотношении 23 : 3), половина особей A. frigida имеет мтДНК A. bipunctata, а у всех собранных здесь имаго A. bipunctata найдена мтДНК A. frigida, что свидетельствует об активно идущей гибридизации. Доля гибридов составляет 56.5% от числа особей A. frigida и A. bipunctata. В Якутске, находящемся вне зоны гибридизации, частота митохондриальной интрогрессии у A. frigida невелика – 5.5%. Очевидно, что два имаго A. frigida, у которых был найден гаплотип H1, представляют собой потомков от скрещивания с самками A. frigida из южнее расположенной гибридной зоны.
Анализируя дендрограммы (рис. 1–3), мы отмечаем разделение разнообразия гаплотипов A. frigida на два кластера. Учитывая, что один кластер (гаплотипы H25–H35) достигает наибольшего разнообразия и наибольшей частоты распространения в Якутске, а другие входящие в него гаплотипы (с учетом данных по A. bipunctata) найдены в Китае, Канаде и США, можно предположить, что он характеризует полиморфизм мтДНК сибирских популяций A. frigida. Второй кластер, образуемый гаплотипами H9, H36, H37 и H38, наоборот, более разнообразен в Салехарде, что позволяет предполагать его европейское происхождение. Однако контакты между европейскими и сибирскими популяциями A. frigida привели к обобществлению гаплотипов из обоих кластеров и дальнейшему распространению их на новые территории. Дивергенция между нуклеотидными последовательностями гаплотипов из этих кластеров, достигающая 2.3–3.1%, находится между средними значениями генетических расстояний (%), рассчитанных для полиморфизма внутри вида (0.89 ± 0.16) и для полиморфизма между близнецовыми видами и подвидами (3.78 ± 1.18) [38]. Такие значения вполне могут характеризовать разницу между отдаленными популяциями одного вида.
Вопрос о таксономическом статусе A. frigida и A. bipunctata дискутировался долгое время. Величина дивергенции по митохондриальному гену cox1 у этих коровок достигает 4.1–4.3%, что характеризует уровень различий между подвидами либо близкими видами [38]. Способность A. frigida и A. bipunctata скрещиваться между собой и то, что их потомки (или часть из них) фертильны, указывает на подвидовой уровень. Однако в последнее время количество свидетельств межвидовых и межродовых гибридизаций неуклонно растет [30, 31, 33], что несколько снижает требования к строгой репродуктивной изоляции между разными видами. Другим близким к A. bipunctata видом является A. tetraspilota, встречающийся в Узбекистане, Индии, Непале [2]. Этот вид репродуктивно изолирован от A. bipunctata [2], а величина дивергенции между A. tetraspilota и A. bipunctata по последовательностям cox1 (6.2%) и ITS2 (1.8%) сходна с наблюдаемой для A. frigida и A. bipunctata (4.9 и 1.8% соответственно) [16]. Это позволяет предположить, что генетические расстояния, отмечаемые для пар A. bipunctata–A. frigida и A. bipunctata–A. tetraspilota, отражают видовой уровень дивергенции для коровок рода Adalia.
У A. bipunctata известен еще один случай митохондриальной интрогрессии от неизвестного близкого вида божьих коровок, который привел к появлению гаплотипа H10. Величина дивергенции гаплотипа H10 от гаплотипов, типичных для A. bipunctata, составляет 6.7% [16]. Гаплотип H10 распространился на значительной части ареала A. bipunctata – от Германии до Бурятии (Россия) [16], родственные ему гаплотипы присутствуют также в США и Канаде (рис. 3). Тем не менее у A. frigida этого гаплотипа не обнаружено. Предполагается, что A. bipunctata приобрел этот гаплотип уже после дивергенции с A. frigida от пока неизвестного, возможно исчезнувшего, вида [16].
Работа выполнена при поддержке гранта РНФ 22-24-00435.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Лус Я.Я. О наследовании окраски и рисунка у божьих коровок Adalia bipunctata L. и Adalia decempunctata L. // Изв. Бюро по генетике. 1928. Т. 6. С. 89–163.
Лусис (Лус) Я.Я. Таксономические отношения и географическое распространение форм жуков рода Adalia Mulsant // Уч. записки Латв. гос. ун-та: Проблемы генетики и эволюции. 1973. Т. 184. № 1. С. 5–128.
Сергиевский С.О., Захаров И.А. Изучение генетического полиморфизма популяций двуточечной божьей коровки Adalia bipunctata (L.) Ленинградской области. II. Состав популяции города Ленинграда // Генетика. 1983. № 4. С. 635–640.
Honek A., Martinková Z., Pekár S. Temporal stability of morph frequency in central European populations of Adalia bipunctata and A. decempunctata (Coleoptera: Coccinellidae) // Eur. J. Entomol. 2005. V. 102. P. 437–442. https://doi.org/10.14411/eje.2005.062
Захаров И.А., Рубанович А.В. Экологическая генетика жуков рода Adalia: популяции A. bipunctata Норвегии и Кольского полуострова // Экол. генетика. 2018. Т. 16. № 1. С. 49–52. https://doi.org/10.17816/ecogen16149-52
Шайкевич Е.В., Захаров И.А., Хонек А. Экологическая генетика жуков рода Adalia: изменчивость и симбиотические бактерии в европейских популяциях десятиточечной божьей коровки Adalia decempunctata // Экол. генетика. 2019. Т. 17. № 4. С. 37–45. https://doi.org/10.17816/ecogen17437-45
Кузнецов В.Н. Сем. Coccinellidae – Божьи коровки // Определитель насекомых Дальнего Востока СССР. Т. 3. Жесткокрылые, или жуки. Ч. 2. Л.: Наука, 1991. С. 333–376.
Никитский Н.Б., Украинский А.С. Божьи коровки (Coleoptera, Coccinellidae) Московской области // Энтомол. обозрение. 2016. Т. 45. № 3. С. 555–582. https://doi.org/10.1134/S0013873816060051
Якобсон Г.Г. Жуки России и Западной Европы. Вып. XIII. Петроград: Девриен, 1916. С. 981–984.
Захаров И.А., Шайкевич Е.В. Молекулярно-генетическое изучение географических форм жуков Adalia bipunctata и A. frigida // Экол. генетика. 2014. Т. 12. № 3. С. 52–59. https://doi.org/10.17816/ecogen12352-59
Shaikevich E.V., Zakharov I.A. Biodiversity in geographically remote natural populations of Adalia ladybirds (Coleoptera: Coccinellidae) // Beetles: Biodiversity, Ecology and Role in the Environment. N.Y.: Nova Sci. Publ., Inc., 2015. P. 205–227.
Schulenburg J.H.G., Hurst G.D.D., Tetzlaff D. et al. History of infection with different male-killing bacteria in the two-spot ladybird beetle Adalia bipunctata revealed through mitochondrial DNA sequence analysis // Genetics. 2002. V. 160. № 3. P. 1075–1086. https://doi.org/10.1093/genetics/160.3.1075
Паленко М.В., Андрианов Б.В., Романов Д.А., Захаров И.А. Географический клинальный полиморфизм распределения митохондриальных гаплотипов Adalia bipunctata Linnaeus, 1758 (Coleoptera: Coccinellidae) Норвегии // Генетика. 2018. Т. 54. № 4. С. 456–461.
Shaikevich E.V., Romanov D.A., Zakharov I.A. The diversity of Wolbachia in a single Adalia bipunctata (Coleoptera: Coccinellidae) population: Correlations with host phylogeny and male-killing // Symbiosis. 2021. V. 85. № 2. P. 249–257. https://doi.org/10.1007/s13199-021-00808-x
Захаров И.А., Шайкевич Е.В. Полиморфизм мтДНК в петербургской популяции Adalia bipunctata и его связь с зараженностью симбиотической бактерией Spiroplasma // Экол. генетика. 2011. Т. 9. № 1. С. 27–31.
Zakharov I.A., Shaikevich E.V. Comparative study of mtDNA in species of the genus Adalia (Coleoptera: Coccinellidae) and origin of ancient mitochondrial haplotypes in the gene pool of Adalia bipunctata // Eur. J. Entomol. 2013. V. 110. № 3. P. 427–433. https://doi.org/10.14411/eje.2013.057
Кузнецов В.Н., Прощалыкин М.Ю. К фауне жуков-кокцинеллид (Coleoptera, Coccinellidae) Курильских островов // Евразиатский энтомол. журн. 2006. Т. 5. № 4. С. 264–270.
Кузнецов В.Н., Прощалыкин М.Ю. Фауна жуков-кокцинеллид (Coleoptera, Coccinellidae) острова Сахалин // Евразиатский энтомол. журн. 2007. Т. 6. № 1. С. 39–50.
Leng C.W. Notes on Coccinellidae. II // J. N.Y. Entomol. Soc. 1903. V. 11. P. 193–213.
Belicek J. Coccinellidae of Western Canada and Alaska with analyses of the transmontane zoogeographic relationships between the fauna of British Columbia and Alberta (Insecta: Coleoptera: Coccinellidae) // Quaestiones Entomologicae. 1976. V. 12. P. 283–409.
Palmer M.A. Some notes on heredity in the coccinellid genus Adalia Mulsant // Ann. Entomol. Soc. Amer. 1911. V. 4. P. 283–302.
Лусис (Лус) Я.Я. О систематическом положении Adalia frigida Schneider (Coleoptera, Coccinellidae) // Генетико-селекционные исследования в Латвийской ССР: Тез. докл. конф. Рига: Зинатне, 1976. С. 3–6.
Iablokoff-Khnzorian S.M. Les coccinelles. Coléoptères–Coccinellidae. Paris: Société nouvelle des Editions Boubée, 1982. 568 p.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1626 p.
Folmer O., Black M., Hoeh W. et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. 1994. V. 3. P. 294–299.
Clewley J.P. Macintosh sequence analysis software. DNASTAR’s Lasergene // Mol. Biotechnol. 1995. V. 3. P. 221–224. https://doi.org/10.1007/BF02789332
Burland T.G. DNASTAR’s Lasergene sequence analysis software // Methods Mol. Biol. 2000. V. 132. P. 71–91. https://doi.org/10.1385/1-59259-192-2:71
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0 // Mol. Biol. Evol. 2013. V. 30. № 12. P. 2725–2729. https://doi.org/10.1093/molbev/mst197
Toews D.P.L., Brelsford A. The biogeography of mitochondrial and nuclear discordance in animals // Mol. Ecol. 2012. V. 21. № 16. P. 3907–3930. https://doi.org/10.1111/j.1365-294X.2012.05664.x
Dias C., Lima K.A., Araripe J. et al. Mitochondrial introgression obscures phylogenetic relationships among manakins of the genus Lepidothrix // Mol. Phylogenet. Evol. 2018. V. 126. P. 314–320. https://doi.org/10.1016/j.ympev.2018.04.017
Crottini A., Orozco-terWengel P., Rabemananjara F.C.E. et al. Mitochondrial introgression, color pattern variation, and severe demographic bottlenecks in three species of Malagasy poison frogs, genus Mantella // Genes. 2019. V. 10. № 4. P. 317:1–25. https://doi.org/10.3390/genes10040317
Horoiwa M., Mandagi I.F., Sutra N. et al. Mitochondrial introgression by ancient admixture between two distant lacustrine fishes in Sulawesi Island // PLoS One. 2021. V. 16. № 6. e0245316. https://doi.org/10.1371/journal.pone.0245316
Shapoval N.A., Yakovlev R.V., Kuftina G.N. et al. Identification of natural hybrids between Ahlbergia frivaldszkyi (Lederer, 1853) and Callophrys rubi (Linnaeus, 1758) (Lepidoptera, Lycaenidae) using mitochondrial and nuclear markers // Insects. 2021. V. 12. P. 1124:1–16. https://doi.org/10.3390/insects12121124
Artfakta. Naturvård. Polarnyckelpiga. 2022. https://artfakta.se/naturvard/taxon/adalia-frigida-105674
Шайкевич Е.В., Ившина Е.В., Захаров И.А. Полиморфизм митохондриальной ДНК и распространение цитоплазматических симбионтов в популяциях двуточечной божьей коровки Adalia bipunctata // Генетика. 2012. Т. 48. № 5. С. 666–671.
Woodcock T.S., Boyle E.E., Roughley R.E. et al. The diversity and biogeography of the Coleoptera of Churchill: insights from DNA barcoding // BMC Biology. 2013. V. 13. P. 40:1–15. https://doi.org/10.1186/1472-6785-13-40
Sikes D.S., Bowser M., Morton J.M. et al. Building a DNA barcode library of Alaska’s non-marine arthropods. Fairbanks: Univ. Alaska Museum, 2017. 38 p. https://doi.org/10.1139/gen-2015-0203
Картавцев Ю.Ф. Генетическая дивергенция видов и других таксонов, географическое видообразование и генетическая парадигма неодарвинизма в действии // Успехи соврем. биологии. 2013. Т. 133. № 5. С. 419–451.
Дополнительные материалы отсутствуют.


