Генетика, 2023, T. 59, № 8, стр. 946-953
История колонизации острова Итуруп красно-серой полевкой Craseomys rufocanus по данным анализа фрагмента гена цитохрома b (cytb)
Н. И. Абрамсон 1, *, Л. С. Турсунова 1, Т. В. Петрова 1, И. Ю. Попов 2, В. В. Платонов 1, А. В. Абрамов 1
1 Зоологический институт Российской академии наук
199034 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: natalia_abr@mail.ru
Поступила в редакцию 27.03.2023
После доработки 10.04.2023
Принята к публикации 11.04.2023
- EDN: XSESJW
- DOI: 10.31857/S0016675823080027
Аннотация
С целью исследования путей колонизации красно-серой полевкой о. Итуруп на основе распределения и численности гаплотипов фрагмента митохондриального гена цитохрома b (662 пн) проведен сравнительный анализ генетической изменчивости популяций полевок из разных локалитетов по периметру острова и полевок островов Хоккайдо, Кунашир и Сахалин, а также прилежащих районов материковой суши. Все изученные экземпляры красно-серой полевки с о. Итуруп (68) представлены единственным гаплотипом, наиболее близким к гаплотипам полевок с о. Сахалин. Только один экземпляр с о. Кунашир, ближайшего к Итурупу, обладал таким же гаплотипом. Еще три экземпляра с этого острова были близки к гаплотипам полевок с о. Сахалин и попадали с ними в одну кладу, большинство же гаплотипов полевок Кунашира близки к гаплотипам полевок Хоккайдо и составляют с ними одну самостоятельную кладу, сильно отличающуюся генетически от особей Сахалина и Итурупа. Полученные данные о генетической изменчивости полевок с о. Итуруп убедительно свидетельствуют в пользу недавнего завоза красно-серой полевки C. rufocanus на этот остров, вероятнее всего с морским транспортом с Сахалина.
История формирования островной фауны Курильской гряды и Японского архипелага изучалась на различных модельных объектах. В предыдущих исследованиях были показаны пути, по которым на Японские и Курильские острова проникли полевки, бурундуки, зайцы и другие мелкие млекопитающие [1, 2]. Последний крупный рост численности и биоразнообразия наземной фауны этих островов связывают с максимумом последнего оледенения (МПЛ) 20–18 тыс. лет назад и наличием сухопутных мостов, соединяющих острова с Евразийским континентом [3–6]. Вместе с потеплением в голоцене уровень моря поднимался, мосты затапливались, что стало преградой для миграции фауны с материка.
Курильскую гряду делят на два крупных биогеографических района [7]. Флора и фауна северных островов (от Парамушира до Симушира) сходны с фауной Камчатского п-ва, фауна и флора южных островов (от Урупа до Хоккайдо и Сахалина) ближе к таковым приморских территорий на континенте. Пролив Буссоль между Урупом и Симуширом является биогеографическим рубежом – в период плейстоценовых оледенений данный пролив из-за сильных течений не покрывался льдом, в то время как проливы меньшего размера покрывались коркой льда, что позволяло фауне мигрировать с материка на острова [7].
Предполагается, что большая часть фауны появилась на Курильских островах порядка 60–68 тысяч лет назад (т.л.н.), в период существования сухопутного моста [8]. Одними из первых (~15 т.л.н.) островов, окончательно отделившихся от островной цепочки, связанной с материком, были Итуруп и Уруп [9]. Это вулканические острова, находящиеся в значительном отдалении от материка и других островов. На о. Итуруп примерно 8–9 т.л.н. произошло крупное извержение вулкана Львиная пасть. В результате извержения слой тефры накрыл большую часть острова, что повлияло на формирование флоры и фауны [10]. Есть данные о намеренном антропогенном завозе млекопитающих на Итуруп [9–11]. Для сохранения и размножения видов на Итуруп в XIX в. российско-американские исследователи завозили: песцов Vulpes logopus L., 1758, в XX в. – европейских норок Mustela lutreola L., 1761 (и случайно завезли серых крыс Rattus norvegicus Berkenhout, 1769), а также собак Canis familiaris L., 1758.
В настоящий момент фауна млекопитающих Итурупа насчитывает восемь видов [12], в том числе: лисица Vulpes vulpes L., 1758, соболь Martes zibellina L., 1758, бурый медведь Ursus arctos L., 1758. Из грызунов на острове распространены: домовая мышь Mus musculus L., 1758, cерая крыса Rattus norvegicus и красно-серая полевка Craseomys rufocanus Sundevall, 1846.
Красно-серая полевка – один из самых широкоарельных евразийских видов грызунов. Ее ареал охватывает всю лесную зону от Финляндии до Приморского края России, северного Китая, Камчатки, Японских и части Курильских островов (в том числе островов Итуруп, Кунашир, Парамушир) [12, 13]. Результаты анализа изменчивости митохондриального гена цитохрома b (cytb) в популяциях красно-серой полевки со всего видового ареала [13] показали, что полевки относятся к четырем генетическим линиям. Характерная генетическая структура могла возникнуть в результате фрагментации ареала в эпохи плейстоценовых оледенений и изоляции популяций в рефугиумах. Подробные исследования истории расселения красно-серой полевки [13–16] с анализом данных митохондриальной ДНК в регионе не включали материал с о. Итуруп, и до настоящего времени пути и время проникновения этого вида на остров остаются неизвестными.
Стоит отметить, что лесные полевки, занимающие аналогичные биотопы: Clethrionomys rutilus Pallas, 1779 и Craseomys rex Imaizumi, 1971, обитают на соседних крупных островах Хоккайдо и Сахалине, но на Итурупе не обнаружены. Цель данной работы – на основе сравнительного анализа последовательностей цитохрома b полевок с о. Итуруп, соседних регионов материка и с островов Японского моря проверить гипотезы о путях колонизации Итурупа красно-серой полевкой и выявить генетическую структуру ее популяции на острове.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 68 образцов тканей красно-серой полевки из коллекции Зоологического института РАН, собранных в пяти локалитетах, расположенных по периметру о. Итуруп, девять образцов с о. Кунашир и четыре образца с Сахалина. Новые данные представлены в табл. 1.
Таблица 1.
Сведения о материале, использованном в работе
| № на карте | Место сбора материала | Номера последовательностей в Генбанке |
|---|---|---|
| 1 | о. Итуруп, 2 км ю-в г. Курильск, Курильский рыбоводный завод, 45.216° N, 147.901° E | OP246032–OP246040 |
| 2 | о. Итуруп, северная часть, устье р. Славная, 45.488° N, 148.610° E | OP246041–OP246049 |
| 3 | о. Итуруп, северная часть, устье р. Славная, 45.389° N, 148.481° E | OP246050–OP246072 |
| 4 | о. Итуруп, южная часть, Одесский залив, 44.809° N, 147.244° E | OP246050–OP246072 |
| 5 | о. Итуруп, залив Касатка, 44.979° N, 147.627° E | OP246089–OP246097 |
| 6 | о. Итуруп, бухта Доброго Старта, 44.041° N, 145.863° E | OP246098 |
| 7 | о. Кунашир, кальдера Головина, 43.859° N, 145.513° E | OP246103 |
| 8 | о. Кунашир, Андреевка, 43.888° N, 145.624° E | OP246105–OP246106, OP246108–OP246110, OP246112 |
| 9 | о. Кунашир, Саратовка, 44.266° N, 146.107° E | OP246104, OP246107, OP246111 |
| 10 | о. Сахалин, Институт морской геологии и геофизики, 47.029° N, 142.717° E | OP246099, OP246100, OP246102 |
| 11 | о. Сахалин, биостанция Сокол, 47.243° N, 142.774° E | OP246101 |
ДНК выделяли из тканей, фиксированных 96%-ным этанолом, с помощью набора GeneJET Genomic DNA (Thermo Fisher Scientific). Фрагмент гена цитохрома b (1010 пн) был амплифицирован с использованием протокола ПЦР и праймеров UCBU-LM [17]. Полученные ПЦР-продукты были визуализированы в агарозном геле и очищены с помощью набора Cleanup S-Cap (Евроген, Россия). Секвенирование проводили с теми же праймерами в обоих направлениях на автоматическом секвенаторе ABI 3130 (Applied Biosystems, США) с наборами BigDye Terminator kit v. 3.1/1.1 (Applied Biosystems, США).
Прямые и обратные последовательности фрагмента cytb были объединены в консенсусную последовательность в программе Bioedit 7.0 [18]. Множественное выравнивание построено алгоритмом MUSCLE в программе Unipro Ugene ver. 37 [19]. Для наиболее полной картины к полученным последовательностям cytb добавлены ортологичные последовательности из базы данных NCBI Nucleotidе с Японских о-вов, Сахалина и материковой части Дальнего Востока, полученные в рамках предыдущих работ [13, 16, 20], № в Генбанке: JF713616-17, JF713623-24, JF713628-30, JF713632-33, JF713637, JF713639, JF713642-44, JF713649, JF713654-55, JF713663-65, JF713678, JF713680, JF713571-72, JF713581-85, JF713593-94, JF713598-99, JF713602-03, JF713537, JF713540, JF713548, JF713552-54, JF713567-71, JF713573, AB031555-61, AB031563, AB031565, AB031570-73, AB031576-77, AB031579, JF713560-61, JF713534, JF713549, JF713547, JF713527-28, JF713673-74, JF713676-77, JF713666, JF713668-70, AB675444-46, FJ792779, FJ792776, FJ792778, FJ792781, FJ792788-92, LC406450, AF429816, KY968261, KY968263-65, KY968282, KY968275, KY968284, KY968286.
Количество гаплотипов, информативных сайтов и единичных мутаций, гаплотипическое и нуклеотидное разнообразие подсчитано в программе DnaSP ver. 5 [21]. Попарные генетические дистанции посчитаны в программе Mega11 [22].
Для поиска всех возможных генетических связей между выявленными гаплотипами в программе PopArt ver. 1.7 [23] была построена медианная сеть гаплотипов методом Median-Joining [24].
РЕЗУЛЬТАТЫ
Окончательное выравнивание содержало 371 последовательность длиной в 662 пн. Среди них 152 вариабельных сайта, 93 информативных и 59 сайтов с единичными заменами. Новые последовательности загружены в базу данных NCBI под номерами OP246032–OP246112 (табл. 1).
Все 68 образцов с о. Итуруп представлены одним гаплотипом, такой же гаплотип обнаружен и у одного образца с острова Кунашир. Этот гаплотип всего на две нуклеотидных замены отличается от большинства гаплотипов полевок с Сахалина. Три из девяти новых исследованных экземпляров с о. Кунашир имеют гаплотипы, идентичные двум самым распространенным гаплотипам среди полевок о. Сахалин, и попадают в так называемую Сахалинскую кладу (рис. 1). Тогда как большинство гаплотипов полевок с о. Кунашир (и вновь исследованные, и изученные ранее [12]) сильно отличаются от полевок с Сахалина, и близки к гаплотипам полевок с Хоккайдо, с которыми составляют единую кладу (рис. 1). Так как образцы с точек по всей протяженности о. Итуруп представлены одним гаплотипом, измерение базовых статистик генетической изменчивости не имеет смысла.
Рис. 1.
Сеть гаплотипов, построенная методом Median Joining на основе участка cytb. Цифрами обозначены образцы Итурупа (1), Сахалина (2), Хоккайдо (3), Кунашира (4), Камчатки и Парамушира (5), и части Дальнего Востока (6), в который включены Китай, Монголия, Россия (Магаданская и Амурская области, Приморский и Хабаровский край, Республика Саха (Якутия), Республика Бурятия, Чукотский А.О.).
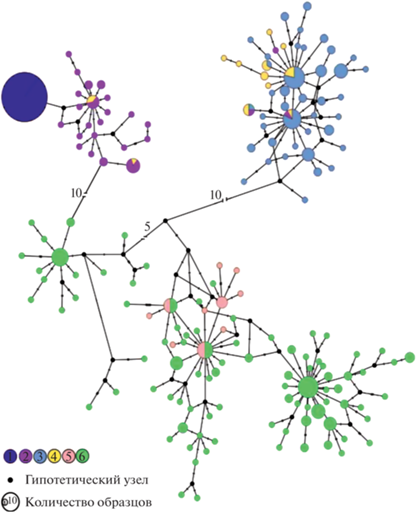
На медианной сети гаплотипов (рис. 1) видна структура из четырех клад: Сахалинской, Хоккайдо, и двух материковых клад. Топология сети, полученной в этой работе, показывает схожую топологию с сетью, построенной в предыдущих исследованиях [13], однако имеется ряд различий, описанных ниже. В работе N.I. Abramson с соавт. [13] все образцы красно-серой полевки с о. Кунашир попадали в единую кладу с полевками с островов Японского архипелага: Хоккайдо, Тобетсу и Рисири. Среди дополнительно исследованных в данной работе образцов с Кунашира, четыре попали в кладу вместе с сахалинскими образцами, а три из четырех новых образцов с Сахалина попали в одну кладу с гаплотипами полевок с Хоккайдо и Кунашира.
Генетическое разнообразие в островных популяциях красно-серой полевки с Сахалина, Кунашира и Хоккайдо оценивали для каждой группы. Во всех группах (табл. 2) наблюдалось низкое нуклеотидное разнообразие – от 0.005 ± 0.003 до 0.014 ± 0.007, и высокое гаплотипическое разнообразие (0.96–0.97 ± 0.2). Анализ попарных генетических дистанций между островными популяциями (табл. 3) выявил наибольшие значения для популяций с Итурупа и Хоккайдо (3.5%) и наименьшие (0.8%) – для популяций с Итурупа и Сахалина.
Таблица 2.
Генетическое разнообразие островных популяций
| Популяции | N | H | Pi(SD) | Hd (SD) | TajimaD | TajimaD’s P-value | Fu’s Fs | Fu’s P-value |
|---|---|---|---|---|---|---|---|---|
| Итуруп | 67 | 1 | 0.000 | 0.000 | – | – | ||
| Кунашир | 19 | 13 | 0.014 (0.007) | 0.959 (0.02) | 0.2870 | 0.655 | –1.536 | 0.253 |
| Сахалин | 28 | 22 | 0.011 (0.007) | 0.968 (0.02) | –1.163 | 0.116 | –10.690 | 0.001 |
| Хоккайдо | 77 | 37 | 0.005 (0.003) | 0.956 (0.01) | 0.000 | 1.000 | –26.366 | 0.000 |
ОБСУЖДЕНИЕ
Остров Итуруп – вулканический остров, сходный по флористическому составу с Хоккайдо и Сахалином. На островах присутствуют фрагменты горной тайги, горные елово-пихтовые леса с подлеском из курильского бамбука и заросли кедрового стланика [25]. Фаунистический состав Итурупа значительно беднее, чем на Хоккайдо и на Сахалине [8, 26]. Явление постепенного обеднения видового разнообразия в зависимости от удаления от материка отмечалось ранее [27]. Чаще всего на отдаленные острова животные попадают с ближайших островов, однако регистрируются случаи интродукций с отдаленных территорий [9, 11].
Возможны несколько вариантов появления красно-серой полевки на Итурупе (рис. 2). Согласно первой гипотезе, красно-серые полевки могли мигрировать по сухопутному мосту с Евразийского континента, где обосновались не позднее 15 т.л.н. (это срок предположительной изоляции Итурупа от соседнего острова). В результате извержения вулкана Львиная Пасть около девяти т.л.н. большая часть популяции могла погибнуть. Так как на территории Евразии красно-серые полевки заселяют места недавних пожарищ, можно предположить, что полевки могли выжить и после извержения вулкана, а в дальнейшем распространиться по всему острову. Вторая гипотеза – красно-серые полевки не мигрировали на Итуруп по сухопутному мосту в позднем плейстоцене; если же мигрировали, то не смогли выжить при масштабном природном катаклизме. А те популяции, которые населяют остров в настоящее время, являются потомками небольшого количества особей, появившихся на острове в результате случайной недавней инвазии.
Рис. 2.
Карта-схема – две вероятные гипотезы о путях колонизации о. Итуруп красно-серой полевкой. Зеленым цветом обозначен ареал Craseomys rufocanus. Стрелками обозначены возможные пути миграции C. rufocanus; пунктирной линией – согласно гипотезе о естественной миграции, сплошной линией – согласно гипотезе непреднамеренной интродукции с морским транспортом. Значок с якорем обозначает место расположения морского порта, синими и розовыми кружками обозначены точки сбора образцов, номера точек соответствуют номерам в табл. 1.
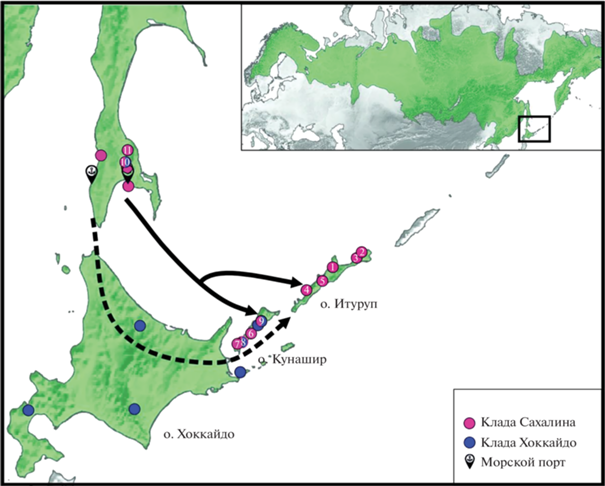
В пользу первой гипотезы о заселении Итурупа по сухопутному мосту могло бы свидетельствовать наблюдаемое постепенное снижение видового разнообразия в направлении материк–Хоккайдо–Кунашир–Итуруп. Геологические и флористические паттерны этих территорий похожи, на дальних островах обитают те же виды, что и на Хоккайдо. На островах Японского архипелага, как и на Сахалине отмечается экспансивный рост популяций C. rufocanus, Apodemus sp. и других мелких млекопитающих, начало которого соотносится с началом потепления около десяти тысяч лет назад [28]. По аналогии можно было бы предположить, что популяции Итурупа так же испытала экспансивный рост в данный период. Большинство видов могли обосноваться на острове до исчезновения сухопутного моста. Впоследствии большое расстояние (>22 км) до ближайших островов и материка ограничило миграцию. На видовое разнообразие в значительной степени влияли природные катаклизмы, в том числе извержение вулкана Львиная пасть, в результате чего фауна и флора острова попали под эффект “бутылочного горлышка” [29]. Извержение вулкана Львиная пасть могло нанести значительный урон популяции, тем не менее нельзя исключать, что небольшая часть ее могла выжить и впоследствии размножиться. Однако такому сценарию противоречат полученные данные о генетическом разнообразии полевок о. Итуруп. Сухопутный мост проходил через Хоккайдо, следовательно, и в случае такого сценария, гаплотипы полевок Итурупа должны были бы быть генетически близки к гаплотипам полевок о-вов Хоккайдо и Кунашир, однако это не так. Кроме того, даже в случае прохождения через бутылочное горлышко 8–9 т.л.н. и последующем экспансивном росте мы наблюдали бы тогда хотя бы несколько гаплотипов, отличающихся одной–двумя случайными заменами и характерную звездообразную структуру на сети. В пользу гипотезы о естественном заселении Итурупа мог бы свидетельствовать тот факт, что красно-серые полевки способны плавать и преодолевать водные преграды [15]. Однако мы не рассматриваем вариант такого естественного недавнего заселения Итурупа, так как расстояние между ближайшим островом, на котором обнаружены красно-серые полевки, 23 километра (расстояние от Итурупа до Кунашира по данным Google maps, 26.04.2022), такую водную преграду полевки преодолеть не могут. Севернее Итурупа находится о. Уруп, на котором красно-серых полевок не обнаружено.
Таким образом, вторая гипотеза наиболее вероятна. Особи с Итурупа генетически близкородственны особям с Сахалина. Три особи с Сахалина, принадлежащие к кладе Хоккайдо, были выловлены в южной части Сахалина (рис. 2). Возможно благодаря морскому сообщению животные были случайно завезены с Кунашира на Сахалин и там выловлены. Все исследуемые красно-серые полевки Итурупа по данным анализа участка гена cytb имеют один гаплотип, отличающийся всего на две замены от гаплотипов сахалинских зверьков, что говорит о недавнем однократном завозе этих животных на Итуруп с Сахалина. Все факты однозначно говорят в пользу второй гипотезы о недавнем случайном завозе красно-серой полевки C. rufocanus на Итуруп морским транспортом. Это вполне логично, если учесть, что со второй половины ХХ в. морское судоходство между о-вами Сахалин, Кунашир и Итуруп интенсивно развивалось.
Авторы признательны С.Ю. Бодрову и О.В. Бондаревой за конструктивные замечания при проведении работы. И.Ю. Попов благодарит Русское географическое общество за организацию экспедиции “Восточный бастион. Курильская гряда”, в ходе которой была собрана часть материала.
Исследование выполнено в рамках проекта Министерства науки и высшего образования РФ (№ 075-15-2021-1069) и государственного задания № 122031100282-2.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Parent C.E., Caccone A., Petren K. Colonization and diversification of Galápagos terrestrial fauna: A phylogenetic and biogeographical synthesis // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2008. V. 363. № 1508. P. 3347–3361. https://doi.org/10.1098/rstb.2008.0118
Sartono S. On pleistocene migration routes of vertebrate fauna in Southeast Asia // Geol. Soc. of Malaysia. Bulletin. 1973. № 6. P. 273–286.
Sato J. A review of the processes of mammalian faunal assembly in Japan: Insights from molecular phylogenetics // Species Diversity of Animals in Japan. Diversity and Commonality in Animals. Tokyo: Springer, 2016. https://doi.org/10.1007/978-4-431-56432-4_3
Dobson M. Patterns of distribution in Japanese land mammals // Mammal Review. 1994. V. 24. № 3. P. 91–111. https://doi.org/10.1111/j.1365-2907.1994.tb00137.x
Wakana S., Sakaizumi M.,Tsuchiya K. et al. Phylogenetic implications of variations in rDNA and mtDNA in red-backed voles collected in Hokkaido, Japan, and in Korea // Mammal Study. 1996. V. 21. № 1. P. 15–26. https://doi.org/10.3106/mammalstudy.21.15
Kohli B., Fedorov V., Waltari E., Cook J. Phylogeography of a Holarctic rodent (Myodes rutilus): Testing high-latitude biogeographical hypotheses and the dynamics of range shifts // J. Biogeography. 2014. V. 42. P. 377–389. https://doi.org/10.1111/jbi.12433
Богатов В.В. Биогеографические проблемы Курильского архипелага // Растительный и животный мир Курильских островов. Владивосток: Дальнаука, 2002. С. 150–160.
Hoekstra H., Fagan W. Body size, dispersal ability and compositional disharmony: The carnivore-dominated fauna of the Kuril Islands // Diversity and Distributions. 1998. V. 4. P. 135–149. https://doi.org/10.1046/j.1365-2699.1998.00016.x
Belousova M., Belousov A., Miller T. Kurile Islands // Encyclopedia of Islands. Berkeley, Los Angeles, London: University of California Press, 2009. P. 520–524.
Razjigaeva N.G., Ganzey L.A., Grebennikova T.A. et al. Holocene climatic changes and vegetation development in the Kuril Islands // Quaternary International. 2013. V. 290–291. P. 126–138. https://doi.org/10.1016/j.quaint.2012.06.034
Khlyap L.A., Bobrov V.V., Warshavsky A.A. Biological invasions on Russian territory: Mammals // Russ. J. Biol. Invasions. 2010. V. 1–2. P. 127–140. https://doi.org/10.1134/S2075111710020128
Frisman L.V., Kartavtseva I.V., Pavlenko M.V. et al. Gene-geographic variation and genetic differentiation in red-backed voles of the genus Clethrionomys (Rodentia, Cricetidae) from the Region of the Sea of Okhotsk // Russ. J. Genetics. 2002. V. 38. P. 538–547. https://doi.org/10.1023/A:1015595315205
Abramson N., Petrova T., Dokuchaev N. et al. Phylogeography of the gray red-backed vole Craseomys rufocanus (Rodentia: Cricetidae) across the distribution range inferred from nonrecombining molecular markers // Russ. J. Theriology. 2012. V. 11. P. 137–156. https://doi.org/10.15298/rusjtheriol.11.2.04
Ishibashi Y., Saitoh T., Abe S., Yoshida M.C. Sex – related spatial kin structure in a spring population of grey – sided voles Clethrionomys rufocanus as revealed by mitochondrial and microsatellite DNA analyses // Mol. Ecology. 1997. V. 6. № 1. P. 63–71. https://doi.org/10.1046/j.1365-294x.1997.00152.x
Ims R.A. Kinship and origin effects on dispersal and space sharing in Clethrionomys rufocanus // Ecology. 1989. V. 70. № 3. P. 607–616. https://doi.org/10.2307/1940212
Iwasa M.A., Utsumi Y., Nakata K. et al. Geographic patterns of cytochrome b and sry gene lineages in the gray red-backed vole Clethrionomys rufocanus from Far East Asia including Sakhalin and Hokkaido // Zool. Sci. 2000. V. 17. № 4. P. 477–484. https://doi.org/10.2108/0289-0003(2000)17[477:GPO-CBA]2.0.CO;2
Abramson N., Melnikova E., Kostygov A. Genetic variation and phylogeography of the bank vole (Clethrionomys glareolus, Arvicolinae, Rodentia) in Russia with special reference to the introgression of the mtDNA of a closely related species, red-backed vole (Cl. rutilus) // Russ. J. Genetics. 2009. V. 45. P. 533–545. https://doi.org/10.1134/S1022795409050044
Hall T. BioEdit: An important software for molecular biology // GERF Bull. of Biosciences. 2011. V. 2. № 1. P. 60–61.
Okonechnikov K., Golosova O., Fursov M. The UGENE team Unipro UGENE: A unified bioinformatics toolkit // Bioinformatics. 2012. V. 28. № 8. P. 1166–1167. https://doi.org/10.1093/bioinformatics/bts091
Cook J.A., Runck A.M., Conroy C.J. Historical biogeography at the crossroads of the northern continents: Molecular phylogenetics of red-backed voles (Rodentia: Arvicolinae) // Mol. Phylogenet. and Evol. 2004. V. 30. № 3. P. 767–777. https://doi.org/10.1016/S1055-7903(03)00248-3
Rozas J., Ferrer-Mata A., Sánchez-DelBarrio J.C. et al. DnaSP 6: DNA sequence polymorphism analysis of large data sets // Mol. Biol. Evol. 2017. V. 34. № 12. P. 3299–3302. https://doi.org/10.1093/molbev/msx248
Tamura K., Stecher G., Kumar S. MEGA11: Molecular evolutionary genetics analysis Version 11 // Mol. Biol. Evol. 2021. V. 38. I. 7. P. 3022–3027. https://doi.org/10.1093/molbev/msab120
Bryant L.J. Popart: Full-feature software for haplotype network construction // Meth. Ecol. Evol. 2015. V. 6. № 6. P. 1110–1116. https://doi.org/10.1111/2041-210x.12410
Bandelt H.J., Forster P., Rohl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
Мартыненко А.Б., Бочарников В.Н. Экологическое районирование Дальнего Востока // Известия РАН. Серия географическая. 2008. № 2. С. 76–84.
Abe H. Winter food of the red fox, Vulpes vulpes schrencki Kishida (Carnivora: Canidae), in Hokkaido, with special reference to vole populations // Applied Entomol. and Zool. 1975. V. 10. № 2. P. 40–51. https://doi.org/10.1303/aez.10.40
Brown J.H. Mammals on mountaintops: Nonequilibrium insular biogeography // Am. Naturalist. 1971. V. 105. № 945. P. 467–478. https://doi.org/10.1086/282738
Honda A., Murakami S., Harada M. et al. Late Pleistocene climate change and population dynamics of Japanese Myodes voles inferred from mitochondrial cytochrome b sequences // J. Mammalogy. 2019. V. 100. № 4. P. 1156–1168. https://doi.org/10.1093/jmammal/gyz093
Nei M., Maruyama T., Chakraborty R. The bottleneck effect and genetic variability in populations // Evolution. 1975. V. 29. № 1. P. 1–10. https://doi.org/10.2307/2407137
Дополнительные материалы отсутствуют.


