Геохимия, 2020, T. 65, № 10, стр. 969-983
Адаптация метаболизма рыб к тепловому загрязнению АЭС субарктического оз. Имандра
Н. А. Гашкина a, *, Т. И. Моисеенко a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: ngashkina@gmail.com
Поступила в редакцию 01.03.2020
После доработки 08.04.2020
Принята к публикации 08.04.2020
Аннотация
Кольская АЭС, сбрасывающая теплые воды в один из заливов субарктического оз. Имандра, существенно изменяет среду обитания рыб, где температурный градиент создается от 2 до 8°С по сравнению с температурой воды в остальной части озера. Дается характеристика проникающей способности, метаболизма и биоаккумуляции элементов стенотермным холодолюбивым видом (Coregonus lavaretus L.) в зоне теплового воздействия. Одним из главных адаптационных механизмов ионной регуляции является интенсивный метаболизм Na вследствие высокой дыхательной активности сигов в более теплых водах. С этой особенностью связано в той или иной степени повышенная аккумуляция Rb и выведение Se, Mo, и Si. В условиях повышенных температур главная метаболическая потребность обусловлена дефицитом Se. С интенсивным метаболизмом селенопротеинов связаны риски в отношении токсичных эффектов и биоаккумуляции Hg, As и Cu при усилении действующего стрессора или появлении новых.
ВВЕДЕНИЕ
Электростанции, сбрасывающие подогретые воды в водоемы суши или в моря, существенно воздействуют на прибрежную экосистему водоема-охладителя. Закономерности изменчивости структурно-функциональной организации экосистем в зонах отепления, способности выживать живых организмов при более высоких температурных условиях предоставляют нам уникальную антропогенно-созданную модель для изучения и прогноза влияния возможного потепления климата на водные экосистемы. Модели глобального изменения климата предсказывают увеличение средней температуры воздуха на 5–8°C к 2100 г. в северной и центральной Европе, а также в арктических регионах (IPCC, 2013). Арктические виды наиболее уязвимы к изменению климата, потепление и его влияние на диких животных и рыб более значительны в Арктике (AMAP, 2018). Таким образом, дальнейшее потепление климата может влиять на виды в естественных условиях, так и усугубить воздействие существующего теплового загрязнения.
В 1974 г. на берегах субарктического озера Имандра начала функционировать Кольская АЭС (КАЭС) на прямоточной системе охлаждения, обеспечивающая около 50% электроэнергии Мурманскую область. Сбросные отработанные воды, пройдя систему охлаждения, объёмом 1218 млн м3 в год поступают в залив оз. Имандра – Молочную губу (Отчет по экологической безопасности, 2018). В озере сформировалась зона теплового загрязнения, площадью до 25 км2, с температурным градиентом от 8°С вблизи устья водосбросного канала и постепенным понижением по мере распространения теплового потока. За более чем 40-летний период функционирования АЭС в зоне теплового влияния сформировалась экосистема с новыми характеристиками, отличными от природных холодноводных экосистем озера. Отмечено повышение биопродуктивности на обогреваемой территории, вследствие которой для рыб, в особенности бентофагов, сформирована высокая кормовая база (Моисеенко и др., 2002). Этот фактор обеспечил постоянное существование сиговых рыб и их возможную адаптацию к изменённым условиям существования. Следует отметить, что в целом озеро Имандра подвержено небольшому загрязнению металлами и сульфатами как со стороны дымовых выбросов медно-никелевого комбината “Североникель”, так и трансграничного переноса токсичных элементов в Арктику (Moiseenko, Sharov, 2019; AMAP, 2002). И хотя концентрации металлов и металлоидов в водах этой части озера не превышают нормативов качества вод, фактор обогащения вод многими элементами, в частности Ni, Cu, Cd, Se, V, Mo и др. повышен по сравнению с фоновыми значениями (Moiseenko et al., 2019).
В рамках классических экотоксикологических моделей уязвимость популяции определяется как произведение трех компонентов: внешнего воздействия, внутренней чувствительности и устойчивости популяции (Moe et al., 2013). Первый зависит от выбора пищи вида и активного избегания; второй зависит от многих характеристик, включая эффективность ассимиляции, способность элиминации токсиканта, секвестрацию токсиканта и потенциал биотрансформации; третий зависит от нескольких характеристик, связанных с реколонизацией, восстановлением и способностью рассеиваться. Вторичным воздействием потепления климата (Gouin et al., 2013, Moe et al., 2013) или теплового загрязнения (Ingleton, McMinn, 2012) являются изменения в круговороте питательных веществ и первичной продукции, кормовых отношений в пищевых цепях.
Привлекаемые богатыми пищевыми ресурсами, особи наиболее распространенного холодолюбивого вида в оз. Имандра – озерный сиг (Coregonus lavaretus L.) – преодолевали внутреннюю чувствительность к тепловому стрессу и демонстрировали местную адаптацию. В период 1978–1996 гг. в зоне влияния подогретых вод Кольской АЭС встречались случаи гермафродитизма. Ярким описанным примером был сиг (длина 35 см, масса 550 г, возраст 7+), у которого обе гонады имели аномалию: семенник занимал одну треть в головной части, яичник следовал далее, который переходил опять в семенник в хвостовой части (Моисеенко, Лукин, 1999). Нормальная функция гипоталамико-гипофизарно-гонадной системы модулируется различными внешними стимулами, такими как доступность пищи, фотопериод, поведенческие взаимодействия и, особенно, у пойкилотермных животных, к которым относятся рыбы, температура (Hooper et al., 2013). Также в период 1978–1996 гг. несколько возрастало число рыб с симптомами общей интоксикации, патологиями почки и аномалиями гонад (Моисеенко, Лукин, 1999). Однако наиболее чувствительная и уязвимая система кроветворения рыб показывала адаптационные эффекты: если в конце 1970-х гг. наблюдался огромный разброс концентрации гемоглобина в крови от 44 до 163 г/л, лейкоцитоз, патологические изменения в эритроцитах (как гемолиз, так и вакуолизация), то к 1990-м гг. концентрация гемоглобина в крови варьировала в экологическом оптимуме (80–130 г/л), а морфологическая картина крови не отличалась от нормы (Моисеенко, 1998). Адаптацию организмов к повышенным температурам демонстрировали пресноводные мидии (Anodonta anatina) из пруда охладителя электростанции, которые характеризовались большей термотолерантностью гемолимфы (самые низкие уровни ядерных аномалий, высокий индекс стабильности лизосомальных мембран) по сравнению с мидиями из участка с нормальным температурным режимом в экспериментах с умеренным (25°C) и экстремальным (30°C) потеплением (Falfushynska et al., 2014).
Сиги, обитающие в зоне теплового загрязнения субарктического озера Имандра, представляют собой хорошие объекты для изучения эффектов долговременного воздействия повышенных температур (влияние более 40 лет) и механизмов адаптации животных к изменяющимся условиям.
Целью исследования было изучить метаболизм и биоаккумуляцию элементов в органах и тканях сигов в условиях теплового загрязнения, а также выявить как положительные эффекты, так и потенциально уязвимые места метаболизма, основываясь на физиологическом состоянии рыб и особенностях метаболизма и биоаккумуляции элементов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Озерный сиг (Coregonus lavaretus L.) – широко распространенный вид в этом регионе. Являясь бентофагом, он ведет относительно оседлый образ жизни, не мигрирует на дальние расстояния и может служить хорошим локальным биоиндикатором водной среды (Моисеенко, Лукин, 1999; Moiseenko et al., 2018).
В основу работы легли данные, полученные в 2018 г., при обследовании сигов в двух исследуемых зонах оз. Имандра (рис. 1): И-7 – зона влияния сбросов теплых вод КАЭС и И-8 – зона, не испытывающая теплового влияния, но наиболее сходная по гидрохимическим параметрам вод. Исследовалось 12 особей (по 6 особей из каждой зоны), у которых определялось содержание элементом в органах и тканях, а также оценивалось физиологическое состояние.
Пробы воды были взяты из озера Имандра в местах отлова рыб (рис. 1). Образцы отбирались в полиэтиленовые бутыли фирмы Nalgene®, которые сразу же помещались в темные контейнеры, охлаждались до приблизительно 4°C и транспортировались в лабораторию. Воду фильтровали с использованием системы Millipore. Аналитическая программа работ включала определение рН, электропроводности, основных ионов минерализации, перманганатной окисляемости, биогенных элементов, а также микроэлементов. Содержание органического вещества определяли по перманганатной окисляемости.
Отлов рыб для анализа сопровождался с одновременным отбором проб воды в местах отлова. Чтобы минимизировать сезонные и возрастные вариации обследование рыб проводилось в преднерестовый период (август–сентябрь) и выборка рыб была одинакового возрастного состава (4+…6+). Биологические образцы высушивали до постоянного веса при 105°С. Содержание элементов анализировалось в жабрах, печени, почке, мышцах и скелете. Подготовку проб осуществляли методом мокрого разложения в концентрированной азотной кислоте с добавлением перекиси водорода. Определение концентраций элементов в пробах воды и биологических образцах проводилось методом масс-спектрометрии с индуктивно-связанной плазмой (Х-7, Thermo Scientific, США). Контроль качества определения элементов в биологических пробах велся с помощью сертифицированных образцов DORM-3 и DORM-4 (Fish protein certified reference material for trace metals, National Research Council Canada, Canada).
Обработку материала проводили по общебиологическим методикам (Правдин, 1966). Гематологические параметры определяли сразу после отлова только на живой рыбе по методике Крылова (1980).
Для оценки физиологического состояния рассчитывался фактор состояния по Фультону (Froese, 2006):
где W – масса тела, г, L – длина тела, см.Также анализировали морфофизиологические показатели (Правдин, 1966):
Статистическая обработка была выполнена с использованием программы Statistica. Независимые выборки сравнивались с использованием t-тестов для оценки различий в средних значениях.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
Физиологический состояние рыб оценивалось по весу, длине, фактору состояния, концентрации гемоглобина в крови, гепатосоматическому и гонадосоматическому индексам. Если первые четыре параметра достоверно различались у рыб между зонами, то у последние двух достоверности различий не было (табл. 1). Следует отметить, что концентрация гемоглобина в крови у сигов из зоны И-7 была в диапазоне экологического оптимума (80–130 г/л), тогда как у более половины обследованных особей зоны И-8 концентрация гемоглобина была ниже нормы. Хотя гонадосоматический индекс достоверно не различался у сигов из этих зон, но следует заметить, что рыбы в зоне И-7 были на более ранней стадии созревания, что вполне закономерно в условиях более теплых вод. Также важно отметить, что максимальный гонадосоматический индекс (2.86) был у сига с минимальным фактором состояния (1.56) из всех сигов в зоне влияния теплых вод, тогда как максимальный гонадосоматический индекс (5.67) был у сига с максимальным фактором состояния (1.72) из всех сигов в зоне И-8 (табл. 1). Таким образом, индивидуальное физиологическое состояние, патологические отклонения и стадия созревания вносили дисперсию в диапазон значений биоаккумуляции элементов в органах и тканях сигов, но не влияли на достоверность различий средних значений между зонами.
Таблица 1.
Показатели физиологического состояния (среднее значение и пределы варьирования) сигов из зоны И-7 (влияние подогретых вод КАЭС) и И-8 оз. Имандра. Жирным выделены значения средних, разница между которыми достоверна при уровни значимости р < 0.05
| Показатели физиологического состояния рыб | Зона | |
|---|---|---|
| И-7 | И-8 | |
| Вес рыбы, г | 642 (530–760) | 404 (298–458) |
| Промысловая длина, см | 33.5 (31.3–36.5) | 29.7 (27.5–31.2) |
| Фактор состояния | 1.71 (1.56–1.76) | 1.53 (1.40–1.72) |
| Концентрация гемоглобина, г/л | 99 (81–131) | 68 (48–88) |
| Гепатосоматический индекс | 0.85 (0.76–0.98) | 0.97 (0.73–2.86) |
| Гонадосоматический индекс | 0.63 (0.06–2.86) | 1.73 (0.12–5.67) |
Предварительное сравнение гидрохимических условий сред обитания сигов в зоне влияния теплового загрязнения вод КАЭС (И-7) и в естественной среде (И-8) не показало существенных различий. Электропроводность воды составляла 61.0 и 53.6 мкСм/см, концентрация Ca2+ была 3.74 и 3.59 мг/л, Mg2+ – 1.12 и 1.09 мг/л, Na+ – 7.27 и 6.25 мг/л, K+ – 1.47 и 1.30 мг/л, ${\text{HCO}}_{{\text{3}}}^{ - }$ – 311 и 295 мкг-экв/л, ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ – 10.6 и 8.80 мг/л, Cl− – 2.62 и 2.23 мг/л, TP – 6.5 и 5.5 мкгР/л, TN – 176 и 168 мкгN/л, органических веществ – 3.57 и 4.28 мг/л в зонах И-7 и И-8 соответственно. Гидрохимические параметры достаточно близки, величина рН одинакова – 7.14. Снижение содержания органического вещества в воде зоны И-7, может объясняться, вероятно, более интенсивными деструкционными процессами в теплой воде. Содержания эссенциальных и неэссенциальных элементов в воде этих двух зон также достаточно близки (табл. 2, 3). Однако концентрация Pb в воде существенно выше в зоне И-7, возможно из-за близости автомобильной дороги. Более высокое содержание Br и более низкие концентрации Fe, Al и Zn наблюдаются в воде зоны И-7 по сравнению с И-8. Следует отметить, что концентрации токсичных элементов не превышали их установленные токсикологические пороги для водоемов рыбохозяйственного назначения (Нормативы…, 2011).
Таблица 2.
Средние значения и стандартные ошибки концентраций эссенциальных и условно-эссенциальных элементов в воде, органах и тканях сигов, выловленных из зоны И-7 (числитель) и зоны И-8 (знаменатель). Жирным выделены значения средних, разница между которыми достоверна при уровни значимости р < 0.05
| Элемент | Вода | Жабры | Печень | Почка | Мышцы | Скелет |
|---|---|---|---|---|---|---|
| мкг/л | мкг/г сухого веса | |||||
| Ca | $\frac{{3740}}{{3590}}$ | $\frac{{30{\kern 1pt} 991 \pm 2232}}{{31{\kern 1pt} 909 \pm 1840}}$ | $\frac{{654 \pm 180}}{{627 \pm 161}}$ | $\frac{{880 \pm 147}}{{1318 \pm 283}}$ | $\frac{{2369 \pm 891}}{{1006 \pm 310}}$ | $\frac{{{\mathbf{155}}{\kern 1pt} {\mathbf{291}} \pm 1500}}{{{\mathbf{148}}{\kern 1pt} {\mathbf{031}} \pm 3047}}$ |
| Mg | $\frac{{1120}}{{1090}}$ | $\frac{{1083 \pm 73}}{{1163 \pm 34}}$ | $\frac{{{\mathbf{713}} \pm 73}}{{{\mathbf{878}} \pm 37}}$ | $\frac{{{\mathbf{883}} \pm 91}}{{{\mathbf{1307}} \pm 131}}$ | $\frac{{1367 \pm 76}}{{1233 \pm 65}}$ | $\frac{{2033 \pm 30}}{{2120 \pm 37}}$ |
| Na | $\frac{{7270}}{{6250}}$ | $\frac{{6418 \pm 449}}{{5745 \pm 347}}$ | $\frac{{{\mathbf{3558}} \pm 387}}{{{\mathbf{5316}} \pm 431}}$ | $\frac{{{\mathbf{6536}} \pm 556}}{{{\mathbf{8979}} \pm 469}}$ | $\frac{{815 \pm 96}}{{834 \pm 59}}$ | $\frac{{{\mathbf{7055}} \pm 163}}{{{\mathbf{6577}} \pm 106}}$ |
| K | $\frac{{1470}}{{1300}}$ | $\frac{{9941 \pm 458}}{{10{\kern 1pt} 080 \pm 534}}$ | $\frac{{10{\kern 1pt} 276 \pm 562}}{{12{\kern 1pt} 105 \pm 835}}$ | $\frac{{10{\kern 1pt} 583 \pm 1235}}{{12{\kern 1pt} 088 \pm 826}}$ | $\frac{{18{\kern 1pt} 264 \pm 1111}}{{17{\kern 1pt} 646 \pm 1216}}$ | $\frac{{{\mathbf{3086}} \pm 220}}{{{\mathbf{3850}} \pm 188}}$ |
| S | $\frac{{5300}}{{4245}}$ | $\frac{{10{\kern 1pt} 857 \pm 340}}{{10{\kern 1pt} 712 \pm 225}}$ | $\frac{{10{\kern 1pt} 684 \pm 621}}{{11{\kern 1pt} 946 \pm 390}}$ | $\frac{{10{\kern 1pt} 924 \pm 912}}{{11{\kern 1pt} 096 \pm 514}}$ | $\frac{{{\mathbf{10}}{\kern 1pt} {\mathbf{479}} \pm 85}}{{{\mathbf{9679}} \pm 339}}$ | $\frac{{4613 \pm 140}}{{4632 \pm 220}}$ |
| P | $\frac{{0.8}}{{0.8}}$ | $\frac{{26{\kern 1pt} 150 \pm 1601}}{{26{\kern 1pt} 587 \pm 660}}$ | $\frac{{{\mathbf{14}}{\kern 1pt} {\mathbf{099}} \pm 985}}{{{\mathbf{17}}{\kern 1pt} {\mathbf{878}} \pm 679}}$ | $\frac{{14{\kern 1pt} 031 \pm 1248}}{{16{\kern 1pt} 413 \pm 514}}$ | $\frac{{12{\kern 1pt} 724 \pm 964}}{{11{\kern 1pt} 675 \pm 865}}$ | $\frac{{{\mathbf{83}}{\kern 1pt} {\mathbf{475}} \pm 960}}{{{\mathbf{78}}{\kern 1pt} {\mathbf{618}} \pm 1495}}$ |
| Fe | $\frac{{6.1}}{{13.9}}$ | $\frac{{{\mathbf{168}} \pm 14}}{{{\mathbf{385}} \pm 57}}$ | $\frac{{155 \pm 19}}{{172 \pm 23}}$ | $\frac{{0.7 \pm 0.2}}{{0.6 \pm 0.2}}$ | $\frac{{13.9 \pm 2.6}}{{13.0 \pm 2.8}}$ | $\frac{{13.3 \pm 4.3}}{{12.6 \pm 3.3}}$ |
| Zn | $\frac{{0.44}}{{2.65}}$ | $\frac{{504 \pm 122}}{{713 \pm 113}}$ | $\frac{{290 \pm 82}}{{334 \pm 78}}$ | $\frac{{231 \pm 29}}{{274 \pm 43}}$ | $\frac{{19.3 \pm 1.3}}{{17.6 \pm 1.3}}$ | $\frac{{120 \pm 12}}{{141 \pm 16}}$ |
| Cu | $\frac{{2.3}}{{2.8}}$ | $\frac{{3.0 \pm 0.4}}{{2.2 \pm 0.1}}$ | $\frac{{{\mathbf{68}}{\mathbf{.1}} \pm 11.3}}{{{\mathbf{32}}.{\mathbf{9}} \pm 7.4}}$ | $\frac{{27.6 \pm 16.5}}{{10.2 \pm 0.9}}$ | $\frac{{1.2 \pm 0.2}}{{1.3 \pm 0.1}}$ | $\frac{{0.7 \pm 0.2}}{{0.6 \pm 0.2}}$ |
| Mn | $\frac{{1.3}}{{1.4}}$ | $\frac{{19.6 \pm 4.4}}{{25.0 \pm 5.3}}$ | $\frac{{{\mathbf{7}}{\mathbf{.21}} \pm 0.53}}{{{\mathbf{8}}.{\mathbf{62}} \pm 0.38}}$ | $\frac{{3.98 \pm 0.82}}{{4.27 \pm 0.40}}$ | $\frac{{2.23 \pm 1.32}}{{0.84 \pm 0.07}}$ | $\frac{{49.7 \pm 13.8}}{{36.9 \pm 3.8}}$ |
| Co | $\frac{{ < 0.1}}{{ < 0.1}}$ | $\frac{{ < 0.04\left( {0.10} \right)}}{{{\mathbf{0}}.{\mathbf{13}} \pm 0.03}}$ | $\frac{{0.10 \pm 0.02}}{{0.12 \pm 0.02}}$ | $\frac{{1.09 \pm 0.22}}{{0.74 \pm 0.16}}$ | $\frac{{ < 0.04}}{{ < 0.04}}$ | $\frac{{ < 0.04}}{{ < 0.04}}$ |
| Se | $\frac{{ < 0.3}}{{ < 0.3}}$ | $\frac{{{\mathbf{4}}{\mathbf{.8}} \pm 0.4}}{{{\mathbf{6}}.{\mathbf{0}} \pm 0.4}}$ | $\frac{{{\mathbf{8}}{\mathbf{.7}} \pm 0.3}}{{{\mathbf{14}}.{\mathbf{2}} \pm 1.8}}$ | $\frac{{{\mathbf{9}}{\mathbf{.4}} \pm 0.7}}{{{\mathbf{11}}.{\mathbf{6}} \pm 0.7}}$ | $\frac{{4.9 \pm 0.7}}{{6.1 \pm 0.5}}$ | $\frac{{{\mathbf{1}}{\mathbf{.6}} \pm 0.3}}{{{\mathbf{2}}.{\mathbf{5}} \pm 0.2}}$ |
| Mo | $\frac{{1.03}}{{0.74}}$ | $\frac{{{\mathbf{0}}{\mathbf{.11}} \pm 0.02}}{{{\mathbf{0}}.{\mathbf{21}} \pm 0.03}}$ | $\frac{{0.67 \pm 0.07}}{{0.73 \pm 0.07}}$ | $\frac{{{\mathbf{0}}{\mathbf{.59}} \pm 0.08}}{{{\mathbf{0}}.{\mathbf{94}} \pm 0.13}}$ | $\frac{{0.02 \pm 0.02}}{{0.02 \pm 0.01}}$ | $\frac{{{\mathbf{0}}{\mathbf{.18}} \pm 0.03}}{{{\mathbf{0}}.{\mathbf{34}} \pm 0.07}}$ |
| B | $\frac{{ < 8}}{{ < 8}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.3}}\left( {3.7} \right)}}{{{\mathbf{2}}.{\mathbf{2}} \pm 0.4}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.3}}}}{{{\mathbf{1}}.{\mathbf{0}} \pm 0.4}}$ | $\frac{{1.0 \pm 0.4}}{{1.6 \pm 0.5}}$ | $\frac{{ < 0.3\left( {0.5} \right)}}{{ < 0.3}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.3}}}}{{{\mathbf{2}}.{\mathbf{4}} \pm 0.7}}$ |
| Br | $\frac{{12.3}}{{8.8}}$ | $\frac{{65.5 \pm 18.7}}{{72.9 \pm 13.3}}$ | $\frac{{46.0 \pm 7.1}}{{54.2 \pm 7.5}}$ | $\frac{{{\mathbf{50}}{\mathbf{.8}} \pm 5.7}}{{{\mathbf{110}} \pm 22.6}}$ | $\frac{{38.0 \pm 8.6}}{{37.6 \pm 5.9}}$ | $\frac{{{\mathbf{32}}{\mathbf{.8}} \pm 16.1}}{{{\mathbf{80}}.{\mathbf{2}} \pm 15.1}}$ |
| Cr | $\frac{{ < 0.5}}{{ < 0.5}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.3}}\left( {3.7} \right)}}{{{\mathbf{0}}.{\mathbf{9}} \pm 0.1}}$ | $\frac{{ < 0.3}}{{ < 0.3}}$ | $\frac{{ < 0.3}}{{ < 0.3}}$ | $\frac{{ < 0.3}}{{ < 0.3}}$ | $\frac{{ < 0.3\left( {0.6} \right)}}{{ < 0.3\left( {0.7} \right)}}$ |
| Ni | $\frac{{1.5}}{{1.3}}$ | $\frac{{1.1 \pm 0.1}}{{1.5 \pm 0.4}}$ | $\frac{{0.6 \pm 0.2}}{{1.1 \pm 0.3}}$ | $\frac{{5.4 \pm 1.3}}{{7.6 \pm 1.5}}$ | $\frac{{0.4 \pm 0.2}}{{0.1 \pm 0.1}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.1}}}}{{{\mathbf{0}}.{\mathbf{2}} \pm 0.1}}$ |
| Si | $\frac{{1.27}}{{1.38}}$ | $\frac{{{\mathbf{54}}{\mathbf{.8}} \pm 20.5}}{{{\mathbf{272}} \pm 38.4}}$ | $\frac{{{\mathbf{18}}{\mathbf{.5}} \pm 1.1}}{{{\mathbf{13}}.{\mathbf{1}} \pm 0.8}}$ | $\frac{{{\mathbf{40}}{\mathbf{.7}} \pm 7.6}}{{{\mathbf{68}}.{\mathbf{9}} \pm 7.2}}$ | $\frac{{18.4 \pm 1.2}}{{15.0 \pm 3.2}}$ | $\frac{{12.5 \pm 1.2}}{{13.1 \pm 4.6}}$ |
| Li | $\frac{{0.54}}{{0.58}}$ | $\frac{{{\mathbf{0}}{\mathbf{.017}} \pm 0.005}}{{{\mathbf{0}}.{\mathbf{095}} \pm 0.016}}$ | $\frac{{0.002 \pm 0.002}}{{0.003 \pm 0.001}}$ | $\frac{{0.006 \pm 0.003}}{{0.016 \pm 0.003}}$ | $\frac{{ < 0.003\left( {0.008} \right)}}{{ < 0.003}}$ | $\frac{{0.026 \pm 0.003}}{{0.030 \pm 0.005}}$ |
Таблица 3.
Средние значения и стандартные ошибки концентраций токсичных элементов в воде, органах и тканях сигов из зоны И-7 (числитель) и зоны И-8 (знаменатель). Жирным выделены значения средних, разница между которыми достоверна (р < 0.05)
| Элемент | Вода | Жабры | Печень | Почка | Мышцы | Скелет |
|---|---|---|---|---|---|---|
| мкг/л | мкг/г сухого веса | |||||
| Hg | $\frac{{ < 0.01}}{{ < 0.01}}$ | $\frac{{0.064 \pm 0.006}}{{0.069 \pm 0.009}}$ | $\frac{{{\mathbf{0}}{\mathbf{.162}} \pm 0.021}}{{{\mathbf{0}}.{\mathbf{120}} \pm 0.007}}$ | $\frac{{0.200 \pm 0.022}}{{0.193 \pm 0.025}}$ | $\frac{{0.098 \pm 0.021}}{{0.099 \pm 0.025}}$ | $\frac{{{\mathbf{0}}{\mathbf{.018}} \pm 0.006}}{{{\mathbf{0}}.{\mathbf{033}} \pm 0.003}}$ |
| Tl | $\frac{{0.001}}{{0.002}}$ | $\frac{{0.042 \pm 0.003}}{{0.045 \pm 0.006}}$ | $\frac{{0.473 \pm 0.054}}{{0.564 \pm 0.119}}$ | $\frac{{0.231 \pm 0.111}}{{0.100 \pm 0.025}}$ | $\frac{{0.031 \pm 0.004}}{{0.032 \pm 0.006}}$ | $\frac{{0.020 \pm 0.002}}{{0.025 \pm 0.004}}$ |
| Be | $\frac{{ < 0.006}}{{ < 0.006}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.002}}}}{{{\mathbf{0}}.{\mathbf{004}} \pm 0.001}}$ | $\frac{{ < 0.002}}{{ < 0.002}}$ | $\frac{{0.023 \pm 0.023}}{{ < 0.002}}$ | $\frac{{ < 0.002}}{{ < 0.002}}$ | $\frac{{ < 0.002}}{{ < 0.002}}$ |
| Cd | $\frac{{ < 0.004}}{{ < 0.004}}$ | $\frac{{0.076 \pm 0.014}}{{0.057 \pm 0.007}}$ | $\frac{{0.172 \pm 0.034}}{{0.250 \pm 0.041}}$ | $\frac{{{\mathbf{2}}{\mathbf{.01}} \pm 0.49}}{{{\mathbf{3}}.{\mathbf{46}} \pm 0.35}}$ | $\frac{{ < 0.004}}{{ < 0.004}}$ | $\frac{{0.013 \pm 0.003}}{{0.008 \pm 0.002}}$ |
| Pb | $\frac{{1.43}}{{0.20}}$ | $\frac{{0.24 \pm 0.10}}{{0.27 \pm 0.04}}$ | $\frac{{0.11 \pm 0.06}}{{0.05 \pm 0.01}}$ | $\frac{{0.07 \pm 0.03}}{{0.07 \pm 0.01}}$ | $\frac{{0.01 \pm 0.01}}{{0.01 \pm 0.004}}$ | $\frac{{0.06 \pm 0.01}}{{0.10 \pm 0.02}}$ |
| Ag | $\frac{{ < 0.005}}{{ < 0.005}}$ | $\frac{{0.003 \pm 0.001}}{{0.012 \pm 0.007}}$ | $\frac{{0.100 \pm 0.024}}{{0.068 \pm 0.011}}$ | $\frac{{0.039 \pm 0.029}}{{0.013 \pm 0.004}}$ | $\frac{{ < 0.002}}{{0.002 \pm 0.002}}$ | $\frac{{ < 0.002}}{{0.016 \pm 0.011}}$ |
| W | $\frac{{0.044}}{{0.031}}$ | $\frac{{0.034 \pm 0.006}}{{0.040 \pm 0.009}}$ | $\frac{{{\mathbf{0}}{\mathbf{.003}} \pm 0.001}}{{{\mathbf{0}}.{\mathbf{007}} \pm 0.001}}$ | $\frac{{{\mathbf{0}}{\mathbf{.040}} \pm 0.012}}{{{\mathbf{0}}.{\mathbf{077}} \pm 0.012}}$ | $\frac{{0.002 \pm 0.001}}{{ < 0.002}}$ | $\frac{{0.158 \pm 0.029}}{{0.155 \pm 0.029}}$ |
| V | $\frac{{0.13}}{{0.09}}$ | $\frac{{ < 0.2\left( {0.4} \right)}}{{0.7 \pm 0.3}}$ | $\frac{{ < 0.2}}{{0.2 \pm 0.1}}$ | $\frac{{0.3 \pm 0.2}}{{0.6 \pm 0.2}}$ | $\frac{{ < 0.2}}{{ < 0.2}}$ | $\frac{{0.3 \pm 0.2}}{{0.4 \pm 0.4}}$ |
| Te | $\frac{{ < 0.006}}{{ < 0.006}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.004}}}}{{{\mathbf{0}}.{\mathbf{008}} \pm 0.001}}$ | $\frac{{0.012 \pm 0.003}}{{0.016 \pm 0.002}}$ | $\frac{{0.031 \pm 0.007}}{{0.034 \pm 0.005}}$ | $\frac{{ < 0.004}}{{ < 0.004}}$ | $\frac{{ < 0.004}}{{ < 0.004}}$ |
| Sb | $\frac{{0.042}}{{0.037}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.002}}}}{{{\mathbf{0}}.{\mathbf{004}} \pm 0.0004}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.002}}}}{{{\mathbf{0}}.{\mathbf{003}} \pm 0.001}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.002}}}}{{{\mathbf{0}}.{\mathbf{005}} \pm 0.0005}}$ | $\frac{{ < 0.002}}{{ < 0.002\left( {0.007} \right)}}$ | $\frac{{0.016 \pm 0.006}}{{0.017 \pm 0.007}}$ |
| Bi | $\frac{{ < 0.004}}{{ < 0.004}}$ | $\frac{{0.0021 \pm 0.0005}}{{0.0026 \pm 0.0004}}$ | $\frac{{0.0022 \pm 0.0010}}{{0.0012 \pm 0.0002}}$ | $\frac{{0.0109 \pm 0.0082}}{{0.0037 \pm 0.0006}}$ | $\frac{{0.0005 \pm 0.0002}}{{0.0010 \pm 0.0002}}$ | $\frac{{0.0009 \pm 0.0003}}{{0.0017 \pm 0.0006}}$ |
| As | $\frac{{ < 0.007}}{{ < 0.007}}$ | $\frac{{0.15 \pm 0.09}}{{ < 0.04}}$ | $\frac{{0.31 \pm 0.26}}{{ < 0.04}}$ | $\frac{{{\mathbf{0}}{\mathbf{.21}} \pm 0.11}}{{ < {\mathbf{0}}.{\mathbf{04}}}}$ | $\frac{{ < 0.04}}{{ < 0.04}}$ | $\frac{{{\mathbf{0}}{\mathbf{.21}} \pm 0.13}}{{ < {\mathbf{0}}.{\mathbf{04}}}}$ |
| Sr | $\frac{{44.2}}{{36.7}}$ | $\frac{{225 \pm 23}}{{182 \pm 11}}$ | $\frac{{5.1 \pm 1.4}}{{5.2 \pm 1.7}}$ | $\frac{{5.9 \pm 0.9}}{{9.2 \pm 2.1}}$ | $\frac{{16.5 \pm 6.5}}{{4.1 \pm 1.5}}$ | $\frac{{{\mathbf{1083}} \pm 127}}{{{\mathbf{812}} \pm 46}}$ |
| Al | $\frac{{7.6}}{{12.3}}$ | $\frac{{{\mathbf{16}}{\mathbf{.5}} \pm 7.9}}{{{\mathbf{195}} \pm 36}}$ | $\frac{{7.3 \pm 1.3}}{{14.2 \pm 3.2}}$ | $\frac{{{\mathbf{10}}{\mathbf{.8}} \pm 2.3}}{{{\mathbf{22}}.{\mathbf{0}} \pm 3.7}}$ | $\frac{{1.7 \pm 1.3}}{{7.0 \pm 4.7}}$ | $\frac{{5.0 \pm 0.7}}{{10.9 \pm 3.2}}$ |
| Ti | $\frac{{ < 0.5}}{{ < 0.5}}$ | $\frac{{{\mathbf{1}}{\mathbf{.3}} \pm 1.0}}{{{\mathbf{16}}.{\mathbf{7}} \pm 2.8}}$ | $\frac{{ < 0.5\left( {1.2} \right)}}{{ < 0.5}}$ | $\frac{{ < 0.5\left( {2.0} \right)}}{{0.5 \pm 0.5}}$ | $\frac{{ < 0.5}}{{ < 0.5}}$ | $\frac{{1.7 \pm 0.4}}{{3.0 \pm 0.9}}$ |
| Zr | $\frac{{0.004}}{{0.012}}$ | $\frac{{0.10 \pm 0.04}}{{0.08 \pm 0.02}}$ | $\frac{{{\mathbf{0}}{\mathbf{.08}} \pm 0.02}}{{{\mathbf{0}}.{\mathbf{02}} \pm 0.01}}$ | $\frac{{0.12 \pm 0.04}}{{0.08 \pm 0.01}}$ | $\frac{{{\mathbf{0}}{\mathbf{.04}} \pm 0.01}}{{ < {\mathbf{0}}.{\mathbf{02}}}}$ | $\frac{{{\mathbf{0}}{\mathbf{.06}} \pm 0.01}}{{{\mathbf{0}}.{\mathbf{02}} \pm 0.01}}$ |
| Rb | $\frac{{2.03}}{{1.66}}$ | $\frac{{{\mathbf{35}}{\mathbf{.0}} \pm 1.7}}{{{\mathbf{23}}.{\mathbf{0}} \pm 2.0}}$ | $\frac{{{\mathbf{41}}{\mathbf{.0}} \pm 3.7}}{{{\mathbf{31}}.{\mathbf{6}} \pm 2.2}}$ | $\frac{{{\mathbf{40}}{\mathbf{.4}} \pm 4.8}}{{{\mathbf{27}}.{\mathbf{1}} \pm 2.0}}$ | $\frac{{{\mathbf{50}}{\mathbf{.3}} \pm 3.3}}{{{\mathbf{31}}.{\mathbf{1}} \pm 4.1}}$ | $\frac{{{\mathbf{9}}{\mathbf{.5}} \pm 0.7}}{{{\mathbf{7}}.{\mathbf{5}} \pm 0.5}}$ |
| Sn | $\frac{{ < 0.012}}{{0.045}}$ | $\frac{{ < 0.005}}{{0.022 \pm 0.017}}$ | $\frac{{0.005 \pm 0.005}}{{0.008 \pm 0.007}}$ | $\frac{{ < 0.005}}{{0.014 \pm 0.007}}$ | $\frac{{ < 0.005}}{{ < 0.005\left( {0.017} \right)}}$ | $\frac{{ < {\mathbf{0}}{\mathbf{.005}}}}{{{\mathbf{0}}.{\mathbf{019}} \pm 0.007}}$ |
| Ba | $\frac{{4.47}}{{6.13}}$ | $\frac{{{\mathbf{3}}{\mathbf{.16}} \pm 0.51}}{{{\mathbf{5}}.{\mathbf{37}} \pm 0.94}}$ | $\frac{{0.47 \pm 0.09}}{{0.41 \pm 0.08}}$ | $\frac{{{\mathbf{0}}{\mathbf{.90}} \pm 1.86}}{{{\mathbf{1}}.{\mathbf{55}} \pm 0.22}}$ | $\frac{{0.37 \pm 0.12}}{{0.43 \pm 0.12}}$ | $\frac{{8.17 \pm 0.93}}{{11.4 \pm 1.62}}$ |
| U | $\frac{{0.036}}{{0.039}}$ | $\frac{{{\mathbf{0}}{\mathbf{.017}} \pm 0.002}}{{{\mathbf{0}}.{\mathbf{028}} \pm 0.004}}$ | $\frac{{0.006 \pm 0.001}}{{0.009 \pm 0.002}}$ | $\frac{{0.028 \pm 0.010}}{{0.029 \pm 0.006}}$ | $\frac{{0.007 \pm 0.003}}{{0.004 \pm 0.002}}$ | $\frac{{{\mathbf{0}}{\mathbf{.034}} \pm 0.004}}{{{\mathbf{0}}.{\mathbf{064}} \pm 0.011}}$ |
| Cs | $\frac{{0.012}}{{0.046}}$ | $\frac{{0.156 \pm 0.009}}{{0.174 \pm 0.026}}$ | $\frac{{0.150 \pm 0.028}}{{0.123 \pm 0.034}}$ | $\frac{{0.232 \pm 0.038}}{{0.304 \pm 0.115}}$ | $\frac{{{\mathbf{0}}{\mathbf{.231}} \pm 0.021}}{{{\mathbf{0}}.{\mathbf{139}} \pm 0.024}}$ | $\frac{{0.059 \pm 0.010}}{{0.042 \pm 0.004}}$ |
В зоне влияния теплых вод у сигов значительно снижены содержания таких эссенциальных и условно-эссенциальных элементов как Fe, Co, Se, Mo, B, Cr и Li в жабрах сигов по сравнению с особями контрольной зоны (табл. 2). В печени пониженные содержания наблюдались таких элементов как Mg, Na, P, Mn, Se и B; повышенные – Cu и Si. В почках рыб меньше аккумулировалось Mg, Na, Se, Mo, Br, Ni и Si. Содержание S достоверно больше в мышцах сигов зоны И-7 по сравнению с сигами зоны И-8. В скелете аккумуляция Са, Na, P была повышена, а K, Se, Mo, B, Br и Ni была понижена. Следует отметить, что содержания Se были низкими почти во всех органах и тканях сигов зоны влияния теплых вод.
Среди токсичных элементов только повышенная аккумуляция Rb, а пониженная аккумуляция Be, Te, Sb, Al, Ti, Ba и U наблюдались в жабрах сигов зоны И-7 (табл. 3). В печени аккумуляция Hg, Zr и Rb была повышена, аккумуляция W, Sb и Al была снижена. В почках Rb и As больше аккумулировались, но Cd, W, Sb, Al и Ba меньше. Только повышенная аккумуляция Zr, Rb и Cs отмечалась в мышцах сигов зоны И-7. В скелете As, Sr, Zr и Rb накапливались больше, а Hg, Sn и U меньше. Следует отметить, что аккумуляция Rb была высокой во всех органах и тканях сигов зоны влияния теплых вод.
На основе применения моделей биоаккумуляции, которые описывают поглощение и распределение химических веществ в биотических системах с моделями химической судьбы и биоэнергетики, зависящими от температуры, прогнозируется, что потребление и темпы роста будут иметь положительную корреляцию с температурой в моделях биоэнергетики, но отрицательную в моделях биоаккумуляции (Gouin et al., 2013). В метаболических реакциях, как правило, наблюдается, что поглощение и выведение химических веществ увеличиваются с повышением температуры (Hooper et al., 2013). Действительно в большинстве случаев наблюдаются пониженные содержания как эссенциальных, так неэссенциальных элементов, особенно в жабрах (табл. 2, 3). Однако, ряд элементов (Hg, Cu, As, Rb, Cs и Zr) показал повышенную аккумуляцию, а у ряда элементов (Zn, Tl, Pb, V и Bi) не было зависимости биоаккумуляции от температуры. Например, тепловое загрязнение не оказывало влияние на биоаккумуляцию Pb и As в отличие от температурно-зависимого накопления Cu, Zn, Hg и Cd такими концентраторами как устрицы в прибрежной зоне, страдающей от сброса теплых вод электростанцией Хуши, Китай (Lan et al., 2020). Природа иона, концентрация в воде могут определять проникающую способность, метаболизм и биоаккумуляцию элементов в зависимости от температуры воды, но также могут определяться метаболической потребностью вида в нем и многими другими экзогенными и эндогенными факторами.
Проникающая способность, метаболизм и биоаккумуляция элементов, связанные с дыхательной активностью и ионной регуляцией
Гомеостаз рыб определяется, во многом, концентрацией гемоглобина в крови. Поэтому, для выживания в условиях повышенных температур особям необходимо поддерживать более высокую концентрацию гемоглобина в крови, оптимальный уровень которого определяет способность особей к выживанию. У сигов, обитающих в зоне теплового загрязнения, при концентрации гемоглобина в крови ниже нормы, возможен более быстрый летальный исход по сравнению с рыбами, выживающими с анемией в нормальных температурных условиях (табл. 1). Частота дыхательного цикла (работа ротового и жаберного насосов) зависит от температуры, тем самым увеличивается вентиляция жабр водой с повышением температуры. Ускорению частоты дыхания способствуют такие факты как снижение насыщения вод кислородом, которое происходит вследствие того, что, во-первых, с увеличением температуры с 0 до 30°С растворимость кислорода в воде падает почти в 2 раза, во-вторых, увеличивается расход кислорода при разложении больших количеств органических веществ в водном столбе и детрита на дне в зоне влияния теплых вод.
Судя по концентрации гемоглобина в крови у сигов из зоны И-7, поглощаемого желудочно-кишечным трактом Fe вполне хватает и гемопоэз не лимитируется, содержание Fe в почке поддерживается, хотя аккумуляция в жабрах значительно ниже, чем у сигов в зоне И-8 (табл. 2). Пониженная аккумуляция Al отмечается в жабрах, печени и почке сигов зоны И-7 (табл. 3), что может объясняться тем, что, по-видимому, Al использует транспортные пути Fe при его активном метаболизме. У человека примерно 90% Al плазмы связывается с трансферрином (гликопротеин, осуществляющий транспорт Fe3+ в плазме) (Yokel, 2006). Другим следствием интенсивного эритропоэза и кровообращения, вероятно, является практически отсутствующая биоаккумуляция Sb (табл. 3), которая в жабрах, печени и почке отрицательно коррелирует с концентрацией гемоглобина в крови (табл. 4). Более 95% Sb (III) в крови человека было обнаружено в эритроциты, с другой стороны, около 90% Sb (V) было идентифицировано в плазме; выведение Sb происходит быстро: Sb (V) в основном выделяется с мочой, а Sb (III) – главным образом с калом (Tylenda et al., 2015).
Таблица 4.
Коэффициенты корреляции содержания элементов в органах и тканях сигов в зависимости от концентрации гемоглобина в крови и фактора состояния
| Элемент | Жабры | Печень | Почка | Мышцы | Скелет |
|---|---|---|---|---|---|
| Концентрация гемоглобина в крови | |||||
| Na | – | – | –0.683** | – | – |
| P | – | –0.590* | – | – | – |
| Cu | – | – | 0.627* | – | – |
| Tl | – | – | 0.600* | – | – |
| Te | –0.649* | – | – | – | – |
| Sb | –0.630* | –0.627* | –0.659** | – | – |
| Sr | 0.743*** | – | – | – | 0.838**** |
| Zr | – | 0.655** | – | – | 0.703*** |
| Rb | 0.759*** | – | 0.675** | 0.776*** | – |
| Фактор состояния | |||||
| Na | – | – | –0.676** | – | – |
| Fe | –0.635* | – | – | – | – |
| Cu | – | 0.640* | – | – | – |
| Co | –0.681** | – | – | – | – |
| Se | – | –0.738*** | –0.596* | – | – |
| Mo | –0.683** | – | –0.635* | –0.602* | –0.607* |
| B | –0.674** | – | – | – | –0.692** |
| Cr | –0.659* | – | – | – | – |
| Ni | – | – | –0.575* | – | –0.905**** |
| Si | – | 0.638* | –0.659** | – | – |
| Li | –0.694** | – | – | – | – |
| Be | –0.637* | – | – | – | – |
| Ag | –0.669** | – | – | – | –0.697** |
| W | – | –0.626* | – | – | – |
| Sb | –0.627* | –0.641* | – | – | – |
| Al | –0.651** | – | – | – | – |
| Ti | –0.603* | – | – | – | – |
| Zr | – | 0.619* | – | – | 0.728*** |
| Rb | –0.600* | – | – | – | – |
Высокая дыхательная активность сигов в зоне влияния теплых вод направлена на поддержание эффективности газообмена О2 и СО2 с водой. Хотя большая часть СО2 удаляется путем пассивной диффузии через эпителий жабр, карбоангидраза катализирует гидратацию СО2 с образованием ионов Н+ и ${\text{HCO}}_{3}^{--}$ в цитозоле эпителиальных клеток. Чтобы избежать метаболического ацидоза, излишки ионов Н+ должны удаляться. Транспорт Н+ связан с транспортом Na+. Следующие транспортные системы находятся на апикальной мембране: первая – электронейтральный Na+/H+–обменник (NHE) транспортирует H+ через апикальную мембрану в обмен на Na+, вторая – H+–АТФаза (VHA) транспортирует H+ через апикальную мембрану, создавая электрохимический градиент для Na+, чтобы диффундировать сквозь апикальную мембрану через Na+–канал, который также может быть проницаемый для K+, других электролитов, Cu+, Ag+; тогда как вдоль базолатеральной мембраны находятся VHA, Na+/K+–АТФаза (NKA), Na+/${\text{HCO}}_{3}^{--}$–котранспортер (NBC) помогает поддерживать очень низкую концентрацию Na в цитозоле, а также удаляет ${\text{HCO}}_{3}^{--}$ из клеток (Griffith, 2017). Также следует отметить, что рыбе нужно быть гиперрегулятором в гипотонической пресной воде (осморегуляционное требование) и поддерживать более высокие концентрации Na и Cl в крови, чем в воде. Таким образом, помимо диффузии Na+ через Na+–канал, у сигов из зоны И-7 идет интенсивная закачка Na+ в обмен на H+ вследствие их большей дыхательной активности. Хотя и недостоверно, но аккумуляция Na несколько повышена в жабрах сигов из зоны И-7 по сравнению с сигами зоны И-8 (табл. 2). При этом в зоне влияния теплых вод сиги вынуждены выводить излишки Na (табл. 2), причем снижение содержания Na усиливается в почке сигов при росте концентрации гемоглобина в крови (табл. 4).
K+–канал (KC), который перемещает K+ обратно через базолатеральную мембрану во внеклеточную жидкость, устроен так, что он также частично проницаем для более крупных ионов щелочных металлов, таких как Rb+ и Cs+, но почти непроницаем для Na+ и Li+ (Griffith, 2017). Проникновение и аккумуляция Rb во всех органах и тканях значительна у сигов зоны И-7 по сравнению с сигами зоны И-8, тогда как для Cs повышенная аккумуляция наблюдается только в мышцах (табл. 3). Рубидий является ближайшим к K конгенером, заменяющим его во всех известных биохимических процессах, катализируемых Na+/K+–АТФазой, K+/Na+/2Cl––транспортером и K+–каналами (Jilkina et al., 2003). Так, 10-кратное увеличение биоккумуляции Rb и Cs наблюдалось в мышцах сигов (Coregonus lavaretus) из двух вулканических озер по сравнению с сигами из искусственного озера в Центральной Италии, также аккумуляция K была немного увеличена, но концентрация Na была немного снижена (Orban et al., 2006). Замена Rb+ на K+ может влиять на NKA, который поддерживает градиенты Na+ на мембранах клеток, тем самым может усилить отток Na+. Аккумуляция Rb во всех органах и тканях сигов зоны И-7 только приблизительно в 1.5 раза больше, чем у сигов зоны И-8 (табл. 3). Однако, с ростом концентрации гемоглобина в крови увеличивается накопление Rb в жабрах, почке и мышцах (табл. 4). В почке аккумуляция Rb, по-видимому, способствует усилению оттока Na, который увеличивается с ростом концентрации гемоглобина в крови, а именно у сигов в зоне влияния теплых вод (табл. 4).
С ростом концентрации гемоглобина в крови увеличивается аккумуляция Cu и Tl в почке (табл. 4), что возможно в какой-то степени связано с метаболизмом K. Взаимосвязь концентрации гемоглобина в крови и накопление Cu обнаруживается именно в почке, а не в печени (основном месте хранения Cu), аккумуляция Cu максимальна в печени сигов из зоны И-7 и в 2 раза превосходит таковую у сигов из зоны И-8 (табл. 2). Хотя взаимосвязь между транспортом Cu и K недостаточно ясна, у человека транспортер Cu CTR1 стимулирует увеличение K в плазматической мембране клеток (Lee et al., 2002). Например, перераспределение эссенциальных элементов в печени лещей (Abramis brama L.) показало увеличение содержаний Cu и K на стадии развития анемии, и их снижение на стадии мобилизации защитных функций организма и усиления гемопоэза, вероятно, как следствие истощения запасов Cu в церулоплазмине и металлотионеине (Гашкина, 2017). Однако, аккумуляция Cu в печени сигов оз. Имандра, по-видимому, не только регулируется интенсивностью гемопоэза, но и в больше мере различной интенсивностью процессов детоксикации (Gashkina et al., 2020). Биоаккумуляция Cu в органах и тканях сигов зоны И-7 в целом соответствовала тканеспецифическим закономерностям, но, по-видимому, в большей мере отражает высокую проникающую способность Cu в ультрапресных мягких водах озера и особенно в условиях влияния теплых вод при интенсивной ионной регуляции и метаболизме. Например, Cu2+ может быть восстановлен до Cu+ с помощью редуктазы Cu на поверхности жабр до его поглощения (Grosell, 2012).
Чтобы избежать метаболического алкалоза, излишки ${\text{HCO}}_{3}^{--}$ также должны удаляться. Апикальные мембраны обладают Cl–/${\text{HCO}}_{3}^{--}$–обменником (AE), тогда как базолатеральные мембраны имеют Cl––канал и NBC (Griffith, 2017). Таким образом, интенсивная закачка Cl также должна происходить у сигов зоны влияния теплых вод, причем Br, имеющий сродство к AE, должен также интенсивно проникать в организм рыб. Хотя концентрация Br в воде зоны И-7 почти в 1.5 раза больше, чем в воде зоны И-8, но Br интенсивно выводится и не депонируется в скелете сигов зоны влияния теплых вод (табл. 2).
Поглощение Ca2+ через апикальную мембрану жабр может происходить путем диффузии через селективный эпителиальный Ca2+–канал (ECaC), транспорт Ca2+ через базолатеральную мембрану осуществляется благодаря комбинированному действию Ca2+–АТФазы плазменной мембраны (PMCA) и Na+/Ca2+–обменника (NCX) (Griffith, 2017). Внутриклеточный свободный Ca значительно ниже (0.1–1 мМ), чем внеклеточный свободный Ca (Cameron, 1990). Тем не менее, есть очень эффективные гомеостатические механизмы для перевода Ca2+ из растворенной формы в другие формы, такие как органические молекулы или частицы, CaCO3 или Ca3(PO4)2, которые могут депонироваться в костях (Griffith, 2017). Вследствие того, что внутриклеточный Ca поддерживается на очень низком уровне, то создается градиент на апикальной мембране жабр. По-видимому, помимо поглощения Са через жабры, проникновение Са через желудочно-кишечный тракт из пищи может быть больше у сигов в условиях влияния теплых вод. На данный факт указывает большая минерализация скелета и большая аккумуляция Са и Р в скелете сигов из зоны И-7 (табл. 2). Стронций, как гомолог Са, также больше депонируется в скелете сигов в теплых условиях, чем в естественной термической среде, причем аккумуляция Sr увеличивается в жабрах и скелете рыб, которые вынуждены постоянно поддерживать высокую концентрацию гемоглобина в крови (табл. 4).
Двухвалентные металлы также могут переноситься ECaC через апикальную мембрану, причем сродство Ca2+–каналов оказывается к Cd2+ и Zn2+ у рыб больше, чем для Ca2+ (Griffith, 2017). Однако, концентрации Zn поддерживаются на физиологических уровнях во всех органах и тканях сигов из зоны И-7 (табл. 2), а Cd интенсивно выводиться из почки (табл. 3).
Магний является кофактором для ферментов, которые переносят фосфатные группы, такие как АТФазы, участвующие в подаче энергии на насосы для H+ и Ca2+ и обменника для Na+ и K+, и большинство клеточного Mg связано с АТФ; в результате дефицит Mg может быть обусловлен дисбалансом Ca, Na и K, включая изменения в соотношении K : Na у рыб (Griffith, 2017). Снижение концентрации Mg наблюдалось в печени сигов в условиях влияния теплых вод (табл. 1). Взаимосвязь Mg и Р (r = 0.963, p < 0.001) в печени может указывать на снижение гликолитической емкости. Причем содержания Р в печени сигов снижается с увеличением концентрации гемоглобина в крови (табл. 4). На пониженные энергетические возможности печени сигов из зоны И-7 также может указывать взаимосвязь Р и Mn (r = 0.679, p < 0.01) и их заниженные концентрации в печени рыб (табл. 2). На энергетический обмен может влиять токсичное воздействие Cu. Снижение гликолитической способности зависит от прямой конкуренции Cu2+ с Mg2+ за сайты связывания, что будет вызывать конформационные изменения фермента, изменяющие его активность (Ransberry et al., 2015). Пресноводные рыбы поглощают наиболее необходимый Mg2+ из пищи через кишечный эпителий, причем Mg2+ требует белка-переносчика с большим участком связывания и механизма дегидратации (Griffith, 2017). Снижение аккумуляции Mg также наблюдалось в почке рыб из зоны И-7 (табл. 2), т.е почечная экскреция превышает ре-абсорбцию Mg. Т.к. Ni также использует транспортеры Mg (Griffith, 2017), то почечная экскреция Mg, по-видимому, способствует и экскреции Ni особенно с увеличением фактора состояния (табл. 4).
Метаболизм и биоаккумуляция элементов, связанные с соматическим ростом
Аналитический обзор по биологическим эффектам рыб в Арктике (AMAP, 2018) обнаруживает примеры того, что длительное потепление пресных вод может изменить темпы роста рыбы, и холодолюбивые виды, такие как арктический голец и озерная форель, растут менее эффективно в более теплых водах. Многолетнее исследование арктического гольца показало, что рыбы испытывают больший метаболический стресс и происходит сильное истощение гликогена в конце аномально теплого лета по сравнению с более холодными годами (Reist et al., 2006). Данные примеры показывают акклиматизационную реакцию на климатические вариации. Тогда как адаптированные к температурному стрессу сиги из зоны И-7 тратят энергетические запасы не только для поддержания основных биологических функций, но и на соматический рост. Фактор состояния у них значительно выше, чем у сигов в зоне И-8 (табл. 1). Ориентировочная средняя величина темпов роста составила 128 г/год для сигов из зоны И-7 против 81 г/год для сигов из зоны И-8. Тогда как главная метаболическая потребность заключается в Se (табл. 2).
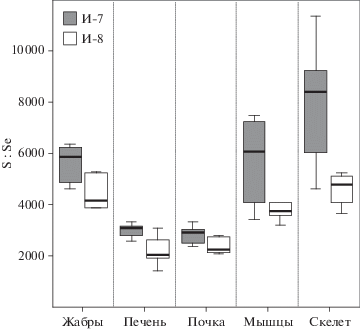
В отличие от наземных животных, эволюционная повышенная зависимость от Se проявляется в виде более крупного селенопротеома у водных животных, включая рыб, которые содержат наибольшее количество селенопротеинов среди всей биоты (Mariotti et al., 2006). В отличие от большинства основных микроэлементов, Se не координируется с белками, а ковалентно включается в виде остатка селеноцистеина (SeCys); группы селеноферментов представляют собой глутатионпероксидазы (которые выполняют функцию восстановления гидропероксидов до соответствующих спиртов за счет глутатиона), тиоредоксинредуктазы (которые поддерживают окислительно-восстановительный статус клеток за счет снижения уровня цистеина), йодтиронин дейодиназы (которые активируют прогормон тироксин (Т4) в активный гормон щитовидной железы трийодтиронин (Т3) и катализируют инактивацию Т4 для превращения реверсивного T3 (rT3) и Т3 в диодотиронин (T2)) и селенофосфатсинтетазы (которые синтезирует селенопротеины путем продуцирования активной (фосфорилированной) формы Se) (Janz, 2012). В отличие от других аминокислот, SeCys не используется повторно в последующих циклах синтеза белка, но его необходимо разложить, чтобы высвободить неорганический Se для синтеза нового SeCys, который включается в активные центры селеноферментов (Hatfield et al., 2006). Если Se специально включен в незаменимые селенопротеины как SeCys, то во всех других белках селенометионин (SeMet) заменяет метионин нерегулируемым и дозозависимым образом, является причиной токсичности Se; хотя SeMet можно рассматривать как нерегулируемый пул Se для синтеза SeCys при нормальном потреблении пищи (Janz, 2012). Достаточное количество пищевого Se необходимо для нормального роста тела рыб (Saffari et al., 2017), а в более теплых условиях наблюдается увеличение скорости роста (McKinley et al., 2012). С другой стороны, темпы роста и содержание липидов в рыбе значительно сокращаются при высоком содержание SeMet в рационе (de Riu et al., 2014). Дозозависимая замена Se на S в метионине как следствие воздействия Se через пищу проиллюстрирована в эксперименте с выдерживаемых в клетках дикого озерного голавля (Couesius plumbeus), выловленных из контрольного озера и озера, получающего воды из уранового завода в северной части Саскачевана, Канада (Phibbs et al., 2011). Снижение сигнатуры S всего тела (по данным анализа стабильных изотопов) и увеличение доли SeMet-подобных соединений (по данным рентгеновской абсорбционной спектроскопии) наблюдали на 21 день эксперимента с увеличением Se в рационе. Т. к. Se имеет высокой потенциал для биомагнификации в водных пищевых цепях (Janz, 2012), то можно предположить, что сиги получают Se с пищей несколько больше в более теплых водах зоны И-7. Однако, рассмотрев молярные отношения серы к Se, эти отношения достоверно выше во всех органах и тканях (исключая мышцы) сигов из зоны И-7 по сравнению с сигами из зоны И-8 (рис. 2). Можно предположить, что Se в большей мере включен в незаменимые SeCys у сигов из зоны И-7, тогда как пул SeMet формируется у сигов из зоны И-8, в больших случаях S замещена Se в метионине, а метионин замещен SeMet. С одной стороны, сиги зоны теплового воздействия не подвержены какому-то либо токсичному воздействию Se, с другой стороны, они больше зависимы от его дефицита. Наибольшее снижение содержания Se (более, чем в 1.5 раза) наблюдается в печени (доминирующий участок синтеза и катаболизма селенопротенов) сигов из зоны И-7 (табл. 2), особенно с увеличением фактора состояния (табл. 4).
Рис. 2.
Молярные отношения серы к селену (S:Se) в органах и тканях сигов в зоне влияния теплового загрязнения (И-8) и в зоне с естественной средой обитания (И-8).
Снижение биоаккумуляции Мо в жабрах, почке, мышцах и скелете с увеличением фактора состояния (табл. 4) связано, по-видимому, с интенсивным метаболизмом, в частности серосодержащих аминокислот. Молибден является кофактором по меньшей мере семи ферментов, главные из которых это ксантиноксидаза/дегидрогеназа (участвует в окислении пурина и пиримидинов, также других азотсодержащих гетероциклических соединений) и сульфитоксидаза (находится в митохондриальном межмембранном пространстве, окисляет сульфит до сульфата и является конечной стадией метаболизма серосодержащих аминокислот) (Reid, 2012). Метаболизм W связан с метаболизмом Мо, на который он очень похож по химическим свойствам (Leffler, Kazantzic, 2015). Mолибдат (Reid, 2012), как и селенат (Janz, 2012) используют транспортную систему сульфатов. Во-первых, 3Na+/${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$–котранспортер (SLC13s1) перемещает как Na+, так и ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ через апикальную границу, управляемую градиентом Na+, создаваемым NKA на базолатеральной мембране; затем ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ перемещается через базолатеральную мембрану с помощью ${{{\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}} \mathord{\left/ {\vphantom {{{\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}} {2{\text{HCO}}_{3}^{ - }}}} \right. \kern-0em} {2{\text{HCO}}_{3}^{ - }}}$–обменника (SLC26a1), который запитывается градиентом ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ через базолатеральную мембрану (Griffith, 2017). По-видимому, Si также использует транспортную систему сульфатов. Вынужденная повышенная экскреция Na почками сигов в зоне влияния теплых вод, вероятно, способствует Na-зависимому транспорту Se, Mo, W и Si (табл. 2, 3), для Se, Mo, Si экскреция усиливается с увеличением фактора состояния (табл. 4).
Селен взаимодействует с множеством других микроэлементов, главным образом антагонистично (Janz, 2012). Одно из неблагоприятных взаимодействий Se связано с увеличением биоаккуляции Hg в печени рыб (табл. 3). Яркий антагонистический пример наблюдался в условиях сильного загрязнения от медеплавильного комбината, и достаточное накопление Se значительно снижало биоаккумуляцию Hg в органах и тканях лещей (Abramis brama L.) по сравнению с фоновыми условиями (Гашкина и др., 2015). С другой стороны, увеличение биоаккумуляции Hg в печени и мышцах рыб наблюдалось вдоль сильного температурного градиента от водоемов субарктических регионов до водоемов юга России (Моисеенко, Гашкина, 2016). Ртуть биомагнифицируется на более высоких трофических уровнях в пищевых цепях, и метилртуть (MeHg) составляет 91%, обнаруженной у сигов (Coregonus clupeaformis) из северной чести озера Гурон (Madenjian et al., 2016). В Феноскандии увеличение концентрации Hg в мышцах у 6 видов рыб и скорости биоаккумуляции Hg в сигах (Coregonus lavaretus) наблюдались по температурному градиенту от холодных нетронутых олиготрофных озер на севере до более теплых и все более измененных человеком мезотрофных и эвтрофных систем на юге, где, по-видимому, процессы метилирования Hg происходят интенсивнее (Ahonen et al., 2018). Метилртуть эффективно всасывается (>90%) из кишечника и попадает в ткани в виде цистеин-связанного конъюгата, который имитирует аминокислоту метионин, свободно перемещаясь в клетки через белки транспорта аминокислот (Hooper et al., 2013). Метилртуть по определению является высокоспецифичным необратимым ингибитором селеноферментов, а внутриклеточная MeHg имеет тенденцию уменьшать количество Se, которое биологически доступно для нормального синтеза селенофермента, особенно при приближении молярных отношений Hg : Se к 1 : 1 (Ralston et al., 2008). Молярное отношение Hg : Se в среднем составило 0.007 (максимальное – 0.012) в печени сигов из зоны И-7, тогда как это отношение составило 0.004 (максимальное – 0.005) у сигов из зоны И-8. Пока эти соотношения невелики.
Другое неблагоприятное взаимодействие Se связано с аккумуляций As, которая существенна во всех органах и тканях (исключая мышцы) у сигов в зоне влияния подогретых вод, тогда как в естественных условиях As не накапливается и концентрации были ниже порога обнаружения (табл. 3). Как арсенит (As(III)), так и арсенат (As(V)) антагонистически взаимодействуют с Se, взаимодействие включает комплексообразование с эндогенными тиолами (Janz, 2012). Однако, известно, что кодируемый геном MRP2 транспортирует широкий спектр анионных субстратов, включая конъюгаты As-глутатион (McIntyre et al., 2012). Инактивация селеферментов в печени сигов из зоны И-7 может возрастать. Молярное отношение (Hg + As) : Se в среднем составило 0.049 (максимальное – 0.232) в печени сигов из зоны И-7, тогда как это отношение остается такое же, как и Hg : Se у сигов из зоны И-8.
Взаимодействие Cu и Se в рыбе снижает тканеспецифическое накопление Se, повышенная диета Cu снижает концентрацию Se в печени (Janz, 2012). Таким образом, Cu не только понижает энергетические возможности печени, как это было показано выше, но и снижает аккумуляцию Se в печени, о чем свидетельствует их отрицательная корреляция (r = –0.606, p < 0.05). Причем аккумуляция Cu увеличивается с увеличением фактора состояния (табл. 4). Например, в (Couture, Pyle, 2008) для желтого окуня (Perca flavescens) приводится верхний порог содержания Cu 38.8 мкг/г сух веса в печени, превышение которого представляет риск токсичности. Содержание Cu в печени превышает этот порог у всех сигов в условиях воздействия теплых вод (табл. 2).
На поддерживающую функциональность печени, вероятно, указывает пониженная аккумуляция Si в жабрах и почке, но повышенная аккумуляция в печени сигов в зоне влияния подогретых вод (табл. 2), причем с ростом фактора состояния аккумуляция Si снижается в почке, но увеличивается в печени (табл. 4). Самые высокие концентрации кремнезема в организме человека наблюдаются в соединительных и эластических тканях и, особенно, в аорте человека, где он, по-видимому, функционирует как сшивающий агент, стабилизирующий коллаген и предположительно укрепляющий сосудистую сеть (Martin, 2013).
Стоит обратить внимание на то, что такой инертный по своим химическим и биологическим свойствам как Zr больше аккумулируется в печени, мышцах и скелете у сигов в условиях более теплых вод (табл. 3), при этом аккумуляция Zr возрастает в печени и скелете при увеличении как концентрации гемоглобина в крови, так и величины фактора состояния (табл. 4).
ЗАКЛЮЧЕНИЕ
Микроэлементный состав рыб сформировался в процессе их эволюционного развития и отражает метаболические процессы, в которых участвует большой спектр эссенциальных металлов и металлоидов. Элементы всегда присутствуют в окружающей среде, их аккумуляция в живых организмах происходит избирательно в зависимости от потребности элементов в метаболических процессах. В стрессовых условиях активируются защитные функции организма, преимущества для выживания имеют особи в популяциях, преадаптированные к выживанию в изменённых условиях обитания, т.е. подвержены селективному отбору.
В зоне влияния подогретых вод Кольской АЭС создана уникальная модель для изучения влияния возможного потепления климата на водные экосистемы Субарктики. Популяция сигов, обитающая в зоне теплового воздействия, адаптировалась к тепловому стрессу: рыбы имеют лучшие показатели физиологического состояния по сравнению с популяцией сигов в естественной среде обитания.
Одним из главных адаптационных механизмов ионной регуляции является интенсивный метаболизм Na вследствие высокой дыхательной активности сигов в более теплых водах. С интенсивным метаболизмом Na, именно, взаимосвязанностью транспорта Na и K, связана повышенная аккумуляция Rb во всех органах и тканях сигов, подверженных тепловому воздействию. Неблагоприятным проявлением высокой почечной экскреции Na является, по-видимому, Na-зависимый транспорт сульфатов, который стимулирует экскрецию Se, Mo, и Si.
В условиях повышенных температур главная метаболическая потребность заключается в Se в случае невысоких уровнях его содержания в окружающей среде. С одной стороны, в зоны теплового воздействия сиги не подвержены какому-то либо токсичному воздействию Se, с другой стороны, они наиболее зависимы от его дефицита, который наиболее ярко проявлен в печени рыб. В целом печень выступает органом-мишенью теплового воздействия. Высокая проникающая способность Cu, особенно в ультрапресных мягких водах озера, и его чрезмерное аккумуляция в печени, а также потери Mg, способствуют пониженным энергетическим возможностям печени.
Адаптация к тепловому воздействию снижает способность адаптации популяции сигов по отношению к другим стрессовым факторам. Наметились риски токсичных эффектов и биоаккумуляции Hg, As и Cu вследствие интенсивного метаболизма селенопротеинов при усилении действующего стрессора или появлении новых.
Работа выполнена при финансовой поддержке РФФИ (грант № 18-05-60012).
Список литературы
Гашкина Н.А. (2017) Эссенциальные элементы в органах и тканях рыб в зависимости от токсичности среды обитания и физиологического состояния. Геохимия (10), 934-941.
Gashkina N.A. (2017) Essential elements in the organs and tissues of fish depending on the freshwater toxicity and physiological state. Geochem. Int. 55(10), 927-934.
Гашкина Н.А., Таций Ю.Г., Удачин В.Н., Аминов П.Г. (2015) Биогеохимическая индикация загрязнения окружающей среды (на примере влияния крупного медеплавильного комбината). Геохимия (3), 264-275.
Gashkina N.A., Tatsii Y.G., Udachin V.N., Aminov P.G. (2015) Biogeochemical indication of environmental contamination: A case study of a large copper smelter. Geochem. Int. 53(3), 253-264.
Крылов О.Н. (1980) Пособие по профилактике и диагностике отравлений рыб вредными веществами. М., 80с.
Моисеенко Т.И. (1998) Гематологические показатели рыб в оценке их токсикозов. Вопросы ихтиологии 38(2), 371-380.
Моисеенко Т.И., Гашкина Н.А. (2016) Биоаккумуляция ртути в рыбах как индикатор уровня загрязнения вод. Геохимия (6), 495-504.
Moiseenko, T.I., Gashkina, N.A. (2016) Bioaccumulation of mercury in fish as indicator of water pollution Geochem. Int. 54(6), 485-493.
Моисеенко Т.И., Даувальтер В.А, Лукин А.А., Кудрявцева Л.П., Ильящук Б.П., Ильящук Л.И., Сандимиров С.С., Каган Л.Я., Вандыш О.И., Шаров А.Н., Шарова Ю.Н., Королева И.Н. (2002) Антропогенные модификации экосистемы озера Имандра. М.: Наука, 476 с.
Моисеенко Т.И., Лукин А.А. (1999) Патологии рыб в загрязняемых водоемах Субарктики и их диагностика. Вопросы ихтиологии 39(7), 535-547.
Нормативы качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения. (2011) М.: ВНИРО, 257 с.
Отчет по экологической безопасности за 2018 год. (2018) Полярные Зори: Филиал АО “Концерн Росэнергоатом” “Кольская атомная станция”. 44 с.
Правдин И.Ф. (1966) Руководство по изучению рыб. М.: Пищевая промышленность, 376 с.
Ahonen S.A., Hayden B., Leppänen J.J., Kahilainen K.K. (2018) Climate and productivity affect total mercury concentration and bioaccumulation rate of fish along a spatial gradient of subarctic lakes. Sci. Total Environ. 637–638, 1586-1596.
AMAP (2005) AMAP Assessment 2002: Heavy Metals in the Arctic. Oslo, Norway: Arctic Monitoring and Assessment Programme (AMAP), xvi+265 p.
AMAP (2018) AMAP Assessment 2018: Biological Effects of Contaminants on Arctic Wildlife and Fish. Tromsø, Norway: Arctic Monitoring and Assessment Programme (AMAP), vii+84 p.
Cameron J.N. (1990) Unusual aspects of calcium metabolism in aquatic animals. Annu. Rev. Physiol. 52, 77-95.
Couture P., Pyle G. (2008) Live fast and die young: metal effects on condition and physiology of wild yellow perch from along two metal contamination gradients. Hum. Ecol. Risk. Assess. 14, 73-96.
de Riu N., Lee J.-W., Huang S.S.Y., Moniello G., Hung S.S.O. (2014) Effect of dietary selenomethionine on growth performance, tissue burden, and histopathology in green and white sturgeon. Aquat. Toxicol. 148, 65-73.
Falfushynska H., Gnatyshyna L., Yurchak I., Ivanina A., Stoliar O., Sokolova I. (2014) Habitat pollution and thermal regime modify molecular stress responses to elevated temperature in freshwater mussels (Anodonta anatina: Unionidae). Sci. Total Environ. 500-501, 339-350.
Froese R. (2006) Cube law, condition factor and weight–length relationships: history, meta-analysis and recommendations. J. Appl. Ichthyol. 22, 241-253.
Gashkina N.A., Moiseenko T.I., Kudryavtseva L.P. (2020) Fish response of metal bioaccumulation to reduced toxic load on long-term contaminated Lake Imandra. Ecotoxicol. Environ. Saf. 191, 110 205.
Gouin T., Armitage J.M., Cousins I.T., Muir D.C.G., Ng C.A., Reid L., Tao S. (2013) Influence of global climate change on chemical fate and bioaccumulation: The role of multimedia models. Environ. Toxicol. Chem., 32(1), 20-31.
Griffith M.B. (2017) Toxicological perspective on the osmoregulation and ionoregulation physiology of major ions by freshwater animals: Teleost fish, crustacea, aquatic insects, and Mollusca. Environ. Toxicol. Chem. 36(3), 576-600.
Grosell M. (2012) Copper. In Homeostasis and Toxicology of Essential Metals, (Eds. Wood C.M., Farrel A.P., Brauner C.J.) London: Academic Press. V. 31A, 53-133.
Hatfield D.L., Carlson B.A., Xu X., Mix H., Gladyshev V.N. (2006) Selenocysteine incorporation machinery and the role of selenoproteins in development and health. Prog. Nucleic. Acid. Res. Mol. Biol. 81, 7-142.
Hooper M.J., Ankley G.T., Cristol D.A., Maryoung L.A., Noyes P.D., Pinkerton K.E. (2013) Interactions between chemical and climate stressors: a role for mechanistic toxicology in assessing climate change risks. Environ. Toxicol. Chem. 32(1), 32-48.
Ingleton T., McMinn A. (2012) Thermal plume effects: A multi-disciplinary approach for assessing effects of thermal pollution on estuaries using benthic diatoms and satellite imagery. Estuar. Coast. Shelf Sci., 99, 132e144.
Intergovernmental Panel for Global Climate Change (IPC-C). The Physical Science Basis. Climate Change 2013. http://www.ipcc.ch/report/ar5/wg1.
Janz D.M. (2012) Selenium. In Homeostasis and Toxicology of Essential Metals, (Eds. Wood C.M., Farrel A.P., Brauner C.J.) London: Academic Press. V. 31A, 327-374.
Jilkina O., Kuzio B., Kupriyanov V.V. (2003) Hyposmotic shock: effects on rubidium/potassium efflux in normal and ischemic rat hearts, assessed by 87Rb and 31P NMR. Biochim. Biophys. Acta 1637, 20-30.
Lan W.-R., Huang X.-G., Lin L.-x., Li S.-X., Liu F.-J. (2020) Thermal discharge influences the bioaccumulation and bioavailability of metals in oysters: Implications of ocean warming. Environ. Pollut. 259, 113 821.
Lee J., Peña M.M., Nose Y., Thiele D.J. (2002) Biochemical characterization of the human copper transporter Ctr1. J. Biol. Chem. 277, 4380-4387.
Leffler P.E., Kazantzic G. (2015) Tungsten. In Handbook on the Toxicology of Metals 4th ed. (Eds. Nordberg G.F., Fowler B.A., Nordberg M.) London: Academic Press. p. 1297-1306.
Madenjian C., Ebener M., Krabbenhoft D. (2016) Mercury accumulation, and the mercury-PCB-sex interaction, in lake whitefish (Coregonus clupeaformis). Environments 3, 7.
Mariotti M., Ridge P.G., Zhang Y., Lobanov A.V., Pringle T.H., Guigo R., Hatfield D.L., Gladyshev V.N. (2012) Composition and evolution of the vertebrate and mammalian selenoproteomes. PLoS One 7(3), e33066.
Martin K.R. (2013) Chapter 14 Silicon: The Health Benefits of a Metalloid. In Interrelations between Essential Metal Ions and Human Diseases, Metal Ions in Life Sciences. (Eds. Sigel A., Sigel H., Sigel R.K.O.) Dordrecht, Heidelberg, New York, London: Springer. V. 13, 451-473.
McIntyre D.O., Linton T.K. (2012) Arsenic. In Homeostasis and Toxicology of Non-Essential Metals, (Eds. Wood C.M., Farrel A.P., Brauner C.J.) San Diego: Academic Press. V. 31B, 297-349.
McKinley A.C., Taylor M.D., Johnston E.L. (2012) Relationships between body burdens of trace metals (As, Cu, Fe, Hg, Mn, Se, and Zn) and the relative body size of small tooth flounder (Pseudorhombus jenynsii). Sci. Total Environ. 423, 84-94.
Moe J., De Schamphelaert K., Clements W.H., Sorensen M.T., Van den Brink P.J., Liess M. (2013) Combined and interactive effects of global climate change and toxicants on populations and communities. Environ. Toxicol. Chem., 32(1), 49-61.
Moiseenko T., Sharov A. (2019) Large Russian Lakes Ladoga, Onega, and Imandra under Strong Pollution and in the Period of Revitalization: A Review. Geosciences 9(12), 492.
Moiseenko T.I., Dinu M.I., Gashkina N.A., Kremleva T.A. (2019) Aquatic environment and anthropogenic factor effects on distribution of trace elements in surface waters of European Russia and Western Siberia. Environ. Res. Lett. 14(6), 065 010.
Moiseenko T.I., Morgunov B.A., Gashkina N.A., Megorskiy V.V., Pesiakova A.A. (2018) Ecosystem and human health assessment in relation to aquatic environment pollution by heavy metals: case study of northwest of the Russian arctic, Kola peninsula. Environ. Res. Lett. 13(6), 065005.
Orban E., Masci M., Nevigato T., Di Lena G., Casini I., Caproni R., Gambelli L., De Angelis P., Rampacci M. (2006) Nutritional quality and safety of whitefish (Coregonus lavaretus) from Italian lakes. J. Food Composit. Anal. 19, 737-746.
Phibbs J., Franz E., Hauck D., Gallego M., Tse J.J., Pickering I.J., Liber K., Janz D.M. (2011) Evaluating the trophic transfer of selenium in aquatic ecosystems using caged fish, X-ray absorption spectroscopy and stable isotope analysis. Ecotoxicol. Environ. Saf. 74, 1855-1863. https://doi.org/10.1016/j.ecoenv.2011.06.015
Ralston N.V.C., Ralston C.R., Blackwell III J.L., Raymond L.J. (2008) Dietary and tissue selenium in relation to methylmercury toxicity. NeuroToxicology 29, 802-811.
Ransberry V.E., Morash A.J., Blewett T.A., Wood C.M., McClelland G.B. (2015) Oxidative stress and metabolic responses to copper in freshwater-and seawater-acclimated killifish, Fundulus heteroclitus. Aquat. Toxicol. 161, 242-252.
Reid S.D. (2012) Molybdenum and chromium. In Homeostasis and Toxicology of Essential Metals, (Eds. Wood C.M., Farrel A.P., Brauner C.J.) London: Academic Press. V. 31A, 375-415.
Reist J.D., Wrona F.J., Prowse T.D., Power M., Dempson J.B., King J.R., Beamish, R.J. (2006) An overview of effects of climate change on selected Arctic freshwater and anadromous fishes. Ambio 35, 381-387.
Saffari S., Keyvanshokooh S., Zakeri M., Johari S.A., Pasha-Zanoosi H. (2017) Effects ofdifferent dietary selenium sources (sodium selenite, selenomethionine and nanose-lenium) on growth performance, muscle composition, blood enzymes and antioxidant status of common carp (Cyprinus carpio). Aquacult. Nutr. 23, 611-617.
Tylenda C.A., Sullivan jr. D.W., Fowler B.A. (2015) Antimony. In Handbook on the Toxicology of Metals 4th ed. (Eds. Nordberg G.F., Fowler B.A., Nordberg M.) London: Academic Press. p. 565-579.
Yokel R.A. (2006). Blood–brain barrier flux of aluminum, manganese, iron and other metals suspected to contribute to metal-induced neurodegeneration. J. Alzheimers Dis. 10, 223-253.
Дополнительные материалы отсутствуют.