Геохимия, 2020, T. 65, № 11, стр. 1110-1114
Фракционирование изотопов бора между жидкостью и газом по линии насыщенного пара воды
А. Ю. Бычков a, *, И. Ю. Николаева a, Я. В. Бычкова a, Ч. Сакагучи b, Э. Накамура b
a Московский Государственный Университет им. М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские горы, 1, Россия
b Институт планетного вещества, Университет Окаяма
682-0193 Misasa, Tottori, Yamada 827, JAPAN
* E-mail: andrewbychkov@rambler.ru
Поступила в редакцию 18.03.2020
После доработки 12.04.2020
Принята к публикации 07.05.2020
Аннотация
Получены первые экспериментальные данные по распределению изотопов бора между газом и жидкостью при 100–350°С и давлении насыщенного пара воды, а также исследовано влияние рН на это распределение при 100°С. Результаты показали, что величина δ11Bgas–δ11Bliquid составила 5.9, 3.7, 1.1, 0.8 и –1.3‰ при 100, 200, 250, 300 и 350°С. В щелочной среде коэффициент распределения бора между газом и жидкостью снижается, а изотопный сдвиг возрастает, при 100°С и рН 9.1 равен 17.0. Исследован изотопный состав бора термальных вод Мутновской геотермальной системы (Камчатский п-ов, Россия). В термальных источниках определен большой разброс значений δ11B от 2.8 до 18‰. Такой разброс может объясняться фракционированием бора между газом и жидкостью.
ВВЕДЕНИЕ
Распределение изотопов бора между жидкостью и газом давно обсуждается как фактор фракционирования в гетерофазных гидротермальных системах. На примере геотермальных систем была показана значимость этого явления (Leeman et al., 1992). В ряде экспериментальных работ при температуре 400–450°С в солевых растворах было показано, что эффект фракционирования изотопов между жидкостью и газом незначителен (Spivak et al., 1990; Berndt, Seyfried, 1990; Liebscher et al., 2005). Экспериментальные данные для условий кривой насыщенного пара воды отсутствуют, на сегодняшний день имеются только оценки, выполненные по геотермальным скважинам (Leeman et al., 1992). Эти оценки показывают, что газовая фаза обогащается 11B относительно жидкой воды.
Цель данной работы – экспериментально определить фракционирование бора между жидкостью и газом по линии насыщенного пара воды и сопоставить с природными данными для Мутновской геотермальной системы (Камчатский п-ов, Россия)
МЕТОДИКА ИССЛЕДОВАНИЯ
Фракционирование изотопов бора исследовано в системе H2O–H3BO3. Опыты при 100°С и атмосферном давлении проводили с использованием стеклянной установки, состоящей из колбы с раствором, дефлегматора, холодильника и сборника конденсата. Колба для кипения изготовлена из безборного стекла № 29, приемный холодильник – из кварцевого стекла С-5-1, также не содержащего бора. Колбу подогревали двумя нагревателями для поддержания кипения раствора без перегрева и охлаждения. Конденсат отбирался в полипропиленовые пробирки. В колбу вводили стеклянный электрод ЭСЛ-63-07 для измерения рН при проведении эксперимента. В качестве электрода сравнения использовали выносной хлорсеребряный электрод ЭВЛ-1М3.1 с проточным солевым ключом, заполненным 3.5 М раствором KCl. В качестве исходного использовали раствор борной кислоты (квалификации х. ч., δ11B = –13.4‰) с концентрацией 0.1 моль/кг. В ходе эксперимента из холодильника отбирали порции конденсата 4 мл, затем в кипящий объем добавляли раствор NaOH для изменения рН.
Опыты при повышенном давлении проводили с использованием автоклава из титанового сплава ВТ-8 с отбором газовой фазы через вентиль и систему охлаждения. Нагрев осуществляли в термостате с измерением температуры термопарой и контролем регулятором ОВЕН ТРМ-10. В качестве исходного был использован 1 М раствор борной кислоты. При каждой температуре отбирали 4 мл конденсата со скоростью 1 мл/мин.
Пробы термальных растворов были отобраны в июле 2019 г. на Мутновской геотермальной станции, п-ов Камчатка, Россия. Опробованы жидкая и газовая фазы из скважины ГЕО-6 с использованием сепаратора. Отобраны пробы воды и конденсата из термальных источников Дачные и Медвежьи. Методика отбора проб подробно изложена в работе (Николаева и др., 2015).
Содержание и изотопный состав бора анализировали в The Pheasant Memorial Laboratory for Geochemistry and Cosmochemistry (Institute for Planetary Materials, Okayama University, Tottori, Japan). Образец массой 14–17.6 г переносили в контейнер и упаривали после добавления 20 мкл 1% раствора маннита и 0.1 мл 30 М HF в каждый. Для выделения бора образец пропускали по одному разу, соответственно, через катионообменную и анионообменную смолу (Nakamura et al., 1992). Общий процедурный бланк этой работы составил 2.5 нг (n = 2). Для определения бланка в пустые контейнеры было добавлено 17.6 г воды B-USQ с низким содержанием бора, очищенной путем пропускания через картридж Milli-Q (Nakamura et al., 2003). Концентрацию бора определяли изотопным разбавлением методом ICP-MS на масс-спектрометре iCAP RQ (Thermo Scientific).
Изотопный состав бора определяли методом TIMS на масс-спектрометре TRITON (Thermo Scientific) по методике (Nakamura et al., 1992; Nakano, Nakamura, 1998). Для изотопного анализа использовали приблизительно 1 мкг или 0.3 нг (только для образца И19-1) образца. Аналитическая воспроизводимость, полученная в результате анализа NIST NBS951, составляла ±0.2‰ (2σ, n = 4), а δ11B эталонного стандарта горных пород (JB2) составляла 7.2‰ (n = 2). Все изотопные составы показаны относительно стандарта NIST NBS-951.
Термодинамические расчеты форм нахождения бора в растворе и газовой фазе проведены с использованием программного комплекса HCh (Шваров, 2008). Термодинамические параметры для боратных частиц водного раствора взяты из работы (Акинфиев и др., 2006), газовой B(OH)3 – (Akinfiev, Plyasunov, 2014).
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Коэффициент распределения бора рассчитывался по формуле:
Таблица 1.
Коэффициенты распределения бора и изотопный сдвиг между жидкостью и газом по линии насыщенного пара воды
| Условия опыта | P, МПа | DG/L газ–жидкость |
δ11Bgas – δ11Bliquid, ‰ |
|---|---|---|---|
| 100°C, pH 5.4 | 0.1 | 0.002 | 5.9 |
| 100°C, pH 9.1 | 0.1 | 0.00012 | 17.0 |
| 200°C | 1.5 | 0.019 | 3.7 |
| 250°C | 3.9 | 0.029 | 1.1 |
| 300°C | 8.5 | 0.094 | 0.8 |
| 350°C | 16.3 | 0.275 | –1.3 |
Рис. 1.
Распределение бора между газом и жидкостью по линии насыщенного пара воды: а – компонентное распределение 1 – данная работа; 2 – Стырикович и др., 1960; 3 – Kukuljan et al., 1999; 4 – Nikolaeva, Bychkov, 2005; 5 – термодинамический расчет по (Nikolaeva, Bychkov, 2005). б – распределение изотопов: 1 – данная работа; 2 – различные геотермальные системы (Leeman et al., 1992); 3 – Мутновская геотермальная система (данная работа); 4 – линейная интерполяция экспериментальных данных (данная работа).
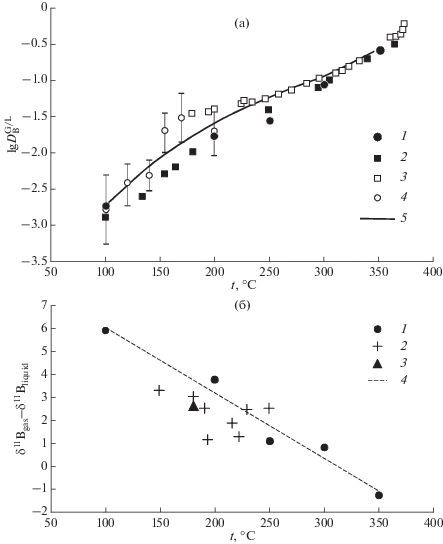
Изотопный сдвиг между жидкостью и газом оказался близок к имеющимся оценкам по геотермальным скважинам (Leeman et al., 1992). Для борной кислоты распределение газ-жидкость приводит к обогащению паровой фазы тяжелым изотопом бора при всех температурах, кроме 350°С.
Температурная зависимость показана на рис. 1б. С повышением температуры изотопный сдвиг ожидаемо уменьшается и при 350°С становится отрицательным. Такое изменение не может быть объяснено обычной температурной зависимостью для коэффициентов изотопного фракционирования ln α = A/T2 + B, как предлагалось в работе (Leeman et al., 1992). Более сложная зависимость определяется формами нахождения бора в жидкой фазе и степенью гидратации молекул борной кислоты (Schmidt et al., 2005). Снижение степени гидратации при приближении к критической точке воды приводит к изменению знака изотопного сдвига. Для распределения бора между рассолом и газом при высокой температуре (Spivak et al., 1990; Berndt, Seyfried, 1990; Liebscher et al., 2005) эти же факторы будут определять фракционирование изотопов, но в более сложной системе. В присутствии других компонентов могут быть устойчивы комплексные соединения борной кислоты, например, с хлорид-ионом (Акинфиев и др., 2006). Поэтому сопоставлять эти результаты с нашими данными трудно. Однако и в этих условиях в ряде экспериментов наблюдаются отрицательные значения изотопного сдвига. Результаты нашей работы позволяют предложить линейное уравнение для интерполяции температурной зависимости изотопного сдвига в интервале t = 100–350°С:
(1)
${{\delta }^{{11}}}{{B}_{{{\text{gas}}}}} - {{\delta }^{{11}}}{{B}_{{{\text{liquid}}}}} = - 0.0285t + 8.9025,$Такая зависимость может быть связана с гидратацией молекул борной кислоты молекулами воды в жидкой фазе. Так, при расчетах фракционирования изотопов бора между борной кислотой и борат-ионом предполагается образование ряда кластеров вида B(OH)3 · nH2O где n = 1–32 (Rustad et al., 2010). В этой же работе показана принципиальная роль тетрагональной формы B(OH)3 · H2O на распределение изотопов бора между разными молекулами в растворе. В газовой фазе присутствуют только молекулы B(OH)3, в которых бор находится в треугольной координации (Pokrovski et al., 2013). Изменение координации приводит к фракционированию изотопов бора.
Фракционирование изотопов бора между газовой и жидкой фазой в зависимости от рН раствора при 100°С показано на рис. 2. При повышении рН в ходе титрования раствора борной кислоты NaOH происходит уменьшение коэффициента распределения газ-жидкость (рис. 2а) и увеличение величины изотопного сдвига (рис. 2б). Такой эффект связан со сменой форм нахождения бора в водной фазе, которая сопровождается изменением координационного числа:
(2)
$\begin{gathered} {\text{B}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{^\circ }\left( {{\text{aq}}} \right) + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{B}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - } + {{{\text{H}}}^{ + }}, \\ {{{\alpha }}_{{34}}} = \frac{{{{{\left( {\frac{{{}^{{{\text{11}}}}{\text{B}}}}{{{}^{{{\text{10}}}}{\text{B}}}}} \right)}}_{{{\text{B(OH}}{{{\text{)}}}_{{\text{3}}}}}}}}}{{{{{\left( {\frac{{{}^{{{\text{11}}}}{\text{B}}}}{{{}^{{{\text{10}}}}{\text{B}}}}} \right)}}_{{{\text{B(OH)}}_{{\text{4}}}^{ - }}}}}}. \\ \end{gathered} $Рис. 2.
Зависимость коэффициента распределения (а) и изотопного сдвига (б) между жидкостью и газом от рН: 1 – данная работа; 2 – термодинамический расчет.
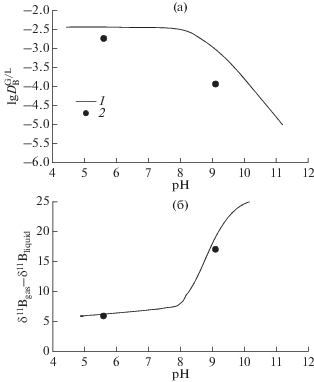
При этом наблюдается большой изотопный сдвиг α34, причем бор в тетраэдрической координации обогащается легким изотопом. Для 100°С отсутствуют прямые экспериментальные измерения фракционирования изотопов бора. Определено фракционирование изотопов бора в морской воде при 25 и 40°С (Klochko et al., 2006). Существуют многочисленные работы по расчету температурной зависимости α34. Наиболее близкий температурный интервал 0–40°С рассчитан в работе (Rustad et al., 2010), эти данные хорошо согласуются с экспериментальными измерениями (Klochko et al., 2006). Экстраполяция температурной зависимости α34 на 100°С дает оценку 1.020. Это значение принято для термодинамических расчетов изотопного сдвига жидкость–газ.
Расчет зависимости коэффициента распределения между жидкостью и газом DG/L для концентрации бора в жидкой фазе 0.1 моль/кг показан на рис. 2а. Наши данные лежат ниже, чем расчет по данным, рекомендованным в работе (Akinfiev, Plyasunov, 2014). В водном растворе преобладающими формами бора во всех случаях являются ${\text{B}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{^\circ }\left( {{\text{aq}}} \right)$ и ${\text{B}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - }.$ Доля полиборных кислот ${{{\text{B}}}_{{\text{2}}}}{\text{O}}\left( {{\text{OH}}} \right)_{{\text{5}}}^{ - },$ ${{{\text{B}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - },$ ${{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{{\text{5}}}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{{{\text{2}} - }}$ и комплекса ${\text{NaB}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{^\circ }\left( {{\text{aq}}} \right)$ незначительна, и не влияет на рН зависимость фракционирования изотопов.
В этом случае, используя оценку величины α34, можно рассчитать изотопный состав форм ${\text{B}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{^\circ }\left( {{\text{aq}}} \right)$ и ${\text{B}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - }.$ Используя полученное нами экспериментальное значение изотопного сдвига для B(OH)3 между газом и жидкостью, можно рассчитать зависимость δ11Bgas–δ11Bliquid от рН. Эта зависимость показана на рис. 2б. Очевидно, что точка в кислой области совпадает, но и значение при рН 9.1 также удовлетворительно согласуется с расчетом.
Изотопный состав бора в глубинном растворе Мутновской геотермальной системы составил δ11B = 3.9‰ (табл. 2), в конденсате газовой фазы δ11B = 6.5‰, что также показывает обогащение газовой фазы тяжелым изотопом. Положение точки изотопного сдвига показано на рис. 1б. Это значение лежит ниже линии, описываемой уравнением (1), но удовлетворительно согласуется с другими геотермальными системами (Leeman et al., 1992).
Таблица 2.
Содержание бора в воде и конденсатах Мутновской геотермальной системы и изотопный состав бора в жидкой фазе
| Проба | Объект | t °C | pH | B мг/л жидкость |
δ11B‰ жидкость |
B мг/л конденсат |
DG/L |
|---|---|---|---|---|---|---|---|
| И19-1 | Дачные источники | 99.3 | 3.15 | 0.0225 | 2.8 | 0.0010 | 0.0456 |
| И19-5 | Медвежьи источники | 98.8 | 3.89 | 0.1296 | 6.1 | 0.0006 | 0.0046 |
| И19-15 | Дачные источники | 96.1 | 2.85 | 0.1159 | 18.1 | 0.0038 | 0.0332 |
| И19-17 | Скв. ГЕО-6 | 165 | 8.38 | 25.9 | 3.92 | 0.142* | 0.0055 |
Термальные источники на поверхности Мутновской геотермальной системы рассматриваются как выходы пара, отделившегося от глубинного резервуара термальных вод. Конденсация этого пара может приводить к существенному разделению изотопов бора за счет изотопного исчерпания при последовательной конденсации. Как видно из табл. 2, величины δ11B для Дачных источников меняются от 2.8 до 18.1%. Отсутствие равновесия между жидкостью и газом может быть причиной высоких значений коэффициентов распределения бора между газом и жидкостью для этих источников. Зачастую в них наблюдаются высокие концентрации бора в газовой фазе, сопоставимые или превосходящие содержание в жидкости (Николаева и др., 2005).
ЗАКЛЮЧЕНИЕ
Фракционирование изотопов бора между жидкостью и газом имеет большое значение для исследования современных геотермальных систем (Pokrovski et al., 2013). При этом необходимо учитывать формы нахождения бора в водных растворах, от которых зависит величина изотопного сдвига. С учетом полученных нами результатов изотопный состав бора для рудных месторождений может быть использован не только для определения источника вещества, но и быть индикатором процессов кипения и конденсации гидротермальных растворов.
Экспериментальные исследования и термодинамические расчеты выполнены при поддержке РНФ 19-17-00200, полевые работы при поддержке РФФ-И, проект 17-05-00257, изотопные исследования при поддержке Joint Use/Research Center for “Earth and Planetary Materials Sciences” (IPM).
Список литературы
Акинфиев Н.Н., Воронин М.В., Зотов А.В., Прокофьев В.Ю. (2006) Экспериментальное исследование устойчивости хлорборатного комплекса и термодинамическое описание водных компонентов в системе B‒Na–Cl–O–H до 350°С. Геохимия. (9), 937-949. Akinfiev N.N., Voronin M.V., Zotov A.V., Prokof’ev V.Yu. (2006) Experimental investigation of the stability of a chloroborate complex and thermodynamic description of aqueous species in the B–Na–Cl–O–H System up to 350°C. Geochem. Int. 44(9), 867-878.
Николаева И.Ю., Бычков А.Ю. (2007) Распределение бора между газовой и жидкой фазами гидротерм Мутновского вулкана (Камчатка). Вестник КРАУНЦ. 9(2), 3-13.
Стырикович М.А., Цхвирашвили Д.Г., Небиеридзе Д.П. (1960) Исследование растворимости борной кислоты в насыщенном водяном паре. ДАН СССР. 134(3), 615-617.
Шваров Ю.В. (2008) HCh: новые возможности термодинамического моделирования геохимических систем, предоставляемые Windows. Геохимия. (8), 898-903.
Shvarov Y.V. (2008) HCh: new potentialities for the thermodynamic simulation of geochemical systems offered by Windows. Geochem. Int. 46(8), 834-839.
Akinfiev N.N., Plyasunov A.V. (2014) Application of the Akinfiev–Diamond equation of state to neutral hydroxides of metalloids (B(OH)3, Si(OH)4, As(OH)3) at infinite dilution in water over a wide range of the state parameters, including steam conditions. Geochim. Cosmochim. Acta. 126, 338-351.
Klochko K., Kaufman A.J., Yao W.S., Byrne R.H., Tossell J.A. (2006) Experimental measurement of boron isotope fractionation in seawater. Earth Planet Sci. Lett. 248, 276-285.
Kukuljan J.A., Alvarez J.L., Fernandez-Prini R. (1999) Distribution of B(OH)3 between water and steam at high temperatures. J. Chem. Thermodynamics. 31, 1511-1521.
Leeman W.P., Vocke R.D., McKibben M.A. (1992) Boron isotopic fractionation between coexisting vapor and liquid in natural geothermal systems. Proc 7th Int Sympos on water-rock interaction-WRI-7. Balkema, Rotterdam, 1007-1010.
Liebscher A., Meixner A., Romer R.L., Heinrich W. (2005) Liquid-vapor fractionation of boron and boron-isotopes: Experimental calibration at 400°C/23 MPa to 450°C/42 MPa. Geochim. Cosmochim. Acta. 69, 5693-5704.
Nakamura E., Ishikawa T., Birk J.L., Allègre C.J. (1992) Precise boron isotopic analysis of natural rock samples using a boronmannitol complex. Chem. Geol. 94, 193-204.
Nakamura E., Makishima A., Moriguti T., Kobayashi K., Sakaguchi C., Yokoyama T., Tanaka R., Kuritani T., Takei H. (2003) Comprehensive geochemical analyses of small amounts (100 mg) of extraterrestrial samples for the analytical competition related to the sample-return mission, MUSES-C. The first Open Competition for the MUSES-C Asteroidal Sample Preliminary Examination Team, The Institute of Space and Astronautical Science Report. (16), 49-101.
Nakano T., Nakamura E. (1998) Static multicollection of ${\text{C}}{{{\text{s}}}_{{\text{2}}}}{\text{BO}}_{{\text{2}}}^{ + }$ ions for precise boron isotope analysis with positive thermal ionization mass spectrometry. Int. J. Mass Spectrom. Ion Processes. 176, 13-21.
Nikolaeva I.Y., Bychkov A.Yu. (2005) Experimental study of boron transport in vapor phase to 200°C. Geochim. Cosmochim. Acta. 69(10), A740.
Pokrovski G.S., Borisova A.Y., Bychkov A.Y. (2013) Speciation and transport of metals and metalloids in geological vapors. Rev. Mineral. Geochem. 76, 165-218.
Pokrovski G.S., Schott J., Sergeyev A.S. (1995) Experimental determination of the stability constants of ${\text{NaSO}}_{{\text{4}}}^{ - }$ and ${\text{NaB}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{^\circ }$ in hydrothermal solutions using a new high-temperature sodium-selective glass electrode – Implications for boron isotopic fractionation. Chem. Geol. 124(3–4), 253-265.
Rustad J.R., Bylaska E.J., Jackson V.E., Dixon D.A. (2010) Calculation of boron-isotope fractionation between B(OH)3(aq) and ${\text{B}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{ - }\left( {{\text{aq}}} \right).$ Geochim. Cosmochim. Acta. 74, 2843-2850.
Schmidt C., Thomas R., Heinrich W. (2005) Boron speciation in aqueous fluids at 22 to 600°C and 0.1 MPa to 2 GPa. Geochim. Cosmochim. Acta. 69, 275-281.
Spivack A.J., Berndt M.E., Seyfried W.E. Jr. (1990) Boron isotope fractionation during supercritical phase separation. Geochim. Cosmochim. Acta. 54, 2337-2339
Дополнительные материалы отсутствуют.


