Геохимия, 2020, T. 65, № 2, стр. 145-152
Биотрансформация нептуния в модельных подземных водах
А. П. Новиков a, *, А. В. Сафонов b, **, Т. Л. Бабич c, ***, К. А. Болдырев d, Д. В. Крючков d, Е. А. Лавринович a, Е. В. Кузовкина a, А. М. Емельянов a, Т. А. Горяченкова a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
c Институт микробиологии им. С.Н. Виноградского ФИЦ Биотехнологии РАН
117312 Москва, просп. 60-летия Октября, 7, корп. 2, Россия
d Институт безопасного развития атомной энергетики РАН (ИБРАЭ РАН)
115191 Москва, Большая Тульская ул., 52, Россия
* E-mail: novikov@geokhi.ru
** E-mail: alexeysafonof@gmail.com
*** E-mail: microb101@yandex.ru
Поступила в редакцию 13.02.2019
После доработки 25.03.2019
Принята к публикации 27.03.2019
Аннотация
Изучена кинетика восстановления Np(VI и V) в модельной пластовой воде в присутствии накопительной культуры микроорганизмов, выделенной из глубинного хранилища жидких радиоактивных отходов ОАО “СХК”. Полученные данные свидетельствуют о химической неустойчивости Np (VI) в изученной системе. Процесс восстановления нептуния (V) зависел от его начальной концентрации и присутствия микроорганизмов. В пробах с микробиотой скорость восстановления значительно возрастала и происходило образование частиц с нептунием размером более 200 нм. При концентрациях нептуния менее 10–7 М константы скорости восстановления не зависели от содержания радионуклида (период полупревращения 36–40 сут). Увеличение концентрации до 10–6 М приводило к двукратному уменьшению константы скорости восстановления.
ВВЕДЕНИЕ
На Сибирском химическом комбинате (СХК) для утилизации жидких радиоактивных отходов (ЖРО) применяется их захоронение в глубоко залегающие пласты осадочных пород (Рыбальченко и др., 1994). Установлено, что латеральная и вертикальная миграция радионуклидов и, в частности, наиболее опасных альфа-излучающих, долгоживущих актинидов в пласте-коллекторе составляет не более чем несколько десятков метров от нагнетательной скважины (Зубков и др., 2002). Причинами возникновения геохимического противомиграционного барьера могут быть сорбция на вмещающих породах, коллоидообразование, микробиологическая трансформация и биоаккумуляция.
Ранее (Novikov, 2010), при исследовании скорости вертикального и латерального распространения радионуклидов в подземных экосистемах, было отмечено, что поведение актинидов в исследуемых водах аналогично их поведению в низших состояниях окисления. Последние отличает повышенная склонность к коллоидообразованию и сорбции. Для объяснения этого факта использовались только абиотические факторы – высокая концентрация нитрит-ионов в закачиваемых отходах и достаточно низкие значения Eh пластовых вод (100–200 mV) (Новиков и др., 2018). Однако, в настоящее время в лабораторных условиях активно изучается влияние микробиологических процессов на окислительно-восстановительные превращения актинидов. Так, Д. Лавли и соавторы (Lovley et al., 1991) первыми обнаружили, что микроорганизмы Geobacter metallireducens и Shewanella putrefaciens (Alteromonas putrefaciens) могут использовать U(VI) в качестве акцептора электронов, восстанавливая его до U(IV), который осаждается в виде малорастворимого UO2. Подобные работы проведены рядом авторов и для нептуния. Риттман изучил восстановление и биоосаждение нептуния (Rittmann et al., 2002) с сообществом сульфатредуцирующих микроорганизмов. В работе (Icopini et al., 2007) изучено восстановление нептуния двумя чистыми культурами железоредуцирующих бактерий Geobacter metallireducens и Shewanella oneidensis. Было доказано ферментативное восстановление металла микробными клетками и комплексообразование органическими лигандами, что исследователи связывают с механизмом уменьшения его токсичности для клетки. В целом, в немногочисленных работах по оценке биологических факторов в миграции нептуния приведена оценка двух механизмов: биогенном – восстановление металлов за счет ферментативных свойств бактериальной клетки и биогенно-опосредованном – восстановление металлов в малорастворимых формах клеточными метаболитами (Thorpe et al., 2015; Williamson., 2016). Целью настоящей работы являлось исследование форм нахождения нептуния в растворе, моделирующем состав пластовой воды, содержащей жидкие радиоактивные отходы, в зависимости от присутствия в среде микробиоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты и методы исследования
В экспериментах использовали радиохимически чистый 237Np в модельной пластовой воде. Np (VI) получали по стандартной процедуре (Ivanova et al., 1994) окислением броматом калия (KBrO3). Модельная пластовая вода (МПВ) была приготовлена на основании усредненных значений содержания ионов в пробах верхнего водоносного горизонта АО “СХК”, исследованных в предыдущих работах (Safonov et al., 2010). В литре дистиллированной воды содержалось (мг): Na+ – 136.9; K+ – 4.5; Mg2+ – 4.8; Ca2+ – 7.3; ${\text{HCO}}_{{\text{3}}}^{ - }$ – 363.1; Cl– – 12.9; ${\text{HPO}}_{{\text{4}}}^{{{\text{2}} - }}$ – 5.5; ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}$ – 2.1; ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ – 15.6, глюкоза – 1000; pH 7.0.
МПВ объемом 10 мл помещали в пенициллиновые флаконы, используя аргон в качестве газовой фазы. Продувку аргоном проводили каждую неделю эксперимента. После продувки аргоном в первый день эксперимента в раствор добавляли 0.3 мл культуральной жидкости с накопительной культурой из пробы подземных вод водоносного горизонта площадка 18 АО “СХК” (глубина 330 м). Использованная в работе накопительная культура была получена путем первичного посева пробы пластовой жидкости на низко минерализованную анаэробную питательную среду следующего состава (г/л): NH4Cl – 1.0, K2HPO4 – 1.5, KH2PO4 – 0.8, CaCO3 – 0.2, NaCl – 0.8, MgSO4 · 7H2O – 0.1, KCl – 0.1, NaNO3 – 1.0, дрожжевой экстракт – 0.5, глюкоза – 5.0. Газовой фазой служил аргон. Эксперимент проводили при температуре 22–23°С, близкой к оптимальной для развития микрофлоры, установленной ранее (Safonov et al., 2018). Известно, что среднегодовая температура глубинных водоносных горизонтов в районе АО “СХК” колеблется в районе 9–11°С, при этом, в зоне дисперсии отходов возможно ее локальное повышение до 12–15°С, а в зоне работы нагнетательных скважин до 100–120°С за счет процессов радиолиза.
Таким образом, было приготовлено 18 флаконов с рабочим раствором (МПВ с микробиотой) и 6 – с МПВ без внесения микробиоты (бланковый опыт). В 12 флаконов был введен Np (VI) и в 12 флаконов Np (V) в концентрации 1 – 10–8 М, 2 и K – 10–7 M, 3 – 10–6 M, где К – бланковый опыт (концентрация 237Np 10–7 М). Расчет проводили по 3-м параллельным измерениям.
Кроме того, для измерения Eh, были подготовлены флаконы объемом 20 мл с МПВ, содержащие микробиоту (11 проб) и без микробиоты (11 проб).
Для определения 237Np был использован метод люминесценции на активированных кристаллофосфорах (предел обнаружения – 0.3 пг) (Novikov et al., 2016). Методика прямого люминесцентного определения актинидов состояла в нанесении аликвоты анализируемого раствора на кристаллофосфор (объем анализируемой пробы может варьироваться от 0.02 до 0.1 мл), находившегося в кварцевом стаканчике, высушивании под ИК лампой, прокаливании образца на электрической плитке в течение 45 мин и окончательном прокаливании в муфельной печи в течение 1 часа при 900оС. Далее на анализаторе ЛФФ-5 измеряли интенсивность люминесценции образца – для 237Np(V) в ближнем ИК диапазоне (1713 нм). Для 237Np(V) наиболее эффективным кристаллофосфором являлся PbMoO4 (Myasoedov, Novikov, 1997). Люминесценция на активированных кристаллофосфорах позволяет определять степени окисления актинидов. В зависимости от состояния окисления актинидов они образуют различные соединения с кристаллофосфором. Так, Np(VI), внесенный на кристаллофосфор (PbMoO4) в виде аликвоты азотнокислого раствора, образует соединение аналогичное PbUO2(MoO4)2 (Вейгель, 1991), которое не дает сигнала люминесценции в ИК-области. Np(V) и Np(IV) образуют соединение аналогичное (Pb2Pu(MoO4)4) (Вейгель и др., 1997, Фейхи, 1991), которое дает сигнал люминесценции. Однако, если на кристаллофосфор внести раствор с гидроксидом любой окислительной формы, сигнал люминесценции будет фоновым. Это объясняется тем, что при прокаливании на воздухе гидроксид 237Np в любой степени окисления образует двуокись, которая не взаимодействует с кристаллофосфором.
В ходе анализа из флакона в анаэробных условиях отбирали шприцом аликвоту жидкости (0.1 мл), помещали на кристаллофосфор (PbMoO4 и CaF2) и определяли окислительные формы 237Np по люминесценции в различных диапазонах спектра. 237Np(VI) на кристаллофосфоре CaF2 определяли по сигналу люминесценции в видимой части спектра. Np(V) – в ИК-области. Np(IV) в модельной грунтовой воде образовывал псевдоосадок и, возможно, полимерные коллоидные частицы, которые кристаллофосфор не активировали. Поэтому его содержание определяли по разнице известной общей концентрации нептуния и высших окислительных форм.
В ультрафильтрационных экспериментах использовали центрифужные фильтрационные вкладыши Amicon. Для анализа на общее содержание 237Np осадок растворяли в 3 M HNO3.
Для анализа генов 16S рРНК микробного сообщества проводили фильтрацию 1.5 л пробы пластовой воды, предварительно зафиксированной сразу после отбора спиртом до 40 мас. % на ацетатцеллюлозных мембранах с диаметром пор 0.22 мкм (Владипор, г. Владимир).
Выделение ДНК из фильтров с биомассой проводили в Балтийском федеральном университете (БФУ им. И. Канта) с использованием набора реактивов ZymoBIOMICS™ DNA Miniprep Kit (Zymo Research, США) согласно инструкции производителя. При подготовке библиотек для амплификации были выбраны вариабельные участки гена 16S рРНК региона V3–V4.
Амплификацию проводили путем ПЦР в реальном времени на приборе CFX96 Touch (Bio-Rad, США) с использованием реакционной смеси qPCRmix-HS SYBR (Евроген, Россия). Далее осуществлялось высокопроизводительное секвенирование с помощью системы MiSeq (Illumina, США) с использованием набора реагентов MiSeq Reagent Kit v2 (500cycle) (Illumina, США).
Оценку численности клеток различных физиологических групп бактерий в 1 см3 жидкой пробы проводили методом ее посева на селективные питательные среды, описанным ранее методом (Nazina et al., 2010).
Результаты рассчитывали методом наиболее вероятного числа по таблице Мак-Креди. Микробиологический мониторинг вели, используя среды, приведенные ранее (Косарева и др., 2007). Численность аэробных органотрофов учитывали в среде (TYEG), содержащей бакто-триптон (5.0 г/л), дрожжевой экстракт (2.5 г/л), глюкозу (1.0 г/л), pH среды около 7.0. Сульфатвосстанавливающие бактерии анализировали по приросту сероводорода в конечных разведениях в среде Постгейта с молочнокислым натрием, дополненной 100 мг/л Na2S · 9H2O. Денитрифицирующие бактерии обнаруживали по появлению молекулярного азота в минеральной среде Адкинса, дополненной ацетатом натрия (2.0 г/л) в качестве источника углерода и энергии и нитратом натрия (1.0 г/л) в качестве акцептора электронов. Бактерии с бродильным типом метаболизма учитывали по образованию водорода в конечных разведениях в среде с пептоном (4.0 г/л) и глюкозой (10.0 г/л).
Геохимические расчеты проводили при использовании методологии расчета эволюции свойств каскада инженерных барьеров DESTRUCT (Болдырев и др., 2017) при помощи включенного в нее РК PhreeqC 2.18 (Parkhurst, Appelo, 1999). При моделировании производился расчет индексов насыщения твердых минеральных фаз нептуния в зависимости от кислотности окислительно-восстановительного уровня среды. Индексы насыщения (SI), определялись как:
где IAP – произведения активности соответствующих ионов, Ks – константа равновесия. При значении SI > 0 прогнозируется образование рассматриваемой фазы. При моделировании применяли базы термодинамических данных llnl.dat. Переход между Np(IV) и Np(V) определялся уравнением:Характеристики растворимости используемые в расчете фаз нептуния приведены ниже:
NaNpO2CO3 : 3.5H2O
$\begin{gathered} {\text{NaNp}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}:{\text{3}}.{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{H}} + = {\text{HCO}}_{{\text{3}}}^{ - } + {\text{N}}{{{\text{a}}}^{ + }} + \\ + \,\,{\text{NpO}}_{{\text{2}}}^{ + } + {\text{3}}.{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O}},\,\,\,\,{\text{lgk}}\,\,{\text{1}}.{\text{2342}}. \\ \end{gathered} $
Np(OH)4
Np2O5
NpO2
NpO2(OH)2
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Микробиологическая характеристика использованной накопительной культуры
По данным молекулярно-биологического анализа в пробе подземной воды, используемой в работе, обнаружены микроорганизмы, способные участвовать в осуществлении реакций циклов углерода, азота, серы и железа, включая аэробные органотрофные, тионовые и нитрифицирующие бактерии, и анаэробные бактерии с бродильным типом метаболизма, денитрифицирующие и железоредуцирующие бактерии. Были выявлены гены 16S рРНК бактерий цикла серы – представители родов Sulfuricurvum, Thiobacillus, Acidiferrobacter, Sulfuritalea, Simplicispira, Sulfuricella, Sulfuriferula; денитрифицирующих бактерий (рода Pseudomonas, Denitratisoma и др.). Были обнаружены последовательности генов 16S рРНК железоредуцирующих бактерий рода Shewanella, известной способностью восстанавливать железо, уран, плутоний, технеций и нептуний (Macaskie, 1991; Lloyd et al., 2002; Lovley, Phillips, 1992; Ляликова, Хижняк, 1996). Численность бактерий различных функциональных групп в исследуемой пробе пластовой воды представлена в табл. 1.
Таблица 1.
Численность бактерий различных физиологических групп в пробе пластовой воды из глубинного горизонта (кл/см3)
| Микроорга-низмы | Аэробные органотрофные | Бродильные | Денитрифи-цирующие | Сульфатреду-цирующие | Железореду-цирующие |
|---|---|---|---|---|---|
| Число клеток | 104 | 102 | 104 | 10 | 10 |
Максимальная численность наблюдалась у аэробных органотрофных и анаэробных денитрифицирующих бактерий. Необходимо отметить, что многие денитрифицирующие бактерии могут использовать кислород в качестве окислителя органических веществ, являясь факультативными анаэробными организмами, тем самым внося свой вклад в общую численность аэробных органотрофных бактерий. Численность сульфатредуцирующих и железовосстанавливающих микроорганизмов в исследованной пробе была невысока. При этом многие денитрификаторы, например, представители родов Pseudomonas и Shewanella, могут восстанавливать трехвалентное железо.
Изучение физико-химических форм нахождения радионуклидов в растворах, моделирующих состав пластовых вод
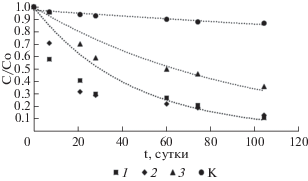
По результатам модельного эксперимента Np(VI) оказался не устойчив в данной системе. Приблизительно через 1 ч после добавления раствора 237Np в микробиологическую среду и бланковый раствор 237Np на 50% был восстановлен до Np(V) (рис. 1). Через 7 сут эта форма 237Np полностью отсутствовала как в растворе с микробиотой, так и бланковом растворе. Скорость восстановления Np(VI) не зависела от общей концентрации нептуния и наличия микробиоты в среде.
Рис. 1.
Окислительные формы 237Np в МПВ через 1 ч после добавления 237Np(VI) в модельные растворы. Исходная концентрация Np(VI): 1 – 10–8 М; 2 и K – 10–7 M, 3 – 10–6 M.
Выявлено, что кинетика и квазиравновесие процесса восстановления Np(V) сильно зависели от наличия микробиоты и исходной концентрации нептуния. В контрольном эксперименте восстановление проходило только на 13%. Что может объясняться частичным диспропорционированием нептуния (процесс известный в кислых средах) с осаждением гидроокиси Np(IV). Это подтверждается термодинамическими данными (Puigdomenech, 1983), в соотвествии с которыми при pH 7.0 и Eh 0 мВ нептуний будет постепенно переходить в кристаллическую форму NpO2.
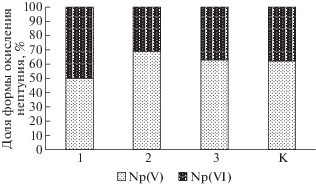
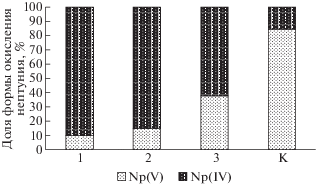
При введении в систему биомассы микроорганизмов эффективность восстановления 237Np была значительно выше, чем в контрольных пробах. Так, через 104 суток от начала эксперимента остаток Np(V) составлял от 11 до 36% в зависимости от его концентрации (рис. 2). Чем выше была концентрация нептуния, тем большая его часть не восстанавливалась до Np(IV). Это объяснимый результат учитывая, что концентрация восстанавливающих бактерий постоянная.
Рис. 2.
Формы 237Np в растворе после 104-х сут выдержки с микробиотой в зависимости от его концентрации: 1 – 10–8 М, 2 и K – 10–7 M, 3 – 10–6 M.
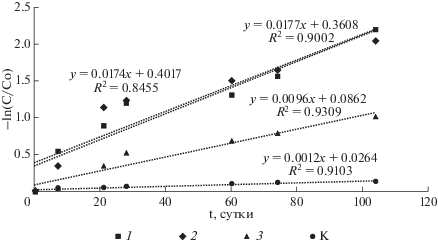
При концентрациях 237Np 10–8–10–7 М константы скорости процесса его восстановления не зависели от количества нептуния (рис. 3, 4). Однако, при концентрации 237Np 10–6 М константа скорости восстановления была в 2 раза ниже, чем для микроколичеств (рис. 4). Причем кинетика процесса при большой концентрации практически соответствует уравнению 1 порядка. А при микроконцентрациях начальный участок кинетической кривой вздернут и в полулогарифмических координатах экстраполяционная зависимость не пересекает их начало, а отсекает участок на вертикальной оси. Это свидетельствует о повышенной скорости восстановления в первые сутки. Возможно, продукты жизнедеятельности бактерий содержат некоторые редокс-способные реагенты, начальная концентрация которых соизмерима с микроколичествами 237Np, но затем снижается в процессе восстановлении металла. Другим механизмом микробного восстановления 237Np может являться его прямое энзиматическое восстановление и осаждение в виде клеточных и внеклеточных фосфатов, что описано для бактерий рода Serratia (ранее Citrobacter) (Macaskie et al., 2000). Неорганические фосфаты важные соединения для клеток бактерий, входящие состав клеточной мембраны, нуклеиновых кислот и запасающиеся в цитоплазме эффективно осаждают U(VI), Am(III) и Th(IV) в малорастворимых комплексах (Renshaw et al., 2007).
Рис. 4.
Кинетика процесса восстановления Np(VI) в полулогарифмических координатах: 1 – 10–8 М, 2 и K – 10–7 M, 3 – 10–6 M.
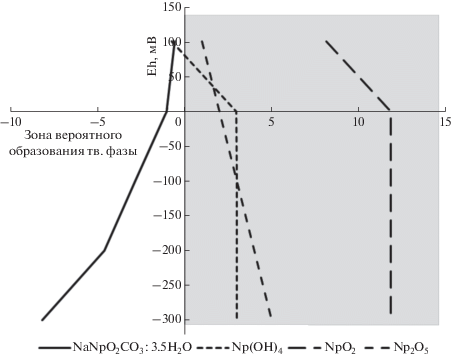
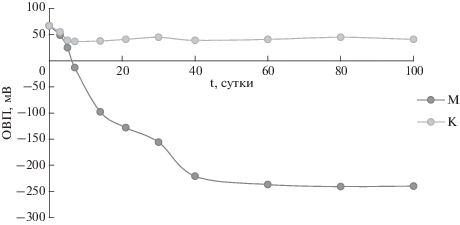
Одним из механизмов, ответственных за восстановление 237Np в присутствии микроорганизмов, может является потребление окислителей и дальнейшее восстановление 237Np при низких значениях окислительно-восстановительного потенциала (ОВП) системы. Для выявления механизма процесса был проведен эксперимент по измерению ОВП среды с использованием модели пластовой жидкости (рис. 5) при разных концентрациях 237Np после добавления глюкозы. На седьмые сутки эксперимента установлено снижение ОВП до нулевых значений, а после сороковых, значения достигли –250, при этом концентрация 237Np не влияла на изменение редокс условий среды.
Рис. 5.
Кинетика изменения окислительно-восстановительного потенциала в системе. М – МПВ с введением микробиоты, К – бланковый опыт.
На основании данных эксперимента был проведен расчет в коде PhreeqC 2.18 форм 237Np при различных значениях ОВП (рис. 6). На основании расчета, можно предположить, что при Eh 0–100 мВ и ниже наиболее вероятна форма нахождения 237Np(IV). Фаза Np(OH)4 соответствует быстрообразующемуся аморфному гидроксиду, который в дальнейшем переходит в более закристаллизованный оксид 237NpO2, вероятность быстрого образования которого низка. Данная фаза, согласно расчетам, начинает образовываться при Eh в районе 0 мВ и ниже. Результаты моделирования указывают на явное требование совершенствования баз термодинамических данных по твердым минеральным фазам нептуния.
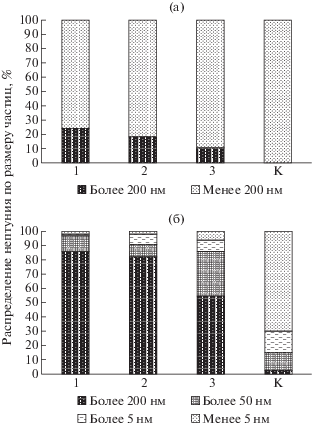
Ультрафильтрационное исследование распределения 237Np по частицам различного размера показало, что через 21-е сут в растворе появляются частицы, содержащие нептуний, размером более 200 нм (рис. 7). По данным по восстановлению (рис. 3) за этот период в растворах с микробиотой появляется от 30% до 70% Np(IV), если первоначально 237Np был в состоянии окисления +5, и от 30% до 40%, если первоначально 237Np был в состоянии окисления +6. Учитывая, что актиниды в состоянии окисления +4 весьма склонны к процессам гидролитической полимеризации, продукты которых могут образовывать достаточно крупные частицы за счет ассоциации и адсорбции (биоаккумуляции). Содержание частиц, аккумулирующих 237Np, на фильтре 200 нм составило 15–18 и 11–25% для исходных фильтруемых растворов с Np(VI) и Np(V), соответственно. Обращает на себя внимание, что в контрольном растворе частиц крупнее 200 нм не обнаружено. После 104-х сут, когда нептуний в растворах с микробиотой восстановился на 60–90% в зависимости от концентрации металла (рис. 2), количество частиц крупнее 200 нм возросло до 60–80%. Вместе с тем, 237Np находится в составе частиц различного размера. В контрольном растворе (без микробиоты) 237Np в основном обнаружен в составе коллоидных частиц размером 5–50 нм. Содержание частиц, аккумулирующих нептуний, на фильтре 200 нм составляет 15–18 и 11–25% для исходных фильтруемых растворов Np(VI) и Np(V), соответственно.
ЗАКЛЮЧЕНИЕ
В пластовой воде II горизонта, отобранной в зоне закачки ЖРО на СХК, обнаружены аэробные органотрофные (до 104 кл/мл) и анаэробные бродильные (102–105 кл/мл), денитрифицирующие (10–104 кл/мл), сульфатредуцирующие (0–10 кл/мл) и метанобразующие микроорганизмы (0–102 кл/мл). Железоредуцирующие бактерии выявлены в 50% исследованных проб. Использованная в работе накопительная культура микроорганизмов была получена путем посева пробы пластовой жидкости на низкоминерализованную анаэробную питательную среду. Микробиоту добавляли в растворы модельной пластовой воды.
Np(VI) оказался в данной системе неустойчив. Приблизительно через 1 ч после добавления раствора 237Np в микробиологическую среду и бланковый раствор 237Np на 50% был восстановлен. Через 7 сут эта форма 237Np полностью отсутствовала как в растворе с микробиотой, так и бланковом растворе. Результаты эксперимента соответствовали термодинамическому расчету.
Процесс восстановления Np(V) сильно зависел от наличия микробиоты и концентрации нептуния. В бланковом эксперименте восстановление проходило только на 13%. При введении микробиоты скорость восстановления значительно возрастала, например, через 104 сут остаток Np(V) составляет от 11 до 36% в зависимости от его концентрации. Чем выше концентрация 237Np, тем большая его часть не восстанавливается до Np(IV). Это объяснимый результат учитывая, что концентрация восстанавливающих бактерий постоянная. При концентрациях нептуния 10–8–10–7 М константы скорости процесса восстановления не зависели от содержания 237Np (период полупревращения 36–40 сут). При концентрации 237Np 10–6 М константа скорости восстановления была в 2 раза ниже, чем для микроколичеств (период полупревращения 72 сут). Причем кинетика процесса при большой концентрации практически соответствует уравнению 1 порядка.
Ультрафильтрационное разделение частиц на мембранах с разным диаметрам пор и анализ растворенных осадков подтвердил образование крупных частиц размером более 200 нм в модельных растворах с микробиотой. Без микробиоты (бланковый опыт) такие частицы не были обнаружены.
Исследование выполнено за счет гранта Российского научного фонда (проект № 17-17-01212).
Список литературы
Болдырев К.А., Крючков Д.В., Мартынов К.В., Нужный А.С., Сускин В.В. (2017) Разработка расчетных методов оценки миграции радионуклидов за пределы ИББ с учетом их эволюции. Препринт ИБРАЭ № IBRAE-2017-11 – Москва: ИБРАЭ РАН, 23.
Вейгель Ф. (1991). Уран. Химия актиноидов. (Под ред. Кац Дж., Сиборг Г., Морс Л.). М.: Мир. 1, 355-358.
Вейгель Ф., Кац Дж., Сиборг Г. (1997). Плутоний. Химия актиноидов. (Под ред. Кац Дж, Сиборг Г., Морс Л.) М.: Мир 2, 351-354.
Зубков А.А., Макарова О.В., Данилов В.В., Захарова Е.В., Каймин Е.П., Меняйло К.А., Рыбальченко А.И. (2002) Техногенные геохимические процессы в песчаных пластах-коллекторах при захоронении жидких радиоактивных отходов. Геоэкология (2), 133–144.
Косарева И.М., Сафонов А.В., Савушкина М.К., Ершов Б.Г., Кабакчи С.А., Ревенко Ю.А., Хафизов Р.Р., Бондин В.В., Назина Т.Н. (2007). Физико-химический и микробиологический контроль полигонов глубинного удаления жидких радиоактивных отходов. Атомная энергия 103(2), 106-112.
Ляликова Н.Н., Хижняк Т.В. (1996) Восстановление гептавалентного технеция ацидофильными бактериями рода Thiobacillus. Микробиология 65(4), 533-539.
Новиков А.П., Захарова Е.В., Горяченкова Т.А., Кузовкина Е.В., Емельянов А.М. (2018) Фракционирование коллоидного вещества пластовых вод при глубинном захоронении радиоактивных отходов. Геохимия (7), 718-724.
Novikov A.P., Zakharova E.V., Goryachenkova T.A., Kuzovkina E.V., Emel’yanov A.M. (2018) Fractionation of Colloidal Matter of Stratal Waters during Deep Burial of Radioactive Wastes. Geochem. Int. 56(7), 743-749.
Рыбальченко А.И., Пименов М.К., Костин П.П. (1994) Глубинное захоронение жидких радиоактивных отходов. М.: ИздАТ, 256 с.
Фейхи Д. (1991) Химия актиноидов. М.: Мир, 1, 490-491.
Icopini G.A., Boukhalfa H., Neu M.P. (2007) Biological reduction of Np(V) and Np(V) citrate by metal-reducing bacteria. Environ. Sci. Technol. 41(8), 2764-2769.
Ivanova S.A., Mikheeva M.N., Novikov A.P., Myasoedov B.F. (1994) Preconcentration of neptunium by supported liquid membranes for luminescent analyses of environmental samples. J. Radioanal. Nucl. Chem., Lett. (186), 341-345.
Lloyd J.R., Chesnes J., Glasauer S., Bunker D.J., Livens F.R., Lovley D.R. (2002) Reduction of actinides and fission products by Fe(III)-reducing bacteria. Geomicrobiol. J. (19), 103-120.
Lovley D.R., Phillips E.J. (1992) Reduction of uranium by Desulfovibrio desulfuricans. Appl. Environ. Microbiol. 58(3), 850-856.
Lovley D.R., Phillips E.J.P., Gorby Y.A., Landa E.R. (1991) Microbial reduction of uranium. Nature (350), 413-416.
Macaskie L.E. (1991) The application of biotechnology to the treatment of wastes produced from the nuclear fuel cycle: biodegradation and bioaccumulation as a means of treating radionuclide-containing streams. Crit. Rev. Biotechnol. 11, 41-112.
Macaskie L.E., Bonthrone K.M., Yong P., Goddard D.T. (2000) Enzymically mediated bioprecipitation of uranium by Citrobacter sp.: a concerted role for exocellular lipopolysaccharide and associated phosphatase in biomineral formation. Microbiol. 146, 1855-1867.
Myasoedov B.F., Novikov A.P. (1997) Main sources of radioactive contamination in Russia and methods for their determination and speciation. Radioanal. Nucl. Chem., Art. 229(1–2), 33-38.
Nazina T.N., Safonov A.V., Kosareva I.M., Ivoilov V.S., Poltaraus A.B., Ershov B.G. (2010) Microbiological Processes in the Severnyi Deep Disposal Site for Liquid Radioactive Wastes. Microbiol. (Eng. Tr.) 79(4), 528-537.
Novikov A.P. (2010) Migration of Radioniclides in the Environment. Geochem. Int. 48(13), 1285-1398.
Novikov A.P., Fabelinsky Yu.I., Lavrinovich E.A., Goryachenkova T.A., Grechnikov A.A. (2016) Membrane luminescence determination of technogenic actinides and their speciation in Eenvironmental objects. Geochem. Int. 54(13), 1196-1209.
Parkhurst D. L. and C.A.J. Appelo (1999) User’s guide to PHREEQC (Version 2): A computer program for speciation, batch-reaction, one-dimensional transport, and inverse geochemical calculations.
Puigdomenech I. “INPUT, SED, and PREDOM: “Computer programs drawing equilibrium diagrams”, TRITA-OOK-3010, (Sept. 1983), (12), Royal Institute of Technology, Dept. Inorg. Chem., S-100 44 Stockholm (ISSN 0348-825X).
Renshaw J.C., Lloyd J.R., Francis R.L. (2007) Microbial interaction with actinides and long-lived fission products. C.R. Chimie (10), 1067-1077.
Rittmann B.E., Banaszak J.E., Reed D.T. (2002) Reduction of Np(V) and precipitation of Np(IV) by an anaerobic microbial consortium. Biodegradation 13(5), 329-342.
Safonov A.V., Babich T.L., Sokolova D.S., Grouzdev D.S., Tourova T.P., Poltaraus A.B., Zakharova E.V., Merkel A.Y., Novikov A.P., Nazina T.N., (2018) Microbial Community and in situ Bioremediation of Groundwater by Nitrate Removal in the Zone of a Radioactive Waste Surface Repository. Front. microbiol. 1985 (9), 2-17.
Thorpe C.L., Morris K., Lloyd Jonathan R., Denecke Melissa A., Law Kathleen A., Dardenne Kathy, Boothman Christopher, Bots Pieter, Law Gareth T.W. (01.12.2015) Neptunium and manganese biocycling in nuclear legacy sediment systems. Appl. Geochem. (63), 303-309.
Williamson A.J. (2016) Microbially mediated reduction of Np(V) by a consortium of alkaline tolerant Fe(III)-reducing bacteria. Mineral. Magazine 79 (6), 1287-1295.
Дополнительные материалы отсутствуют.