Геохимия, 2020, T. 65, № 3, стр. 258-276
Физико-химические условия формирования повышенных содержаний индия в рудах оловосульфидных и полиметаллических месторождений Сибири и Дальнего Востока по данным термодинамического моделирования
И. В. Гаськов a, b, *, Л. В. Гущина a, **
a Институт геологии и минералогии им. В.С. Соболева СО РАН
630090 Новосибирск, просп. Акад. Коптюга, 3, Россия
b Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: gaskov@igm.nsc.ru
** E-mail: gushchina@igm.nsc.ru
Поступила в редакцию 04.10.2017
После доработки 18.06.2019
Принята к публикации 05.07.2019
Аннотация
В настоящее время основными поставщиками индия в мире являются полиметаллические (70–75 мас. %) и оловосульфидные (10–15 мас. %) месторождения. Однако до сих пор непонятны причины и условия накопления In в рудах этих месторождений. Поэтому нами было проведено моделирование физико-химических условий образования полиметаллических и оловосульфидных руд с повышенной индиеносностью. С этой целью по имеющимся литературным данным установлен средний состав рудоносных гидротермальных растворов и параметры процессов рудообразования на этих месторождениях. На основании этих данных и полученных нами стандартных термодинамических характеристик $\Delta G_{f}^{0},$ $\Delta H_{f}^{0},$ $S_{f}^{0},$ $V_{f}^{0},$ $C_{p}^{0}$ хлоридных форм индия (${\text{InCl}}_{2}^{ + },$ InCl3, InClOH+) с учетом коэффициентов, необходимых для расчета при повышенных температурах и давлениях, проведено по программам “Gem-Selektor-3” и “Chiller” термодинамическое моделирование формирования повышенных содержаний индия в этих рудах. Результаты термодинамического моделирования процесса образования кварц-касситеритовых и оловосульфидных руд показывают, что более высокие содержания индия в оловосульфидных рудах связаны с их формированием из кислых (pH 4.3) высоко хлоридных (6.6 m), растворов, в которых In находился в виде (InCl3aq) с концентрацией 0.002 m. Формирование кварц-касситеритовых руд происходило из близ нейтрального (pH 5.3), низко хлоридного (1.02 m) раствора, в котором In находился в виде гидроксокомплексов InO2H и ${\text{InO}}_{2}^{ - }$ c концентрацией не превышающей 0.00004 m, что, соответственно, и определило более низкие его содержания в этих рудах. Компьютерное моделирование формирования индиеносных колчеданно-полиметаллических и барит-полиметаллических месторождений показывает, что их формирование происходило из высокотемпературных хлоридных (1.3–4.3 m) гидротермальных растворов близ нейтрального состава (pH 5.8–6). Основными формами нахождения индия в растворе, являлись гидроксокомплексы InO2H и ${\text{InO}}_{2}^{ - }$, обеспечивающие концентрации (5–9 × 10–5 m). Однако, в силу низких концентраций индия в гидротермальных растворах, образующиеся сульфидные минералы (сфалерит, пирит и халькопирит), отличаются более низкими содержаниями индия по сравнению минералами оловосульфидных руд.
ВВЕДЕНИЕ
Индий это типичный рассеянный редкий элемент, среднее содержание которого в земной коре равен 1.4 × 10–5%. Близость ионного радиуса индия с размерами ионов более распространенных металлов (Fe, Zn, Mn, Sn, Mg, Pb и др.) приводит к тому, что в природе индий встраивается в кристаллические решетки минералов этих элементов. Однако, несмотря на такое сходство, содержание индия в подавляющем большинстве минералов-носителей невелико и редко выходит за пределы нескольких тысячных долей процента. Главными минералами-носителями индия являются цилиндрит Pb3Sn4Sb2S14 (0.1–1% In) и франкеит Pb5Sn3Sb2S14 (до 0.1% In), сфалерит ZnS (0.1–1% In), халькопирит CuFeS2 (0.05–0.1% In) и борнит Cu3FeS3 (0.01–0.05% In). Также известно несколько собственных минералов индия: самородный индий, индит FeIn2S4, рокезит CuInS2, сакуранит (CuZnFe)3InS4, патрукит (Cu,Fe,Zn)2(Sn,In)S4, интерметаллид йиксуит PtIn, джалиндит In(OH)3, но они не имеют практического значения вследствие своей исключительной редкости. Наибольший интерес для промышленности представляет сфалерит (ZnS), в котором концентрации индия могут достигать 1.5 мас. %. Однако содержания индия в этом минерале чрезвычайно неравномерные и зависят от типа месторождения и от условий его образования. В настоящее время основными поставщиками индия в мире являются полиметаллические (70–75%) и оловосульфидные (10–15 мас. %) месторождения. Более высокие содержания индия характерны для комплексных олово-полиметаллических месторождений, развитых в Иберийском поясе (месторождения Рио-Тинто, Neves Corvo и Lagoa Salgada) (Schwarz-Schampera, Herzig, 2002; Benzaazoua е.а., 2003), в Японии (Toyoha, Ashio и Akenobe), Китае (Dulong и Dachang), Боливии (Potosi, Huari, Bolivar и Porco) (Murakami, Ishihara, 2013) и в оловосульфидных месторождениях Приморского и Хабаровского краев (Дальний Восток), где содержания In достигает до 1.5 мас. % в сфалерите и до 1300 ppm – в халькопирите (Бутова и др., 1998; Гавриленко и др., 1992). Также в виде примеси In входит в небольших количествах в состав касситерита, где его содержание по данным исследований, включающих электронную и сканирующую микроскопию, LA-ICP-MS составляет от 0.5 до 45 ppm. Наряду с оловосульфидными месторождениями Дальнего Востока повышенные концентрации In также установлены в колчеданно-полиметаллических месторождениях Южного Урала (Гайское, Узельгинское, Сафьяновское и др.) и Рудного Алтая (месторождения Юбилейное, Корбалихинское, Зареченское), в которых содержания индия достигают 69 ppm (Pavlova et al., 2013, 2015; Гаськов и др., 2014, 2017). Более высокие содержания индия отмечаются в месторождениях, где сталкиваются два спутника индия – олово и цинк. В сфалеритах из различных оловосульфидных месторождений содержание индия доходит до 1.5%.
Как известно, на изученных нами месторождениях индий в виде изоморфной примеси входит в структуру главных рудных минералов: сфалерита, халькопирита, пирита и касситерита. Главными условиями этого изоморфизма являются близость ионных радиусов взаимозамещающихся элементов, близкие их кристаллохимические свойства и сохранение после замещения электронейтральности структуры. Так как в нашем случае валентность замещающихся ионов различна, то возможно проявление лишь гетеровалентного изоморфизма. Для сфалерита Zn2++ (R = 0.074 нм) и In3+ (R = 0.08 нм) проявляется совершенный гетеровалентный изоморфизм, так как различие между их радиусами составляет меньше 15% по правилу Гримма–Голдшмидта (Годовиков, 1975). Для пирита Fe2+ (R = 0.078 нм), халькопирита Cu2+ (R = 0.073 нм) и касситерита Sn4+ (R = 0.067 нм) изоморфизм с In3+ является несовершенным, гетеровалентным, хотя ионные радиусы их катионов и индия близки (за исключением Sn4+). Это связано (по правилу А.Е. Ферсмана и В.М. Гольдшмидта) с различной степенью поляризации ионов, которая даже при очень близких радиусах затрудняет изомеризацию между ними.
Для понимания всех причин и условий накопления In в этих минералах, нами было выполнено моделирование физико-химических условий образования полиметаллических и оловорудных месторождений повышенной индиеносности. Для этого по данным изучения флюидных включений было проведено обобщение материалов по составу рудоносных гидротермальных растворов оловорудных месторождений Дальнего Востока (Депутатское, Тигриное и Правоурмийское) и в рудах колчеданно-полиметаллических месторождений Рудного Алтая (Юбилейное, Корбалихинское, Зареченское).
Для термодинамического моделирования физико-химических условий образования повышенной индиеносности в этих месторождениях были использованы компьютерные программы: “Gem-Selektor-3” (Kulik et al., 2013), в которой расчет равновесного состояния системы выполняется методом минимизации энергии Гиббса и “Chiller” (Reed, 1982) – расчет основан на константах равновесий соответствующих реакций и данная программа дает возможность расчета реакций с участием теллура (в виде HTe–) и сульфосолей серебра (пираргирит) и меди (тетраэдрит и теннантит), термодинамические параметры которых находятся только в ее базе данных.
КРАТКАЯ ХАРАКТЕРИСТИКА МИНЕЛЬНОГО СОСТАВА И УСЛОВИЙ ФОРМИРОВАНИЯ ОЛОВОРУДНЫХ И КОЛЧЕДАННО-ПОЛИМЕТАЛЛИЧЕСКИХ МЕСТОРОЖДЕНИЙ
Анализ литературных данных по минеральному составу оловянных месторождений в оловорудных районах Дальнего Востока позволил выделить два типа руд: кварц-касситеритовые и оловосульфидные (Бутова и др., 1998; Коростелев и др., 1998; Родионов, 2005; Попова и др., 2013). Кварц-касситеритовые руды связаны в основном с кварц-топазовыми грейзенами с сидерофиллитом. Главным рудным минералом в них является касситерит, который отлагался на ранней стадии рудного процесса. В подчиненном количестве установлены сульфидные минералы: арсенопирит, халькопирит и пирит, которые имеют более позднее формирование по отношению к касситериту. Содержания индия в касситерите руд низкие и изменяются от 10 до 160 ppm. Кроме того в этих рудах установлены ниобий и тантал, которые изоморфно входят в состав касситерита до 1000 ppm и небольшие содержания серебра до 25 ppm.
Оловосульфидные руды часто ассоциируют с кварц-турмалиновыми метасоматитами, в которых преобладает тонкоигольчатый турмалин, придающий им зеленый цвет. В отличие от кварц-касситеритового типа в составе оловосульфидных руд резко преобладают сульфиды – Fe-сфалерит, халькопирит, пирротин, арсенопирит, пирит, а касситерит и станин являются второстепенными минералами. Нередко в составе оловосульфидных руд присутствует сульфид марганца, алабандин. Индий в значительном количестве входит в состав сфалерита (до 25 000 ppm) и халькопирита (до 1000 ppm). Содержание индия в алабандине невысокое и составляет (14–20 ppm). Иногда отмечаются собственно индиевые минералы – индит, рокезит, лафоретит (Гавриленко и др., 1992; Семеняк и др., 1994; Seifert, Sandmann, 2006). Кроме индия в этих рудах установлены повышенные концентрации германия (до 100 г/т), галлия (до 37 ppm), серебра (до 400 ppm) и ниобия (до 66 ppm).
Изучение флюидных включений в рудных и сопутствующих минералах оловорудных месторождений Дальнего Востока с целью определения физико-химических параметров формирования оруденения и состава рудообразующих растворов проводилось многими исследователями: (Сущевская и др., 2002; Борисенко и др., 1997; Борисенко и др., 2014; Pavlova, Borovikov, 2010; Pavlova et al., 2015а, б; Павлова и др., 2016). Эти исследования показали, что формирование кварц-касситеритовых руд происходило при высоких температурах (600–400°С) из рудообразующих растворов с низкими концентрациями солей (1–10 мас. %) (табл. 1). Газовая фаза во включениях представлена в основном СO2 и в небольшом количестве N2, CH4. По данным анализов флюидных включений в кварце, проведенным рядом исследователей (Heinrich et al., 1999; Audetat et al., 2000; Cauzid et al., 2007; Борисенко и др. 1997, 2014) было установлено присутствие рудных элементов, которые представлены в табл. 1. Статистический анализ состава включений показывает, что водно-солевая фракция гетерофазных флюидов, формировавших касситерит-кварцевый минеральный парагенезис, была обогащена Sn, As, а газообразная содержала невысокие концентрации Fe, Zn, Cu, Pb и S.
Таблица 1.
Концентрация петрогенных и рудных элементов во флюидных включениях
| Депутатское (Борисенко и др., 1997, 2014) микрорентгеноспектральный анализ, LA-ICP-MS | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T, °C | NaCl, мас. % эквивал. | Na, мас. % | K, мас. % | Ca, мас. % | Mn, мас. % | Fe, мас. % | Cu, ppm | Zn, ppm | As, ppm | Rb, ppm | Sr, ppm | Ag, ppm | Sn, ppm | Sb, ppm | Cs, ppm | W, ppm | S, мас. % | Pb, ppm | Bi, ppm |
| 600–400 | 1–10 | 0.2–2 | 0.1–1.8 | – | – | – | 30 | 200 | 290 | 30 | – | – | 110 | – | – | 70 | – | 30 | 6 |
| 480 | 21.5 | 8.6 | 5.3 | 0.9 | 2.6 | 10.4 | 100 | 11 233 | 200 | – | – | 800 | – | – | – | – | 0.15 | – | – |
| 450 | 50 | 17.7 | 1.4 | 0.07 | 2.5 | 2.2 | 120 | 5720 | 11 | 100 | 2.4 | 15 | 11 | 5 | 40 | 1240 | 0.05 | 1500 | 130 |
| 400 | 48 | 9.4 | 4.9 | 1.6 | 2.4 | 10.6 | 4300 | 19 300 | 2900 | 1140 | 780 | 470 | 760 | 270 | 510 | 330 | 0.07 | 2720 | 80 |
| 380 | 44 | 7.5 | 3.1 | 1.3 | 0.7 | 6.7 | 820 | 2400 | 240 | 1040 | 450 | 24 | 280 | 52 | 550 | 20 | 0.18 | 530 | 13 |
| Moле Гранит (Heinrich et al, 1999; Audetat et al., 2000) LA-ICP-MS | |||||||||||||||||||
| T, °C | NaCl, мас. % эквивал. | Na, мас. % | K, мас. % | Mn, мас. % | Fe, мас. % | Cu, ppm | Zn, ppm | As, ppm | Rb, ppm | Sb, ppm | Cs, ppm | Pb, ppm | Bi, ppm | ||||||
| 528 | 28 | 7.2 ± 0.5 | 3.5 ± 0.4 | 1.4 ± 0.2 | 4 ± 1 | 600 ± 200 | 3200 ± 800 | 180 ± 30 | 1400 | 100 | 3100 | 2600 | 6 | ||||||
| 470 | 35.7 | 5.8 | 9.9 | 1.6 | 8.6 | 220 | 9400 | 350 | 2200 | 160 | 2400 | 2300 | 20 | ||||||
| 430 | 34.5 | 6.5 | 6.3 | 1.2 | 9.3 | 120 | 2800 | 200 | 2400 | 45 | 1400 | 1700 | 28 | ||||||
| 398 | 32.5 | 7.2 | 4.6 | 1.9 | 6.8 | 165 | 5200 | 170 | 1100 | 150 | 2200 | 3400 | 300 | ||||||
| Янки Лойд (Cauzid et al., 2007) RXF | |||||||||||||||||||
| T, °C | K, мас. % | Ca, мас. % | Mn, мас. % | Fe, мас. % | Cu, ppm | Zn, ppm | As, ppm | Pb, ppm | |||||||||||
| 450 | 1 | 0.04 | 0.4 | 2 | 200 | 1000 | 80 | 800 | |||||||||||
| 450 | 1 | 0.05 | 0.5 | 2 | 200 | 2000 | 100 | 1000 | |||||||||||
| 450 | 4 | 0.06 | 0.5 | 2 | 200 | 2000 | 100 | 600 | |||||||||||
| 450 | 3 | 0.08 | 0.5 | 2 | 200 | 1000 | 200 | 800 | |||||||||||
Оловосульфидная минерализация отлагалась при температурах 480–380°С из высококонцентрированного (50–21.5 мас. %) хлоридно-карбонатного флюида, что подтверждается присутствием галита, сильвина и сидерита во включениях, с газовой фазой состава CO2–CH4. Данные анализа флюидных включений в кварце оловосульфидных руд представлены в табл. 1. Кроме этих элементов во включениях методом LA-ICP-MS анализа иногда фиксируются Mo, W, Ag, Sb, Sr, Cs, Rb, Bi и In. Концентрацию In в многофазных включениях, учитывая интерференцию по массам 115Sn и 115In, можно грубо оценить в величину от 6.2 до 0.3 ppm. Водно-солевая фракция включений из оловосульфидных руд обогащена Fe, Mn, Zn, As, Cu, Sn и In, а газовая фаза содержала повышенные концентрации Fe, Mn, Zn, а также S и As.
Изученные нами колчеданно-полиметаллические месторождения Рудного Алтая относятся к единой вулканогенной колчеданно-полиметаллической формации, в рамках которой выделяются два устойчивых минеральных типа – собственно колчеданно-полиметаллический (месторождения Юбилейное, Корбалихинское,) и барит-полиметаллический (месторождение Зареченское), различающиеся по содержанию пирита, барита, по соотношению главных рудных компонентов (меди, цинка и свинца) и концентрациям золота, серебра и других элементов-примесей. Содержания In в рудах разных месторождений имеют крайне неравномерное распределение и в целом изменяются от кларковых величин до 69 ppm. Средние содержания индия в рудах колчеданно-полиметаллических месторождений составляют 9 ppm на Юбилейном месторождении, 6.5 ppm на Корбалихинском месторождение, а в рудах барит-полиметаллического Зареченского месторождения установлены более высокие средние содержания In (11.45 ppm). Максимальное содержание индия (69 ppm) выявлено в сплошных пирит-халькопиритовых рудах Юбилейного месторождения. Главными концентраторами In являются сфалерит и халькопирит, причем в рудах Юбилейного месторождения более высокие концентрации In установлены в халькопирите (до 51.1 ppm), а на Корбалихинском месторождении повышенные концентрации In фиксируются и в сфалерите (до 38.6 ppm) и в халькопирите (до 25.1 ppm). В рудах Зареченского барит-полиметаллического месторождения, где установлены наиболее высокие средние содержания In (11.45 ppm) в рудах, его концентрации в главных рудных минералах ниже, чем в рудах в целом (сфалерит – до 5.02 ppm, галенит – не обнаружен, пирит – до 5.38 ppm), что может указывать либо на самостоятельные минеральные фазы In в этих рудах, либо на связь его с другими более редкими минералами. Руды также характеризуются широким набором других элементов-примесей, главными из которых являются кадмий, висмут, марганец, мышьяк, сурьма, серебро и золото. Концентрации этих элементов близки в одинаковых минеральных и текстурных разновидностях руд. Основными концентраторами кадмия и марганца является сфалерит; висмут, мышьяк, сурьма и серебро предпочтительней накапливаются в галените, а золото в пирите и халькопирите.
Изучению физико-химических условий рудоотложения древних колчеданно-полиметаллических месторождений и описанию термодинамических моделей формирования их современных аналогов посвящены многие работы (Гричук, 2000; Симонов, Бортников и др., 2002; Тереня и др., 2003; Tivey, 2007; de Ronde, et al., 2011; Бортников и др., 2014). Химический состав и концентрации элементов в рудообразующем флюиде современных геотермальных систем представлены в табл. 2а. Состав растворов и физико-химические условия рудоотложения на колчеданно-полиметаллических месторождениях Рудного Алтая также изучались многими исследователями (Гибшер, 1975; Щербань и др., 1980; Гаськов и др., 1988, 1991, 2005). Анализ изучения флюидных включений в минералах руд колчеданно-полиметаллических месторождениях Юбилейное, Корбалихинское и барит-полиметаллического Зареченского месторождения показывает, что температуры рудообразования на этих месторождениях изменялись от 360–270 до 160–100°С, охватывая диапазон температур всего гидротермального процесса, включая формирование разных типов руд и пострудные стадии (табл. 2б). Основное рудоотложение для колчеданно-полиметаллических месторождений происходит при температурах 360–250°С, а для барит-полиметаллических 260–150°С. Детальное изучение условий образования этих месторождений (Гаськов и др., 1988, 1991) показало, что основным фактором субмаринного рудоотложения являлось вскипание высокотемпературных растворов при входе в область низких давлений, сопровождаемое резким снижением температуры. Эта особенность рудоотложения проявилась в увеличении содержания солей в гидротермальном растворе (20–30 мас. %) (табл. 2б). По составу эти соли представлены, в основном, хлоридами (KCl, NaCl и MgCl2). По мере снижения температуры в растворах увеличивается роль хлорида кальция (CaCl2), а затем, в заметных количествах, появляются карбонаты калия (K2CO3). В более низкотемпературных растворах с температурами гомогенизации включений 120–200°С общая концентрация солей не превышает 8.0 мас. %, потому что они не претерпели вскипания и их солевые концентрации сохранились на исходном уровне (до 8.0 мас. %), что в целом отмечается для многих современных и древних гидротермальных систем (Симонов, Бортников и др., 2002; Тереня и др., 2003). Исследования газовой фазы флюидных включений показало, что в них преобладают газы сернистой группы (SO2, H2S), углекислый газ (CO2), в небольших количествах отмечается азот, водород и углеводороды. Изучение флюидных включений в минералах современных гидротермальных полей (Бортников и др., 2014) выявили высокие концентрации элементов в растворах, захваченных флюидными включениями (табл. 2а).
Таблица 2.
(a) Химические составы гидротермальных растворов современных систем
| Концентрация (ppm) химических элементов и температур гомогенизации в растворах, захваченных флюидными включениями (Бортников и др., 2014) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T, °C | Ca | K | Mg | Fe | Mn | Cu | Zn | Pb | Sn | Au | Ag | Rb |
| 310–372 | 3–5 | 510–5170 | 380–790 | 330–8300 | 110–2540 | 270–10 600 | 510 | До 200 | До 45 | 0.3–1.2 | До 340 | До 230 |
| Концентрация химических элементов в рудообразующих флюидах современных геотермальных системах Рейнбоу (1) и Лост Сити (2) (Tivey, 2007) | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T,°C | pH (25°C) | Cl, mmol | Na, mmol | Ca, mmol | K, mmol | Ba, mmol | Fe, μmol | Mn, μmol | Cu, μmol | Zn, μmol | Pb, μmol | Ni, μmol | CH4, mmol | H2S mmol | H2, mmol | SO4 mmol |
| (1) 365 | 2.8 | 750 | 553– | 67 | 20 | ≥67 | 24000 | 2250 | 140 | 160 | 13 | 3 | 0.13–2.2 | 1 | 13 | 0 |
| (2) ≤91 | 10–11 | 548 | 479–485 | <30 | – | – | – | – | – | – | – | – | 1–2 | <0.064 | <1–15 | 1.4 |
| Примечание. (1), (2) – геотермальные системы | ||||||||||||||||
| Химические составы гидротермальных растворов современных островодужных проявлений Тихого океана (Гричук, 2000) | ||||||||||||||||
| T,°C | pH (25°C) | Cl, mmol | Na, mmol | Ca, mmol | K, mmol | Ba, mmol | Fe, μmol | Mn, μmol | Cu, μmol | Zn, μmol | Pb, μmol | Ni, μmol | CH4, μmol | H2S, mmol | CO2, mmol | SO4, mmol |
| 320 | 4.72 | 528 | – | – | – | – | – | – | – | – | – | – | – | 12.27 | 192 | 0 |
| 100 | 5.42 | 509 | – | – | – | – | – | – | – | – | – | – | – | 9.27 | 90 | 16.4 |
| 30 | 5.3–5.5 | 524 | 464 | 11.2 | 12.3 | – | 1.01 | 0.0211 | – | – | – | – | – | – | 300 | 27.0 |
| Химический состав флюида Бразе кальдера (de Ronde et al., 2011) | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T, °C | pH | Cl, mmol |
Na, mmol |
Ca, mmol |
K, mmol |
Ba, μmol |
Fe, mmol | Mn, mmol |
Cu μmol |
Zn, μmol |
Sr, μmol |
Rb, μmol |
Mg, mmol |
H2S, μmol |
CO2, mmol |
SO4, mmol |
| 302– 294 | 2.8–3.8 | 502–737 | 370–528 | 33.7–44.5 | 48.8–73.0 | 2.5–148.3 | 4.2–7.1 | 0.5–0.8 | 4.2–7.5 | 7.7–74.9 | 123–186 | 97–122 | 2.0–6.8 | 1.4–5.8 | 17.3–42.8 | 0–5.2 |
| 67–68 | 5.1–5.9 | 539–544 | 432–460 | 7.9–10.4 | 11.0–16.9 | 0.18–0.25 | 0.04 | 0.01–0.30 | 0.06 | 0.6–1.4 | 57 | 1.9–5.2 | 46.7–52.4 | 0.015 | – | 24.9 |
| 60 | 2.3–3.2 | 540–547 | 439–451 | 9.7–10.4 | 13.6–14.8 | – | 0.03–0.04 | 0.08–0.14 | 0.047 | 6.8–17.9 | 55–66 | 3.4–5.2 | 51.7– 50.5 | 701–1703 | – | 25.4 |
| (б) Температура гомогенизации и состав флюидных включений колчеданно-полиметаллических месторождении северо-западной части Рудного Алтая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Месторождение | Тип руды, породы | Минерал-хозяин | Температура гомогенизации, °С | Конц. солей в гидротерм. р-ре, эквивал. NaCl, мас. % | Состав газовой фазы (объем %) | ||||
| SO2, H2S | CO2 | CO | H2 | N2+ редкие газы | |||||
| Юбилейное | Рудоносный риолитовый порфир |
Кварц Kварц |
160–260 120–160 |
7.9–12.5 3.4–5.5 |
– | – | – | – | – |
| Колчеданно- полиметаллический |
Кварц Сфалерит |
270–310 110–140 |
2.9–5.2 | 37–40 | 35 | 5 | 10 | 15 | |
| Барит- полиметаллический |
Кварц Карбонат |
160–200 100–150 |
4.7–8.0 1.4–4.0 |
35–45 | 24–35 | 3–7 | 9–12 | 11 | |
| Корбалихинское | Колчеданно- полиметаллический |
Кварц Сфалерит |
360–270 | 20–30 | 39 | 35 | – | 12 | 14 |
| Зареченское | Барит- полиметаллический |
Кварц Сфалерит |
260–200 | 16–17 | 36 | 35.1 | 8 | 9 | 10.6 |
ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ ХИМИЧЕСКИХ ФОРМ ИНДИЯ(III) В ВОДНОМ РАСТВОРЕ (МЕТОДЫ СОГЛАСОВАНИЯ И ОЦЕНКИ НЕДОСТАЮЩИХ ДАННЫХ)
Отсутствие или неполная информация в литературе по формам переноса In(III) и растворимости твердых фаз индия в водных растворах, особенно, при повышенных температурах и давлениях, делало невозможным компьютерное моделирование условий формирования оловосульфидного и колчеданно-полиметаллического оруденения c повышенной индиеносностью. Наиболее полная сводка экспериментально установленных различными исследователями констант образования гидроксидных, гидроксохлоридных, хлоридных и сульфидных комплексов индия (III) имеется в обзорной работе (Wood, Samson, 2006), где представлены диаграммы распределения химических форм In(III) в зависимости от pH и концентрации хлорид-иона в растворе при температуре 25°С и давлении 1 бар. В этой статье приведены наиболее надежные, на взгляд авторов, литературные данные о константах, взятых из работ (Алтынов, Птицын, 1962; Hasegawa et al., 1980; Tunaboylu, Schwaizenbach, 1970) и результаты экстраполяции на нулевую ионную силу с использованием известного уравнения Дебая–Хюккеля, проведенного Дж. Баес и Р. Месмер (Baes, Mesmer, 1986). Значения константы и параметр уравнения, зависимый от ионной силы, были ими определены через регрессионный анализ данных, используя метод наименьших квадратов. Поведение In ожидается переменной в формах его переноса, в зависимости от условий и состава флюида.
Термодинамические параметры ($\Delta G_{f}^{0},$ $\Delta H_{f}^{0},$ $S_{f}^{0},$ $V_{f}^{0},$ ${{\omega }_{{{\text{Pr,Tr}}}}} = - 1514.4{\text{ }}S_{{{\text{Pr,Tr}}}}^{0} + {{\beta }_{z}},$) гидроксокомплексов индия (III) (InOH2+; ${\text{In}}({\text{OH}})_{2}^{ + }$ (InO+ + H2O); ${\text{In}}({\text{OH}})_{3}^{0}$ (HInO2 + H2O) и ${\text{In}}({\text{OH}})_{4}^{ - }$ (${\text{InO}}_{2}^{ - }$ + 2H2O) вместе с коэффициентами для расчета соответствующих характеристик при повышенных температурах и давлениях (Shock et al., 1997; Sverjensky et al., 1997) представлены в базе данных программного комплекса “Gem-Selektor-3” (Kulik et al., 2013). Там же имеются термодинамические характеристики, но только для одного хлорокомплекса индия (InCl2+), полученные Д. Сверженски с соавторами (Sverjensky et al., 1997) на основе термодинамических данных (Turner et al., 1981). Нами было отмечено, что значение lg β1 = 3.26 константы образования химической формы (${\text{InCl}}_{{{\text{ag}}}}^{{2 + }}$) при температуре 25°С и давлении 1 бар отличается от величины lg β1 = 2.75, рекомендованной Дж. Баес и Р. Месмер (Baes, Mesmer, 1986). К. Тунабоулу и Шварценбах (Tunaboylu, Schwarzenbach, 1970) определили константы образования для In(HS)2+ и ${\text{In}}({\text{HS}})_{2}^{ + }$ комплексов индия(III) при 25°С в 1 M растворе NaClO4, замеряя растворимость In2S3(тв) с помощью методов спектрофотометрической и атомной абсорбционной спектроскопии. Термодинамические параметры ($\Delta G_{{\text{f}}}^{0},$ $\Delta H_{f}^{0},$ $S_{f}^{0},$ $C_{p}^{0}$ и коэффициенты (a, b, c)) этого сульфида индия, полученные данными авторами и дополненные из справочника (Наумов и др., 1971) были введены впоследствии, как твердая фаза, в базу данных компьютерной программы “Gem-Selektor-3”. С. Вуд и И. Самсон (Wood, Samson 2006) предположили, что гидроксокомплексы индия(III) (I-nOH2+, InO+, HInO2, ${\text{InO}}_{2}^{ - }$) и, возможно, гидроксохлоридный комплекс (InOHCl+) будут доминирующими только в близнейтральной низко хлоридной среде. Хлоридные формы индия(III) (${\text{InCl}}_{{{\text{aq}}}}^{{2 + }},$ ${\text{InCl}}_{{{\text{2}}\,\,{\text{aq}}}}^{ + }$ и ${\text{InCl}}_{{{\text{3}}\,\,{\text{aq}}}}^{0}$) будут преобладающими в переносе индия кислыми (pH ≅ 3–4) высоко хлоридными гидротермальными растворами, а сульфидные формы (${\text{In}}({\text{HS}})_{{{\text{aq}}}}^{{2 + }}$ и ${\text{In}}({\text{HS}})_{{{\text{2}}\,\,{\text{aq}}}}^{ + }$) в данных условиях будут незначимы.
Мы провели свой детальный анализ имеющейся информации о константах образования хлорокомплексов (${\text{InCl}}_{{{\text{aq}}}}^{{2 + }},$ ${\text{InCl}}_{{{\text{2}}\,{\text{aq}}}}^{ + }$ и ${\text{InCl}}_{{{\text{3}}\,\,{\text{aq}}}}^{0}$) и гидроксохлоридного (${\text{InOHCl}}_{{{\text{aq}}}}^{ + }$) комплекса In(III), опираясь на опыт проведения ранее такого сравнительного анализа для констант образования хлоридных комплексов ртути(II) (Белеванцев и др., 1982). Нами были выбраны из расширенного списка литературных экспериментальных данных о константах устойчивости хлорокомплексов индия(III), приведенного в статье (Wood, Samson, 2006), только результаты исследований образования хлоридных комплексов индия(III) в растворах при низких ионных силах (I ≤ 1), чтобы уменьшить их влияние на константы образования хлорокомплексов. В таблице (3) приведены величины констант образования и результаты их экстраполяции на нулевую ионную силу при температуре 25°С по уравнению Дэвис (Davies, 1962):
(1)
$\lg {{K}_{{\text{I}}}} = \lg {{K}_{0}} + \Delta {{Z}^{2}}{{A}_{{25}}}\left( {\left( {{{I}^{{{\text{1/2}}}}}/1 + {{I}^{{{\text{1/2}}}}}} \right)--0.3I} \right),$Таблица 3.
Отобранные константы образования хлоридных комплексов индия(III) в водных растворах при 20–25°С
| Уравнения реакций | I, м/л (ионная сила, среда) |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0.691 (HClO4) |
I → 0 | 0.7 (HClO4) |
I → 0 | 0.5 (HClO4) |
I → 0 | 1.0 (NaClO4) |
I→0v | I → 0 | I → 0 | I → 0 | |
| ${\text{I}}{{{\text{n}}}^{{3 + }}} + {\text{C}}{{{\text{l}}}^{ - }}~ = \,\,~{\text{InC}}{{{\text{l}}}^{{2 + ~}}}\,\left( {{\text{lg}}{{{\beta }}_{{\text{1}}}}} \right)$ | 2.36 | 3.11 | 2.36 | 3.11 | 2.47 | 3.27 | 2.19 | 2.80 | 3.07 ± 0.17 | 3.26 | 2.75 ± 0.1 |
| ${\text{I}}{{{\text{n}}}^{{3 + }}} + 2{\text{C}}{{{\text{l}}}^{ - }}~ = ~\,\,{\text{InCl}}_{2}^{ + }\left( {{\text{lg}}{{{\beta }}_{{\text{2}}}}} \right)$ | 3.63 | 4.87 | 3.57 | 4.82 | 3.11 | 4.45 | 3.54 | 4.56 | 4.68 ± 0.18 | – | 4.37 ± 0.3 |
| ${\text{I}}{{{\text{n}}}^{{3 + }}} + 3{\text{C}}{{{\text{l}}}^{ - }}~ = {\text{\;InCl}}_{3}^{0}\left( {{\text{lg}}{{{\beta }}_{{\text{3}}}}} \right)$ | 3.95 | 5.45 | 3.78 | 5.27 | 3.94 | 5.55 | – | – | 5.42 ± 0.12 | – | 5.00 ± 0.3 |
| In3+ + Cl– + OH– = = InClOH+ (lg β1,1,1) | – | – | – | – | – | – | – | – | 12.73 | – | – |
| Источники | Carleson, Irving (1954) |
Бусев, Канаев (1959) |
Вавра, Руденко, (1964) |
Sunden, (1954) |
Используемые нами в расчетах средние величины констант | Sverjensky
et al., (1997) |
Baes, Mesmer, (1986) |
||||
Можно видеть, что после приведения к одинаковым условиям заметны различия в величинах констант для трех ступеней образования хлорокомплексов In(III). Усредненные оценки полных констант равновесия (βi) для трех ступеней комплексообразования с рассчитанными погрешностями (среднее квадратичное отклонение) представлены в табл. 3. Среднее значение константы образования для первой ступени ближе к значению константы, полученной Д. Свержeнски с соавторами (Sverjensky et al., 1997), чем константе, рекомендованной Дж. Баес и Р. Месмер (Baes, Mesmer, 1986). Поэтому нами была принята константа, полученная первыми авторами, для дальнейшего использования ее в компьютерных термодинамических расчетах. Программный комплекс “Gem-Selektor-3” сопряжен с электронными базами стандартных термодинамических параметров ($\Delta G_{f}^{0},$ $\Delta H_{f}^{0},$ $S_{f}^{0},$ $C_{{p\,f}}^{0}$) растворимых химических форм и твердых фаз для использования в моделировании процессов рудообразования, поэтому нами были проведены расчеты свободной энергии Гиббса, используя фундаментальное соотношение:
которое дает возможность определить стандартные значения изменения свободных энергий реакций образования хлорокомплексов, InCl2+, ${\text{InCl}}_{2}^{ + },$ ${\text{InCl}}_{3}^{0}.$ Комбинируя эти величины с данными $\Delta G_{f}^{0}$ для ${\text{In}}_{{{\text{aq}}}}^{{3 + }},$ ${\text{Cl}}_{{{\text{aq}}}}^{ - }$ (Shock et al., 1997), находим $\Delta G_{f}^{0}$ данных комплексов. Результаты расчетов приведены в таблице 4. Поскольку прямые экспериментальные определения констант устойчивости комплексов со смешанными лигандами в гидротермальных условиях весьма сложны и трудоемки, необходимо сочетать их с расчетными термодинамическими методами. В основу теоретического подхода к проблеме могут быть положены закономерности комплексообразования, изложенные в работах (Белеванцев и др., 1977; Колонин, 1978), когда константа образования комплекса InClOH+ вычислена на основе отобранных нами данных из базы данных пакета “Gem-Selektor-3”для однородного гидроксокомплекса ${\text{In}}({\text{OH}})_{2}^{ + }$ и средней величиной константы образования для однородного хлорокомплекса ${\text{InCl}}_{2}^{ + }$ (табл. 3) при условии равенства лиганд-эффекта нулю, т.е. с учетом только статистического фактора. Находим:(3)
$\begin{gathered} \lg {{\beta }_{{{\text{InClO}}{{{\text{H}}}^{ + }}}}} = {\text{ }}1/2\lg {{\beta }_{{{\text{InCl}}_{2}^{ + }}}} + 1/2\lg {{\beta }_{{{\text{In}}}}}_{{{\text{(OH)}}_{2}^{ + }}} + \\ + \,\,\lg 2{\text{!}}/{\text{1}}{\kern 1pt} {\text{!}}{\kern 1pt} 1{\kern 1pt} ! = 12.73. \\ \end{gathered} $Таблица 4.
Стандартные термодинамические парциальные моляльные параметры хлоридных и гидроксохлоридного комплексов In(III) при температуре 25°С и давлении 1 бар и коэффициенты, необходимые для расчета при повышенных температурах и давлениях с помощью HKF уравнения (Helgeson et al., 1981; Tanger, Helgeson., 1988)
| Химические формы |
$\Delta G_{f}^{0},$ cal/mol (J/mol) |
$\Delta H_{f}^{0},$ cal/mol (J/mol) |
$S_{f}^{0},$ cal/mol K (J/mol K) |
$G_{{p\,f}}^{0},$ cal/mol K (J/mol K) |
$V_{f}^{0},$ cm3/mol (J/bar) |
a1 × 10, cal/mol bar |
a2 ×10–2, cal/mol |
a3, cal K/ mol bar |
a4 × 10–4, cal K/mol |
c1, cal/mol K |
c2 × 10–4, cal K/ mol |
ω × 10–5, cal/mol |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ${\text{InCl}}_{{{\text{aq}}}}^{{2 + }}$ | –59 226 (–247 802) |
–66 209 (–277 018) |
–38.8 (–162.339) |
1.57 (6.569) |
–21.67 (–2.167) |
–0.6441 | –9.3513 | 9.4185 | –2.3924 | 22.2354 | –2.7149 | 1.6444 |
| ${\text{InCl}}_{{{\text{2aq}}}}^{ + }$ | –92 521 (–387 108) |
–105 206 (–440 182) |
–15.7 (–65.689) |
18.9 (79.078) |
4.97 (0.497) |
2.7176 | –1.1056 | 6.0285 | –2.7317 | 24.4492 | 0.8039 | 0.7932 |
| ${\text{InCl}}_{{{\text{3aq}}}}^{0}$ | –125 206 (–523 862) |
–138 693 (–580 292) |
23.9 (99.998) |
25.6 (107.110) |
22.76 (2.276) |
4.7552 | 3.8312 | –3.8917 | –2.9374 | 18.2000 | 2.1687 | –0.3616 |
| ${\text{InClOH}}_{{{\text{aq}}}}^{ + }$ | –109 681 (–458 905) |
–125 272 (–524 138) |
–11.9 (–49.790) |
–26.9 (–112.550) |
12.58 (1.258) |
3.7380 | 1.3455 | 4.9589 | –2.8347 | –3.9819 | –8.5255 | 0.7314 |
Основываясь на экспериментальных данных, которые получены при температуре 25°С в водном
растворе перхлората натрия с ионной силой 3 М Д. Ферри (Ferri, 1972а, б), нами была
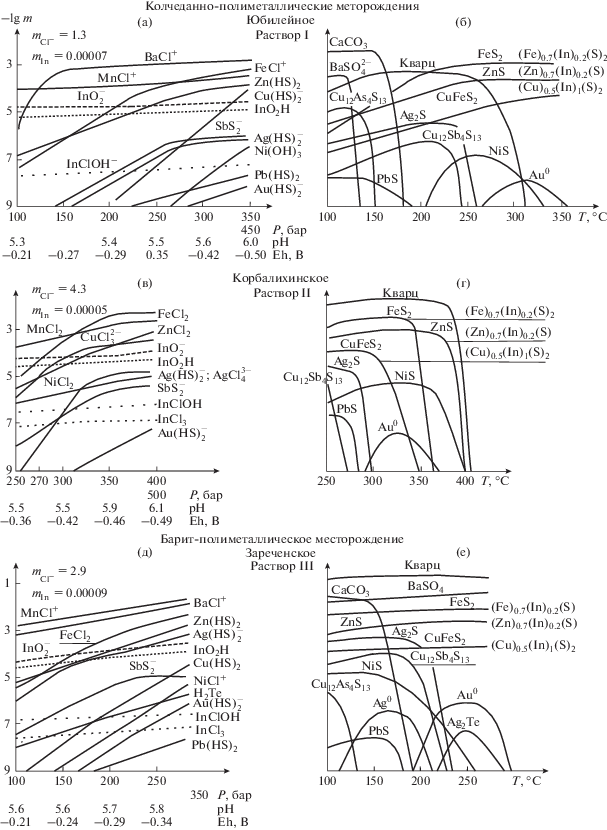
оценена константа образования гидроксохлоридного комплекса In(III) при I → 0 (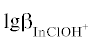 = 12.95).
= 12.95).
Величину $\Delta G_{f}^{0}$ для этого смешанного (InClOH+) комплекса находим, используя значения $\Delta G_{f}^{0}$ для ${\text{In}}_{{{\text{aq}}}}^{{3 + }},$ ${\text{Cl}}_{{{\text{aq}}}}^{ - }$ и OH– (Shock et al., 1997), а $\Delta H_{f}^{0}$ рассчитываем как полусумму энтальпий образования гидроксидного (${\text{In}}({\text{OH}})_{2}^{ + }$) и хлоридного (${\text{InCl}}_{2}^{ + }$) комплексов индия(III), схема расчета предложена в работе (Белеванцев и др., (1982). Значение $\Delta G_{f}^{0}$ и полученная путем полуэмпирической оценки $\Delta H_{f}^{0}$ смешанного комплекса равная – 125 272 кал/моль были помещены в табл. 4. Энтропия ($\Delta S_{f}^{0}$ = 40.1 кал/моль K) реакции образования комплекса ${\text{InClOH}}_{2}^{ + }$ была определена из термодинамического соотношения:
и, используя эту величину со значениями $S_{f}^{0}$ для ${\text{In}}_{{{\text{aq}}}}^{{3 + }},$ ${\text{Cl}}_{{{\text{aq}}}}^{ - }$ и OH– (Shock et al., 1997), находим ($S_{f}^{0}$ = = –11.9 кал/моль K) данного комплекса (табл. 4).В таблице 5 представлена имеющаяся информация величин изменения свободной энергии Гиббса (ΔG0), энтальпии (ΔH0), энтропии (ΔS0) реакций (K1, K2, K3) образования хлорокомплексов In(III), которые получены при температуре 25°С в водном растворе перхлората натрия с ионной силой 2 М прямым калориметрическим определением тепла при образовании трех хлоридных комплексов (Ryhl, 1969). Согласно П. Гердин, И. Джонсон (Gerding, Jonsson, 1968) и А. Мокееву с соавторами (Мокеев и др., 1979), термодинамические параметры ($\Delta H_{f}^{0}$, $\Delta S_{f}^{0}$) не меняются очень резко с изменением ионной силы в этой области. Во всяком случаи нужно иметь в виду, что неопределенность в величине энтальпии вплоть до ±6 ккал/моль для T2 – T1 = ±10 K при комнатной температуре приводит к неопределенности поправки константы всего до ±0.15 лог. ед. (Белеванцев и др., 1982). Автором (Ryhl, 1969), приведенной экспериментальной работы, было принято, что для реакций образования трех хлоридных комплексов In(III) будут более стабильными значения энтропии ($\Delta {{S}^{0}}$) данных реакций. Важно отметить, что используя величины ΔS0 реакций образования (K1 = β1, K2, K3) (табл. 5) хлорокомплексов In(III) с данными $S_{f}^{0}$ для ${\text{In}}_{{{\text{aq}}}}^{{3 + }},$ ${\text{Cl}}_{{{\text{aq}}}}^{ - }$ находим значения энтропий трех хлоридных форм индия(III). Для комплекса ${\text{InCl}}_{{{\text{aq}}}}^{{2 + }}$ рассчитанная энтропия оказалась ($S_{f}^{0}$ = –35.7 кал/моль K). Величины теплоемкости ($\Delta C_{p}^{0}$) образования хлорокомплексов и смешанного гидроксохлоридного комплекса In(III) были получены по известному корреляционному уравнению (Ходаковский, 1975):
где Z – абсолютное значение величины заряда, а коэффициенты A и D определены на обширной эмпирической базе и табулированы. Тогда на основе $C_{{p\,f}}^{0}$ для ${\text{In}}_{{{\text{aq}}}}^{{3 + }},$ ${\text{Cl}}_{{{\text{aq}}}}^{ - }$ и ${\text{OH}}_{{{\text{aq}}}}^{ - }$ находим значения парциальных теплоемкостей трех хлоридных и гидроксохлоридного комплексов индия(III). Для химической формы ${\text{InCl}}_{{{\text{aq}}}}^{{2 + }}$ рассчитана парциальная теплоемкость ($C_{p}^{0}$ = –0.74 кал/моль K). В работe Д. Свержeнски с соавторами (Sverjensky et al., 1997) и в термодинамической базе данных программного пакета “Gem-Selektor-3” для хлоридного комплекса ${\text{InCl}}_{{{\text{aq}}}}^{{2 + }}$ величина стандартной энтропии ($S_{f}^{0}$ = –38.8 кал/моль K), а стандартной парциальной теплоемкости ($C_{{p\,f}}^{0}$ = 1.57 кал/моль K). Результаты значений $S_{f}^{0}$ и $C_{{p\,f}}^{0}$ трех хлоридных и гидроксохлоридного комплексов индия(III) приведены в таблице 4, где имеются так же значения $\Delta C_{f}^{0}$ этих химических форм. Можно видеть, что полученные величины энтропии и парциальной теплоемкости для химической формы ${\text{InCl}}_{{{\text{aq}}}}^{{2 + }}$ на основе экспериментальной работы (Ryhl, 1969), достаточно близки к стандартным значениям $S_{f}^{0}$ и $C_{{p\,f}}^{0}$ (различия не выходят за пределы 20 кал/моль K) (Белеванцев и др. 1982), приведенным в термодинамической базе данных программного пакета “Gem-Selektor-3”. Находим (табл. 4) стандартные парциальные моляльные объемы и коэффициенты Борна (ω) для хлоридных комплексов индия(III), используя корреляцию их со стандартным парциальным моляльным объемом катиона металла и стандартными парциальными моляльными энтропиями при 25°С и 1 бар, соответственно (Shock et al., 1997; Sverjensky et al., 1997). Эти авторы для расчета, в первом приближении, стандартных парциальных моляльных объемов хлоридных форм металлов предложили уравнение: но при использовании их в термодинамической базе компьютерного пакета “Gem-Selektor-3” они могут быть уточнены. Рассчитанные стандартные парциальные моляльные объемы хлоридных комплексов In(III): $V_{{{\text{InC}}{{{\text{l}}}^{{2 + }}}}}^{0}~$ = 4.97; $V_{{{\text{InC}}{{{\text{l}}}^{3}}}}^{0}~$ = 22.76 и $V_{{{\text{InClO}}{{{\text{H}}}^{ + }}}}^{0}~$ = 12.58 см3/моль представлены в таблице 4. Оценочные значения (V0), по мнению авторов, ведут к незначительной неопределенности константы образования (βi) данных комплексов по сравнению с энтропией (S0) и теплоемкостью ($C_{p}^{0}$). Поскольку ω (коэффициент Борна) является линейной функцией энтропии (S0), то можно использовать для определения ω уравнение: где βz(×10–5) = 0.5512; 1.0586; 1.5795 (заряд ионов z = 1, 2, 3), а – нейтральных β = 34.00 кал/моль. Используя для расчета приведенные данные, мы получили ${{\omega }_{{{\text{InC}}{{{\text{l}}}^{{2 + }}}}}}$ (×10–5) = 0.7932; ${{\omega }_{{{\text{InC}}{{{\text{l}}}_{3}}}}}$(×10–5) = –0.3616; ${{\omega }_{{{\text{InClO}}{{{\text{H}}}^{ + }}}}}$(×10–5) = 0.7314 кал/моль. Зная величины $C_{p}^{0}$, V0 и ω для каждого хлоридного комплекса In(III), по регрессионным уравнениям, приведенным в статье (Sverjensky et al., 1997) можно рассчитать коэффициенты (a1, a2, a3, a4, c1, c2):(8)
$\begin{gathered} {{a}_{1}} = \left( {0.01384} \right)\left( {V_{{{\text{Pr,Tr}}}}^{0} + \left( {41.84} \right){{\omega }_{{{\text{Pr,Tr}}}}}{{Q}_{{{\text{Pr,Tr}}}}}} \right) + \\ + \,\,0.1765, \\ \end{gathered} $(9)
$\begin{gathered} {{a}_{2}} = \left( {33.423} \right)\left( {V_{{{\text{Pr,Tr}}}}^{0} + \left( {41.84} \right){{\omega }_{{{\text{Pr,Tr}}}}}{{Q}_{{{\text{Pr,Tr}}}}}} \right) - \\ - \,\,347.23, \\ \end{gathered} $(10)
$\begin{gathered} {{a}_{3}} = - \left( {0.1435} \right)\left( {V_{{{\text{Pr,Tr}}}}^{0} + \left( {41.84} \right){{\omega }_{{{\text{Pr,Tr}}}}}{{Q}_{{{\text{Pr,Tr}}}}}} \right) + \\ + \,\,7.0274, \\ \end{gathered} $(11)
$\begin{gathered} {{a}_{4}} = - \left( {138.17} \right)\left( {{\text{ }}V_{{{\text{Pr,Tr}}}}^{0} + \left( {41.84} \right){{\omega }_{{{\text{Pr,Tr}}}}}{{Q}_{{{\text{Pr,Tr}}}}}} \right) - \\ - \,\,26{\kern 1pt} 355, \\ \end{gathered} $(12)
${{c}_{1}} = \left( {0.6087} \right)C_{{{\text{Pr,Tr}}}}^{0} + {{\omega }_{{{\text{Pr,Tr}}}}}{{T}_{{{\text{Pr,Tr}}}}}{{X}_{{{\text{Pr,Tr}}}}} + 5.85,$Таблица 5.
Расcчитанные значения изменения свободной энергии Гиббса, энтальпии и энтропии (с погрешностями) реакций образования хлоридных комплексов индия (III) в водном растворе (I = 2 M) при 25°С и 1бар. В качестве среды взят NaClO4 (Ryhl, 1969).
| Реакции образования | ΔG0, ккал/моль | ΔH0, ккал/моль | ΔS0, кал/моль K |
|---|---|---|---|
| In3+ + Cl– = InCI2+ (K1 = β1) | –2.86 (4) | 1.23 (4) | 13.7 (3) |
| ${\text{InC}}{{{\text{l}}}^{{2 + }}} + {\text{C}}{{{\text{l}}}^{ - }}~ = {\text{InCl}}_{2}^{ + }\left( {{{K}_{2}}} \right)$ | –2.05 (4) | 0.78 (8) | 9.5 (4) |
| ${\text{InCl}}_{2}^{ + } + {\text{C}}{{{\text{l}}}^{ - }}~ = \,\,~{\text{InCl}}_{3}^{0}\left( {{{K}_{3}}} \right)$ | 0.33 (10) | 8 (2) | 26 (4) |
Представленные в таблице статьи (Sverjensky et al., 1997) коэффициенты для хлоридной формы InCl2+ рассчитаны по уравнениям (8)–(13), это дает нам основание и позволяет ожидать, что оценки коэффициентов (а1, а2, а3, а4, с1, с2) для других хлоридных форм In(III) (табл. 4) являются удовлетворительным приближением и могут быть вставлены в базу данных пакета “Gem-Selektor-3” и использованы для дальнейших расчетов при повышенных температурах и давлениях.
Таким образом, на основе детального анализа имеющейся в литературе экспериментальной информации и используя фундаментальные термодинамические соотношения нами были получены: 1) усредненные значения полных констант (βi) с рассчитанными погрешностями (среднее квадратичное отклонение) для трех ступеней образования хлоридных (InCl2+, ${\text{InCl}}_{2}^{ + }$, InCl3) и смешанного гидроксохлоридного (InClOH+) комплексов индия(III) в водном растворе при температуре 25°С и давлении 1 бар при нулевой ионной силе, 2) термодинамические стандартные парциальные моляльные параметры данных комплексов и коэффициенты, необходимые для расчета данных характеристик при повышенных температурах и давлениях с помощью HKF (Helgeson et al., 1981; Tanger, Helgeson, 1988) уравнения. Это дает возможность проведения в дальнейшем компьютерного термодинамического моделирования физико-химических условий концентрированного отложения индия в рудах.
РЕЗУЛЬТАТЫ ТЕРМОДИНАМИЧЕСКОГО МОДЕЛИРОВАНИЯ ИНДИЕНОСНЫХ ОЛОВОРУДНЫХ И ПОЛИМЕТАЛЛИЧЕСКИХ МЕСТОРОЖДЕНИЙ
Полученные результаты по характеристике минерального состава руд и флюидных включений в минералах индиеносных оловорудных и колчеданно-полиметаллических месторождений, а также теоретическая оценка недостающих термодинамических параметров для хлоридных (${\text{InCl}}_{2}^{ + }$, ${\text{InCl}}_{3}^{0}$) и гидроксохлоридного (InClOH+) комплексов индия (III) стали основой проведения компьютерного моделирования условий отложения индия в рудах в рамках сложной геохимической системы In–Fe–Cu–As–Pb–Zn–Sn–Mn–H2O–Cl–H2S.
Моделирование формирования кварц-касситеритовых и Sn-сульфидных руд
Как показали результаты изучения руд месторождений, состав рудоносного гидротермального раствора по данным флюидных включений характеризовался невысоким содержанием солей (1–10 мас. %) (табл. 1), а содержание индия в валовом составе руд составляли (0.5–45 ppm) (табл. 6 ). Поэтому для термодинамического моделирования (пакет “Gem-Selektor-3”) образования кварц-касситеритовых руд был выбран модельный раствор I, отвечающий этим параметрам (табл. 6 ). В таком гидротермальном растворе доминирующей формой переноса индия являются гидроксокомплексы, InO2H и ${\text{InO}}_{2}^{ - }$. По мере охлаждения с шагом Т = 50°С исходного восстановленного (Eh = = –0.42 B) низко хлоридного (1.02 m) сульфидного (0.001 m), близ нейтрального (pH 5.3) раствора (рис. 1а, 1б) происходило последовательное изменение его состава, что вызывало осаждение индия (при снижении концентрации гидроксокомплексов) совместно с касситеритом в интервале температур от 400 до 200°С при давлении 600 бар. Индий в виде примеси, преимущественно, входит в состав касситерита, который является главным его минералом-носителем, но с несовершенным (ограниченным) гетеровалентным изоморфизмом. Результаты расчета показывают, что концентрации гидроксокомплексов индия в гидротермальном растворе такого состава невысокие, поэтому касситерит, который кристаллизуется из этого раствора, и в целом кварц-касситеритовые руды отличаются низкими содержаниями примеси индия.
Рис. 1.
Результат термодинамического моделирования по программам ”Gem Selektor-3” и “Chiller” процессов изобарического охлаждения: (а) близ нейтрального низко хлоридно-сульфидного раствора (I), (в) кислого высоко хлоридного раствора (II) и концентрации химических форм переноса индия и основных рудных элементов; (б), (г) – отложение минеральных фаз оловорудных месторождений.
В отличие от кварц-касситеритового типа состав гидротермального раствора, из которого формировались оловосульфидные руды, отвечает высоким содержаниям солей (50–21.5 мас. %) (табл. 1), а в составе оловосульфидных руд резко преобладают сульфиды – сфалерит с совершенным (неограниченным) гетеровалентным изоморфизмом, халькопирит, пирротин, арсенопирит, пирит с ограниченным гетеровалентным изоморфизмом, а касситерит и станнин являются второстепенными минералами. Нередко в составе оловосульфидных руд присутствует сульфид марганца – алабандин. Индий в значительном количестве входит в состав сфалерита (до 15 000 ppm) и халькопирита (до 1000 ppm). Содержание индия в алабандине невысокое и составляет (14–20 ppm). Иногда отмечаются собственно индиевые минералы – индит, рокезит, лафоретит и другие сульфидсодержащие минералы.
Для термодинамического моделирования формирования оловосульфидного оруденения, по данным изучения флюидных включений кварца (табл. 1), был выбран кислый (pH 4.3), высоко хлоридный (6.6 m) сульфидный (0.5 m), восстановленный (Eh = –0.22 B) раствор II (табл. 6). В таком кислом гидротермальном растворе доминирующей формой переноса индия является I-nCl3aq, концентрация которого достигала 0.002m, и резко превышала его содержание относительно близ нейтрального раствора, из которого формировались кварц-касситеритовые руды. По мере понижения с шагом 50°С температуры, при изобарическом охлаждении (600 бар), этого раствора основная масса индия отлагалась в температурном интервале от 400 до 250°С одновременно и совместно с сульфидными минералами (сфалерит, халькопирит, пирит, алабандин), с изоморфным вхождением в их кристаллические решетки, и кварцем, (рис. 1г), что отвечает кристаллизации твердых фаз из одной порции раствора. Индий содержащие сульфиды и собственные минералы индия отлагались за счет снижения концентрации его хлоридного комплекса (${\text{InCl}}_{3}^{0}$) в гидротермальном растворе (рис. 1в).
Таблица 6.
Исходные концентрации (моль/кг H2O) компонентов в модельных растворах (для оловорудных месторождений)
| Компоненты | Концентрация | при 400°С |
|---|---|---|
| раствор I | раствор II | |
| pH 5.3 | pH 4.3 | |
| HS– | 0.001 | 0.5 |
| ${\text{SO}}_{4}^{{2 - }}$ | 1.00 × 10–5 | 0.001 |
| ${{{\text{H}}}_{2}}{\text{AsO}}_{3}^{ - }$ | 1.00 × 10–6 | 0.01 |
| Ag+ | – | 0.0002 |
| Ca2+ | – | 2.00 |
| Cu+ | 1.00 × 10–5 | 0.1 |
| Fe2+ | 0.001 | 0.1 |
| In3+ | 4.00 × 10–5 | 0.002 |
| K+ | 0.02 | 0.2 |
| Na+ | 1.00 | 1.00 |
| Pb2+ | 1.00 × 10–6 | 0.01 |
| SiO2 aq | 0.1 | 0.1 |
| Sn2+ | 0.01 | 0.002 |
| Zn2+ | 1.00 × 10–5 | 0.1 |
| Mn2+ | – | 0.45 |
| ${\text{HCO}}_{3}^{ - }$ | – | 0.02 |
| Cl– | 1.02 | 6.6 |
| CO2газ | 0.001 | 0.01 |
| ${\text{HCO}}_{3}^{ - }$ | – | 0.02 |
| CH4газ | 0.001 | 0.001 |
| N2газ | 0.001 | 0.001 |
| Eh, в | –0.42 | –0.22 |
Таким образом, результаты термодинамического моделировании процесса образования повышенных концентраций индия в оловорудных месторождениях показывают, что более высокие содержания индия в оловосульфидных рудах по сравнению с кварц-касситеритовыми связаны с их формированием из кислого (pH 4.3) высоко хлоридного (6.6 m), раствора, в котором концентрация In в виде хлоридного комплекса (InCl3) могла достигать 0.002 m. Кварц-касситеритовые руды, напротив, формировались из близнейтрального (pH 5.3), низко хлоридного (1.02 m) раствора, в котором In находился в виде гидроксокомплексов ${\text{InO}}_{2}^{ - }$ и InO2H и имел низкие концентрации (около 0.00004 m), что и определило его низкие содержания в этих рудах. О преобладающей форме переноса индия в виде хлоридов отмечают также и другие авторы (Чураков и др., 2000), изучавшие поведение индия в фумарольных образованиях вулкана Кудрявый.
Моделирование формирования колчеданно-полиметаллических и барит-полиметаллических руд с повышенным содержанием In
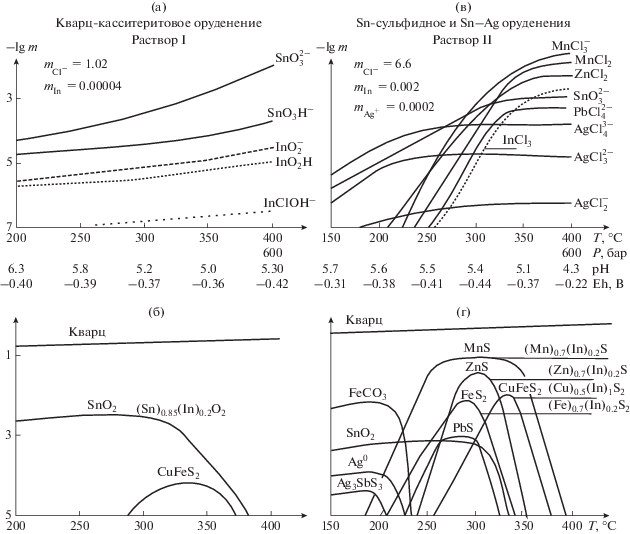
Для компьютерного моделирования (пакет “Gem-Selektor-3”) формирования индиеносных полиметаллических руд были выбраны разные модельные растворы (табл. 7) с учетом данных изучения состава растворов в современных колчеданно-полиметаллических рудообразующих системах и во флюидных включениях древних колчеданных месторождений (табл. 2а, 2б). Для колчеданно-полиметаллических месторождений с исходными температурами формирования 360–300°С были взяты следующие исходные растворы: для Юбилейного месторождения раствор I – близ нейтральный (pH 6.0), восстановленный (Eh = –0.5 B) низко хлоридный (1.3 m) сульфидный (0.02 m); для Корбалихинского месторождения раствор II – близ нейтральный (pH 6.1), восстановленный (Eh = = –0.49 B) хлоридный (4.3 m), а для Зареченского барит-полиметаллического месторождения с температурами формирования 250–200°С был выбран раствор III – близ нейтральный (pH 5.8) восстановленный (Eh = –0.34 B) хлоридно (2.9 m) – сульфидный (0.01 m) и с концентрациями In3+, соответствующими средним содержаниям индия в валовом составе руд данных месторождений (табл. 7). При охлаждении с шагом 50°С при изобарическом охлаждении (450 бар) раствора I от 350 до 250°С было установлено небольшое снижение pH раствора до 5.5 и уменьшение в нем концентрации ${\text{InO}}_{2}^{ - }$ и InO2H (рис. 2а), что происходит одновременно с выпадением рудных минералов (пирит, халькопирит, сфалерит) (рис. 2б), которые и являются его концентраторами (Гаськов и др., 2017). Из раствора II концентрации гидроксокомплексов In(III) интенсивно понижаются в интервале температур от 400 до 350°С (при P = 500 бар) (рис. 2в) вместе со сфалеритом и кварцем (рис. 2г). Из данных растворов также осаждаются золото (за счет разложения комплекса ${\text{Au}}({\text{HS}})_{2}^{ - }$), а при дальнейшем их охлаждении – аргентит, за счет комплексов серебра, ${\text{AgCl}}_{4}^{{3 - }}$ и ${\text{Ag}}({\text{HS}})_{2}^{ - }$, галенит (рис. 2б, 2г), кальцит (рис. 2б), тетраэдрит, теннантит и барит, который отлагается с понижением восстановительной обстановки в растворе (рис. 2б). Из раствора III, отличающегося от предыдущих более низкой температурой и менее восстановительными условиями, при понижении температуры сразу же отлагается барит (BaSO4), затем пирит, халькопирит, сфалерит (рис. 2е) и индий (за счет разложения комплексов ${\text{InO}}_{2}^{ - }$, InO2H), который изоморфно входит в кристаллические решетки данных сульфидов (рис. 2д). Изменение температуры (при P = 350 бар) также приводит к осаждению золота и гессита (Ag2Te) при наличии теллура в виде (${\text{HTe}}_{{{\text{ag}}}}^{ - }$) в растворе (рис. 2д). При дальнейшем понижении температуры из раствора III отлагаются: аргентит, галенит и самородное серебро, тетраэдрит, теннантит (рис. 2е), и продолжает осаждаться барит с понижением температуры и восстановительной обстановки в растворе (рис. 2д).
Таблица 7.
Исходные концентрации (моль/кг H2O) компонентов в модельных растворах (для полиметаллических месторождений)
| Компоненты | Концентрация при 350°С | Концентрация при 400°С | Концентрация при 250°С |
| раствор I | раствор II | раствор III | |
| pH 6.0 | pH 6.1 | pH 5.8 | |
| HS– | 0.02 | 0.02 | 0.01 |
| ${\text{SO}}_{4}^{{2 - }}$ | 3 × 10–4 | 3 × 10–4 | 1 × 10–4 |
| H2AsO3 | 2 × 10–5 | 2 × 10–5 | 2 × 10–5 |
| Ag+ | 2 × 10–6 | 1 × 10–5 | 3 × 10–5 |
| Au+ | 2 × 10–7 | 1 × 10–7 | 1 × 10–5 |
| Al3+ | 2 × 10–6 | 1 × 10–6 | 1 × 10–6 |
| Ba2+ | 0.002 | – | 0.02 |
| Ca2+ | 0.1 | 0.1 | 0.1 |
| Cu+ | 2 × 10–4 | 2 × 10–4 | 3 × 10–5 |
| Fe2+ | 0.002 | 0.002 | 0.002 |
| In3+ | 7 × 10–5 | 5 × 10–5 | 9 × 10–5 |
| K+ | 0.06 | 0.06 | 0.06 |
| Na+ | 1.0 | 4.2 | 2.6 |
| Mg2+ | 1 × 10–5 | 1 × 10–4 | 1 × 10–4 |
| Pb2+ | 2 × 10–7 | 2 × 10–7 | 1 × 10–7 |
| Ni2+ | 1 × 10–6 | 5 × 10–6 | 5 × 10–5 |
| SiO2aq | 0.01 | 0.01 | 0.01 |
| Zn2+ | 8 × 10–4 | 5 × 10–4 | 3 × 10–4 |
| Mn2+ | 0.003 | 0.003 | 0.003 |
| Sbобщ | 2 × 10–6 | 5 × 10–6 | 5 × 10–5 |
| HTe– | – | – | 1 × 10–6 |
| ${\text{HCO}}_{3}^{ - }$ | 0.01 | 0.001 | 0.001 |
| Cl– | 1.3 | 4.3 | 2.9 |
| CO2газ | 0.001 | 0.001 | 0.001 |
| H2Sгаз | 0.001 | 0.001 | 0.001 |
| SO2газ | 0.001 | 0.001 | 0.001 |
| CH4газ | 0.0001 | 0.0001 | 0.0001 |
| H2газ | 0.0001 | 0.0001 | 0.0001 |
| Eh, в | –0.50 | –0.49 | –0.34 |
Рис. 2.
Результат термодинамического моделирования по программам ”Gem Selektor-3” и “Chiller” процессов изобарического охлаждения: (а) близ нейтрального низко хлоридно-сульфидного раствора (I), (в), (д) близ нейтральных хлоридных растворов (II), (III) и концентрации химических форм переноса индия и основных рудных элементов; (б), (г), (е) – отложение минеральных фаз колчеданно-полиметаллических месторождений.
Как показывают расчеты, основными формами нахождения индия в растворе, из которого формировались полиметаллические руды являются гидроксокомплексы InO2H и ${\text{InO}}_{2}^{ - }$, устойчивость которых снижается при охлаждении раствора и изменении рН. Выпадающий из раствора индий входит в структуру сфалерита и других сульфидных минералов, образующихся при этих же условиях. Однако, невысокие концентрации гидроксокомплексов индия (5–9 × 10–5 m) в этих хлоридных близ нейтральных (pH 6.1–5.8) гидротермальных растворах обусловили более низкие содержания индия в сульфидных минералах полиметаллических месторождений по сравнению с минералами оловосульфидных руд, которые кристаллизуются из высоко хлоридных (6.6 m), но кислых (pH 4.3) растворов, с концентрацией индия (0.002 m) в виде InCl3.
ВЫВОДЫ
1. На основе детального анализа литературных данных впервые были получены усредненные значения констант образования хлоридных и гидроксохлоридных форм In(III) (${\text{InCl}}_{2}^{ + }$, InCl3, InClOH+) и рассчитаны стандартные термодинамические параметры $\Delta G_{f}^{0},$ $\Delta H_{f}^{0},$ $S_{f}^{0},$ $V_{f}^{0},$ $C_{p}^{0}$ этих комплексов, а также коэффициенты, необходимые для расчета при повышенных температурах и давлениях с помощью HKF уравнения.
2. Используя полученные значения термодинамических параметров этих комплексов, впервые проведено моделирование физико-химических условий отложения индия из гидротермальных растворов при формировании кварц-касситеритовых, оловосульфидных, колчеданно-полиметаллических и барит-полиметаллических месторождений.
3. Результаты термодинамического моделирования процесса образования кварц-касситеритовых и оловосульфидных руд показывают, что более высокие содержания индия в оловосульфидных рудах связаны с их формированием из кислых (pH 4.3) высоко хлоридных (6.6 m), растворов, в которых In находился в виде (InCl3aq) с концентрацией 0.002 m. Формирование кварц-касситеритовых руд происходило из близ нейтрального (pH 5.3), низко хлоридного (1.02 m) раствора, в котором In находился в виде гидроксокомплексов InO2H и ${\text{InO}}_{2}^{ - }$ c концентрацией не превышающей 0.00004 m, что, соответственно, и определило более низкие его содержания в этих рудах.
4. Компьютерное моделирование формирования индиеносных колчеданно-полиметаллических и барит-полиметаллических месторождений показывает, что их формирование происходило из высокотемпературных хлоридных (1.3–4.3 m) гидротермальных растворов близ нейтрального состава (pH 5.8–6). Основными формами нахождения индия в растворе, являлись гидроксокомплексы InO2H и ${\text{InO}}_{2}^{ - }$, обеспечивающие концентрации (5–9 × 10–5 m). При охлаждении раствора и изменении рН раствора снижалась устойчивость этих комплексов и происходило отложение индия совместно со сфалеритом и другими рудными минералами. Однако, в силу низких концентраций индия в гидротермальных растворах, образующиеся сульфидные минералы (сфалерит, пирит и халькопирит), отличаются более низкими содержаниями индия по сравнению минералами оловосульфидных руд.
5. Полученные данные указывают, что главным геохимическим фактором формирования повышенных концентраций индия в изученных месторождениях является состав исходного высокотемпературного рудообразующего раствора. Кислый высоко хлоридный раствор содержит высокие (до 0.002 m) концентрации индия в виде хлоридного комплекса (InCl3aq), у которого с понижением температуры раствора и его нейтрализации снижается устойчивость и In входил в структуру образующихся сульфидов или отлагался в виде самостоятельных минералов.
Работа выполнена при поддержке проекта госзадания № 0330-2016-0001 и Российского фонда фундаментальных исследований (проект № 14-05-00191).
Список литературы
Алтынов В.И., Птицын Б.В. (1962) Теория хлоросеребряного электрода и определение констант нестойкости комплексных хлоридов. Журнал неорганическая химия VII(9), 2103-2109.
Белеванцев В.И., Гущина Л.В., Оболенский А.А. (1982) Гидротермальные растворы и миграция ртути. Гидротермальное низкотемпературное рудообразование и метасоматоз. Новосибирск: Наука, 3-49.
Белеванцев В.И., Колонин Г.Р., Пещевицкий Б.И. (1977) О способах оценки констант устойчивости и возможной роли в минералообразовании смешанных комплексных соединений (на примере гидроксогалогенокомплексов). Основные параметры природных процессов эндогенного рудообразования. Институт геологии и геофизики. СО АН СССР, Новосибирск, III, 62-63.
Борисенко А.С., Холмогоров А.И., Боровиков А.А., Шебанин А.П., Бабич В.В. (1997) Состав и металлоносность рудообразующих растворов Депутатского оловорудного месторождения (Якутия). Геология и геофизика 38(11), 1830-1841.
Борисенко А.С., Павлова Г.Г., Боровиков А.А., Брянский Н.В. (2014) Состав и металлоносность рудообразующих флюидов Депутатского Sn-W (Ag) месторождения (Якутия). Тезисы Иркутск: Институт геохимии СО РАН, 8-9.
Бортников Н.С., Симонов В.А., Амплиева Е.Е., Боровиков А.А. (2014) Аномально высокие концентрации металлов во флюиде современной гидротермальной системы Семенов (Срединно-Атлантический Хребет 13о31' С.Ш.): изучение флюидных включений в минералах с помощью LA-ICP-MS. ДАН 456(5), 596-574.
Бусев А.И., Канаев Н.А. (1959). Вычисление констант устойчивости некоторых комплексных соединений индия методом постоянной разности по данным, полученным при помощи катионитов. Вестник Московского университета, серия: математика, механика, астрономия, физика, химия 1, 135-143.
Бутова М.Н., Зубков Л.Б., Чистов Л.Б. (1998) Проблемы развития сырьевой базы и производства индия. Минеральные ресурсы России. Экономика и управление 4, 3-8.
Вавра С., Руденко Н.П. (1964). Сорбция индия катионитом КУ-2 и константы устойчивости хлоридных комплексов индия в водно-этаноловых растворах. Вестник Московского университета, серия II, Химия 6, 14-17.
Гавриленко В.В., Ефименко С.А., Ткаченко Г.А., Панова Е.Г., Погребс Н.А. (1992) Геолого-структурные и минералого-геохимические особенности Правоурмийского оловорудного месторождения. Геология рудных месторождений 6, 34-47.
Гаськов И.В., Миронова Н.Ю., Перцева А.П. (1988) Геохимия руд колчеданно-полиметаллических месторождений северо-западной части Рудного Алтая. Геология и геофизика 6, 100-109.
Гаськов И.В., Дистанов Э.Г., Миронова Н.Ю., Чекалин В.М. (1991) Колчеданно-полиметаллические месторождения верхнего девона северо-западной части Рудного Алтая. Новосибирск: Наука, 121 с.
Гаськов И.В., Симонов В.А., Драничникова В.В., Тереня Е.О. (2005) Состав растворов и физико-химические условия рудоотложения на колчеданно-полиметаллических месторождениях северо-западной части Рудного Алтая (по флюидным включениям). Проблемы геологии и разведки месторождений полезных ископаемых. Томск, 229-231.
Гаськов И.В., Павлова Г.Г., Владимиров А.Г., Гвоздев И.И. (2014) Индий и другие элементы-примеси в рудах колчеданно-полиметаллических и оловосульфидных месторождений Сибири и Дальнего востока. Геология и минерально-сырьевые ресурсы Сибири 3(1), 67-71.
Гаськов И.В., Владимиров А.Г., Ханчук, Павлова Г.Г., Гвоздев И.И. (2017) Особенности распределения индия в рудах некоторых полиметаллических и оловосульфидных месторождений Сибири и Дальнего Востока России. Геология рудных месторождений 59(1), 62-74.
Гибшер Н.А. (1975) Исследования рудообразующих растворов Среднего полиметаллического и Зареченского барит-полиметаллического месторождений Рудного Алтая (по включениям в минералах). Минералогия эндогенных образований. Новосибирск, 67-69.
Годовиков А.А. (1975) Минералогия. Москва: Недра, 519 с.
Гричук Д.В. (2000) Термодинамические модели субмаринных гидротермальных систем. Москва: ГФ МГУ, 304 с.
Колонин Г.Р. (1978) О комплексных соединениях серебра, висмута и свинца со смешанными лигандами и возможностях учета их роли в гидротермальном рудообразовании. Исследования по экспериментальной минералогии. Новосибирск, 176-182.
Коростелев П.Г., Семеняк Б.И., Кокорин А.М. (1998) Индий в рудных месторождениях Дальнего востока. Стратегия использования и развития минерально- сырьевой базы редких металлов России в XXI веке: Тезисы докладов Международного. Симпозиума. Москва: ВИМС МПР, 77-79.
Мокеев А.А., Козловский Е.В., Васильев В.П. (1979) Изменения энтальпии и теплоемкости в реакциях образования простых и смешанных хлоридно-бромидных комплексов ртути II. Тезисы VIII Всесоюзной конференции по калориметрии и химической термодинамике. Иваново: 1, 185 с.
Наумов Г.Б., Рыженко В.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин. Москва. Атомиздат, 238 с.
Павлова Г.Г., Борисенко А.С., Прокопьев А.В., Иванов А.И., Боровиков А.А., Васюкова Е.А., Травин А.В. (2014) Индий в оловорудных месторождениях Якутии. Граниты и эволюция Земли. Тезисы II международной конференции. Новосибирск. ИГМ СОРАН, 164-166.
Павлова Г.Г., Владимиров А.Г., Гвоздев В.И., Коростелев П.Г., Семеняк Б.И., Гоневчук В.Г., Тишин П.А. (2016) Индиеносность оловосульфидной минерализации в оловорудных месторождениях Дальнего Востока России. ДАН 471(1), 71-76.
Попова В.И., Попов В.А., Коростелев П.Г., Орловский В.В. (2013) Минералогия руд W-Sn месторождения Тигриное на Сихотэ-Алине и перспективы его освоения. Институт Минералогии УО РАН. Екатеринбург: Наука, 132 с.
Родионов С.М. (2005) Металлогения олова Востока России. М.: Наука, 327 с.
Семеняк Б.И., Недашковский А.П., Никулин Н.Н. (1994) Минералы индия в рудах Правоурмийского месторождения (Дальний Восток, Россия). Геология рудных месторождений 36(4), 230-236.
Симонов В.А., Бортников Н.С., Лисицын А.П. (2002) Физико-химические условия минералообразования в современной гидротермальной постройке “Венский лес” (задуговой бассейн Манус, Тихий океан). Металлогения древних и современных океанов – 2002. Формирование и освоение месторождений в офиолитовых зонах. Миасс: И. Мин УрО РАН, 61-68.
Сущевская Т.М., Рыженко Б.Н. (2002) Моделирование смешения флюидов различной природы при осаждении касситерита. Геохимия 2, 184-193.
Syshevskaya T.M., Ryzhenko B.N. (2002) Simulation of mixing of fluids from different sources during cassiterite deposition. Geochem. Int. 40(2), 155-163.
Тереня Е.О., Симонов В.А., Зайков В.В. (2003) Физико-химические условия гидротермального минералообразования на колчеданном месторождении Кызыл-Таш (Восточная Тува). Металлогения древних и современных океанов – 2003. Формирование и освоение месторождений в островодужных системах. Миасс: И. Мин УрО РАН, 120-127.
Ходаковский И.Л. (1975) Некоторые вопросы термодинамики водных растворов при высоких температурах и давлениях. Физико-химические проблемы гидротермальных и магматических процессов. М.: Наука, 124-150.
Чураков С.В., Ткаченко С.И., Коржинский М.А., Бочарников Р.Е., Шмулович К.И. (2000) Термодинамическое моделирование эволюции состава высокотемпературных фумарольных газов вулкана Кудрявый, о. Итуруп, Курильские о-ва. Геохимия 5, 485-501.
Churakov C.V., Tkachenko C.I., Korzhinskii M.A., Bocharnikov R.E., Shmulovich K.I. (2000) Evolution of composition of high-temperature fumarolic gases from Kudryavy volcano, Iturup, Kuril Islands: the thermodynamic modeling. Geochem. Int. 38(5), 436-451.
Щербань И.П., Долгов Ю.А., Боровикова Г.А., Гибшер Н.А. (1980) Физико-химические условия формирования Рубцовского колчеданно-полиметаллического месторождения Рудного Алтая по термодинамическим и термобарометрическим данным. Геология и геофизика 1, 84-92.
Audetat A., Gunther D., Heinrich C.A. (2000) Magmatic-hydrothermal evolution in fractionating granite: a microchemical study of the Sn-W-F – mineralized Mole Granite (Australia). Geochim. Cosmochim. Acta 64, 3373-3393.
Baes Jr.C.E., Mesmer R.E. (1986) The Hydrolysis of Cations. Krieger Publishing Company, Malabar, Florida, 489 p.
Benzaazoua M., Marion P., Pinto A., Migeon H. and Wagner F.E. (2003) Mineral. Engineer. 16, 1291-1302.
Carleson B. G. F., Irving H. (1954). The Stability Constants of the Indium Halides. J. Chem. Soc. 4390-4399.
Cauzid J., Philippot P., Martinez-Criado G., Menez B., Laboure S. (2007) Contrasting Cu-complexing behavior in vapor and liquid fluid inclusions from Ynkee Lode tin deposit, Mole Granite, Australia. Chem. Geol. 246, 39-54.
Debye P., Huckel E. (1923) Zur Theorie der Electrolyte. Phys. Zeitsch., Bd 24 (9), 185-206.
Gerding P., Jonsson I. (1968) Termochemical Studies on Metal Complexes. VII. Free Energy, Enthalpy, and Entropy changes for stepwise formation of cadmium(II) chloride complexes at different ionic strengths. Acta Chem. Scand. 22(7), 2247-2254.
Ferri D. (1972a) On the complex formation equiliria between indium(III) and chloride ions. Acta Chem. Scand. 26, 733-746.
Ferri D. (1972b) On the hydrolis of the indium(III) ion in chloride solutions. Acta Chem. Scand. 26, 747-759.
Hasegawa Y., Shimada T., Nitsu M. (1980) Solvent extraction of 3B group metal ions from hudrochloric acid with trioctylphosphine oxid. J. Inorg. Nucl. Chem. 42, 1487-1489.
Heinrich C.A., Gunther D., Audetat A., Ulrich T., Frischknecht R. (1999) Metal fractionation between magmatic bring and vapor, detected by microanalysis of fluid inclusions. Geology, 27, 755-758.
Helgeson H.C., Kirkham D.H., Flowers G.G. (1981) Theoretical prediction of the thermodynamic behavior of aqueous electrolytes at high pressures and temperatures. IV. Calculation of activity coefficients, osmotic coefficients, and apparent molal and standard and relative partial molal properties to 5 kb and 600°C. Amer. J. Sci. 281, 1241-1516.
Kulik D.A., Wagner T., Dmytrieva S.V., Kozakowski G., Hingerl F.F., Chudnenko K.V., Berner U. (2013) GEM-Selektor geochemical modeling package: revised algorithm and GEMS3K numerical kernel for coupled simulation codes. Comput. Geosci. 17, 1-24.
Murakami H., Ishihara Sh. (2013) Trace elements of indium-bearing sphalerite from tin-polymetallic deposits in Bolivia, China and Japan: A femto-second LA-ICP-MS study. Ore Geol. Rev. 53, 223-243.
Pavlova G.G., Borovikov A.A. (2010) Silver-antimony deposits of Central Asia: Physico-chemical model of formation and sources of mineralization. Aust. J. Sci. 57, 755-775.
Pavlova G.G., Phan Luu Anh, Vladimirov A.G., Borisenko A.S., Seifert Th. (2013) Geodynamic setting of indium deposits formation. International symposium Lakge Igneous provinces of Asia Mantle plumes and metallogeny. Hanoi, Vietnam, 41-42.
Pavlova G.G., Palessky S.V., Borisenko A.S., Vladimirov A.G., Seifert Th., Phan Luu Anh.. (2015, a) Indium in cassiterite and ores of tin deposits of Russia. Ore Geol. Rev. 66, 99-113.
Pavlova G.G., Borisenko A.S., Borovikov A.A, Prokopiev A.V., Ivanov A.I. (2015, б) Indium in Tin and Sn-sulfide Ores of the Deputatsky Ore District (Yakutia). Absracts of the Joint Assembly AGU-GAC-MAC-CGU, Montreal, Canada, Abstract ID: 33272, 297-298.
Reed M.H. (1982) Calculation of multicomponent chemical equlibria and reaction processes in systems involving minerals, gases and an aqueous phase. Geochim. Cosmochim. Acta 46, 513-528.
de Ronde C.E.J., Massoth G.J., Butterfield D.A., Christenson B.W., Ishibashi J., Ditchburn R.G., Hannington M.D., Brathwaite R.L., Lupton J.E., Kamenetsky V.S., Graham I.J., Zelmer G.F., Dziak R.P., Emley R.W., Dekov V.M., Munnik F., Lahr J., Evans L.J., Takai K. (2011). Submarine hydrothermal activity and gold-rich mineralization at Brothers Volcano, Kermadec Arc, New Zealand. Mineral. Deposit. 46, 541-584.
Ryhl T. (1969) Thermodynamic properties of indium (III) halogenide and thiocyanate complexes in aqueous solution. Acta Chem. Scand. 23, 2667-2676.
Seifert Th., Sandmann D. (2006) Mineralogy and geochemistry of indium-bearing polymetallic vein-type deposits: Implication for host minerals from the Freiberg district, Eastern Erzgebirge, Germany. Ore Geol. Rev. 28, 1-31.
Schwarz-Schampera U., Herzig P.M. (2002) Indium: geology, mineralogy, and economics. Springer-Verlag Berlin Heidelberg, 269 p.
Shock E.L., Sassany D.C., Willis M., Sverjensky D.A. (1997) Inorganic species in geologic fluids: correlations among standard molal thermodynamic properties of aqueous ions and hydroxide complexes. Geochim. Cosmochim. Acta 61, 907-950.
Sverjensky D.A., Shock E.L., Helgeson H.C. (1997) Prediction of the thermodynamic properties of aqueous metal complexes to 1000°C and 5 kb. Geochim. Cosmochim. Acta 61(7), 1359-1412.
Sunden N. (1954). On the complex chemistry of the indium ion: Part IV. An investigation of the chloride and sulfate systems by ion exchangers. Svensk Kemisk Tidskrift 66, 173-178.
Tanger IV J.C., Helgeson H.C. (1988) Calculation of the thermodynamic and transport properties of aqueous species at high pressures and temperatures: Revised equations of state for standard partial molal properties of ions and electrolytes. Amer. J. Sci. 288, 19-98.
Tivey M.K. (2007) Generation of seafloor hydrothermal vent fluids and accociated mineral deposits. Oceanography 20(1), 50-65.
Tunaboylu K., Schwarzenbach G. (1970) Die Loslichkeit von Indiumsulfid. Chimia (Switzerland) 24, 424-427.
Turner D.R., Whitfield M., Dickson A.G. (1981) The equilibrium speciation of dissolved components in freshwater and seawater at 25°C and 1 atm pressure. Geochim. Cosmochim. Acta 45, 855-881.
Wood S. A., Samson I. M. (2006) The aqueous geochemistry of gallium, germanium, indium and scandium. Ore Geol. Rev., 57-102.
Дополнительные материалы отсутствуют.


