Геохимия, 2020, T. 65, № 5, стр. 499-510
Особенности аккумулирования химических элементов в биогеохимической пищевой цепи северной части Норильского плато
Ю. В. Ермолов a, *, М. А. Лебедева a, **, М. Г. Бондарь b, ***, Л. А. Колпащиков b, ****, А. С. Черевко a, *****, Н. Б. Смоленцев a, ******
a ФГБУН Институт почвоведения и агрохимии СО РАН
630090 Новосибирск, просп. Академ. Лаврентьева 8/2, Россия
b ФГБУ “Объединенная дирекция заповедников Таймыра”
663305 Норильск, ул. Талнахская, 22, Россия
* E-mail: ermolov.07@mail.ru
** E-mail: marinamyadelets@ya.ru
*** E-mail: mikisayan@yandex.ru
**** E-mail: ntnt69@yandex.ru
***** E-mail: ascherevko@yandex.ru
****** E-mail: nick-sm@yandex.ru
Поступила в редакцию 08.05.2018
После доработки 17.01.2019
Принята к публикации 17.01.2019
Аннотация
Исследовано влияние промышленных выбросов на содержание зольных химических элементов в звеньях биогеохимической цепи “снежный покров–почвы–кустарниковые ивы–белая куропатка” в пределах северной части Норильского плато. Обнаружен избыток металлов загрязнения (Ni, Cu, Co, Fe) и недостаток Mn в листьях ив и веточном корме белой куропатки (Lagopus Lagopus L.), свидетельствующий о несбалансированном поступлении этих химических элементов в организмы растений и животных. Выявлено повышенное накопление Cu, Ni, Fe и Cd в мышечной ткани куропатки. Аккумуляция кадмия в мышцах птицы не является следствием загрязнения, а связана с естественным повышенным содержанием этого металла в зимнем корме куропатки – концевых побегах и почках кустарниковых ив.
ВВЕДЕНИЕ
Одной из основных проблем геохимии окружающей среды и биогеохимии остается техногенное загрязнение (Сает и др., 1990, Добровольский, 2003, Ермаков и др., 2012). В промышленных районах оно нередко настолько сильное, что существенно снижает биоразнообразие, разрушает биоценозы, создает угрозу для здоровья населения. Пример этого – зона загрязнения выбросами Норильского горно-металлургического комбината (НГМК). Кислотное воздействие выбрасываемого НГМК в атмосферу сернистого ангидрида привело к деградации растительного покрова на обширной территории северо-западнее и юго-восточнее г. Норильска. Здесь произошла полная гибель древесного яруса (лиственницы), лишайников и мхов, наблюдается замещение мохово-лишайникового покрова злаково-осоковыми сообществами (Телятников, Пристяжнюк, 2008; Корец и др. 2014). Наряду с сернистыми соединениями территория сильно загрязнена тяжелыми металлами (Cu, Ni, Co, Cr и др.). Высокое содержание этих химических элементов (ХЭ) в местных почвах и растительности свидетельствует о возможности их избыточно-опасного поступления в организмы животных и человека не только с воздухом, но и по пищевой цепи (Яковлев и др., 2008, Водяницкий и др., 2011; Карпенко и др., 2012). Для объективной оценки поступления элементов загрязнения на верхние трофические уровни целесообразно исследование их накопления не только в компонентах окружающей среды и растительности, но и в организмах растительноядных животных, особенно если они являются значимым кормовым ресурсом для хищников или имеют промысловое значение. Обзор литературы показал, что такие комплексные биогеохимические работы в зоне воздействия выбросов НГМК не осуществлялись.
В связи с этим, целью настоящего исследования стало выяснение современного экологического статуса зольных ХЭ, включая поступающие с выбросами металлы, в системе “снежный покров–почвы–растения–животные”. В качестве тестовых биологических объектов были выбраны кустарниковые ивы (преимущественно Salix lanata L.) и белая куропатка (Lagopus lagopus L.). Такой выбор обусловлен непосредственной связью (пища-потребитель) этих организмов в пищевой цепи, существенной кормовой значимостью куропатки для ряда хищников (песца, кречета, полярной совы) и охотничье-промысловой ценностью для человека. Основной корм куропатки зимой – концевые побеги и почки кустарниковых ив. Ивы, по сравнению с другими кустарниками (карликовая березка, ольха), более устойчивы к загрязнению, ввиду чего сохранились даже в непосредственной близости от источников выбросов НГМК (Власова, 1990; Телятников, Пристяжнюк, 2008). Благодаря этой устойчивости загрязненная территория осталась пригодной для обитания белой куропатки.
ОБЪЕКТЫ И МЕТОДЫ
Обследовалась территория в 8–16 км южнее г. Норильска (69.23757 N, 88.21846 E – ближайший к Норильску пункт, 69.16975 N, 88.38264 E – наиболее удаленный от Норильска пункт), находящаяся в зоне основного выпадения грубодисперсной фракции техногенных аэрозолей (Власова, 1990). По другим данным (Онучин и др., 2014), участок работ непосредственно примыкает к ареалу, внутри которого выпадает 90% грубодисперсных техногенных аэрозолей. Он охватил отрезок долины р. Ергалах, фрагмент низкогорного хребта Лонгтокойский Камень и всхолмленной предгорной местности на переходе от гор к долине р. Рыбная. Горы (Ергалах, Медовая, Круглая, Черная) разделены глубоко врезанными долинами ручьев и рек, абсолютные высоты поверхности здесь варьируют от 102 м (долина р. Ергалах) до 648 м (вершина горы Ергалах). В почвенном покрове территории преобладают торфянистые или грубогумусные маломощные скелетные криотурбированные недифференцированные почвы супесчаного и легкосуглинистого гранулометрического состава. Присутствуют кислые, слабокислые и нейтральные (в местах выхода на поверхность известняков) почвы. Мощность почвенного профиля и количество мелкозема обычно увеличиваются от вершин и склонов гор к шлейфам и долинам водотоков. В пойме р. Ергалах распространены аллювиальные слоистые песчаные почвы.
Отбор образцов снега (n = 11) и отстрел птицы (n = 10) провели в конце марта 2014-го года. Пробы снега весом 2–3 кг, отбирали с учетом рекомендаций (Василенко и др., 1985) по разным элементам рельефа и экспозициям склонов с помощью цилиндрического пробоотборника (диаметр сечения – 11 см) по 2–10 кернов (в зависимости от мощности снега в пункте отбора), помещали в пластиковые емкости и взвешивали. Доставка снега в лабораторию была осуществлена в исходном фазовом состоянии. Отстрел куропатки проведен в местах кормления птиц – преимущественно в пределах поймы р. Ергалах. Отбор проб почв (n = 14) и листьев кустарниковых ив (Salix lanata L. (ива мохнатая) – 7 проб, Salix saxatilis Turez. ex Ledeb. (ива скальная) – 1 проба, Salix reticulata L. (ива сетчатая) – 1 проба) выполнен в августе 2014-го года. Для этого в разных ландшафтных условиях были выбраны 8 площадок размером 10 × 10 м, их размещение по абсолютной высоте ограничивалось уровнем подгольцового пояса (<400 м н. у. м.). Почвенные пробы отбирали из верхней толщи 0–20 см по выделенным в ее пределах почвенным горизонтам. Образцы почв складывались из 5 индивидуальных проб равного объема, взятых в пределах площадки методом “конверта”.
Исследование примесей снега выполнили раздельно для растворенной и твердой фаз примесей. Сразу после таяния проб в них определили водородный показатель (рН), потенциометрическим методом. Подготовка проб к элементному химическому анализу включала фильтрование снеговой воды через мембранные фильтры (“Владипор” МФАС-Б-4, средний диаметр пор 0.2 мкм), концентрирование фильтрата путем упаривания (Snyder-Conn, 1997) и кислотное автоклавное разложение осадка на фильтрах. Элементный анализ (Pb, Fe, Mn, Ni, Co, Zn, Cu, Cd, Cr) упаренного в 100 раз фильтрата снеговой воды провели методом масс-спектрометрии с индуктивно-связанной плазмой (ISP-MS) в аналитическом центре Института геологии и минералогии им. В.С. Соболева СО РАН. Определение содержания этих металлов в твердой фазе примесей было выполнено методом атомно-адсорбционной спектрометрии после кислотного разложения проб (Методические рекомендации.., 1986).
В пробах почвы валовое содержание химических элементов (ХЭ) и количество подвижных форм (экстрагент – ацетатно-аммонийный буфер с рН 4.8, в массовом соотношении почва/экстрагент – 1/10) определялось методом атомно-абсорбционной спектрометрии с пламенной атомизацией (М-МВИ-80-2008).
В листьях ивы определение общего количества ХЭ (Pb, Fe, Mn, Ni, Co, Zn, Cu, Cd, Cr, Al, Ti, Si, Ba, V, K, Ca, Mg, Sr, Y, Yb, Ga, Sc, Zr, Nb, Sn, Mo, P, La, Be, B) провели после сухого озоления проб методом атомно-эмиссионного спектрографического анализа с дуговым аргоновым двухструйным плазмотроном (Черевко и др., 2000).
Калибровку приборов и контроль точности количественного определения ХЭ в пробах почв и растений выполняли по аттестованным значениям их массовой доли в стандартных образцах. В их числе: ГСО дерново-подзолистой супесчаной почвы – СДПС-1 № 2498-83; ГСО дерново-подзолистой легкосуглинистой почвы – САДПП-09/3 № 18 809; ГСО черноземной выщелоченной среднесуглинистой почвы – САЧвП – 05/2 № 28813; ГСО состава травяной муки злаковой (гранулированной) (ТМЗг-01) № 10-176-2011. Относительная погрешность количественного определения элементов в пробах находилась в пределах 10%.
Для анализа накопления зольных ХЭ в организме L. lagopus у каждой птицы были взяты образцы мышечной ткани (грудная мышца, сердце) и содержимое зоба Определение количества ХЭ (Pb, Fe, Mn, Ni, Co, Zn, Cu, Cd, Cr, Ca, K, Mg) в этих пробах проводили методом атомно-абсорбционной спектрометрии с пламенной атомизацией (ГОСТ Р 53642-2009, МУ 01-19/47-11-92). Содержание ХЭ в печени и почках птиц, к сожалению, не исследовалось. Безусловно, эти органы более подходят для индикации загрязнения, чем мышечная ткань (они накапливают загрязняющие вещества в значительно большей степени), но для прогноза дальнейшей миграции загрязнителей по пищевой цепи в организмы хищников и человека более информативно содержание химических элементов в мышцах куропатки.
Все анализы выполнены в трех аналитических повторностях. Статистическую обработку данных проводили с помощью стандартного пакета программы “Microsoft Excel”. Рассчитаны значения средних и их стандартных ошибок, медиан и квартилей, коэффициентов корреляции (r) и вариации (V).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Снежный покров
Концентрации примесей и зольных химических элементов в пробах снега, отобранных в период максимального влагозапаса, позволяют оценить относительно “фона” средний уровень загрязнения приземного слоя воздуха за зимний период (для Норильска около 260 дней в году). Кроме того снег в нашем исследовании был важен еще и как источник воды в зимнем рационе куропатки. В качестве “фона” нами были использованы данные о концентрациях ХЭ в снеге центрального сектора Западной Сибири (Ермолов и др., 2014; Shevchenko et al., 2016).
Результаты лабораторного анализа показали, что все исследованные металлы (за исключением цинка) преимущественно поступили в снег в составе твердых примесей (рис. 1). Концентрация этих примесей в большинстве проб не превышает 20 мг/кг снега, но в трех образцах она оказалось существенно выше (78–302 мг/кг). Твердые примеси в этих трех пробах обеднены металлами загрязнения (Cu, Ni, Fe, Co, Сr) относительно остальных проб, что, по-видимому, является следствием значительного участия в их составе эрозионного материала, ввиду чего, данные по этим пробам нами не учитывались.
Рис. 1.
Диапазоны концентраций металлов в снеге (1 – “фон” в центральном секторе таежной зоны Западной Сибири, 2 – на обследованном участке зоны влияния выбросов НГМК).
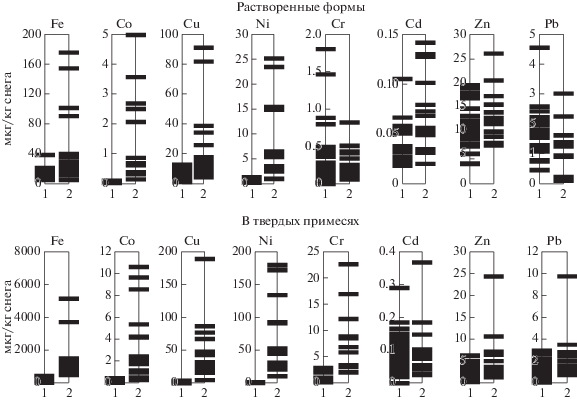
Без учета этих проб в снеге обнаружено значительное превышение (на порядок и более по медианам) “фоновых” концентраций Cu, Ni, Fe, Co (табл. 1). Особенно сильно превышен фон никеля (в 56 раз), существенно слабее – меди и железа (в 18 и 17 раз соответственно), еще слабее – кобальта (в 9 раз), хрома (в 4 раза), цинка и свинца (менее чем в 3 раза). Признаков загрязнения снега марганцем и кадмием не обнаружено.
Таблица 1.
Концентрации металлов в снеге, мкг/кг
| ХЭ | Район исследований min–med–max (n = 11) |
Фон min–med–max (n = 103) (Ермолов, 2014) |
Превышение фона (по медиане), раз |
|---|---|---|---|
| Ni | 11–39–96 | 0.06–0.70–3.45 | 56 |
| Cu | 12–35–67 | 0.6–2.0–4.2 | 18 |
| Fe | 520–978–1490 | 15–59–656 | 17 |
| Co | 0.4–1.9–6.3 | 0.04–0.21–2.79* | 9 |
| Cr | 2.1–2.9–12.7 | 0.14–0.73–3.2* | 4 |
| Zn | 9–15–32 | 1.5–5.2–21.0 | 2.9 |
| Pb | 1.9–3.2–4.4 | 0.1–1.3–4.1 | 2.5 |
| Mn | 3.9–9.6–14.9 | 1.0–5.4–37.4 | 1.8 |
| Cd | 0.09–0.10–0.40 | 0.02–0.10–0.23 | 1 |
По соотношению концентраций твердой и растворенной форм поступающие с выбросами металлы располагаются в следующем порядке (средние значения): Fe (43 ± 9) > Cr (22 ± 6) > > Ni (12 ± 2) > Pb (6 ± 3) > Co (2.6 ± 0.5) > Cu (1.8 ± ± 0.4). Наиболее устойчиво это соотношение для никеля и кобальта, о чем свидетельствуют очень высокие коэффициенты положительной корреляции между концентрациями твердой и растворенной форм ХЭ (r = 0.94 для Ni и r = 0.98 для Co). Для остальных металлов соотношение твердой и растворенной форм изменяется в широких диапазонах. Отчасти, особенно для железа и меди, это можно объяснить влиянием реакции среды (рН) на растворимость их соединений. Выборочные значения рН в пробах снеговой воды варьируют в диапазоне от 4.7 до 6.2, с подкислением отмечено закономерное увеличение концентраций растворенных форм железа (до 100 мкг/л) и меди (до 40 мкг/л).
Судя по соотношению форм, существенная часть меди и кобальта, в отличие от железа, никеля и хрома находится в растворимой форме, что согласуется с данными А.А. Онучина, который также отмечает, что присутствие растворимой формы металлов в атмосфере увеличивается с уменьшением размера и увеличением удельной площади поверхности аэрозольных частиц (Онучин и др., 2014). В связи с этим можно предположить, что Cu и Co сосредоточены в более мелких частицах техногенного аэрозоля, чем Ni, Fe, Cr, способны дольше находиться в воздушной среде и дальше мигрировать. Это подтверждается данными Т.М. Власовой (Власова, 1990), обнаружившей, что воздушное рассеивание Cu и Co в зоне воздействия выбросов НГМК прослеживается существенно дальше от источника эмиссии (свыше 100 км), чем Ni (35–40 км).
Таким образом, интенсивность техногенного поступления из атмосферы металлов на удалении 8–16 км южнее г. Норильска в зимний период 2013–2014 годов снижалась в ряду Ni > Cu ≈ Fe > > Co > Cr > Zn > Pb, что объясняется не только элементным составом выбросов, но и распределением ХЭ по видам и гранулометрическим фракциям аэрозолей.
Почвы
Анализ почвенных проб показал сильное загрязнение поверхностного слоя почвы медью и никелем (табл. 2). Оно прослеживается как по валовому содержанию, так и по количеству подвижных форм металлов. В маломощных (<10 см) поверхностных органогенных и органоминеральных горизонтах фоновые уровни общего содержания металлов (Подкорытов, 1969) превышены до 20 раз по меди (в среднем в 8 раз) и до 30 раз по никелю (в среднем в 17 раз). Загрязнение подвижными формами меди и никеля в этом слое варьирует от опасного до крайне опасного (СанПиН 2.1.7.1287-03). Вниз по профилю почвы общее содержание и концентрации подвижных форм этих металлов быстро снижаются, как правило, достигая безопасных значений уже в слое 10–20 см, что говорит о слабой миграции загрязнителей вглубь почвы.
Таблица 2.
Концентрации металлов в почвах, мг/кг
| ХЭ | 1 (n = 6) | 2 (n = 10) | Фон | ПДК подвижной формы (ГН 2.1.7.2041-06) |
|||
|---|---|---|---|---|---|---|---|
| общее содержание (вал) M ± m | подвижные формы M ± m |
общее содержание (вал) M ± m |
подвижные формы M ± m |
общее содержание (вал) М (Подкорытов, 1969) | подвижные формы* min–max |
||
| Zn | 92 ± 17 | 4.0 ± 3.2 | 91 ± 6 | 1.5 ± 0.3 | 75 | 0.16–16 | 23 |
| Cu | 253 ± 87 | 13.3 ± 3.7 | 49 ± 4 | 2.3 ± 0.8 | 32 | 0.02–2.5 | 3 |
| Cd | 0.8 ± 0.3 | − | 0.5 ± 0.1 | − | 0.4* | <0.1 | − |
| Pb | 3.5 ± 0.7 | 1.3 ± 0.2 | 5.1 ± 1.0 | 1.1 ± 0.2 | 17 | <0.1–3.9 | 6 |
| Ni | 349 ± 81 | 11.2 ± 3.1 | 71 ± 10 | 3.8 ± 0.5 | 21 | <0.2–2.4 | 4 |
| Co | − | 2.2 ± 0.4 | − | 1.0 ± 0.1 | 21 | − | 5 |
| Cr | − | <1 | − | <1 | 72 | <1 | 6 |
| Mn | − | 59 ± 15 | − | 27 ± 17 | 400 | 0.2–118 | − |
Концентрации подвижных форм Co и Cr в почвах остались на безопасном уровне (<ПДК) несмотря на значительное присутствие этих металлов в выбросах НГМК. Судя по данным анализа снега, хром поступает в почву почти исключительно в виде твердых примесей в малом относительно других загрязнителей количестве и, по-видимому, в дальнейшем существенно не меняет своих химических форм, в то время как значительная часть кобальта поступает в растворенной форме и, вероятно, утрачивает подвижность, связываясь почвой.
Признаков существенного загрязнения почв кадмием, цинком и свинцом не обнаружено, что согласуется с данными по снегу.
Листья ивы и содержимое зобов куропатки
Несмотря на преобладание в выборке проб одного вида ивы (S. lanata), варьирование концентраций большинства (2/3) исследованных химических элементов в листьях оказалось заметным (V > 30%). В золах варьирование несколько слабее, но при обоих способах выражения результатов в группу элементов со слабым варьированием концентраций (V < 20%) попали только Be, La, Ga, Zr, Y, Yb, K, умеренно варьируют (V < 30%) концентрации Ca, Mg и Si.
Содержание металлов загрязнения (Cu, Ni, Co, Cr, Fe) характеризуется существенно более высоким варьированием (V = 45–72%). В связи с этим проведенное нами сравнение средних и медианных значений с опубликованными данными следует рассматривать как ориентировочное, без утверждения статистической достоверности различий. Ввиду отсутствия сведений о региональном фоновом уровне концентраций ХЭ в листьях растений рода Salix в качестве “фона” мы использовали данные по северу Европы (Reimann et al., 2001; Reimann et al., 2015). Для концентраций в золе листьев ивы за “фон” были приняты сведения по южной тундре Центрального Ямала (Тентюков, 2010).
Зольность листьев ивы изменяется в пределах 7–11%, что в среднем соответствует их зольности при отсутствии техногенной нагрузки (7.46–8.14%) (Парибок и др., 1967; Игошина и др., 1996). Концентрации в золе листьев ивы многих ХЭ (Ba, Ti, Zr, V, Mn, Cu, Ni, Co, Mo, Cd, Fe) существенно отличаются от их фоновых значений и среднемировых содержаний в золе растений по В.В. Добровольскому (Добровольский, 2003) (табл. 3). Особенно сильное превышение обнаружено по кадмию (в 50 раз по медиане). В снеге и почвах нет аномальных концентраций этого металла, что свидетельствует об отсутствии внешних (техногенных или природных) причин его избыточного поступления в растения. Для большинства других металлов, концентрации которых в золе листьев ивы значительно превышают “норму” (Ni, Cu, Co, Fe) такого противоречия нет – территория ими загрязнена. Максимальная степень аккумулирования характерна для никеля (превышение фона в 21 раз по медиане) и меди (8-ми кратное превышение). Концентрации кобальта и молибдена превышают фоновый уровень в 4–5 раз. Относительно небольшое отклонение от фона (в 2–3 раза) обнаружено по свинцу. Концентрации хрома, несмотря на обнаруженные признаки загрязнения территории этим металлом, не отличаются от фонового уровня и заметно меньше среднемирового содержания в золе растений. Сильные отличия в меньшую сторону относительно этого репера обнаружены для зольных концентраций бария, титана, ванадия и марганца.
Таблица 3.
Концентрации ХЭ в золе листьев ив (n = 9), мг/кг золы
| ХЭ | (Q1–Me–Q3) | “Фон” южная тундра Центрального Ямала (Тентюков, 2010) (Q1–Me–Q3) | Среднее содержание в золе растительности суши (Добровольский, 2003) | КБП |
|---|---|---|---|---|
| Cu | 542–797–1308 | 77–100–133 | 160 | 29.5 |
| Ni | 706–778–914 | 31–37–75 | 40 | 15.6 |
| Co | 37–43–67 | 5.6–18–32 | 10 | 2.9 |
| Cd | 25–41–43 | − | 0.7 | 455.6 |
| Fe | 3228–3985–4798 | − | 2790 | 0.1 |
| Al | 1135–1575–1800 | − | − | 0.02 |
| Ti | 84–103–129 | 316–562–740 | − | 0.03 |
| Si | 8430–9180–9970 | − | 0.03 | |
| Ba | 40–53–58 | 131–178–750 | 450 | 0.1 |
| V | 3.3–3.5–4.7 | 10–15–32 | 30 | 0.03 |
| K | 111 000–120 000–127 000 | − | − | 5.4 |
| Ca | 90 875–117 000–131 500 | − | − | 6.6 |
| Mg | 23 550–27 900–36 750 | − | − | 1.6 |
| Mn | 399–551–777 | 1200–4900–5600 | 4100 | 0.7 |
| Sr | 473–644–744 | 86–237–316 | 700 | 2.4 |
| Y | 2.9–3.1–3.4 | 1–2–3 | 15 | 0.1 |
| Yb | 0.24–0.25–0.27 | − | − | 0.1 |
| Ga | 1.7–1.8–2.1 | 0.8–1–1.8 | 1 | 0.1 |
| Sc | 0.6–0.7–0.9 | 0.2–1.8–3.2 | − | 0.1 |
| Zr | 13–14–16 | 1–2–3 | 150 | 0.1 |
| Nb | 0.2–0.3–0.7 | 1.0–1.8–3.2 | − | 0.02 |
| Sn | 0.7–0.9–1.0 | 0.6–1–1.8 | 5 | 0.4 |
| Mo | 2.8–4.6–4.9 | 0.6–0.8–1 | 10 | 4.2 |
| P | 14 200–18 150–29 100 | 7500–10 000–13 300 | − | 26.3 |
| Zn | 553–1360–1745 | 1000–1150–1780 | 600 | 18.1 |
| Pb | 16–19–22 | 3.2–5.6–10 | 25 | 1.2 |
| Cr | 7.6–7.9–13.0 | 6.5–17.8–31.6 | 35 | 0.1 |
| La | 9–10–11 | − | 15 | 0.3 |
| Be | 0.50–0.53–0.57 | − | 2 | 0.2 |
| B | 127–134–163 | − | 500 | 3.9 |
В сухом веществе листьев ивы отклонения концентраций ХЭ относительно условного фона несколько иные. В данном случае между медью и никелем нет существенной разницы, их количества превышают фон приблизительно на порядок (табл. 4). Обнаруженное накопление меди и никеля в листьях ивы явно избыточное и, возможно, токсичное для растений (Kabata-Pendias, 2011). В отношении других металлов загрязнения это не столь очевидно. В 4–5 раз превышен фон по железу и свинцу, в 2–3 раза – по кобальту и молибдену.
Таблица 4.
Содержание ХЭ в листьях кустарниковых ив, мг/кг сухой массы
| ХЭ | M ± m (n = 9) |
Min | Max | Med | Север Европы (Reimann et al., 2001) | Содержание в листьях различных растений (Kabata-Pendias, 2011) | ||
|---|---|---|---|---|---|---|---|---|
| “фон”, Med |
зона воздействия Кольской ГМК, Med |
нормальное | токсичное | |||||
| Al | 153 ± 27 | 58 | 358 | 125 | 25 | 28 | − | − |
| B | 12.2 ± 1.0 | 7.4 | 20.0 | 11.7 | 15.9 | 14.4 | 10–100 | 50–200 |
| Ba | 4.6 ± 0.7 | 2.6 | 10.6 | 4.0 | 15.1 | 12.3 | − | 500 |
| Be | 0.04 ± 0.001 | 0.03 | 0.05 | 0.044 | <0.01 | <0.01 | <1–7 | 10–50 |
| Ca | 9048 ± 607 | 4310 | 11 133 | 9590 | 11 000 | 14 300 | − | − |
| Cd | 2.94 ± 0.31 | 1.14 | 4.34 | 2.8 | 2.1* | 0.34 | 0.05–0.2 | 5–30 |
| Co | 4.45 ± 0.81 | 1.07 | 9.68 | 3.83 | 1.76 | 4.58 | 0.02–1 | 15–50 |
| Cr | 0.8 ± 0.1 | 0.4 | 1.4 | 0.8 | 1.3* | 0.7 | 0.1–0.5 | 5–30 |
| Cu | 75.7 ± 11 | 27.8 | 140.0 | 69.4 | 7.7 | 45.1 | 5–30 | 20–100 |
| Fe | 337 ± 38 | 120 | 507 | 335 | 79 | 91 | − | − |
| K | 10 136 ± 614 | 6707 | 12 844 | 10 024 | 16 500 | 13 450 | − | − |
| La | 0.84 ± 0.03 | 0.7 | 1.0 | 0.84 | 0.63* | − | − | − |
| Mg | 2391 ± 171 | 1593 | 2965 | 2505 | 3010 | 2500 | − | − |
| Mn | 49 ± 7 | 21 | 94 | 46 | 310 | 60 | 30–300 | 400–1000 |
| Mo | 0.39 ± 0.07 | 0.09 | 0.90 | 0.35 | 0.11 | 0.24 | 0.2–5 | 10–50 |
| Na | 61 ± 9 | 19 | 129 | 57 | <20 | <20 | − | − |
| Ni | 71.5 ± 9.3 | 22.4 | 137.0 | 64.8 | 9.0 | 141.1 | 0.1–5 | 10–100 |
| P | 1713 ± 164 | 1048 | 2450 | 1774 | 3600 | 1285 | − | − |
| Pb | 1.55 ± 0.13 | 0.76 | 1.98 | 1.8 | 0.4* | 1.19 | 5–10 | 30–300 |
| Si | 810 ± 64 | 456 | 1109 | 851 | 97 | 117 | − | − |
| Sc | 0.06 ± 0.003 | 0.03 | 0.10 | 0.06 | <0.03 | <0.03 | − | − |
| Sr | 54.9 ± 5.4 | 28.7 | 89.8 | 52.9 | 37.3 | 59.9 | − | − |
| Sn | 0.08 ± 0.01 | 0.04 | 0.13 | 0.07 | <0.01 | 0.06 | − | 60 |
| Ti | 9.7 ± 1.2 | 4.7 | 17.9 | 8.7 | 7* | − | − | 50–100 |
| Ga | 0.16 ± 0.01 | 0.10 | 0.19 | 0.16 | <0.1 | − | − | − |
| V | 0.39 ± 0.06 | 0.20 | 0.83 | 0.33 | <2* | 0.64 | 0,2–1,5 | 5–10 |
| Y | 0.25 ± 0.14 | 0.193 | 0.351 | 0.2 | 0.075 | 0.084 | − | − |
| Yb | 0.022 ± 0.001 | 0.017 | 0.028 | 0.022 | − | − | − | − |
| Zn | 103.4 ± 18.7 | 19.7 | 214.4 | 95.5 | 125.0 | 23.5 | 25–150 | 100–400 |
| Zr | 1.25 ± 0.06 | 0.91 | 1.53 | 1.3 | 0.04 | 0.07 | − | 15 |
| Зола, % | 8.5 ± 0.5 | 7.0 | 11.0 | 7.8 | − | − | − | − |
Подобная аккумуляция всех этих металлов различными видами ивы обнаружена в зоне воздействия Кольской ГМК (Парибок и др., 1967; Reimann et al., 2001). Такое же сходство, но при сильно пониженных относительно фона концентрациях (в 5–6 раз по медиане), наблюдается для марганца, что, по-видимому, связано с антагонизмом между марганцем и металлами-загрязнителями при поступлении в растения (Kabata-Pendias, 2011).
Близость концентраций к фону (отличие медиан менее чем в 2 раза) обнаружена для B, Ca, K, Mg, Sr, Ti, La, Zn, Cr, Cd. При этом, как и в случае с концентрацией в золе, в сухом веществе листьев ивы выявлено сильное превышение концентрации кадмия над средним содержанием этого элемента в растительности суши (Романкевич, 1988). Вместе с тем, корреляционных связей между накоплением кадмия и металлов-загрязнителей в листьях не обнаружено. Учитывая это и отсутствие признаков загрязнения снежного покрова и почв кадмием, нет оснований считать высокое накопление кадмия в листьях ив следствием загрязнения, и следует согласиться с выводом ряда исследователей (Gough, Wilson, 1999; Han, 2010; Gough, Lamothe, 2013; Петрунина и др., 2013; Ермаков и др., 2015;) о том, что ивы являются типичными концентраторами этого металла.
Медиана и средняя концентрация цинка в листьях ив соответствуют обычному уровню, подтверждая отсутствие существенного загрязнения территории этим элементом. О преимущественно корневом поглощении Zn, свидетельствует высокий коэффициент корреляции (0.87) между его содержанием в пробах почв и листьях ив. Обнаружена тесная связь между концентрациями кадмия и цинка в листьях ив (r = 0.88), которая объясняется синергизмом их корневого поглощения растениями вследствие сходства химических свойств этих металлов (Kabata-Pendias, 2011).
Для Ni и Cu связей между концентрациями в почвах и растениях не выявлено. Также не обнаружено влияния pH почв на поступление этих ХЭ в растения. Отсутствие этих связей свидетельствует в пользу того, что существенную или даже ведущую роль в загрязнении растений играет фолиарное поступление металлов после осаждении техногенных аэрозолей на поверхность листьев.
Высокие уровни содержания металлов загрязнения и кадмия в листьях ивы указывают на возможность их избытка в веточном корме куропатки. Частичное подтверждение этого обнаружено при исследовании содержимого зоба птиц (которое на 100% состояло из почек ивы). Его результаты (табл. 5) выявили сильное превышение содержания никеля в местном корме куропатки относительно корма из других районов Западного Таймыра (в среднем – в 57 раз) и относительно максимально допустимого уровня (МДУ) (в 63 раза). Обнаруженные концентрации никеля не превысили, но в части проб оказались довольно близки к ориентировочному порогу токсичности этого металла в кормах (200–300 мг/кг) (Outridge, Scheuhammer, 1993). Таким образом, учитывая сильную изменчивость выборочных концентраций никеля в ивах, нельзя исключить возможности потребления куропатками кормов с токсичным для животных содержанием никеля.
Таблица 5.
Концентрации химических элементов в корме, мг/кг сухой массы
| ХЭ | Содержимое зоба куропатки |
Пороговые концентрации в кормах сельскохозяйственных животных (Ковальский, 1974) | МДУ в комбикормах птицы (Временный максимально допустимый уровень…, 1987) |
||
|---|---|---|---|---|---|
| данные авторов |
западный Таймыр (Кочкарев, 2012) | оптимальная концентрация | верхняя пороговая концентрация |
||
| Mn | $\frac{{12 \pm 2}}{{4 - 18}}$ | − | 20–60 | 60–70 | − |
| Fe | $\frac{{78 \pm 11}}{{49 - 149}}$ | $\frac{{37 \pm 5}}{{24 - 49}}$ | 24–30 | − | 100 |
| Cu | $\frac{{57 \pm 4}}{{38 - 79}}$ | − | 3–12 | 20–40 | 80 |
| Zn | $\frac{{39 \pm 6}}{{22 - 79}}$ | − | 20–60 | 60–100 | 50 |
| Ni | $\frac{{63 \pm 7}}{{44 - 113}}$ | $\frac{{1.1 \pm 0.03}}{{0.09 - 1.6}}$ | − | − | 1 |
| Cd | $\frac{{0.3 \pm 0.03}}{{0.13 - 0.41}}$ | $\frac{{0.12 \pm 0.02}}{{0.09 - 0.17}}$ | − | − | 0.3 |
| Pb | $\frac{{2.2 \pm 0.4}}{{0.4 - 4.1}}$ | $\frac{{0.23 \pm 0.04}}{{0.18 - 0.75}}$ | − | − | 3 |
Выборочные средние количества других металлов в содержимом зоба птиц не превышают МДУ, хотя в отдельных пробах встречается избыток Fe, Cd, Zn. Ориентируясь на верхний порог оптимума содержания в кормах (Ковальский, 1974) можно также отметить небольшой избыток меди. Превышение “фона” концентрации в корме куропатки (в среднем в 10 раз) обнаружено по свинцу, но случаев превышения МДУ этого металла нет.
Количество марганца, во всех пробах содержимого зобов оказалось ниже диапазона оптимальных концентраций, что согласуется с данными по содержанию этого элемента в пробах листьев ив и свидетельствует о недостатке этого элемента в рационе птицы.
Мышечная ткань Lagopus lagopus L.
Тяжелые металлы в организме L. lagopus активно исследуются, но абсолютное большинство работ посвящено оценкам их накопления в почках и печени (Wren et al., 1994; Myklebust et al., 1999; Pedersen et al., 2006; Rodrigue et al., 2007). Исследования мышц очень редки (нам известна только одна публикация по очень малой выборке птиц, Kuhnlein et al., 2002), хотя именно по концентрации в мышечной ткани можно оценить поступление металлов в следующие звенья пищевой цепи. Ограниченность сведений не позволяет судить о норме существования вида, ввиду чего для сравнения нами были использованы также данные по содержанию ХЭ в мышечной ткани других тетеревиных, эти данные приняты за условный фон.
Судя по полученным данным, скелетные мышцы белой куропатки обогащены всеми исследованными металлами по сравнению с сердцем (табл. 6), особенно сильные различия концентраций обнаружены по Ni и Со (в среднем в 4.2 и 3.3 раза соответственно). Если эти различия связаны с уровнем загрязнения, то они могли бы использоваться для индикации загрязнения.
Таблица 6.
Содержание химических элементов в мышечной ткани птиц, мг/кг сырой массы
| ХЭ | Белая куропатка (Lagopus lagopus L.) | Тетереви́ные (Tetraoninae) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| зона воздействия НГМК, n = 10 | Канада | Таймыр (Устименко, 1973), Lagopus mutus L.,n = 11 | Мурманская область (Дударев, 2015), Lagopus sp. | Финляндия (Hanseт, 2017) Lagopus spp. n = 5 |
Читинская область (Устименко, 1973), | Карелия (Медведев, 2003) | ||||||
| грудная мышца |
сердце | (Kuhnlein, 2002), n = 3 | (Langlois, 1995), n = 5 | Perdix perdix L., n = 11 |
Bonasa bonasia L., n = 11 | Tetrao urogallus L.,n = 7 | Lyrurus tetrix L., n = 5 | Bonasa bonasia L., n = 7 | ||||
| Ca | $\frac{{155 \pm 17}}{{83 - 237}}$ | $\frac{{93 \pm 20}}{{73 - 113}}$ | 300 | − | 161 | − | − | 134 | 173 | − | − | − |
| K | $\frac{{8134 \pm 574}}{{4805 - 10{\kern 1pt} 691}}$ | $\frac{{3966 \pm 522}}{{3444 - 4488}}$ | 4320 | − | − | − | − | − | − | − | − | − |
| Mg | $\frac{{689 \pm 66}}{{375 - 1041}}$ | $\frac{{294 \pm 49}}{{245{\kern 1pt} - {\kern 1pt} 343}}$ | 370 | − | − | − | − | − | − | − | − | − |
| Mn | $\frac{{0.45 \pm 0.07}}{{0.2 - 0.8}}$ | $\frac{{0.14 \pm 0.01}}{{0.14 - 0.14}}$ | 0.6 | − | 1.20 | − | − | 2.27 | 1.35 | − | − | − |
| Fe | $\frac{{120.9 \pm 11.1}}{{70 - 190}}$ | $\frac{{75.4 \pm 1.98}}{{73.3 - 77.5}}$ | 100 | − | 64 | − | − | 45.1 | 24.2 | − | − | − |
| Cu | $\frac{{8.0 \pm 0.6}}{{4.3 - 10.5}}$ | $\frac{{5.7 \pm 0.1}}{{5.6 - 5.7}}$ | 4 | − | 4.9 | 4.1 | $\frac{{5.2}}{{5.2 - 5.2}}$ | 5.9 | 3.6 | $\frac{{3.1 \pm 0.3}}{{2.1 - 4.1}}$ | $\frac{{3.2 \pm 0.2}}{{2.6 - 3.8}}$ | $\frac{{4.5 \pm 1.0}}{{2.1 - 8.4}}$ |
| Zn | $\frac{{20.8 \pm 1.7}}{{11.8 - 28.8}}$ | $\frac{{16.8 \pm 1.1}}{{15.7 - 17.9}}$ | 12 | − | − | 6.3 | − | − | − | $\frac{{27.8 \pm 5.9}}{{8.2 - 44.0}}$ | $\frac{{24.1 \pm 5.5}}{{13.1 - 44.0}}$ | $\frac{{24.9 \pm 5.7}}{{9.4 - 43.5}}$ |
| Ni | $\frac{{0.42 \pm 0.06}}{{0.18 - 0.74}}$ | $\frac{{0.10 \pm 0.04}}{{0.06 - 0.13}}$ | − | − | − | 0.1 | $\frac{{0.004}}{{0.003 - 0.005}}$ | − | − | $\frac{{0.12 \pm 0.03}}{{0.04 - 0.24}}$ | $\frac{{0.13 \pm 0.05}}{{0.06 - 0.32}}$ | $\frac{{0.17 \pm 0.02}}{{0.12 - 0.23}}$ |
| Cd | $\frac{{0.33 \pm 0.08}}{{0.06 - 0.94}}$ | $\frac{{0.25 \pm 0.11}}{{0.14 - 0.36}}$ | 0.61 | 0.27 | − | 0.02 | $\frac{{0.008}}{{0.007 - 0.01}}$ | − | − | $\frac{{0.19 \pm 0.04}}{{0.06 \pm 0.35}}$ | $\frac{{0.32 \pm 0.16}}{{0.06 - 0.95}}$ | $\frac{{0.64 \pm 0.16}}{{0.34 - 1.57}}$ |
| Pb | $\frac{{0.52 \pm 0.08}}{{0.28 - 1.13}}$ | $\frac{{0.17 \pm 0.02}}{{0.15 - 0.2}}$ | − | <0.1 | − | 0.17 | <0.005 | − | − | $\frac{{1.28 \pm 0.38}}{{0.33 - 3.25}}$ | $\frac{{0.86 \pm 0.31}}{{0.19 - 1.77}}$ | $\frac{{2.18 \pm 0.88}}{{0.34 - 7.13}}$ |
| Co | $\frac{{0.20 \pm 0.02}}{{0.10 - 0.29}}$ | $\frac{{0.06 \pm 0.02}}{{0.05 - 0.08}}$ | − | − | 0.26 | 0.01 | − | 0.148 | 0.21 | − | − | − |
| Cr | $\frac{{0.34 \pm 0.04}}{{0.18 - 0.57}}$ | $\frac{{0.12 \pm 0.01}}{{0.1 - 0.12}}$ | − | − | − | − | − | − | − | − | − | − |
Коэффициенты варьирования концентраций в образцах скелетных мышц куропатки возрастают в ряду: K(22%) > Cu(24%) > Zn(26%) > Fe(29%) > Mg(30%) > Na(34%) > Ca(35%) > Cr(38%) > Со(40%) > Mn(46%) > Pb(47%) = Ni(47%) > Cd(75%). Между химическими элементами, для которых обнаружено относительно слабое варьирование концентраций (K, Cu, Zn, Fe, Mg, Na, Са), выявлены тесные положительные парные корреляции. Особенно высокие коэффициенты корреляции (r > 0.9) найдены между суммарной концентрацией (мг-экв/кг сырой массы) катионов электролитного фона (K + Na + Mg + Ca) и Cu, Zn, Fe. Соотношения концентраций в среднем равны: Fe/Cu = 26, Fe/Zn = 10, Zn/Cu = 2.5, (К + Na + Mg + Ca)/Fe = 50, (K + Na + Mg + + Ca)/Cu = 1290, (K + Na + Mg + Ca)/Zn = 508. Все эти элементы входят в число “металлов жизни”, т.е., безусловно, необходимы для животных (Уильямс, 1975). Слабое варьирование концентраций и их соотношений (коэффициенты варьирования соотношений не превышают 18%) объясняется их взаимосвязанной жесткой физиологической регуляцией, поэтому загрязнение внешней среды медью и железом в зоне воздействия выбросов НГМК, может не отразиться на содержании этих металлов в мышечной ткани куропатки. Тем не менее, сравнительный анализ показывает (табл. 6), что концентрации большинства элементов загрязнения (Cu, Ni, Fe) в скелетных мышцах у белой куропатки выше, чем у тетеревиных из других регионов (без утверждения достоверности различий). Так, средняя концентрация меди в нашей выборке превысила условно-фоновые величины в 1.4–2.6 раза, что, учитывая небольшой коэффициент варьирования выборочных значений (24%), можно расценить как влияние загрязнения внешней среды. Вместе с тем, обнаруженные превышения условного фона во много раз меньше, чем превышения в снеге, почвах и растительности, а значит чувствительность индикации загрязнения медью по накоплению в мышцах куропатки слабая. Оценка относительного накопления железа оказалась затруднена в связи с широким разбросом опубликованных данных, тем не менее, среднее содержание железа в мышцах исследованной нами птицы превышает условный фон от 1.2 до 5.0 раз. Для среднего содержания никеля кратность превышения условно-фоновых значений варьирует от 2.5 до 4 раз, хотя, сильная вариабельность выборочных концентраций Ni (V = 47%) также указывает на ненадежность индикации загрязнения этим способом.
Не выявлено признаков относительного накопления кобальта и металлов не входящих в число поллютантов (Mn, Zn, Pb, Cd). Содержание марганца оказалось даже ниже, чем в птицах из других регионов (в 1.3–5.0 раз) что говорит о возможном его недостатке вследствие малого количества в корме.
Действующие гигиенические нормативы (СанПиН 2.3.2.1078-01) не нормируют содержание Cu, Ni, Fe, Co, Cr в мясной продукции. Учитывая слабое накопление металлов загрязнения в мышцах куропатки относительно тетеревиных птиц из других регионов, избыточно-опасное поступление этих ХЭ с мясом птицы в организмы хищников и человека маловероятно. В тоже время обнаружено сильное превышение ПДК кадмия (50 мкг/кг мяса), хотя признаков его техногенного поступления на обследованную территорию, как было показано выше, нет. Этот парадокс является прямым следствием питания куропатки кустарниковыми ивами, которые накапливают кадмий активнее большинства других растений. Связь зимнего питания куропаток ивовыми побегами с высоким накоплением кадмия в печени и почках была показана в разных регионах (Larison, 2002; Rodrigue et al., 2007). В связи с повышенным уровнем содержания кадмия в мясе куропатки обсуждается вопрос его токсикологической безопасности для человека (Rodrigue et al., 2007; Кочкарев, 2014). Судя по средней концентрации Cd в нашей выборке – 330 мкг/кг, которая превышает ПДК в 6.6 раза для получения максимальной допустимой суточной дозы Cd (70 мкг) человеку достаточно употребить 0.21 кг мяса куропатки в сутки. Однако, принимая во внимание небольшой объем выборочных данных и высокий коэффициент варьирования выборочных значений, это заключение требует подтверждения и уточнения.
ВЫВОДЫ
1. В зоне сильного загрязнения выбросами НГМК превышение условно-фоновых концентраций металлов-загрязнителей снижается в ряду снег > поверхностный слой почвы > листья кустарниковых ив > мышечная ткань белой куропатки.
2. В зимний период 2014 года относительное загрязнение приземного слоя воздуха тяжелыми металлами на удалении 8–16 км южнее предприятий НГМК снижалось в ряду: Ni > Cu > Fe > Co > > Cr > Zn > Pb. Не обнаружено признаков загрязнения марганцем и кадмием.
3. В результате многолетнего аэротехногенного загрязнения, опасное накопление металлов-загрязнителей в почвах наблюдается лишь в поверхностном маломощном органогенном горизонте, нижележащая минеральная толща почвы, как правило, не загрязнена.
4. Загрязнение воздуха и почв приводит к сильному накоплению металлов (Ni, Cu, Fe, Co) в растениях, многократному превышению их фоновых концентраций в листьях кустарниковых ив и зимнем корме белой куропатки, а также к неблагоприятному для растений, высокому соотношению Fe/Mn.
5. Salix lanata, как и многие другие виды ив, является концентратором кадмия, поэтому, преобладание побегов и почек кустарниковых ив в зимнем корме белой куропатки – причина высокого содержания кадмия в ее мышцах.
6. Вследствие физиологической регуляции содержания химических элементов в мышечной ткани, относительное накопление в ней поступающих с выбросами НГМК металлов (Cu, Ni, Fe, Co) выражено слабо, что не позволяет достоверно выявить степень загрязнения. Избыточное поступление этих металлов в зоне загрязнения выбросами НГМК с мясом куропатки в организмы хищников и человека маловероятно: ежедневное употребление этого мяса не способно существенно превысить обычных для человека суточных доз меди (2.5 мг) и никеля (0.3–0.6 мг). Более опасно оно в отношении кадмия, концентрация которого в мышечной ткани куропатки в среднем превышает гигиенический норматив в 6.6 раза.
Список литературы
Василенко В.Н., Назаров И.М., Фридман Ш.Д. (1985) Мониторинг загрязнения снежного покрова. Л.: Гидрометеоиздат, 181 с.
Власова Т.М. (1990) Биоиндикация аэротехногенного загрязнения в условиях Енисейского севера. Дисс. канд. биол. наук. М.: ИЭМЭЖ., 174 с.
Водяницкий Ю.Н., Плеханова И.О., Прокопович Е.В., Савичев А.Т. (2011) Загрязнение почв выбросами предприятий цветной металлургии. Почвоведение (2), 240-249.
Временный максимально допустимый уровень (МДУ) содержания некоторых химических элементов и госсипола в кормах для сельскохозяйственных животных и кормовых добавках (1987). М.: Государственный агропромышленный комитет СССР; Главное управление ветеринарии.
Григорьев Н.А. (2009) Распределение химических элементов в верхней части континентальной коры. Екатеринбург: УрО РАН, 382 с.
Добровольский В.В. (2003) Основы биогеохимии. М.: Издательский центр “Академия”, 400 с.
Дударев А.Н., Душкина Е.В., Чупахин В.С., Сладкова Ю.Н., Бурова Д.В., Гущин И.В., Талыкова Л.В., Никанов А.Н., Лукичева Л.А. (2015) Содержание металлов в местных продуктах питания Печенгского района Мурманской области. Медицина труда и промышленная экология. (2), 35-40
Ермаков В.В., Карпова Е.А., Корж В.Д., Остроумов С.А. (2012) Инновационные аспекты биогеохимии. М.: ГЕОХИ РАН, 360 с.
Ермаков В.В., Петрунина Н.С., Тютиков С.Ф., Данилова В.Н., Хушвахтова С.Д., Дегтярев А.П., Кречетова Е.В. (2015) Концентрирование металлов растениями рода Salix и их значение при выявлении кадмиевых аномалий. Геохимия (11), 978-990.
Ermakov V.V., Petrunina N.S., Tyutikov S.F., Danilova V.N., Khushvakhtova S.D., Degtyarev A.P., Krechetova E.V. (2015) Concentrating Metals of the Genus Salix and Their Importance for Indetification of Cd Anomalies. Geochem.Int. 53 (11), 951-963.
Ермолов Ю.В., Махатков И.Д., Худяев С.А. (2014) Фоновые концентрации химических элементов в снежном покрове центрального сектора Западной Сибири. Оптика атмосферы и океана 27(9), 790-800.
Игошина Т.И., Алексеева-Попова Н.В., Секретарева Н.А. (1996) О накоплении минеральных элементов представителями семейств Salicaceae и Ericaceae на известковых и силикатных породах (Юга-Восток Чукотского полуострова). Ботанический журнал 81(1), 38-48.
Карпенко Л. В., Анискина А.А., Пермякова Г.В. (2012) Состояние растительности болот в зоне техногенного воздействия Норильского горного металлургического комбината. География и природные ресурсы (1), 56-62
Ковальский В.В. (1974) Геохимическая экология М.: Наука, 302 с.
Корец М.А., Рыжкова В.А., Данилова И.В. (2014) Использование ГИС для оценки состояния наземных экосистем Норильского промышленного района. Сибирский экологический журнал (6), 887-902.
Кочкарев П.В. (2014) Роль слепых отростков белой куропатки (Lagopus lagopus montin. 1976) в процессе регулирования микроэлементного состава. Вестник КрасГАУ. Серия Экология (10), 122-126.
Кочкарев П.В. (2012) Сравнительный анализ потребления тяжелых металлов растительноядными участниками тундровой биоты на зимних пастбищах Западного Таймыра. Вестник КрасГАУ (10), 110-112.
Медведев Н. В. (2003) Загрязненность тяжелыми металлами организмов тетеревиных птиц Карелии. Петрозаводск, Ин-т леса Кар. НЦ РАН, 17 с.
Методические рекомендации по спектральному определению тяжелых металлов в биологических материалах и объектах окружающей среды (1986), М.: Б. И., 52 с.
Онучин А.А., Буренина Т.А., Зубарева О.Н., Трефилова О.В., Данилова И.В. (2014) Загрязнение снежного покрова в зоне воздействия предприятий Норильского промышленного района. Сибирский экологический журнал (6), 1025-1037.
Парибок Т.А., Алексеева-Попова Н.В., Норин Б.Н. (1967) Содержание микроэлементов в растениях лесотундры. Ботанический журнал 52(1), 13-27.
Подкорытов Ф.М. (1969) Биологическое поглощение элементов растениями Таймырского национального округа. Микроэлементы в растениях. Тр. Бурятского инст. естественных наук БФ СО АН СССР. Выпуск 5. Улан-Удэ, 107-133.
Петрунина Н.С., Ермаков В.В., Тютиков С.Ф., Проскурякова Л.В., Дегтярев А.П., Кречетова Е.В. (2013) Способ биогеохимического мониторинга загрязнения среды кадмием: пат. 2486507 РФ: RU 2 486 507 C1 / Дата публикации: 27.06.2013 г. Бюлл. № 18.
Романкевич Е.А. (1988) Живое вещество Земли (биогеохимические аспекты проблемы). Геохимия (2), 292-306.
Сает Ю.Е., Ревич Б.А., Янин Е.П., Ачкасов А.И., Башаркевич И.Л., Онищенко Т.Л., Павлова Л.Н., Саркисян С.Ш., Смирнова Р.С., Трефилова Н.Я., (1990) Геохимия окружающей среды. М.: Недра, 335 с.
Телятников М.Ю., Пристяжнюк С.А. (2008) Трансформация растительного покрова в зоне воздушных выбросов предприятий г. Норильска. География и природные ресурсы (2), 40-45.
Тентюков М.П. (2010) Геохимия ландшафтов равнинных тундр (на примере Ямала и Большеземельской тундры). Сыктывкар, 260 с.
Устименко Л.И. (1973) Содержание макро- и микроэлементов в мышечной ткани диких промысловых пернатых. Товароведение животного сырья. Сб. научн. трудов 68, 143-146.
Черевко А.С., Сысо А.И., Полякова Г.Е. (2000) Одновременное атомно-эмиссионное спектрографическое определение с дуговым аргоновым двухструйным плазматроном макро- и микроэлементов в золе растительных материалов. Агрохимия (10), 75-82.
Яковлев А.С., Плеханова И.О., Кудряшев С.В. (2008) Оценка и нормирование экологического состояния почв в зоне деятельности предприятий металлургической компании “Норильский никель”. Почвоведение (6), 737-750.
Eisler R. (1998) Copper hazards to fish, wildlife, and invertebrates: a synoptic review. U.S. Geological Survey, Biological Resources Division, Biological Science Report, 120 p.
Gough L. P., Lamothe P. J. (2013) Cadmium geochemistry of soils and willow in a metamorphic bedrock terrain and its possible relation to moose health, seward peninsula, Alaska. Alces 49, 99-111.
Gough L.P., Wilson F.H. (1999) Biogeochemistry of Arsenic and Cadmium, Fortymile River Watershed, East-Central Alaska. Geologic Studies in Alaska by the U.S. Geological Survey, 109-126. http://pubs.dggsalaskagov.us/webpubs/ usgs/p/text/p1633.pdf
Han S.H., Kim D.H., Lee J.C. (2010) Cadmium and zinc interaction and phytoremediation potential of seven Salix caprea clones. Ecol. Field Biol. 33(3), 245-251.
Hansen M., Nost T., Heimstad E., Evenset A., Dudarev A., Rautio A., Myllynen P., Dushkina E., Jagodic M., Christensen G., Anda E., Brustad M., Sandanger T. (2017) The Impact of a Nickel-Copper Smelter on Concentration of Toxic Elements in Local wild food from the Norwegian, Finnish, and Russian border regions. Int. J. Environ. Res. Public Health 14 (7), https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC5551132/pdf/ijerph-14-00694.pdf
Kabata-Pendias A. (2011) Trace Elements in Soils and Plants. Taylor & Francis Group, Boca Raton London New York, 105 p.
Kuhnlein H.V., Chan H.M., Leggee D., Barthet V. (2002) Macronutrient, Mineral and Fatty Acid Composition of Canadian Arctic Traditional Food. J. Food Compos. Anal. 15(5), 545-566.
Langlois C., Langis R. (1995) Presence of airborne contaminants in the wildlife of northern Quebec. Sci. Total Environ. (160–161), 391-402.
Larison J.R. (2002) Effects of cadmium on white-tailed ptarmigan in Colorado. NAAMLP 24th Annual Conference Proceedings Technical paper session 5 – Biology/Vegetation, 188-197. https://fs.ogm.utah.gov/PUB/MINES/AMR_ Related/NAAMLP/BioVeg/Larison.pdf
Myklebust I., Pedersen H.C. (1999) Accumulation and Distribution of Cadmium in Willow Ptarmigan. Ecotoxicology (8), 457-465.
Outridge P.M., Scheuhammer A.M. (1993) Bioaccumulation and toxicology of nickel: implications for wild mammals and birds. Environ. Reviews 1(2), 172-197.
Pedersen H.C., Fossøy F., Kålås J.A., Lierhagen S. (2006) Accumulation of heavy metals in circumpolar willow ptarmigan (Lagopus lagopus l.) populations. Sci. Total Environ. 371, 176-189.
Reimann C., Englmaier P., Fabian K., Gough L., Lamothe P., Smith D. (2015) Biogeochemical plant–soil interaction: Variable element composition in leaves of four plant species collected along a south–north transect at the southern tip of Norway. Sci. Total Environ. 506–507, 480-495.
Reimann C., Koller F., Kashulina G., Niskavaara H., Englmaier P. (2001) Influence of extreme pollution on the inorganic chemical composition of some plants. Environ. Pollution 115(2), 239-252.
Rodrigue J., Champoux L., Leclair D., Duchesne J. 2007) Cadmium concentrations in tissues of willow ptarmigan (Lagopus lagopus) and rock ptarmigan (Lagopus muta) in Nunavik, Northern Québec. Environmental Pollution 147, 642-647.
Roselli C., Desideri D., Meli M., Fagiolino I., Feduzi L. (2016) Essential and toxic elements in meat of wild birds. J. Toxicol. Environ. Health 79(21), 1008-1014.
Shevchenko V.P., Pokrovsky O.S., Vorobyev S.N., Krickov I.V., Manasypov R.M., Politova N.V., Kopysov S.G., Dara O.M., Auda Y., Shirokova L.S., Kolesnichenko L.G., Zemtsov V.A., Kirpotin S.N. (2017) Impact of snow deposition on major and trace element concentrations and fluxes in surface waters of Western Siberian Lowland. Hydrol. Earth Syst. Sci., 21(11), 5725-5746.
Snyder-Conn E., Garbarino J.R., Hoffman G.L., Oelkers A. (1997) Soluble Trace Elements and Total Mercury in Arctic Alaskan Snow. Arctic 50(3), 201-215.
Wren C.D., Nygard T., Steinnes E. (1994) Willow Ptarmigan (Lagopus lagopus) as a biomonitor of environmental metal levels in Norway. Environ. Pollution 85, 291-295.
Дополнительные материалы отсутствуют.


