Геохимия, 2020, T. 65, № 6, стр. 618-624
Физико-химическая модель поведения серебра в профиле выветривания
В. А. Копейкин *
Ухтинский государственный технический университет Россия
169300 Республика Коми, Ухта, ул. Первомайская, 13, Россия
* E-mail: vkopeikin@ugtu.net
Поступила в редакцию 11.01.2019
После доработки 20.08.2019
Принята к публикации 26.08.2019
Аннотация
Методом физико-химического моделирования на ЭВМ по программе “Селектор” рассчитан профиль выветривания по филлитовидным сланцам с первичным содержанием серебра 10–5 вес. %, при среднем его содержании в земной коре, равном 7 × 10–6 вес. %. Установлено, что в окислительных условиях серебро в растворе представлено катионом ${\text{Ag}}_{{({\text{p}} - {\text{p}})}}^{ + }$, который преобладает, и несколькими процентами аниона ${\text{AgCО}}_{{3\left( {{\text{p - p}}} \right)}}^{ - }$, при общем содержании серебра 10–6.4 мол/л. В восстановительных условиях доминирует ион ${\text{Ag}}_{{({\text{p - p}})}}^{0}$, его концентрация составляет 10–8.19 мол/л. По всему разрезу профиля выветривания минеральная форма – самородное серебро.
ВВЕДЕНИЕ
Распространенность серебра в земной коре 7 × × 10–6 вес. %. В ультраосновных и кислых породах серебра 5 ×10–6, в основных и осадочных – по 1 × × 10–5, в средних – 7 × 10–6 вес. % (Taylor 1964; Ярошевский, 2006).
Содержание серебра в речных водах 0.3 мкг/л, в морской воде 0.04 мкг/л. Из благородных металлов серебро наиболее широко распространено в природе. В зкзогенных процессах серебро часто встречается в самородном виде.
Серебро, как изоморфная примесь, входит в состав многих сульфидов (в основном в галенит). Главные минералы серебра – самородное серебро, аргентит (акантит) – Ag2S, пираргирит – Ag3SbS3, прустит – Ag3AsS3. Серебро дает непрерывный изоморфный ряд с золотом (электрум – Au, Ag). В самородном золоте содержание серебра может достигать 50% (Бетехтин, 2008).
Среднее содержание серебра в бокситах (Броневой с соавтор., 1983) 3 г/т. По сравнению с исходным субстратом в бокситах серебра больше ‒ первые граммы на тонну (Лихачев 1993).
Чтобы выяснить особенности поведения серебра в профиле выветривания и причины его возможного накопления в бокситах, мы провели физико-химического анализ поведения серебра в процессе выветривания на ЭВМ (программа “Селектор” Карпов, 1981; Чудненко, 2010).
На основании опубликованных данных об окислительно-восстановительных потенциалах соединений серебра в водном растворе и констант ступенчатой диссоциации с различными лигандами серебра (сульфатами, карбонатами, гидрокарбонатами и другими, табл. 1), автором вычислены значения стандартной свободной энергии Гиббса ‒ $\Delta G_{{f\left( {298} \right)}}^{^\circ }$ Дж/моль для 41 иона и комплекса серебра (табл. 2). Бромидные, иодидные, роданидные, цианидные и другие растворенные ионы серебра, практически отсутствующие в профиле выветривания, не учитывались.
Таблица 1.
Значения ${\text{pK}}_{n}^{0}$ диссоциации лигандов Ag+ при 25°С и 1 бар
| Лиганды | $\Delta G_{{f(298)}}^{^\circ }$, Дж/моль | ${\text{pK}}_{1}^{0}$ | ${\text{pK}}_{2}^{0}$ | ${\text{pK}}_{3}^{0}$ | ${\text{pK}}_{4}^{0}$ |
|---|---|---|---|---|---|
| OH– | –157 262 | 2.00 | 1.50 | 1.2 | ‒ |
| S${\text{O}}_{4}^{{2 - }}$ | –744 459 | 1.3 | –0.73 | –2.24 | ‒ |
| S${\text{O}}_{3}^{{2 - }}$ | –486 599 | 5.60 | 3.08 | 0.32 | ‒ |
| S2${\text{O}}_{3}^{{2 - }}$ | –522 582 | 8.82 | 4.64 | 0.69 | ‒ |
| HC${\text{O}}_{3}^{ - }$ | –586 870 | –0.29 | –0.69 | ‒ | ‒ |
| C${\text{O}}_{3}^{{2 - }}$ | –527 983 | 3.40 | 1.79 | ‒ | ‒ |
| Cl– | –131 290 | 3.27 | 1.96 | 1.53 | 0.20 |
| F– | –281 751 | 0.36 | –0.26 | ‒ | ‒ |
| N${\text{O}}_{3}^{ - }$ | –43 522 | –0.29 | ‒ | ‒ | ‒ |
| N${\text{O}}_{2}^{ - }$ | –32 217 | 1.88 | 0.97 | ‒ | ‒ |
Таблица 2.
Значения стандартной свободной энергии Гиббса $\Delta G_{{f(298)}}^{^\circ }$ Дж/моль для соединений серебра
| Ион, соединение |
$\Delta G_{{f(298)}}^{^\circ }$, Дж/моль | Ион, соединение |
$\Delta G_{{f(298)}}^{^\circ }$, Дж/моль | Ион, соединение | $\Delta G_{{f(298)}}^{^\circ }$, Дж/моль |
|---|---|---|---|---|---|
| H2O(ж) | –237 141 | АОН0(р-р) | –90 775 | Ag(S${{{\text{O}}}_{4}}{\text{)}}_{3}^{{5 - }}$ (р-р) | –2 146 751 |
| Ag(к) | 0 | Ag(О${\text{H)}}_{2}^{ - }$( р-р) | –256 599 | Ag(SO3)– (р-р) | –441 471 |
| Ag0(р-р) | +46 749 | Ag(О${\text{H)}}_{3}^{{2 - }}$( р-р) | –420 711 | Ag(S${{{\text{O}}}_{3}}{\text{)}}_{2}^{{3 - }}$(р-р) | –915 651 |
| Ag+(p-p) | +77 093 | Ag2OH+( р-р) | –19 596 | Ag(S${{{\text{O}}}_{3}}{\text{)}}_{2}^{{5 - }}$(р-р) | –1 434 077 |
| Ag2+(р-р) | +268 137 | Ag2(O${\text{H)}}_{2}^{0}$( р-р) | –219 064 | Ag(S2O3)– (р-р) | –495 834 |
| AgCl0(p-p) | –72 862 | AgC${\text{O}}_{3}^{ - }$(p-p) | –470 297 | Ag(S2${{{\text{O}}}_{3}}{\text{)}}_{2}^{{3 - }}$ (р-р) | –1 044 901 |
| Ag${\text{Cl}}_{2}^{ - }$(p-p) | –214 848 | Ag(C${{{\text{O}}}_{3}}{\text{)}}_{2}^{{3 - }}$(p-p) | –1 008 497 | Ag(S2${{{\text{O}}}_{3}}{\text{)}}_{3}^{{5 - }}$ (р-р) | –1 571 422 |
| Ag${\text{Cl}}_{3}^{{2 - }}$(p-p) | –344 994 | AgОНC${\text{O}}_{3}^{{2 - }}$(p-p) | –628 530 | Ag(S2O3)Cl2– (р-р) | –634 715 |
| Ag${\text{Cl}}_{4}^{{3 - }}$(p-p) | –478 848 | AgC2${\text{O}}_{4}^{ - }$(p-p) | –608 011 | AgНS0(р-р) | +9682 |
| AgClОН–(p-p) | –236 819 | AgHC${\text{O}}_{3}^{0}$(p-p) | –508 122 | Ag(Н${\text{S)}}_{2}^{ - }$(р-р) | +1201 |
| AgCl2ОН2–(p-p) | –366 766 | Ag(HC${{{\text{O}}}_{3}}{\text{)}}_{2}^{ - }$(p-p) | –1 086 053 | AgN${\text{O}}_{2}^{0}$(р-р) | +34 259 |
| AgF0(p-p) | –206 713 | Ag(CН2СО${\text{O)}}_{2}^{ - }$(p-p) | –665 290 | Ag(N${{{\text{O}}}_{2}}{\text{)}}_{2}^{{2 - }}$(р-р) | –3495 |
| Ag${\text{F}}_{2}^{ - }$(р-р) | –486 980 | Ag2C2${\text{O}}_{4}^{0}$(p-p) | –579 204 | Ag(NO3)0(р-р) | +34 226 |
| OH–(р-р) | –157 262 | AgCH3COO0(p-p) | –296 470 | C2${\text{O}}_{4}^{{2 - }}$(p-p) | –668 879 |
| C${\text{O}}_{3}^{{2 - }}$(р-р) | –527 983 | AgCH3COO+(p-p) | –221 618 | HN${\text{O}}_{3}^{0}$(р-р) | –35 363 |
| НС${\text{O}}_{3}^{ - }$(р-р) | –586 870 | AgS${\text{O}}_{4}^{ - }$ (р-р) | –674 786 | N${\text{O}}_{3}^{ - }$ (р-р) | –43 522 |
| HS–(p-p) | +11 966 | Ag(S${{{\text{O}}}_{4}}{\text{)}}_{2}^{{3 - }}$ (р-р) | –1 415 078 | N${\text{O}}_{2}^{ - }$(р-р) | –32 217 |
| S${\text{O}}_{4}^{{2 - }}$(р-р) | –744 459 | Ag2S(акантит) | –40 668 | ${\text{F}}_{{({\text{p - p)}}}}^{ - }$ | –281 751 |
| S${\text{O}}_{3}^{{2 - }}$(р-р) | –486 599 | Ag2S(аргентит) | –39 539 | ${\text{Cl}}_{{({\text{p - p)}}}}^{ - }$ | –131 290 |
| S2${\text{O}}_{3}^{{2 - }}$(р-р) | –522 582 | AgCl(хлораргирит) | –109 809 | Ag2Oкр. | –11 196 |
Из твердых минеральных фаз серебра учитывались Ag(к), Ag2S (аргентит и акантит), хлораргирит (AgCl).
ТЕРМОДИНАМИЧЕСКАЯ ИНФОРМАЦИЯ И МЕТОД МОДЕЛИРОВАНИЯ
Цель данной работы − выяснить, какие минералы и ионы существуют в растворах профиля выветривания для одного конкретного химического элемента, в данном случае серебра. Использовался метод физико-химического моделирования на ЭВМ по программе “Селектор”.
Моделирование проводилось при 25°С и 0.1 МПа.
Величина стандартного электродного потенциала серебра в водных растворах для реакции
при 25°C (Е° = +0.7991 В) получена в 1938 г. (Owen 1938). В том же журнале Owen и Brinkley (Owen, Brinkley, 1938) рекомендуют значение Е° = +0.7994 В.В справочниках Латимера (1954), Батлера (1973), Эмсли (1993), в базе данных электронной библиотеки химического факультета МГУ (Морозов с соавтор., 2003) приводится величина 0.7991 вольт. В справочнике (Лидин с соавтор., 2006) дается значение Е° = +0.799 В, которое использовано нами.
По уравнению
получаем величину свободной энергии иона $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag}}_{{({\text{p - p}})}}^{ + }$ = +77 093 Дж/моль (n ‒ число участвующих в реакции электронов, F ‒ число Фарадея, равное 96487 Дж/вольт экв).В справочнике Термические константы веществ (ТКВ) свободная энергия иона $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag}}_{{({\text{p - p}})}}^{ + }$ = = 77 127 ± 20 Дж/моль, в справочнике (Васильев, 1982) $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag}}_{{({\text{p - p}})}}^{ + }$ = 77 128 ± 121 Дж/моль. По данным (Shock, Helgeson, 1988) $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag}}_{{({\text{p - p}})}}^{ + }$ = = 77 099 Дж/моль.
В рекомендациях CODATA (1976) даются значения энтальпии $\Delta H_{f}^{^\circ }$(298.15 K) = 105.750 ± ± 0.085 kJ/mol и энтропии S°(298.15 K) = 73.38 ± ± 0.40 J/K mol для иона ${\text{Ag}}_{{{\text{(aq}}{\text{.)}}}}^{ + }.$
Яхонтова и Грудев (1978) приводят (на основании литературных данных) основные реакции для серебра в гипергенных условиях, где рассматривают возможное присутствие ионов ${\text{Ag}}_{{\left( {{\text{р - р}}} \right)}}^{{2 + }}$ и ${\text{Ag}}_{{\left( {{\text{р - р}}} \right)}}^{{3 + }}$. По мнению этих авторов, миграция серебра в гипергенезе очень незначительна и нужны особые условия для увеличения подвижности серебра, которое, совместно с золотом, накапливается ниже уровня грунтовых вод. В области гипергенного минералообразования отмечаются значительные различия в параметрах рН и Еh (Яхонтова 1987).
Для реакции
(3)
$\begin{gathered} {\text{A}}{{{\text{g}}}^{{2 + }}} + {\text{e}} = {\text{A}}{{{\text{g}}}^{ + }}{\text{ }} \\ Е^\circ = + 1.980{\text{ В}} \\ \end{gathered} $Козлов и Ходаковский (1983) считали, что в водном растворе есть ион ${\text{Ag}}_{{({\text{p - p}})}}^{0}$, который может играть важную роль при переносе серебра и допускали также возможность существования в гидротермальных растворах растворенных атомарных форм для Cu0, Au0, Hg0.
Для реакции
ими рекомендуется уравнение температурной зависимости константы равновесия и значение рK° = 8.19 при 25°С. Отсюда получаем значение свободной энергии $\Delta G_{{f\left( {298} \right)}}^{^\circ }$ для иона ${\text{Ag}}_{{({\text{p - p}})}}^{0}$ = +46 749 Дж/моль.Уравнение (5) получено Козловым и Ходаковским (1983) из экспериментов по растворимости металлического серебра в воде и растворах NaCl и HCl при температурах 200 и 280°С. Для реакции (5) константа равновесия K = (3.41 ± 0.18) × 10–5 (при 200°С) и (2.81 ± 0.81) × 10–5 (при 280°С) (доверительная вероятность 0.95).
Однако, Зотов с соавтор. (1985) считают это предположение Козлова и Ходаковского (1983) о важном геохимическом значении частицы ${\text{Ag}}_{{({\text{p - p}})}}^{0}$ спорным. Были поставлены опыты (при 300 и 450°С) по определению растворимости металлического серебра в восстановительной среде в водных растворах, не содержащих вероятных комплексообразователей. Результаты этих опытов показали крайне низкую концентрацию серебра в растворе в равновесии с металлическим серебром. Но Зотов с соавтор. (1985) не отвергают принципиальную возможность существования частицы ${\text{Ag}}_{{({\text{p - p}})}}^{0}$ в растворе. Ее содержание должно быть очень незначительным (меньше 10–7 моль/кг Н2О).
Крайнов с соавторами (2012), Лурье (1971) рекомендуют константы ${\text{pK}}_{n}^{0}$ тупенчатой диссоциации разных лигандов (сульфатов, оснований, карбонатов, гидрокарбонатов и других) для иона серебра (Ag+) в водном растворе (табл. 1). Рекомендуемые Крайновым с соавтор. (2012), константы весьма близки к экспериментальным, например для сульфатов Ag+${\text{pK}}_{1}^{0}$ рекомендуемое равно 0.88, а экспериментальное 1.30 (Smith, Martell, 1978; Turner еt al., 1981); ${\text{pK}}_{2}^{0}$ рекомендуемое равно –0.44, а экспериментальное –0.73.
Диссоциация основания серебра по первой ступени:
(6)
${\text{AgOН}}_{{{\text{(р - р)}}}}^{0} = {\text{Ag}}_{{\left( {{\text{р - р}}} \right)}}^{ + } + {\text{OН}}_{{\left( {{\text{р - р}}} \right)}}^{ - }\, = \,2.00,\,\,\,{\text{pK}}_{1}^{0} = 2.00,$(7)
${\text{Ag(OН)}}_{{2{\text{(р - р)}}}}^{ - } = {\text{AgОН}}_{{{\text{(р - р)}}}}^{0} + {\text{OН}}_{{{\text{(р - р)}}}}^{ - }\,\,\,{\text{pK}}_{2}^{0} = 1.50,$(8)
${\text{Ag(OН)}}_{{3{\text{(р - р)}}}}^{ - }\, = \,{\text{Ag}}\left( {{\text{ОН}}} \right)_{{{\text{2(р - р)}}}}^{ - } + {\text{OН}}_{{{\text{(р - р)}}}}^{ - }\,\,\,{\text{pK}}_{3}^{0} = 1.2.$Используя принятые нами значения свободной энергии ${\text{Ag}}_{{({\text{p - p}})}}^{ + }$ = +77 093 Дж/моль и ${\text{OH}}_{{({\text{р - р}})}}^{ - }$ = = –157 262 Дж/моль, получим величину $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{AgOH}}_{{({\text{p - p}})}}^{0}$ = –90 775 Дж/моль, $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(OH)}}_{{2({\text{p - p}})}}^{ - }$ = –256 599 Дж/моль и $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(OH)}}_{{3({\text{p - p}})}}^{{2 - }}$ = –420 711 Дж/моль.
Пятницкий, Сухан (1975) приводят значения lg K для реакции
(9)
$2{\text{Ag}}_{{{\text{(p - p)}}}}^{ + }\, + \,{{{\text{H}}}_{2}}{\text{O}}\, = \,{\text{A}}{{{\text{g}}}_{2}}({\text{OH}})_{{{\text{(p - p)}}}}^{ + } + {\text{H}}_{{{\text{(p - p)}}}}^{ + }\,\,\,{\text{pK}}_{1}^{0} = 11.1,$(10)
$\begin{gathered} 2{\text{Ag}}_{{{\text{(p - p)}}}}^{ + } + 2{{{\text{H}}}_{2}}{\text{O}} = {\text{A}}{{{\text{g}}}_{2}}({\text{OH}})_{{{\text{2(p - p)}}}}^{ + } + 2{\text{H}}_{{{\text{(p - p)}}}}^{ + } \\ {\text{pK}}_{2}^{0} = 17.7. \\ \end{gathered} $Морозов с соавтор. (2003) для реакции
(11)
${\text{A}}{{{\text{g}}}_{{\text{2}}}}{{{\text{С}}}_{{\text{2}}}}{\text{О}}_{{4({\text{p - p)}}}}^{0} + 2{\text{е}} = 2{\text{Ag}} + {{{\text{С}}}_{{\text{2}}}}{\text{О}}_{4}^{{2 - }}$Аналогично для реакции диссоциации сульфата серебра по первой ступени
(12)
${\text{AgSO}}_{{4({\text{p - p)}}}}^{ - } = {\text{Ag}}_{{{\text{(p - p)}}}}^{ + } + {\text{SO}}_{{4({\text{p - p)}}}}^{{2 - }}\,\,\,\,{\text{pK}}_{1}^{0} = 0.88$Для реакции диссоциации по второй ступени
(13)
$\begin{gathered} {\text{Ag}}\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)_{{2({\text{p - p)}}}}^{{3 - }} = {\text{Ag}}\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)_{{{\text{(p - p)}}}}^{ - } + {\text{SO}}_{{4({\text{p - p)}}}}^{{2 - }} \\ {\text{pK}}_{2}^{0} = - 0.73. \\ \end{gathered} $Для реакции диссоциации по третьей ступени
(14)
$\begin{gathered} {\text{Ag}}\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)_{{3({\text{p - p)}}}}^{{5 - }} = {\text{Ag}}\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)_{{{\text{2(p - p)}}}}^{{2 - }} + {\text{SO}}_{{4({\text{p - p)}}}}^{{2 - }} \\ {\text{pK}}_{3}^{0} = - 2.24. \\ \end{gathered} $Свободная энергия сульфитов и тиосульфатов серебра получена по константам ступенчатой диссоциации из справочника Лурье (1989). Для сульфитов ${\text{pK}}_{1}^{0}$ = 5.6, ${\text{pK}}_{2}^{0}$ = 3.08, ${\text{pK}}_{3}^{0}$ = 0.32. $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{SO}}_{{3({\text{p - p}})}}^{{2 - }}$ = –486 599 Дж/мол (Крайнов с соавтор. 2012). Отсюда $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(S}}{{{\text{O}}}_{3}})_{{({\text{p - p}})}}^{ - }$ = = ‒441 471, $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(S}}{{{\text{O}}}_{3}})_{{2({\text{p - p}})}}^{{3 - }}$ = –945 651, $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(S}}{{{\text{O}}}_{3}})_{{3({\text{p - p}})}}^{{5 - }}$ = –1 434 077 Дж/моль.
Для тиосульфитов ${\text{pK}}_{1}^{0}$ = 8.82,${\text{\;pK}}_{2}^{0}$ = 4.64, ${\text{pK}}_{3}^{0}$ = = 0.69. $\Delta G_{{f\left( {298} \right)}}^{^\circ }{{{\text{S}}}_{2}}{\text{O}}_{{3({\text{p - p}})}}^{{2 - }}$ = –522582 Дж/мол. Отсюда $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}})_{{({\text{p - p}})}}^{ - }$ = –495 834, $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}})_{{2({\text{p - p}})}}^{{3 - }}$ = –1 044 901, $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}})_{{3({\text{p - p}})}}^{{5 - }}$ = –1 571 422 Дж/моль.
Для реакции
(15)
$\begin{gathered} {\text{Ag}}_{{({\text{p - p)}}}}^{ + } + {\text{Cl}}_{{({\text{p - p)}}}}^{ - } + {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{3({\text{p - p)}}}}^{{2 - }} = {\text{Ag}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{Cl}}_{{({\text{p - p)}}}}^{{2 - }} \\ {\text{lgK}} = 10.15 \\ \end{gathered} $В статье Акинфиева, Зотова (2010) приведены данные по свободной энергии ионов ${\text{HS}}_{{({\text{р - р}})}}^{ - }$ = = 11 966, ${\text{AgHS}}_{{({\text{р - р}})}}^{0}$ = 9682 и ${\text{Ag(HS)}}_{{2({\text{р - р}})}}^{ - }$ = = 1201 Дж/моль.
Аналогичным способом (по ${\text{pK}}_{n}^{0}$ рекомендованным Крайнов с соавтор., 2012) получены значения свободной энергии карбонатов, гидрокарбонатов, хлоридов, фторидов серебра (табл. 2).
Величину свободной энергии хлораргирита AgCl(к), равную –109 809 Дж/моль, сульфидов серебра – акантита, аргентита Ag2S(акантит) = = ‒40 668 Дж/моль, Ag2S(аргентит) = –39 539 Дж/моль и Ag2Окр. = –11 196 Дж/моль берем из справочника Наумова с соавтор. (1971).
Садовников с соавтор. (2016) методом дифференциального термического анализа установили, что при нормальных условиях акантит является стабильной фазой и аргентит (при атмосферном давлении 0.1 МПа) устойчив при температуре выше 449‒450 K (176°С).
В работе Зотова с соавтор. (1982) рекомендовано уравнение температурной зависимости константы равновесия реакции
(16)
${\text{AgC}}{{{\text{l}}}_{{\left( {\text{к}} \right)}}} + {\text{ОН}}_{{({\text{p - p)}}}}^{ - } = {\text{AgClОН}}_{{({\text{p - p)}}}}^{ - }$Вычисленное значение $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{AgClOH}}_{{({\text{p - p}})}}^{ - }$ = = –236 819 Дж/моль.
В той же работе приводится величина свободной энергии реакции
(17)
${\text{AgCl}}_{{3({\text{p - p)}}}}^{{2 - }} + {\text{ОН}}_{{({\text{p - p)}}}}^{ - } = {\text{AgC}}{{{\text{l}}}_{{\text{2}}}}{\text{ОН}}_{{({\text{p - p)}}}}^{{2 - }} + {\text{Cl}}_{{({\text{p - p)}}}}^{ - },$Козлов (1984) рекомендует для реакции
(18)
${\text{Ag}}_{{({\text{p - p)}}}}^{ + } + {\text{CO}}_{{3({\text{p - p)}}}}^{{2 - }} + {\text{ОН}}_{{({\text{p - p)}}}}^{ - } = {\text{AgОНCO}}_{{3({\text{p - p)}}}}^{{2 - }}$(19)
$\begin{gathered} 0.5{\text{A}}{{{\text{g}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{(к)}}}}} + {\text{CO}}_{{3({\text{p - p)}}}}^{{2 - }} + 0.5{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{(ж)}}}}} = \\ = {\text{AgОНCO}}_{{3({\text{p - p)}}}}^{{2 - }} \\ \end{gathered} $В справочнике Лурье (1989) дается значение ${\text{pK}}_{1}^{0}$ = 1.88, для реакции
(20)
${\text{Ag}}_{{{\text{(p - p)}}}}^{ + } + {\text{NO}}_{{{\text{2(p - p)}}}}^{ - } = {\text{Ag}}\left( {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right)_{{({\text{p - p)}}}}^{0},$(21)
${\text{Ag}}_{{{\text{(p - p)}}}}^{ + } + 2{\text{NO}}_{{{\text{2(p - p)}}}}^{ - } = {\text{Ag}}\left( {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right)_{{2({\text{p - p)}}}}^{ - }.$С учетом принятого нами значения свободной энергии иона ${\text{Ag}}_{{({\text{p - p}})}}^{ + }$, cвободная энергия ${\text{Ag}}{{{\text{C}}}_{2}}{\text{O}}_{{4({\text{p - p}})}}^{ - }$, ${\text{Ag(C}}{{{\text{H}}}_{2}}{\text{COO)}}_{{2({\text{p - p}})}}^{ - }$, ${\text{Ag(C}}{{{\text{H}}}_{3}}{\text{COO)}}_{{({\text{p - p}})}}^{0}$, ${\text{Ag(C}}{{{\text{H}}}_{3}}{\text{COO)}}_{{({\text{p - p}})}}^{ + }$, (по данным справочника ТКВ) соответственно равна –608 011, –665 290, –296 470, ‒221 618 Дж/моль (табл. 2).
Свободная энергия нитрат-иона серебра ${\text{Ag(N}}{{{\text{O}}}_{3}}{\text{)}}_{{2({\text{p - p}})}}^{0}$ = –33 179 Дж/моль (ТКВ), включает в себя свободную энергию иона ${\text{NO}}_{{3({\text{p - p}})}}^{ - }$, равную –111 420 Дж/моль (Наумов с соавтор., 1971). Однако Карпов (1982), Карпов с соавтор. (1996), Чудненко (2010) считают эту величину ошибочной и рекомендуют значение $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{NO}}_{{3({\text{p - p}})}}^{ - }$ = –43 522 Дж/моль и $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{HNO}}_{{3({\text{p - p}})}}^{0}$ = –35 363 Дж/моль. С учетом этой поправки принятая нами величина $\Delta G_{{f\left( {298} \right)}}^{^\circ }{\text{Ag(N}}{{{\text{O}}}_{3}}{\text{)}}_{{({\text{p - p}})}}^{0}$ равна +35 226 Дж/моль.
Процесс физико-химического моделирования на ЭВМ (программа “Селектор”) детально разобран в работах Карпова (1981) и Чудненко (2010).
Нами по этой программе было изучено поведение серебра в процессе выветривания филлитовидных сланцев в окислительных и восстановительных условиях при исходном содержании серебра 10–5 вес. %. Моделирование проведено при 25°С и давлении в 0.1 МПа. Всего было учтено 41 ион и комплекс серебра в водном растворе (табл. 2). Матрица мультисистемы включала 17 независимых компонентов – Ag, Al, Si, Fe, K, Na, Ca, Mg, Ti, S, F, Cl, C, N, H, O и электрон. В растворе учитывалось 207 ионов и комплексов. Было также включено 17 газов и 33 минерала. В атмосферный воздух были включены только азот, кислород и СО2.
Минеральный состав филлитовидных сланцев (вес. %): мусковит – KAl2[AlSi3O10][OH]2 (49.4); хлорит – Mg5[Al2Si3O10][OH]8 (20.3); каолинит – Al2[Si2O5][OH]4 (5.4); альбит – NaAlSi3O8 (1.1); кварц – SiO2 (12.3); магнетит – Fe3O4 (2); гематит – Fe2O3 (3); пирит – FeS2 (2); кальцит – CaCO3 (2.3); ильменит – FeTiO3 (0.5); флюорит – CaF2 (0.5); ангидрит – CaSO4 (1.1); галит – NaCl (0.10). Σ = = 100%.
Процесс выветривания протекает в принципе одинаково по любым породам. Это латеритный процесс в условиях жаркого влажного климата, типа климата Гвинеи (Копейкин В. А., 1988).
Смена окислительных условий на восстановительные нами проводилась за счет титрования атмосферы углеродом при соотношении вода (water) : порода (rock) ‒ [W/R] = 1000 : 1 (lg[W/R] = 3).
Это сделано специально для сравнения поведения других химических элементов в процессе выветривания при одинаковых условиях (Копейкин, 2017, 2018).
Карпов (1981), автор метода физико-химического моделирования на ЭВМ и программы “Селектор” для соотношения “порода‒вода” использовал обозначение рυ.
Процесс моделирования по программе “Селектор” проводится для 1 кг воды (55.51 моль Н2О). В этот объем воды добавляется разное количество исходной породы. При добавлении минимального количества породы (10–7–10–6 моль) все растворимые продукты переходят в раствор, а остаются только не растворимые, в нашем случае минералы гетит и гиббсит. При добавлении в исходный 1 кг воды большего количества субстрата (филлитовидных сланцев) в профиле выветривания появляются и другие не растворимые минералы.
Взаимодействие небольшого количества исходной породы и большого количества воды (большие значения параметра [W/R] ‒ степень протекания реакции), характерно для верхней части профиля выветривания. В нижней части профиля, в зоне почти неизмененной или слабо измененной породы характерны малые значения [W/R] (Борисов, Шваров, 1992).
Исходного количества серебра в филлитовидных сланцах в окислительных условиях профиля выветривания недостаточно для образования минеральной форма серебра.
При удалении из атмосферы кислорода в профиле выветривания создается восстановительная среда. Здесь проходит окислительное-восстановительный барьер резкого изменения геохимической обстановки. Здесь исчезает красящая красно-рыжая окраска пород трехвалентным железом, поскольку в восстановительных условиях железо двухвалентно и входит в состав новообразованных глин (алюмосиликатов). Здесь проходит граница геохимического барьера смены Eh и рН.
Серебро в растворе в окислительных условиях при соотношении вода : порода (lg[W/R]) = 4.9 представлено катионом Ag+ в количестве 10–6.4 моль/л, который прослеживается до границы восстановительной обстановки (рисунок 1). Там, где значение Eh становится отрицательным, в растворе появляется нейтральный ион серебра – ${\text{Ag}}_{{({\text{p - p}})}}^{0}$ возможное существование которого допускается Козловым и Ходаковским (1983). Его концентрация 10–8.19 мол/л.
Рис. 1.
Поведение серебра в профиле выветривания филлитовидных сланцев. W ‒ вода, R ‒ порода Gbs – гиббсит, Gth – гетит, Rt – рутил, Kln – каолинит, Ilt – иллит, Py – пирит, Sd – сидерит, Dol – доломит, Qz – кварц, Ag (сокращенные названия минералов даны по рекомендации Whitney D., Evans B. W. (2010)).
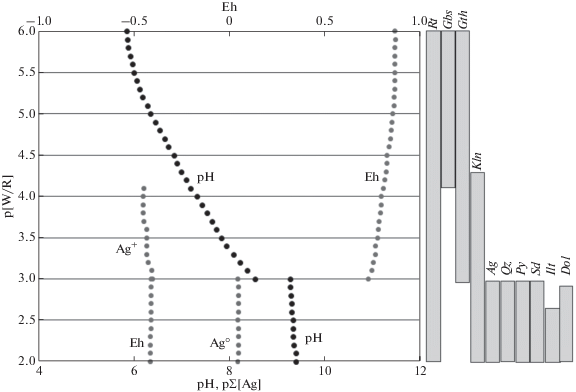
Профиль выветривания в своей верхней части, где дождевой водой вымыты практически все растворимые минералы субстрата, представлен парагенезисом гиббсита с гетитом. Это зона боксита, которая прослеживается вниз по разрезу до значения (lg[W/R]) = 4.75.
Далее появляется каолинит и кремневый модуль боксита (соотношение содержания SiO2/Al2O3) уменьшается при (lg[W/R]) равным 4.55, значение модуля выходит за пределы бокситового – гиббсит исчезает и практически до границы смены окислительных условий на восстановительные наблюдается парагенезис гетит и каолинит.
В восстановительных условиях минеральный парагенезис представлен самородным серебром, пиритом, сидеритом, доломитом, кварцем, каолинитом, иллитами. Сульфида серебра – акантита, (Ag2S) нет, поскольку нет сероводорода. Концентрация серебра в растворе 10–8.19 мол/л (практически только один ${\text{Ag}}_{{({\text{p - p}})}}^{0}$).
Если в исходном субстрате, который попадает в процесс выветривания, присутствует акантит, то в окислительных условиях сульфид серебра окисляется и переходит в самородное серебро.
ВЫВОДЫ
Согласно имеющейся термодинамической информации о возможном наличии в водном растворе 41 иона и комплекса серебра в окислительной обстановке профиля выветривания серебро представлено катионом ${\text{Ag}}_{{({\text{p - p}})}}^{ + }$, который преобладает, и всего несколькими процентами аниона ${\text{AgCO}}_{{3({\text{p - p}})}}^{ - }$, при общем содержании серебра 10–6.4 мол/л. На возможную миграцию серебра в зоне гипергенеза в виде карбонатных растворов указывал Годовиков (1975).
Исходного количества серебра в филлитовидных сланцах в окислительных условиях профиля выветривания недостаточно для образования минеральной форма серебра.
В восстановительной обстановке образуется самородное серебро, а растворенная форма серебра представлена только одним нейтральным ионом – ${\text{Ag}}_{{({\text{p - p}})}}^{0}$). Его концентрация 10–8.19 мол/л.
Бокситы не являются возможными промышленными месторождениями серебра.
Список литературы
Акинфиев Н.Н., Зотов А.В. (2010) Термодинамическое описание водных компонентов системы Cu–Ag–Au–S–O–H в диапазоне температур 0–600°С и 1–3000 бар. Геохимия (7), 761-767.
Akinfiev N.N., Zotov A.V. (2010) Thermodynamic Description Aqueous Species in the System Cu–Ag–Au–S–O–H at Temperatures of 0–600°C and Pressures of 1–3000 Bar. Geochem. Int. 48(7), 714-720.
Батлер Дж.Н. (1973) Ионные равновесия (математическое описание). Л.: Химия, 448 с.
Бетехтин А. Г. (2008) Курс минералогии: учебное пособие. М.: КДУ, 736 с.
Борисов М.В., Шваров Ю.В. (1992) Термодинамика геохимических процессов. Учебное пособие. М.: МГУ, 211 с.
Броневой В.А., Зильберминц А.В., Липин В.М., Теняков В.А. (1983) Средние коэффициенты концентрации химических элементов в бокситах. ДАН 270(5), 1167-1170.
Васильев В.П. (1982) Термодинамические свойства растворов электролитов: Учебное пособие. М.: Высшая школа, 320 с.
Гаррелс Р.М., Крайст Ч.Л. (1968) Растворы, минералы, равновесия. М.: Мир. 368 с.
Годовиков А.А. (1975) Минералогия. М.: Недра, 520 с.
Зотов А.В., Левин К.А., Котова З.Ю., Волченкова В.А. (1982) Экспериментальное исследование устойчивости гидроксохлоридных комплексов серебра в гидротермальных растворах. Геохимия (8), 1124-1136.
Зотов А. В., Левин К. А., Котова З. Ю. (1985) К вопросу о существовании частицы ${\text{Ag}}_{{({\text{p - p}})}}^{0}$ в гидротермальных условиях. Геохимия (6), 903-906.
Карпов И.К. (1981) Физико-химическое моделирование на ЭВМ в геохимии. Новосибирск: Наука, 248 с.
Карпов И.К., Чудненко К.В., Бычинский В.А., Кашик С.А. (1996) Определение станлартного изобарно-изотермического потенциала образования нитрат-иона по физико-химической модели озера Байкал. ДАН 346(3), 383-386.
Козлов Вл.К. (1984) О роли карбонатных комплексов в гидротермальном переносе серебра (по экспериментальным данным). Геохимия (10), 1432-1442.
Козлов Вл.К., Ходаковский И.Л. (1983) Экспериментальное изучение термодинамических свойств атомарного серебра в водных растворах в интервале температур 25–280°С. Геохимия (6), 836-848.
Копейкин В.А. (1988) Физико-химическая модель латеритного процесса. Физико-химические модели в геохимии. Новосибирск: Наука. Сиб. отд-ние, 61-80.
Копейкин В.А. (2017) Физико-химическая модель поведения олова в профиле выветривания. Геохимия (4), 368-371.
Kopeikin V.A. (2017) Physicochemical Model of Tin Behavior in Weathering Profiles. Geochem. Int. 55(4), 389-392.
Копейкин В.А. (2018) Физико-химическая модель поведения титана в профиле выветривания. Сыктывкар: Вестник ИГ Коми НЦ УрО РАН 10, 35-38.
Крайнов С.Р., Рыженко Б.Н., Швец В.М. (2012) Геохимия подземных вод. Теоретические, прикладные и экологические аспекты. М.: ЦентрЛитНефтеГаз, 672 с.
Латимер В.М. (1954) Окислительные состояния элементов и их потенциалы в водных растворах. Изд-во Ин. Литер. М.: 400 с.
Лидин Р.А., Андреева Л.Л., Молочко В.А. (2006) Константы неорганических веществ: справочник. М.; Дрофа, 685 с.
Лихачев В.В. (1993) Редкометальность бокситоносной коры выветривания Среднего Тимана. Сыктывкар. Коми НЦ УрО РАН. 224 с.
Лурье Ю.Ю. (1989) Справочник по аналитической химии. М.: Химия, 448 с.
Морозов И.В., Болталин А.И., Карпова Е.В. (2003) Окислительно-восстановительные процессы. Электронная библиотека химического факультета. М.: МГУ, 64 с.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин (для геологов). М.: Атомиздат, 240 с.
Пятницкий И.В., Сухан В.В. (1975) Аналитическая химия серебра. Серия: “Аналитическая химия элементов”. М.: Наука, 264 с.
Садовников С.И., Чукин А.В., Ремпель Н.А., Гусев А.И. (2016) Полиморфное превращение в нанокристаллическом сульфиде серебра. Физика твердого тела (58), 32-38.
Термические константы веществ. (1965–1979) Справочник. Под ред. Глушко В.П. М.: Наука. Вып. 1-10.
Чудненко К.В. (2010) Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: ГЕО, 287 с.
Эмсли Дж. (1993) Элементы. Справочник. М.: Мир, 236 с.
Яхонтова Л.К., Грудев А.П. (1978) Зона гипергенеза рудных месторождений. М.: МГУ, 230 с.
Яхонтова Л.К. (1987) Регулирующая роль кислотно-основных характеристик минералов в гипергенезе. ДАН 294 (6), 1448-1450.
Ярошевский А.А. (2006) Распространенность химических элементов в земной коре. Геохимия (1), 54-62.
Yaroshevsky A.A. (2006) Abundances of Chemical Elements in the Earth,s Crast. Geochem. Int. 44 (1), 48-55.
Lewis G.N., Randall M. (1923) Thermodinamics and the free energy of chemical substances. N. Y.; L.: McGray-Hill Book Company, 556-568.
Owen B.B. (1938) The elimination of liquid junction potentials. II. The standard electrode potential of silver from 5 to 45°. Am. J. Sci. 60(9), 2229-2233.
Owen B.B., Brinkley S.R. (1938) The elimination of liquid junction potentials. I. The solubility product of silver chloride from 5 to 45°, and related thermodynamic quantities. Am. J. Sci. 60(9), 2233-2239.
Shock E.L., Helgeson H.C. (1988) Calculation of the thermodynamic and transport properties of aqueous species in high pressures and temperatures. Correlation algorithms for ionic species and equation of state pedicthions to 5 kb and 1000°C. Geochim. Cosmochim. Acta. 52(2), 2009-2036.
Smith R.H., Martell A.E. (1977) Critical stability constants. 4. N.Y.-L.: Plenum Press. 156 p.
Taylor S.R. (1964) Abundance of chemical elements in the continental crust: a new table. Geochim. Cosmochim. Acta 28(8), 1273-1285.
Turner D.R., Whitefield M., Dickson A.G. (1981) The equilibrium speciation of dissolved components in freshwater and seawater at 25°C and 1 atm pressure. Geochim. Cosmochim. Acta. 45(6), 855-881.
Whitney D., Evans B.W. (2010) Abbreviations for names of rock-forming minerals. Amer. Mineral. 95, 185-187.
Дополнительные материалы отсутствуют.


