Геохимия, 2020, T. 65, № 7, стр. 654-670
Экспериментальное исследование взаимодействия амфибола с H2O–HCl флюидом при 650–750°С, 5–7 кбар: приложение к высокотемпературному метасоматозу метабазитов
Л. И. Ходоревская *
Институт экспериментальной минералогии им. академика Д.С. Коржинского РАН
4142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 4, Россия
* E-mail: khodorevskaya@mail.ru
Поступила в редакцию 22.04.2019
После доработки 12.09.2019
Принята к публикации 13.09.2019
Аннотация
В аппарате с внутренним нагревом при 650–800°C и 5–7 кбар проведены опыты по взаимодействию амфибола и амфиболита с флюидом H2O–HCl. Получено, что стабильность анортит – амфиболовых ассоциаций в интервале Т = 650–800°С, (Р = 5–7 кбар) ограничивается интервалом фугитивности HCl (fHCl) 50 < fHCl < 400 бар. При более высоких fHCl амфибол замещается жедритом (или кордиеритом при 800°С) + хлоритом. Измерены концентрации основных петрогенных компонентов в равновесных растворах. Показан преимущественный вынос из амфибола Ca и Fe по сравнению с Mg. Al и Si слабо выносятся во флюидную фазу, в основном формируют алюмосиликатную матрицу, состоящую из мелких сферических и обломочных форм кварца, фаз типа Al2SiOn ⋅ mH2O, тонковолокнистого силлиманита. В алюмосиликатной матрице местами обособляются крупные, превышающие 100 мкм, кристаллы корунда и кварца. На основании данных экспериментов показано, что на о-ве Кий (Белое море) вследствие взаимодействия метабазитов с подкисленными флюидами происходил вынос из метабазита Ca и Fe, в меньшей степени Mg. Фугитивность HCl во флюидах, вызвавших метасоматоз, отвечала значениям ≈50–200 бар при параметрах Т = 650 – 800°С, Р = 5–7 кбар. Вынос оснований приводил к накоплению в остаточной матрице Al2O3 и SiO2. Это создавало благоприятные предпосылки для формирования корунда с одной стороны, и образование высококремнистых пород, таких как кварциты, с другой.
ВВЕДЕНИЕ
Такие магматические процессы, как извержения вулканов, дифференциация силикатных расплавов, а также образование рудных месторождений частично контролируются флюидом с растворенными летучими компонентами. Среди последних важнейшая роль отводится хлору, во многом влияющему на процессы экстрагирования и миграции рудных компонентов. Наряду с хлоридами щелочей важнейшей производной хлора является HCl. Обогащение флюидной фазы HCl может происходить при образовании кислых расплавов в присутствии растворов галогенидов щелочей согласно реакциям типа MeCln(Fl) + + nH2O = Me(OH)n(Melt) + nHCl(Fl) (Рябчиков, 1975; Aranovich et al., 2013; Manning, Aranovich, 2014 и др.). Активность HCl влияет на обмен петрогенных компонентов в системах флюид-расплав (Frank et al., 2002). Увеличение активности HCl во флюиде способствует увеличению инконгруэнтной растворимости большинства породообразующих минералов, выщелачиванию Ca, Fe, Mg, их переносу и переотложению (Hemley, 1959; Sverjensky et al., 1991; Frank et al., 1998). HCl также является существенной составной частью рудообразующих флюидов (Пуртов, 1998; Hedenquist, Lowenstern, 1994; Simon et al., 2005 и др.).
Определение хлорсодержащей составляющей во флюидной фазе основывается на реакциях обмена типа M-OH + HCl = M-Cl + H2O. На сегодняшний день расчет отношений фугитивностей ${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$ во флюиде, равновесном с биотитом, проводится на основании экспериментальных данных (Munoz, Swenson, 1981; Munoz, 1984) и теоретической корректировки соотношений Fe–OH–Cl в биотите и флюиде (Zhu, Sverensky, 1992). Отношения ${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$ во флюиде, равновесном с апатитом, рассчитываются на основании данных экспериментов (Рябчиков, 1975; Коржинский, 1981), проведенных при Т = 500–700°С, Р = 1–5 кбар.
Результаты экспериментальных исследованных реакций обмена Cl ↔ OH послужили основой для определения отношения ${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$ во флюиде для природных комплексов (Valley, Essene, 1980; Sisson, 1987; Mora, Valley, 1989; Valley et al., 1990; Nijland, 1993; Сотников, Берзина, 1993 и др.). Согласно указанным исследованиям, соотношение ${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$ во флюидах, фильтрующихся через различные природные комплексы, либо отделяющихся от кристаллизующихся интрузивов, меняется в интервале 0.2 < lg(${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$) < 4.02 в интервале T = = 600–850°C и Р = 2.5–10 кбар. Количественные оценки непосредственно fHCl проводились реже, чем отношения ${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$. Это связано с тем, что если отношение ${{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {{{f}_{{{\text{HCl}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{HCl}}}}}}}$ можно оценить на основании химических составов биотитов и апатитов, встречающихся в породах довольно часто, то для оценки fHCl требуется независимое определение ${{f}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ для данного объекта. Это порой не представляется возможным. Тем не менее, по данным (Markl, Piazolo, 1998) fHCl во флюидах, ассоциированных с породами различных типов (от метапелитов до гранитов и сиенитов), меняется в интервале 0.11–474 бар. Это позволяет исследователям предполагать, что типичные магматические и высокоградные метаморфические флюиды могут иметь близкие к вышеуказанным значения fHCl. Однако, как отмечают сами авторы, ограниченное количество экспериментальных и полевых данных, не позволяет это утверждать однозначно.
Наряду с биотитом и апатитом в амфиболе также возможно изоморфное замещение OH ↔ Cl. Хлорсодержащие амфиболы (0.4–0.8 мас. Cl) встречаются в высокотемпературных метасоматитах, в частности в базификатах (Ходоревская, 2010). В зонах инфильтрационных колонок гранитизации также отмечены амфиболы с содержанием Cl, достигающим 0.4–0.5 мас. %. Как правило, хлорсодержащие амфиболы в зонах гранитизации и базификации, характеризуются повышенной железистостью (XFe = FeO/(FeO + MgO) ≥ 0.511). В отличие от амфиболов метасоматитов амфиболы из вмещающих метабазитов гранулитовой фации характеризуются меньшей железистостью (XFe ≤ 0.3), в них практически нет хлора (Ходоревская, Кориковский, 2007; Ходоревская, 2010; Кориковский, Аранович, 2010). Однако определяющее значение для соотношения Cl/OH в амфиболе имеет не столько корреляция между XFe и Cl в минерале, сколько положительная корреляция между Cl и K (Volfinger et al., 1985; Morrison, 1991; Safonov, 1999; Aranovich, Safonov, 2017). Это позволяет полагать, что вхождение хлора в амфибол связано с воздействием на него водно-солевых флюидов, в состав которых входит KCl.
Взаимодействие амфибола с HCl-содержащими флюидами ранее не изучалось. Целью наших экспериментов являлось определение и изучение составов фаз, образующихся при вариациях кислотности растворов, а также определение значений fHCl во флюидах. Полученные данные позволят уточнить и расширить характеристики высокотемпературного метасоматоза амфиболитовой и гранулитовой фаций.
ТЕХНИКА И МЕТОДИКА ЭКСПЕРИМЕНТОВ
В экспериментах использовались образцы амфибола и амфиболита из меланократовых жил о. Кий (Онежская губа, Белое море). Состав исходного амфибола (мас. %): SiO2 – 44.11, TiO2 – 0.95, Al2O3 – 15.12, FeO – 12.08, MnO – 0.13, MgO – 12.05, CaO – 11.74, Na2O – 1.66, K2O – 0.49, сумма 98.32. Номенклатура амфиболов и пересчет анализов на кристаллохимическую формулу ${\text{A}}{{{\text{B}}}_{2}}{\text{C}}_{5}^{{{\text{VI}}}}{\text{T}}_{8}^{{{\text{IV}}}}{{{\text{O}}}_{{22}}}$(OH)2 проводились согласно (Leake et al., 1997). Используемый амфибол соответствует чермакиту, его формула: (Na0.3K0.1)(Ca1.8Na0.2) (${\text{M}}{{{\text{g}}}_{{2.6}}}{\text{Fe}}_{{1.1}}^{{2 + }}{\text{Fe}}_{{0.3}}^{{3 + }}{\text{T}}{{{\text{i}}}_{{0.1}}}{\text{Al}}_{{0.9}}^{{{\text{VI}}}}$)[${\text{Al}}_{{1.7}}^{{{\text{IV}}}}{\text{S}}{{{\text{i}}}_{{6.3}}}$]O22(OH)2. (Na + + K)A = 0.4, железистость XFe = 0.3.
Состав исходного амфиболита (мас. %): SiO2 – 48.14, TiO2 – 1.37, Al2O3 – 15.82, FeO – 12.27, MnO – 0.19, MgO – 5.46, CaO – 11.49, Na2O – 3.02, K2O – 0.88, P2O5 – 0.05, Cl – 0.10, сумма – 98.81. Амфиболит состоит из амфибола и плагиоклаза An46. Cостав амфибола в амфиболите: SiO2 – 41.60, TiO2 – 2.00, Al2O3 – 12.13, FeO – 18.50, MnO – 0.22, MgO – 9.26, CaO – 11.74, Na2O – 1.50, K2 O – 1.95, P2O5 – 0.05, Cl – 0.04, сумма – 98.90, соответствует ферропаргаситу, (Na + K)A = 0.75, XFe = 0.51 (Leake et al., 1997).
Предварительно измельченные до размеров 5–20 мкм навески амфибола или амфиболита помещались в ампулы и взвешивались. Свободный объем ампул заполнялся растворами HCl, концентрация которых менялась от 0.05 до 2.81 моль/кг H2O (m) (табл. 1). Использовались стандартные 1m и 0.1m растворы. Растворы с концентрацией HCl, превышающей 1m, готовились разбавлением сертифицированной 14 мас. % HCl (4.46m).
Таблица 1.
Условия экспериментов и минеральный состав навески после опытов, рассчитанные значения fHCl и ${{f}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$
| № опытов | Т, °С |
P, кбар |
Вес навески, г | Вес раствора, г | Концентрация HCl (m) | XHCl | Минеральные ассоциации после опытов | XHCl после опытов |
fHCl,бар | ${{f}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, бар | pH до опыта | pH после опыта |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Амфибол + растворы HCl | ||||||||||||
| P-1 | 650 | 7 | 0.032 | 0.401 | 0.05 | 0.001 | Hbl, Pl, Chl, Ap, Gl1 | ≈0* | 0 | 6118 | 3 | 4–5 |
| P-2 | 650 | 7 | 0.031 | 0.369 | 0.1 | 0.002 | Hbl, Chl, Ap, Pl | 0.0002 | 8 | 6116 | 1 | 5–6 |
| P-3 | 650 | 7 | 0.041 | 0.250 | 0.5 | 0.009 | Crn, Sil, Chl, Qtz, Hbl, oAmph, Ap | 0.004 | 169 | 6093 | 0.3 | 5–6 |
| P-4 | 650 | 7 | 0.052 | 0.41 | 1.0 | 0.018 | Crn, Sil, Qtz, Hbl, Ap, oAmph, Chl | 0.008 | 339 | 6069 | 0 | 4–5 |
| P-5 | 650 | 7 | 0.053 | 0.32 | 2.0 | 0.035 | Crn, Sil, Qtz, Hbl, oAmph, Chl, Ap | 0.035 | 1485 | 5903 | –0.3 | <1 |
| Y-1 | 750 | 7 | 0.034 | 0.404 | 0.1 | 0.002 | Hbl, Spl, Ilm, Gl1, Pl | 0.0002 | 7 | 7278 | 1 | 5–6 |
| Y-2 | 750 | 7 | 0.038 | 0.363 | 1.0 | 0.018 | Crd, oAmph, Spl, Gl1 | 0.018 | 684 | 7148 | 0 | <1 |
| Y-3 | 750 | 7 | 0.03 | 0.422 | 1.5 | 0.026 | Qtz, Crn, Rt, Crd | 0.026 | 988 | 7090 | –0.17 | <1 |
| Y-4 | 750 | 7 | 0.029 | 0.41 | 1.64 | 0.03 | Qtz, Crn, Rt, Crd | 0.03 | 1140 | 7061 | –0.21 | <1 |
| Амфиболит + растворы HCl | ||||||||||||
| 2-D | 750 | 7 | 0.031 | 0.48 | 0.15 | 0.003 | Hbl, Gl2, Pl, Ilm | 0.001 | 38 | 7272 | 0.82 | 5–6 |
| 3-D | 750 | 7 | 0.026 | 0.324 | 0.5 | 0.009 | Hbl, Spl, Ilm, Gl2, Pl | 0.004 | 152 | 7251 | 0.3 | 4–5 |
| Y-5 | 750 | 7 | 0.037 | 0.410 | 1.61 | 0.028 | Qtz, Crn, Rt, Mag, Crd, Gl2 | 0.028 | 1064 | 7076 | –0.68 | <1 |
| X-4 | 750 | 7 | 0.042 | 0.388 | 2.81 | 0.05 | Qtz, Crn, Rt, Mag, Crd, Gl2 | 0.05 | 1900 | 6916 | –0.33 | <1 |
| W-3 | 800 | 5 | 0.029 | 0.171 | 0.8 | 0.01 | Hbl, Gl2, Pl, Ap, Gl1, Ilm | 0.008 | 132 | 4513 | 0.1 | н/изм**. |
| W-2 | 800 | 5 | 0.021 | 0.256 | 1.5 | 0.026 | oAmph, Ap, Pl, Ilm, Gl2, Gl1 | 0.013 | 214 | 4490 | –0.18 | <1 |
| W-12 | 800 | 5 | 0.038 | 0.161 | 1.70 | 0.03 | oAmph, Ap, Pl, Ilm, Gl2, Gl1 | 0.016 | 241 | 4477 | –0.23 | н/изм. |
| W-4 | 800 | 5 | 0.028 | 0.210 | 2 | 0.035 | Crd, oAmph, Ap, Ilm, Gl2, Gl1 | 0.035 | 528 | 4390 | –0.3 | <1 |
При изучении взаимодействия минералов с растворами большое значение имеет соотношение раствор/твердая навеска. При изучении полей устойчивости минералов добиваются увеличения выхода новых фаз в количествах, достаточных для диагностики. Для этого в опытах создается высокое отношение раствор/шихта. В случаях, когда целью является изучение химизма растворов и растворимости минерала в сосуществующих растворах, используют низкое отношение раствор/шихта (Хитаров, Рыженко, 1963; White, Classen, 1980). Поскольку целью наших экспериментов являлось определение и изучение минеральных фаз, характерных для условий кислотного метасоматоза, а также измерение концентраций петрогенных компонентов в растворах после опытов, в ампулах создавался значительный избыток флюида по отношению к минеральной навеске (табл. 1).
После заполнения ампулы взвешивались, заваривались, переворачивались и хорошо встряхивались для более равномерного распределения раствор–порода. Все эксперименты проводились в золотых ампулах во избежание потерь железа в стенки ампул. Летучесть кислорода не контролировалась, принималась близкой к буферу Ni–NiO (Helz, 1973). Исследования более тысячи экспериментальных и природных кристаллов амфиболов, представленные в (Ridolfi, Renzulli, 2012), также показывают, что соотношение двух- и трехвалентного железа в этих минералах отвечает буферу Ni–NiO ± 0.37 лог. ед.) в широком диапазоне Р-Т условий.
Опыты проводились при Т = 650–800°С и Р = = 5–7 кбар в аппаратах с газовым давлением и внутренним нагревом (газовые бомбы) в Институте экспериментальной минералогии РАН. Продолжительность опытов – четверо суток, после чего проводилась закалка. Погрешность регулировки и измерения температуры оценивалась в ±7°, погрешность измерения давления – ±300 бар, скорость закалки – 100°/мин.
После опытов сохранность ампул контролировалась повторным взвешиванием. Ампулы вскрывались, извлеченный из ампул раствор разбавлялся 1 мл дистиллированной воды и анализировался. Элементный анализ проб проведен в Аналитическом сертификационном испытательном центре Института проблем технологии микроэлектроники и особо чистых материалов РАН (АСИЦ ИПТМ РАН) масс-спектральным (Х-7, Thermo Elemental, США) и атомно-эмиссионным (ICAP-61, Thermo Jarrеll Ash, США) методами анализа. Концентрация хлора в растворе после опытов не определялась. Задаваемый значительный избыток флюида по отношению к навеске и отсутствие хлорсодержащих твердых фаз после опытов (табл. 1) позволяли полагать, что концентрация Cl во флюидах до и после опытов почти не менялась. Образование за счет амфибола других водосодержащих фаз, таких как хлорит, кордиерит (уравнения 1–4, см. ниже), могут изменить количество H2O во флюиде в интервале ≈10–5–10–4 г H2O. Подобные значения количества H2O практически не меняют ни общий объем раствора, ни концентрации H2O–Cl в нем, учитывая, что содержание H2O в исходном задаваемом растворе составляет 0.15–0.48 г (табл. 1).
Однако близкая к исходной концентрация Cl во флюиде после опытов не означала, что pH растворов за время опытов также не менялся. Так, после опытов, проведенных с невысокими mHCl ≤ 1m (табл. 1), pH закалочных растворов увеличивался до значений 4–6. Нейтрализация раствора в таких опытах происходила вследствие выноса из навески амфибола/амфиболита щелочей в раствор, которые связывались с Cl–. В опытах, проводимых с mHCl высоких концентраций (>1m), закалочные растворы оставались кислыми (pH < 1).
Твердая навеска извлекалась из ампулы и промывалась дистиллированной водой. Затем каждый из образцов помещался в контейнер, заливался эпоксидным клеем, полировался и анализировался методом локального рентгеноспектрального микроанализа с применением сканирующего электронного микроскопа “CamScan MV2300” (VEGA TS 5130MM), оснащенном энергодисперсионным рентгеновским спектрометром INCA Energy-350 (лаборатория электронной микроскопии и микроанализа ИЭМ РАН). Время набора спектра – 70 с для разных фаз.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Составы фаз в продуктах опытов
Система амфибол–флюид–H2O–HCl. Т = 650–750°С, Р = 7 кбар.
На рис. 1 приведены типичные фотографии образцов после опытов, проведенных при 650°С и mHCl = 0.05, 0.1 и 0.5 m (соответственно опыты P-1, P-2, P-3 в табл. 1).
Рис. 1.
Фотографии образцов после опытов, проведенных в системе амфибол–H2O–HCl при 650°C, 7 кбар. (а) – крупные кристаллы амфибола с редким хлоритом (опыт P-1, mHCl = 0.05 m); (б) – мелкие кристаллы амфибола, крупный кристалл кварца и розетка хлорита в центре, в рамке – алюмосиликатные скопления (опыт P-3, mHCl = 0.5 m); (в) – одиночные кристаллы Crn в цементирующей алюмосиликатной массе (опыт P-3).

В опытах P-1 и P-2 резко преобладающей (>90%) фазой оставались кальциевые амфиболы – чермакиты с (Na + K)A = 0.45–0.49, XFe = 0.25–0.35 (рис. 1а), по составу не отличающиеся от исходных. Хлорит отмечался во всех опытах независимо от концентрации HCl. Это могли быть одиночные кристаллы (рис. 1а) различных, от 10 до ≈80 мкм, либо розетки размером до 100 мкм, состоящие из мелких игольчатых пластин. Формула хлоритов: (Mg2.93Fe1.59Al1.4)(Si2.68Al1.32)O10(OH)8. С ростом концентрации HCl в хлоритах происходит изоморфное замещение Fe → Mg, Fe → Al(VI), и Al(IV) → Si, общая формула хлоритов при mHCl = 1 m (опыт P-4) (Mg3.43Fe0.95Al1.57)5.95(Si2.92Al1.08)O10(OH)8.
В опыте P-1 кроме амфиболов и хлоритов фиксировались плагиоклазы An95-100. В опыте P-2 хорошо выраженные кристаллы Pl не обнаружены. Помимо указанных фаз отмечались единичные мелкие (<10 мкм) зерна апатита с содержанием Cl = 1.72 мас. %. Появление апатита в продуктах опытов объясняется примесью фосфора в исходном амфиболе, не определяемой микрозондовым анализом. По данным (Koritnig, 1965) примеси фосфора в амфиболе могут колебаться в интервале 0–180 ppm.
Кроме минеральных фаз в опытах P-1 и P-2 отмечены мелкие (≈10 мкм) сферические формы, представляющие собой продукты закалки флюидной фазы – закалочное стекло Gl1.
В опытах P-3–P-5, проведенных при более высоких mHCl (табл. 1), кальциевые амфиболы сохраняются, однако их количество резко уменьшается. Это в основном чермакиты c (Na + K)A = = 0.4–0.5. В некоторых зернах изредка отмечается увеличение (Na + K)A до значений 0.52–056. Железистость амфиболов XFe = 0.3–0.4.
В опыте P-3 наряду с кальциевыми амфиболами появляются единичные кристаллы ромбического амфибола Mg5(Mg0.65Al0.98Fe0.10)5Si8O22(OH)2, по составу близкого к антофиллиту, либо куммингтониту, но со значительной примесью Al.
В опытах P-3–P-5 не отмечается плагиоклаз, появляются скопления, состоящие из мелких сферических форм кварца, фаз типа Al2SiOn ⋅ mH2O, тонковолокнистого силлиманита (в рамках на рис. 1б). Иногда встречаются единичные очень крупные, >200 мкм, кристаллы кварца, хлорита (рис. 1б), корунда (рис. 1в), фиксируются мелкие глобулы (2–3 мкм) оксидов Fe.
Результаты опытов, проведенных при Т = = 750°С, показаны на рис. 2. При концентрациях HCl ≤ 0.1 m (опыт Y-1 в табл. 1) исходный чермакит остается основной фазой (рис. 2а). В центрах кристаллов состав амфибола близок к исходному, к краям происходит вынос Na, Ca, Fe в большей степени, чем Mg. Вследствие подобного выноса в минерале увеличивается содержание SiO2, Al2O3 и понижается железистость от XFe = 0.30 до XFe = 0.20, чермакит превращается в Mg-Hbl. В-ынесенные Fe и Mg образуют соответственно ильменит ${\text{Fe}}_{{0.20}}^{{2 + }}{\text{Fe}}_{{1.30}}^{{3 + }}{\text{M}}{{{\text{g}}}_{{0.10}}}{\text{T}}{{{\text{i}}}_{{0.40}}}{{{\text{O}}}_{3}}$ и шпинель ${\text{M}}{{{\text{g}}}_{{0.8}}}{\text{Fe}}_{{0.09}}^{{2 + }}{\text{Fe}}_{{0.08}}^{{3 + }}{\text{A}}{{{\text{l}}}_{{1.90}}}{{{\text{O}}}_{4}}$. Однако вынос элементов из амфибола крайне слаб при такой кислотности, суммарное количество шпинели и ильменита не достигает 1 мас. %. Сохраняются анортит, а также единичные сферические образования закалочного стекла Gl1, подобные наблюдаемым в опыте P-1.
Рис. 2.
Фотографии образцов после опытов, проведенных в системе амфибол–H2O–HCl при 750°C, 7 кбар. (а) – кристаллы Hbl и мелкие вкрапления Spl (опыт Y-1, mHCl = 0.1 m); (б) – крупный кристалл Crd, oAmph и мелкие сферы закалочного флюида (Gl1)/расплава (Gl2) (опыт Y-2, mHCl = 1 m); (в) – хорошо выраженные кристаллы Crn в алюмосиликатной матрице (опыт Y-3, mHC l = 1.5 m).

При концентрации HCl = 1m (опыт Y-2 в табл. 1) после опытов кальциевые амфиболы сменяются ортоамфиболами типа жедрита Mg2(Mg2.50Al1.61Fe0.90)(Si7.22Al0.78)O22(OH)2, с XFe = = 0.1–0.2. Появляется редкий мельчайший ильменит и кордиерит, размеры которого могут достигать ≈300 мкм (рис. 2б). Состав кордиерита: (Mg1.95Fe0.07)[Al4.05Si4.86O] ⋅ nH2O. Отмечаются мелкие сферические формы Gl1 размером 5–10 мкм.
При дальнейшем увеличении концентрации кислоты (HCl ≥ 1.5 m) амфиболы растворяются в значительной степени (опыты Y-3, Y-4 в табл. 1). В продуктах опытов наряду с сохраняющимися редкими кристаллами амфибола и кордиерита отмечаются коллоидные скопления, по составу отвечающие SiO2. В этих скоплениях обособляются многочисленные хорошо выраженные, удлиненные кристаллы Al2O3, (корунд) ≈20 мкм (рис. 2в). Кроме того, в алюмосиликатной матрице изредка наблюдаются нитевидные выделения рутила. Размеры рутила варьируют от <1 до 40 мкм.
Таким образом, при взаимодействии амфибола с растворами HCl получены следующие результаты.
При Т = 650°C, 7 кбар и низких концентрациях HCl (<0.1m) происходит слабое инконгруэнтное растворение кальциевых амфиболов с образованием небольшого количества анортита, хлорита, кварца и оксидов Fe. При концентрациях HCl > 0.1m плагиоклаз не отмечается, наряду с кальциевыми амфиболами и хлоритом появляются ортоамфиболы по составу близкие к антофиллиту, либо куммингтониту с примесью Al.
При Т = 750°C, 7 кбар кальциевые амфиболы с ростом mHCl также сменяются ортоамфиболами и, затем, кордиеритом. Вместо антофиллита образуется жедрит со значительным содержанием Al. Анортит сохраняется при несколько более высоких mHCl, хлорит не отмечается. Как при 650, так и при 750°С, взаимодействие амфибола с кислыми растворами приводит к отсутствию щелочей в новообразованных минералах, т.е. эти элементы практически полностью переходят в раствор.
Система амфиболит–флюид–H2O–HCl, Т = = 750–800°C, Р = 5–7 кбар.
В отличие от системы амфибол–H2O–HCl, взаимодействие амфиболита, состоящего из амфибола и плагиоклаза, с растворами H2O–HCl приводит к заметному частичному плавлению породы вследствие того, что в плавлении участвуют и амфибол, и плагиоклаз. Образующийся расплав Gl2 отмечается по краям и по трещинам в плагиоклазе и в амфиболе. Кроме того, расплав Gl2 может коагулироваться в сферические формы. Также как в рассмотренной выше системе амфибол–H2O–HCl, в системе амфиболит–H2O–HCl избыток флюидной фазы приводит к осаждению при закалке вещества из флюида в виде сферул закалочного стекла Gl1 (рис. 3а).
Рис. 3.
Фотографии образцов амфиболитов после опытов. (а) – расплав Gl2, образующий линзы в oAmph и Pl; в левом верхнем углу вытянутые кристаллы Ap, достигающие 150 мкм, Ilm, образующийся по краям Hbl; сферические формы Gl2 варьирующих размеров, (опыт W-2, mHCl = 1.5 m); (б) – крупные кристаллы Crd, oAmph с частичным плавлением, Ap в Gl1 (опыт W-4, mHCl = 2 m); (в) – кристаллы Crd в алюмосиликатной матрице (опыт Y-5, mHCl = 1.61 m).

Взаимодействие амфиболитов с водой и разбавленными растворами HCl представлено в опытах D-2 D-3 и W-3 (табл. 1). В этих опытах сохраняются кальциевые амфиболы. В центрах кристаллов их состав близок к исходному, в краевых частях выносятся Na, Ca и Fe в большей степени, чем Mg. Вследствие подобного выноса в минерале увеличивается содержание SiO2, Al2O3, понижается железистость XFe от 0.51 до 0.44. Исходный паргасит (Na + K)A = 0.75 превращается в чермакит, либо в Mg-Hbl с содержанием (Na + K)A = = 0.35–0.40. Вынесенные Fe и Ti образуют ильменит, который зачастую располагается по краю амфибола. Исходный плагиоклаз An46, переходит в An96. Расплав Gl2 в виде слоев и пятен отмечается в амфиболе и плагиоклазе, а также образует редкие сферические формы, не превышающие ≈50 мкм. Закалочные стекла Gl1 редки в опытах W-3, D-2 и не отмечены в опыте D-3.
При увеличении концентрации HCl (mHCl = 1.5m, опыт W-2 в табл. 1) кальциевые амфиболы сменяются ортоамфиболами. На рис. 3а видно, что размеры oAmph составляют ≈50–80 мкм, их состав выражается как: Mg2(Ca0.26Mg2.56Al0.50Ti0.02Fe1.45${\text{Fe}}_{{0.16}}^{{3 + }}$)(Si7.34Al0.66)O22 (OH)2, XFe = 0.24. Плагиоклаз – An94–96. Отмечен апатит, достигающий 150 мкм. В нем содержится до 2 мас. % хлора. Ильменит, образующийся за счет выноса Ti и Fe из амфибола, также как в опытах D-2, D-3 и W-3, располагается по краям минерала. В амфиболе отмечаются участки расплава, а также крупные сферические формы Gl2, наблюдаются единичные сферулы Gl1 (рис. 3а).
При дальнейшем увеличении концентрации HCl (mHCl ≥ 1.6m, опыты W-4 и др. в табл. 1) наряду с уменьшающимся количеством oAmph появляются кристаллы кордиерита, в единичных случаях достигающие 200 мкм. Состав кордиерита: (Mg1.95Fe0.07)[Al4.05Si4.86O] ⋅ nH2O, отсутствует плагиоклаз. Большое количество расплава Gl2, который сегрегируется в сферические формы (рис. 3б), объясняется полным плавлением плагиоклаза в этом опыте по сравнению с опытами W-3, W-2, где Pl остается устойчивым. Закалочные стекла, отвечающие по составу Gl1, фиксируются вокруг удлиненных тонких кристаллов апатита (рис. 3б). Поэтому в данном опыте кристаллизация апатита, видимо, проходила из флюидной фазы.
В сильно кислых растворах (Y-5, X-4, в табл. 1) oAmph исчезает, сменяется Crd (рис. 3в). Отмечаются мельчайшие сферулы SiO2 ⋅ nH2O, которые местами образуют бесформенные скопления. В этой, существенно кварцевой матрице, проявляются редкие удлиненные кристаллы корунда, аналогичные представленным на рис. 2в. Здесь же изредка встречаются нитевидные выделения рутила от <1 до 40 мкм, ильменит в высоко кислотных растворах распадается на оксиды Fe и рутил.
Таким образом, результаты опытов по взаимодействию как амфибола, так и амфиболита с растворами H2O–HCl имеют много общего. В той и другой системе наблюдается вынос щелочей, железа и кальция с формированием как магнезиальных ортоамфиболов, кордиерита, так и алюмосиликатной матрицы. Вместе с тем, весьма существенным отличием является появление значимых количеств расплава Gl2 в системе амфиболит H2O–HCl. В системе амфибол H2O-HCl наблюдаются только сферулы закалочного стекла Gl1, расплав Gl2 отсутствует.
Составы флюидной фазы в системе амфибол–флюид–H2O–HCl при Т = 650°С, Р = 7 кбар
В табл. 2 приведены концентрации основных петрогенных и некоторых рудных элементов в растворах после экспериментов. Во всех опытах концентрации Si и Al в закалочных растворах низкие. Это связано с тем, что при концентрациях HCl ≤ 0.1 моль/кг амфибол растворяется слабо (опыты P-1–P-2 в табл. 1), при более высоких mHCl Si и Al также не уходят в раствор, а формируют алюмосиликатную матрицу. Концентрации Na, Ca, Mg, Fe в растворах на несколько порядков выше, чем Si, Al, и возрастают с ростом кислотности растворов.
Таблица 2.
Составы растворов (мкг/г) после опытов, проведенных при 650°С, 7 кбар
| Элемент | Номера опытов | ||||
|---|---|---|---|---|---|
| P-1 | P-2 | P-3 | P-4 | P-5 | |
| концентрация HCl, (моль/кгH2O) | |||||
| 0.05 | 0.1 | 0.5 | 1 | 2 | |
| Si | 139 | 446 | 191 | 218 | 413 |
| Ti | <ПО* | <ПО | <ПО | <ПО | <ПО |
| Al | 7.7 | 6.1 | 4.5 | 19.9 | 33.0 |
| Fe | 33.5 | 231 | 1628(0.16%) | 6330(0.7%) | 12 390(1.74%) |
| Mn | 2.06 | 9.8 | 46.2 | 156 | 269 |
| Mg | 79.6 | 160 | 424(0.04) | 1159 | 3335(033%) |
| Ca | 1315 | 1815 | 6095 | 15433 | 21540 |
| Na | 1507 | 1582 | 1428 | 3215 | 5626 |
| K | 320 | 983 | 817 | 1595 | 3762 |
| Co | 2.2 | <ПО | 0.54 | 2.5 | 7.4 |
| Zn | 6.1 | 8.3 | 13.4 | 53.6 | 70.6 |
| Ba | 6.7 | 10.0 | 11.8 | 23.0 | 60 |
| Pb | <ПО | 0.064 | 0.068 | 5.1 | 7.3 |
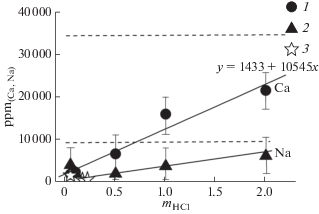
На рис. 4 видно, что концентрации Ca в слабокислых растворах HCl близки к данным (Luce, 1985) и не сильно отличаются от концентраций Ca в H2O при близких параметрах по данным (Budanov, Shmulovich, 2000). С ростом mHCl содержания Ca и Na в растворах будут определяться степенью растворения амфибола. В случаях, когда амфибол растворяется полностью, весь Ca и Na из навески амфибола переходит в раствор, поскольку в новообразованных фазах ни Ca, ни Na нет. Зная процентное содержание этих элементов в минерале, вес задаваемой навески и объем задаваемого раствора, можно определить теоретические максимальные концентрации Ca и Na в растворах, равновесных с твердыми фазами в опытах. Рассчитанные подобным образом концентраци Ca и Na показаны на рис. 2 пунктиром. Видно, что рассчитанные значения концентраций Ca и Na остаются выше, чем измеренные после опытов. Это связано с тем, что исходный амфибол растворяется не полностью и небольшие его количества сохраняются после опытов (табл. 1).
Рис. 4.
Соотношение mHCl – ppm(Ca, Na) в растворе: 1 – Ca, 2 – Na, 3 – данные (Luce, 1985); пунктирные линии – рассчитанные концентрации Ca и Na (см. в тексте).
Концентрации Fe в растворах возрастают с ростом кислотности, увеличиваясь в несколько раз. Концентрации Mg остаются низкими даже в сильно кислых растворах (рис. 5), поскольку вынесенный из амфибола Mg переотлагается в хлорите.
Рис. 5.
Соотношение mHCl – ppm (Fe, Mg) в растворе: 1 – Fe, 2 – Mg; 3–4 – концентрации Fe и Mg соответственно по данным (Пуртов, Ятлук, 1982).
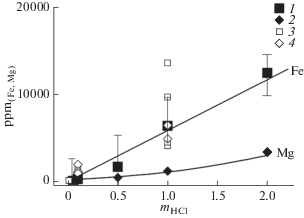
Светлыми квадратами и ромбами на рис. 5 показаны значения концентраций Fe и Mg в растворах, равновесных с породами, представленными габбро и дунитами для 600оС, 1 кбар и mHCl = 1 моль/кг по данным (Пуртов, Ятлук, 1982). Из рис. 5 видно, что значения концентраций Fe из наших опытов находятся в интервале концентраций Fe, равновесных с породами. Концентрации Mg в наших 1m растворах HCl ниже в 4–5.5 раз, чем в исследованиях (Пуртов, Ятлук, 1982). Подобная разница значений концентраций Mg в растворах объясняется различными методиками исследования. При постановке наших опытов, как указывалось выше, задавалось высокое соотношение флюид/навеска. При этом в области высоких значений mHCl (1–2 m) проходило инконгруэнтное растворение амфибола и связывание выщелачиваемого растворами Mg в новообразованные минералы, такие как хлорит, ортоамфибол и кордиерит, характеризующиеся низкой железистостью. Соответственно концентрации Mg в равновесных растворах были низки. По данным (Пуртов, Ятлук, 1982) соотношение флюид/навеска составляло (1.5–2.0)/1). В таких условиях авторами не отмечалось появление новообразованных минералов. Концентрации Mg в растворах были выше, чем в наших исследованиях.
В области разбавленных mHCl (≤0.01m) значения концентраций Mg в растворах по нашим данным и данным (Пуртов, Ятлук, 1982) совпадают в пределах погрешностей определения. Это объясняется низкой растворимостью амфибола в близнейтральных условиях, слабой степенью осаждения новообразованных Mg-содержащих фаз. В целом, слабый разброс значений концентраций Fe и Мg в растворах из наших экспериментов, проведенных при 7 кбар, и данных, приведенных в работе (Пуртов, Ятлук, 1982) при 1 кбар, свидетельствует о том, что давление в интервале 1–7 кбар слабо влияет на растворимость Fe–Mg алюмосиликатов, как и указывалось в исследованиях (Азимов, Бушмин, 2007).
Измерения концентраций элементов в растворах после опытов при 750°С не проводились, поскольку увеличение температуры на 100 градусов почти не влияет на растворимость амфибола (Азимов, Бушмин, 2007).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Особенности систем амфибол–флюид и амфиболит–флюид
Стабильность амфибола зависит от состава минерала, Т–Р параметров, состава флюидной фазы, окислительно-восстановительной обстановки. По данным (Holloway, 1973; Allen, Boettcher, Marland, 1975; Allen, Boettcher,1983; Jenkins, Clare, 1990 и др.) дегидратация амфибола и его частичное плавление начинаются при 900°C или более высокой температуре. В наших экспериментах, проведенных при T = 650–750°C, плавление амфибола не отмечено (рис. 1а). Поэтому, мелкие сферулы закалочного стекла Gl1, фиксируемые в опытах, представляют собой продукты закалки флюидной фазы (табл. 3). В таких случаях количество осажденного материала и, соответственно, размеры сфер определяются кислотностью растворов. Мелкие (<10 мкм) сферические формы Gl1 наблюдаются в опытах, проведенных при низких mHCl, в то время, как крупные (≥10 мкм) – в опытах, проводимых с высокими mHCl. Этот вывод подтверждают расчетные данные (Азимов, Бушмин, 2007). Согласно этим данным растворимость амфиболов практически не меняется в широком интервале температур (400–800°C) при давлениях 3–5 кбар, но на 2.5–3 порядка увеличивается с ростом кислотности растворов от нейтральных до сильно кислых (>1 моль/кг).
Таблица 3.
Составы закалочных фаз
| Компо-ненты | Амфибол + H2O + HCl | Амфиболит + H2O + HCl | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Р-1 | Y-1 | Y-2 | Y-4 | D-2 | Y-5 | W-3 | W-3 | W-2 | W-2 | W-12 | W-12 | W-4 | W-4 | |
| Gl1* | Gl1 | Gl1 | Gl1 | Gl2 | Gl1 | Gl1 | Gl2 | Gl1 | Gl2 | Gl1 | Gl2 | Gl1 | Gl2 | |
| 7** | 3 | 6 | 2 | 8 | 3 | 3 | 7 | 6 | 7 | 2 | 6 | 7 | 7 | |
| SiO2 | 85.81(0.9) | 71.14(1.3) | 73.29(2.1) | 77.01(0.6) | 63.72(1.4) | 70.95(2.0) | 75.33(3.1) | 64.15(1.4) | 79.76(2.9) | 62.56(2.4) | 85.61(1.1) | 64.49(0.8) | 85.33(3.2) | 63.85(2.3) |
| TiO2 | 0.05(0.1) | 0.23(0.1) | 0.07(0.07) | 0.18(0.04) | 0.00 | 0.00 | 0.24(0.2) | 0.32(0.3) | 0.24(0.1) | 0.32(0.2) | 0.26(0.1) | 0.30(0.1) | 0.21(0.1) | 0.33(0.1) |
| Al2O3 | 3.60(1.5) | 10.86(0.9) | 10.37(1.4) | 8.61(0.1) | 15.85(0.7) | 8.24(0.9) | 10.12(0.5) | 13.93(0.8) | 5.83(1.3) | 13.32(0.9) | 3.87(0.8) | 12.89(0.4) | 3.84(1.8) | 12.91(0.3) |
| FeO | 0.62(0.3) | 0.96(0.1) | 0.75(0.2) | 0.17(0.1) | 1.43(0.4) | 0.34(0.1) | 0.42(0.2) | 2.30(2.1) | 0.66(0.2) | 2.19(1.1) | 0.57(0.2) | 1.54(0.4) | 0.33(0.1) | 1.54(0.3) |
| MnO | 0.02(0.0) | 0.04(0.04) | 0.12(0.1) | 0.01(0.01) | 0.11(0.11 | 0.00 | 0.06(0.1) | 0.13(0.1) | 0.01(0.01) | 0.05(0.1) | 0.04(0.04) | 0.07(0.1) | 0.06(0.03) | 0.06(0.1) |
| MgO | 0.53(0.4) | 1.02(0.5) | 0.97(0.1) | 1.08(0.1) | 0.30(0.2) | 0.98(0.2) | 0.22(0.1) | 0.85(0.8) | 0.33(0.1) | 1.31(0.9) | 0.14(0.02) | 0.82(0.3) | 0.13(0.01) | 0.88(0.2) |
| CaO | 1.50(0.7) | 3.59(0.2) | 3.35(0.5) | 1.21(0.1) | 3.99(0.9) | 2.44(0.2) | 0.90(0.2) | 2.58(1.3) | 1.47(0.4) | 4.06(0.3) | 0.57(0.2) | 3.75(0.2) | 0.61(0.4) | 3.62(0.3) |
| Na2O | 0.04(0.0) | 0.10(0.1) | 0.15(0.1) | 0.13(0.1) | 0.37(0.2) | 0.16(0.1) | 0.82(0.3) | 1.66(0.3) | 0.46(0.1) | 0.53(0.1) | 0.79(0.1) | 0.78(0.1) | 0.42(0.1) | 0.57(0.2) |
| K2O | 0.17(0.0) | 0.36(0.2) | 0.27(0.1) | 0.09(0.02) | 0.31(0.2) | 0.06(0.02) | 2.17(0.1) | 2.02(0.1) | 0.57(0.1) | 0.55(0.1) | 0.65(0.1) | 0.83(0.1) | 0.60(0.1) | 0.84(0.1) |
| Cl | 0.01(0.01) | 0.03(0.03) | 0.08(0.08) | 0.09(0.07) | 0.00 | 0.10(0.1) | 0.05(0.05) | 0.00 | 0.09(0.1) | 0.21(0.2) | 0.05(0.05) | 0.18(0.2) | 0.06(0.02) | 0.17(0.1) |
| Сумма | 92.36 | 88.33 | 89.43 | 88.58 | 86.08 | 83.27 | 90.33 | 87.94 | 89.42 | 85.10 | 92.55 | 85.65 | 91.59 | 84.77 |
| Пересчет на безводный остаток | ||||||||||||||
| SiO2 | 92.92 | 80.54 | 81.96 | 86.94 | 74.02 | 85.20 | 83.39 | 72.95 | 89.20 | 73.51 | 92.50 | 75.29 | 93.17 | 75.32 |
| TiO2 | 0.05 | 0.26 | 0.08 | 0.20 | 0.00 | 0.00 | 0.27 | 0.36 | 0.27 | 0.38 | 0.28 | 0.35 | 0.23 | 0.39 |
| Al2O3 | 3.90 | 12.29 | 11.60 | 9.72 | 18.41 | 9.90 | 11.20 | 15.84 | 6.52 | 15.65 | 4.18 | 15.05 | 4.19 | 15.23 |
| FeO | 0.67 | 1.09 | 0.84 | 0.19 | 1.66 | 0.41 | 0.46 | 2.62 | 0.74 | 2.57 | 0.62 | 1.80 | 0.36 | 1.82 |
| MnO | 0.02 | 0.05 | 0.13 | 0.01 | 0.13 | 0.00 | 0.07 | 0.15 | 0.01 | 0.06 | 0.04 | 0.08 | 0.07 | 0.07 |
| MgO | 0.57 | 1.15 | 1.08 | 1.22 | 0.35 | 1.18 | 0.24 | 0.97 | 0.37 | 1.54 | 0.15 | 0.96 | 0.14 | 1.04 |
| CaO | 1.62 | 4.06 | 3.75 | 1.37 | 4.64 | 2.93 | 1.00 | 2.93 | 1.64 | 4.77 | 0.62 | 4.38 | 0.67 | 4.27 |
| Na2O | 0.04 | 0.11 | 0.17 | 0.15 | 0.43 | 0.19 | 0.91 | 1.89 | 0.51 | 0.62 | 0.85 | 0.91 | 0.46 | 0.67 |
| K2O | 0.18 | 0.41 | 0.30 | 0.10 | 0.36 | 0.07 | 2.40 | 2.30 | 0.64 | 0.65 | 0.70 | 0.97 | 0.66 | 0.99 |
| Cl | 0.01 | 0.03 | 0.09 | 0.10 | 0.00 | 0.12 | 0.06 | 0.00 | 0.10 | 0.25 | 0.05 | 0.21 | 0.07 | 0.20 |
| CIPW | ||||||||||||||
| Qtz | 87.15 | 67.1 | 69.49 | 81.10 | 58.18 | 75.55 | 66.21 | 43.38 | 79.32 | 53.09 | 83.11 | 54.30 | 86.23 | 55.79 |
| Crn | 0.69 | 4.28 | 4.18 | 6.92 | 8.88 | 4.19 | 5.30 | 4.91 | 2.00 | 5.26 | 0.91 | 4.55 | 1.51 | 5.30 |
| Ort | 1.06 | 2.42 | 1.77 | 0.59 | 2.13 | 0.41 | 14.18 | 13.59 | 3.78 | 3.84 | 4.14 | 5.73 | 3.84 | 5.85 |
| Ab | 0.34 | 0.93 | 1.44 | 1.18 | 3.64 | 1.61 | 7.70 | 15.99 | 4.4 | 5.33 | 7.19 | 7.70 | 3.89 | 5.67 |
| An | 8.04 | 20.19 | 18.6 | 6.75 | 23.03 | 14.54 | 4.96 | 14.54 | 8.14 | 23.71 | 3.08 | 21.78 | 3.32 | 21.23 |
| Hy | 2.60 | 4.5 | 4.36 | 3.08 | 4.16 | 3.69 | 1.15 | 6.91 | 1.85 | 8.03 | 1.05 | 5.27 | 0.77 | 5.40 |
| Ilm | 0.09 | 0.49 | 0.15 | 0.38 | 0.00 | 0.00 | 0.51 | 0.68 | 0.51 | 0.72 | 0.53 | 0.66 | 0.44 | 0.74 |
В отличие от системы амфибол–H2O–HCl, при взаимодействии амфиболита, состоящего из амфибола и плагиоклаза, с растворами H2O–HCl наблюдается частичное инконгруэнтное плавление породы (рис. 3а–3б). Полученные результаты согласуются с данными (Poli, 1993; Жариков 1995), согласно которым в условиях избытка флюидной фазы плавление амфиболита отвечает параметрам водонасыщенного солидуса базальтовых систем: 650–700°С при P = 5–7 кбар. Образующийся при частичном плавлении амфиболита расплав Gl2 может формироваться по краям минералов, по плоскостям спайности и трещинам, в виде включений. Кроме того, расплав Gl2 может коагулироваться, образуя сферические формы из-за того, что две жидкости (расплав и флюид) не смачиваются (Newton, Manning, 2008). Также как и в системе амфибол–H2O–HCl, взаимодействие амфиболита с аналогичными растворами приводит к частичному растворению породы и осаждению растворенных веществ из флюидной фазы при закалке с формированием закалочных стекол Gl1.
Визуально Gl1 и сферические форы Gl2 не различаются. Однако Gl1 обычно отмечаются в виде очень мелких, не превышающих первые десятки мкм, сферул, в то время как размеры сферул Gl2 могут превышать сотни мкм (рис. 3а).
Составы закалочных фаз Gl1 и Gl2 в системе амфиболит–H2O–HCl
По данным (Shmulovich et al., 2001; Ходоревская, Аранович, 2016 и др.) вещество, осажденное из флюидной фазы Gl1, отличается от закаленного расплава Gl2 более высокими содержаниями SiO2 и К2О и наиболее низкими – Al2O3, СаО и Na2О. Поэтому определение химических составов сферических форм, наблюдаемых в опытах, является, пожалуй, единственным критерием разграничения закалочного флюида Gl1 и закаленного расплава Gl2 (табл. 3).
Как видно из данных табл. 3, составы Gl1 и Gl2 характеризуются отсутствием хлора, т.е. хлор практически не входит в закалочные фазы, остается во флюиде (Zhu and Sverjensky 1991; Чевычелов, 2013). Составы Gl1 характеризуются большим содержанием SiO2, чем составы Gl2. Содержание Al2O3, СаО, FeO, MgO, Na2O, т.е. фактически всех петрогенных элементов в Gl1 ниже, чем в Gl2.
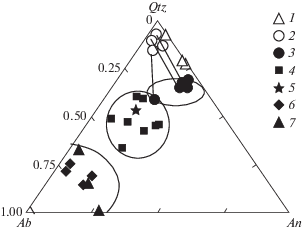
Пересчет по методу CIPW показывает, что составы закалочного флюида (полые кружки на рис. 6) характеризуются высоким содержанием Qtz и незначительной Ab (и Ort) составляющей. Соотношение Qtz/An в Gl2 будет определяться в основном составом исходной породы, в то время как соотношение Ab/An определяется кислотностью флюида. При низкой кислотности (опыт W-3, D-2) соотношение Qtz–Ab–An в Gl2 (1 на рис. 6) попадает в поле составов расплавов, образующихся при частичном плавлении метабазитов в присутствии H2O (Helz, 1976; Beard, Lofgren, 1991) и H2O–CO2 флюида (Safonov et al., 2014). С увеличением кислотности флюида составы расплавов смещаются к линии Qtz-An. В целом, как видно на рис. 6, по соотношению Qtz–Ab–An составы Gl2, полученные при высокой кислотности флюида отличаются от расплавов, полученных при частичном плавлении метабазитов в присутствии H2O и H2O–CO2 флюида при сходных параметрах. Еще большие различия в составах расплавов наблюдаются при взаимодействии метабазитов с растворами H2O–NaCl (Ходоревская, Варламов, 2016) и растворами H2O–NaCl–CO2 (Safonov et al., 2014). Поэтому можно утверждать, что составы парциальных расплавов, образующихся при плавлении метабазитов в присутствии сильно кислых растворов HCl, не являются характерными для природных магматических комплексов. В то же время флюидная фаза с высоким содержанием SiO2 может вызывать образование кварцевых жил, иногда наблюдаемых в метабазитах (Frantz et al., 2001). Кроме того, различия в составах, наблюдаемых плагиогранитных образований, например, окварцованных мигматитов в метаамфиболитах, могут возникать при кристаллизации расплава и осаждении вещества из сосуществующего флюида при дальнейшем охлаждении, а не только разновозрастным частичным плавлением или плавлением варьирующих по составу пород.
Рис. 6.
Составы закалочных фаз в координатах Ab-Qtz-An. 1 – закалочный Gl1 в системе Hbl–H2O–HCl, 650–750°C; 2–3 – соответственно Gl1 и Gl2, образующиеся при частичном плавлении амфиболита, 800°С; 4–5 – данные по составам расплавов Gl2, образующихся при частичном плавлении метабазитов в присутствии H2O (Helz, 1976; Beard, Lofgren, 1991) (4) и H2O–CO2 флюида (Safonov et al., 2014) (5) при сходных параметрах; 6–7 – расплавы Gl2, образующиеся при взаимодействии метабазитов с растворами H2O–NaCl (Ходоревская, Варламов, 2016) (6) и растворами H2O–NaCl–CO2 (Safonov et al., 2014) (7).
Реакции в системе амфибол–флюид (H2O–HCl)
Результаты опытов показывают, что начальная стадия воздействия кислотных флюидов на амфиболы сопряжена с выносом в раствор Si, Al и в меньшей степени Ca, которые в основном переосаждаются при закалке в виде стекла Gl1, частично остаются в растворе. Щелочи также выносятся из амфибола, однако не переосаждаются в новообразованных фазах, а наряду с Cl остаются в растворе. Новые фазы (Chl, oAmph, Crd) образуются за счет перераспределения Са, Fe и Mg из амфибола, в раствор Mg и Fe выносятся слабо (табл. 2). Упрощенные реакции образования новых фаз могут быть представлены в следующем виде:
(1)
$\begin{gathered} 5TSch + 18{\text{HCl}}^\circ \to \\ \to 3Chl + An + 6{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 9{\text{CaCl}}_{2}^{^\circ } + 19{\text{Si}}{{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Приняты следующие составы минералов: Tsch – Ca2Mg3Al4Si6O22(OH)2; Chl –Mg5Al[AlSi3O10][OH]8; Ged – Mg5Al4Si6O22(OH)2; Crd – Mg2Al4Si5O18.
В уравнениях (1)–(4) предполагалось, что основная часть частиц Ca и Mg, а также HCl существует в недиссоциированном виде ${\text{CaCl}}_{2}^{^\circ }$, ${\text{MgCl}}_{2}^{^\circ },$ HCl° (Frantz, Popp, 1979, a, b).
С увеличением fHCl анортит в продуктах опыта не отмечается, реакция записывается следующим образом:
(2)
$\begin{gathered} 5TSch + 20{\text{HCl}}^\circ \to \\ \to 3Chl + 7{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 10{\text{CaCl}}_{2}^{^\circ } + 21{\text{Si}}{{{\text{O}}}_{2}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $При дальнейшем увеличении кислотности исходных растворов наряду с образованием хлорита происходит еще и образование ортоамфибола с выносом FeO, MgO. Упрощенная реакция может быть записана как
(3)
$\begin{gathered} nTsch + (10n - 10){\text{HCl}}^\circ \to \\ \to Ged + (3n - 5)({\text{Fe}},{\text{Mg}}){\text{Cl}}_{2}^{^\circ } + 2n{\text{CaCl}}_{2}^{^\circ } + \\ + \,\,(2n - 2){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + (6n - 6){\text{Si}}{{{\text{O}}}_{2}} + (6n - 6){{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(В случаях, если n ≤ 1, реакция представляемая, как Tsch +2(Fe,Mg)${\text{Cl}}_{2}^{^\circ }$ → Ged + $2{\text{CaCl}}_{2}^{^\circ }$ не отражает взаимодействие Tsch с HCl).
Уравнения (1)–(3) характеризуют реакции, наблюдаемые в экспериментах при 650°С. С увеличением Т до 750°С в результате взаимодействия амфибола с растворами HCl ≥ 1 m в продуктах опытах появлялся еще и кордиерит, реакция образования которого может быть записана следующим образом:
(4)
$\begin{gathered} nTsch + (10n - 4){\text{HCl}}^\circ \to Crd + 2n{\text{CaCl}}_{2}^{^\circ } + \\ + \,\,(3n - 2)({\text{Fe}},{\text{Mg}}){\text{Cl}}_{2}^{^\circ } + (2n - 2){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + \\ + \,\,(6n - 5){\text{Si}}{{{\text{O}}}_{2}} + (6n - 2){{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $По данным экспериментов (опыты P-1, P-2 в табл. 1, уравнение (1)) хлорит образуется в продуктах опытов, проведенных при низкой XHCl в составе флюида. Появление этого минерала является практически обязательным при всех высокотемпературных метасоматических преобразованиях метабазитов. Перераспределение Mg из амфиболов в хлорит способствует накоплению в растворах Ca (уравнения (1)–(2)), при более высокой кислотности в растворы переходят Fe и Mg (уравнения (3)–(4)). Однако Mg во флюидную фазу выносится в меньшей степени, чем Fe, в основном накапливается в новообразованных Mg-содержащих фазах, таких как хлорит, ортоамфиболы, кордиерит. Таким образом, флюиды с повышенной кислотностью характеризуются преобладающим содержанием Ca и Fe наряду с остальными петрогенными элементами. Флюиды подобного состава впоследствии могут участвовать в образовании метасоматитов. В породах основного состава метасоматиты обычно представлены меланократовыми жилами Hbl-, Grt–Cpx–Opx–Hbl-, Hbl–Cpx–Pl–Bt-, Hbl–Grt–Pl-, Cpx–Grt–Pl–Mag- состава, которые носят название базификаты (Судовиков, 1964; Беляев, Рудник, 1980 и др.) Минералы подобных пород отличаются повышенной железистостью и повышенным содержанием Ca (например, повышенное содержание гроссуляра в гранатах, образование цоизититов) по сравнению с вмещающими породами.
Таким образом, на основании проведенных экспериментов можно утверждать, что формирование базификатов может быть связано с воздействием подкисленного флюида на метаморфизованные породы основного состава, например, на амфиболиты.
Рассмотренные реакции 1–4 идут с поглощением большого количества HCl, а значит – к нейтрализации растворов. Падение кислотности растворов приводит к уменьшению растворимости минералов и, как следствие, уменьшению степени выноса компонентов из амфиболов/амфиболитов. Видимо поэтому масштабы проявления Fe–Ca–Mg метасоматоза в природных условиях, как правило, не имеют площадного распространения, а локализуются в относительно малых объемах.
Оценки fHCl во флюиде
Летучесть HCl° связана с ее мольной долей в гидротермальном флюиде следующим уравнением:
(5)
${{f}_{{{\text{HCl}}}}} = {{X}_{{{\text{HCl}}}}}\gamma _{{{\text{HCl}}^\circ }}^{*}{{P}_{{{\text{общ}}}}}.$Подобное же выражение отражает связь между летучетью H2O и ее мольной долей в смеси:
(6)
${{f}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = {{X}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}\gamma _{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}^\circ }}^{*}{{P}_{{{\text{общ}}}}},$При расчетах fHCl определенную трудность составляет оценка XHCl во время опытов. Допущение, что значительный избыток раствора по сравнению с навеской амфибола/амфиболита практически не приводит к изменению задаваемой XHCl, справедливо только для опытов, в которых исходная концентрация HCl > 1m. В таких опытах pH исходного раствора ≈pH закалочного раствора (табл. 1). Однако в опытах при mHCl ≤ 1m pH закалочного раствора за время опытов изменялся от кислого до слабо кислого (табл. 1). Поэтому для таких опытов допущение равенства XHCl до и после опытов при расчетах fHCl (уравнения (5)–(6)) было бы не корректным. В таких случаях расчеты XHCl проводились на основании уравнений баланса.
В чермаките, используемом в опытах, содержится 1.8 атома Ca и 0.6 атомов Na + K (см. выше). Вынос Ca и щелочей в раствор можно представить в упрощенном виде, как
(7)
${\text{C}}{{{\text{a}}}^{{2 + }}} + 1/2{{{\text{O}}}_{2}} + 2{\text{HCl}}^\circ \to {\text{CaCl}}_{2}^{^\circ } + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(8)
$2{\text{N}}{{{\text{a}}}^{ + }} + 1/2{{{\text{O}}}_{2}} + 2{\text{HCl}}^\circ \to 2{\text{NaCl}}^\circ + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Содержание Ca, Na (мкг/г) в растворах после опытов было известно (табл. 2), поэтому несложно оценить XHCl, участвующее в реакциях 7–8, следовательно, и fHCl в опытах. При расчетах XHCl допускалось, что объем раствора до и после опыта был одинаков; основная часть частиц Ca и Na, а также HCl существует в недиссоциированном ${\text{CaCl}}_{2}^{^\circ }$, NaCl°, HCl°; значения концентраций Ca в растворе при расчетах принимались согласно корреляционной прямой y = 1433 + 10 545x (рис. 4).
На рис. 7 показано соотношение lg fHCl–T, создаваемое в наших экспериментах. Пунктирной линией отделены ассоциации с плагиоклазом (Hbl + Pl + Melt + ox.Fe) и без него (Crn + Qtz ± ± oAmph + Chl ± Crd). Оконтуренные поля представляют значения fHCl во флюидах, отделяющихся на позднемагматической стадии кристаллизации сиенитов (S), чарнокитов (TC) интрузий и вмещающих метапелитов (M) по данным (Markl, Piazolo, 1998). Как видно на рис. 7, значения fHCl во флюидах природных объектов попадают, в основном, в поле устойчивости Ca-плагиоклаза. Иными словами, при Т = 650–830°С значения fHCl во флюидах, вызывающих метасоматоз, скорее всего отвечают значениям <300–350 бар, более высокие значения fHCl, вероятно, реализуются в природных условиях в исключительных случаях или не реализуются вовсе.
Рис. 7.
Соотношение lg fHCl – температура для различных природных комплексов. 1–2 – данные наших экспериментов: 1 – стабильны Ca-амфиболы; 2 – стабильны Crn + Qtz + (Jd–Chl–Crd) ассоциации. По данным (Markl, Piazolo, 1998) оконтурены и обозначены буквами поля составов флюидов, в ассоциациях с сиенитом (S), чарнокитом (TC), метапелитом (M).
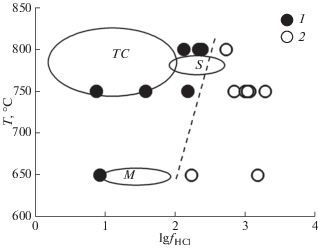
Таким образом, оценки fHCl < 300–350 бар, полученные в наших исследованиях, подтверждают предположение (Markl, Piazolo, 1998) о том, что вариации фугитивности HCl как в типичных магматических, так и в высокоградных метаморфических флюидах не сильно отличаются и ограничиваются первыми сотнями бар.
СОПОСТАВЛЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТОВ С ПРИРОДНЫМИ НАБЛЮДЕНИЯМИ
В исследованиях (Ходоревская, Варламов, 2018) было показано, что в СЗ части перидотит-габбро-анортозитового массива (о. Кий, Онежская губа, Белое море) проявлен обширный метасоматоз, выражающийся в чередовании мощных метасоматических меланократовых жил среди вмещающих амфиболитов. Жилы представлены чередующимися гранатитами и горнблендитами, единичными прослоями анортозитов (Ходоревская, Варламов, 2018, рис. 6а). Встречаются жилки цоизититов, отмечены две небольшие линзы фисташково-зеленого цвета амфибол-цоизитовых пород. Минералы меланократовых жил, такие как гранат и амфибол, отличаются повышенным содержанием Fe по сравнению с вмещающими породами. В амфибол-цоизитовых породах изредка отмечаются рубиноподобные корунды (вплоть до ювелирных разностей) размером 2 × 2 × 0.4 см. Формирование метасоматитов на о-ве Кий проходило на пике свекофеннского метаморфизма и начале ретроградной стадии при Т ≈ 700–630°С, P ≈ 10–8 кбар. Флюид, вызвавший метасоматоз, характеризовался существенно водным, слегка подкисленным (за счет вероятного присутствия Cl и CO2) составом при незначительном содержании солевой составляющей (Na,K)Cl. Об этом свидетельствует отсутствие в породах кислого плагиоклаза и чермакитовый, а не паргаситовый состав амфибола.
Результаты экспериментов, представленные в настоящей работе, показали, что действительно взаимодействие амфибола/амфиболита с растворами HCl (концентрация HCl = 0–2 моль/кг H2O) может приводить к образованию корунда. Однако для того, чтобы образовался корунд, требуется обогащение исходной навески Al2O3. Это достигается путем значительного выноса элементов из амфибола/амфиболита в раствор (Ca > 6000 ppm, Fe > 1600, Mg > 500, Na > 1500 ppm). Подобный вынос элементов может реализоваться либо при высокой fHCl (>200–300 бар при 650–750°С) в условиях закрытой системы, либо при относительно низкой fHCl (реакция 1), но при условии длительной фильтрации флюида через породу (открытая система). В отличие от экспериментов, проводимых в условиях закрытой системы, расслоенный габбро-анортозитовый массив о-ва Кий, представляет собой открытую систему. Локальные линзы с корундом в амфиболитах острова свидетельствуют о том, что значительный вынос Ca, Mg, Fe обеспечивал создание высокоглиноземистой матрицы в локальных участках и формирование в них корунда. Результаты экспериментов показали, что индикатором варьирующей кислотности флюида являются такие минералы, как анортит (реакция 1), либо ортоамфибол, жедрит, кордиерит (реакция 2). На о-ве Кий жедрит и кордиерит не отмечались. Однако в метасоматических меланократовых жилах изредка наблюдались анортозиты в виде тонких (2–7 см) лейкократовых прослоев (Ходоревская, Варламов, 2018, рис. 6а). Происхождение подобных анортозитовых прослоев было не вполне понятно. Допускалось, что это сохранившиеся первично магматические лейкократовые прослои перидотит-габбро-анортозитового массива о-ва Кий (Терехов, 2003). Результаты экспериментов, в частности появление в продуктах опытов анортита, позволяют считать, что вынос Ca из вмещающих метабазитов и его переотложение приводили к формированию анортозитовых прослоев в метасоматических меланократовых жилах. Справедливость этого утверждения доказывается пространственным положением данных прослоев именно среди метасоматических меланократовых жил. Можно полагать, что рассматриваемые метасоматические преобразования были вызваны инфильтрацией через метабазиты флюида с невысокой fHCl < 150–200 бар.
С другой стороны, на о-ве Кий отмечаются выдержанные горизонты окварцованных мигматитов или кварцитов мощностью от первых см до первых м. Простирание пластов кварцитов соответствует общей СЗ ориентировке тектонических элементов в этом районе (Терехов, 2003). Автор указывает, что наблюдаются постепенные переходы от мигматитов, развитых в некоторых местах по амфиболитам, к кварцитам, что указывает на не осадочную природу кварцитов. Как показали наши эксперименты, обязательным следствием взаимодействия амфибола/амфиболита с растворами HCl является не только формирование корунда, но и переотложение SiO2 (рис. 1б, 1в, 4в, 5в, уравнения 1–4). В природных условиях это, очевидно, проявляется в образовании существенно кремнистых пород в амфиболитах. Например, это могут быть кварцевые жилы, кварциты, окварцованные мигматиты.
Таким образом, представляемые экспериментальные данные дополнили полученные данные полевых исследований свекофеннского метасоматоза, проявленного на о-ве Кий. Установлено, что образование мощных меланократовых жил горнблендитов и гранатитов с тонкими анортозитовыми прослоями, а также цоизит-амиболовых пород с корундом, кварцитом объясняется высокотемпературным метасоматозом вмещающих метабазитов о-ва Кий. Первичная магматическая расслоенность массива обеспечивала мощные метасоматические изменения. Состав флюида, вызвавшего подобный метасоматоз, характеризовался вариациями кислотности флюида и отсутствием в нем хлоридов щелочей.
ВЫВОДЫ
1. При взаимодействии амфибола/амфиболита с разбавленными растворами HCl при 650–800°С, 5–7 кбар образуется равновесная ассоциация Hbl + An + Chl ± Qtz ± Ap. Увеличение концентрации HCl (>0.3 m) приводит к растворению анортита и полному переходу Ca и щелочей в раствор; Fe и Mg перераспределяются между новообразованными хлоритом, кордиеритом, ортоамфиболом и раствором. Концентрации Fe в растворе выше, чем Mg, поэтому новообразованные темноцветные минералы отличаются низкой железистостью. Al и Si слабо выносятся во флюидную фазу, а формируют алюмосиликатную матрицу, в которой обособляются кристаллы корунда и кварца.
2. Стабильность An-Hbl ассоциаций в интервале Т = 650–800°С, (Р = 5–7 кбар) ограничивается значениями fHCl < 400 бар; при более высоких fHClHbl замещается Ged + Chl или Crd. Таким образом, такие минералы, как ортоамфибол, жедрит, кордиерит в метасоматитах по метабазитам являются индикаторами высококислотных флюидов.
3. Составы закалочного флюида отличаются от составов расплавов, полученных при частичном плавлении метабазитов с варьирующей флюидной фазой (от NaCl–H2O – до H2O–HCl), более высоким содержанием SiO2.
4. Результаты экспериментов подтвердили, что на о-ве Кий (Белое море) взаимодействие метабазитов с подкисленными водными флюидами на пике свекофеннского метасоматоза приводит к выносу Ca, Fe и в меньшей степени Mg и накоплению в локальных участках пород Al2O3 и SiO2. Это создает благоприятные предпосылки для формирования корунда с одной стороны и образование высококремнистых пород с другой. Максимальная fHСl во флюидах, вызвавших метасоматоз, отвечала значениям ≈50–200 бар при параметрах Т = 650–800°С, Р = 5–7 кбар.
Автор глубоко признательна О.Г. Сафонову (ИЭМ РАН), Л.Я. Арановичу (ИГЕМ РАН) и анонимному рецензенту журнала “Геохимия” за конструктивные научные замечания и полезные советы. Большое спасибо В.К. Карандашеву (ИПТ-М РАН) за четкую и качественную организацию проведения химических анализов растворов.
Исследование выполнено в рамках темы АААА-А18-118020590148-3 государственного задания ИЭМ РАН на 2019–2021 гг.
Список литературы
Азимов П.Я., Бушмин С.А. (2007) Растворимость минералов метаморфических и метасоматических пород в гидротермальных растворах разной кислотности: термодинамическое моделирование при 400–800°C и 1–5 кбар. Геохимия (12), 1305-1330.
Azimov P.Ya., Bushmin S.A. (2007) Solubility of minerals of metamorphic and metasomatic rocks in hydrothermal solutions of varying acidity: thermodynamic modeling at 400–800°C and 1–5 kbar, Geochem. Int. 45(12), 1210-1234.
Беляев Г.М., Рудник В.А. (1980) О типах железо_магнезиально-кальциего метасоматоза в связи с гранитообразованием (на примере Алданского щита). Железо-магнезиальный метасоматизм и рудообразование. М.: Наука, 13-28.
Вольф М.Б., Уайли П.Дж. (1993) Некоторые результаты экспериментального исследования дегидратационного плавления амфиболита при 10 кбар. Геология и геофизика 34(12), 100-115.
Жариков В.А. (1995) Реакции дегидратации и плавления при различном термодинамическом режиме воды. Петрология 3(4), 340-348.
Коржинский М.А. Апатитовый твердый раствор как индикатор летучести НСl и НF в гидротермальном флюиде (1981) Геохимия (5), 689-706.
Кориковский С.П., Ходоревская Л.И. (2006) Гранитизация палеопротерозойских высокобарических метагаббро-норитов в беломорской серии Балтийского щита (район Кандалакшского залива, о. Горелый). Петрология 14(5), 453-481.
Кориковский С.П., Аранович Л.Я. (2010) Чарнокитизация и эндербитизация основных гранулитов Лапландского гранулитового пояса (южная часть Кольского полуострова, район Порьей губы): I. Петрология и термобарометрия. Петрология 18(4), 340-368.
Мельник Ю.П. (1978) Термодинамические свойства газов в условиях глубинного петрогенезиса. Киев: Наукова думка, 153 с.
Пуртов В.К. (1998) Экспериментальное исследование процессов высокотемпературного метасоматоза пород базальтового состава и генерации кислых расплавов в хлоридных растворах. Автореф. дисс. докт. геол.-мин. наук. ИГиГ УО РАН. Екатеринбург, 40 стр.
Пуртов В.К., Ятлук Г.М. (1982) Экспериментальные исследования процессов мобилизации петрогенных компонентов в гидротермальных системах. Препринт. УНЦ АН СССР, 61 с.
Рябчиков И.Д. (1975) Термодинамика флюдной фазы гранитоидных магм. М.: Наука, 232 с.
Сафонов О.Г. (1998) Роль щелочей в образовании коронарных структур в метамангеритах и метаанортозитах комплекса Адирондак (США). Петрология, 6(6), 646-666.
Сотников В.И., Берзина А.Н. (1993) Режим хлора и фтора в медно-молибденовых рудно-магматических системах. Новосибирск, 132 с.
Судовиков Н.Г. Региональный метаморфизм и некоторые проблемы петрологии (1964) Л.: Изд-во ЛГУ, 550 с.
Терехов Е.Н. (2003) Геологическое строение Лапландско-Беломорского комплекса и роль процессов растяжения в его эволюции. Дис. докт. геол.-мин. наук. Москва: ГИН РАН, 361 с.
Хитаров Н.И., Рыженко Б.Н. (1963) К оценке pH гидротермальных растворов. Геохимия (12), 112-114.
Ходоревская Л.И., Кориковский С.П. (2007) Метасоматические гранат-клинопироксен-ортопироксен-роговообманковые жилы в метаанортозитах Колвицкого массива, Кольский полуостров: минеральный состав и связь с сингранулитовой гранитизацией. ДАН, 415(4), 539-543.
Ходоревская Л.И. (2010) Минеральный состав и РТ условия образования Ca–Mg–Fe метасоматитов в основных гранулитах (Порья губа, Беломорье): доказательства сингенетичности процессов гранитизации и базификации. ДАН 432(3), 392-395.
Ходоревская Л.И., Аранович Л.Я. (2016) Экспериментальное исследование взаимодействия амфибола с флюидом H2O–NaCl при 900°С, 5 кбар: к процессам плавления и массопереноса в гранулитовой фации. Петрология 24(3), 235-254.
Ходоревская Л.И., Варламов Д.А. (2018) Высокотемпературный метасоматоз в Кийостровском базит-ультрабазитовом расслоенном массиве Беломорского подвижного пояса. Геохимия (6), 541-558.
Khodorevskaya L.I., Varlamov D.A. (2018) High-Temperature Metasomatism of the Layered Mafic–Ultramafic Massif in Kiy Island, Belomorian Mobile Belt. Geochem. Int. 56(6), 535-553.
Ходоревская Л.И., Варламов Д.А. (2016) Флюиды N-aCl-KCl в высокотемпературном метасоматозе основных пород (экспериментальные данные). Современные проблемы теоретической, экспериментальной и прикладной минералогии (Юшкинские чтения – 2016) Мат-лы минералогического семинара с международным участием (Сыктывкар, 17–20 мая 2016 г.) Сыктывкар: ИГ Коми НЦ УрО РАН, 205-206.
Чевычелов В.Ю. (2013) Распределение летучих, породообразующих и рудных компонентов в магматических системах: экспериментальные исследования. Дис. докт. геол.-мин. наук. М.: МГУ, 62 с.
Allen J.C., Boettcher A.L. (1983) The stability of amphibole in andesite and basalt at high pressures. Am. Mineral. 68(3-4), 307.
Allen J.C., Boettcher A.L., Marland G. (1975) Amphiboles in andesite and basalts: I. Stability as a function of P–T–${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$. Am. Mineral. 60(11–12), 1069.
Aranovich L.Y., Newton R.C., Manning C.E. (2013). Brine-assisted anatexis: exper-imental melting in the system haplogranite–H2O–NaCl–KCl at deep-crustal conditions. Earth Planet. Sci. Lett. 374, 111-120.
Aranovich L.Y., Safonov O.G. (2017) Halogens in High-Grade Metamorphism. Harlov D., Aranovich L.Y. (eds). The role of halogens in terrestrial and extraterrestrial geochemical processes. NY.: Springer. P. 713-757.
Beard J.S., Lofgren G.E. (1991) Dehydration melting and water-saturated melting of basaltic and andesitic greenstones and amphibolites at 1, 3 and 6.9 kb J. Petrol. 32(2), 365-402.
Budanov S.V., Shmulovich K.I. (2000) Experimental measurement of diopside solubility in H2O–NaCl fluids at 650°C and pressures of 2–7.5 kbar. Geochem. Int. 30 (SUPPL 2), 237.
Frank M.R., Candela P.A., Piccoli P.M. (2003) Alkali exchange equilibria between a silicate melt and coexisting magmatic volatile phase:An experimental study at 800°C and 100 MPa. Geochim. Cosmochim. Acta 67(7), 1415-1427.
Frantz J.D., Popp R.K. (1979a) Mineral-solution eyuilibria: (I) An experimental study of complexing and thermodynamic properties of aqueous MgCI2, in the system MgO–SiO2–H2O–HCI. Geochim. Cosmochim. Acta 43(8), 1223-1239.
Frantz J.D., Popp R.K. (1979b) Mineral solution equilibria-II. An experimental study of mineral solubilities and the thermodynamic properties of aqueous CaCI2 in the system H2O–HCI Geochim. Cosmochim. Acta 43(11), 1777-1790.
Franz L., Romer R.L., Klemd R., Schmid R. (2001) Eclogite-facies quartz veins within metabasites of the Dabie Shan (eastern China): pressure-temperature-time-deformation path, composition of the fluid phase and fluid flow during exhumation of high-pressure rocks. Contrib. Mineral. Petrol. 141(3), 322-346.
Hedenquist J.W., Lowenstern J.B., (1994). The role of magmas in the formation of hydrothermal ore deposits. Nature 370, 519-526.
Helz R.T. (1973) Phase relations of basalts in their melting ranges at P = 5 kb as a function of oxygen fugacity. Part I. Mafic phases. J. Petrol. 14(2), 249-302.
Helz R.T. (1976) Phase relations of basalts in their melting ranges at P = 5 kb. Part II. Melt compositions. J. Petrol. 17(2), 139-193.
Holland H.D. (1972) Granite, solutions, and base metal deposits. Econ. Geol. 67(3), 281-301.
Holloway J.R. The System Pargasite–H2O–CO2: A model for melting of a hydrous mineral with a mixed-volatile fluid.I. Experimental results to 8 kbar (1973) Geochim. Cosmochim. Acta 37(3), 651-666.
Holloway J.R., Ford C.E. Fluid-absent melting of the fluoro-hydroxy amphibole pargasite to 35 kilobars (1975) Earth Planet. Sci. Lett. 25(1), 44-48.
Jenkins D.M., Clare A.K. Comparison of the high-temperature and high-pressure stability limits of synthetic and natural tremolite (1990) Am. Mineral. 75, 358-366.
Kestin J., Sengers J.V., Kamgar-Parsi B., Levelt Sen-gers J.M.H. (1984) Thermophysical Properties of fluid H2O. J. Phys. Chem. Ref. Data 13(1), 175-183.
Koritnig S. (1965) Geochemistry of phosphorus-I. The replacement of Si4+ by P5+ in rock-forming silicate minerals Geochim. Cosmochim. Acta 29(5), 361-371.
Leake B.E., Woolley A.R., Birch W.D. et al. (1997) Nomenclature of amphiboles. Report of the Subcommittee on Amphiboles of the International Mineralogical Association Commission on New Minerals and Mineral Names. Can. Miner. 35(1), 219-246.
Luce R.W., Cygan G.L., Hemley J.J., D’Angelo W.M. (1985) Some mineral stability relations in the system CaO–MgO–SiO2–H2O–HCl (1985) Geochim. Cosmochim. Acta 49(2), 525-538.
Manning C.E., Aranovich L.Y. (2014). Brines at high pressure and temperature: thermodynamic, petrologic and geochemical effects. Precambrian Res. 253, 6-16.
Markl G., Bucher K. Composition of fluids in the lower crust inferred from metamorphic salt in lower crustal rocks. Nature 391, 781-783.
Markl G., Piazolo S. (1998) Halogen-bearing minerals in syenites and high-grade marbles of Dronning Maud Land, Antarctica: monitors of fluid compositional changes during late-magmatic fluid-rock interaction processes. Contrib. Mineral. Petrol. 132(3), 246-268.
Merrill R.B., Robertson J.K., Wyllie P.J. (1970) Melting reactions in the system NaAISi3O8–KAISi3O8–SiO2–H2O to 20 kilobars compared with results for other feldspar-quartz-H2O and rock-H2O systems, J. Geology 78(5), 558-569.
Mora C.I., Valley J.W. (1989) Halogen–rich scapolite and biotite: implication for metamorphic fluid–rock interaction. Am. Mineral. 74(7–8), 721-737.
Morrison J. (1991) Compositional constraints on the incorporation of Cl into amphiboles. Am. Mineral. 76(11–12), 1920-1930.
Munoz J.L., Swenson A. (1981) Chloride–hydroxyl exchange in biotite and estimation of relative HCl/HF activities in hydrothermal fluids. Econ. Geol. 76(8), 2212-2221.
Munoz J.L. (1984) F–OH and Cl–OH exchange in micas with applications to hydrothermal deposits. Mineral. Soc. Amer. Rev. Mineral. 13, 460-544.
Newton R.C., Manning C.E. (2008) Solubility of corundum in the system Al2O3–SiO2–H2O–NaCl at 800°C and 10 kbar Chem. Geol. 249(3–4), 250–261.
Nijland T.G., Jansen J.B., Maijer C. (1993) Halogen geochemistry of fluid during amphibolite–granulite metamorphism as indicated by apatite and hydrous silicates in basic rocks from the Bamble sector, South Norway. Lithos. 30(2), 167-189.
Poli S. (1993) The amphibolite-eclogite transformation: An experimental study on basalt Amer. J. Sci. 293(10), 1061-1107.
Rapp R.P. (1995) Amphibole-out phase boundary in partially melted metabasalt, its control over liquid fraction and composition, and source permeability. J. Geophys. Res. B8 100 (10), 15601–15610.
Safonov O.G., Kosova S.A., Van Reenen D. D (2014). Interaction of Biotite – Amphibole Gneiss with H2O–CO2–(K, Na)Cl Fluids at 550 MPa and 750 and 800°C: Experimental Study and Applications to Dehydration and Partial Melting in the Middle Crust. J. Petrol. 55(12), 2419-2456.
Shmulovich K.I., Graham G., Yardley B.W.D. (2001) Quartz, albite and diopside solubilities in H2O–NaCl and H2O–CO2 fluids at 0.5–0.9 GPa. Contrib. Mineral. Petrol. 141(1), 95-108.
Simon A.C., Pettke T., Candela P.A., Piccoli P.M., Heinrich C.A. (2004) Magnetite solubility and iron transport in magmatic-hydrothermal environments. Geochim. Cosmochim. Acta 68(23), 4905-4914.
Sisson V.B. (1987) Halogen chemistry as an indicator of metamorphic fluid interaction with the Ponder Pluton, Coast Plutonic Complex, British Columbia, Canada. Contrib. Mineral. Petrol. 95(1), 123-131.
Valley J.W., Essene E.J. (1980) Calc-silicate reactions in Adirondack marbles: The role of fluids and solid solutions. Geol. Soc. Amer. Bul. Part II. 91, 720-815.
Valley J.W., Bohlen S.R., Essene E.J., Lamb W. (1990) Metamorphism in the Adirondacks: II. The Role of Fluid. J. Petrol. 31(3), Part 3, 555-596.
Volfinger M., Robert J.L, Vielzeuf D., Neiva A.M.R. (1985) Structural control of the chlorine content of OH-bearing silicates (micas and amphiboles). Geochim. Cosmochim. Acta 49(1), 37-48.
White A.F., Classen H.C. (1980) Kinetic model for the short-term dissolution of a rhyolite glass. Chem. Geol. 28, 91-109.
Williams T.J., Candela P.A., Piccoli P.M. (1995) The partitioning of copper between silicate melts and two-phase aqueous fluids: An experimental investigation at 1 kbar, 800°C and 0.5 kbar, 850°C. Contrib. Mineral. Petrol. 121(4), 388-399.
Zhu C., Sverjensky D.A. (1992) F–Cl–OH partitioning between biotite and apatite. Geochim. Cosmochim. Acta 56(9), 3435-3467.
Дополнительные материалы отсутствуют.


