Геохимия, 2020, T. 65, № 8, стр. 823-832
Геохимическая экология мелких млекопитающих в условиях промышленного загрязнения среды: есть ли эффект от снижения выбросов?
В. С. Безель a, *, С. В. Мухачева a, **
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: bezel@ipae.uran.ru
** E-mail: msv@ipae.uran.ru
Поступила в редакцию 11.01.2019
После доработки 13.06.2019
Принята к публикации 23.06.2019
Аннотация
Рассмотрено участие локальных популяций рыжей полевки (Clethrionomys glareolus) в биогеохимических циклах Cu, Zn, Cd и Pb в условиях сильного химического загрязнения среды (1990–1992 гг.) крупным предприятием цветной металлургии (Средний Урал) и после существенноыо сокращения объема промышленных выбросов (2015–2017 гг.). Установлено, что на максимально загрязненных участках (импактная зона) к концу периода исследований контролируемые животными транзитные потоки Cu, Cd, Pb приблизились к фоновым значениям, Zn – 2-кратно снизился в сравнении с незагрязненной территорией. На участках с умеренным уровнем загрязнения (буферная зона) существенных изменений величины потока металлов не зарегистрировано ни для одного из элементов. Своеобразие транзитных потоков изученных элементов на участках с разным уровнем загрязнения определяется их содержанием в корме и численностью животных. При этом многократное (в 50 раз) сокращение выбросов не привело к эквивалентному снижению концентраций металлов в рационах животных на загрязненных территориях. Основной причиной изменений явилась перестройка в структуре сообщества мелких млекопитающих, повлекшая резкое снижение численности рыжей полевки в импактной зоне. В результате совместного влияния рассмотренных факторов за 25-летний период исследований отмечена интенсификация (фоновая зона), замедление (импактная зона), либо стабилизация (буферная зона) биогеохимического обмена элементов.
ВВЕДЕНИЕ
В связи с наметившейся тенденцией повсеместного снижения объемов промышленных выбросов вследствие совершенствования технологий, либо прекращения работы предприятий, в последнее десятилетие отмечается повышенное внимание к проблеме восстановления качества антропогенно нарушенных территорий (Воробейчик и др., 2014; Калабин, Моисеенко, 2011; Копцик и др., 2016, Лянгузова, Мазная, 2012; Мухачева, 2017; Черненькова, Бочкарев, 2013; Camizuli et al., 2018; Juknys et al., 2003). Вблизи точечных источников эмиссии многие загрязнители, в том числе тяжелые металлы, сохраняются в экосистемах длительное время (Воробейчик, Кайгородова, 2017; Douay et al., 2009; Kabala et al., 2008). При отсутствии специальных реабилитационных мероприятий они продолжают циркулировать в пищевых цепях (Gall et al., 2015), оказывая негативное воздействие на биоту (Мухачева, Безель, 2015; Berglund et al., 2011; Kozlov, Zvereva, 2011).
На сегодняшний день нет единого мнения о скорости и интенсивности процессов естественной реабилитации территорий, нарушенных вследствие деятельности человека. Одни авторы считают, что вслед за снижением техногенных выбросов произойдет быстрое восстановление экосистем до их исходного состояния (Черненькова, Бочкарев, 2013; Berglund et al., 2012; Juknys et al., 2003). Другие, напротив, полагают, что на реабилитацию потребуется значительное время, даже после полного прекращения выбросов (Воробейчик и др., 2014; Лянгузова, Мазная, 2012; Мухачева, 2017; Berglund et al., 2011; Camizuli et al., 2018). По мнению ряда авторов, подвергнувшаяся воздействию загрязнения экосистема, после снижения токсичного загрязнения не возвращается к исходному состоянию, а модифицируется, приобретая новые свойства устойчивости (Моисеенко, 2011). Сложность трактовки наблюдаемых изменений связана с необходимостью однозначного определения их причин. Обусловлены ли они только снижением объемов выбросов, либо действием иных факторов, в том числе антропогенных, прямо не связанных с токсическим воздействием на животных?
Долговременные исследования динамических изменений разных компонентов биоты, выполненные в окрестностях Среднеуральского медеплавильного завода (СУМЗ) на одних и тех же участках в сходные сроки, показали, что даже после многократного сокращения объемов промышленных выбросов в непосредственной близости от источника эмиссии продолжается гибель древостоя, отсутствуют восстановительные процессы в травяно-кустарничковом ярусе (Воробейчик и др., 2014), структуре сообществ почвенных беспозвоночных (Воробейчик и др., 2012), мышевидных грызунов и мелких насекомоядных млекопитающих (Воробейчик, Нестеркова, 2015; Мухачева, 2016). Угнетенное состояние лесных экосистем авторы связывают с крайне медленным очищением верхних горизонтов почвы от тяжелых металлов, наличием мощного слоя лесной подстилки, а также подавленным состоянием процессов деструкции и последующей минерализации растительных остатков. В этих условиях особый интерес представляют работы, позволяющие исследовать механизмы и оценить интенсивность процессов естественного восстановления природных биогеценозов (БГЦ), в том числе, биогеоценотических циклов.
Участие в биогенном обмене животных включает в себя “животный опад” в виде отмирающих особей, транзитный поток (связанный с потреблением первичной продукции и выделением элементов с продуктами жизнедеятельности), а также роющую и гнездостроительную функции. В случае млекопитающих основные потоки химических элементов связаны в основном с их трофической деятельностью (Ермаков, Тютиков, 2008; Ермаков и др., 2018; Покаржевский, 1985).
Ранее мы оценили величину транзитного потока некоторых макро- и микроэлементов через популяции мелких млекопитающих (на примере рыжей полевки), обитающих в окрестностях СУМЗ на территориях с разным уровнем загрязнения. Было показано, что деформация биогенных потоков, контролируемых животными, обусловлена не только повышенным поступлением элементов с пищей, но, в значительной степени, зависит от уровня численности локальных популяций (Мухачева, Безель, 2004; Безель и др., 2007). Эти исследования были выполнены в период интенсивного загрязнения окружающей среды выбросми предприятия (90-е годы ХХ в.). За последующие 25 лет (особенно после завершения реконструкции в 2010 г.) валовые выбросы завода многократно (в 50 раз) сократились, при этом максимально снизились концентрации SO2, Cu, Zn и Pb. Изменился ли биогеохимический обмен этих элементов через популяции мелких млекопитающих (ММ) после существенного уменьшения объема промышленных выбросов?
Цель настоящей работы – оценить динамические изменения величины транзитного потока элементов (Cu, Zn, Cd, Pb) через популяции ММ, населяющие территории в окрестностях СУМЗ после существенного сокращения выбросов. Исследования проводили по единой методике на одних и тех же участках с интервалом в 25 лет (в 1990–92 гг. и 2015–2017 гг.). Предполагали, что постепенное восстановление компонентов биоты, начавшееся после снижения выбросов (Воробейчик и др., 2012, 2014, 2017), приведет к выравниванию количественных показателей транзитных потоков изученных элементов на сравниваемых территориях.
МЕТОДИКА
Источник эмиссии
Среднеуральский медеплавильный завод (СУМЗ), расположенный в 50 км к западу от г. Екатеринбурга (56°51′ N, 59°53′ E), – крупнейшее в России предприятие по первичной выплавке меди и производству серной кислоты – работает с 1940 г. В 1980-х годах его валовые выбросы (в основном SO2 и пыль с тяжелыми металлами и металлоидами) составляли 150–225 тыс. т/год, в 1990-х – 95–100 тыс. т/год, к середине 2000-х снизились до 30 тыс. т/год, а с 2010 г. (по окончании реконструкции) не превышают 2.5–5 тыс. т/год (Воробейчик и др., 2014). Таким образом, за последние 25 лет валовые выбросы предприятия уменьшились почти в 50 раз. Особенно сильно снизилось количество SO2 (в 80 раз), Cu (3000 раз), Zn (15 раз) и Pb (8.5 раз) (Воробейчик, Кайгородова, 2017). Условно годы наблюдений, использованные в работе, были отнесены к периодам стабильно высоких (1990–1992 гг., I период) и сильно сокращенных выбросов (2015–2017 гг., II период).
Экспериментальные животные
В качестве модельного объекта использовали рыжую полевку (Clethrionomys glareolus Schreber, 1780) – типичного обитателя лесов таежной зоны, на протяжении всего периода наблюдений занимающего доминирующее положение в составе сообществ ММ фоновых (около 75% численности населения) и загрязненных (более 50%) территорий. Рыжая полевка обладает высокой экологической пластичностью и характеризуется широким спектром кормовых объектов, среди которых основную массу составляют вегетативные части травянистых растений, семена, ягоды, грибы, мхи, лишайники, различные беспозвоночные, иногда – мелкие позвоночные животные (Европейская рыжая полевка, 1981; Hansson, 1985). Являясь преимущественно фитофагом, она выступает в роли биокатализатора, пропуская транзитом через желудочно-кишечный тракт потребляемую первичную продукцию, способствуя тем самым более полному и интенсивному включению в биогенный обмен разнообразных химических элементов.
Отлов животных
Проводили ежегодно в течение бесснежного периода (с мая по сентябрь) в три тура по единой схеме. Ловушки-плашки (по 25 шт. через 5–7 м, экспозиция – 4 суток с ежедневной однократной проверкой) располагали на стационарных линиях, заложенных в 1990 г. в западном направлении от завода (против господствующего направления ветров) в елово-пихтовых лесах в импактной (в 1–2 км от источника эмиссии), буферной (в 4–5 км) и фоновой (в 20 км) зонах. Животных отлавливали на всех участках одновременно, располагая в каждой зоне от 3 до 9 линий (на удалении от 100 до 1000 м друг от друга). Отработано более 26 тыс. ловушко-суток (13.8 тыс. в I период, 12.3 тыс. – во II период), добыто 764 особи рыжей полевки, в том числе, 463 экз. – на фоновой территории, 301 – в окрестностях завода (416 экз. – в I период, 348 – во II период). У отловленных животных определяли пол, возраст и репродуктивный статус. По комплексу признаков выделяли 3 группы: перезимовавших особей, неполовозрелых и половозрелых сеголеток.
Оценка численности животных
В работе использованы данные по абсолютной численности животных (число особей/га), расчитанные по методике А.Д. Бернштейн с соавторами (1995). Для перевода относительных показателей (число особей/100 лов.-сут.) в абсолютные использовали предложенные авторами коэффициенты, которые корректировали в зависимости от уровня численности. Известно, что в зоне бореальных лесов умеренных широт рыжая полевка характеризуется выраженными циклическими колебаниями численности (Европейская рыжая полевка, 1981). Для нивелирования подобных различий, для каждого периода мы привлекали данные за 3 последовательных года, включавшие все фазы динамики численности (депрессию, рост, пик). Отлов животных в течение всего бесснежного периода (весна, лето, осень) позволил учесть сезонные изменения численности животных. В дальнейших расчетах использовали данные по всему бесснежному периоду, усредненные за 3 года (табл. 1).
Таблица 1.
Изменение плотности населения рыжей полевки (особей/га) и суточного потребления корма “условной” особью (г, сухой массы) в градиенте техногенного загрязнения
| Удаление от завода, км | Зона исследования |
Учетный период (годы) | |
|---|---|---|---|
| I (1990–1992 гг.) | II (2015–2017 гг.) | ||
| Абсолютная численность населения рыжей полевки, особей/га | |||
| 20 | Фоновая | 12.6 ± 3.6 | 17.9 ± 5.50 |
| 4–5 | Буферная | 8.0 ± 1.8 | 10.8 ± 3.80 |
| 1–2 | Импактная | 4.2 ± 0.5 | 2.7 ± 0.60 |
| Масса корма, потребляемого “условной” особью, г/сутки | |||
| 20 | Фоновая | 3.01 ± 0.05 | 2.96 ± 0.03 |
| 4–5 | Буферная | 2.96 ± 0.09 | 2.86 ± 0.02 |
| 1–2 | Импактная | 3.02 ± 0.05 | 2.89 ± 0.07 |
Суточное потребление корма
Согласно литературным сведениям интенсивность потребления корма зверьками разного пола, возраста и репродуктивного статуса в течение бесснежного периода существенно (до 30% и более) различается (Воронов, 1955; Кузнецов, Михайлин, 1985; Мухачева, 2005). Поэтому в работе использовали данные о суточном потреблении корма “условной” особью, рассчитанные на основе средневзвешенных значений (табл. 1), учитывающих демографическую структуру локальных популяций рыжей полевки в течение I и II периодов, размерно-весовые характеристики зверьков и количество поедаемого ими корма.
Химический анализ образцов
Для оценивания уровня накопления элементов (Cu, Zn, Cd, Рb) в кормовых объектах животных использовали содержимое желудка. При сложном составе и пластичности рациона, активном пространственном перемещении животных, мозаичности загрязнения, наиболее правильным, на наш взгляд, было определять концентрации элементов именно в содержимом желудка (Мухачева, 2005). Образцы отбирали чистым пластиковым шпателем индивидуально у каждой особи, помещали на предметные стекла, высушивали в сушильном шкафу при температуре 75°С до воздушно-сухой массы и упаковывали в герметичные пластиковые пакеты. Далее образцы гомогенизировали, взвешивали (около 0.1 г) на аналитических весах КERN-770 с ценой деления 0.00001 г, помещали в тефлоновые сосуды с 7 мл 65%-ной HNO3 (осч) и 1 мл деионизированной H2O, выдерживали в течение 30 мин. и затем озоляли в микроволновой печи МWS-2 (Berghof, Германия). После озоления объем пробы доводили до 10 мл деионизированной H2O. Концентрацию элементов (мкг/г сухой массы) определяли методом атомной абсорбции на спектрометре AAS 6 Vario (Analitik Jena, Германия) с использованием пламенного (Cu, Zn) и электротермического (Cd, Рb) вариантов атомизации в лаборатории экотоксикологии популяций и сообществ ИЭРиЖ УрО РАН, аккредитованной на техническую компетентность (аттестат аккредитации № РОСС RU000l.515630). Качество измерений оценивали по международному стандартному образцу СRМ 185R (бычья печень). Извлечение составило (в %): Cu – 93.2, Zn – 99.8, Cd – 114.2, Pb – 94.4; предел обнаружения (в мкг/мл): для Cu – 0.013, Zn – 0.005, Cd – 0.001, Pb – 0.013. В случае, когда концентрация элемента была ниже предела обнаружения, для статистического анализа использовали значение, равное половине предела обнаружения. Проанализировано 487 образцов содержимого желудков.
Расчет транзитного потока химических элементов
Для расчета транзитного потока элементов (мг/га сутки, в пересчете на сухую массу) через локальные популяции рыжей полевки (Pi) в пределах отдельного участка (i) использовали данные об абсолютной численности животных (Ni), концентрации соответствующего элемента в рационе (Сi) и количестве корма, потребляемого за сутки “условной” особью (Mi):
Статистический анализ
Распределение концентраций элементов в большинстве случаев было близко к логнормальному, поэтому для дальнейшего анализа данные предварительно логарифмировали. Для концентраций ТМ и величины транзитного потока рассчитывали среднее геометрическое, минимальное и максимальное значения; для данных по численности животных и потреблению корма оперировали средними арифметическими значениями и ошибкой среднего. Для выявления различий между участками и периодами для исследованных переменных использовали дисперсионный анализ (ANOVA). В статистических тестах значимыми считали различия при p < 0.05. Расчеты выполнили в пакете JMP v.11.
РЕЗУЛЬТАТЫ
Численность населения рыжей полевки
Данные о динамических изменениях абсолютной численности населения рыжей полевки, обитающей на разном удалении от источника эмиссии, приведены в табл. 1. При увеличении техногенной нагрузки регистрировали существенное монотонное снижение плотности животных (F = 6.67, p = 0.011), тогда как в пределах зоны различия между периодами были незначимыми (F = 0.69, p = 0.421). Следует заметить, что усиление различий в численности рыжей полевки в импактной зоне относительно буферных (с 2х до 3 раз) и фоновых (с 4 до 7 раз) участков в период II обусловлено разнонаправленными трендами: 40% увеличением плотности животных на фоновых и умеренно загрязненных территориях при одновременном 60% ее снижении в импактной зоне.
Суточное потребление корма полевками
Результаты расчетов суточного потребления корма одной “условной” особью свидетельствуют об отсутствии значимых межзональных отличий этого показателя (F = 1.49, p = 0.264), тогда как динамические изменения в количестве поедаемого корма были значимыми на всех участках (F = = 7.76, p = 0.017). От I периода наблюдений ко II повсеместно регистрировали снижение массы корма, потребляемого животными (табл. 1). Вероятно, это связано с общим “омоложением” населения. Анализ демографической структуры локальных популяций показал, что после снижения выбросов на всех участках доля молодняка (неполовозрелых сеголеток) в популяциях увеличилась: на загрязненных территориях “прибавка” составила около 20%, на фоновых – около 5%. При этом доля перезимовавших особей, потребляющих корма на 20–30% больше, снизилась.
Концентрация элементов в рационах
Данные о накоплении элементов в рационах животных, отловленных в течение бесснежного сезона на разном удалении от источника эмиссии, приведены в табл. 2. Концентрации всех элементов закономерно увеличивались по мере приближения к заводу (p < 0.0001). Так, в период I на импактных участках для Cu, Cd и Pb отмечено превышение фоновых концентраций в 5–6 раз, для Zn – в 2 раза. Во II период диапазон изменений для Zn сохранился на том же уровне, концентрации Cu при удалении от завода уменьшились в 4.6 раза. Для токсических элементов различия, напротив, усилились в 7–10 раз (для Cd и Pb соответственно). В результате уменьшения объемов аэральных выбросов СУМЗ снижение концентраций в рационах полевок (от периода I к периоду II) было значимым только для Cu (F = 23.42, p = <0.0001) и Pb (F = 9.18, p = 0.003). В то же время количество Cd в рационах животных увеличилось, а Zn – осталось на прежнем уровне. Эффект повышенного содержания Cd в рационах рыжих полевок и его возможные причины обсуждался нами ранее (Мухачева, 2017).
Таблица 2.
Концентрация химических элементов (мкг/г сухой массы) в рационе рыжей полевки и величина транзитного потока элементов (мкг/га сут) через локальные популяции в градиенте техногенного загрязнения
| Элемент | Учетный период (годы) | |||||
|---|---|---|---|---|---|---|
| I (1990–1992 гг.) | II (2015–2017 гг.) | |||||
| Зона загрязнения | ||||||
| фоновая | буферная | импактная | фоновая | буферная | импактная | |
| Концентрация элементов в рационе, мкг/г сухой массы | ||||||
| Медь | $\frac{{18.6}}{{3.3--223.6}}$ | $\frac{{79.5}}{{6.5--1048.8}}$ | $\frac{{105.7}}{{4.1--831.8}}$ | $\frac{{16.4}}{{4.5--48.0}}$ | $\frac{{61.1}}{{9.8--161.5}}$ | $\frac{{74.4}}{{34.2--442.0}}$ |
| Цинк | $\frac{{90.6}}{{18.3--416.0}}$ | $\frac{{139.7}}{{23.0--1824.8}}$ | $\frac{{185.3}}{{19.2--810.9}}$ | $\frac{{91.0}}{{37.1--194.7}}$ | $\frac{{122.8}}{{20.6--608.0}}$ | $\frac{{181.9}}{{81.6--395.4}}$ |
| Кадмий | $\frac{{0.56}}{{{\text{na}}--14.40}}$ | $\frac{{2.56}}{{0.11--18.34}}$ | $\frac{{3.44}}{{0.09--88.63}}$ | $\frac{{0.81}}{{{\text{na}}--9.23}}$ | $\frac{{2.36}}{{0.25--20.09}}$ | $\frac{{5.88}}{{1.55--25.26}}$ |
| Свинец | $\frac{{4.56}}{{{\text{na}}--43.16}}$ | $\frac{{18.53}}{{0.10--207.47}}$ | $\frac{{24.21}}{{0.63--287.38}}$ | $\frac{{1.82}}{{{\text{na}}--13.70}}$ | $\frac{{16.82}}{{1.97--78.82}}$ | $\frac{{17.25}}{{4.64--83.01}}$ |
| n | 234 | 131 | 104 | 75 | 24 | 18 |
| Транзитный поток через популяцию, мкг/га сут | ||||||
| Медь | $\frac{{652}}{{438--1072}}$ | $\frac{{1722}}{{1145--2637}}$ | $\frac{{1328}}{{1077--1550}}$ | $\frac{{759}}{{352--1280}}$ | $\frac{{1670}}{{1057--3233}}$ | $\frac{{543}}{{367--846}}$ |
| Цинк | $\frac{{3137}}{{2131--5219}}$ | $\frac{{3133}}{{2011--4614}}$ | $\frac{{2329}}{{1889--2719}}$ | $\frac{{4218}}{{1958--7111}}$ | $\frac{{3357}}{{2126--6498}}$ | $\frac{{1328}}{{898--2069}}$ |
| Кадмий | $\frac{{20}}{{13--32}}$ | $\frac{{57}}{{37--85}}$ | $\frac{{43}}{{35--50}}$ | $\frac{{38}}{{17--63}}$ | $\frac{{65}}{{41--125}}$ | $\frac{{43}}{{29--67}}$ |
| Свинец | $\frac{{160}}{{107--263}}$ | $\frac{{413}}{{267--612}}$ | $\frac{{304}}{{247--355}}$ | $\frac{{84}}{{39--142}}$ | $\frac{{460}}{{291--890}}$ | $\frac{{126}}{{85--196}}$ |
Величина транзитного потока химических элементов через популяции
Расчетные значения величины транзитного потока для каждого из элементов в исследованные периоды приведены в табл. 2. В течение бесснежного периода на каждом гектаре пихтово-еловых лесов за счет потребления первичной продукции популяциями рыжей полевки в биогеохимический обмен ежедневно включается Zn – от 0.9 до 7.1 мг, Cu – от 0.4 до 3.2 мг, Cd – от 0.01 до 0.13 мг, Pb – от 0.04 до 0.9 мг. При этом зональные различия в величине потока для всех элементов были значимыми (табл. 3). Для Cu, Cd и Pb в течение обоих периодов регистрировали нелинейные изменения с максимумом в буферной зоне, тогда как для Zn отмечали монотонное убывание по мере приближения к источнику эмиссии. В то же время четкие динамические изменения величины транзитного потока от периода I к периоду II (по данным однофакторного дисперсионного анализа), выразившиеся в снижении интенсивности биогенного обмена в 2.5 раза, были зарегистрированы только на импактных участках для Cu (F = = 11.33, p = 0.028) и Pb (F = 11.04, p = 0.029).
Таблица 3.
Результаты двухфакторного дисперсионного анализа отличий величины транзитного потока элементов через локальные популяции рыжей полевки в градиенте загрязнения среды в разные периоды
| Элемент | Источник изменчивости | df | F | p |
|---|---|---|---|---|
| Медь | Зона | 2 | 5.73 | 0.018 |
| Период | 1 | 1.38 | 0.269 | |
| Зона × период | 2 | 1.97 | 0.182 | |
| Цинк | Зона | 2 | 3.96 | 0.049 |
| Период | 1 | 0.09 | 0.771 | |
| Зона × период | 2 | 1.25 | 0.321 | |
| Кадмий | Зона | 2 | 4.20 | 0.041 |
| Период | 1 | 1.26 | 0.287 | |
| Зона × период | 2 | 0.78 | 0.481 | |
| Свинец | Зона | 2 | 11.44 | 0.002 |
| Период | 1 | 4.28 | 0.061 | |
| Зона × период | 2 | 1.17 | 0.222 |
ОБСУЖДЕНИЕ
Важнейшим фактором, определяющим участие ММ в биогеохимическом обмене, выступает уровень пищевого транзита химических элементов через их популяции. Интенсивность такого обмена зависит от концентрации элементов в рационах животных, количества потребляемого корма и локальной численности видовых популяций. Поскольку в пределах каждого периода исследований масса суточного потребления корма “условной” особью не имела значимых зональных отличий, то можно полагать, что на интенсивность биогеохимического обмена отдельных элементов оказывали влияние их концентрации в рационе и уровень численности полевок. Согласно нашим расчетам, величина транзитного потока в градиенте техногенного загрязнения для всех изученных элементов значимо различалась (табл. 2, 3). Полученный результат кажется очевидным, поскольку оба основных показателя – численность животных и концентрация химических элементов в рационах – претерпевают в градиенте загрязнения значительные изменения. Возможно также, что именно совместное действие этих факторов является причиной наблюдаемых нелинейных изменений величины транзитного потока для Cu, Cd и Pb (табл. 2).
Ранее (Мухачева, Безель, 2004; Безель и др., 2007) на примере локальных популяций рыжей полевки из окрестностей СУМЗа, исследованных в период стабильно высоких выбросов предприятия (1990–1998 гг.) нами было установлено, что участие животных в биогеохимических циклах (оцененных для 21 элемента) определяется не столько уровнем химического загрязнения среды (в первую очередь – рационов), сколько видовым составом и обилием сообщества. Было показано, что в годы депрессии, когда численность животных на контрастных участках отличалась незначительно, величина транзитного потока зависела, главным образом, от концентрации того или иного элемента в рационе зверьков. Увеличение обилия животных приводило к более интенсивному включению химических элементов в обмен. Возросшая роль численности, которая в годы пика увеличивалась на порядок и более, была особенно выражена на фоновых участках.
Ожидалось, что в результате существенного (в 50 раз) сокращения валового объема атмосферных выбросов медеплавильного завода за два десятка лет произойдет хотя бы частичное “очищение” компонентов биоты, в том числе растительности и верхних почвенных горизонтов. Кроме того, мы предполагали, что постепенное восстановление среды приведет к улучшению качества местообитаний, увеличению их экологической емкости и опосредованно – к увеличению плотности животных разных видов. Вследствие подобных изменений биогеохимический обмен изученных элементов через популяции млекопитающих-фитофагов, населяющих загрязненные территории, сможет приблизиться к фоновому уровню.
Анализ обобщенных (за каждый 3-летний период) данных показал, что за 25 лет наблюдений на фоновых территориях увеличились транзитные потоки Zn (на 1/3) и Cd (почти в 2 раза), 2-кратно снизился поток Pb, тогда как для Cu значения сохранились на прежнем уровне. На буферных участках ни для одного из 4 элементов значимых изменений величины потока не зарегистрировано. В импактной зоне, напротив, величина транзитного потока большинства изученных элементов снизилась: для Cu и Pb – в 2.4 раза, Zn – в 1.8 раза. Исключение составил лишь Cd, для которого величина потока не изменилась. Можно констатировать, что современные (II период) значения потока для Cu, Cd и Pb, зарегистрированные в импактной зоне, приблизились к фоновым (для I и/или II периодов), для Zn в сравнении с незагрязненными участками они снизились в 1.7–2.4 раза.
Подобные изменения биогеохимической ситуации могут быть обусловлены действием различных факторов. Среди наиболее вероятных можно предполагать: 1) резкое сокращение объемов загрязнителей, поступающих в природную среду и, как следствие, снижение концентраций поллютантов в компонентах биоты (в том числе, растительности); 2) изменения в структуре рациона (вследствие смены видового состава растительных сообществ в ходе восстановительной сукцессии); 3) избирательное потребление животными менее загрязненного корма; 4) изменение обилия локальных популяций.
Как показали наши исследования (Мухачева, 2017), эквивалентного изменения уровней накопления изученных элементов в корме животных после многократного снижения объемов промышленных выбросов медеплавильного комбината не произошло. За 25 лет наблюдений содержание эссенциальных элементов (Cu, Zn) в пределах зоны варьировало незначительно (не более чем на 20%) и не имело четко выраженных трендов. Для токсических элементов (Cd, Pb) изменения были разнонаправленными: к концу периода наблюдений содержание Pb в корме животных повсеместно снизилось, а Cd, напротив, усиленно накапливался в пище особей с загрязненных участков.
По данным наших коллег (Воробейчик и др., 2014) состав растительных сообществ в импактной зоне за рассматриваемый временной интервал не изменился, поэтому спектр кормовых объектов также можно считать постоянным. В литературе имеются сведения о возможностях эффективного регулирования животными поступления загрязнителей в организм. Этот феномен, продемонстрированный для отдельных видов мышевидных грызунов как в лабораторных (Beernaert et al., 2008), так и в природных условиях (Зайченко, 1981; Ozaki et al., 2018), обеспечивается путем селективного выбора самими зверьками менее загрязненного корма. Однако, в наших условиях и этим фактором можно пренебречь, поскольку в течение 25 лет наблюдений в рационах полевок из зоны умеренного загрязнения концентрации всех 4-х элементов варьировали незначительно, а на импактных участках регистрировали разнонарправленные тренды, сходные с изменениями в почвенных горизонтах (Мухачева, 2017).
Следовательно, биогеохимическое своеобразие потоков на участках с разным уровнем загрязнения определяется, главным образом, численностью животных и содержанием элементов в рационе. Оценить вклад каждого из этих факторов в изменение величины транзитного потока в градиенте загрязнения среды можно, сравнивая кратность изменения пищевого транзита химических элементов через локальные популяции животных как функцию их численности (рис. 1а) и концентрации элементов в рационе (рис. 1б). Приведенные зависимости показывают, что решающим фактором в обмене химических элементов через популяции рыжей полевки является численность животных. Полученные результаты хорошо согласуются с выводами, сделанными нами ранее (Мухачева, Безель, 2004; Безель и др., 2007).
Рис. 1.
Изменение транзитного потока элементов через локальные популяции рыжей полевки в зависимости от численности животных (а) и концентрации элементов в рационе (б). Темные маркеры – период стабильно высоких выбросов (1990–1992 гг), светлые – период сниженных выбросов (2015–2017 гг.). Треугольники – Cu, квадраты – Zn, точки – Cd, ромбы – Pb. Кратность изменения показателей приведена относительно фоновых значений, принятых за единицу. Биссектриса соответствует прямой зависимости величины потока от рассматриваемых факторов.
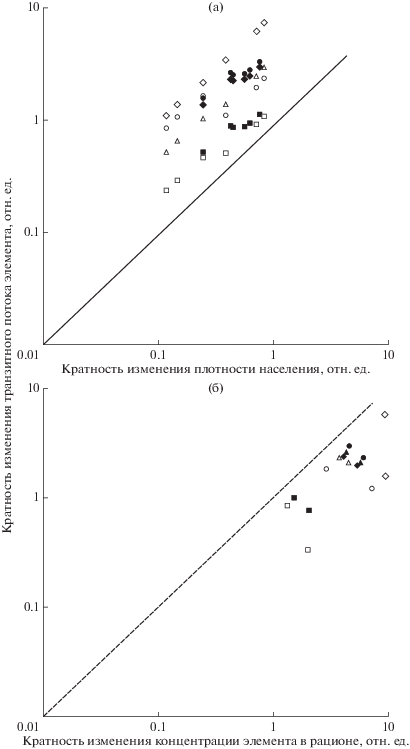
Численность локальных популяций является интегральным показателем, отражающим сбалансированность популяционных процессов рождаемости, смертности и миграционной активности животных. Она зависит как от естественных динамических процессов (сезонных, годовых), так и от качества среды обитания, ее экологической емкости. Специальными исследованиями было показано, что потенциальная “емкость” фрагментов пихто-ельников, сохранившихся в импактной зоне, немногим ниже (примерно на 20%) ненарушенных (Мухачева, 2007). В благоприятных условиях локальная плотность населения рыжей полевки на этих участках может приближаться к фоновой. Мы ожидали, что постепенное восстановление исходных местообитаний в окрестностях завода должно было создать предпосылки для увеличения численности животных на загрязненных территориях.
В реальности за 25-летний период наблюдений мы регистрировали снижение абсолютной численности рыжей полевки в импактной зоне с 4.4 до 2.7 особей/га (табл. 1). Однако при этом численность красной полевки – близкого по экологическим требованиям вида – на этих же участках пропорционально увеличилась (с 2.6 до 4.2 особей/га). Таким образом, суммарная плотность обоих видов в сравниваемые периоды оказалась сопоставимой: 7.0 особей/га в I период, 6.9 – во II. Представленные данные свидетельствуют о том, что за исследованный временной интервал качество среды в импактной зоне не претерпело существенных изменений, а снижение численности населения рыжей полевки в непосредственной близости от источника эмиссии есть результат конкурентного замещения вида красной полевкой. Следует заметить, что в буферной и фоновой зонах абсолютная численность рыжей полевки, напротив, увеличилась в среднем на 40% (табл. 1). Сходным образом на этих участках изменилась и численность красной полевки, однако масштабы несопоставимы с обилием рыжей полевки.
Результатами совместного действия рассмотренных факторов (численности и концентрации изученных элементов в корме) в условиях сокращения промышленных выбросов в зависимости от сбалансированности процессов могут быть интенсификация, замедление, либо стабилизация биогеохимического обмена элементов. В окрестностях СУМЗ наблюдаются все перечисленные варианты. В импактной зоне интенсивность обмена большинства элементов cнижается по сравнению с исходными значениями в 2 раза, достигая фоновых величин (Cu, Cd, Pb), либо становится еще ниже (Zn). В буферной зоне можно констатировать стабилизацию биогеохимического обмена, поскольку ни для одного из 4 элементов существенных изменений величины потока не зарегистрировано. При этом именно в условиях умеренного загрязнения для большинства элементов (кроме Zn) регистрировали максимальные значения транзитного потока, превышающие фоновые величины в 1.7–5.5 раз, импактные – в 1.3–3.7 раз. В фоновой зоне мы имеем дело с интенсификацией биогенного обмена (за исключением Pb), когда величина транзитного потока в сравнении с исходными значениями может увеличиваться до 2 раз.
ЗАКЛЮЧЕНИЕ
Выполенные исследования показали, что биогеохимическое своеобразие транзитных потоков Cu, Zn, Cd и Pb через локальные популяции рыжей полевки на участках с разным уровнем загрязнения определяется численностью животных и содержанием элементов в рационе. Многократное сокращение объема промышленных выбросов СУМЗ за последние десятилетия не привело к эквивалентному снижению концентраций изученных элементов в корме рыжей полевки, населяющей загрязненные территории. В импактной зоне содержание Cu, Zn и Pb в рационе животных существенно не изменилось, а концентрации Cd к концу периода наблюдений двукратно возросли по сравнению с исходными значениями. Для концентраций металлов в корме животных из буферной зоны не было выявлено четких направленных изменений. Сходная картина наблюдалась в фоновой зоне для Cu, Zn и Cd, тогда как содержание Pb в рационе полевок снизилось в 2.5 раза по сравнению с исходным уровнем. Изменения абсолютной численности локальных популяций рыжей полевки в градиенте загрязнения носили разнонаправленный характер – на фоновых и буферных территориях регистрировали ее 40% увеличение, в импактной зоне – снижение на 60%. При этом снижение численности модельного вида обусловлено межвидовой конкуренцией симпатрических видов с близкими экологическими требованиями, а не изменением качества среды.
Результатами совместного действия рассмотренных выше факторов в условиях сокращения промышленных выбросов в зависимости от сбалансированности процессов могут быть интенсификация (фоновая зона), замедление (импактная зона), либо стабилизация (буферная зона) биогеохимического обмена элементов. Наши предположения о постепенном выравнивании количественных показателей транзитных потоков изученных элементов на загрязненных и фоновых территориях подтвердились частично. Величина транзитного потока Cu, Cd, Pb в импактной зоне к концу периода исследований приблизилась к фоновой, тогда как для Zn регистрировали 2-кратное снижение в сравнении с незагрязненной территорией. Основная причина подобных изменений – существенные перестройки в структуре сообщества ММ, повлекшие за собой резкое падение численности рыжей полевки в импактной зоне.
Оцененные нами уровни биогенного обмена химических элементов через природные популяции ММ и его изменение в градиенте загрязнения не столь значительны, чтобы оказывать существенное влияние на общий геохимический статус рассмотренных территорий. Между тем популяции рассмотренного нами модельного вида отражают общую реакцию животного населения природных БГЦ на изменение геохимического фона загрязненных территорий, особо подчеркивая роль качества среды обитания, в том числе при ее антропогенной деформации.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН, а также частично поддержана Программой УрО РАН (проект 18-4-4-9).
Список литературы
Безель В.С., Мухачева С.В., Куценогий К.П., Савченко Т.И., Чанкина О.В. (2007) Участие мелких млекопитающих в биогенных циклах химических элементов в наземных экосистемах. Проблемы биогеохимической и геохимической экологии 4(2), 80-91.
Бернштейн А.Д., Михайлова Т.В., Апекина Н.С. (1995) Эффективность метода ловушко-линий для оценки численности и структуры популяций рыжей полевки. Зоологический журнал 74(7), 217-282.
Воробейчик Е.Л., Ермаков А.И., Золотарев М.П., Тунева Т.К. (2012) Изменение разнообразия почвенной мезофауны в градиенте промышленного загрязнения. Rus. Entomol. J. 21(2), 203-218.
Воробейчик Е.Л., Кайгородова С.Ю. (2017) Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов. Почвоведение (8), 1009-1024.
Воробейчик Е.Л., Нестеркова Д.В. (2015) Техногенная граница распространения крота в районе воздействия медеплавильного завода: смещение в период сокращение выбросов. Экология (4), 308-312.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. (2014) Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода. Экология (6), 448-458.
Воронов А.Г. (1955) О методах полевого изучения кормового рациона мелких грызунов. Бюлл. МОИП. Отд. биол. 60(5), 21-30.
Европейская рыжая полевка (1981). М.: Наука, 352 с.
Ермаков В.В., Тютиков С.Ф. (2008) Геохимическая экология животных М.: Наука, 315 с.
Ермаков В.В., Тютиков С.Ф., Сафонов В.А. (2018) Биогеохимическая индикация микроэлементозов. М.: Издание РАН, 386 с.
Зайченко О.А. (1981) Мелкие млекопитающие как индикатор антропогенных нагрузок. Природоохранные аспекты освоения ресурсов Минусинской котловины". Иркутск, Шушенское, с. 51-60.
Калабин Г.В., Моисеенко Т.И. (2011) Экодинамика техногенных провинций горнопромышленных производств: от деградации к восстановлению. ДАН 437(3), 398-403.
Копцик Г.Н., Копцик С.В., Смирнова Н.Е., Кудрявцева А.Д., Турбабина К.А. (2016) Реакция лесных экосистем на сокращение атмосферных промышленных выбросов в Кольской субарктике. Журнал общей биологии 77(2), 145-163.
Кузнецов Г.В., Михайлин А.П. (1985) Особенности питания и динамики численности рыжей полевки в условиях широколиственного леса. В кн.: Млекопитающие в наземных экосистемах. М.: Наука, с. 127-156.
Лянгузова И.В., Мазная Е.А. (2012) Динамические тренды популяций Vaccinium myrtillus L. в зоне воздействия медно-никелевого комбината: результаты 20-летнего мониторинга. Экология (4), 261-269.
Моисеенко. Т.И. (2011) Устойчивость водных экосистем и их изменчивость в условиях токсичного загрязнения. Экология (6), 441-448.
Мухачева С.В. (2005) Особенности питания рыжей полевки в условиях техногенного загрязнения среды обитания. Сибирский экологический журнал (3), 523-533.
Мухачева С.В. (2007) Особенности пространственно-временного размещения населения рыжей полевки в градиенте техногенного загрязнения среды обитания. Экология (3), 178-184.
Мухачева С.В. (2016) Население мелких млекопитающих в зоне действия крупного медеплавильного комбината в условиях существенного сокращения промышленных выбросов. Териофауна России и сопредельных территорий. М.: ТНИ КМК, 272.
Мухачева С.В. (2017) Многолетняя динамика концентрации тяжелых металлов в корме и организме рыжей полевки в период снижения выбросов медеплавильного завода. Экология (6), 461-471.
Мухачева С.В., Безель В.С. (2004) Участие мелких млекопитающих в биогеохимических циклах на химически загрязненных территориях. Тяжелые металлы, радионуклиды и элементы-биофилы в окружающей среде. Семипалатинск: Изд-во СГУ, 75-78.
Мухачева С.В., Безель В.С. (2015) Тяжелые металлы в системе мать–плацента–плод у рыжей полевки в условиях загрязнения среды выбросами медеплавильного комбината. Экология (6), 444-453.
Покаржевский А.Д. (1985) Геохимическая экология наземных животных. М.: Наука. 429 с.
Черненькова Т.В., Бочкарев Ю.Н. (2013) Динамика еловых насаждений Кольского Севера в условиях воздействия природно-антропогенных факторов среды. Журнал общей биологии 74(4), 283-303.
Beernaert J., Scheirs J., Van Den Brande G., Leirs H.; Blust R., De Meulenaer R., Van Camp J., Verhagen R. (2008). Do wood mice (Apodemus sylvaticus L.) use food selection as a means to reduce heavy metal intake? Environ. Pollut. 151, 599-607.
Berglund Å.M., Nyholm N. (2011) Slow improvements of metal exposure, health- and breeding conditions of pied flycatchers after decreased industrial heavy metal emissions. Sci. Tot. Environ. 409(20), 4326-4334.
Berglund Å.M., Rainio M.J., Eeva T. (2012) Decreased metal accumulation in passerines as a result of reduces emissions. Environ. Toxicol. Chem. 31, 1-7.
Camizuli E., Scheifer R., Garnier S., Monna F., Lonso R., Gourault C., Hamm G., Lachiche C., Delivet G., Chateau C., Alibert P. (2018) Trace metals from historical mining sites and past metallurgical activity remain bioavailable to wildlife today. Sci. rep. (8) 3436.
Douay F., Pruvot C., Waterlot C. Fritsch C., Fourrier H., Loriette A., Bidar G., Grand C., Vaufleury A., Scheifler R. (2009) Contamination of woody habitat soils around a former lead smelter in the North of France. Sci. Tot. Environ. 407(21), 5564-5577.
Gall J.E., Boyd R.S., Rajakaruna N. (2015) Transfer of heavy metals through terrestrial food webs: a review. Environ. Monit. Asses. 187(4), 1-21.
Hansson L. (1985) Clethrionomys food: generic, specific and regional characteristics. Ann. zool. fenn. 22(3), 315-318.
Juknys R., Vencloviene J., Stravinskiene V., Augustaitis A., Bartkevicius E. (2003) Scots pine (Pinus sylvestris L.) growth and condition in a polluted environment: From decline to recovery. Environ. Pollut. 125(2), 205-212.
Kabala C., Chodak T., Szerszen L. (2008) Influence of land use pattern on changes in copper content in soils around a copper smelter, based on a 34-year monitoring cycle. Zemes Ukio Mokslai 15(3), 8-12.
Kozlov, M.V., Zvereva, E.L. (2011). A second life for old data: Global patterns in pollution ecology revealed from published observational studies. Environ. Pollut. 159, 1067-1075.
Ozaki S., Fritsch C., Valot B. Mora F., Cornier T., Scheifler R. (2018) Does pollution influence small mammal diet in the field? A metabarcoding approach in a generalist consumer. Molecular Ecology 1-14.
Дополнительные материалы отсутствуют.


