Геохимия, 2021, T. 66, № 1, стр. 37-44
Равновесно-кинетический расчет серпентинизации оливина. Сопоставление с модельным экспериментом
М. В. Мироненко a, *, Е. С. Сидкина a, **, В. Б. Поляков b, ***
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
b Институт экспериментальной минералогии им. академика Д.С. Коржинского РАН
142432 Московская обл., Черноголовка, ул. Академ. Осипьяна, д. 4, Россия
* E-mail: mironenko@geokhi.ru
** E-mail: sidkinaes@yandex.ru
*** E-mail: polyakov@iem.ac.ru
Поступила в редакцию 09.12.2019
После доработки 20.02.2020
Принята к публикации 25.02.2020
Аннотация
На основе баз данных и программ GEOCHEQ_M и GEOCHEQ_Isotope выполнены расчеты протекания химических взаимодействий во времени в закрытой системе “водный раствор 0.495 М NaCl и 0.0194 M NaHCO3 + оливин (Fo91)” для 200 и 320°С и давления 350 бар. Соотношение масс раствора и породы, выбранные температуры и давление, состав и размер зерен оливина, состав водного раствора, а также длительность взаимодействий соответствуют экспериментам, описанным в статьях McCollom et al., 2016; McCollom, 2016. Изменен лишь изотопный состав углерода NaHCO3. В отличие от эксперимента, вместо NaH13CO3 для расчетов принят изотопный состав углерода белемнита из формации Пи-Ди, Южная Каролина, США. Результаты расчетов сопоставлены с результатами экспериментов. Новообразованная минеральная ассоциация, как и в экспериментах, представлена высокомагнезиальными серпентином и бруситом, магнетитом и при 200°С подчиненным количеством магнезита. Рассчитанная скорость серпентинизации оливина близка к экспериментальной. В отличие от эксперимента, расчеты дают значительно более высокие содержания метана в растворе. Это объясняется неучетом кинетических ограничений реакции взаимодействия растворенной углекислоты морской воды с водородом, образующимся в системе. Рассчитано фракционирование изотопов углерода между карбонатом водного раствора, новообразованными углеводородами и магнезитом. Углеводороды существенно обогащены легким изотопом в сравнении с карбонатом раствора и, при 200°С, магнезитом.
ВВЕДЕНИЕ
Флюиды, образующиеся при интенсивной серпентизации ультраосновных океанических пород, часто обогащены метаном и водородом (Charlou et al., 2010; Etiope, Sherwood, 2013). Образование водорода в этом процессе можно упрощенно описать реакцией оливина с морской водой, приводящей к образованию хризотила, брусита и магнетита: (Mg,Fe)2SiO4 + H2O → → Mg3Si2O9(OH)4 + Mg(OH)2 + Fe3O4 + H2. Метан может образоваться в реакции водорода с растворенным неорганическим углеродом (РНУ) морской воды: 4H2 + CO2 = CH4 + 2H2O. Однако, экспериментальные исследования показали, что эта реакция имеет достаточно жесткие кинетические ограничения и протекает очень медленно в отсутствие специфических катализаторов (Horita, Berndt, 1999; Charlou et al., 2010).
В разработанной нами равновесно-кинетической модели скорость серпентинизации определяется скоростью реакции конгруэнтного растворения оливина. Эксперименты по серпентинизации оливина, детально описанные в (McCollom et al., 2016; McCollom, 2016), предоставляют достаточно редкую возможность проверки и верификации этой модели. В данной работе мы моделировали крайние ситуации в отношении метанообразования в этой модели: (1) образование метана и его гомологов (этан и пропан) запрещено; (2) кинетические ограничения на формирование углеводородов (метан, этан и пропан) отсутствуют.
ОПИСАНИЕ МОДЕЛИ
Равновесно-кинетическая модель необратимых химических взаимодействий в системе “раствор-порода” описана в (Мироненко, Золотов, 2012; Zolotov, Mironenko, 2007). Она основана на принципе частичного равновесия (Helgeson et al., 1970), который сводится к следующим допущениям: наиболее медленными химическими взаимодействиями в системе являются реакции растворения минералов; гомогенные реакции в растворе протекают практически мгновенно, т.е. все компоненты раствора находятся в равновесии друг с другом11; реакции осаждения протекают быстро и контролируются насыщением. Моделирование заключается в последовательном расчете серии частичных равновесий в системах, валовый химический состав которых рассчитывается из состава водного раствора на предыдущем временном шаге с учетом масс и состава минералов, растворившихся в течение данного шага за время Δt. Кинетика растворения большинства минералов при постоянном рН достаточно хорошо описывается реакциями псевдо-нулевого порядка (Brantley, 2004) с соответствующим замедлением при приближении к насыщению (Lasaga, 1981). Для того, чтобы изменение рН на каждом шаге по времени не приводило к существенным изменениям в скоростях растворения, продолжительность временного шага Δt должна быть достаточно малой, в ходе расчета Δt регулируется автоматически.
Равновесно-кинетическая модель реализована на основе комплекса GEOCHEQ_M (Мироненко и др., 2008). Основу базы термодинамических данных составляет известная база SUPCRT92 (Johnson et al., 1992) с многочисленными дополнениями. Для наиболее важных силикатов, алюмосиликатов, карбонатов, оксидов, гидроксидов в ней также содержатся значения кинетических параметров для расчета скоростей конгруэнтного растворения минералов в зависимости от рН для 25°С, а также энергии активации этих реакций.
Для численного воспроизведения экспериментов по серпентинизации оливина в базу данных и вычислительную программу GEOCHEQ_M были внесены некоторые дополнения. Поскольку возникла необходимость учитывать образование железосодержащего брусита, то введена информация по термодинамическим свойствам амакинита Fe(OH)2cr из (Иориш и др., 1978–2004). Кроме того, поскольку наиболее реалистичные, на наш взгляд, описания кинетики растворения оливина (Fo91) и брусита не укладываются в формализмы, принятые в базе GEOCHEQ_M, текущие скорости растворения этих минералов рассчитывались индивидуально (для оливина по уравнению lg r(pH, T) = lg A – $\frac{{{{E}_{a}}}}{{2.303R}}\left( {\frac{1}{T}} \right)$ – n pH, lg A = 0.54 ± ± 0.14, Ea = 42.6 ± 0.8 kJ/mol, n = 0.50 ± 0.004 из (Rosso, Rimstidt, 2000) и для брусита по формуле r =Aa exp(–Ea/RT)${{\left( {\frac{{a_{{{{{\text{H}}}^{ + }}}}^{2}}}{{a_{{{\text{M}}{{{\text{g}}}^{{2 + }}}}}^{2}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 8}} \right. \kern-0em} 8}}}},$ Aa = 1.7 × × 10‒3 mol/cm2/s, Ea = 46 kJ/mol из (Declerq, Oekers, 2014)).
Так как модель должна предусматривать возможность образования эволюционирующих по составу твердых растворов, возникает задача различать твердые растворы одного минерала, образующиеся или растворяющиеся на различных временных интервалах. Для этого потенциальные твердые растворы серпентин и брусит были разбиты на серию дискретных минералов с фиксированной формулой, отличающихся по содержанию конечных миналов на 0.002 стехиометрические единицы. Свободные энергии этих промежуточных членов рассчитывались по модели идеального смешения, при этом изоморфное вхождение Fe(III) в серпентин не учитывалось. При расчете фракционирования изотопов углерода между возможными магнезитом, сидеритом и водным раствором, также была использована модель идеальных твердых растворов изотопологов магнезита Mg(12C,13C)O3 и сидерита Fe(12C,13C)O3. Однако, полагалось, что на стадии осаждения этих карбонатов происходит изотопное переуравновешивание минералов на каждом шаге по времени, а при растворении эти минералы растворяются конгруэнтно, т.е. с сохранением изотопного состава.
Изотопные равновесия. Для одновременного расчета химических и изотопных по углероду равновесий методом минимизации свободной энергии Гиббса, база термодинамических данных GEOCHEQ (Мироненко и др., 2000) была модифицирована в GEOCHEQ_Isotope (Mironenko et al., 2018) за счет добавления изотопа 13С в качестве нового независимого компонента (химического элемента). Соответственно, в список веществ базы данных добавлены редкие изотопологи ряда важнейших углеродсодержащих веществ, для которых были критически оценены и согласованы β-факторы и аппроксимированы их температурные зависимости (Mironenko et al., 2018). Это позволяет рассчитывать свободные энергий Гиббса редких изотопологов. Поскольку значения β-факторов растворенных 13CH4,aq, 13C2H6,aq, 13C3H8,aq неизвестны, их величины приняты равными β-факторам газообразных веществ.
Совокупность информации, содержащейся в базах данных GEOCHEQ_M и GEOCHEQ_Isotope, позволила сформировать массив входных данных для равновесно-кинетического моделирования гидротермальной серпентинизации с учетом фракционирования изотопов углерода.
ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ И РАСЧЕТНОЙ СИСТЕМ
В экспериментах (McCollom et al., 2016; McCollom, 2016) лишь в единичном случае для 300°С, при понижении давления до 100 бар и впрыскивании дополнительного водорода в систему, зафиксированы существенные концентрации метана с содержанием в нем 13СН4 53%, т.е., введенный в раствор изотоп 13С участвует в метанообразовании. В экспериментах при давлении 350 бар газовая фаза не образуется. Как правило, концентрации СН4,aq очень низки (моляльности порядка n × 10–5). При этом изотопный состав образующегося метана соответствует природному (табл. 1 в McCollom, 2016). Введенный в раствор изотоп 13С не участвует в реакции метанообразования. Только в одном опыте при 320°С зафиксированы повышенные (250 × 10–6) концентрации метана с содержанием 13СН4, существенно отличающимся от природного (6%). Эти данные указывают на то, что в образовании метана преимущественно участвовал рассеянный углерод природного состава, присутствующий в оливине, но при этом в (McCollom, 2016) присутствие органического углерода в оливине не отмечается.
Мы промоделировали в двух вариантах (с возможностью образования метана и без) два эксперимента: (1) при температуре 200°С продолжительностью 3331 ч и (2) 320°С продолжительностью 2087 ч. Давление в обоих случаях составляло 350 бар. В этих экспериментах к фракции 53–212 мкм оливина Fo91 (химический состав примерно соответствует формуле Mg1.82Fe0.18SiO4) добавляли в соотношении W/R = 2.55 водный раствор 0.495 М NaCl и 0.0194 M NaH13CO3, имитирующий морскую воду. Расчетные величины рН этого раствора составляют 7.87 для 200°С и 8.50 для 320°С. В отличие от экспериментов, для расчетов был принят исходный изотопный состав соды 13С/12С = 0.0112372 (δ13С = 0 относительно стандарта PDB – карбоната раковин белемнита позднемелового возраста из формации Пи-Ди, Южная Каролина, США (Галимов, 1968)). Для исходной навески оливина мы рассчитали площадь поверхности сферических зерен оливина диаметра 132.5 мкм (среднее арифметическое между 53 и 212). В эксперименте площадь удельной поверхности фракции оливина была определена экспериментально ВЕТ-методом по величине сорбции азота и составила 0.59 ± 0.02 м2/г (McCollom et al., 2016). Мы приняли, коэффициент доступности поверхности зерен раствору равным 0.2. В дальнейшем, по мере растворения оливина и соответствующего уменьшения размера его зерен, площадь поверхности постоянно пересчитывалась. Размер зерен всех вторичных минералов предполагался постоянным – 0.01 мм, увеличивалось лишь их число, поверхность зерен считалась полностью доступной раствору; вторичные минералы не изменяли доступности поверхности зерен первичного оливина.
Расчеты частичных равновесий проводились в 9-компонентной системе H–O–12C–13C–Mg–Fe–Si–Na–Cl. Неидеальность водного флюида рассчитывалась по уравнению Дебая–Хюккеля (второе приближение). В водном растворе рассматривались 38 частиц: H2O, OH–, H+, H2, O2, 12CH4aq, 13CH4aq, 12C2H6aq, 13C2H6aq, 12C3H8aq, 13C3H8aq, 12CO2aq, 13CO2aq, ${{{\text{H}}}^{{{\text{12}}}}}{\text{CO}}_{{\text{3}}}^{ - },$ ${{{\text{H}}}^{{{\text{13}}}}}{\text{CO}}_{{\text{3}}}^{ - },$ $^{{{\text{12}}}}{\text{CO}}_{{\text{3}}}^{{{\text{2}} - }},$ $^{{{\text{13}}}}{\text{CO}}_{{\text{3}}}^{{{\text{2}} - }},$ Fe2+, FeO, FeOH+, FeCl+, FeCl2, FeO+, ${\text{FeO}}_{{\text{2}}}^{ - },$ Fe3+, Mg2+, MgCl+, ${\text{MgHSiO}}_{{\text{3}}}^{ + },$ MgOH+, SiO2, ${\text{HFeO}}_{{\text{2}}}^{ - },$ HFeO2, ${\text{HSiO}}_{{\text{3}}}^{ - },$ Na+, Cl–, NaCl, NaHSiO3, NaOH. В газовой фазе 11 частиц: 12CH4, 13CH4, 12C2H6, 13C2H6, 12C3H8, 13C3H8, 12CO2, 13CO2, H2, O2, H2O. В качестве возможных минералов рассматривались: оливин Mg1.82Fe0.18SiO4; серпентины фиксированного состава (промежуточные члены твердого раствора хризотил-гриналит (Mg,Fe)3Si2O5(OH)4); магнетит Fe3O4; промежуточные члены твердого раствора брусит-амакинит (Mg,Fe)(OH)2; твердые растворы изотопологов магнезита Mg(12C,13C)O3, сидерита Fe(12C,13C)O3 и графита; кварц.
РЕЗУЛЬТАТЫ РАСЧЕТОВ
Первая серия расчетов проведена для ситуации, когда был наложен запрет на образование метана, этана и пропана. На рис. 1 показаны рассчитанные минеральные трансформации в системе во времени для температур 200 и 320°С и давления 350 бар. Количества растворившегося за время взаимодействия оливина для обеих температур близки к зафиксированным по окончании экспериментов (рис. 1а, 1г). Это свидетельствует об адекватности используемой нами равновесно-кинетической модели и корректности параметров кинетических уравнений конгруэнтного растворения высокомагнезиального оливина. Вторичные минеральные ассоциации соответствуют полученным в экспериментах: высокомагнезиальный серпентин, магнетит, брусит (рис. 1б, 1д).
Рис. 1.
Рассчитанные массы растворившегося оливина (а, г); массы новообразованных серпентина и магнетита, массы и химические составы брусита (б, д); масса магнезита (в) для 200 и 320°С во времени в отсутствии синтеза метана.
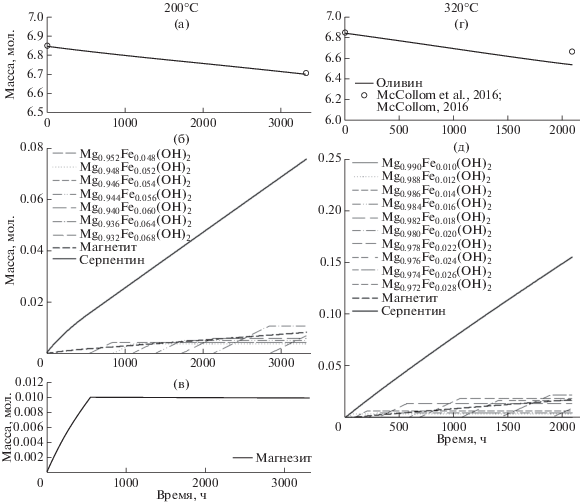
Согласно расчетам, при 200°С вначале образуется небольшое количество магнезита, который впоследствии слегка растворяется, далее выпадает брусит. В (McCollom et al., 2016) отмечается присутствие малых количеств карбонатов в большинстве экспериментов (рис. 4, McCollom et al., 2016), хотя тщательная проверка результатов эксперимента с оливином при 320° его не обнаружила (McCollom et al., 2016, с. 184).
Рассчитанный состав серпентина оказался более магнезиальными (99 мол. %), чем в экспериментах (97–96 мол. %) и показал удивительное постоянство независимо от температуры и степени серпентинизации оливина.
В наших расчетах для 200°, образование брусита начинается после окончания осаждения магнезита, примерно через 540 ч. При 320°С брусит начинает выпадать уже в конце первого часа с начала взаимодействий. Рассчитанная магнезиальность брусита, в отличие от серпентина, варьирует в более широких пределах 93–99 мол. % (в экспериментах 92–99). При этом, как и в экспериментах (рис. 5, McCollom et al., 2016) его железистость увеличивается с падением температуры. Кроме того, она постепенно увеличивается в ходе серпентинизации (рис. 1б, 1д).
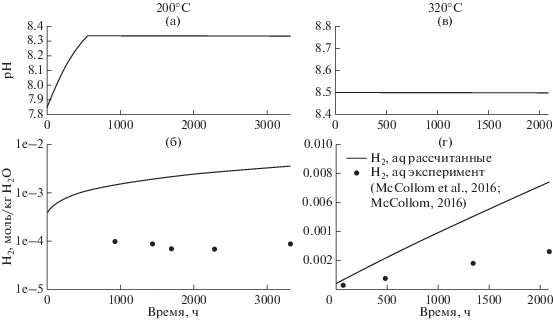
На рис. 2а и 2в показано расчетное изменение кислотности водного раствора по мере серпентинизации оливина для 200°С и 320°С. В первом случае рН возрастает от исходного 7.87 до 8.34 в течение примерно 540 ч с начала эксперимента, пока происходит осаждение магнезита, а затем остается практически постоянным. Во втором случае рН раствора составляет 8.50 на протяжении всего времени взаимодействий, так что в этом случае скорость растворения оливина также постоянна. На рис. 2б, 2г показаны рассчитанные концентрации растворенного во флюиде водорода при 200 и 320°С в сравнении с измеренными в ходе и в конце экспериментов (табл. 2 , McCollom et al., 2016; табл. 1 , McCollom, 2016). Рассчитанные для 320°С концентрации водорода превышают измеренные не более чем втрое, для 200°С – на порядок. На наш взгляд, эти различия вполне допустимы и могут быть объяснены как ошибками анализа, связанными с возможной частичной потерей водорода при анализе малых аликвот раствора, так и с упрощениями, принятыми в модели. На вероятную потерю значимого количества водорода в эксперименте указывает и то обстоятельство, что измеренные концентрации водорода значительно меньше, чем должны быть согласно стехиометрии реакций серпентинизации, приведенных в табл. 8 из (McCollom et al., 2016) для различных температур. Рассчитанные нами концентрации оказались чуть ниже, чем следует из этих уравнений реакций.
Рис. 2.
Рассчитанные кислотности флюида (а, в) и концентрации водорода (б, г) для 200 и 320°С во времени при запрете образования метана.
Вторая серия расчетов касается крайней ситуации, когда какие-либо кинетические ограничения для образования углеводородов (метана, этана, пропана) отсутствуют, то есть эти химические реакции могут протекать быстро. Минеральные преобразования в ходе серпентинизации при 200 и 320°С показаны на рис. 3а–3д. Они очень схожи с полученными ранее в системе, не содержащей углеводороды. Основные отличия касаются количества и железистости брусита. В присутствии метана масса новообразованного брусита заметно возрастает, при этом он представлен более магнезиальными членами.
Рис. 3.
Рассчитанные массы растворяющегося оливина (а, г); массы новообразованных серпентина и магнетита, массы и химические составы брусита (б, д); масса магнезита (в) для 200 и 320°С во времени в системе с образованием метана.
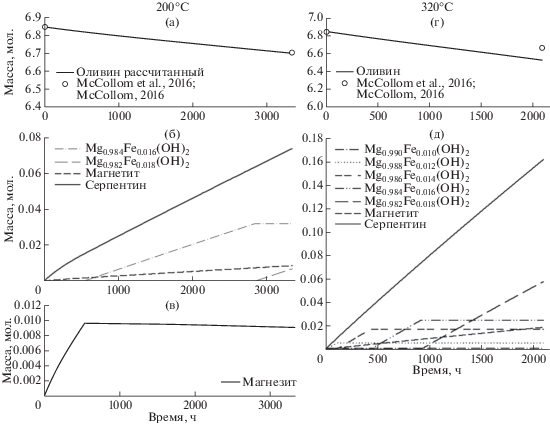
Рис. 4.
Рассчитанные изменения рН (а, в); концентрации водорода и метана (б, г) для 200 и 320°С во времени в системе с образованием метана.
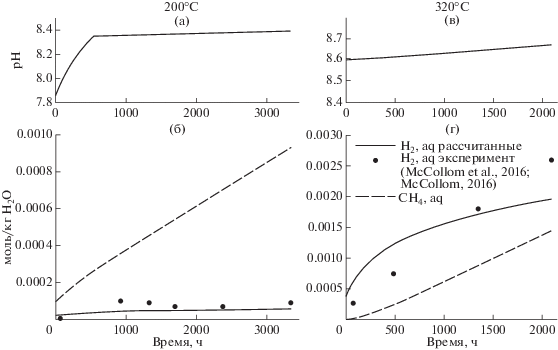
Рис. 5.
Рассчитанное фракционирование изотопов углерода между компонентами флюида и магнезитом для 200°С (а) и между компонентами флюида для 320°С (б).
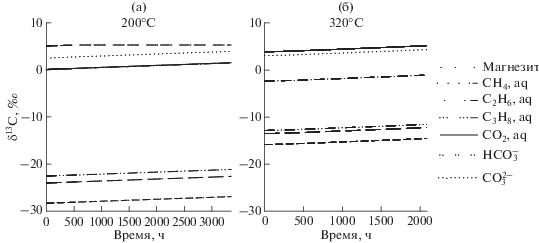
Рассчитанные концентрации метана и водорода во флюиде для 200 и 320°С показаны на рис. 4а, 4б. При 200°С концентрации метана существенно превышают содержания водорода, для 320° наблюдается обратная картина – доминирует водород. Метан по сути является единственным углеводородом, образовавшимся в системе, рассчитанные моляльности растворенных этана и пропана по окончании взаимодействий составляют соответственно около 7 × 10–9 и 5 × 10–13 для 200°С и 5 × 10–10 и 1 × 10–13 для 320°С.
Появление метана в системе заметно сказалось на рассчитанном режиме кислотности флюида в ходе серпентинизации (рис. 4а, 4в). Если раньше при 200° после выпадения магнезита рН оставался постоянным, то теперь он слегка возрастает от 8.35 до значения 8.39. При 320°С кислотность плавно растет во всем временном интервале от рН 8.50 до 8.54.
Фракционирование изотопов углерода между компонентами флюидной фазы и магнезитом для 200°С показано на рис. 5а. Моделирование изотопного состава магнезита имело свои особенности, как отмечено выше. На первом этапе (от 0 до 535 ч, рис. 3в) магнезит осаждается в равновесии с раствором. На этом этапе происходит незначительное, но последовательное, обогащение магнезита, как и гидролизованных форм РНУ, тяжелым изотопом 13С, вызванное образованием обедненных этим изотопом органических соединений, в основном метана. На втором этапе изотопное фракционирование при конгруэнтном растворении магнезита полагали равным нулю. Это обстоятельство связано с тем, что для проявления изотопных эффектов при растворении необходимо выполнение условия 1/St = Pe = vl/D $ \ll $ 1 (Поляков, 1989), St и Pe – критерии Стэнтона и Пекле (диффузионный), v – линейная скорость растворения кристалла, l – размер кристалла, D – скорость диффузии углерода в магнезите. Скорость диффузии в твердом теле мала и поэтому обычно при растворении имеет место 1/St = Pe $ \gg $ 1, а, следовательно, изотопные эффекты незначительны. Таким образом на втором этапе (свыше 535 ч) изотопный состав магнезита не изменяется. δ13С гидролизованных форм РНУ продолжает незначительно увеличиваться за счет образования органических соединений, как и на первом этапе. Изотопный состав растворенного органического углерода (РОУ) в целом близок к изотопному составу метана, концентрация которого на несколько порядков превосходит концентрации остальных компонентов РОУ. Изменяется от δ13С = –28.4‰ в начале реакции до = –26.9‰ в конце процесса через 3350 ч. Примерно на ту же величину ~1.5‰ увеличивается и δ13С суммарного РНУ, от 0.12 до 1.67‰.
При 320°С магнезит не образуется (рис. 5б). Изотопный состав РНУ последовательно обогащается тяжелым изотопом (от δ13С = 0‰ до δ13С = 1.5‰) за счет образования РОУ, в основном метана, с низкими значениями δ13С (от –15.8 до –14.6‰).
ВЫВОДЫ
Предпринятая попытка численно, с помощью равновесно-кинетической модели, воспроизвести результаты детально описанных модельных экспериментов по серпентинизации оливина (McCollom et al., 2016; McCollom, 2016) показала, что, несмотря на схематичность модели, основанной на принципе частичного равновесия, она удовлетворительно описывает скорости коррозии оливина и образования вторичных минералов, химический состав минеральных твердых растворов, генерацию водорода.
Термодинамическое моделирование в предположении частичного равновесия показывает, что метан должен образовываться в системе в значительных количествах, что согласуется с (Delacour et al., 2008; Proskurowski et al., 2008).
При этом рассчитанное фракционирование изотопов углерода при равновесном синтезе метана сопоставимо с измеренным в природных флюидах.
Работа частично выполнена по теме госзадания 0137-2019-0016 “Моделирование гидрогеохимических и гидротермальных процессов для решения фундаментальных и прикладных задач” и частично по гранту РФФИ № 19-05-00865a.
Список литературы
Галимов Э.М. (1968) Геохимия стабильных изотопов углерода. Изд-во: Недра. 226 с.
Иориш В.С., Аристова Н.М., Бергман Г.А., Горохов Л.Н., Гусаров А.В., Ежов Ю.С., Куликов А.Н., Осина Е.Л., Шенявская Е.А., Хандамирова Н.Э., Юнгман В.С. (1978–2004) Термодинамические свойства индивидуальных веществ. М.: Наука. Т. 5. Табл. 2080.
Мироненко М.В., Золотов М.Ю. (2012) Равновесно-кинетическая модель взаимодействий вода-порода. Геохимия. (1), 3-9.
Mironenko M.V., Zolotov M.Yu. (2012) Equilibrium–kinetic model of water–rock interaction. Geochem. Int. 50(1), 1-7.
Мироненко М.В., Акинфиев Н.Н., Мелихова Т.Ю. (2000) GEOCHEQ – комплекс для термодинамического моделирования геохимических процессов. Вестник ОГГГГН РАН. 5(15). (URL: http: //www.scgis.ru/ r-ussian/cp1251/h_dggms/5_000/term10).
Поляков В.Б. (1989) Изотопный эффект, лимитируемый диффузией, при протекании гетерогенной реакции в кинетической области. Теория. Химическая физика. 8(11), 1539-1541.
Charlou J.L., Donval J.P., Konn C., Ondréas H., Fouquet Y. (2010) High production and fluxes of H2 and CH4 and evidence of abiotic hydrocarbon synthesis by serpentinization in ultramafic-hosted hydrothermal systems on the Mid-Atlantic Ridge. Diversity of Hydrothermal Systems on Slow-Spreading Ocean Ridges, eds. Rona P., Devey C., Dyment J., Murton B. Washington, DC: American Geophysical Union, 265-296.
Declercq J., Oelkers E.H. (2014) CarbFix Report PHREEQC mineral dissolution kinetics database. Geoscience Environement Toulouse, 197 p.
Delacour A., FruEh-Green G.L., Bernasconi S.M., Schaeffer Ph., Kelley D.S. (2008) Carbon geochemistry of serpentinites in the Lost City Hydrothermal System (30_N, MAR). Geochim. Cosmochim. Acta. 72, 3681-3702.
Etiope G., Sherwood L.B. (2013) Abiotic methane on Earth. Rev. Geophys. 51, 276-299.
Helgeson H.C., Brown T.H., Nigrini A., Jones T.A. (1970) Calculation of mass transfer in geochemical processes involving aqueous solutions. Geochim. Cosmochim. Acta. 34(5), 569-592.
Lasaga A.C. (1981) Transition state theory, in Kinetics of Geochemical Processes. Rev. Mineral. 8, edited by A.C. Lasaga and R.J. Kirkpatrick, 135-169.
McCollom T.M., Klein F., Robbins M., Moskowitz B., Berquoґ T.S., JoEns N., Bach W., Templeton A. (2016) Temperature trends for reaction rates, hydrogen generation, and partitioning of iron during experimental serpentinization of olivine. Geochim. Cosmochim. Acta. 181, 175-200.
McCollom T.M. (2016) Abiotic methane formation during experimental serpentinization of olivine. Proc. Natl. Acad. Sci. USA. 113(49), 13965-13970.
Mironenko M.V., Polyakov V.B., Alenina M.V. (2018) Simultaneous calculation of chemical and isotope equilibria using the GEOCHEQ_Isotope software: carbon isotopes. Geochem. Int. 56(13), 1354-1367.
Proskurowski G. et al. (2008) Abiogenic hydrocarbon production at Lost City hydrothermal field. Science. 319(5863), 604-607.
Rosso J.J., Rimstidt J.D. (2000) A high resolution study of forsterite dissolution rates. Geochim. Cosmochim. Acta. 64(5), 797-811.
Zolotov M.Yu., Mironenko M.V. (2007) Timing of Acid Weathering on Mars: A Kinetic-Thermodynamic Assessment. J. Geophys. Research, [Planets]. 112 E07006, https://doi.org/10.1029/2006JE002882
Дополнительные материалы отсутствуют.


