Геохимия, 2021, T. 66, № 1, стр. 63-72
Геохимическое моделирование поведения урана в подземных водах вблизи шламохранилищ при биоремедиации
А. В. Сафонов a, c, *, А. Е. Богуславский b, К. А. Болдырев c, О. Л. Гаськова b, О. С. Наймушина b, Н. М. Попова a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
b Институт геологии и минералогии им. В.С. Соболева СО РАН
630090 Новосибирск, просп. академ. Коптюга, 3, Россия
c Институт проблем безопасного развития атомной энергетики РАН
115191 Москва, Большая Тульская ул., 52, Россия
* E-mail: alexeysafonof@gmail.com
Поступила в редакцию 10.01.2019
После доработки 29.07.2019
Принята к публикации 08.08.2019
Аннотация
Проведено экспериментальное и компьютерное моделирование процесса биоремедиации водоносных горизонтов, загрязненных нитрат-, сульфат-ионами и ураном в районе шламохранилища Новосибирского завода химконцентратов (НЗХК). С использованием двух компьютерных пакетов программ для геохимического моделирования “HCh” 4.4 (МГУ) и PHREEQC 2.18 (USGS) было установлено, что микробные процессы потребления окислителей (кислорода и нитрат-ионов) приводят к снижению окислительно-восстановительного потенциала до –400 мВ, что является важным фактором для восстановления уранил-ионов и стабилизации урана в виде малорастворимых биогенных осадков, включающих фосфаты кальция, сульфиды железа и сопутствующих тяжелых металлов. Экспериментальное и компьютерное моделирование подтверждается составом минеральных фаз in situ в зоне разгрузки загрязненного водоносного горизонта.
ВВЕДЕНИЕ
На предприятиях ядерного топливного цикла хранение больших объемов твердых радиоактивных отходов после переработки руд и обогащения урана в открытых шламохранилищах приводит к загрязнению анионами минеральных кислот (в основном нитрат- и сульфат-ионами) и ураном окружающей среды, в первую очередь, верхних водоносных горизонтов. Моделирование процессов миграции урана в загрязненных природных водах представляет собой задачу, требующую учета поведения макро- и микрокомпонентов, органического вещества под влиянием биогеохимических процессов, которые могут быть инициированы их поступлением в экосистемы. В подземных водоносных горизонтах мобильность урана, в первую очередь, обусловлена геохимическими параметрами среды миграции (Eh, pH, минерализация, парциальные давления газов), а во вторую – взаимодействиями вода–порода (Abdelouasa et al., 1998; Anderson et al., 2003; Chen et al., 2016). Значительные изменения в геохимическое поведение вносит микробная деятельность, обуславливающая восстановление или окисление многовалентных элементов и образование новых минеральных фаз. Ряд авторов уже включают микробные процессы в прогнозное моделирование условий среды шламохранилищ (Hallbeck, Pedersen, 2012).
Одним из методов восстановления качества вод подземных водоносных горизонтов является in situ биоремедиация, поскольку позволяет эффективно и c низкими затратами иммобилизовать загрязнитель за счет использования метаболических возможностей подземной микрофлоры, путем ее стимулирования нагнетанием в пласты растворимых органических соединений. Этот подход наиболее часто используется для удаления соединений азота и углерода, поскольку позволяет полностью их удалить из экосистемы в виде газов (Dullies et al., 2010; Eschenbach et al., 2015; Gorman-Lewis et al., 2009). При комплексном загрязнении с высоким содержанием нитратов и металлов, метод биоремедиации также применяется и показывает неплохие результаты (Hazen et al., 2018; Holmes et al., 2018). В этом случае исследование поведения всех компонентов системы сложнее, поскольку удаление одного компонента может способствовать увеличению миграционной активности другого. Термодинамическое моделирование позволяет выбрать и обосновать методы очистки конкретных подземных вод и сделать геохимическую оценку окружающей среды шламохранилищ на годы вперед, а также планировать экспериментальные исследования и проводить пилотные испытания.
Созданные к настоящему времени алгоритмы моделирования и компьютерные программы, основанные как на принципе минимизации термодинамического потенциала системы, так и на “константах равновесия химических реакций”, позволяют решать задачи практически любой сложности и моделировать химические процессы различной природы, протекающие одновременно в изучаемой системе. Адекватность модельных описаний (валидация) ограничена полнотой и точностью термодинамических баз данных. В частности, устойчивость аморфных и плохо кристаллизованных веществ достаточно сложно охарактеризовать в моделях.
В пакете программ “HCh”4.4 (HydroChemistry) расчет равновесий основан на минимизации свободной энергии Гибсса системы (Gorman-Lewis et al., 2009). Входящая в пакет база термодинамических данных UNITHERM является пополняемой в зависимости от решаемых задач, есть подпрограммы для согласования термодинамических величин. В программе Gibbs реализован эффективный способ подключения внешних модулей расчета коэффициентов активности через библиотеки динамической загрузки (DLL).
Компьютерная программа для геохимического моделирования PHREEQC 2.18 (pH-REdox-EQuilibrium), авторы David L. Parkhurst и C.A.J. Appelo (USGS) предназначена для оценки форм нахождения элементов в растворах сложного состава (вводятся измеренные значения pH и Eh), насыщенности этих растворов по отношению к различным минералам, газам и твердым растворам, расчета параметров ионного обмена и адсорбции на поверхностях минеральных фаз, одномерного переноса в гидродинамическом потоке (при соответствующем варьировании размера ячеек объема можно моделировать упрощенный двумерный транспорт) и кинетических задач (Parkhurst et al., 2015). PHREEQC базируется на методе решении системы уравнений закона действующих масс и материального баланса. Коррекция ионной силы осуществляется как по уравнению Дебая–Хюккеля, так и по параметрам Питцера.
Целью работы явилось компьютерное моделирование поведения урана в биогеохимических процессах при биоремедиации подземных вод в районе шламохранилища НЗХК, с использованием ПК “HCh” и PHREEQC, и валидация моделей очистки от нитратных и сульфатных стоков.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Хранилище низкоактивных отходов Новосибирского завода химконцентратов (НЗХК) функционирует с 1954 г. Оно включает два последовательно расположенных шламоотстойника; первый был выведен из эксплуатации и осушен с восстановлением территории, а второй подготовлен к выведению в 2019 г. Жидкие отходы производства, содержащие азотную и серную кислоты, после предварительной нейтрализации известковым молоком, сбрасывались в шламохранилища и на протяжении многих лет фильтровались сквозь дно и борта, приводя к загрязнению подземных вод. Подземные воды были отобраны из скважины на расстоянии 15 метров от шламохранилища с глубины 6 м в среднечетвертичных отложениях Краснодубровской свиты, состоящих из прослоев песка, супесей и суглинков. Преобладающими минералами вмещающих осадочных пород являются кварц и полевые шпаты с редкими включениями кальцита. В подчиненных количествах содержатся гидрослюды и глинистые минералы. В пересчете на оксиды, состав этих пород (в мас. %): SiO2 – 64.42, TiO2 – 0.75, Al2O3 – 12.36, Fe2O3 – 4.75, MnO – 0.09, MgO – 2.08, CaO – 4.54, Na2O – 1.08, K2O – 1.94, P2O5 – 0.15, Ba – 0.04, потери при прокаливании (H2O, CO2) – 7.22%. Содержание органического вещества не превышает 0.5 мас. %, сульфидов типа пирита и гидротроилита, меркапто-группы органических сульфидов обнаружено не было.
Во время отбора проб были измерены в поле значения окислительно-восстановительного потенциала, рН, электропроводность с помощью универсального портативного прибора HANNA INSTRUMENTS. Анализ ионного состава вод проводили в ПНИЛ гидрогеохимии НОЦ “Вода” ИПР ТПУ, на базе аналитического центра ИГМ СО РАН выполнен микроэлементный состав вод методами масс-спектрометрии с индуктивно-связанной плазмой (ICP MS) высокого разрешения (ELEMENT FINNIGAN MAT) и атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP-AES) на приборе IRIS Advantage производства фирмы Thermo Jarell Ash Corporation.
Расчеты с использованием двух ПК проводились на основе пробы реальной пластовой жидкости из скважины в районе шламохранилища НЗХК (табл. 1). В пробе воды присутствовали выше значений ПДК нитрат-и сульфат ионы, а также уранил-ионы.
Таблица 1.
Параметры пробы пластовой жидкости (концентрации мг/л)
| pН | Eh, мВ | Cl– | HC${\text{O}}_{3}^{ - }$ | N${\text{O}}_{3}^{ - }$ | S${\text{O}}_{4}^{{2 - }}$ | Ca | Mn | Fe | Cu | Zn | U |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 6.8 | –28 | 590 | 161 | 1124 | 1769 | 561.6 | 2.3 | 10. 7 | 3.2 | 0.31 | 0.0008 |
Лабораторное моделирование биологических процессов в пробах пластовых вод проводили путем стимулирования микробной жизнедеятельности добавлением молочной сыворотки, составом, мг/л: фосфор 78, калий 130, натрий 42, магний 8, кальций 60, железо 0.06, хлор 67 и их культивированием при комнатной температуре. Эксперимент проводили в герметично закрытых 100 мл стеклянных флаконах с пенициллиновой крышкой объемом жидкой фазы 50 мл, газовая фаза изначально была воздушной. Отбор проб для анализа проводили каждые 5–7 дней.
Термодинамическое моделирование при помощи “HCh” проводилось в гетерофазной 17-ти компонентной системе H–O–Ca–Na–Mg–K–Cl–Si–Al–Fe–S–N–C–P–U–Cu–Zn при 25°C и общем давлении 1 бар. Для имитации микробного восстановления использовался виртуальный компонент –СН2О, задавая разное количество, которого, можно снижать окислительно-восстановительный потенциал в закрытой системе (пластовых водах или запаянном экспериментальном сосуде). Теоретически можно ожидать следующие реакции:
(1)
$\begin{gathered} {\text{2}}.{\text{5}}(--{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}) + {\text{2NO}}_{{\text{3}}}^{ - } + {\text{2}}{{{\text{H}}}^{ + }} \to {\text{2}}.{\text{5C}}{{{\text{O}}}_{{{\text{2}}({\text{gas}})}}} + \\ {\text{ + }}\,\,{{{\text{N}}}_{{{\text{2}}({\text{gas}})}}} + {\text{3}}.{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(2)
$\begin{gathered} 0.25\left( { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) + {\text{Fe}}{{\left( {{\text{OOH}}} \right)}_{{{\text{coll}}}}} + 2{{{\text{H}}}^{ + }} \to \\ \to 0.25{\text{C}}{{{\text{O}}}_{2}} + 1.75{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}}, \\ \end{gathered} $(3)
$\begin{gathered} \left( { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) + 0.{\text{5SO}}_{{\text{4}}}^{{{\text{2}} - }} + 0.{\text{5}}{{{\text{H}}}^{ + }} \to 0.{\text{5H}}{{{\text{S}}}^{ - }} + \\ {\text{ + }}\,\,{\text{C}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(4)
$0.{\text{5}}\left( { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) + {\text{UO}}_{{\text{2}}}^{{{\text{2}} + }} \to {\text{U}}{{{\text{O}}}_{{{\text{2}}({\text{s}})}}} + 0.{\text{5C}}{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{ + }},$(5)
${\text{F}}{{{\text{e}}}^{{2 + }}} + 2{\text{H}}{{{\text{S}}}^{ - }} + 0.5{{{\text{O}}}_{2}} \to {\text{Fe}}{{{\text{S}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(6)
$\begin{gathered} 0.{\text{5}}\left( { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) + {\text{NO}}_{{\text{3}}}^{ - } \to \\ \to 0.{\text{5C}}{{{\text{O}}}_{{{\text{2}}({\text{gas}})}}} + {\text{NO}}_{{\text{2}}}^{ - } + 0.{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Роль реакции (1) преобразовать нитрат (важный компонент бактериального питания) в биологически инертный молекулярный азот. В эксперименте мы фиксировали только промежуточную реакцию (6). Ожидается, что реакция (1) будет продолжаться на основе резкого уменьшения концентраций ${\text{NO}}_{{\text{3}}}^{ - }$ до 10 мг/л на 13 день эксперимента.
Процессы (1, 6) полностью связаны с активностью денитрифицирующих бактерий, которые имеют способность сокращать количество нитрата до оксидов азота и азота газообразного. Молярная величина –CH2O была выбрана не в соответствии со стехиометрией реакций (1)–(6), а для воспроизведения наиболее точного окислительно-восстановительного потенциала, измеренного в эксперименте. Например, мы ввели 0.026 моль –CH2O на литр раствора, содержащего исходное количество ${\text{NO}}_{{\text{3}}}^{ - }$ и ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ для достижения Eh +190 мВ.
Расчет индексов насыщения (Saturation Index) – это метод определения того, будет ли вода осаждать минералы или поддерживать их в растворе. Идеальное равновесие – это lg SI = 0, приближение к равновесию оценивается точностью ±0.3.
Расчет состава образующихся фаз проводился согласно каждому шагу эксперимента: исходного раствора с добавленным ураном. В течение эксперимента (4 и 13 дни) и при максимальном понижении Eh до –400 мВ и его стабилизации до конца опытов.
ПК PHREEQC 2.18 использовался для моделирования состава образующихся минеральных фаз (расчет индексов насыщения) в условиях, приближенных к пластовым (12°C и общее давление 2 бар). В расчетах использовалась база термодинамических данных Llnl.dat, конвертированная из базы данных thermo.com.V8.R6.230, созданной в Ливерморской национальной лаборатории США (Lawrence Livermore National Laboratory) в формате программного пакета Geochemist’s Workbench. БД была дополнена следующей реакцией образования отенита (Ca-Autunite) (Gorman-Lewis, 2009)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Расчеты в “HCh”
Расчет составов исходного раствора (табл. 2) показал его возможное пересыщение по отношению к гетиту, куприту и каолиниту, которые находятся в равновесии с кварцем, смесью урановых оксидов, кальцитом и гипсом.
Таблица 2.
Прогностическая оценка образования минеральных фаз в 1л пластовой воды (при Eh 119 мВ, pH 7.1).
| Минерал | Количество образовавшихся тв.мин.фаз, моль | Минерал | SI |
|---|---|---|---|
| Образующиеся фазы | Фазы, образование которых не прогнозируется | ||
| Куприт Cu2O | 2.51 × 10–5 | U3O8 | –0.16 |
| Гетит | 1.92 × 10–4 | Кальцит | –0.25 |
| Каолинит | 7.97 × 10–6 | Гипс | –0.16 |
Согласно термодинамическим расчетам, значения Eh нейтральной точки воды при температуре 25°C должны составлять +400 мВ. При этом, несмотря на большое количество нитратов (1124 мг/л), измеренные на месте пробоотбора значения Eh были ниже расчетных значений и составляли всего +190 мВ. Согласно рис. 1, при данных условиях доминирующая форма азота должна быть N${\text{H}}_{4}^{ + }$. Именно это и показали пересчеты состава модельного раствора, в котором кроме того железо находится в виде 75% ${\text{Fe}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{0}$ и 25% ${\text{FeSO}}_{{\text{4}}}^{0},$ сера в виде ${\text{SO}}_{{\text{4}}}^{{2 - }},$ а уран в виде карбонатных комплексов U(VI). Термодинамический расчет изменения состава раствора после добавления молочной сыворотки показал возможное пересыщение раствора по отношению к тем же минералам из табл. 1, и дополнительно к хлориту (вместо каолинита) и апатиту Ca5(PO4)3(F,OH). Формы нахождения редокс-зависимых микрокомпонентов изменились и перешли в низшие степени окисления – Fe2+, Cu+, Mn2+. Поведение железа должно определяться Eh-буфером Fe2+/FeOOH(s). После добавления сыворотки, уран должен находится в виде комплексов ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{{\text{2}}}^{{{\text{2}} - }}$ и ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{{\text{3}}}^{{{\text{4}} - }}$ 70% и 30% соответственно (pH 6.9) в равновесии с β-UO2.25(s).
Рис. 1.
Схема диаграммы Eh–pH системы N–O–Fe–S-вода, где активность элементов составляет около 0.001 М.
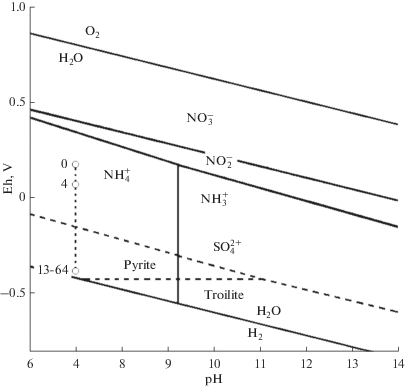
Дальнейшие процессы, протекающие за счет микробного нитратного дыхания (денитрификации) приводят к резкому снижению редокс потенциала среды и образованию новых минеральных фаз с преобладанием сульфидов (пирит, халькопирит и сфалерит). В данных условиях основной формой серы является гидросульфид-ион HS– (табл. 3). Снижение окислительно-восстановительного потенциала до –397 мВ создает предпосылки для процессов метаногенеза (7) и анаэробного окисления аммония до газообразного азота с использованием нитрита в качестве акцептора электронов в бескислородных условиях ANAMMOX процесс (8) (Chen, 2016):
(7)
${\text{HCO}}_{{\text{3}}}^{ - } + {\text{4}}{{{\text{H}}}_{{{\text{2}}({\text{gas}})}}} + {\text{H}} + \to {\text{C}}{{{\text{H}}}_{{{\text{4}}({\text{gas}})}}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$(8)
${\text{NH}}_{{\text{4}}}^{ + } + {\text{NO}}_{{\text{2}}}^{ - } \to {{{\text{N}}}_{{{\text{2}}({\text{gas}})}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Таблица 3.
Ожидаемые твердые фазы и компоненты раствора после микробного стимулирования (при. Eh –397 мВ и pH 7.1)
| Минеральная фаза | Моль/л | Форма в растворе | Моль/л |
|---|---|---|---|
| Пирит | 1.42 × 10–4 | N${\text{H}}_{4}^{ + }$ | 1.76 × 10–5 |
| Сфалерит | 4.62 × 10–6 | H2S | 6.63 × 10–3 |
| Халькопирит | 4.92 × 10–5 | HS– | 1.14 × 10–2 |
| Апатит | 6.84 × 10–6 | Cu(H${\text{S)}}_{2}^{ - }$ | 1.14 × 10–6 |
| Хлорит | 5.31 × 10–6 | C${\text{H}}_{4}^{0}$ | 2.64 × 10–3 |
| Уранинит | 1.68 × 10–5 | U(O${\text{H)}}_{4}^{0}$ | 1.41E–14 |
Использование программного кода PНREEQC позволило провести расчет применительно к пластовым условиям (2 бар, 12°C). Расчет форм нахождения металлов и индексов насыщения минеральных фаз (табл. 3) раствора с введенным ураном 10 мг/л, показал пересыщение по отношению к фосфату уранила (UO2)3(PO4)2 × 4H2O), отениту Ca(UO2)2(PO4)2 ∙ 3H2O, а также многим силикатам, оксидам и оксигидроксидам. Также после добавления сыворотки в пластовые воды возможно пересыщение по новым фосфатным фазам других металлов – стренгиту (FePO4 · 2H2O), фосфату марганца (MnHPO4), гидроксиапатиту Ca5(OH)(PO4)3 (табл. 4). Очевидно, что эти расчеты предполагают возможность образования разнообразных фосфатов, в том числе урана. В реальности же это четче указывает на вероятное осаждение урана сначала с апатитом. Протекание микробных процессов в пласте вследствие потребления кислорода и нитрата должно привести к снижению Eh до –400 мВ, что будет способствовать его пересыщению помимо фосфатов, по отношению к сульфидам железа пириту (FeS2), пирротину (FeS), а также сфалериту и фазам восстановленного урана (нингиониту CaUP2O8 · 2H2O, ураниниту UO2, коффиниту USiO4).
Таблица 4.
Индексы насыщения (SI) растворов по отношению к минеральным фазам (БД PНREEQC с дополнениями авторов)
| Исходный раствор | Смесь сыворотки и раствора (после осаждения отенита по реакции) |
После понижения Eh до –400 мВ | ||||||
|---|---|---|---|---|---|---|---|---|
| название | SI | формула | название | SI | формула | название | SI | формула |
| Фосфат уранила | 1.83 | (UO2)3(PO4)2 · 4H2O | Андрадит | 2.18 | Ca3Fe2(SiO4)3 | Алабандит | 0.61 | MnS |
| Отенит | 5.39 | Ca(UO2)2(PO4)2 · 3H2O | Феррит кальция | 5.37 | CaFe2O4 | Шамозит | 4.17 | Fe2Al2SiO5(OH)4 |
| Шамозит | 10.8 | Fe2Al2SiO5(OH)4 | Гетит | 1.46 | FeOOH | Гидроксилапатит | 0.74 | Ca5(OH)(PO4)3 |
| Лимонит | 0.77 | Fe(OH)3 | Гидроксилапатит | 7.48 | Ca5(OH)(PO4)3 | Марганец гидрофосфат | 2.47 | MnHPO4 |
| Гетит | 5.88 | FeOOH | Магнетит | 7.11 | Fe3O4 | Нингетит | 7.31 | CaUP2O8 ⋅ 2H2O |
| Хайвиайт | 0.82 | Ca(UO2)2(Si2O5)3 · 5H2O | Манганит | 2.33 | MnO(OH) | Пирит | 3.75 | FeS2 |
| Гематит | 1.34 | Fe2O3 | Марганец гидрофосфат | 3.44 | MnHPO4 | Пирротин | 1.03 | FeS |
| Хайвиайт | 2.24 | CaFe2O4 | Стренгит | 1.65 | FePO4·2H2O | Сфалерит | 8.60 | ZnS |
| Гидроксилапатит | 2.25 | Ca5(OH)(PO4)3 | Вайтлокит | 1.40 | Ca3(PO4)2 | Троилит | 4.59 | FeS |
| Марганец гидрофосфат | 2.52 | MnHPO4 | Марганец гидрофосфат | 3.44 | MnHPO4 | Уранинит | 10.5 | UO2 |
| Соддиит | 3.88 | (UO2)2SiO4 · 2H2O | – | – | Вайтлокит | 4.69 | Ca3(PO4)2 | |
| Магнетит | 11.60 | Fe3O4 | – | – | – | – | ||
При этом, окисление органического вещества вследствие микробной жизнедеятельности должно приводить к образованию углекислого газа (минерализации ОВ). Карбонат-ионы теоретически могут способствовать стабилизации шестивалентного урана в виде карбонатных комплексов. Для оценки возможности протекания этого процесса был проведен расчет эффекта добавления органического вещества (молочной сыворотки) с концентрацией, превышающей необходимую для полного восстановления нитрата и сульфата. На основании расчета (добавление 0.6 г/л сыворотки) произошло полное восстановление нитратов, повлекшее снижение редокс-потенциала до –200 мВ и образование избыточного количества углекислого газа (до 5.20–2 моль/л). Это привело к тому, что значения рН снизились до 5.95. Однако, после полного потребления органики наблюдалось недосыщенность системы по углекислому газу, что дало возможность резкого снижения количества карбонатных комплексов урана(VI) до 10–12 моль/л (табл. 5). При этом уменьшение содержания форм U(IV) не наблюдалось.
Таблица 5.
Концентрация (моль/л) карбонатных форм в модельном растворе и индексы насыщения осадков (0.6 г/л –CH2O)
| Форма карбонатов в растворе | Концентрация | Минеральная фаза осадка |
Индекс насыщения |
|---|---|---|---|
| HC${\text{O}}_{3}^{ - }$ | 1.668 × 10–2 | Аргонит (CaCO3) | 0.61 |
| CO2 | 4.109 × 10–3 | Кальцит (CaCO3) | 0.75 |
| CaHCO3 | 7.754 × 10–4 | Дафнит NaAlCO3(OH)2 | 2.71 |
| NaHCO3 | 5.515 × 10–4 | Доломит CaMg(CO3)2 | 0.18 |
| FeHC${\text{O}}_{3}^{ + }$ | 1.191 × 10–4 | Родохрозит MnCO3 | 0.17 |
| CaCO3 | 3.901 × 10–5 | Сидерит FeCO3 | 0.34 |
| C${\text{O}}_{3}^{{2 - }}$ | 1.083 × 10–5 | – | – |
| FeCO3 | 3.314 × 10–6 | – | – |
| MgHC${\text{O}}_{3}^{ + }$ | 2.303 × 10–6 | – | – |
| MnCO3 | 1.389 × 10–6 | – | – |
| MnHC${\text{O}}_{3}^{ + }$ | 1.174 × 10–6 | – | – |
| NaC${\text{O}}_{3}^{ - }$ | 5.538 × 10–7 | – | – |
| ZnHC${\text{O}}_{3}^{ + }$ | 3.008 × 10–7 | – | – |
| MgCO3 | 5.397 × 10–8 | – | – |
| ZnCO3 | 2.521 × 10–8 | – | – |
| CuCO3 | 1.752 × 10–10 | – | – |
| UO2(CO3$)_{3}^{ - }$ | 4 2.050 × 10–12 | – | – |
| UO2(CO3$)_{2}^{ - }$ | 5.881 × 10–13 | – | – |
Результаты лабораторной валидации
В нашей предыдущей работе (Сафонов и др., 2019) подробно описаны результаты лабораторного моделирования биогенных процессов при добавлении сыворотки в пластовую жидкость (рис. 2).
Рис. 2.
Динамика экспериментальных изменений в значениях концентрации нитратов, нитритов и сульфатов и окислительно-восстановительного потенциала в пластовой жидкости (опробованная скважина). Левая ось соответствует концентрациям, а правая ось относится к окислительно-восстановительному потенциалу в мВ.

Исходный раствор содержал, мг/л: 1124 ${\text{NO}}_{{\text{3}}}^{ - },$ 1769 ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ 161 ${\text{HCO}}_{{\text{3}}}^{ - },$ натрий 217, кальций 577, железо 10.7, хлор 590, а также другие элементы в незначительном количестве при рН 6.8 и окислительно-восстановительном потенциале +190 мВ. Поскольку азот и фосфор являются двумя наиболее распространенными питательными веществами в естественных экосистемах, способные стимулировать развитие микробных процессов на 4-й день после добавления сыворотки, мы зафиксировали потребление оставшегося кислорода и части нитрата (на 200 мг/л), что привело к снижению значений Eh до +115 мВ (рис. 2, точка 4) и появлению ${\text{NO}}_{{\text{2}}}^{ - }$ в количестве 146 мг/л. Переходное накопление нитрита было обнаружено в пробах из-за более высокой скорости восстановления нитрата до нитрита, чем нитрита до NO(газ) или N2(газ) (Yi et al., 2007). В ходе данной стадии эксперимента отмечается выпадение светлого осадка – фаза 1. Концентрация сульфатной серы не менялась на первых этапах. Резкие изменения состава растворов и твердых фаз происходят на 13-й день (рис. 2, точка 13 дней) – снижение ${\text{NO}}_{{\text{3}}}^{ - }$ до 5 мг/л и ${\text{NO}}_{{\text{2}}}^{ - }$ до 0.1 мг/л. Концентрация сульфатной серы уменьшается незначительно (на 300 мг/л). Значения ОВП достигли значений ‒400 мВ. При таких значениях, согласно геохимическим расчетам, доминирующая форма урана должна быть UO2(s) в твердой фазе. Влияние факторов окружающей среды, включая рН и сосуществующих ионов на процессы биоредукции урана U(VI) (ПБУ) обсуждалось в (Yi et al., 2007). Отмечено, что биоосаждение сильно зависит от рН, увеличиваясь с 12.9 до 99.4% при рН 2 и 6 соответственно Концентрация сульфата <4000 мг/л не влияла на ПБУ, ингибирования ПБУ не наблюдалось, а уранинит был обнаружен в осажденных сульфидах металлов при концентрациях цинка 20 мг/л или меди 10 мг/л. Уранинит не обнаруживается до удаления нитрата, что указывает на то, что нитрат сильно ингибировал ПБУ. Ранее было показано (Abdelouasa et al., 1998), что разновидности ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{{\text{2}}}^{{{\text{2}} - }}$ и ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{{\text{3}}}^{{{\text{4}} - }}$ при рН 7 трудно восстановить сульфидом напрямую, они требуют ферментативного восстановления через путь переноса электронов. Снижение концентрации сульфата серы сопровождалось выпадением темного осадка, который отлагался поверх ранее выпавшей фазы 1, мы обозначили его как фазу 2.
Для проверки применимости модельных расчетов был выполнен рентгенофлуоресцентный анализ (РФА) твердых фаз после экспериментов (табл. 6). Выявлено две доминирующие фазы. Данные сканирующего электронного микроскопа (СЭМ) показали, что описанные фазы отличаются как по морфологии, так и по составу частиц. Первая фаза (рис. 3а), содержит более высокие концентрации фосфора и кальция, вторая фаза (рис. 3в) содержит существенно больше серы, в ней появляются высокие концентрации урана.
Таблица 6.
Элементный анализ EDX-спектров, приведенных на рис. 3
| № спектров |
Рис. | Элементы, мас. % | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Si | Al | Fe | Mg | Ca | Na | K | Ni | U | P | S | Cl | O | ||
| 1 | Ris 3 A | 0.38 | 0.33 | 0.29 | 1.87 | 24.21 | 0.98 | 0.15 | n.o. | n.o. | 15.19 | 0.20 | 0.19 | 56.21 |
| 2 | Ris 3 A | 0.42 | 0.33 | 0.37 | 1.71 | 24.53 | 0.99 | 0.12 | n.o. | n.o. | 14.95 | 0.20 | 0.16 | 56.22 |
| 3 | Ris 3 B | 0.74 | n.o. | 0.47 | 2.19 | 20.79 | 6.07 | 0.40 | n.o. | 2.20 | 11.15 | 1.79 | 1.53 | 52.67 |
| 4 | Ris 3 B | 0.92 | n.o. | 0.78 | 2.19 | 18.00 | 6.76 | 0.88 | n.o. | 5.36 | 10.41 | 2.42 | 1.77 | 50.51 |
| 5 | Ris 3 B | 0.96 | n.o. | 0.64 | 2.29 | 19.43 | 6.56 | 0.64 | 0.34 | 5.23 | 11.12 | 2.20 | 1.65 | 48.95 |
Рис. 3.
СЭМ-снимок двух типов частиц после микробного стимулирования (а) первая фаза, (б) вторая. Номерами указаны включения (табл. 6).

Светлый цвет первой твердой фазы обусловлен осаждением апатита Ca5(PO4)3(OH, Cl); осаждение урана подтверждается в количестве 4.5% (по расчетам как нестехиометрический гидроксид или примесь фосфатов урана в апатите), следы серы обусловлены небольшим количеством гипса. Темная фаза обогащена железом и серой из-за осаждения сульфидных минералов; в ней меньше урана (по расчетам оксидов, фосфатов или силикатов). Будущее исследование должно дать оценку стабильности этих новых фаз U(IV) в естественных осадочных разрезах, подверженных окислительно-восстановительному изменению.
Во время окислительно-восстановительных экспериментов мы оценили относительное время связывания (удаления) различных загрязняющих веществ при помощи биостимуляции. Попытка точно воспроизвести условия эксперимента в термодинамической модели удалась частично, поскольку при измеренном Eh +190 мВ должен быть ${\text{NH}}_{{\text{4}}}^{ + },$ а не нитрат. Второе, в природе идет более медленное восстановление ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ несмотря на резко отрицательный потенциал на 13-й день эксперимента. Это означает электрохимическое неравновесие в экспериментальном растворе (Eh уже очень низкий на 13 день, а серы все еще много в растворе).
Данные термодинамического моделирования подтверждаются также и натурными наблюдениями. В отложениях, отобранных в зоне разгрузки загрязненных вод из описываемого водоносного горизонта обнаружен ряд минеральных фаз. Данные сканирующего электронного микроскопа (СЭМ) показали наличие F-апатита размером до 30 мкм и микрочастиц хлорита в виде включений в мусковите, а также микрочастиц оксида урана(IV) размером до 15–25 мкм (рис. 3). Составы отдельных фаз приведены в табл. 7.
Таблица 7.
Элементный анализ EDX-спектров, приведенных на рис. 4
| № спектра | O | F | Na | Mg | Al | Si | P | S | K | Ca | Fe | Ba | U | Минерал |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 42.67 | <0.1 | 0.39 | 0.63 | 0.59 | 0.52 | 3.52 | 1.28 | <0.1 | 9.69 | 17.16 | <0.1 | 22.98 | Оксид |
| 2 | 38.65 | 3.72 | <0.1 | <0.1 | 0.12 | 0.17 | 18.31 | <0.1 | <0.1 | 38.81 | 0.22 | <0.1 | <0.1 | Апатит |
| 3 | 47.95 | <0.1 | 0.23 | 1.09 | 17.44 | 22.46 | <0.1 | <0.1 | 9.13 | <0.1 | 1.4 | <0.1 | <0.1 | Мусковит |
| 4 | 53.48 | <0.1 | <0.1 | <0.1 | 0.07 | 46.29 | <0.1 | <0.1 | <0.1 | <0.1 | 0.16 | <0.1 | <0.1 | Кварц |
| 5 | 48.03 | <0.1 | 0.2 | 1.61 | 16.66 | 22.34 | <0.1 | <0.1 | 8.61 | 0.08 | 2.18 | <0.1 | <0.1 | Мусковит |
| 6 | 48.27 | <0.1 | <0.1 | 1.39 | 16.71 | 22.21 | <0.1 | <0.1 | 9.27 | <0.1 | 1.53 | 0.41 | <0.1 | Мусковит |
| 7 | 53.16 | <0.1 | <0.1 | <0.1 | 0.18 | 46.66 | <0.1 | <0.1 | <0.1 | <0.1 | <0.1 | <0.1 | <0.1 | Кварц |
| 8 | 47.6 | <0.1 | 0.15 | 3.13 | 15.44 | 21.75 | <0.1 | <0.1 | 5.73 | 0.25 | 5.67 | <0.1 | <0.1 | Мусковит |
| 9 | 49.28 | <0.1 | 0.4 | 0.91 | 17.28 | 22.31 | <0.1 | <0.1 | 8.04 | <0.1 | 1.26 | <0.1 | <0.1 | Мусковит |
| 10 | 45.49 | <0.1 | 0.52 | 8.18 | 11.8 | 19.72 | <0.1 | <0.1 | 1.03 | 0.38 | 12.89 | <0.1 | <0.1 | Хлорит |
Рис. 4.
СЭМ-снимок отложений краснодубровской свиты в зоне разгрузки грунтовых вод вблизи шламохранилища. Номерами указаны включения (табл. 7).

Согласно (Carpenter et al., 2015) осадки сульфида железа, образовавшиеся в условиях восстановления сульфата, могут создать буфер нерастворимых твердых фаз и предотвратить повторное окисление U(IV) даже если окислители снова внедряются в зону восстановленных пластовых вод. Восстановление сульфата, по-видимому, должно отставать от восстановления нитратов, при этом, исходное содержание тяжелых металлов в пробах для образования их сульфидов было достаточно низким, г/л – железо 10.7, медь 3.2 и цинк 0.31. Известно, что в ряде случаев нитрат является сильным ингибитором активности сульфат-восстанавливающих бактерий (СВБ), что можно объяснить с точки зрения термодинамики путем сравнения парциальной фугитивности fO2 в реакциях:
(9)
${\text{2NO}}_{{\text{3}}}^{ - }\, + \,{\text{2}}{{{\text{H}}}^{ + }} \to {{{\text{N}}}_{{{\text{2}}({\text{gas}})}}} + {\text{2}}.{\text{5}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}~\,\,\,{\text{lg}}{{{\text{f}}}_{{{{{\text{O}}}_{{\text{2}}}}}}} - {\text{4}}.{\text{5}},$(10)
${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }} + {{{\text{H}}}^{ + }} \to {\text{H}}{{{\text{S}}}^{ - }} + {\text{2}}{{{\text{O}}}_{{\text{2}}}}\,\,\,\,{\text{lg}}{{{\text{f}}}_{{{{{\text{O}}}_{{\text{2}}}}}}} - {\text{69}}.{\text{8}},$(11)
$\begin{gathered} \left( {{\text{U}}{{{\text{O}}}_{{\text{2}}}}} \right)\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{{\text{2}}}^{{ - {\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{U}}{{{\text{O}}}_{{{\text{2}}({\text{s}})}}} + {{{\text{O}}}_{{\text{2}}}} + \\ + \,\,{\text{2}}{{\left( {{\text{HC}}{{{\text{O}}}_{{\text{3}}}}} \right)}^{ - }}\,\,\,\,{\text{lg}}{{{\text{f}}}_{{{{{\text{O}}}_{{\text{2}}}}}}} - {\text{47}}.{\text{8}}. \\ \end{gathered} $Таким образом, на основе моделирования, добавление питательной молочной сыворотки в пластовую жидкость может привести к интенсивному развитию микрофлоры, осуществляющей процесс денитрификации, сопровождающийся снижением редокс-потенциала. После удаления нитрат-ионов возможно протекание процесса сульфатредукции. В результате данных процессов предсказано восстановление урана в виде малорастворимых соединений, стабилизированных минеральными фазами сульфидов железа и других тяжелых металлов.
ЗАКЛЮЧЕНИЕ
Термодинамическая модель процесса нейтрализации загрязняющих веществ в подземных водах во время стимулированных микробных окислительно-восстановительных процессов построена c использованием двух ПК. Рассчитаны формы нахождения переменно-валентных элементов U, N, S, и Fe в растворах и твердых фазах. Установлено, что микробные процессы потребления окислителей (кислорода и нитрат-ионов) приводят к снижению окислительно-восстановительного потенциала до –400 мВ, что является важным фактором для восстановления уранил-ионов и стабилизации урана в виде малорастворимых биогенных осадков, включающих фосфаты кальция, сульфиды железа и сопутствующих тяжелых металлов.
Разработанную модель можно использовать в качестве отправной точки для оценки поведения группы элементов чувствительных к окислительно-восстановительным реакциям в процессе биоремедиации. Использование денитрифицирующих и сульфатредуцирующих микроорганизмов для очистки загрязненных вод может быть решением для ремедиации в других техногенных средах.
Аналитические работы (измерения) выполнены на оборудовании ЦКП ФМИ ИФХЭ РАН и ЦКП Многоэлементных и изотопных исследований СО РАН.
Работа выполнена по государственному заданию ИГМ СО РАН, ИФХЭ РАН (тема № АААА-А16-11611091001). Исследования проведены при финансовой поддержке РФФИ, грант № 17-05-00707.
Список литературы
Лиманцева О.А., Алексеева Н.В., Платонова А.В. (2018) Анализ гидрогеохимических условий нижнесреднекембрийского водоносного комплекса на Талаканском нефтегазоконденсатном месторождении по результатам термодинамического моделирования. Материалы конференции Геологическая эволюция взаимодействия воды с горными породами. С. 276-279.
Abdelouasa A., Yongming Lu, Lutze W., Nuttall H.E. (1998) Reduction of U (VI) to U (IV) by indigenous bacteria in contaminated ground water. J. Cont. Hydr. 35(1–3), 217-233.
Anderson R.T., Vrionis H.A., Ortiz-Bernad I., Resch C.T., Long P.E., Dayvault R., Karp K., Marutzky S., Metzler D.R., Peacock A., White D.C., Lowe M., Lovley D.R. (2003) Stimulating the in situ activity of Geobacter species to remove uranium from the groundwater of a uranium-contaminated aquifer. Appl. environ. microbiol. 69(10), 5884-5891.
Carpenter J., Bi Y., Hayes. K.F. (2015) Influence of iron sulfides on abiotic oxidation of UO2 by nitrite and dissolved oxygen in natural sediments. Environ. Sci.&Tech. 49(2), 1078-1085.
Chen C., Sync F., Zhang H., Wang J., Shen Y., Liang X. (2016) Evaluation of COD effect on anammox process and microbial communities in the anaerobic baffled reactor (ABR). Bioresource tech. 216, 571-578.
Cho K.C., Fuller M.E., Hatzinger P.B., Chu K.H. (2016) Identification of groundwater microorganisms capable of assimilating RDX-derived nitrogen during in-situ bioremediation. Sci. Total Environ. 569, 1098-1106.
Dixit R., Wasiullah, Malaviya D., Kuppusamy P., Udai B.S., Asha S., Renu S., Bhanu P.S., Jai P.R., Pawan K.S., Harshad L., Diby P. (2015) Bioremediation of heavy metals from soil and aquatic environment: an overview of principles and criteria of fundamental processes. Sustainability. 7(2), 2189-2212.
Dullies F., Lutze W., Gong W., Nuttall H.E. (2010) Biological reduction of uranium – From the laboratory to the field. Sci. Total Environ. 408(24), 6260-6271.
Eschenbach W., Well R., Walther W. (2015) Predicting the denitrification capacity of sandy aquifers from in situ measurements using push–pull 15 N tracer tests. Biogeosciences. 12(8), 2327-2346.
Gorman-Lewis D. Shvareva T., Kubatko K.A., Burns P.C., Wellman D.M., Mcnamara B., Szymanowski J.E., Navrotsky A., Fein J.B. (2009) Thermodynamic properties of autunite, uranyl hydrogen phosphate, and uranyl orthophosphate from solubility and calorimetric measurements. Environ. Sci.&Tech. 43(19), 7416-7422.
Hallbeck L., Pedersen K. (2012) Culture-dependent comparison of microbial diversity in deep granitic groundwater from two sites considered for a Swedish final repository of spent nuclear fuel. FEMS microbiol. ecol. 81(1), 66-77.
Hazen T.C. (2018) In situ: groundwater bioremediation. Consequences of Microbial Interactions with Hydrocarbons, Oils, and Lipids: Biodegradation and Bioremediation. (Ed. Steffan R.). Springer, 1-18.
Holmes D.E., Orelana R., Giloteaux L., Wang L.Y., Shrestha P., Williams K., Lovley D.R., Rotaru A.E. (2018) Potential for Methanosarcina to contribute to uranium reduction during acetate-promoted groundwater bioremediation. Microb. Ecol. 76(3), 1-8.
Kulshreshtha A., Agrawal R., Barar M., Saxena S. (2014) A review on bioremediation of heavy metals in contaminated water. IOSR J. Environ. Sci., Toxicol.&Food Technol. 8(7), 44-50.
Parkhurst D. L., Wissmeier L. Phreeq R.M. (2015) A reaction module for transport simulators based on the geochemical model PHREEQC. Adv. Water Res. 83, 176-189.
Senko J.M., Jonathan D.I., Joseph M.S., Krumholz L.R. (2002) In-situ evidence for uranium immobilization and remobilization. Environ. Sci.&Tech. 36(7), 1491-1496.
Sodov A., Gaskova O., Vladimirov A., Battushig A., Moroz E. (2016) Spatial Distribution of Uranium and Metalloids in Groundwater near sandstone-type uranium deposits, Southern Mongolia. Geochem. J. 50(5), 393-401.
Yi Z.J., Tan K.X., Tan A.L., Yu Z.X., Wang S.Q. (2007) Influence of environmental factors on reductive bioprecipitation of uranium by sulfate reducing bacteria. Int. Biodeter.&Biodegrad. 60(4), 258-266.
Дополнительные материалы отсутствуют.


