Геохимия, 2021, T. 66, № 10, стр. 926-937
Фазовое фракционирование химических элементов в зонах смешения кислых вулканических и морских вод (по данным экспериментального моделирования)
А. В. Савенко a, *, В. С. Савенко b, О. С. Покровский c, d
a Московский государственный университет им. М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские горы, Россия
b Московский государственный университет им. М.В. Ломоносова, Географический факультет
119991 Москва, Ленинские горы, Россия
c Федеральный исследовательский центр комплексного изучения Арктики РАН
163000 Архангельск, наб. Северной Двины, 23, Россия
d Национальный исследовательский Томский государственный университет
634050 Томск, просп. Ленина, 36, Россия
* E-mail: Alla_Savenko@rambler.ru
Поступила в редакцию 02.10.2019
После доработки 03.09.2020
Принята к публикации 03.09.2020
Аннотация
Проведены эксперименты по моделированию фазового фракционирования микроэлементов (Mn, Co, Ni, Cu, Zn, Cd, Pb, Tl, Ga, Y, редкоземельные элементы, V, As, Sb, U) в процессе взаимодействия кислых вулканических вод с морской водой, сопровождающемся последовательным осаждением гидроксидов железа и алюминия. Показано, что соосаждение различных микроэлементов с гидроксидами железа и алюминия происходит с разной эффективностью. Наиболее резкие отличия характерны для галлия и редкоземельных элементов: галлий преимущественно входит в состав гидроксида железа, редкоземельные элементы – гидроксида алюминия. Установлено, что на степень соосаждения микроэлементов, помимо величины pH, влияет относительная доля объема морской воды, увеличение которой предположительно приводит к смещению адсорбционных равновесий и, как следствие этого, к изменению эффективности соосаждения.
Характерной чертой наземного вулканизма служит выделение больших количеств кислых газов (HCl, HF, SO2 и др.), которые в силу хорошей растворимости в воде создают высокую кислотность значительной части термальных источников и расположенных вблизи вулканов поверхностных водотоков (ручьев и небольших речек). Как вулканические эксгаляции, так и кислые вулканические воды химически чрезвычайно агрессивны и при взаимодействии с твердыми продуктами вулканизма – пеплами, туфами, лавами – выщелачивают макро- и микроэлементы, составляющие основную массу растворенных веществ. В процессе выщелачивания происходит нейтрализация растворов, которая сопровождается осаждением собственных твердых фаз некоторых элементов, например, гидроксидов железа(III) и алюминия (Набоко, Филькова, 1966; Борисенков, 1967; Никитина, 1978; Фазлуллин, 1999а). Если нейтрализация не завершается на суше и кислые вулканические водотоки достигают моря, процесс продолжается за счет щелочного резерва морской воды. В результате в зоне смешения вод кислых вулканических водотоков с морской водой возникает кислотно-основной геохимический барьер. Это явление было описано К.К. Зеленовым (1958), наблюдавшим в прибрежных водах о. Парамушир (Охотское море) образование зон последовательного осаждения вначале гидроксидов железа, а затем гидроксидов алюминия на разном удалении от устья р. Юрьева, воды которой имели высокую кислотность и значительное содержание растворенных железа, алюминия и других металлов. Впоследствии было установлено, что нейтрализация вод кислых вулканических водотоков морской водой представляет собой широко распространенное явление, играющее заметную роль в геохимии океана (Зеленов, 1972; Никитина, 1978; Миклишанский и др., 1989; Фазлуллин, Савенко, 1992; Шулькин и др., 1992а, б; Шулькин, 1995; Фазлуллин, 1999б).
С гидроксидами железа и алюминия могут с разной эффективностью соосаждаться многие микроэлементы. При этом происходит фазовое фракционирование – разделение химических элементов, обусловленное изменением их фазового состояния в миграционных потоках. По данным натурных наблюдений количественно охарактеризовать процесс фазового фракционирования трудно, поскольку в естественных условиях в морской воде присутствует взвешенное вещество терригенного и биогенного происхождения, которое содержит значительную часть микроэлементов примерно в тех же количествах, что и хемогенные гидроксиды из зон смешения кислых вулканических и морских вод (Савенко, 1988; Миклишанский и др., 1989). Цель настоящей работы состояла в экспериментальном определении параметров межфазового (раствор – осадки гидроксидов) распределения микроэлементов в процессе нейтрализации кислых вулканических вод щелочным резервом морской воды.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
В экспериментах использовали искусственную бескарбонатную морскую воду с соленостью ~35‰ и модельный раствор, имитирующий состав кислых вод р. Юрьева. В табл. 1 приведены количества солей для приготовления 1 л модельного раствора, а в табл. 2 показаны концентрации главных растворенных компонентов в полученном таким образом модельном растворе, которые сравниваются с их содержанием в водах р. Юрьева выше устья по данным многолетних наблюдений. Ориентируясь на имеющиеся сведения по содержанию в водах р. Юрьева микроэлементов (табл. 3), в 1 л модельного раствора вводили небольшие аликвоты стандартных растворов элементов с концентрациями 100 мкг/мл: Со, Cd, Y, редкоземельные элементы, Tl, V, As, Sb, U – по 0.1 мл; Ni – 0.35 мл, Cu – 0.60 мл, Zn – 8.0 мл, Pb – 0.30 мл, Ga – 0.88 мл. Более низкое по сравнению с природным уровнем содержание мышьяка имело целью облегчить сравнение поведения сходных по химическим и геохимическим свойствам мышьяка и сурьмы. Одинаковые концентрации редкоземельных элементов также были созданы для удобства выявления возможных различий их поведения в ходе смешения кислых вулканических и морских вод. Для достижения равновесия и стабильности концентраций растворенных компонентов модельный раствор после добавления микроэлементов выдерживали при комнатной температуре в течение 4 мес., после чего фильтровали через запаренный плотный бумажный фильтр “синяя лента”. Концентрации железа, алюминия и микроэлементов в искусственной морской воде, модельном растворе “р. Юрьева”, а также в использованных при проведении химико-аналитических процедур разбавленной 1 : 4 азотной кислоте марки ос. ч. и дистиллированной воде приведены в табл. 3.
Таблица 1.
Содержание главных компонентов в модельном растворе “р. Юрьева”
| Раствор (соль) | Аликвота (навеска) на 1 л | Концентрация, мМ |
|---|---|---|
| H2SO4, 1 М | 5 мл | 5 |
| HCl, 1 М | 15 мл | 15 |
| NaCl | 0.217 г | 3.71 |
| KCl | 0.107 г | 1.44 |
| MgSO4 ⋅ 7H2O | 0.552 г | 2.24 |
| CaCl2 | 0.386 г | 3.48 |
| Al2(SO4)3 ⋅ 18H2O | 2.165 г | 3.25 |
| Fe(NH4)(SO4)2 ⋅ 12H2O | 0.964 г | 2.00 |
| MnCl2 ⋅ 4H2O, 5.0 г Mn/л | 1 мл | 0.091 |
| SiO2, 1.7 мМ | 500 мл | 0.85 |
Таблица 2.
Концентрации главных компонентов в модельном растворе и водах р. Юрьева
| Компонент | Модельный раствор “р. Юрьева” | Р. Юрьева (Фазлуллин, 1999а) | |
|---|---|---|---|
| среднее | диапазон | ||
| pH | 1.60 | 1.70 | 1.36–2.02 |
| Концентрация, мг/л | |||
| ${{{\text{Н}}}^{ + }}$ | 25.0 | 20.0 | 43.7–9.5 |
| ${\text{N}}{{{\text{a}}}^{ + }}$ | 85.3 | 85.4 | 27.0–151 |
| ${{{\text{K}}}^{ + }}$ | 56.3 | 56.3 | 20.0–92.5 |
| ${\text{M}}{{{\text{g}}}^{{{\text{2}} + }}}$ | 54.4 | 54.5 | 23.1–86.0 |
| ${\text{C}}{{{\text{a}}}^{{{\text{2}} + }}}$ | 139 | 139 | 54.0–200 |
| ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ | 2020 | 3740 | 1190–5060 |
| ${\text{C}}{{{\text{l}}}^{ - }}$ | 961 | 1080 | 419–1700 |
| ${\text{Si}}{{{\text{O}}}_{{\text{2}}}}$ | 51.0 | 47.8 | 7.0–71.9 |
| ${\text{A}}{{{\text{l}}}^{{3 + }}}$ | 176 | 312 | 112–486 |
| ${\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}$ | 112 | 152 | 62.8–243 |
| ${\text{M}}{{{\text{n}}}^{{{\text{2}} + }}}$ | 5.0 | 6.1 | 1.2–22.0 |
Таблица 3.
Концентрации железа, алюминия и микроэлементов в бидистилляте, азотной кислоте 1 : 4, бескарбонатной искусственной морской воде, модельном растворе и природных водах р. Юрьева, мкг/л
| Элемент | H2O | HNO3 1 : 4 | 35‰ морская вода | Модельный раствор “р. Юрьева” | Природные воды р. Юрьева |
|---|---|---|---|---|---|
| Fe | 0.20 | 2.73 | 1.02 | 111 700 | 153 000 (62 800–242 900)*, 173 000** |
| Al | 0.71 | 6.97 | 6.66 | 175 500 | 312 500 (111 800–486 100)* |
| Mn | 0.03 | 0.06 | 49.8 | 5000 | 6080 (1200–22 000)*, 366** |
| Co | 0.001 | 0.003 | 0.08 | 15.0 | 3.7** |
| Ni | 0.010 | 0.089 | 1.9 | 35.0 | 35* |
| Cu | 0.07 | 0.16 | 5.6 | 60.0 | 23 (10–40)*, 10.2** |
| Zn | 1.33 | 7.31 | 74 | 800 | 470 (200–1000)*, 610** |
| Cd | 0.001 | 0.001 | 0.28 | 10.0 | – |
| Pb | 0.01 | 0.05 | 3.2 | 30.0 | 14 (10–20)* |
| Tl | Не опр.*** | Не опр. | 0.08 | 10.0 | – |
| Ga | Не опр. | 0.001 | 0.022 | 88.0 | 32** |
| Y | Не опр. | 0.001 | 0.009 | 10.0 | – |
| La | Не опр. | 0.004 | 0.002 | 10.0 | 35** |
| Ce | Не опр. | 0.002 | 0.002 | 10.0 | 81** |
| Pr | Не опр. | Не опр. | Не опр. | 10.0 | 8.6** |
| Nd | Не опр. | 0.003 | 0.002 | 10.0 | – |
| Sm | Не опр. | Не опр. | Не опр. | 10.0 | 7.1** |
| Eu | Не опр. | Не опр. | 0.004 | 10.0 | 2.4** |
| Tb | Не опр. | Не опр. | 0.004 | 10.0 | 1.3** |
| Gd | Не опр. | Не опр. | 0.002 | 10.0 | – |
| Dy | Не опр. | Не опр. | 0.003 | 10.0 | 14** |
| Ho | Не опр. | Не опр. | 0.003 | 10.0 | 1.6** |
| Er | Не опр. | Не опр. | 0.003 | 10.0 | 4.5** |
| Тm | Не опр. | Не опр. | Не опр. | 10.0 | – |
| Yb | Не опр. | Не опр. | 0.001 | 10.0 | 4.6** |
| Lu | Не опр. | Не опр. | Не опр. | 10.0 | 0.83** |
| V | 0.002 | 0.007 | 0.71 | 10.0 | – |
| As | 0.0025 | 0.0016 | 0.21 | 10.0 | 1200 (650–2010)*, 162** |
| Sb | 0.006 | 0.009 | 0.22 | 10.0 | 0.5** |
| U | 0.0002 | 0.0007 | 0.0018 | 10.0 | 3.4** |
В колбы с широким горлом вносили разные объемы (от 40 до 490 мл) морской воды с соленостью 35‰, лишенной бикарбонатов, и добавляли по 10 мл модельного раствора “р. Юрьева”. Затем при интенсивном перемешивании (барботаже), использующемся для удаления образующейся при нейтрализации СО2 и ускорения установления равновесия, вводили 1.7–6.5 мл 0.2 М NaHCO3, после чего сразу начиналось образование осадка гидроксидов. Всего было выполнено 8 экспериментов.
Для получения однородных проб через сутки осадок взмучивали и при поддержании постоянной концентрации взвеси отфильтровывали 5–50 мл раствора через мембранный ацетат-целлюлозный фильтр 0.45 мкм МФАС-ОС-1 “Владипор” так, чтобы во всех пробах на фильтре осталось примерно одинаковое количество осадка. Фильтрат, состав которого соответствовал содержанию растворенных компонентов, помещали в полипропиленовые флаконы с предварительно внесенными туда аликвотами HNO3 1 : 4 (0.25 мл на 8 мл пробы) и анализировали. Насадку с фильтром промывали дистиллированной водой, и осадок растворяли фильтрацией 20 мл HNO3 1 : 4 в полипропиленовые флаконы, после чего полученный раствор, содержащий химические элементы, находившиеся в осадке гидроксидов, также анализировали.
Объемы морской воды, модельного раствора “р. Юрьева”, раствора бикарбоната натрия и суспензий хемогенной взвеси для каждого из экспериментов, а также значения pH, измеренные в оставшихся после фильтрации пробах, приведены в табл. 4.
Таблица 4.
Условия экспериментов по моделированию процесса смешения вод р. Юрьева с морской водой
| Экспе-римент | Объем смешанных растворов Vобщ, мл | pH конечный (после смешения) | Объем взмученной суспензии, взятой для химического анализа | ||
|---|---|---|---|---|---|
| 35‰ бескарбонатная морская вода | модельный раствор “р. Юрьева” | 0.2 М NaHCO3 | |||
| I | 40 | 10 | 1.7 | 3.37 | 5.0 |
| I′ | 40 | 10 | 3.8 | 7.63 | 5.0 |
| II | 90 | 10 | 1.7 | 3.73 | 10.0 |
| II′ | 90 | 10 | 4.1 | 7.53 | 10.0 |
| III | 240 | 10 | 1.7 | 4.17 | 25.0 |
| III′ | 240 | 10 | 5.0 | 7.77 | 25.0 |
| IV | 490 | 10 | 1.7 | 4.65 | 50.0 |
| IV′ | 490 | 10 | 6.5 | 7.66 | 50.0 |
Несмотря на то, что перед растворением в азотной кислоте осадок гидроксидов промывали дистиллированной водой, в нем могли сохраниться окклюдированные растворимые компоненты. Поскольку натрий, как известно, на гидроксидах железа и алюминия сорбируется слабо, его содержание в твердой фазе гидроксидов было использовано в качестве показателя количества окклюдированного раствора. Основываясь на этом допущении, концентрации микроэлементов во взвешенном состоянии $({{C}_{{i({\text{взв}})}}})$ рассчитывали с поправкой на их содержание в окклюдированном растворе:
(1)
$\begin{gathered} {{C}_{{i({\text{взв}})}}} = C_{{i({\text{взв}})}}^{{{\text{измер}}}} - {{C}_{{i({\text{оккл}})}}} = \\ = C_{{i({\text{взв}})}}^{{{\text{измер}}}} - \left( {\frac{{{{C}_{{i({\text{раств}})}}}}}{{{{C}_{{{\text{Na(раств)}}}}}}}} \right)С_{{{\text{Na(взв)}}}}^{{{\text{измер}}}}, \\ \end{gathered} $Концентрации растворенных макро- и микроэлементов определяли методом масс-спектрометрии с индуктивно связанной плазмой на приборе Agilent 7500ce с относительной погрешностью не более ±4%. Для оценки воспроизводимости анализов использовали международные стандарты речной воды SLRS-4 и SLRS-5 и стандарт воды из эстуария с соленостью 15‰ SLEW-3, для которых расхождение измеренных и сертифицированных концентраций изученных элементов не превышало 20%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
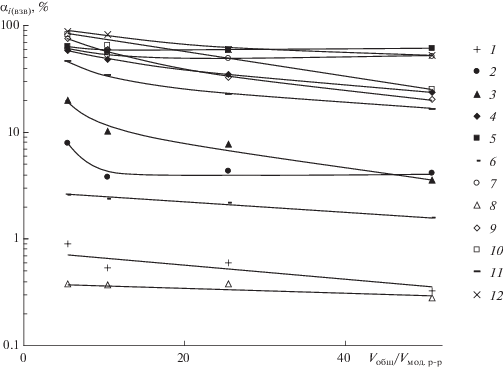
Результаты экспериментов представлены в табл. 5 и 6, где приведены концентрации растворенных и взвешенных форм химических элементов, а также доли взвешенных форм в опытах с низкими и высокими значениями pH. Изменение долей химических элементов во взвешенном состоянии в опытах с высокими значениями pH в зависимости от степени разбавления модельного раствора “р. Юрьева” морской водой показано на рисунке 1.
Таблица 5.
Концентрации химических элементов в растворе ${{С}_{{i({\text{pаств}})}}},$ хемогенной взвеси ${{C}_{{i({\text{взв}})}}}$ (мкг/л) и доли элементов во взвешенном состоянии ${{\alpha }_{{i({\text{взв}})}}}$ (%) в опытах с низкими значениями pH
| Эле- мент |
Эксперимент | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I (pH 3.37) | II (pH 3.73) | III (pH 4.17) | IV (pH 4.65) | |||||||||
| ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | |
| Mn | 1100 | 1.31 | 0.12 | 572 | 0.351 | 0.06 | 259 | 0.092 | 0.04 | 151 | 0.080 | 0.05 |
| Fe | 1340 | 20 600 | 93.9 | 455 | 11 500 | 96.2 | 115 | 4000 | 97.2 | 98 | 2070 | 95.5 |
| Co | 3.08 | 0.018 | 0.58 | 1.67 | 0.0074 | 0.44 | 0.76 | 0.0035 | 0.46 | 0.39 | 0.0018 | 0.46 |
| Ni | 9.45 | 0.407 | 4.13 | 5.53 | 0.194 | 3.39 | 3.39 | 0.089 | 2.56 | 2.39 | 0.070 | 2.85 |
| Cu | 11.6 | 3.12 | 21.2 | 7.95 | 1.65 | 17.2 | 6.62 | 0.60 | 8.31 | 6.90 | 0.35 | 4.83 |
| Zn | 182 | 45.4 | 20.0 | 113 | 22.7 | 16.7 | 96.8 | 11.5 | 10.6 | 84.1 | 5.86 | 6.52 |
| Cd | 2.29 | 0.0060 | 0.26 | 1.28 | 0.0035 | 0.27 | 0.66 | 0.0014 | 0.21 | 0.48 | 0.00092 | 0.19 |
| Pb | 7.99 | 0.65 | 7.52 | 5.27 | 0.52 | 8.98 | 3.88 | 0.39 | 9.13 | 3.31 | 0.43 | 11.5 |
| Tl | 2.17 | 0.004 | 0.20 | 1.15 | 0.003 | 0.24 | 0.480 | 0.001 | 0.26 | 0.290 | 0.001 | 0.29 |
| Al | 34 100 | 344 | 1.00 | 17 500 | 300 | 1.68 | 6930 | 246 | 3.43 | 3230 | 260 | 7.45 |
| Ga | 1.39 | 17.1 | 92.5 | 0.330 | 8.36 | 96.2 | 0.110 | 3.41 | 96.9 | 0.120 | 1.52 | 92.7 |
| Y | 2.11 | 0.021 | 0.97 | 1.15 | 0.011 | 0.92 | 0.420 | 0.004 | 0.91 | 0.210 | 0.004 | 1.85 |
| La | 2.18 | 0.016 | 0.75 | 1.11 | 0.011 | 0.96 | 0.406 | 0.005 | 1.19 | 0.221 | 0.002 | 0.88 |
| Ce | 2.14 | 0.029 | 1.31 | 1.01 | 0.017 | 1.64 | 0.425 | 0.008 | 1.82 | 0.200 | 0.004 | 1.94 |
| Pr | 2.12 | 0.025 | 1.15 | 1.06 | 0.019 | 1.75 | 0.400 | 0.009 | 2.17 | 0.199 | 0.004 | 1.95 |
| Nd | 2.08 | 0.033 | 1.55 | 1.06 | 0.017 | 1.56 | 0.420 | 0.009 | 2.07 | 0.211 | 0.004 | 1.84 |
| Sm | 2.09 | 0.033 | 1.54 | 0.920 | 0.027 | 2.85 | 0.454 | 0.012 | 2.55 | 0.208 | 0.004 | 1.87 |
| Eu | 2.05 | 0.025 | 1.20 | 1.05 | 0.021 | 1.95 | 0.422 | 0.009 | 2.06 | 0.210 | 0.003 | 1.39 |
| Tb | 2.08 | 0.021 | 0.99 | 1.03 | 0.017 | 1.61 | 0.415 | 0.006 | 1.40 | 0.207 | 0.002 | 0.94 |
| Gd | 2.05 | 0.029 | 1.39 | 1.05 | 0.019 | 1.76 | 0.423 | 0.008 | 1.83 | 0.226 | 0.006 | 2.57 |
| Dy | 2.03 | 0.025 | 1.21 | 1.05 | 0.017 | 1.58 | 0.385 | 0.006 | 1.51 | 0.193 | 0.003 | 1.51 |
| Ho | 2.08 | 0.025 | 1.17 | 1.03 | 0.017 | 1.61 | 0.415 | 0.006 | 1.40 | 0.209 | 0.002 | 0.93 |
| Er | 2.07 | 0.029 | 1.37 | 1.04 | 0.019 | 1.78 | 0.432 | 0.006 | 1.34 | 0.189 | 0.003 | 1.54 |
| Tm | 2.06 | 0.029 | 1.38 | 0.992 | 0.021 | 2.07 | 0.399 | 0.006 | 1.45 | 0.203 | 0.002 | 0.96 |
| Yb | 1.98 | 0.033 | 1.64 | 0.990 | 0.023 | 2.26 | 0.402 | 0.007 | 1.68 | 0.204 | 0.002 | 0.95 |
| Lu | 2.09 | 0.033 | 1.54 | 1.02 | 0.023 | 2.19 | 0.426 | 0.007 | 1.59 | 0.192 | 0.002 | 1.01 |
| V | 0.53 | 2.00 | 79.2 | 0.65 | 0.98 | 60.1 | 0.71 | 0.40 | 36.1 | 0.76 | 0.15 | 16.5 |
| As | 0.35 | 1.78 | 83.6 | 0.29 | 0.92 | 76.0 | 0.22 | 0.41 | 65.1 | 0.28 | 0.15 | 34.9 |
| Sb | 1.54 | 0.60 | 28.0 | 0.66 | 0.50 | 43.1 | 0.43 | 0.19 | 30.6 | 0.36 | 0.075 | 17.2 |
| U | 2.16 | 0.016 | 0.76 | 1.07 | 0.011 | 1.00 | 0.438 | 0.007 | 1.54 | 0.189 | 0.010 | 5.01 |
Таблица 6.
Концентрации химических элементов в растворе ${{С}_{{i({\text{pаств}})}}},$ хемогенной взвеси ${{C}_{{i({\text{взв}})}}}$ (мкг/л) и доли элементов во взвешенном состоянии ${{\alpha }_{{i({\text{взв}})}}}$ (%) в опытах с высокими значениями pH
| Эле- мент |
Эксперимент | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I′ (pH 7.63) | II′ (pH 7.53) | III′ (pH 7.77) | IV′ (pH 7.66) | |||||||||
| ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | ${{С}_{{i({\text{pаств}})}}}$ | ${{C}_{{i({\text{взв}})}}}$ | ${{\alpha }_{{i({\text{взв}})}}}$ | |
| Mn | 1020 | 9.27 | 0.90 | 565 | 3.06 | 0.54 | 254 | 1.54 | 0.60 | 153 | 0.509 | 0.33 |
| Fe | 44.9 | 22 100 | 98.3 | 22.20 | 11 080 | 99.8 | 8.7 | 4320 | 99.8 | 4.4 | 2200 | 99.8 |
| Co | 2.80 | 0.24 | 7.89 | 1.46 | 0.057 | 3.76 | 0.66 | 0.030 | 4.35 | 0.35 | 0.015 | 4.11 |
| Ni | 6.51 | 1.63 | 20.0 | 5.39 | 0.617 | 10.3 | 3.22 | 0.269 | 7.72 | 2.68 | 0.099 | 3.58 |
| Cu | 6.79 | 9.39 | 58.0 | 5.66 | 5.32 | 48.4 | 5.23 | 2.84 | 35.2 | 5.16 | 1.60 | 23.7 |
| Zn | 72.7 | 131 | 64.3 | 66.3 | 89.8 | 57.5 | 46.9 | 65.1 | 58.1 | 34.0 | 54.6 | 61.6 |
| Cd | 2.20 | 0.059 | 2.60 | 1.21 | 0.029 | 2.34 | 0.63 | 0.014 | 2.17 | 0.46 | 0.0074 | 1.58 |
| Pb | 3.46 | 5.18 | 60.0 | 2.79 | 3.15 | 53.0 | 2.13 | 2.02 | 48.7 | 1.83 | 1.97 | 51.8 |
| Tl | 2.08 | 0.008 | 0.38 | 1.09 | 0.004 | 0.37 | 0.52 | 0.002 | 0.38 | 0.280 | 0.0008 | 0.28 |
| Al | 960 | 34 500 | 97.3 | 357 | 17 500 | 98.0 | 300 | 6660 | 95.7 | 230 | 3290 | 93.5 |
| Ga | 0.910 | 16.7 | 94.8 | 0.560 | 8.26 | 93.7 | 0.440 | 3.06 | 87.4 | 0.260 | 1.50 | 85.2 |
| Y | 0.036 | 1.71 | 97.9 | 0.026 | 0.850 | 97.0 | 0.018 | 0.353 | 95.1 | 0.017 | 0.200 | 92.2 |
| La | 0.050 | 1.74 | 97.2 | 0.013 | 0.844 | 98.5 | 0.008 | 0.347 | 97.7 | 0.004 | 0.171 | 97.7 |
| Ce | 0.019 | 1.71 | 98.9 | 0.004 | 0.846 | 99.5 | 0.002 | 0.344 | 99.4 | 0.002 | 0.180 | 98.9 |
| Pr | 0.033 | 1.71 | 98.1 | 0.003 | 0.850 | 99.6 | 0.003 | 0.345 | 99.1 | 0.002 | 0.172 | 98.9 |
| Nd | 0.030 | 1.74 | 98.3 | 0.003 | 0.854 | 99.6 | 0.002 | 0.343 | 99.4 | 0.001 | 0.174 | 99.4 |
| Sm | 0.033 | 1.76 | 98.2 | 0.004 | 0.862 | 99.5 | 0.002 | 0.350 | 99.4 | 0.001 | 0.176 | 99.4 |
| Eu | 0.045 | 1.73 | 97.5 | 0.002 | 0.856 | 99.8 | 0.002 | 0.344 | 99.4 | 0.001 | 0.172 | 99.4 |
| Tb | 0.034 | 1.76 | 98.1 | 0.001 | 0.872 | 99.9 | Не опр. | 0.353 | ∼100 | Не опр. | 0.178 | ∼100 |
| Gd | 0.032 | 1.78 | 98.2 | 0.007 | 0.880 | 99.2 | Не опр. | 0.357 | ∼100 | Не опр. | 0.185 | ∼100 |
| Dy | 0.034 | 1.76 | 98.1 | 0.001 | 0.888 | 99.9 | Не опр. | 0.354 | ∼100 | Не опр. | 0.184 | ∼100 |
| Ho | 0.034 | 1.79 | 98.1 | 0.001 | 0.874 | 99.9 | Не опр. | 0.359 | ∼100 | Не опр. | 0.180 | ∼100 |
| Er | 0.036 | 1.78 | 98.0 | 0.001 | 0.876 | 99.9 | Не опр. | 0.356 | ∼100 | Не опр. | 0.180 | ∼100 |
| Tm | 0.031 | 1.75 | 98.3 | 0.001 | 0.866 | 99.9 | Не опр. | 0.354 | ∼100 | Не опр. | 0.176 | ∼100 |
| Yb | 0.027 | 1.73 | 98.5 | 0.002 | 0.862 | 99.8 | 0.001 | 0.344 | 99.7 | Не опр. | 0.176 | ∼100 |
| Lu | 0.034 | 1.75 | 98.1 | 0.001 | 0.874 | 99.9 | Не опр. | 0.351 | ∼100 | Не опр. | 0.176 | ∼100 |
| V | 0.61 | 1.84 | 75.1 | 0.64 | 0.94 | 59.5 | 0.73 | 0.36 | 33.0 | 0.75 | 0.19 | 20.2 |
| As | 0.38 | 1.82 | 82.7 | 0.42 | 0.76 | 64.4 | 0.24 | 0.36 | 60.0 | 0.33 | 0.11 | 25.0 |
| Sb | 1.13 | 0.95 | 45.7 | 0.82 | 0.42 | 33.9 | 0.49 | 0.16 | 22.6 | 0.34 | 0.067 | 16.5 |
| U | 0.229 | 1.72 | 88.2 | 0.175 | 0.812 | 82.3 | 0.160 | 0.236 | 59.6 | 0.089 | 0.098 | 52.4 |
Рис. 1.
Изменение долей химических элементов во взвешенном состоянии $\left( {{{\alpha }_{{i({\text{взв}})}}}} \right)$ в опытах с высокими значениями pH в зависимости от степени разбавления модельного раствора “р. Юрьева” морской водой (Vобщ/Vмод. р-р). i: 1 – Mn, 2 – Co, 3 – Ni, 4 – Cu, 5 – Zn, 6 – Cd, 7 – Pb, 8 – Tl, 9 – V, 10 – As, 11 – Sb, 12 – U.
Железо и алюминий. При снижении кислотности среды вначале осаждается гидроксид железа, с которым связано 93.9% суммарного железа при pH 3.37, 95.5–97.2% при pH 3.73–4.65 и 98.3–99.8% при pH 7.53–7.77. Осаждение основной массы гидроксида алюминия начинается при более высоких значениях pH. При pH 3.37 количество взвешенных форм алюминия составляет 1.0%, увеличиваясь до 1.7% при pH 3.73, 3.4% при pH 4.17 и достигая 7.4% при pH 4.65. В слабощелочной среде с pH 7.53–7.77 практически весь алюминий (93.5–98.0%) находится в форме взвесей, причем их вклад незначительно снижается по мере увеличения степени разбавления модельного раствора “р. Юрьева” морской водой.
Считая, что хемогенная взвесь состоит из гидроксидов железа и алюминия, по данным о содержании взвешенных форм этих элементов можно рассчитать концентрации Fe(OH)3 и Al(OH)3 и определить их соотношение в зависимости от кислотно-щелочных условий водной среды и степени разбавления модельного раствора морской водой. При низких значениях pH происходит осаждение гидроксида железа, содержащего небольшое количество гидроксида алюминия, вклад которого возрастает от 2.5% при pH 3.37 до 15.9% при pH 4.65. При pH 7.53–7.77 наблюдается полное осаждение гидроксидов железа и алюминия с постоянным массовым соотношением 30 к 70% (табл. 7).
Таблица 7.
Зависимость компонентного состава хемогенной взвеси от величины pH смеси и степени разбавления модельного раствора “р. Юрьева” морской водой
| Эксперимент | pH | Разбавление модельного раствора Vобщ/Vмод. р-р | Доля от суммы гидроксидов, % | |
|---|---|---|---|---|
| Fe(OH)3 | Al(OH)3 | |||
| I | 3.37 | 5.2 | 97.54 | 2.46 |
| II | 3.73 | 10.2 | 96.21 | 3.79 |
| III | 4.17 | 25.2 | 91.50 | 8.50 |
| IV | 4.65 | 50.2 | 84.06 | 15.94 |
| I′ | 7.63 | 5.4 | 29.78 | 70.22 |
| II′ | 7.53 | 10.4 | 29.54 | 70.46 |
| III′ | 7.77 | 25.5 | 30.05 | 69.95 |
| IV′ | 7.66 | 50.7 | 30.69 | 69.31 |
Марганец. Во всем изученном диапазоне кислотности марганец почти полностью находится в растворенном состоянии. На долю взвешенных форм приходится 0.12% при pH 3.37 и всего 0.04–0.06% при pH 3.73–4.65. В слабощелочной среде с pH 7.53–7.77, соответствующей области осаждения гидроксида алюминия, вклад взвешенных форм марганца незначительно возрастает, составляя 0.33–0.90%. При этом намечается тенденция к слабому снижению доли взвешенного марганца при увеличении степени разбавления модельного раствора морской водой.
Кобальт. Подобно марганцу, взвешенные формы кобальта имеют второстепенное значение. При pH 3.37–4.65 их доля составляет 0.49 ± 0.06%; в области полного осаждения гидроксида алюминия с pH 7.53–7.77 – увеличивается до 5.0 ± 1.9%. В окислительной обстановке, особенно в щелочной среде, кобальт может находиться в трехвалентном состоянии, в котором он должен эффективно соосаждаться с гидроксидами железа и алюминия. Поскольку в экспериментах этого не наблюдается, можно утверждать, что на всех стадиях смешения модельного раствора с морской водой кобальт остается в двухвалентном состоянии.
Никель. По сравнению с марганцем и кобальтом вклад взвешенных форм никеля во всем изученном диапазоне pH несколько выше. В кислой среде их доля уменьшается от 4.1% при pH 3.37 до 2.6–2.8% при pH 4.17–4.65. Это находится в противоречии с известным фактом увеличения эффективности соосаждения (и сорбции) тяжелых металлов с гидроксидом железа с возрастанием величины pH. Можно, однако, предположить, что в данном случае определяющую роль играет степень разбавления модельного раствора морской водой, увеличение которой приводит к снижению эффективности соосаждения в большей степени, чем противоположное влияние pH. Подтверждением этого предположения можно считать отчетливо проявляющееся снижение доли взвешенного никеля с 20.0 до 3.6% при увеличении степени разбавления модельного раствора морской водой от 1 : 5 до 1 : 50 в слабощелочной среде при незначительно изменяющейся величине pH 7.65 ± 0.10.
Медь. В процессе смешения модельного раствора с морской водой поведение меди сходно с поведением никеля, хотя роль взвешенных форм меди существенно выше. В кислой области наблюдается плавное снижение доли взвешенной меди с увеличением степени разбавления модельного раствора и pH смеси: от 21.2% при разбавлении 1 : 5 и pH 3.37 до 4.8% при разбавлении 1 : 50 и pH 4.65. При pH 7.65 ± 0.10 доля взвешенной меди также плавно снижается с ростом степени разбавления модельного раствора: от 58.0% при разбавлении 1 : 5 до 23.7% при разбавлении 1 : 50.
Цинк. В области низких значений pH доли взвешенных форм цинка близко соответствуют таковым для меди, включая их явно выраженное снижение от 20.0 до 6.5% по мере увеличения степени разбавления модельного раствора. Однако в слабощелочной среде при pH 7.65 ± 0.10 доля взвешенных форм цинка, в отличие от меди, не зависит от степени разбавления модельного раствора и составляет 60.3 ± 3.1%.
Кадмий. По химическим и геохимическим свойствам кадмий является близким аналогом цинка, однако по результатам проведенных экспериментов соотношение взвешенных и растворенных форм этих элементов сильно различается: вклад взвешенных форм кадмия не превышает 0.3% при pH 3.37–4.65 и 1.6–2.6% при pH 7.65 ± 0.10. Наиболее вероятная причина указанных различий связана с существенно бόльшим ионным радиусом кадмия (0.99 Å) по сравнению с таковым для цинка (0.83 Å), что осложняет его изоморфное вхождение в свежеосажденные гидроксиды алюминия и железа(III) с ионными радиусами катионов соответственно 0.57 и 0.67 Å.
Свинец. В кислой среде при pH 3.37–4.65 взвешенные формы свинца составляют 9.3 ± 1.6% общего содержания, тогда как в щелочной среде при pH 7.65 ± 0.10 вклад его взвешенных форм возрастает до 53.4 ± 4.8%, не показывая явной зависимости от степени разбавления модельного раствора.
Таллий. Во всех проведенных экспериментах доля взвешенных форм таллия была незначительной и не превышала 0.4%. В зоне гипергенеза таллий может находиться в одно- и трехвалентном состояниях. Одновалентный таллий подобен щелочным элементам и устойчив в водных растворах. Трехвалентный таллий, устойчивый в сильно окислительной среде, входит в группу элементов-гидролизатов, которые эффективно сорбируются и соосаждаются с гидроксидами железа и алюминия. В модельном растворе таллий первоначально находился в одновалентном состоянии, и чрезвычайно слабо выраженный процесс перехода из раствора во взвешенные формы свидетельствует о постоянстве его валентности.
Галлий. Галлий – близкий химический и геохимический аналог алюминия, однако результаты экспериментального моделирования взаимодействия модельного раствора “р. Юрьева” с морской водой показывают резкие различия в поведении этих элементов. Если содержание взвешенного алюминия в кислой среде возрастает от 1.0% при pH 3.37 до 7.4% при pH 4.65, то доля взвешенного галлия во всем указанном диапазоне pH составляет 94.6 ± 2.3%, свидетельствуя о высокой эффективности его соосаждения с гидроксидом железа. При pH 7.65 ± 0.10 наблюдается слабо выраженное снижение доли взвешенных форм галлия с 94.8 до 85.2% при увеличении степени разбавления модельного раствора от 1 : 5 до 1 : 50.
Иттрий и редкоземельные элементы. В экспериментах с кислой реакцией среды, когда происходит осаждение гидроксида железа, во взвешенной форме находится лишь небольшая часть (0.8–2.8%) иттрия и редкоземельных элементов. После осаждения гидроксида алюминия при pH 7.65 ± 0.10 в растворе остается менее 1–3% исходного содержания редкоземельных элементов и 3–8% иттрия. Таким образом, фазой-коллектором этих элементов служит гидроксид алюминия, тогда как с гидроксидом железа они соосаждаются в незначительных количествах.
Ванадий, мышьяк, сурьма. Элементы этой группы мигрируют в природных водах преимущественно в форме оксианионов и способны эффективно сорбироваться и соосаждаться с гидроксидами алюминия и, особенно, железа. На начальном этапе нейтрализации для ванадия и мышьяка наблюдается снижение вклада взвешенных форм соответственно с 79.2 и 83.6% при pH 3.37 и разбавлении кислого модельного раствора 1 : 5 до 16.5 и 34.9% при pH 4.65 и разбавлении 1 : 50. В слабощелочной среде при pH 7.65 ± 0.10, когда осаждение гидроксидов железа и алюминия практически полностью завершено, доли взвешенных форм ванадия и мышьяка также значительно снижаются при увеличении степени разбавления модельного раствора морской водой: соответственно с 75.1 до 20.2% и с 82.7 до 25.0%. Для сурьмы эффект разбавления проявляется только в слабощелочной среде и в меньшей степени (доля взвешенных форм снижается с 45.7 до 16.5%), тогда как в кислой области при pH 3.73 отмечался максимум взвешенных форм (43.1%), а при pH 3.37 и 4.17–4.65 доли взвешенных форм составляли соответственно 28.0 и 17.2–30.6%. Наличие максимума иммобилизации сурьмы в слабокислой среде ранее было обнаружено с помощью радиоактивных индикаторов (Фазлуллин и др., 1992).
Уран. В кислой среде доля урана во взвеси незначительна и увеличивается от 0.76% при pH 3.37 и разбавлении модельного раствора 1 : 5 до 5.0% при pH 4.65 и разбавлении 1 : 50. В слабощелочных условиях при pH 7.65 ± 0.10 более половины урана переходит во взвешенные формы, вклад которых снижается с увеличением относительного количества морской воды в смеси: с 88.2 до 52.4% при возрастании объемного отношения модельного раствора и морской воды от 1 : 5 до 1 : 50.
Наиболее интересным результатом проведенных экспериментов является зависимость доли взвешенных форм от соотношения объемов модельного раствора “р. Юрьева” и морской воды, которая соответствует увеличению массового отношения раствор/осадок гидроксидов. Эта зависимость характерна для многих (но не для всех) элементов и может быть обусловлена двумя факторами. Во-первых, при увеличении массового отношения раствор/осадок может происходить частичное растворение твердой фазы гидроксидов, сопровождающееся переходом в раствор соосажденных (сорбированных) микроэлементов. Частичное растворение гидроксида железа, обладающего чрезвычайно низкой растворимостью в морской воде и водных растворах с нейтральной или слабощелочной реакцией, не должно играть сколько-нибудь значимую роль (Byrne, Kester, 1976; Zafiriou, True, 1980). Однако этот процесс может быть заметен для гидроксида алюминия, растворимость которого намного выше: 0.1–0.2 мг Al/л (Савенко, Савенко, 2011). Если бы частичное растворение гидроксидов железа и алюминия имело существенное значение, оно должно было бы отражаться на поведении всех элементов, чего в действительности не наблюдается. Во-вторых, в случае, когда концентрации растворенных элементов в морской воде намного ниже их содержания в растворе после нейтрализации, увеличение доли морской воды в смеси может сопровождаться смещением сорбционно-десорбционных равновесий и переходом части адсорбированных элементов в раствор. Подчеркнем, что этот механизм реализуется только в отношении адсорбированных форм и не затрагивает соосажденные элементы, находящиеся в составе изоморфных примесей. Разное соотношение адсорбированных и изоморфных форм нахождения микроэлементов в гидроксидах железа и алюминия, по-видимому, служит причиной того, что эффект разбавления проявляется для различных элементов в неодинаковой степени.
В заключение сравним результаты экспериментов с данными натурных наблюдений по составу взвешенного вещества из зон смешения кислых вулканических и морских вод. Как отмечал К.К. Зеленов (1972), поскольку перед химическим анализом образцы взвесей из зон смешения не промывали дистиллированной водой, они содержали значительные количества морских солей. Поэтому для корректного сравнения данных экспериментов и наблюдений целесообразно использовать не абсолютные, а относительные концентрации элементов, например, отношение i/Fe.
В связи с сильной временнόй изменчивостью химического состава вод р. Юрьева (Фазлуллин, 1999а) для верификации экспериментальных данных лучше всего подходит работа А.З. Миклишанского с соавторами (1989), содержащая результаты синхронных измерений концентраций железа и микроэлементов в воде из устья этой реки и взвесях из зон осаждения гидроксидов железа и алюминия. В табл. 8 приведены отношения i/Fe во взвесях из зоны осаждения только гидроксида железа (pH 3.86) и зоны полного осаждения гидроксидов железа и алюминия (pH 6.32). В этой же таблице для сравнения даны значения отношений i/Fe в хемогенной взвеси, рассчитанные по экспериментальным данным с поправкой на различие концентраций растворенных элементов в воде р. Юрьева и модельном растворе:
(2)
${{({i \mathord{\left/ {\vphantom {i {{\text{Fe}}}}} \right. \kern-0em} {{\text{Fe}}}})}_{{{\text{расч}}}}} = {{K}_{i}}{{({i \mathord{\left/ {\vphantom {i {{\text{Fe}}}}} \right. \kern-0em} {{\text{Fe}}}})}_{{{\text{эксп}}}}},$Таблица 8.
Сравнение наблюдаемых (Миклишанский и др., 1989) и экспериментальных значений отношений i/Fe во взвесях из зон нейтрализации вод р. Юрьева
| Отношение (i/Fe) × 104 | Натурные наблюдения | Ki* | Эксперимент | ||
|---|---|---|---|---|---|
| pH 3.86 | pH 6.32 | pH 3.76 ± 0.40 | pH 7.65 ± 0.10 | ||
| Mn/Fe | 0.098 | 1.5 | 0.047 | 0.011–0.030 | 0.11–0.20 |
| Co/Fe | 0.019 | 0.14 | 0.16 | 0.0010–0.0014 | 0.0082–0.017 |
| Cu/Fe | 0.098 | 1.5 | 0.11 | 0.16–0.17 | 0.47–0.80 |
| Zn/Fe | 1.1 | 3.4 | 0.49 | 9.7–14.1 | 29–122 |
| Ga/Fe | 2.5 | 2.9 | 0.23 | 1.7–2.0 | 1.6–1.7 |
| La/Fe | 0.016 | 2.1 | 2.26 | 0.018–0.028 | 1.7–1.8 |
| Ce/Fe | 0.031 | 8.3 | 5.23 | 0.074–0.11 | 4.0–4.3 |
| Pr/Fe | 0.00043 | 0.65 | 0.56 | 0.0068–0.013 | 0.43–0.45 |
| Sm/Fe | 0.0038 | 0.90 | 0.46 | 0.0074–0.14 | 0.36–0.37 |
| Eu/Fe | 0.0010 | 0.16 | 0.16 | 0.0019–0.0036 | 0.12–0.13 |
| Tb/Fe | – | 0.16 | 0.084 | 0.0009–0.0013 | 0.066–0.069 |
| Dy/Fe | 0.0051 | 0.66 | 0.90 | 0.011–0.014 | 0.72–0.75 |
| Er/Fe | 0.0037 | 0.64 | 0.29 | 0.0041–0.0048 | 0.23–0.24 |
| Yb/Fe | 0.0038 | 0.53 | 0.30 | 0.0048–0.0060 | 0.23–0.24 |
| Lu/Fe | – | 0.10 | 0.054 | 0.0009–0.0011 | 0.043–0.044 |
| As/Fe | 64 | 61 | 10.5 | 8.4–9.8 | 5.3–8.7 |
| Sb/Fe | 0.056 | – | 0.032 | 0.0093–0.015 | 0.010–0.014 |
| U/Fe | 0.64 | 7.7 | 0.22 | 0.0017–0.0039 | 0.10–0.17 |
Сравнение отношений i/Fe в морских взвесях из зон осаждения гидроксидов железа и алюминия показывает хорошую согласованность с результатами экспериментов при pH 3.76 ± 0.40 и 7.65 ± 0.10 для меди, галлия, редкоземельных элементов и сурьмы. В пределах порядка величины экспериментальные оценки отношений i/Fe и данные натурных наблюдений согласуются по марганцу, кобальту, мышьяку и цинку, причем в отличие от первых трех элементов экспериментальные определения отношения Zn/Fe превышают таковые для морской взвеси из зон нейтрализации. Учитывая значительную временнýю изменчивость химического состава вод р. Юрьева и наличие в природных условиях дополнительных факторов (присутствие взвешенных веществ терригенного и биогенного происхождения, протекание микробиологических процессов и др.), такие расхождения можно признать вполне приемлемыми. Различия экспериментальных и наблюдаемых отношений i/Fe более чем на порядок величины отмечаются только для урана и составляют 160–380 раз в зоне осаждения гидроксида железа и 45–77 раз в области полного осаждения гидроксидов железа и алюминия. Наиболее вероятное объяснение столь больших расхождений состоит, по-видимому, в том, что присутствующее в кислых водах р. Юрьева растворенное двухвалентное железо (Борисенков, 1967) обеспечивает четырехвалентное состояние урана, в котором он эффективно соосаждается с гидроксидом железа (III), тогда как в условиях экспериментов уран находился в существенно менее сорбционно активном шестивалентном состоянии.
В работе (Фазлуллин, Савенко, 1992) определено содержание железа, марганца, никеля, меди и цинка во взвешенном веществе из зоны смешения кислых вод р. Юрьева с морской водой в трех диапазонах кислотности: при pH 2.9–5.5, 5.5–7.4 и >8.0. В первом диапазоне кислотности 9 из 10 проб располагались в области осаждения гидроксида железа с минимальной примесью (≤10%) гидроксида алюминия (pH 2.9–4.2) и только в одной пробе с pH 5.2 вместе с гидроксидом железа осаждалась основная масса гидроксида алюминия. Второй диапазон кислотности соответствовал почти эквивалентной нейтрализации кислых вод р. Юрьева щелочным резервом морской воды и практически полному осаждению гидроксидов железа и алюминия. Область максимальных значений pH, помимо полного осаждения гидроксидов железа и алюминия, характеризовалась присутствием большого избытка неконтаминированной морской воды, из которой гидроксиды железа и алюминия могут сорбционным путем извлекать растворенные формы тяжелых металлов и других редких элементов. Кроме того, в этой зоне должна резко возрастать роль обычной океанской взвеси с химическим составом, который существенно отличается от состава хемогенной взвеси, образующейся в зоне смешения кислых вулканических водотоков и морской воды (Савенко, 1988).
В табл. 9 приведено сопоставление отношений Mn/Fe, Ni/Fe, Cu/Fe и Zn/Fe во взвесях из зон нейтрализации и в осадках гидроксидов, полученных в экспериментах при pH 3.37–4.65 (преимущественное осаждение гидроксида железа) и при pH 7.53–7.77 (полное осаждение гидроксидов железа и алюминия). Для указанных диапазонов кислотности величины отношений Cu/Fe и Zn/Fe по данным натурных наблюдений и экспериментов хорошо согласуются между собой. В зоне преимущественного осаждения гидроксида железа отношение Mn/Fe в природных взвесях превышает экспериментальное отношение немногим более чем в 10 раз, тогда как в области полной нейтрализации отношение Mn/Fe различается несущественно, составляя соответственно 8.4 × 10–4 и 3.0 × 10–4. Отношение Ni/Fe в природных взвесях больше экспериментальных значений в 17 раз в зоне преимущественного осаждения гидроксида железа и в 26 раз в области полной нейтрализации. Однако трудно сказать, насколько репрезентативны исходные данные, поскольку расчетные оценки базируются на одном единственном определении концентрации никеля в воде р. Юрьева (Фазлуллин, 1999а).
Таблица 9.
Сравнение наблюдаемых (Фазлуллин, Савенко, 1992) и экспериментальных значений отношений i/Fe во взвесях из зон нейтрализации вод р. Юрьева
| Отношение (i/Fe) × 104 | Натурные наблюдения | Ki* | Эксперимент** | Взвесь океана (Савенко, 1988) | |||
|---|---|---|---|---|---|---|---|
| pH <5.5 | pH 5.5–7.4 | pH >8.0 | pH 3.37–4.65 | pH 7.53–7.77 | |||
| Mn/Fe | 4.1 | 8.4 | 145 | 0.93 | 0.36 (0.21–0.60) | 3.0 (2.1–3.9) | 250 |
| Ni/Fe | 3.5 | 14 | 34 | 0.90 | 0.21 (0.15–0.31) | 0.53 (0.41–0.67) | 88 |
| Cu/Fe | 2.0 | 4.1 | 35 | 0.30 | 0.45 (0.42–0.51) | 1.7 (1.3–2.2) | 375 |
| Zn/Fe | 5.1 | 44 | 227 | 0.51 | 12.6 (10.0–14.7) | 69 (30–127) | 750 |
Для третьей зоны нейтрализации с pH > 8.0, в которой преобладает неконтаминированная морская вода, отношения Mn/Fe, Ni/Fe, Cu/Fe и Zn/Fe больше характерных для взвесей из первой и второй зон нейтрализации и приближаются к таковым для взвеси открытого океана (Савенко, 1988). Именно доминирование “нормальной” океанской взвеси, по-видимому, служит главной причиной значительных расхождений экспериментальных и наблюдаемых величин отношений i/Fe в этой зоне. Роль указанного фактора должна снижаться по мере увеличения доли кислой речной воды, т.е. в более кислых водах зон смешения, что, в целом, подтверждается сближением в них экспериментальных и наблюдаемых значений нормированных по железу концентраций металлов.
Таким образом, несмотря на ограниченность фактического материала, прежде всего по содержанию растворенных форм микроэлементов в водах р. Юрьева, и неопределенность, связанную с действием в природных условиях ряда побочных факторов, можно утверждать, что, за исключением урана, результаты натурных наблюдений принципиально не противоречат данным экспериментального моделирования. Значительные расхождения по урану, вероятнее всего, связаны с разными формами нахождения этого элемента в кислых вулканических водах и модельном растворе, использованном в экспериментах.
ВЫВОДЫ
1. В процессе нейтрализации кислых вулканических вод щелочным резервом морской воды, сопровождающемся последовательным осаждением гидроксидов железа и алюминия, происходит фазовое фракционирование микроэлементов, связанное с их преимущественным вхождением в состав одного из гидроксидов.
2. Наиболее резко фазовое фракционирование проявляется для галлия, с одной стороны, а также для иттрия и редкоземельных элементов, с другой: 92–97% галлия соосаждается с гидроксидом железа, а 92–100% иттрия и редкоземельных элементов – с гидроксидом алюминия. Уран в незначительной степени (<1–5%) соосаждается с гидроксидом железа, тогда как в области осаждения гидроксида алюминия доля его взвешенных форм возрастает до 52–88%. Для никеля характерно сходное распределение, отличающееся меньшей долей (3.6–20%) взвешенных форм в области осаждения гидроксида алюминия. Крайне слабо фазовое фракционирование выражено для марганца, кобальта, кадмия и таллия, вклад взвешенных форм которых не превышает 8% во всем изученном диапазоне кислотности (pH 3.37–7.77), а также для ванадия, мышьяка и сурьмы. Промежуточное поведение показывают медь, цинк и свинец, для которых на долю взвешенных форм в зонах осаждения гидроксидов железа и алюминия приходится соответственно 5–21 и 24–64%.
3. Степень соосаждения микроэлементов, помимо величины pH, зависит от относительной доли объема морской воды, при увеличении которой происходит смещение адсорбционных равновесий и изменение эффективности соосаждения. При pH 7.65 ± 0.10 увеличение степени разбавления модельного раствора “р. Юрьева” морской водой от 1 : 5 до 1 : 50 для большинства микроэлементов приводит к снижению доли взвешенных форм: в 5.6 раза для никеля, в 2.4–3.7 раза для марганца, меди, ванадия, мышьяка и сурьмы, в 1.6–2.0 раза для кобальта, кадмия и урана, в 1.2–1.4 раза для свинца и таллия. Для цинка, галлия, иттрия и редкоземельных элементов влияние степени разбавления на долю взвешенных форм практически отсутствует, составляя не более 10%.
4. За исключением урана, результаты натурных наблюдений принципиально не противоречат данным экспериментального моделирования. Значительные расхождения по урану, вероятнее всего, связаны с разными формами нахождения этого элемента в кислых вулканических водах и модельном растворе, использованном в экспериментах.
Работа выполнена при поддержке РФФИ (грант 20–05–00802).
Список литературы
Борисенков В.И. (1967) Некоторые условия миграции алюминия, железа и титана в поствулканическом гидротермальном процессе. Литология и полезные ископаемые. (4), 67-75.
Зеленов К.К. (1958) О выносе растворенного железа в Охотское море гидротермами вулкана Эбеко (о. Парамушир). ДАН СССР. 120(5), 1089-1092.
Зеленов К.К. (1972) Вулканы как источники рудообразующих компонентов осадочных толщ. М.: Наука, 214 с.
Миклишанский А.З., Колотов В.П., Яковлев Ю.В. (1989) Нейтронно-активационный анализ геотермальных вод и продуктов их взаимодействия с морскими водами. Геохимия. (1), 142-147.
Набоко С.И., Филькова Е.М. (1966) Осадки из кислых вулканических вод и химическая дифференциация. Бюл. вулканол. станции СО АН СССР. (42), 33-41.
Никитина Л.П. (1978) Миграция металлов с активных вулканов в бассейны седиментации. М.: Наука, 80 с.
Савенко А.В., Савенко В.С. (2011) Растворимость гидроксида алюминия и формы нахождения растворенного алюминия в морской воде. Океанология. 51(2), 242-245.
Савенко В.С. (1988) Элементарный химический состав океанского планктона. Геохимия. (8), 1084-1089.
Фазлуллин С.М. (1999а) Геохимическая система р. Юрьева (Курильские о-ва): условия поступления и выноса химических элементов в бассейн реки. Вулканология и сейсмология. (1), 54-67.
Фазлуллин С.М. (1999б) Геохимическая система р. Юрьева (Курильские о-ва): зона смешения кислых речных и морских вод. Вулканология и сейсмология. (2), 45-57.
Фазлуллин С.М., Савенко В.С. (1992) Геохимические особенности зоны смешения кислых вулканических и морских вод. Океанология. 32(2), 246-252.
Фазлуллин С.М., Савенко В.С., Вирцавс М.В. (1992) Экспериментальное моделирование поведения тяжелых металлов в зоне смешения кислых вулканических и морских вод с помощью радиоактивных индикаторов. Радиохимия. (1), 197-201.
Шулькин В.М. (1995) Влияние гидротерм на седиментационное удаление металлов в прибрежных водах. Океанология. 35(3), 405-410.
Шулькин В.М., Цуканова Е.В., Майборода А.Б. (1992а) Влияние современной гидротермальной деятельности на распределение металлов в водах бухты Матупи (Папуа – Новая Гвинея). Геохимия. (3), 389-399.
Шулькин В.М., Цуканова Е.В., Майборода А.Б. (1992б) Влияние современной гидротермальной деятельности на содержание металлов в донных осадках бухты Матупи (о. Новая Британия, Папуа – Новая Гвинея). Литология и полезные ископаемые. (2), 3-23.
Byrne R.H., Kester D.R. (1976) Solubility of hydrous ferric oxide and iron speciation in seawater. Marine Chem. 4(3), 255-274.
Zafiriou C., True M.B. (1980) Interconversion of iron (III) hydroxy complex in seawater. Marine Chem. 8(4), 281-288.
Дополнительные материалы отсутствуют.


