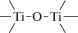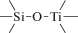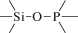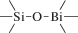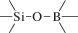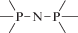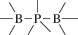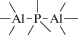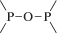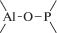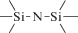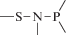Геохимия, 2021, T. 66, № 11, стр. 1042-1049
Термоцикл и эволюционная комбинаторика макромолекул – основа первичных процессов происхождения жизни
С. Д. Варфоломеев a, b, *, И. В. Гачок a, b, **
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, Россия
b Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
* E-mail: sdvarf@bk.ru
** E-mail: ivgachok@gmail.com
Поступила в редакцию 11.05.2021
После доработки 21.05.2021
Принята к публикации 24.05.2021
Аннотация
Статья посвящена проблемам происхождения жизни, изучение которых было начато академиком Э.М. Галимовым. Э.М. Галимов – ученый широкого профиля интересов, глубокого понимания основ процессов, происходящих в природе, исследователь с удивительной научной интуицией. В результате многочисленных обсуждений и дискуссий одного из авторов статьи С.Д. Варфоломеева с академиком Е.М. Галимовым сформировалась концепция, на естественно-научной основе объясняющая происхождение жизни. Рассмотрены базовые кинетические принципы зарождения и эволюции протобиополимерных молекул. Основой подхода, объединяющей процессы полимеризации и селекции макромолекулярных структур является термоцикл, обеспечивающий термодинамическую возможность образования связи мономер–мономер и кинетическую селекцию структур за счет отбора более уставных комплексов. Кинетическое моделирование и анализ полученных решений продемонстрировали возможности экспоненциального роста всех протополимеров системы и образование возможных интерполимерных комплексов – прототипов клеточных органелл типа рибосом. Рассмотрена возможность возникновения жизни, имеющей принципиально другую химическую основу, в других условиях, отличных от планеты Земля.
ВВЕДЕНИЕ
Важнейшей проблемой современного естествознания является вопрос о происхождении жизни. Жизнь это продукт химии полимеров. Условия на Земле или на каких-либо других космических телах обеспечили самопроизвольное возникновение и отбор полимерных систем, способных размножаться и совершенствоваться.
Наш интерес к проблемам возникновения жизни был инициирован академиком Э.М. Галимовым. Э.М. Галимов – ученый широкого профиля интересов, глубокого понимания основ процессов, происходящих в природе, исследователь, обладающий удивительной научной интуицией. Один из авторов был рецензентом его книги “Феномен жизни: между равновесием и нелинейностью. Происхождение и принципы эволюции” (Галимов, 2001), обсуждение которой создало основу наших совместных интересов к пониманию первичных молекулярных основ зарождения и эволюции полимерных систем, которые в настоящее время представляют биологический мир. Многочисленные дискуссии, в том числе публичные, которые один из авторов имел возможность проводить с академиком Э.М. Галимовым, обеспечили формирование и развитие концепции, которая на естественно–научной основе объясняет происхождение жизни.
Очевидно, что существенную роль в предбиологической стадии возникновения жизни играют тепловые потоки – главный фактор регуляции кинетики и термодинамики химических процессов.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Ключевая проблема происхождения жизни – возникновение и пролиферативный синтез уникальных полимерных молекул, обеспечивающих матричное воспроизведение и направленную эволюцию макромолекулярных систем (пептидов, белков, нуклеиновых кислот).
В настоящее время при обсуждении проблемы возникновения жизни считается общепринятым фактом, согласно которому набор органических низкомолекулярных соединений (сахара, аминокислоты, азотистые основания) может быть синтезирован в предбиологических условиях в режимах воздействия на простые молекулы (CO2, углеводороды, HCN и др.) радиационных и термических полей, электрических разрядов, температурных градиентов и т.п. (Галимов, 2001; Fox, 1988; Kauffman, 1993; Orgel, 1973; Eigen, 1971). Принципиальная проблема, требующая обсуждения – происхождение, селекция первичных саморазмножаемых макромолекул, эволюция которых способна привести к полимерным структурам, составляющим природу современных биологических систем.
При обсуждении этой проблемы следует исходить из следующих очевидных факторов:
1) Все биополимеры – линейные макромолекулы, продукты одной и той же химической реакции поликонденсации, образования связей между мономерами происходит за счет образования и выделения воды. Как результат, все биополимеры термодинамически неустойчивы в воде, синтез продуктов поликонденсации возможен лишь в условиях удаления воды. Это может быть достигнуто путем химического поглощения выделяющейся воды или удаления воды вследствие фазового перехода жидкость–пар, жидкость–твердая фаза.
2) Все природные мономеры (аминокислоты и нуклеотиды) представляют собой трифункциональные молекулы, содержащие центры химической реакции поликонденсации и центры “узнавания” мономера за счет природы дополнительной функциональной группы.
Предбиологическая и биологическая эволюция обеспечила колоссальное сужение возможных структур макромолекул, разнообразие которых создается вариациями последовательностей мономеров в полимерной цепи.
Согласно работам (Eigen, 1971; Varfolomeev, 2007; Demina et al., 2012; Varfolomeev, Lushchekina, 2014) естественной движущей силой зарождения и эволюции предбиологических макромолекул является термоцикл, создаваемый периодическими колебаниями температуры с переходом точки температуры фазового перехода.
Кинетическое и экспериментальное моделирование процессов зарождения и эволюции биомакромолекул (Eigen, 1971; Varfolomeev, 2007; Demina et al., 2012; Varfolomeev, Lushchekina, 2014), в рамках нашего подхода, базируется на следующих принципах:
1) Термоцикл, включающий точку фазового перехода воды (в зависимости от давления 20–100°С) является термодинамической движущей силой процессов образования амидных (пептидных), фосфодиэфирных связей при температурах выше точки фазового перехода. Термоцикл также обеспечивает возможность процессов деструкции (гидролиза) отдельных связей при температурах ниже точки фазового перехода. Температура фазового перехода определяется давлением атмосферы и в условиях предбиологии Земли в силу разреженности атмосферы может быть достаточно низкой. Очевидно, что процессы поликонденсации могут идти также в условиях термоцикла на других космических объектах, например, кометах.
2) Полимеризация мономера в присутствии полимерной молекулы не может протекать без влияния полимера. При приближении к точке фазового перехода происходит драматическое концентрирование растворов и мономер в силу трифункциональности и наличия “центров узнавания” с определенной селективностью сортируется на полимере (ионные, водородные, гидрофобные связи). Это обеспечивает, возможно, очень незначительное преимущество синтеза комплиментарных полимеру цепей (Varfolomeev, 2007). На определенном этапе развития это делает возможным сосуществование трех “миров” протополимеров – протопептидов, прото–РНК и прото–ДНК. Их взаимодействие и создает существенное преимущество в развитии и обеспечивает возможность эволюционного успеха. Направленная эволюция полимерных молекул в рамках эволюционной комбинаторики базируется на том, что комплексы пептид – пептид, пептид–РНК, РНК–ДНК, ДНК–ДНК термодинамически и кинетически более устойчивы в реакциях высокотемпературного гидролиза (ниже температуры фазового перехода), по сравнению со свободными индивидуальными полимерными молекулами.
3) Ключевой этап эволюции – синтез и усовершенствование в процессе развития системы каталитически активных полипептидов, участвующих, как в процессах гидролиза, так и синтеза протобиополимеров. Базовый кинетический принцип эволюции заключается в том, что побеждают системы, в механизме развития которых заложены стации экспоненциального роста. Эти системы принципиально неустойчивы в математическом смысле (положительные степени экспонент в характеристических уравнениях, системы с положительной обратной связью, автокаталитические системы). Однако быстрый рост обеспечивает им возможности борьбы за ресурсы и вытеснения конкурентных систем. Очевидными примерами являются рост и эволюция микробных популяций (Варфоломеев, Гуревич, 1999). Яркий пример – рост популяции человека, динамика развития которой превышает скорость экспоненты и имеет гиперэкспоненциальный характер (Varfolomeyev, Gurevich, 2001).
Можно полагать, что преимущества экспоненциального роста проявлялись на стадии предбиологической эволюции протомакромолекул. В данной работе обсуждаются закономерности поведения и взаимодействия трех “миров” протополимеров, а именно протопептидов, обладающих каталитической активностью, прото–РНК и прото–ДНК.
Кинетическое моделирование базируется на сравнении кинетических схем, систем уравнений однозначно следуемых из этих кинетических схем и качественном сравнении полученных решений. Задачей моделирования является поиск схем и решений, обеспечивающих базовые принципы эволюции – экспоненциальный рост всех трех основных участников процесса, а именно пептидов и белков (P), РНК (R), ДНК (D).
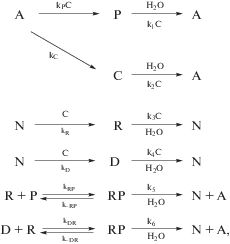
Базовая кинетическая схема имеет вид
где A – аминокислоты, P – белки (пептиды), C – пептидный катализатор, N – нуклеотиды, R – РНК, D – одноцепочечные ДНК; k1, kC, kP, k2,k3, kR, k4, kD,k5, kRP, k-RP, k6, kDR, k-DR – константы скоростей отдельных стадий процесса.Система анализируется в режиме устойчивого избытка A, N (A = A0, N = N0 = const). Время t = nτ, τ – время цикла, $T \to {{T}_{n}} \to {{T}_{p}} \to T$, где Tn – температура фазового перехода, Tp – температура реакции (поликонденсации).
Кинетическая схема (1) отражает основные процессы, происходящие в “первичном полимерном бульоне”, а именно: синтез и частичный гидролиз пептидов P из аминокислот A, синтез и частичный гидролиз пептидного катализатора C, синтез и частичный гидролиз РНК (R) и ДНК (D). Предположим, что R и P способны образовывать комплексы RP, D и R – комплексы DR. С учетом того, что синтез и частичный гидролиз P, C, R и D может иметь каталитический характер, т.е. скорость синтеза и частичного гидролиза зависит от конкуренции пептидного катализатора C, базовая система уравнений имеет вид:
$\frac{{d{\text{P}}}}{{dt}} = {{{\text{k}}}_{{\text{P}}}}{\text{A}}\,{\text{C}} - {{{\text{k}}}_{1}}{\text{P}}\,{\text{C}},$
$\frac{{d{\text{C}}}}{{dt}} = {{{\text{k}}}_{{\text{C}}}}{\text{A}}\,{\text{C}} - {{{\text{k}}}_{2}}{\text{C}},$
(2)
$\begin{gathered} \frac{{d{\text{R}}}}{{dt}} = {{{\text{k}}}_{{\text{R}}}}{\text{N}}\,{\text{C}} - {{{\text{k}}}_{3}}{\text{R}}\,{\text{C}}, \\ \frac{{d{\text{D}}}}{{dt}} = {{{\text{k}}}_{{\text{D}}}}{\text{N}}\,{\text{C}} - {{{\text{k}}}_{4}}{\text{D}}\,{\text{C}}, \\ \end{gathered} $$\frac{{d{\text{RP}}}}{{dt}} = {{{\text{k}}}_{{{\text{RP}}}}}{\text{R}}\,{\text{P}} - {{{\text{k}}}_{{ - {\text{RP}}}}}{\text{RP}} - {{{\text{k}}}_{5}}{\text{RP}}\,{\text{C}},$
$\frac{{d{\text{DR}}}}{{dt}} = {{{\text{k}}}_{{{\text{DR}}}}}{\text{D}}\,{\text{R}} - {{{\text{k}}}_{{ - {\text{DR}}}}}{\text{DR}} - {{{\text{k}}}_{6}}{\text{DR}}\,{\text{C}},$
где A, N – мономеры, P, C, R, D – полимеры.
Анализ полученных решений системы уравнений (1) показывает, что ни при каких значениях параметров kP, kC,k1,k2, kR, kD, k3,k4, kRP, k–RP, k5, k6, kDR, k–DR, все переменные концентраций протополимеров не переходят в режим экспоненциального развития. Это наблюдается даже при экспоненциальном росте C (режим kC A > k2, см. рис. 1).
Рис. 1.
Динамика изменения протополимерных молекул в соответствии с кинетической схемой (1) и системой уравнений (2) при kP = k1 = kD =0.4, kC = 1.1, kR = 0.5, k3 = k4 =0.1, k2 = kRP = k–RP = k5 = 1, kDR = 10, k–DR = k6 = 100. P – белки (пептиды), C – пептидный катализатор, R – РНК, D – одноцепочечные ДНК, RP, DR –комплексы R и P, R и D соответственно.
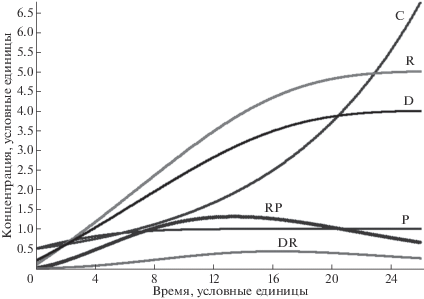
Ситуация принципиально не меняется, даже в условиях введения в систему уравнений членов автокаталитического роста R и D (введение в dR/dt положительного члена k7R, в dD/dt – положительного члена k8D). Эволюционный экспоненциальный процесс по всем переменным может быть достигнут лишь в режимах участия катализатора C на стадиях “размножения” R и D (введение членов k0P C, k7R C, k8D C, k9RP C и k10DR C, см. систему уравнений (3)).
$\frac{{d{\text{P}}}}{{dt}} = {{{\text{k}}}_{{\text{P}}}}{\text{A}}\,{\text{C}} - {{{\text{k}}}_{1}}{\text{P}}\,{\text{C}} + {{{\text{k}}}_{0}}{\text{P}}\,{\text{C}},$
$\frac{{d{\text{C}}}}{{dt}} = {{{\text{k}}}_{{\text{C}}}}{\text{A}}\,{\text{C}} - {{{\text{k}}}_{2}}{\text{C}},$
(3)
$\begin{gathered} \frac{{d{\text{R}}}}{{dt}} = {{{\text{k}}}_{{\text{R}}}}{\text{N}}\,{\text{C}} - {{{\text{k}}}_{3}}{\text{R}}\,{\text{C}} + {{{\text{k}}}_{7}}{\text{R}}\,{\text{C}}, \\ \frac{{d{\text{D}}}}{{dt}} = {{{\text{k}}}_{{\text{D}}}}{\text{N}}\,{\text{C}} - {{{\text{k}}}_{4}}{\text{D}}\,{\text{C}} + {{{\text{k}}}_{8}}{\text{D}}\,{\text{C}}, \\ \end{gathered} $$\frac{{d{\text{RP}}}}{{dt}} = {{{\text{k}}}_{{{\text{RP}}}}}{\text{R}}\,{\text{P}} - {{{\text{k}}}_{{ - {\text{RP}}}}}{\text{RP}} - {{{\text{k}}}_{5}}{\text{RP}}\,{\text{C}} + {{{\text{k}}}_{9}}{\text{RP}}\,{\text{C}},$
$\frac{{d{\text{DR}}}}{{dt}} = {{{\text{k}}}_{{{\text{DR}}}}}{\text{D}}\,{\text{R}} - {{{\text{k}}}_{{ - {\text{DR}}}}}{\text{DR}} - {{{\text{k}}}_{6}}{\text{DR}}\,{\text{C}} + {{{\text{k}}}_{{10}}}{\text{DR}}\,{\text{C}},$
и k0 ≥ k1, k7 ≥ k3, k8 ≥ k4 решение системы уравнений (3) демонстрирует экспоненциальный рост всех переменных (рис. 2).
Рис. 2.
Динамика изменения протополимерных молекул в соответствии с системой уравнений (3) при kP = 0.4, k0 = k1 = = k9 =0.3, kC = 1.1, k2 = 1, kR = 0.6, k3 = k7 = k4 = k8 = 0.1, kRP = 0.2, k–RP = k5 = 1, kDR = 30, k–DR = k6 = 200, k10 = 0.5. P – белки (пептиды), C – пептидный катализатор, R – РНК, D – одноцепочечные ДНК, RP, DR –комплексы R и P, R и D соответственно.
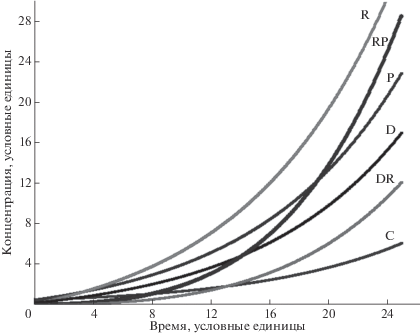
Базовым кинетическим принципом эволюции является экспоненциальный характер развития системы. Только в режиме экспоненциального роста по всем ключевым переменным система может набрать необходимое количество материала и стать доминирующей. Переход в устойчивый стационарный режим по любому из ключевых компонентов лишает систему принципиального эволюционного преимущества – экспоненциального роста.
Таким образом, особенности первичного синтеза и эволюции полимерных молекул на стадиях зарождения жизни, по нашим представлениям, состоит в следующем:
1) на первичных этапах развития полимерных систем синтезируются и сосуществуют три основных типа макромолекул, а именно, протопептиды – продукт поликонденсации разнообразных аминокислот, протоаналоги РНК и ДНК – продукты поликонденсации углеводов с образованием фосфодиэфирных связей. Полимеризационные процессы идут при высоких температурах выше температуры фазового перехода воды. Реакции поликонденсации абсолютно неспецифичны и все три основных класса полимеров характеризуются бесконечным набором вариантов структур.
2) термоциклический процесс обеспечивает возможности частичного матричного синтеза во всех классах протополимеров. Синтез амидной и фосфодиэфирной связи в системе полимер–мономер не может протекать без взаимодействия полимерных молекул с мономером. При приближении к точке фазового перехода и элиминировании воды происходит существенное концентрирование растворов и взаимодействие (адсорбция) мономера с полимером за счет трифункционального характера мономеров. Частичное селектирование мономера на полимере за счет водородных, ионных и гидрофобных связей обеспечивает при переходе точки фазового перехода частично селектированный матричный синтез. В силу большого числа циклов (1 млрд лет – 3.65 × 1011 циклов) даже очень незначительное селектирование приводит к существенному сужению распределения молекул по разнообразию структур. При этом все три типа протополимеров могут существовать независимо в “первичном протополимерном бульоне”.
3) одним из физико-химических факторов первичного отбора может быть кинетическая устойчивость протомакромолекулы в водной среде. При повышенных температурах, особенно при приближении к точке фазового перехода, существенную роль могут играть гидролитические процессы. Это обеспечивает преимущественное существование более кинетически устойчивых протополимерных молекул. Принципиально важным фактором отбора является тот факт, что комплексы более защищены от агрессивного, деполимеризующего действия воды. Это относится к комплексам полимер–аминокислота, полимер–нуклеотид, пептид˗РНК, пептид˗ДНК. В результате этих процессов популяции протополимеров обогащаются макромолекулами, хорошо адсорбирующими мономеры и образующими интерполимерные комплексы.
4) качественный скачок эволюции – освоение возможностей экспонециального роста. Три типа макромолекул, сосуществующих в “протополимерном бульоне” характеризуются принципиально разными свойствами. Пептиды способны образовывать глобулярные структуры и обладать ярко выраженными каталитическими свойствами. Прото˗РНК могут проявлять каталитические свойства, формировать нелинейные трехмерные структуры, взаимодействовать с пептидами и селективно комплексообразоваться с ДНК. Для ДНК характерны комплиментарные связи с РНК и одноцепочечными ДНК. Возможный переход к экспоненциально-эволюционному развитию определяется в первую очередь каталитическими свойствами протопептидов. Протопептиды (протобелки) способны участвовать как на стадиях полимеризации, так и на стадиях гидролитического расщепления кинетически неустойчивых макромолекул. В соответствии с принципами микроскопической обратимости один и тот же активный центр способен ускорять как прямой, так и обратный процесс. В рамках нашего подхода при низких концентрациях воды и высоких температурах катализатор может участвовать в синтезе мономер–мономерной связи, при низких температурах – в гидролизе и отборе нестабильных структур. При этом гидролитические процессы приводят к регенерации мономеров, способных при следующем термоцикле участвовать в образовании новых макромолекул. Это одно из главных качеств эволюционной комбинаторики. В соответствии с этими представлениями эволюция катализатора C должна иметь автокаталитический характер (см. систему уравнений (2)). Эволюционная динамика протобиокатализатора задает возможности экспоненциального развития других компонентов системы.
Кинетическое моделирование и анализ полученных решений демонстрирует тот факт, что только с участием протобиокатализаторов C в синтезе прото–РНК и прото–ДНК возможно наблюдать экспоненциально-эволюционное развитие системы (члены R C, D C, и P C в системе уравнений (3)). Более того, образование интерполимерных комплексов PC, RPC, DRC с участием каталитически активных полимерных молекул определяет возможности экспоненциального роста всех протополимеров системы. Возможные интерполимерные комплексы – прототипы клеточных органелл типа рибосом.
Разнообразие возможностей
Биополимерные молекулы, составляющие суть жизни на Земле, – продукт всего лишь одной химической реакции – реакции поликонденсации – образования связи мономер–мономер с выделением молекулы воды. При этом “биополимерная жизнь” базируется на предельно ограниченном наборе химических элементов – углероде, кислороде, фосфоре, водороде и азоте. Остальные элементы (железо, медь, селен, калий, натрий, кальций и др.) представлены в биоматериалах в следовых количествах и не входят в состав участников, образующих полимерные молекулы. Вместе с тем современная химия полимеров иллюстрирует гигантское разнообразие возможностей с участием кремния, бора, фосфора, металлов (алюминия, титана, олова и др.).
В табл. 1 приведен далеко не полный список связей мономер–мономер, синтезированных в современных химических лабораториях (Коршак, 1969).
Полимеры на базе этих структур могут быть основой принципиально отличной от земной эволюционной комбинаторики с созданием саморазмножающих (пролиферирующих) полимерных молекул. Гигантские возможности в этом плане лежат в области химии кремния. При этом кремний – органические полимеры обладают рядом выдающихся физических свойств и термостабильностью (Коршак, 1969). Разнообразие возможностей химии полимеров позволяет надеяться, что в других условиях, отличных от планеты Земля, жизнь может иметь принципиально другую химическую основу.
Температурные ограничения функционирования систем на основе полимеров имеет два принципиальных ограничения.
Термостабильность полимерных молекул
При высоких температурах макромолекулы нестабильны и деградируют на осколки различной химической природы.
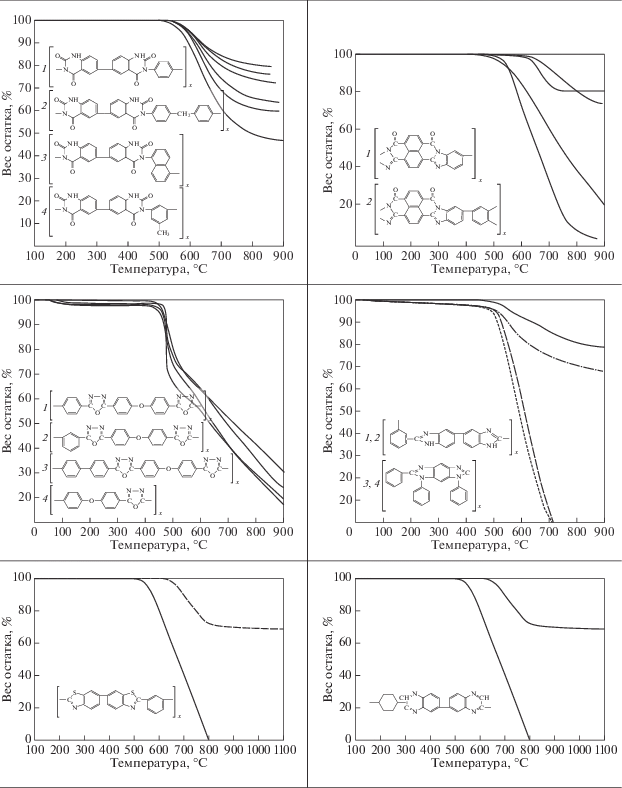
Одна из задач, которая решалась в области химии полимеров – создание материалов с высоким эксплутационными характеристиками, способными “работать” при высоких температурах. В табл. 2 приведены данные, взятые из монографии (Коршак, 1969) по изучению стабильности полимеров различной структуры. Исследовалась потеря веса образца от температуры.
Видно, что предельные условия, при которых полимеры сохраняют структуру, 500–700°С. Вывод, который следует из этих данных, заключается в том, что “полимерная жизнь” на основе термостабильных полимеров, возможна на любой планете солнечной системы: Меркурий (350°С), Венера (450°С), Земля (0°С), Марс (–50°С), Юпитер (–120°С), Сатурн (–120°С).
Принципиальное ограничение возникновения “полимерной жизни” заключается в зависимости скорости химических реакций от температуры. Ограничения отсутствуют для реакций полимеризации на Земле, Венере и Меркурии. Для Меркурия и Венеры в силу высоких температур процессы полимеризации могут идти существенно быстрее, чем на Земле. При переходе от 150°С (полимеризация в пике термоциклов на Земле) к 300°С (полимеризация на Венере и Меркурии) процесс ускорения приблизительно в 35 000 раз.
Полимеризационные процессы драматически замедляются при переходе к низким температурам Марса, Юпитера или Сатурна. Если принять температуру поверхности Марса – 50°С, а Сатурна (Юпитера) –150°С, то кинетика полимеризации замедляется в 106–109 раз. Расчеты, проведенные в (Varfolomeev, 2007) показывают, что стадия протополимерной эволюции на Земле заняла ~100 млн лет. С учетом температурного замедления эти процессы на Марсе, Сатурне или Юпитере должны были бы протекать 1014–1017 лет. Если принять возраст Солнечной системы 5 × 1019 лет, становится очевидным, что “полимерная жизнь” на холодных планетах Марс, Юпитер, Сатурн возникнуть не могла. При этом локальные изменения температуры типа вулканической деятельности существенно на возникновение “протополимерной жизни” повлиять не могут, поскольку главная черта развиваемой концепции – термоцикл. Длительность термоцикла определяется частотой вращения Земли вокруг своей оси.
Работа выполнена в рамках государственного задания “Молекулярный дизайн, структурно-функциональный анализ и регуляция ферментных систем, клеточных конструкций, бионаноматериалов: фундаментальные основы и приложения в технологии, медицине, охране окружающей среды”, № АААА-А21-121011290089-4; а также при поддержке Программы Президиума РАН “Эволюция органического мира и планетарных процессов” (грант I.22п).
Список литературы
Варфоломеев С.Д., Гуревич К.Г. (1999) Биокинетика. М.: Фаир-Пресс, 720 с.
Галимов Э.М. (2001) Феномен жизни: между равновесием и нелинейностью. Происхождение и принципы эволюции. М.: Едиториал УРСС, 256 с.
Коршак В.В (1969) Термостабильность полимеров. М.: Наука, 411 с.
Demina O.V., Kononikhin A.S., Laptev A.V., Khodonov A.A., Nikolaev E.N., Varfolomeev S. D. Modelling of prebiotic synthesis and selection of peptides under isothermal conditions and thermal cycling mode. (2012) Russ. Chem. Bull. 61(2), 422-441.
Eigen M. (1971) Self-Organization of Matter and the Evolution of Biological Macromolecules. Berlin: Springer Verlag, 108 p.
Fox S.W. (1988) The Emergence of Life: Darwinian Evolution from the Inside. New York: Basic Books, 244 p.
Kauffman S.A. (1993) The Origin of Order: Self-Organization and Selection in Evolution. Oxford: Oxford University Press, 734 p.
Orgel L.E. (1973) The Origin of Life: Molecules and Natural Selection. New York: John Wiley, 238 p.
Varfolomeev S.D. (2007) Kinetic models of the prebiological evolution of macromolecules. Thermocucle as the motive force of the process. Mendeleev Commun. 17(1), 7-9.
Varfolomeev S. D., Lushchekina S.V. (2014) Prebiotic synthesis and selection of macromolecules: Thermal cycling as a condition for synthesis and combinatorial selection. Geochem. Int. 52(13), 1197-1206.
Varfolomeyev S.D., Gurevich K.G. (2001) The hyperexponential growth of the human population on a macrohistorical scale. J. Theor. Biol. 212(3), 367-372.
Дополнительные материалы отсутствуют.