Геохимия, 2021, T. 66, № 3, стр. 281-288
Физико-химическое и калориметрическое изучение алюминокопиапита и термодинамические свойства минералов копиапитовой группы
Л. П. Огородова a, *, Ю. Д. Гриценко a, b, М. Ф. Вигасина a, Д. А. Косова c, Л. В. Мельчакова a, Д. А. Ксенофонтов a, С. К. Дедушенко c
a Московский Государственный Университет им. М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские Горы, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
19692 Москва, Ленинский просп., 18, Россия
c Московский Государственный Университет им. М.В. Ломоносова, Химический факультет
11991 Москва, Ленинские Горы, Россия
* E-mail: logor@geol.msu.ru
Поступила в редакцию 21.10.2019
После доработки 05.12.2019
Принята к публикации 09.12.2019
Аннотация
Проведено физико-химическое изучение природного основного водного сульфата алюминия и железа – алюминокопиапита состава (Al0.60${\text{Fe}}_{{0.07}}^{{3 + }}$)${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.03(OH)1.95 ⋅ 19.54H2O (Блява, Южный Урал, Россия) методами порошковой рентгенографии, инфракрасной и мёссбауэровской спектроскопии, термического анализа. На высокотемпературном теплопроводящем микрокалориметре Тиана-Кальве “Сетарам” (Франция) методом высокотемпературной расплавной калориметрии растворения определена энтальпия его образования из элементов ${{\Delta }_{f}}H_{{el}}^{0}$(298.15 K) = –11 826 ± 58 кДж/моль. Оценены величины стандартных энтропий и энергий Гиббса образования изученного алюминокопиапита и других минералов копиапитовой группы.
ВВЕДЕНИЕ
Минералы группы копиапита имеют общую формулу $M{\text{Fe}}_{4}^{{3 + }}$[SO4]6(OH)2 ⋅ 20H2O, где M = Fe2+, 2/3Fe3+, 2/3Al3+, Mg, Ca, Zn, Cu. Такие различия в химическом составе способствуют образованию нескольких разновидностей копиапита: ферри-, ферро-, магнезио-, купро-, алюмино- и цинкокопиапита (IMA, 2017). Минералы этой группы, среди которых алюминокопиапит генетически преобладает, имеют широкое географическое распространение. Структура копиапита построена из бесконечных тетраэдрически-октаэдрических цепей состава [${\text{Fe}}_{4}^{{3 + }}$(H2O)8(OH)2(SO4)6] параллельных плоскости [101], изолированных катионов M, октаэдрически координированных шестью молекулами воды M(H2O)6, и шести молекул воды, находящихся в интерстициях и связанных с каркасом слабыми водородными связями (Hawthorne et al., 2000). Таким образом, имеющиеся в структуре копиапита двадцать молекул воды занимают три различные кристаллографические позиции (Wang et al., 2012). Особенности этих позиций воды определяют легкость ее потери при обезвоживании минерала. По данным (Majzlan, Michallik, 2007) копиапиты могут быть разделены на две большие группы в зависимости от ориентации структурных фрагментов. Одна группа (AL) состоит из копиапитов, где M = Al3+, Fe2+ или Fe3+; другая группа (MG) состоит из копиапитов с M = Mg2+, Ca2+, Zn2+, Ni2+. Ферри- и алюминокопиапиты (Fe3+и Al3+ в позиции M) образуют непрерывную серию твердых растворов, в то время как AL и MG группы копиапитов не образуют между собой непрерывных изоморфных рядов. Копиапиты кристаллизуются в триклинной сингонии, пространственная группа $P\bar {1}.$
Минералы группы копиапита образуются в гипергенных условиях в районах современной вулканической деятельности (Назарова и др., 2011; Rodrígues, van Bergen, 2017); при химическом выветривании железосодержащих минералов, особенно сульфидов на колчеданных месторождениях (Хлыбов, Симакова, 2005), окисление которых обычно и приводит к образованию безводных и водных сульфатов, гидроксисульфатов и других соединений. Добыча и переработка сульфидных руд дают значительное количество отвалов, в которых также происходит накопление продуктов окисления сульфидов. В дальнейшем образовавшиеся сульфаты вымываются, создавая кислотные стоки, загрязняющие окружающую среду. Экологические риски, связанные с кислотным дренажом на сульфидсодержащих рудных месторождениях, оценены в работах (Лиманцева и др., 2015; Рыженко и др., 2015) с помощью компьютерного моделирования равновесного состояния многокомпонентной системы H–O–K–Na–Li–Ca–Mg–Fe–Mn–Al–Si–Ti–P–Cl–F–C– S–N–As–Ba–Be–Cd–Co–Cr–Cu–Mo–Ni–Pb–Se–Sr–V–W–Zn–Zr с участием 125 твердых фаз и 190 простых и комплексных частиц в водном растворе с использованием программного комплекса HCh (Шваров, 2008). Моделирование процессов минералообразования при различных температурах и давлениях является в настоящее время практически основным способом изучения истории развития планет Солнечной системы. Так, например, в работе (Marion et al., 2008) было проведено моделирование минеральных равновесий в диапазоне температур от – 70 до + 25°С и давлений от 1 до 1000 бар в системе Na–K–Mg–Ca–Fe2+–Fe3+–H–Cl–${\text{SO}}_{4}^{{2 - }}$–${\text{NO}}_{3}^{ - }$–OH––${\text{HCO}}_{3}^{ - }$–${\text{CO}}_{3}^{{2 - }}$–CO2–O2–CH4–H2O, что является геохимической моделью поверхности Марса. При этом были использованы оценочные значения термодинамических величин (энтальпии и энергии Гиббса образования) для многих железосодержащих соединений и минералов, в том числе копиапита (Hemingway et al., 2002). Других сведений о термодинамических свойствах минералов группы копиапита не обнаружено. Приведенная в работе (Majzlan et al., 2006) величина ${{\Delta }_{f}}H_{{el}}^{0}$(298.15 K) была получена для синтезированного аналога феррикопиапита cостава Fe4.78[SO4]6(OH)2.34 ⋅ (H2O)20.71.
Бóльшая часть имеющихся в настоящее время публикаций, посвященных изучению минералов группы копиапита и их синтетических аналогов, относится к определению их структуры и параметров элементарной ячейки (Kashkai, Alijev, 1960; Süsse, 1972; Fanfani et al., 1973; Bayliss, Atencio, 1985; Majzlan, Kiefer, 2006; Majzlan, Michallik, 2007; Maizlan et al., 2011; Santos et al., 2014; Sobron et al., 2014; Wang, Zhou, 2014). В работах (Majzlan, Michallik, 2007; Ling, Wang, 2010; Maizlan et al., 2011; Wang et al., 2012; Dyar et al., 2013; Sobron et al., 2014; Wang, Zhou, 2014; Buzatu et al., 2016) методами спектроскопии комбинационного рассеяния, инфракрасной и мёссбауэровской спектроскопии исследованы образцы копиапита природного и искусственного происхождения. Сведения об алюминокопиатите ограничиваются незначительным количеством работ, посвященных главным образом рентгенографическому изучению и исследованию химического состава (Jolly, Foster, 1967; Zodrow, 1980; Bayliss, Atencio, 1985; Jamieson et al., 2005; Santos et al., 2014).
Целью настоящей работы явилось физико-химическое и калориметрическое изучение природного образца алюминокопиапита и расчет термодинамических констант минералов копиапитовой группы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Изучен образец копиапита из медно-цинкового месторождения Блява (Южный Урал, Россия) из фондов Минералогического музея им. А.Е. Ферсмана РАН (образец № 67687). Образец представлен мелкозернистыми агрегатами кремового цвета.
Рентгенографическое изучение выполнено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge (III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 0.178897 Å). Сбор данных осуществлялся в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора, угол захвата которого составлял 5° по углу 2Θ с шириной канала 0.02°.
Химический анализ выполнен с помощью электронно-зондового микроанализатора “CAMEBAX-MICROBEAM” (Франция) c энергодисперсионным Si(Li)-детектором и системой анализа INCA Energy Oxford (ускоряющее напряжение 20 кВ, ток пучка 30 нА).
ИК-спектроскопическое изучение проведено на Фурье-спектрометре “ФСМ-1201” (ЛОМО, Россия) в диапазоне от 400 до 4000 см–1 с точностью определения частот ±2 см–1 в режиме пропускания при комнатной температуре на воздухе на образцах, приготовленных в виде суспензии в вазелиновом масле.
Термическое поведение копиапита изучено на термовесах “NETZSCH TG 209 F1" (Германия) в потоке азота (40 мл/мин) со скоростью нагревания 10 K/мин на образце массой 4.43 (±2 × 10−2) мг. Термовесы откалиброваны по температуре плавления стандартных веществ (Ag, Al, Bi, In, Sn 99.999% чистоты).
Абсорбционный мёссбауэровский спектр был записан при комнатной температуре на спектрометре “MS-1101” (Россия), работающем в режиме постоянного ускорения, с использованием стандартного мёссбауэровского источника 57Со в матрице металлического родия активностью около 5 мКи (АО “РИТВЕРЦ”, Россия). Изомерные сдвиги представлены относительно α-железа. Моделирование спектров осуществлялось при помощи компьютерной программы HappySloth (www.happysloth.ru).
Калориметрическое исследование выполнено на высокотемпературном теплопроводящем микрокалориметре Тиана–Кальве “SETARAM” (Франция). Для определения энтальпии образования копиапита использован метод растворения в расплаве состава 2PbO ⋅ B2O3. При растворении образцы массой 2.5–10.5 (±2 × 10–3) мг сбрасывали от комнатной температуры в расплав–растворитель, находящийся в калориметре при T = 973 K, при этом измеряли тепловой эффект, включающий приращение энтальпии минерала и энтальпию его растворения [H0(973 K)–H0(298.15 K) + + ΔраствH0(973 K)] (Киселева и Огородова, 1983). При проведении 6–8 опытов по растворению в одной порции расплава (30–35 г) соотношение растворенное вещество – растворитель может быть отнесено к бесконечно разбавленному раствору с близкой к нулю энтальпией смешения. Калибровку калориметра осуществляли по приращению энтальпии [H0(973 K)–H0(298.15 K)] эталонного вещества – платины (Robie, Hemingway, 1995).
Электронно-зондовый микроанализатор “CAMEBAX-MICROBEAM” установлен в Минералогическом музее им. А.Е. Ферсмана РАН; порошковый дифрактометр “STOE-STADI MP”, инфракрасный Фурье-спектрометр “ФСМ-1201” и микрокалориметр Тиана-Кальве "SETARAM” установлены на геологическом факультете МГУ имени М.В. Ломоносова; термовесы “NETZSCH TG 209 F1” и мёссбауэровский спектрометр “MS-1101” – на химическом факультете МГУ им. М.В. Ломоносова.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химическое изучение
По данным рентгендифракционного и микрозондового анализов изученный минерал является алюминокопиапитом (Jolly, Foster, 1967) и имеет следующий состав (мас. %): MgO 0.01; CuO 0.06; Al2O3 2.52; Fe2O3 26.91; SO3 40.09.
Cпектр инфракрасного поглощения изученного образца (рис. 1а) близок к спектру алюминокопиапита (№ S28) из рудника Алькапарроса (Калама, Чили), приведенному в справочном издании (Chukanov, 2014). В высокочастотной части спектра (2700–3600 см–1) наблюдается широкая интенсивная полоса поглощения (с максимумами около 3125 и 3400 см–1), приписываемая валентным колебаниям ОН-групп, ассоциированных в молекулы воды. На высокочастотном крыле этой полосы регистрируется узкая полоса малой интенсивности при 3529 см–1, которая согласно (Majzlan, Michallik, 2007; Majzlan et al., 2011) может быть отнесена к валентным колебаниям гидроксильных групп из октаэдрического окружения катионов железа. Деформационные колебания молекул воды представлены узкой интенсивной полосой поглощения (максимум при 1638 см–1) с плечом при 1687 см–1. В области структурных колебаний регистрируется интенсивная раздвоенная полоса, соответствующая антисимметричным валентным колебаниям (1185, 1148, 1113 см–1) и симметричным валентным колебаниям (995 см–1) сульфат-иона.
Рис. 1.
Спектры ИК-поглощения изученного алюминокопиапита (а) и продуктов его нагревания до Т = 400 K (б), Т = = 500 K (в) и Т = 750 K (г).
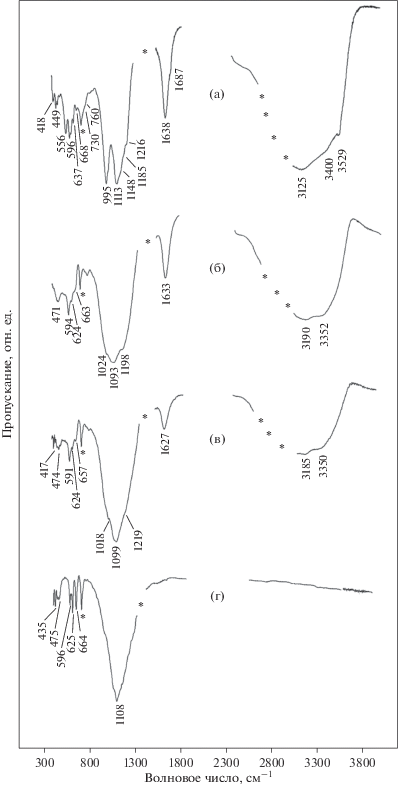
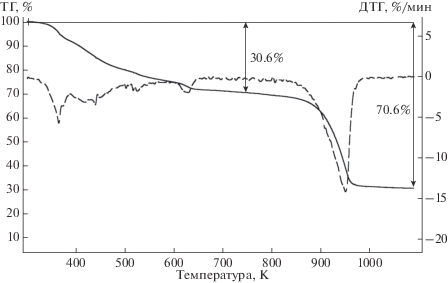
Общий вид термогравиметрических кривых (ТГ и ДТГ) (рис. 2) характерен для всех минералов группы копиапита (Kashkai, Alijev, 1960; Fanfani et al., 1973; Иванова и др., 1974; Földvári, 2011). Образец начинает терять массу с существенной скоростью при температуре около 340 K, полное разложение заканчивается при 1090 K. Авторы вышеупомянутых работ относят потерю массы интервале от 340 до 600 K к дегидратации минерала (удаление воды в молекулярной форме), в интервале от 600 до 660 K – к дегидроксилизации (удаление конституционной воды в виде гидроксильных групп); в интервале 800–1090 K – к десульфатизации копиапита. Нами было проведено ИК-спектроскопическое исследование продуктов поэтапного обезвоживания изучаемого алюминокопиапита. В спектре поглощения образца, нагретого до Т = 400 K c потерей массы ~8.7% (рис. 1б), отмечается: 1) заметное уменьшение интенсивности полосы поглощения валентных колебаний ОН-групп, входящих в молекулы воды (3100–3400 см–1) в структуре минерала, и полосы поглощения, соответствующей конституционной воде в виде гидроксильных групп (около 3524 см–1); 2) уменьшение количества воды в минерале также приводит к снижению интенсивностей полос, соответствующих либрационным колебаниям молекул воды и ОН-групп (около 672, 624, 558 см–1); 3) в области валентных колебаний сульфат-аниона (1200–990 см–1) наблюдается практически полное исчезновение полосы, относящейся к симметричным валентным колебаниям тетраэдра [SO4]2– (около 997 см–1), что указывает на изменение структуры минерала. При этом образец кремового цвета приобретает коричневато-рыжий оттенок, свидетельствующий об образовании триоксида железа, что подтверждает начало процесса дегидроксилизации алюминокопиапита. Спектры ИК-поглощения образцов, нагретых до 500 K (этап 400–500 K с потерей 8.6% массы) и 600 K (этап 500–600 K с потерей 8.7% массы) аналогичны друг другу и обнаруживают дальнейшее уменьшение количества воды и продолжающееся изменение кристаллической структуры вещества (спектр минерала после нагрева до 500 K приведен на рис. 1в). Спектр образца, нагретого до 750 K (рис. 1г), подтверждает полное обезвоживание минерала и наличие в безводном продукте сульфатов железа и алюминия, а также оксида железа(III), на что указывает красно-коричневый цвет продукта прокаливания. Общее количество выделившейся при нагревании воды получилось равным 30.6%. Содержание триоксида серы (40.0%) согласуется с данными микрозондового анализа.
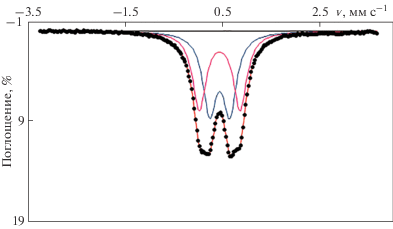
Абсорбционный мёссбауэровский спектр изученного образца (рис. 3) согласуется с данными для копиапитов (Dyar et al., 2013) и представляет собой суперпозицию двух уширенных линий поглощения, близких по интенсивности и ширине. Центр тяжести спектра находится около 0.43 мм с–1. Вершина каждой линии имеет два выраженных максимума, что указывает на присутствие в структуре минерала нескольких позиций железа. Спектр был разложен на два симметричных лоренцевых квадрупольных дублета с одинаковыми изомерными сдвигами (IS1, 2 = 0.43(1) мм с–1, QS1 = 0.41(1) мм с–1, QS2 = 0.84(1) мм с–1, FWHM1, 2 = 0.34(1) мм с–1), площадями и ширинами линий. Полученные параметры обоих дублетов соответствуют трехвалентному железу в высокоспиновом состоянии. В спектре отсутствует значимое поглощение при скоростях более 0.8 мм с–1, что указывает на отсутствие в образце двухвалентного железа. В соответствии с представлением о структуре копиапита (Hawthorne et al., 2000) трехвалентное железо занимает две октаэдрические структурно неэквивалентные позиции, чередующиеся в бесконечных цепях [${\text{Fe}}_{4}^{{3 + }}$(H2O)8(OH)2(SO4)6], при этом позиции полностью заселены железом. Согласно данным химического анализа позиции островного катиона М заняты главным образом алюминием.
Исходя из данных химического и термического анализов, мёссбауэровской спектроскопии химическая формула изученного минерала, рассчитанная на 14 зарядов, имеет вид: (Al0.60${\text{Fe}}_{{0.07}}^{{3 + }}$)${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.03(OH)1.95 ⋅ 19.54H2O.
Калориметрическое изучение
На микрокалориметре Кальве было проведено семь определений величины [H0(973 K) –‒ H0(298.15 K) + ΔраствH0(973 K)] для изучаемого алюминокопиапита, среднее из экспериментальных значений составило: 1263.2 ± 32.1 Дж/г = 1525.8 ± 38.8 кДж/моль (М = 1207.93 г/моль), погрешность рассчитывалась с вероятностью 95%.
Энтальпия образования изученного алюминокопиапита из элементов была рассчитана с использованием полученных калориметрических данных, реакции (1) и уравнений (2) и (3).
(1)
$\begin{gathered} {\text{4}}{\text{.07/2F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{ }}41.0{\text{3/3Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} + {\text{ }}6.03{\text{CaS}}{{{\text{O}}}_{{\text{4}}}} = \\ = {\text{(A}}{{{\text{l}}}_{{{\text{0}}{\text{.60}}}}}{\text{)}}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{{{\text{6}}{\text{.03}}}}}{{\left( {{\text{OH}}} \right)}_{{{\text{1}}{\text{.95}}}}} \cdot 19.54{{{\text{H}}}_{{\text{2}}}}{\text{O }} + \\ + \,\,{\text{39}}{\text{.23/6A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{ }}6.03{\text{CaO}}, \\ \end{gathered} $(2)
$\begin{gathered} {{\Delta }_{{{\text{р - ции(1)}}}}}{{H}^{0}}\left( {298.15{\text{ }}K} \right) = \\ = \Sigma {{\nu }_{i}}\Delta H{\text{ком}}{{{\text{п}}}_{i}} - \Delta H{\text{минерала}}, \\ \end{gathered} $(3)
$\begin{gathered} {{\Delta }_{f}}\left( {298.15{\text{ K}}} \right){\text{минерала}} = {{\Delta }_{{{\text{р - ции(1)}}}}}{{H}^{0}}\left( {298.15{\text{ K}}} \right) + \\ + \,\,\Sigma {{\nu }_{i}}{{\Delta }_{f}}\left( {298.15{\text{ }}K} \right){\text{ком}}{{{\text{п}}}_{i}}, \\ \end{gathered} $Таблица 1.
Термохимические данные, использованные в расчетах энтальпий образования копиапитов (кДж/моль)
| Компонент | ΔHа | – Δf$H_{{{\text{el}}}}^{0}($2.15 K)б |
|---|---|---|
| ZnO(цинкит) | 50.8 ± 1.2в | 350.5 ± 0.3 |
| CuO(тенорит) | 70.10 ± 0.84г | 156.1 ± 2.0 |
| MgO(периклаз) | 36.38 ± 0.59д | 601.6 ± 0.3 |
| CaO(к.) | –21.78 ± 0.29е | 635.1 ± 0.9 |
| Fe2O3(гематит) | 171.6 ± 1.9ж | 826.2 ± 1.3 |
| Al2O3(корунд) | 107.38 ± 0.59з | 1675.7 ± 1.3 |
| CaSO4(ангидрит) | 131.3 ± 1.6и | 1434.4 ± 4.2 |
| Al(OH)3(гиббсит) | 172.6 ± 1.9к | 1293.1 ± 1.2 |
Примечания. аΔH = [H0(973 К) – H0(298.15 К) + + Δрас твH0(973 К)]. бСправочные данные (Robie, Hemingway, 1995).вПо данным (Rodriges et al., 2000). г–иРассчитано с использованием справочных данных по [H0(973 К) – ‒ H0(298.15 К)] (Robie, Hemingway, 1995) и экспериментальных данных по растворению ΔраствH0(973 К). г (Kiseleva et al., 1992), д(Navrotsky, Coons, 1976), е(Киселева и др., 1979), ж(Киселева, 1976), з(Ogorodova et al., 2003), и(Котельников и др., 2000), кПо данным (Огородова и др., 2011).
Таблица 2.
Термодинамические свойства минералов группы копиапита, полученные в настоящей работе
| Состав минерала | Молекулярная масса, г/моль | –ΔfH0(298.15 K), кДж/моль |
S0(298.15 K), Дж/(K моль) |
–ΔfG0(298.15 K), кДж/моль |
|---|---|---|---|---|
|
(Al0.60${\text{Fe}}_{{0.07}}^{{3 + }}){\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.03(OH)1.95 ⋅ 19.54H2O изученный копиапит |
1207.93 | 11 826 ± 58 | 1345.0 | 9935 ± 58 |
|
Cu1.00${\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O купрокопиапит |
1257.63 | 11 570 ± 59 | 1387.7 | 9657 ± 59 |
|
${\text{Fe}}_{{0.67}}^{{3 + }}{\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O феррикопиапит |
1231.50 | 11 670 ± 59 | 1371.6 | 9757 ± 59 |
|
Zn1.00${\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O цинкокопиатит |
1259.48 | 11 786 ± 59 | 1388.1 | 9871 ± 59 |
|
${\text{Fe}}_{{1.00}}^{{2 + }}{\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O копиапит |
1249.93 | 11 807 ± 59 | 1386.0 | 9896 ± 59 |
|
Al1.00${\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O алюминокопиапит |
1212.16 | 11 952 ± 59 | 1361.6 | 10036 ± 59 |
|
Mg1.00${\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O магнезиокопиапит |
1218.39 | 11 999 ± 58 | 1374.3 | 10083 ± 58 |
|
Ca1.00${\text{Fe}}_{{4.00}}^{{3 + }}$O4]6.00(OH)2.00 ⋅ 20H2O кальциокопиапит |
1234.17 | 12 111 ± 58 | 1381.4 | 10194 ± 58 |
Энергия Гиббса образования изученного алюминокопиапита из элементов была рассчитана с учетом оцененного нами значения его стандартной энтропии, отсутствующего в литературе. Расчет S0(298.15 K) проводили по методу Латимера с использованием усредненных значений энтропий, приходящихся на катионы и анионы в твердых веществах, и энтропийного вклада воды (Наумов и др., 1971). Основываясь на величинах S0(298.15 K) и Δf$H_{{el}}^{0}$(298.15 K), мы рассчитали значение Δf$G_{{el}}^{0}$(298.15 K) изученного алюминокопиапита (табл. 2).
Термодинамические характеристики минералов копиапитовой группы теоретического состава. На основании полученных экспериментальных данных по растворению природного образца алюминокопиапита были оценены энтальпии образования всех членов копиапитовой группы: купрокопиапита Cu1.00${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.00(OH)2.00 ⋅ 20H2O, феррикопиапита ${\text{Fe}}_{{0.67}}^{{3 + }}$${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.00(OH)2.00 ⋅ 20H2O, цинкокопиатита Zn1.00${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.00(OH)2.00 ⋅ 20H2O, собственно копиапита (феррокопиапита) ${\text{Fe}}_{{1.00}}^{{2 + }}$${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.00(OH)2.00 ⋅ 20H2O, алюминокопиапита Al0.67${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.00(OH)2.00 ⋅ 20H2O и магнезиокопиапита Mg1.00${\text{Fe}}_{{4.00}}^{{3 + }}$[SO4]6.00(OH)2.00 ⋅ 20H2O. Результаты калориметрических измерений были пересчитаны на молекулярные массы копиапитов теоретических составов. Расчет значений Δf$H_{{el}}^{0}$(298.15 K) проводили с использованием реакций и уравнений, аналогичных (1–3). Оценку стандартных энтропий также проводили по методу Латимера. Полученные величины энтальпий образования и энтропий были использованы для расчета значений стандартных энергий Гиббса образования из элементов (табл. 2). Значение Δf$H_{{el}}^{0}$(298.15 K) копиапита, равное –11807 ± 59 кДж/моль, согласуется с величиной, оцененной в (Hemingway et al., 2002) (–11 824 кДж/моль). Как видно из табл. 2, наиболее термодинамически устойчивым в группе является кальциокопиапит, обладающий наиболее отрицательным значением Δf$G_{{el}}^{0}$(298.15 K); наименее устойчивым является купрокопиапит.
Полученные термодинамические константы для минералов группы копиапита могут быть рекомендованы для включения в базы термодинамических данных минералов, используемых при моделировании процессов минералообразования.
Список литературы
Иванова В.П., Касатов Б.К., Красавина Т.Н., Розинова Е.Л. (1974) Термический анализ минералов и горных пород. Ленинград: Недра, 399 с.
Киселева И.А. (1976) Термодинамические свойства и устойчивость пиропа. Геохимия. (6), 845-854.
Киселева И.А., Огородова Л.П. (1983) Об использовании высокотемпературной калориметрии растворения для определения энтальпий образования гидроксил-содержащих минералов (на примере талька и тремолита). Геохимия. (12), 1745-1755.
Киселева И.А., Огородова Л.П., Топор Н.Д., Чигарева О.Г. (1979) Термохимическое исследование системы СаО–MgO–SiO2. Геохимия. (12), 1811-1825.
Котельников А.Р., Кабалов Ю.К., Зезюля Т.Н., Мельчакова Л.В., Огородова Л.П. (2000) Экспериментальное изучение твердого раствора целестин-барит. Геохимия. (12), 1286-1293.
Kotel’nikov A.R., Kabalov Yu K., Zezyulya T.N., Mel’chakova L.V., Ogorodova L.P. (2000) Experimental study of celestine -barite solid solution. Geochem. Int. 38(12), 1181-1187.
Лиманцева О.А., Рыженко Б.Н., Черкасова Е.В. (2015) Прогноз влияния кислотного дренажа на изменение гидрогеохимической обстановки в районах сульфидсодержащих месторождений. Геохимия. (10), 945-960.
Limantseva O.A., Ryzhenko B.N., Cherkasova E.V. (2015) Prediction of the Effects of Acid Mine Drainage on Variations in the Hydrogeochemical Environment at Sulfide-Bearing Ore Deposits. Geochem. Int. 53(10), 922-934.
Назарова М.Ф., Вергасова Л.П., Овсянников А.А., Сергеева С.В. (2011) Изучение фумарольных минералов изоморфного ряда галотрихит-пиккеренгит. Материалы конференции, посвященной Дню вулканолога “Вулканизм и связанные с ним процессы”, Петропавловск Камчатский ИВиС ДВО РАН, 150-153.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин (для геологов). М.: Атомиздат, 239 с.
Огородова Л.П., Киселева И.А., Мельчакова Л.В., Вигасина М.Ф., Спиридонов Э.М. (2011) Калориметрическое определение энтальпии образования пирофиллита. ЖФХ. (9), 1609-1611.
Рыженко Б.Н., Белова Т.П., Рябенко А.Е., Черкасова Е.В. (2015) Оценка кислотного дренажа на рудных месторождениях. Геоэкология. (5), 415-424.
Хлыбов В.В., Симакова Ю.С. (2005) Гипергенная сульфатная минерализация на келловейских глинах реки Ухтым (западное Притиманье). Вестник. (6), 9-11.
Bayliss P., Atencio D. (1985) X-ray powder-diffraction data and cell parameters for copiapite group minerals. Can. Mineral., 23, 53-56.
Buzatu A., Dill H.G., Buzgar N., Damian G., Maftei A.E., Apopei A.I. (2016) Efflorescent sulfates from Baia Sprie mining area (Romania) – Acid mine drainage and climatological approach. Sci. Total Environ. 542, 629-641.
Chukanov N.V. (2014) Infrared Spectra of Mineral Species: Extended Library. Springer-Verlag GmbH, Dordrecht–Heidelberg–New York–London, 1703 p.
Dyar M.D., Breves E., Jawin E., Marshand G., Nelms M., O’Connor V., Peel S., Rothstein Y., Sklute E.C., Lane M.D., Bishop J.L., Mertzman S.A. (2013) What lurks in the Martian rocks and soil? Investigations of sulfates, phosphates, and perchlorates. Mössbauer parameters of iron in sulfate minerals. Am. Mineral. 98, 1943-1965.
Fanfani L., Nunzi A., Zanazzi P.F., Zanzari A.R. (1973) The Copiapite Problem: The Crystal Structure of a Ferrian Copiapite. Am. Mineral. 58, 314-322.
Földvári M. (2011) Handbook of thermogravimetric system of minerals and its use in geological practice. Occacional Papers of the Geological Institute of Hungary. 213, 180 p.
Hawthorne F.C., Krivovichev S.V., Burns P.C. (2000) The Crystal Chemistry of Sulfate Minerals in “Sulfate minerals: crystallography, geochemistry, and environmental significance” (Alpers C.N., Jambor J.L., Nordstrom D.K., eds.) Rev. Mineral. Geochem. 40, 608 p.
Hemingway B.S., Seal R.R., II, Chou I.-M. (2002) Thermodynamic data for modeling acide mine drainage problems: compilation and estimation of data for selected soluble iron-sulfate minerals. Open-File Report 02-161, U.S. Geol. Surv., Reston, VA.
IMA (2017) International Mineralogical Association, 2017. http://www.ima-mineralogy.org
Jamieson H.E., Robinson C., Alpers C.N., McCleskey R.B., Nordstrom D.K., Peterson R.C. (2005) Major and trace element composition of copiapite-group minerals and coexisting water from the Richmond mine, Iron Mountain, California. Chem. Geol. 215, 387-405.
Jolly J.H., Foster H.L. (1967) X-ray diffraction data of aluminocopiapite. Am. Mineral. 52(7, 8), 1220-1223.
Kashkai M.A., Alijev R.M. (1960) The new mineral – calciocopiapite (tuciit) of the copiapite group and the characteristics of this group in general. Trudy Azerbaidzhanskogo Geografi pcheskogo Obshchestva. 49-76.
Kiseleva I.A., Ogorodova L.P., Melchakova L.V., Bissengalieva M.R., Becturganov N.S. (1992) Thermodynamic properties of copper carbonates – malachite Cu2(OH)2CO3 and azurite – Cu3(OH)2(CO3)2. Phys.Chem.Miner. 19, 322-333.
Ling Z.C., Wang A. (2010) A systematic spectroscopic study of eight hydrous ferric sulfates relevant to Mars. Icarus. 209, 422-433.
Majzlan J., Kiefer B. (2006) An X-ray- and neutron-d-iffraction study of synthetic ferricopiapite, Fe14/3(SO4)6(OD,OH)2(D2O,H2O)20, and AB INITIO calculations on the structure of magnesiocopiapite, MgFe4(SO4)6(OH)2(H2O)20Can. Mineral. 44, 1227-1237.
Majzlan J., Michallik R. (2007) The crystal structures, solid solutions and infrared spectra of copiapite-group minerals. Mineral. Mag. 71(5), 553-569.
Majzlan J., Alpers C.N., Koch C.B., McCleskey R.B., Myneni S.C.B., Neil J.M. (2011) Vibrational, X-ray absorbtion, and Mössbauer spectra of sulfate minerals from the weathered massive sulfide deposit at Iron Mountain, California. Chem. Geol. 284, 296-305.
Majzlan J., Navrotsky A., McCleskey R.B., Alpers C.N. (2006) Thermodynamic properties and crystal structure refinement of ferricopiapite, coquimbite, rhomboclase, and Fe2(SO4)3(H2O)5Eur. J. Mineral., 18, 175-186.
Marion G.M., Kargel J.S., Catling D.C. (2008) Modelling ferrous-ferric iron chemistry with application to martian surface geochemistry. Geochim. Cosmochim. Acta. 72, 242-266.
Navrotsky A., Coons W.J. (1976) Thermochemistry of some pyroxenes and related compounds. Geochim. Cosmochim. Acta. 40, 1281-1295.
Ogorodova L.P., Melchakova L.V., Kiseleva I.A., Belitsky I.A. (2003) Thermochemical study of natural pollucite. Thermochim. Acta. 403, 251-256.
Robie R.A., Hemingway B.S. (1995) Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) pressure and at higher temperatures. U.S. Geol. Surv. Bull. 2131, 461 p.
Rodriges M.A., Navrotsky A., Francesca L. (2000) Thermochemistry of YBa2Cu3 –xMxOy(M = Ni, Zn) Physica. 329, 88-94
Rodrígues A., van Bergen M.J. (2017) Superficial alteration mineralogy in active volcanic systems: An example of Poás volcano, Costa Rica. J. Volcan. Geotherm. Research. 346, 54-80.
Santos E.S., Magalhães M.C.F., Abreu M.M., Macías F. (2014) Effect of organic/inorganic amendments of trace elements dispersion leachates from sulfide-containing tailings of the São Domingos mine, Portugal. Time evaluation Geoderma. 226–227, 188-203.
Shvarov Yu.V. (2008) HCh: New potentialities for the thermodynamic simulation of geochemical systems offered by Windows. Geochem. Int. 46, 834-839.
Sobron P., Bishop J.L., Blake D.F., Chen B., Rull F. (2014) Natural Fe-bearing oxides and sulfates from the Rio Tinto Mars analog site: Critical assessment of VNIR reflectance spectroscopy, laser Raman spectroscopy, and XRD as mineral identification tools. Am. Mineral. 99, 1199-1205.
Süsse P. (1972) Crystal structure and hydrogen bonding of copiapite. Z. Kristallogr. 135, 34-55.
Wang A., Zhou Y. (2014) Experimental comparison of the pathways and rates of the dehydration of Al-, Fe-, Mg- and Ca-sulfates under Mars relevant conditions. Icarus. 234, 162-173.
Wang A., Ling Z., Freeman J.J., Kong W. (2012) Stability field and phase transition pathways of hydrous ferric sulfates in the temperature range 50°C to 5°C: Implication for martian ferric sulfates. Icarus. 218, 622-643.
www.happysloth.ru: Левин Д.М., Дедушенко С.К. Свидетельство о регистрации программы для ЭВМ № 2 016 660 090.
Zodrow E.L. (1980) Hydrated sulfates from Sydney Coalfield, Cape Breton Island, Nova Scotia, Canada: the copiapite group. Am. Mineral. 65, 961-967.
Дополнительные материалы отсутствуют.