Геохимия, 2021, T. 66, № 7, стр. 630-645
Распределение форм металлов и оценка их биодоступности в водах суши Арктического региона (предложения к нормативам качества вод)
Т. И. Моисеенко a, *, Н. А. Гашкина a, М. И. Дину a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: moiseenko@geokhi.ru
Поступила в редакцию 12.05.2020
После доработки 25.11.2020
Принята к публикации 27.11.2020
Аннотация
В работе освещается уязвимость вод суши арктических регионов к региональным и глобальным потокам полиметаллического загрязнения, которая требует особых подходов к нормативам качества вод. Показано, что в большинстве случаев металлы присутствуют в низко минерализованных водах северных территорий в их ионных формах, которые определяют их высокую биодоступность для водных обитателей. Разработана модель расчета ионных форм нахождения металлов, в основе которой лежит математическое моделирование химических реакций, протекающих в природных водах. Для 22 ареалов исследований на Кольском регионе определены концентрации металлов (Hg, Cd, Pb, Ni, Cu, Al, Sr) и рассчитаны формы их нахождения в воде. В этих же точках изучена аккумуляция металлов в различных системах организма рыб (на примере сига). Показано, что биогеохимическая активность конкретных металлов определяет в первую очередь соотношение лабильных и нелабильных форм их нахождения в воде. Дана оценка биодоступности форм металлов в зависимости от геохимических условий водной среды и форм нахождения металлов (in situ) по результатам оригинальных исследований на озерах региона. Методами многомерного шкалирования и RDA-техники выявлены связи между содержаниями металлов в системах организма рыб и содержанием форм металлов в воде. Предложены значения предельно допустимых концентраций металлов с учетом их высокой биодоступности в северных низко минерализованных водах.
ВВЕДЕНИЕ
Поверхностные воды суши являются компонентом природы, сознательные преобразования или попутные изменения которых в результате человеческой деятельности наиболее существенные. Антропогенный фактор в формировании химического состава вод суши становится по значимости в одном ряду с природными геохимическими и биологическими процессами. Климатический фактор также влияет на качество вод через изменение гидрологических и биогеохимических циклов элементов, их биодоступности и экотоксичности. Вода – жизненно необходимый ресурс для всех живых организмов, включая человека, и среда обитания для водных организмов, ее качество может быть оценено по отношению к живым системам. В основе методов оценки качества вод (в экспериментальных или натурных условиях лежит изучение влияния свойств вод на водные экосистемы и их структурные элементы – отдельные организмы, популяции или сообщества. Рыбы (in situ) являются информативным индикатором качества вод и здоровья экосистем (Моисеенко, 2008; Whitfield, Elliott, 2002; Moiseenko et al., 2019).
Повышение уровня содержания металлов в водах суши наблюдается практически повсеместно как следствие их рассеивания в биосфере под влиянием как региональных выбросов металлургических производств и тепловых станций, так и трансграничных переносов. В снежном покрове Гренландии и высокой Арктике обнаружены повышенные концентрации таких опасных элементов как Hg, Cd и Pb (АМАР, 2002). Угроза нарастания содержаний металлов, связана с тем, что, попадая в окружающую среду, они включаются в биогеохимические циклы и накапливаются в живых организмах, включая человека, оказывая токсическое действие на них (Ковальский, 1974; Ермаков, Тютиков, 2008; Bjerregaard, Andersen, 2014; Amde et al., 2017; Moiseenko et al., 2018).
Несмотря на то, что большинство металлов в малых количествах необходимы для нормального функционирования водных организмов, в более высоких концентрациях они являются токсичными. Неэссенциальные микроэлементы, такие как Cd, Hg и Pb известны как высокотоксичные (Handbook on the Toxicology of Metals, 2014). Экотоксичность металлов для водных обитателей во многом определяется формами их нахождения, которые определяют их биодоступность – способность проникать и аккумулироваться в живых организмах, вызывая патологические нарушения (Жулидов, 1988; Моисеенко, 2019; Gandhi et al., 2011; Väänänena et al., 2018). Известно, что в природных водах металлы могут быть инактивированы путем связывания их с органическими лигандами природных вод (Варшал и др., 1979; Лапин, Красюков, 1986; Дину, 2017)
Природа Арктической зоны чрезвычайно уязвима к загрязнению в силу низкого уровня масс- и энергообменов в холодных широтах. В России качество вод и загрязнение водного объекта оценивается на основе установления превышения измеренных концентраций отдельных элементов и веществ к их Предельно допустимым концентрациям (ПДК), которые применяются для всех типов вод: от Арктики до степных регионов. Информация о предельно допустимых концентрациях тех или иных металлов в России (Перечень…, 1999), как и в Западных странах руководство по определению качества вод для водной жизни (Gideline, GL) (European commission, 2011; CCME, 2007; U.S. EPA, 2004) основывается на экспериментальных работах в аквариумах с тест-объектами. Эксперименты проводятся по принципу: один металл – организмы одного вида (возможно 2–3 тест-объекта). Экспериментальные работы с определением токсичных свойств элементов на тест-объектах (водных организмах) дают информацию об относительной опасности металлов в сопоставлении с друг другом. Однако параметры эксперимента и используемые тест-организмы имеют мало общего с природными условиями и популяциями.
В настоящее время управленческие организации в сфере охраны окружающей среды заявили о необходимости включения методов определения биодоступности металлов в оценки рисков загрязнения вод металлами и в экологическое регулирование качества вод (Smith et al., 2015; Magalhaes et al., 2015; Merrington et al., 2016; Väänänena et al., 2018). Недавно принятая Водная рамочная директива по качеству вод в ЕС подчеркивает необходимость включения в стандарты качества вод для Ni и Pb концентрации их биодоступных форм (European Commission, 2013). Агентство по охране окружающей среды США уже внедрило инструмент оценки биодоступности Cu в нормирование загрязнения вод этим элементом (U.S. EPA, 2007). В основе моделей лежит определение количества ионов металлов, которые обладают наибольшей проникающей способностью, т.е. биодоступностью.
Однако, существует ряд проблем применимости моделей биотических лигандов (BLM) для пресных мягких и ультрамягких вод, каковыми являются воды арктического бассейна. Например, из примерно 1500 обследованных озер и рек Швеции, половина оказалась за пределами калибровки BLM по величинам рН, РОВ и особенно из-за низкой карбонатной щелочности. При тестировании трех различных доступных сегодня моделей BLM по токсичности меди получали большую и статистически значимую разницу между результатами моделирования. Наибольшая неадекватность рассчитанных концентраций без эффекта токсичности получена в области низкой жесткости воды (Hoppe et al., 2015). В моделях сложно учесть все сопутствующие гидрологические и физико-химические факторы, которые влияют на формы нахождения металлов.
Целью работы было:
• Определить содержания общих и биодоступных форм металлов (Hg, Cd, Pb, Ni, Cu, Al, Sr), основываясь на математическом моделировании химических реакций, протекающих в природных водах и опираясь на фундаментальные законы аналитической и физической химии;
• Установить аккумуляцию металлов в различных системах организма типичного северного вида рыб (на примере сига Coregonus lavaretus L.) и выявить связь интенсивности биоаккумуляции с биодоступными формами содержания в воде (in situ) по результатам оригинальных исследований на озерах Кольского Севера России;
• Предложить корректировки к нормативам качества вод для Арктических регионов по содержаниям опасных металлов с учетом их биодоступности в низкоминерализованных водах суши холодных широт.
МАТЕРИАЛ И МЕТОДЫ
Объекты исследований
Объектами исследований были субарктические озера, расположенные на Северо-Западе России (Кольский Север). Схема расположения озер и точек обследования представлена на рис. 1. Среди всех арктических регионов этот регион является наиболее индустриально развитым, здесь сосредоточены плавильные медно-никелевые и горнорудные производства. Наиболее крупным озером среди исследованных является озеро Имандра, которое состоит из трех плесов (Большая, Йокостровская и Бабинская), соединенных узкими проливами. Остальные озера являются придаточной системой озера Имандра, воды из которых поступают в озеро Имандра. По своему генезису послеледникового периода все озера характеризуются как олиготрофные, с ультрапресными водами, что типично для озер субарктической зоны.
Рис. 1.
Картосхема исследуемого региона (1 – город; 2 – крупные промышленные предприятия; 3 – промзоны, отстойники, хвостохранилища; 4 – Кольская АЭС; 5 – станции отбора проб воды и вылова рыб).
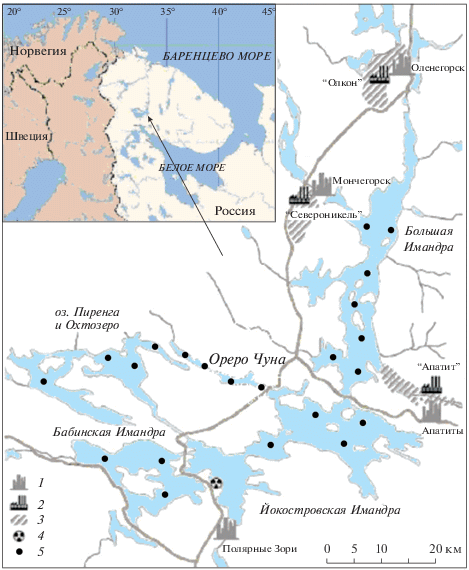
Исследуемые озера различаются по степени антропогенного влияния и геохимическим условиям формирования вод. Озеро Имандра (северный плес Большой Имандры) подвержены влиянию антропогенной нагрузки со стороны крупных металлургических и горно-обогатительных производств. Комбинат “Североникель” на протяжении многих лет являлся источником загрязнения озера сточными водами, содержащими тяжелые металлы. Загрязненные воды распространялись в Йокостровскую Имандру. Водосборная система, включая озера придаточной системы озера Имандра, были подвержены воздушному загрязнению дымовыми выбросами со стороны указанного производства, содержащими диоксид серы и аэрозоли металлов.
Были выделены определенные участки на озерах (22 локации) для гидрохимических и гидробиологических исследований (рис. 1). В этих локациях, различающихся по уровню и спектру загрязнения вод металлами, проведено определение химического состава вод, рассчитаны и измерены формы нахождения металлов, а также определены их содержания в органах и тканях рыб. Подчеркнём, что обследовался определенный ареал, который включал не менее 10 проб воды, при этом в каждом ареале производился отлов не менее 10 особей рыб).
Определение химического состава вод и металлов в воде
Пробы воды отбирались в полиэтиленовые бутыли фирмы Nalgen®, поверхность материала которых не имеет сорбирующих свойств. Бутылки были тщательно очищены в лаборатории и непосредственно перед отбором дважды ополаскивались водой из исследуемого озера. Отдельно отливались пробы воды объемом 20 мл для определения концентраций металлов. Образцы помещались в темные контейнеры и в охлажденном виде (приблизительно +4°C) транспортировались в сжатые сроки в лаборатории для дальнейшего анализа. В каждом озере обследовался ареал возможного обитания рыб, который включал не менее 15 проб воды (поверхность и дно).
Химический состав вод: рН, электропроводность (χ), Са2+, Mg2+, K+, Na+, щелочность (Alk), ${\text{SO}}_{4}^{{2 - }},$ Сl–, цветность (Цв), содержание органического вещества (DОС) по перманганатной окисляемости, ${\text{NO}}_{3}^{ - },$ NH4, общего азота (ТN), РО4, общего фосфора (ТР), Si выполнены по единым методикам в Институте Проблем промышленной экологии Севера КНЦ РАН (ИППЭС КНЦ РАН) в соответствии с рекомендациями (Eaton, 1992). Концентрации микроэлементов в подготовленных водных пробах определялись атомно-абсорбционным методом (GFAAS, model Perkin-Elmer – 5000, Corp., Norwalk, USA) с непламенной атомизацией (HGA-400) в лаборатории ИППЭС КНЦ РАН. Контроль качества измерений осуществлялся при жестком внутрилабораторном контроле, корректность полученных результатов подтверждалась ежегодными международными интеркалибрациями аналитических измерений лаборатории.
Формы нахождения металлов в воде
Формы нахождения элементов в водных пробах рассчитывались с помощью разработанной компьютерной программы, патент “ACIDFORMMET” № 2 015 617 036. (Дину, Моисеенко, 2015). В основе расчетов лежат: моделирование уравнений материального баланса; математическое выражение констант равновесий; уравнения электронейтральности; уравнения протонных равновесий в условиях конкурирующих реакций. В качестве исходных данных использовались физико-химические параметры водной среды.
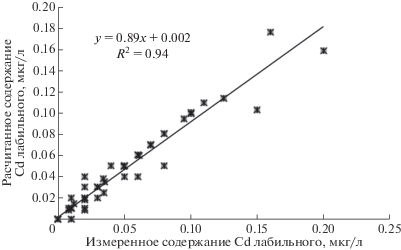
Верификации модели была проведена на основе более 100 озер Кольского полуострова, в которых были измерены лабильной и нелабильной формы. При натурном определении физико-химических форм элементов в природных водах следовали методике (Родюшкин, 1995), позволяющей определять содержания металлов в формах, входящих в состав взвешенной и растворенной фракций с последующим разделением последней на удаляемые и не удаляемые ион-обменной смолой (Dowex 50W-X8, 50–100 mesh в Na+ форме), т.е. на лабильные и нелабильные относительно смолы. К лабильным формам условно относятся неорганические соединения металлов, ионные формы и слабосвязанные с органическими компонентами; к нелабильным – металлы, наиболее прочно связанные с органическим веществом вод. На рис. 2 показана корреляция между измеренными и рассчитанными данными по Cd, которая показала хорошую сопоставимость и правомерность использования расчетных данных в дальнейших исследованиях.
Содержания металлов в органах и тканях рыб
Объектом для изучения биоаккумуляции был выбран сиг (Coregonus Lavaretus L.), который ведет достаточно оседлый образ жизни и больших миграций не совершает. Имеет обширные ареалы своего распространения в озерах субарктической зоны. Отбор проб от рыб осуществлялся в полевых условиях в один и тот же период (сентябрь) одновременно с обследованием гидрохимических условий их обитания. Чтобы свести к минимуму интернальные факторы, такие как созревание и возраст рыб, пробы отбирались в сентябре у неполовозрелых рыб в возрасте 4+ и 5+.
Биологические образцы высушивали до постоянного веса при 105°С. На анализ содержания элементов отбирались жабры, печень, почка, мышцы и скелет. Подготовка проб осуществлялась методом мокрого разложения в концентрированной азотной кислоте с добавлением перекиси водорода. Определение элементов в пробах воды в биологических образцах проводилось методом атомно-абсорбционной спектрофотометрии с графитовой атомизацией на приборах фирмы Perkin-Elmer (Perkin-Elmer-5000, Aanalyst-800 c Зеемановским корректором фона). Содержание ртути определялось на анализаторе ртути FIMS-100 (фирмы Perkin-Elmer). Для приготовления шкал использовались стандартные растворы фирмы Merck. Общий объем проб органов и тканей на содержание в них микроэлементов превысил 1500 образцов.
Учитывая, что объем выборок неравнозначен по содержанию металлов в воде и в системах организма рыб, определялось их средневзвешенное значение по 22 районам. Каждая из выборок обеспечена большим объемом измерений (>10), что значительно повысило точность и достоверность результатов.
Статистическая обработка данных
Математическая обработка данных проведена с использованием пакета ”Statistica”, версия 12, фирмы “StatSoft Inc.”. Мы использовали аппарат множественной регрессии для понимания влияния факторов среды и форм нахождения металлов на их биодоступность. Проведена статистическая обработка данных методами многомерного шкалирования (redundancy analysis, RDA) для наиболее показательных элементов – Cu, Ni, Cd, Pb, а также модельное распределение для Hg по данным рассчитанных форм нахождения в воде и измеренных концентраций органах рыб. Суть метода сводится к выявлению “сродства” содержания элементов в органах рыб к наиболее предпочтительным формам их существования в природных водах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химический состав вод и формы нахождения металлов
Для удобства интерпретации данных результаты химических измерений были сгруппированы по 4 крупным водным объектам (табл. 1). Северная часть озера Имандра (Большая Имандра) подвержена наибольшему антропогенному влиянию, Этот участок отличается от природных характеристик более высокой электропроводностью и концентрацией техногенных сульфатов, а также концентрацией фосфора. В данном плесе наиболее высокие концентрации Ni и Cu, как следствие влияния сточных вод комбината “Североникель”. Здесь прослеживаются более высокие концентрации Al и Sr.
Таблица 1.
Медиана и пределы варьирования (в скобках) гидрохимических параметров и содержание металлов в воде исследуемых водоемов
| Параметр | Большая Имандра | Йокостровская и Бабинская Имандра | Пиренга и Охтозеро | Озеро Чуна |
|---|---|---|---|---|
| pH | 7.31 (6.89–7.62) | 7.27 (6.85–7.44) | 7.22 (7.04–7.29) | 6.89 (7.04–7.29) |
| Электропроводность, мкСм/см | 112 (99.5–128) | 91.2 (55.3–112) | 41.2 (31.2–47.1) | 25.0 (19.3–27.0) |
| Ca, мг/л | 3.8 (3.2–4.6) | 3.8 (3.2–4.0) | 3.4 (2.7–3.6) | 2.2 (1.8–2.5) |
| Mg, мг/л | 1.1 (1.0–1.3) | 1.1 (1.0–1.1) | 1.2 (0.80–1.3) | 0.76 (0.63–0.85) |
| Na, мг/л | 16.5 (14.3–20.2) | 6.0 (5.7–6.3) | 2.8 (2.0–3.1) | 1.2 (1.1–1.4) |
| K, мг/л | 2.4 (1.8–3.6) | 1.3 (1.2–1.4) | 0.94 (0.74–1.3) | 0.33 (0.27–0.39) |
| Alk, мкг-экв/л | 362 (321–443) | 283 (270–290) | 262 (183–296) | 110 (106–158) |
| SO4, мг/л | 26.3 (19.6–32.4) | 18.5 (8.34–25.5) | 5.39 (3.95–5.83) | 2.81 (2.59–4.62) |
| Cl, мг/л | 5.2 (4.7–7.4) | 2.2 (1.9–2.3) | 1.0 (0.90–1.2) | 0.95 (0.65–1.1) |
| Жесткость, мг/л как CaCO3 | 26.5 (22.9–31.4) | 25.0 (20.0–28.1) | 10.5 (6.00–18.5) | 9.96 (8.28–12.1) |
| Цветность,°Pt-Co | 9.5 (7.0–18.5) | 10.5 (6.0–18.5) | 30 (5.0–30.5) | 27 (14–34) |
| DOC, мгС/л | 3.69 (3.53–4.58) | 3.67 (3.28–4.45) | 4.66 (4.36–4.71) | 3.79 (3.51–4.45) |
| TP, мкгP/л | 29 (17–76) | 13 (4.5–36) | 6.5 (4.5–6.5) | 4.0 (4.0–8.0) |
| Cd, мкг/л | 0.05 (<0.05–0.36) | 0.10 (<0.05–0.16) | 0.10 (<0.05–0.11) | 0.08 (<0.05–0.13) |
| Pb, мкг/л | 0.15 (0.10–0.30) | 0.35 (0.20–0.55) | <0.1 (<0.1–0.18) | <0.1 (<0.1–0.60) |
| Ni, мкг/л | 10.1 (6.15–28.8) | 5.05 (1.80–13.2) | 0.80 (0.65–1.00) | 1.65 (1.00–2.40) |
| Cu, мкг/л | 4.90 (3.85–7.20) | 3.35 (2.00–6.40) | 0.80 (0.65–1.00) | 1.55 (1.00–2.00) |
| Al, мкг/л | 71.0 (19.0–175) | 31.5 (14.5–157) | 26.0 (20.0–37.5) | 32.0 (17.0–41.0) |
| Sr, мкг/л | 61.0 (37.5–112) | 55.0 (32.5–75.5) | 61.5 (39.5–81.5) | 13.5 (8.90–47.2) |
Йокостровская и Бабинская Имандра подвержена косвенному влиянию техногенной нагрузки вследствие распространения разбавленного потока сточных вод из Большой Имандры, В этих водоемах также более высокая электропроводность и концентрации сульфатов по сравнению с природными характеристиками, тогда как содержания Ni и Cu, сокращается почти в два раза, включая их неорганические формы. Концентрации Al и Sr лишь незначительно снижаются в этих плесах.
Озера Пиренга и Охтозеро расположены на значительном удалении от промышленной деятельности, поэтому их воды практически соответствуют природным – низкие показатели электропроводности и содержания минеральных солей. Для вод этих озер характерны повышенные концентрации растворенного органического углерода. Более высокий показатель цветности свидетельствует о влиянии небольшой заболоченности водосбора по сравнению с озером Имандра. Содержания Pb, Ni и Cu здесь ниже, что связано с удаленность расположения этих водоемов от промышленных центров.
Озеро Чуна окружено гористой местностью (Чуна-тундрами), водосбор сложен кристаллическими породами. Поэтому здесь наиболее низкие показатели электропроводности вод и содержаний органического вещества, также более низкие содержания ряда элементов. Исключение составляют немного более высокие концентрации Ni и Cu п сравнению с Пиренгскими озерами, как следствие влияния воздушного распространения выбросов от комбината “Североникель”.
Расчеты и натурные измерения форм нахождения металлов показали большое сходство распределения элементов на органические и неорганические формы миграции элементов в водах исследованных озер (рис. 3). Как указывалось выше, лабильные формы представлены связанными с неорганическими анионами соединениями металлов, ионными акваформами, а также слабосвязанными комплексами металлов с органическим веществом. В свою очередь, нелабильные формы – это наиболее прочно связанные с органическим веществом соединения металлов. Соотношения ионов металлов и их связанных форм в воде для каждого металла специфично, но достаточно близко во всех исследованных водоемах. По количеству свободных ионов (осредненные данные) исследованные металлы располагались в следующем порядке:
Рис. 3.
Неорганическая (1) и органическая (2) форма металлов в воде Большой Имандры (а), Йокостровской и Бабинской Имандра Имандры (б), Пиренги и Охтозера (в) и озера Чуна (г).
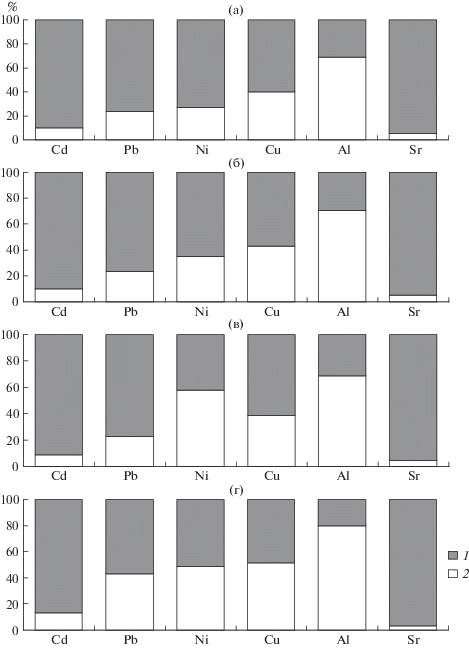
Sr (~95%) > Cd (~90%) > Pb (~76%) > > Ni (~42–77%) > Сu (~60%) > Al (~30%).
Высокая вариабельность прослеживалась для никеля. Концентрации его лабильных форм увеличивались в загрязненных водоемах, как следствие влияния распространения сточных вод, с которыми он поступает в ионных формах. В исследованных 22 ареалах условия водной среды варьировались в небольших пределах (за исключением плеса Большая Имандра) по содержаниям солей, органическому веществу и концентрациям металлов (табл. 1).
В экспериментах значительно легче выявить влияние тех или иных параметров на процессы комплексобразования по сравнению с исследованиями на природных водоемах. В наших работах вариабельность геохимических условий была свойственной водам суши арктического бассейна. Как отмечалось, теоретические модели биотических лигандов (BLM) не применяемы для вод суши арктического бассейна (Hoppe et al., 2015). В плесе Большая Имандра процент содержания элементов в неорганических формах высок в зоне распространения сточных вод к-та “Североникель”, для Ni процент ионных форм здесь достигает до 90%, для меди – до 70%. По мере распространения сточных вод концентрации ионных форм этих элементов снижаются как следствие связывания их органическим веществом природных вод. Если ионные формы Al не превышает 50%, то ионы Sr превалируют во всех плесах. В Пиренгских озерах и Охтозере вследствие повышенных содержаний органического вещества возрастает доля органических форм изученных элементов. Для Сd почти 90% составляют ионные формы металлов от общей концентрации элемента в воде для всех исследованных озер. Для Pb процент ионов в воде по отношению к связанным формам также высок.
Особенности аккумуляции металлов в рыбах и оценка их биодоступности
Концентрации свободных ионов металлов в водной среде, которые могут быть доступны организмам, часто ниже по сравнению с общим содержанием металлов и могут изменяться в зависимости от ряда геохимических факторов. Биодоступность элементов зависит от природы иона и условий водной среды, которые влияют на форму существования металла. (Ehlers, Luthy, 2003; Bjerregaard, Andersen, 2014). Металлы, связанные в комплексы с природными макромолекулами органического вещества, мало доступны водным организмам, в то время как неорганические комплексы или ионы металлов обладают более высокой проникающей способностью (Dudal, Gérard, 2004; Smith et al., 2015 Magalhaes et al., 2015). Однако это положение нельзя экстраполировать на все металлы-микроэлементы. В ряде работ высказывается сомнение, что свободный ион металла – самая биологически доступная форма элемента (Сampbell, 1995). Известно, что метилирование ртути заметно усиливает ее поглощение рыбами и токсичные эффекты (Davidson, Costa, 2014).
Концентрации металлов в рыбах исследованных водоемов представлены в табл. 2. Мы использовали аппарат множественной регрессии для понимания влияния факторов среды и форм нахождения металлов на их биодоступность и проникающую способность в организм рыб путем поиска зависимостей по результатам натурных исследований. В качестве независимого параметра использовалось значение содержания металла в органе (мг/г сух. в-ва), в качестве переменных: содержание металла в воде (неорганической и органической формы, мкг/л), такие показатели как рН и жесткость воды (мг/л), РОВ (мг/л). Были выявлены достоверные связи (при р ≤ 0.05, n = 22) между аккумуляцией металлов в органах и тканях рыб и содержаниями той или иной формы в воде, а также показателями геохимических условий водной среды (табл. 3). Следует отметить, что рН вод и содержание органического вещества имело положительную корреляцию, что указывало вклад органического вещества, тогда как жесткость и рН – отрицательную (r = ≥0.7, при р ≤ 0.01).
Таблица 2.
Медиана и пределы варьирования (в скобках) концентраций металлов (мкг/г сух. в-ва) в органах и тканях сигов, выловленных из исследуемых водных объектов
| Металл | Большая Имандра | Йокостровская и Бабинская Имандра | Пиренга и Охтозеро | Озеро Чуна |
|---|---|---|---|---|
| Hgжабры | 0.014 (0.004–0.490) | 0.071 (0.010–0.145) | 0.036 (0.023–0.058) | – |
| Hgпечень | 0.095 (0.030–0.568) | 0.152 (0.063–0.578) | 0.214 (0.073–0.713) | – |
| Hgпочка | 0.058 (0–0.480) | 0.161 (0.019–0.503) | 0.123 (0.006–0.382) | – |
| Hgмышцы | 0.021 (0.005–0.160) | 0.105 (0.010–0.171) | 0.101 (0.019–0.170) | – |
| Hgскелет | 0.010 (0.001–0.400) | 0.046 (0.002–0.111) | 0.015 (0.006–0.033) | – |
| Cdжабры | 0.12 (0–1.16) | 0.07 (0–1.09) | 0.13 (0–0.76) | 1.06 (0.48–1.49) |
| Cdпечень | 0.24 (0.01–2.09) | 0.45 (0.03–1.88) | 0.78 (0.16–3.02) | 2.79 (0.52–7.27) |
| Cdпочка | 1.91 (0.08–16.3) | 3.17 (0.24–10.1) | 3.76 (0.76–19.3) | 27.1 (14.1–38.3) |
| Cdмышцы | 0.004 (0–0.038) | 0.01 (0–0.39) | 0.13 (0–0.35) | 0.01 (0–0.10) |
| Cdскелет | 0.005 (0–0.088) | 0.03 (0–0.24) | 0.03 (0–0.44) | – |
| Pbжабры | 0.20 (0–1.23) | 0.11 (0–0.70) | 0.08 (0.01–0.44) | 0.24 (0.02–3.70) |
| Pbпечень | 0.06 (0–8.41) | 0.06 (0.01–0.40) | 0.07 (0.01–0.97) | 0.06 (0.03–0.22) |
| Pbпочка | 0.16 (0–1.93) | 0.11 (0.01–7.72) | 0.13 (0–1.21) | – |
| Pbмышцы | 0.07 (0–0.81) | 0.08 (0–0.27) | 0.04 (0–0.10) | – |
| Pbскелет | 0.08 (0–1.32) | 0.14 (0.03–0.86) | 0.09 (0.03–0.15) | – |
| Alжабры | 36.5 (3.26–533) | 11.4 (2.92–55.9) | 31.3 (4.34–969) | 20.2 (7.57–32.8) |
| Alпечень | 19.1 (2.76–112) | 9.61 (3.74–43.1) | 8.91 (3.75–48.6) | 8.68 (4.69–65.8) |
| Alпочка | 15.9 (4.35–147) | 22.5 (2.87–59.2) | 23.2 (8.08–540) | 31.0 (13.5–75.4) |
| Alмышцы | 4.70 (0.68–39.0) | 1.91 (0.88–5.71) | 4.61 (0.89–17.5) | 3.03 (1.13–6.96) |
| Alскелет | 14.4 (2.90–123) | 11.4 (3.04–41.2) | 40.7 (5.94–77.3) | 12.5 (5.75–34.2) |
| Srжабры | 168 (96.9–254) | 149 (103–207) | 161 (53.7–216) | 57.6 (37.6–64.6) |
| Srпечень | 3.64 (1.26–57.3) | 1.98 (0.83–16.1) | 1.61 (0.32–9.86) | 0.51 (0.05–2.77) |
| Srпочка | 5.40 (1.81–830) | 6.27 (0.75–20.6) | 5.85 (1.72–17.9) | 2.39 (0.83–28.2) |
| Srмышцы | 11.0 (0.60–47.4) | 3.57 (0.55–20.6) | 9.15 (0.72–32.3) | 3.30 (0.17–7.10) |
| Srскелет | 654 (363–1088) | 521 (362–783) | 676 (274–1112) | 217 (152–267) |
| Niжабры | 2.69 (0.33–8.86) | 2.02 (0.77–3.12) | 0.80 (0.18–8.77) | 0.55 (0.37–1.20) |
| Niпечень | 1.23 (0.33–8.86) | 1.43 (0.45–5.41) | 0.44 (0.09–0.82) | 0.18 (0.07–0.64) |
| Niпочка | 7.21 (1.73–27.9) | 6.58 (2.69–27.9) | 1.48 (0.60–4.28) | 3.22 (1.02–5.29) |
| Niмышцы | 0.67 (0.04–3.80) | 0.92 (0.27–1.91) | 0.52 (0.05–1.45) | 0.12 (0.09–0.18) |
| Niскелет | 1.92 (0.41–8.17) | 4.34 (0.77–6.87) | 1.46 (0.12–13.3) | 0.25 (0.13–0.39) |
| Cuжабры | 2.71 (1.10–15.8) | 1.78 (0.89–7.04) | 1.50 (0.91–3.66) | 2.88 (1.91–9.23) |
| Cuпечень | 30.5 (8.42–249) | 31.7 (3.03–145) | 19.6 (11.5–55.1) | 81.0 (9.00–245) |
| Cuпочка | 6.06 (1.66–11.0) | 5.60 (2.09–32.0) | 2.91 (2.18–9.68) | 10.6 (5.38–43.4) |
| Cuмышцы | 0.78 (0.51–2.80) | 0.87 (0.49–1.33) | 0.65 (0.43–1.93) | 1.07 (0.48–1.55) |
| Cuскелет | 2.72 (0.75–4.53) | 1.08 (0.38–5.87) | 0.54 (0.26–1.19) | 0.84 (0.53–1.18) |
| Znжабры | 390 (115–1047) | 509 (159–1599) | 296 (117–2051) | 226 (117–2051) |
| Znпечень | 174 (90.0–495) | 202 (86.7–912) | 216 (127–545) | 201 (77.1–284) |
| Znпочка | 146 (85.8–276) | 198 (115–419) | 157 (119–495) | 212 (108–242) |
| Znмышцы | 16.8 (12.0–125) | 17.9 (13.4–45.5) | 19.0 (15.2–70.0) | 19.2 (15.2–48.2) |
| Znскелет | 139 (48.0–268) | 124 (66.9–266) | 104 (34.7–172) | 113 (96.5–208) |
| Mnжабры | 21.6 (0.82–152) | 20.5 (7.78–31.2) | 23.0 (2.48–1243) | 16.9 (8.91–32.7) |
| Mnпечень | 8.70 (6.10–22.0) | 9.13 (0.47–14.9) | 9.56 (7.18–14.9) | 8.21 (4.24–10.9) |
| Mnпочка | 3.85 (1.20–206) | 3.89 (1.00–8.86) | 3.66 (2.37–38.8) | 3.68 (1.49–14.9) |
| Mnмышцы | 1.64 (0.32–11.0) | 1.14 (0.30–3.27) | 2.11 (0.71–38.0) | 0.94 (0.23–2.12) |
| Mnскелет | 31.6 (10.0–256) | 35.4 (13.9–90.3) | 37.3 (4.11–109) | 24.5 (13.4–49.2) |
Таблица 3.
Характеристика уравнений множественной регрессии показателей биоаккумуляции металлов в органах и тканях рыб в зависимости от неорганической и органической формы металла в воде и геохимических факторов среды обитания
| Концентрация металла, мкг/г сух веса | Коэффициенты регрессии (числитель) и t-статистика (знаменатель) | Свободный член | r | ||||
|---|---|---|---|---|---|---|---|
| неорганическая форма металла, мкг/л | органическая форма металла, мкг/л | pH | жесткость, мг/л | DOC, мгС/л | |||
| Cdжабры | $\frac{{2.84}}{{{\mathbf{3}}.{\mathbf{82}}}}$ | – | $\frac{{0.657}}{{1.91}}$ | $\frac{{ - 0.040}}{{ - {\mathbf{3}}.{\mathbf{82}}}}$ | – | –3.76 | 0.763 |
| Cdпочка | – | – | $\frac{{6.32}}{{1.07}}$ | $\frac{{ - 0.937}}{{ - {\mathbf{4}}.{\mathbf{02}}}}$ | – | –19.3 | 0.749 |
| Pbжабры | $\frac{{ - 3.60}}{{ - {\mathbf{4}}.{\mathbf{81}}}}$ | $\frac{{11.2}}{{{\mathbf{4}}.{\mathbf{15}}}}$ | $\frac{{0.542}}{{{\mathbf{4}}.{\mathbf{10}}}}$ | – | $\frac{{ - 0.022}}{{ - {\mathbf{2}}.{\mathbf{72}}}}$ | –3.52 | 0.943 |
| Alжабры | $\frac{{1.61}}{{{\mathbf{2}}.{\mathbf{39}}}}$ | $\frac{{ - 0.356}}{{ - 1.36}}$ | $\frac{{74.0}}{{{\mathbf{2}}.{\mathbf{27}}}}$ | $\frac{{ - 2.35}}{{ - 1.80}}$ | – | –469 | 0.650 |
| Srпочка | $\frac{{0.142}}{{{\mathbf{3}}.{\mathbf{47}}}}$ | – | – | – | – | –1.49 | 0.613 |
| Niжабры | – | $\frac{{0.676}}{{{\mathbf{2}}.{\mathbf{67}}}}$ | – | – | $\frac{{ - 0.058}}{{ - 1.21}}$ | 1.68 | 0.643 |
| Niпочка | $\frac{{0.504}}{{{\mathbf{4}}.{\mathbf{29}}}}$ | – | – | – | – | 3.76 | 0.692 |
| Cuжабры | $\frac{{0.954}}{{{\mathbf{3}}.{\mathbf{44}}}}$ | – | $\frac{{2.95}}{{1.72}}$ | $\frac{{ - 0.200}}{{ - 2.00}}$ | $\frac{{ - 0.059}}{{ - 1.06}}$ | –15.2 | 0.726 |
| Cuпечень | $\frac{{5.47}}{{1.59}}$ | – | – | $\frac{{ - 3.03}}{{ - {\mathbf{3}}.{\mathbf{20}}}}$ | $\frac{{ - 0.934}}{{ - 1.42}}$ | 106 | 0.615 |
| Cuскелет | $\frac{{0.567}}{{{\mathbf{2}}.{\mathbf{84}}}}$ | – | – | $\frac{{ - 0.082}}{{ - 1.41}}$ | $\frac{{ - 0.097}}{{ - {\mathbf{2}}.{\mathbf{55}}}}$ | 3.84 | 0.806 |
| Znскелет | – | – | $\frac{{ - 48.4}}{{ - {\mathbf{2}}.{\mathbf{14}}}}$ | – | $\frac{{ - 3.03}}{{ - {\mathbf{5}}.{\mathbf{16}}}}$ | 521 | 0.791 |
| Mnпочка | $\frac{{0.382}}{{{\mathbf{2}}.{\mathbf{70}}}}$ | $\frac{{ - 6.39}}{{ - 1.70}}$ | $\frac{{11.1}}{{1.51}}$ | $\frac{{ - 0.904}}{{ - 2.04}}$ | – | –54.4 | 0.606 |
Ртуть. Глобальные проблемы переноса Hg в арктические регионы широко известны. Еще в 1990-х годах S.A. Norton et al. (1990) отмечал обогащение северной хемосферы рядом опасных элементов, включая Hg. Доказанным фактом является накопление ртути в пресноводных рыбах северных регионов (AMAP/UNEP, 2013). За счет биогеохимических процессов изменяются формы нахождения ртути, самой опасной из которых является метилртуть (MMHg), накапливающаяся преимущественно в жабрах рыб).MMHg наиболее токсична и является серьезной проблемой для ряда стран Европы вследствие активного накопления Hg в пресноводных рыбах.
В наших исследованиях содержания Hg в воде были ниже порога аналитического обнаружения, однако этот элемент накапливается в почках, печени и мышцах рыб из всех исследованных озер, в большей степени в рыбах из озер, где в повышенных концентрациях присутствует органическое вещество – озера Пиренга и Охтозеро. Достоверная связь установлена между накоплением Hg в органах рыб и содержанием органического вещества (РОВ) в воде и низкими значениями рН.
Данные показывают, что этот элемент преимущественно накапливается в печени, немного меньших количествах – в почках рыб. Повышенные содержания элемента в жабрах рыб, вероятно, отражают осаждение метилорганических комплексов на их поверхности, тогда как аккумуляция Hg в скелете свидетельствует об интернальном метаболизме и накоплении этого элемента в костной ткани, как следствие пролонгированного влияния повышенных концентраций метилорганических комплексов на рыб. В работе (Моисеенко, Гашкина, 2016), охватывающей исследования на Европейской территории России (от зон тундры до степных) доказана связь высоких концентраций Hg в печени рыб с содержаниями в воде РОВ.
Для оценки форм нахождения Hg и их вклада в биодоступность было проведено следующее условное моделирование. Мы провели условное моделирование, приняв, что уровень концентрация элемента в воде колеблется в районе 0.01 мкг/л (это предельный минимальный уровень определения концентрации элемента указанными способами, с максимальной погрешностью 20%), в районе 97–99% от этой величины связано с органическим веществом. Далее проведено многомерное шкалирование (RDA-анализ), которое позволило выявить достоверное сродство содержания металлов во всех органах именно к органической (нелабильной) форме ртути (рис. 4).
Рис. 4.
Осевая диаграмма “Анализ избыточности” для модельной оценки биодоступности форм нахождения Нg: точки – зависимые компоненты, векторы – независимые компоненты.
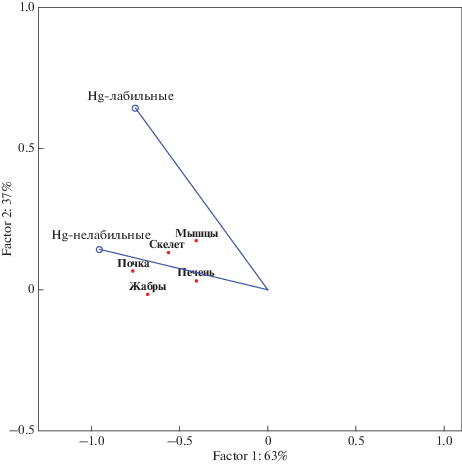
Следует отметить, что региональных источников загрязнения вод Hg в Кольском регионе не выявлено. Очевидно, что накопление ртути в рыбах связано с трансграничным атмосферным переносом элемента в северные регионы и включением его в биогеохимические циклы.
Кадмий. Метаболизм Сd тесно связан с эссенциальными элементами и особенно с цинком, он способен замещать последний во многих жизненно важных энзиматических реакциях (Brzoska, Mdiuszko-Jakoniuk, 2001). Поэтому Cd может рассматриваться как антиметаболит Zn. C.M. Wood (2001) предположил, что первичный механизм токсического действия Cd может быть связан с ингибированием переноса кальция протеинами, и гипокальциемия является наиболее распространенной гипотезой для объяснения острого токсического действия этого элемента.
Содержание Сd наибольшее в почках рыб, что позволяет этот орган определить, как орган – мишень по отношению к элементу. В очень высоких концентрациях он аккумулируется в почках рыб, обитающих в водах самой низкой минерализации (озере Чуна), расположенного в горах Чуна тундр и подверженного влиянию кислотных осаждений со стороны комбината “Североникель”. Несмотря на то, что в озере Большая Имандра распространяются сточные воды комбината “Североникель”, содержания Cd во всех системах организма рыб более низкие сравнению с рыбами из озера Чуна тундр. Этот феномен можно объяснить более высокой минерализацией вод в плесе Большая Имандра или антагонизмом Сd с другими элементами.
В данной работе яркие примеры влияния ионной формы нахождения металлов на его биодоступность продемонстрировано на примере достоверных связей содержаний кадмия в жабрах и почках рыб с его ионной формой и обратно пропорционально жесткости воды. RDA анализ показал высокое сродство этого элемента в лабильной форме с его содержаниями практически во всех системах организма рыб (рис. 5), что свидетельствует об активной аккумуляции этого элемента даже при низких концентрациях элемента в воде.
Рис. 5.
Осевая диаграмма “Анализ избыточности” для оценки биодоступности форм нахождения Pb и Cd: точки – зависимые компоненты, векторы – независимые компоненты.
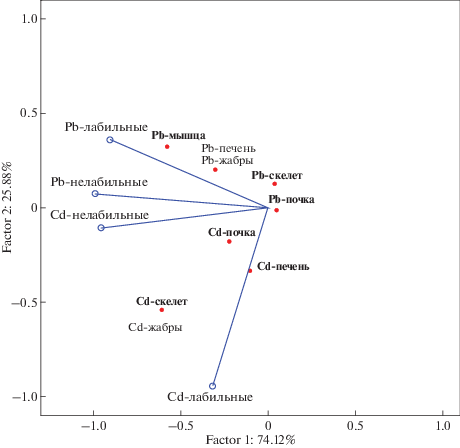
Данные J.T. Cullen, M.T. Maldonado (2013) показывают, что наибольшей биодоступностью обладают ионные формы Cd, что подтверждается и нашими данными. В работе Т.И. Моисеенко, Н.А. Гашкина (2018) установлена достоверная обратная зависимость между содержанием Cd в жабрах, печени, почках, скелете кумжи Кольского Севера и концентрацией кальция в воде, что согласуется с нашими последними данными.
Исследование населения Кольского региона, потребляющего воды низкой минерализации и с незначительно повышенными концентрациями Сd в питьевой воде, показали высокую степень накопления этого элемента в почках обследованных посмертно пациентов (Moiseenko et al., 2018). Биокаккумуляция и этиология заболевания имело сходство с патологиями рыб. В работе S. Satarug et al. (2010) показано, что малые дозы Cd приводят к накоплению кадмия в легких, почках и надпочечниках населения, обуславливая почечную патологию. Особо следует отметить высокую значимость жесткости вод. В Канаде (CCME, 2007) норматив GL (гидлайн) концентрации Сd зависит от жесткости вод, например, при содержании CaCO3 в водах до 60 мг/л, допускается содержание Cd не более 0.2 мкг/л, при более высоких – эти значения повышаются.
Свинец в большей степени аккумулируется в жабрах и почках рыб практически в близких количествах. Также проявляются эффекты преимущественной биоаккумуляции этого элемента в рыбах, обитающих в маломинерализованных водах. Pb вследствие высокого сходства с Са, проникает в организм и вовлекается в метаболические процессы, поглощаясь жабрами пресноводных рыб через апикальный Са-канал (Wood, 2001). Как показано, в воде Кольских озер этот элемент содержится в очень низких концентрациях, достаточно сильно варьирует и не имеет связей с потоком сточных вод промышленного производства. В большей части обследованных водоемов Pb представлен в воде в ионной форме (до 70%). Его содержания в жабрах, почках, мышцах и скелете коррелирует между собой и подтверждается достоверной связью с общим содержанием в воде (r > 70, p = 0.05). Это свидетельствует о том, что лабильные формы Pb являются наиболее биодоступной формой и накапливается во всех системах организма (r > 80, p = 0.05).
Наши расчеты показали также высокую степень достоверности проникновения Pb в жабры, как барьерном органе, не только ионной, но и органической формы свинца. RDA анализ подтверждает тесные связи между содержаниями лабильных форм Pb в воде и концентрациями элемента в органах и тканях рыб (рис. 5). Исходя из полученных данных следует вывод, что при загрязнении вод Pb, он проникает во все жизненно важные системы организма, при этом наибольшей проникающей способностью обладают лабильные формы этого элемента. Исходя из полученных данных следует достаточно парадоксальный вывод, что свинец, несмотря на нахождение преимущественно в ионной форме, его аккумуляция в жабрах связана также и с органической формой, возможно как следствие барьерной роли этого органа.
Алюминий. Более высокие содержание Al во всех системах организма наблюдается у рыб из Большой Имандры, получающей стоки металлургических и горнорудных производств. В большей степени Al накапливается в жабрах, которые контактируют с водой, и на поверхности которых Al может осаждаться. Однако в редких случаях его содержание в почках рыб может достигать аномальных значений – до 500–950 мкг/г сухого вещества. Содержания Аl в жабрах демонстрируют зависимость с содержаниями в воде неорганической формы. Наши натурные данные показывают большое влияние на биоаккумуляцию неорганических форм этого элемента, а также обратную зависимость с жесткостью вод (табл. 3).
Основные последствия влияния Al на рыб: нарушение дыхательной функции; нарушение ион- и осморегуляции, вызванное осаждением алюминия на поверхности жабр, межклеточной аккумуляцией алюминия и др. (Wilson, 2012). Исследования на примере природных водоемов продемонстрировали связь аккумуляции Al в рыбах с его неорганическими формами, которые в водной среде находятся в доминирующем положении.
Стронций в воде находится преимущественно в ионной форме, что закономерно для элементов щелочноземельной группы. Sr в метаболических процессах способен замещать Ca, приводить к патологиям косной основы (Ковальский, 1974; Boyer, 2018). Следует отметить, что самое высокое содержание Sr в организме рыб определено на участках озера Большой Имандры, где сказывается влияние стоков горно-обогатительного апатит-нефелинового производства. Рыбы озера Имандра характеризовались развитием патологий костной основы, такими заболеваниями как остеопороз и сколиоз, нарушением окостенения черепной коробки (Moiseenko, Kudryavtseva, 2002). В этом случае важны не столько абсолютные концентрации элемента, сколько его соотношение с кальцием. В данных исследованиях Sr показал максимальное накопление в костной основе рыб из ареалов Большой Имандры. При повышении соотношения Sr/Ca в воде, этот элемент накапливается во всех системах организма рыб. Нашими исследованиями подтверждено, например, что его накопление в почках зависит от концентрации в воде неорганической формы этого элемента (табл. 3).
Никель является маркером антропогенного влияния медно-никелевого производства концерна “Норникель” на воды Кольского региона. Никель, как и кадмий, в наибольшей степени аккумулируется в почках рыб. Это приводит к развитию фиброэластоза и нефрокальцитоза, как техногенно-обусловленных эндемичных патологий рыб этого региона (Moiseenko, Kudryavtseva, 2001). Загрязнение вод отходами медно-никелевой индустрии носит комплексный характер, в стоках присутствуют также Zn, Cu, Co, Cd и другие металлы, способные усиливать повреждающее действие на почки рыб загрязненных металлами вод.
Методом RDA анализа выявлено наибольшее сродство ионных форм Ni к содержаниям металла почти во всех органах (за исключением жабр). Тогда как закономерная зависимость органической формы Ni с содержаниями его в жабрах подтверждается достоверным сродством методом RDA. Согласно результатам, можно говорить о наибольшем вкладе в биоаккумуляцию сульфатных- и гидроксо- неорганических форм Ni (рис. 6).
Рис. 6.
Осевая диаграмма “Анализ избыточности” для оценки биодоступности форм нахождения Ni и Cu: точки – зависимые компоненты, векторы – независимые компоненты.
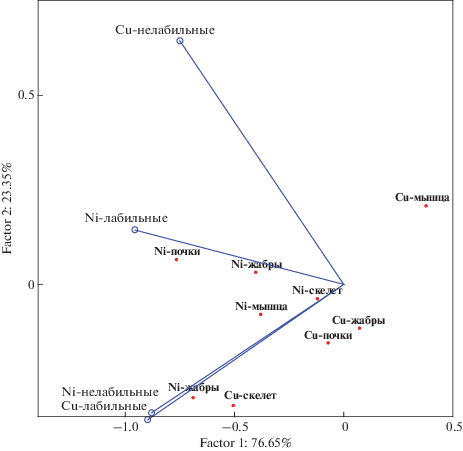
Показано, что содержание Ni в жабрах определяется органической формой нахождения этого элемента. Возможно, что эта форма задерживается жабрами, тогда как ионная проникает в организм и аккумулируется в почках. Наибольшее содержания никеля в неорганической форме характерны для загрязненных водных масс Большой Имандры. По мере распространения потока загрязнённых вод содержание свободных форм Ni снижается до 50% от обшей их концентрации вследствие процессов комплексообразования.
Медь характеризуется высокой комплесообразующей способностью (Линник, Набиванец, 1986). По содержаниям меди в печени выделяются рыбы из озера Имандра и Чуна озера, как следствие повышенного их содержания в воде. Аккумуляция Сu в организме рыб увеличивается при условии ее присутствия в виде ионов, т.е. в низко минерализованных и антропогенно закисленных водах. В присутствии гумусовых кислот (природного подкисления) – она инактивируется и ее накопление в рыбах снижается. Этот феномен отчетливо доказан для рыб из озер Кольского Севера (Moiseenko, Kudryavtseva, 2001). В экспериментах J.C. McGeer et al. (2002) показано, что при близких содержаниях меди в воде, добавление органических хелатов резко снижало эффект биоаккумуляции меди в жабрах и печени радужной форели. Таким образом, в цветных, обогащенных гумусом водах, проникающая способность Cu в организм рыб уменьшается.
RDA анализ подтверждает общие закономерности – в низкоминерализованных водах происходит более активная аккумуляция неорганических форм Сu в органе-мишене – печени, что подтверждается прямой зависимостью с содержаниями ионов меди в воде и обратной – с жесткостью вод. Соответственно содержание органического вещества также находится в обратной зависимости – чем выше содержание гумусовых веществ, тем более активно идут процессы комплексообразования, и снижается доля неорганических форм Сu, т.е. ее биодоступность для живых организмов. Содержания Сu в органах характеризуются статистической близостью к лабильной форме ее нахождения (рис. 6). Для Сu преимущественную роль в статистическом сродстве играют аква-ионные и гидратные формы нахождения.
В наших условиях содержание закомплексованных форм Сu лишь немногим было меньше по сравнению с неорганической формой. В низкоминерализованных водах происходит более активная аккумуляция неорганических форм Сu в органе-мишени – печени, что подтверждается прямой зависимостью с содержаниями ионов Сu в воде и обратной – с жесткостью вод (табл. 3). По содержанию меди в печени выделяются рыбы из озера Имандра и Чуна озера, как следствие повышенного их содержания в воде.
Изложенные результаты показывают, что биоаккумуляция элементов в рыбах проявляется в различных органах и тканях, зависит не только от концентрации металлов в воде, но и ряда сопутствующих экзогенных и эндогенных факторов.
Предложения к корректировке нормативов качества вод
В отличие от экспериментальных работ, в естественных условиях многие сопутствующие факторы могут увеличивать или снижать проникающую способность опасных металлов в организм, как показали наши исследования. Токсичные свойства элементов зависят не только от их концентрации в воде, но от форм их нахождения, содержания кальция в воде, гумусовых кислот, рН, температуры, комбинаций с другими металлами. Растворенное органическое вещество (РОВ) вод способно инактивировать поступающие в водоем металлы путем их связывания с лигандами амино-, фульво- и гуминовых кислот, что снижает их токсичность и биодоступность для гидробионтов. Однако это правило не может быть распространено на все элементы: например, метилирование Hg значительно увеличивает ее биодоступность.
Определение биодоступности металлов основано на изучении их проникновения в живые организмы, которое, как показано, для большинства элементов определяется их ионной формой. В основе ряда моделей заложен принцип расчета ионных форм металлов (Free Ion Activity Model, FIAM) в зависимости от параметров водной среды (Smith et al., 2015; Merrington et al., 2016). Существуют подходы и модели, которые учитывают смесь металлов и аддитивные свойства токсичности металлов (Magalhaes et al., 2015). Эти инструменты уже в определенной степени используются в Канаде, США и EC (CCME, 2007; U.S. EPA, 2007; European Commission, 2011). В ЕС недавно принятая Водная рамочная директива (Water Framework Directive WFD) подчеркивает эту тенденцию, устанавливая стандарты качества для Ni и Pb в виде их биодоступных концентраций (European Commission, 2013). Агентство по охране окружающей среды США уже внедрило инструмент оценки биодоступности Cu для водной жизни (U.S. EPA, 2007). В основе указанных моделей определяется количество ионов металлов, которые обладают наибольшей проникающей способностью. В работе (Моисеенко, 2019) был предложен подход, основанный на 2 принципах: учет конкурентного ряда металла за органические лиганды и нормированных концентраций металлов к их потенциальной токсичности на основе данных ПДК. Следует подчеркнуть, что данные, на которых основаны значения лимитирующих показателей вредности (ПДК) получены в экспериментах и не приемлемы для природных водных объектов в широкой географической зональности.
Наши исследования на озерах субарктической зоны показали более высокую опасность загрязнения вод металлами этой зоны вследствие низкой минерализации и высокой биодоступности тяжелых металлов в таковых водах для водной жизни. Как показано в таблице 1 все концентрации изученных элементов в большинстве случаев находились значимо ниже рыбохозяственных нормативов ПДК. Однако были получены достоверные связи между концентрациями ионных форм металлов и их биоаккумуляцией в организме рыб. Исходя из полученных данных и мирового опыта проанализируем допустимость использования существующих нормативов качества вод по металлам для арктических вод.
В России по сравнению с другими странами (Канада, США, страны ЕС), неоправданно низкие значения для Cu, V, Mn и др., тогда как нормативы для Cd, As, Pb и Al завышены. Если нормативы по Hg в России сопоставимы с западными странами, то – по Pb и Cd они значительно более жесткие в Европе и Америке. Контролирующие органы Западных стран предлагают учитывать при этом биодоступность элементов, которая зависит от геохимических особенностей природных вод. Жесткость вод в арктических регионах очень низкая, поэтому нормативы по Cd – не могут быть более 0.2, Pb – 1, Al – 5 мкг/л (Al при рН менее 6.5). С учетом, что содержание ионов никеля составляет 50–70%, которые обладают высокой проникающей способностью, его норматив должен не превышать 5 мкг/л.
Растворенное органическое вещество (РОВ) вод способно снизить проникающую способность элементов. В представленных результатах исследований РОВ находилась в относительно низких концентрациях, однако для вод суши северных регионов характерно наличие озер высокой цветности, т.е. с высокими содержаниями гумусовых кислот. Такие элементы как Mn, Fe и Сu могут входить в состав макромолекул гумусовых кислот и быть недоступны для проникновения в живые организмы. Отметим неоправданно жесткий норматив для меди в 1 мкг/л для вод России, он может быть логичен для вод крайне низкой минерализации и цветности вод. По нашим данным (Moiseenko et al., 2019) большая часть вод гумидной территории имеет концентрации меди 3–5 мкг/л. В этих случаях необходим дифференцированный подход с учетом проникновения ионных форм металлов. Для управляющих органов в сфере охраны окружающей среды было бы важным внедрять модели определения биодоступности элементов для оценки рисков загрязнения природных вод.
ЗАКЛЮЧЕНИЕ
Нарастающие объемы поступления металлов в воды суши требуют новых походов к оценке опасности их содержаний в водах суши арктических регионов. Биодоступность элементов в водной среде является ключевым свойством, определяющим опасность их накопления в живых организмах, включая человека. Биоаккумуляция металлов зависит от природы иона и условий водной среды, которые влияют на форму нахождения металла. Для оценки биодоступности металлов широкое применение находит сложная модель биотического лиганда (BLM), которая имеет три наиболее значимые составляющие: термодинамический расчет форм нахождения металла, способность биологических рецепторов связывать ионы металлов и их токсикологические свойства.
Нами предложен метод определения форм нахождения металла (ACIDFORMMET, патент № 2 015 617 036). В основе расчетов которого лежит моделирование физико-химических процессов, протекающих в конкурентной среде. В качестве исходных данных применены параметры водной среды озер Кольского Севера. Согласно полученным данным на водоемах субарктической зоны – Кольского Севера, соотношения ионов металлов и их связанных форм с DOC в воде для каждого металла специфично, но достаточно близко во всех исследованных водоемах, поскольку вариабельность гидрохимических параметров была не столь значительна. Исключение составил более загрязненный плес Большая Имандра.
Наибольшее внимание мировая научная общественность уделяет таким опасным элементам, как Hg, Cd и Pb. В воде исследованных акваторий содержания Hg были очень низкими, тогда как накопление этого элемента в органах и тканях рыб свидетельствует о глобальном загрязнении Hg этого региона. Высокие содержания Hg в жабрах рыб говорят об осаждении метилорганических комплексов на их поверхности, тогда как аккумуляция ртути в скелете свидетельствует об интернальном накоплении этого элемента в костной ткани, как следствие пролонгированного влияния повышенных доз Hg-метилорганических комплексов на рыб.
Pb и Cd в водах озер в большей части представлены в ионных формах, которые обладают высокой проникающей способностью в организм рыб. Cd накапливается во всех системах организма рыб, но в наиболее высоких – в почках рыб. Полученные данные свидетельствуют об активной аккумуляции этих элементов при крайне низких концентрациях их в воде. Жесткость вод снижает биодоступность Pb и Cd.
Ni и Cu являются маркерами загрязнения вод стоками и воздушными выбросами предприятий цветной металлургии. По концентрации Ni была установлена наиболее высокая вариабельность его лабильный формы, которая увеличивалась в загрязненных водоемах. Сu характеризовалась более высокой комплесобразующей способностью. Аккумуляция Cu в организме рыб увеличивается при условиях, в которых Cu присутствует в виде ионов, т.е. в низко минерализованных и антропогенно закисленных водах.
Исследования на озерах субарктической зоны показали более высокую опасность загрязнения вод металлами вследствие высокой биодоступности тяжелых металлов для водных организмов при низкой их минерализации. Исходя из результатов исследований, можно утверждать, что ионная форма нахождения для большинства изученных элементов является более биодоступной (за исключением Hg). Поэтому, для низко минерализованных вод Севера требуется корректировки принятых в России ПДК по Cd, Pb, Al и Ni в сторону ужесточения нормативов.
Работа выполнена в рамках гранта РФФИ № 18-05-60012.
Список литературы
Варшал Г.М., Кощеева И.Я., Сироткина И.С., Велюханова Т.К., Инцкирвели Л.Н., Залюкина Н.С. (1979) Изучение органических веществ поверхностных вод и их взаимодействие с ионами металлов. Геохимия. (4), 598-608.
Дину М.И. (2017) Формирование органических веществ гумусовой природы и их биосферные функции. Геохимия. (10), 917-933.
Dinu M.I. (2017) Formation of organic substances of humus nature and their Biospheric properties. Geochem. Int. 55(10), 911-926.
Дину М.И., Моисеенко Т.И. (2015) ACIDFORMMET патент № 2015617036.
Ермаков В.В., Тютиков С.Ф. (2008) Геохимическая экология животных. М.: Наука, 315 с.
Жулидов А.В. (1988) Физико-химическое и химическое состояние металлов в природных водах: токсичность для пресноводных организмов. Экологическое нормирование и моделирование антропогенного воздействия на водные экосистемы 1. Л.: Гидрометеоиздат, 78-82.
Ковальский В.В. (1974) Геохимическая экология. М.: Наука, 269 с.
Лапин И.А., Красюков В.Н. (1986) Роль гумусовых веществ в процессах комплексообразования и миграции тяжелых металлов в поверхностных водах. Водные ресурсы. (1), 134-145.
Линник П.Н., Набиванец Б.И. (1986) Формы миграции металлов в пресных поверхностных водах. Л.: Гидрометеоиздат, 270 с.
Моисеенко Т.И. (2019) Биодоступность и экотоксичность металлов в водных системах: критические уровни загрязнения. Геохимия. 64(7), 675-688.
Moiseenko T.I. (2019) Bioavailability and Ecotoxicity of 411-419 Metals in Aquatic Systems: Critical Contamination Levels. Geochem. Int. 57(7), 737-750.
Моисеенко Т.И. (2008) Концепция “здоровья” экосистемы в оценке качества вод и нормирования антропогенных нагрузок. Экология. 6, 411-419.
Моисеенко Т.И., Гашкина Н.А. (2016) Биоаккумуляция ртути в рыбах как индикатор уровня загрязнения вод. Геохимия. (6), 495-504.
Moiseenko T.I., Gashkina N.A. (2016) Бioaccumulation of mercury in fish as indicator of water pollution. Geochem. Int. 54(6), 485-493.
Моисеенко Т.И., Гашкина Н.А. (2018) Биогеохимия кадмия: антропогенное рассеивание, биоаккумуляция и экотоксичность. Геохимия. (8), 759-773.
Moiseenko T.I., Gashkina N.A. (2018) Biogeochemistry of Cadmium: Anthropogenic Dispersion, Bioaccumulation, and Ecotoxicity. Geochem. Int. 56(8), 798-811.
Перечень рыбохозяйственных нормативов предельно допустимых концентраций (ПДК) и ориентировочно безопасных уровней воздействия (ОБУВ) вредных веществ для воды и водных объектов, имеющих рыбохозяйственное значение (1999). М.: ВНИРО, 304 с.
Родюшкин И.В. (1995) Основные закономерности распределения металлов по формам в поверхностных водах Кольского Севера. Дис. канд. геогр. наук. Санкт-Петербург: Институт Озероведения, 161 с.
AMAP Assessment (2002) Heavy Metals in the Arctic. Arctic Monitoring and Assessment Programme (AMAP). Oslo, Norway.
AMAP/UNEP (2013) Technical Background Report for the Global Mercury Assessment 2013., in: Norway/UNEP ChemicalsBranch (Ed.), Arctic Monitoring and Assessment Programme. Geneva, Oslo. 2013. 263 p
Amde M., Liu J., Tan Z., Bekana D. (2017) Transformation and bioavailability of metal oxide nanoparticles in aquatic and terrestrial environments. A review. Environ. Pollut. 230, 250-257.
Bjerregaard P., Andersen O. (2014) Ecotoxicology of Metals – Sources, Transport, and Effects in the Ecosystem. In Handbook on the Toxicology of Metals (Eds. Nordberg G.F., Fowler B. A., Nordberg M.). Amsterdam: Elsevier, 79-100.
Boyer A., Ning P., Killey D., Klukas M., Rowan D., Simpson A.J., Passeport E. (2018) Strontium adsorption and desorption in wetlands: Role of organic matter functional groups and environmental implications. Water Res. 133, 27-36.
Brzoska M.M., Moniuszko-Jakoniuk J. (2001) Interaction between cadmium and zinc in the organism. Food Chem. Toxicol. 39, 967-980.
Campbell P.G.C. (1995) Interactions between trace metals and aquatic organisms: a critique of the free-ion activity model. In Metal speciation and bioavailability in aquatic systems (Eds. Tessier A., Turner D.R.). Chichester: Wiley, 45-102.
CCME (Canadian Council of Ministers of the Environment) (2007) A Protocol for the Derivation of Water Quality Guidelines for the Protection of Aquatic Life. Winnipeg, Canada.
Cullen J.T., Maldonado M.T. (2013) Biogeochemistry of Cadmium and Its Release to the Environment. In Cadmium: From Toxicity to Essentiality (Eds. Sigel A., Sigel H., Sigel R.). Dordrecht: Springer, 31-62.
Davidson T., Costa M. (2014) Selected Molecular Mechanisms of Metal Toxicity and Carcinogenicity. In Handbook on the Toxicology of Metals (Eds. Nordberg G.F., Fowler B. A., Nordberg M.). Academic Press, 79-100.
Dudal, Y., Gérard, F. (2004) Accounting for natural organic matter in aqueous chemical equilibrium models: a review of the theories and applications. Earth-Sci. Rev. 66(3–4), 199-216.
Eaton A., Arnold E., Archie A.E., Rice E.W., Clesceri L.S. (1992) Standard Methods for the Examination of Water and Wastewater 17th ed. Washington, DC: American Public Health Association (APHA).
Ehlers L.J., Luthy R.G. (2003) Contaminant bioavailability in soil and sediment. Improving risk assessment and remediation rests on better understanding bioavailability. Environ. Sci. Technol. 37(15), 295-302.
European Commission Common Implementation Strategy for the Water Framework Directive. Technical Guidance for Deriving Environmental Quality Standards (2011). European Communities, Brussel, Belgium.
European Commission (2013). Directive 2013/39/EC Amending Directives 2000/60/EC and 2008/105/EC as Regards Priority Substances in the Field of Water Policy. 2013/39/EC.
Gandhi N., Diamond M.L., Huijbregts M.A.J., Guinée J.B., Peijnenburg W.J.G.M., Van De Meent D. (2011) Implications of considering metal bioavailability in estimates of freshwater ecotoxicity: examination of two case studies. Int. J. Life Cycle Assess. 16(8), 774-787.
Handbook on the Toxicology of Metals (2014) (eds. Nordberg G.F., Fowler B.A., Nordberg M.), Academic Press, 1542 p.
Hoppe S., Gustafsson J.-P., Borg H., Breitholtz M., (2015) Evaluation of current copper bioavailability tools for soft freshwaters in Sweden. Ecotoxicol. Environ. Saf. 114, 143-149.
Magalhaes D., Marques M, Baptista D., Forsin D, Buss D. (2015) Metal bioavailability and toxicity in freshwaters. Environ. Chem. Lett. 13, 69-87.
McGeer J.C.,Szebedinszky C., McDonald D.G., Wood C.M. (2002) The role of dissolved organic carbon in moderating the bioavailability and toxicity of Cu to rainbow trout during chronic waterbourne exposure. Comp. Biochem. Physiol. 133, 147-160.
Merrington G., Peters A., Schlekat C.E. (2016) Accounting for metal bioavailability in assessing water quality: a step change? Environ. Toxicol. Chem. 35(2), 257-265.
Moiseenko T.I., Dinu M.I., Gashkina N.A., Kremleva T.A. (2019) Aquatic environment and anthropogenic factor effects on distribution of trace elements in surface waters of European Russia and Western Siberia. Environ. Res. Lett. 14(6), 065010.
Moiseenko T.I., Morgunov B.A., Gashkina N.A., Megorskiy V.V., Pesiakova A.A. (2018) Ecosystem and human health assessment in relation to aquatic environment pollution by heavy metals: case study of the Murmansk region, northwest of the Kola Peninsula, Russia. Environ. Research Let. 13(6), 065005.
Moiseenko T.I., Kudryavtseva L.P. (2001) Trace Metals Accumulation and Fish pathologies in Areas affected by Mining and Metallurgical enterprises. Environ. Pollut. 114(2), 285-297. 065010.
Norton S.A., Dillon P.J., Evans R.D. (1990) The history of atmospheric deposition of Cd, Hg and Pb in North America: Evidence from lake and peat bog sediments. Sources, Deposition and Capony Interactions. In Acidic Precipitation Vol. 3 (Eds. Lindberg S.E., Page A.L., Norton S.A.). N.Y.: Springer, 73-101.
Satarug S., Garrett S.H., Sens M.A., Sens D.A. (2010) Cadmium, Environmental Exposure, and Health Outcomes. Environ. Health Persp. 118, 82-190
Smith K.S., Balistrierib L.S., Todd A.S. (2015) Using biotic ligand models to predict metal toxicity in mineralized systems. Appl. Geochem. 57, 55-72.
U.S. EPA (2004) National Recommended Water Quality Criteria. Report 4304T. Office of Water, Office of Science and Technology. (EPA/600/4-91/002) Springfield, Virginia.
U.S. EPA (2007) National Recommended Water Quality Criteria. Report 4304T. Office of Water, Office of Science and Technology. (EPA/600/4-91/002) Springfield, Virginia.
Väänänena K., Leppänen M.T., Chen X., Akkanenaa J. (2018) Metal bioavailability in ecological risk assessment of freshwater ecosystems: from science to environmental management. Ecotoxicol. Environ. Saf. 147, 430-446.
Whitfield A.K., Elliott M. (2002) Fish as indicator of environmental and ecological changes within estuaries: a review of progress and suggestions for the future. Fish Biol. 61(4), 229-250.
Wilson R.W. (2012) Aluminium. In Homeostasis and Toxicology of Non-Essential Metals (Eds. Wood, C.M., Farrel, A.P., Brauner, C.J.). San Diego: Academic Press, 67-123.
Wood C.M. (2001) Toxic responses of the gill. In Target Organ Toxicity in Marine and Freshwater Teleosts (Eds. Schlenk D., Benson W.H.). London: Taylor and Francis, 1-89.
Дополнительные материалы отсутствуют.