Геохимия, 2022, T. 67, № 10, стр. 1004-1012
Депонированный органический углерод мелководных бухт залива Петра Великого (Японское море)
П. Я. Тищенко a, *, Е. М. Шкирникова a, В. А. Горячев a, А. А. Рюмина a, С. Г. Сагалаев a, П. П. Тищенко a, О. А. Уланова a, Е. Ю. Тибенко a
a Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
690041 Владивосток, ул. Балтийская, 43, Россия
* E-mail: tpavel@poi.dvo.ru
Поступила в редакцию 11.06.2021
После доработки 22.12.2021
Принята к публикации 26.12.2021
- EDN: VMLMZY
- DOI: 10.31857/S0016752522100119
Аннотация
В период 2014–2020 гг. в бухтах залива Петра Великого (Японское море) рассчитан депонированный углерод (${{{\text{C}}}_{{{\text{dep}}}}}$) в толще осадка в 1 м. В отсутствии лугов зостеры морской (ЗМ) для бухт Воевода, Новгородская и залива Угловой, ${{{\text{C}}}_{{{\text{dep}}}}}$ составил 140, 99 и 55 тС/га, соответственно. Присутствие ЗМ существенно повышает эту величину: 180 и 126 тС/га для бухт Воевода и Новгородская, соответственно. Используя измерения радиоактивности техногенного изотопа 137Cs оценена скорость накопления ${{{\text{C}}}_{{{\text{dep}}}}}$ в исследуемых бассейнах без лугов ЗМ: 17, 69, 98 гС/(м2 год) в зал. Угловой, б. Новгородская и б. Воевода, соответственно, а также 101 и 144 гС/(м2 год) в бухтах Новгородская и Воевода, в местах покрытых лугами ЗМ. Используя результаты измерений концентрации хлорофилла а в донных осадках исследуемых бассейнов в период 2018–2020 гг, оценены коэффициенты биотурбации (62.7–5.3 см2/сут) и кажущиеся константы деградации ${{{\text{C}}}_{{{\text{орг}}}}}$ (0.003–0.068 сут–1). Максимальные скорости деградации ${{{\text{C}}}_{{{\text{dep}}}}}$ соответствуют верхним горизонтам: 550, 115, 24 и 11 гС/(м2 год), соответственно, б. Воевода с лугами ЗМ, б. Воевода в отсутствии ЗМ, зал. Угловой, б. Новгородская в отсутствии ЗМ. Установлено, что луга ЗМ обеспечивают максимальную концентрацию трудно-разлагаемого органического вещества (${{{\text{C}}}_{{{\text{орг}}}}} = {\text{1}}{\text{.9\% }}$ в донных осадках б. Воевода).
ВВЕДЕНИЕ
Важнейшим биогеохимическим процессом в океане является работа ”биологического насоса”, суть которого сводится к аккумуляции энергии Солнца в форме органического вещества (ОВ) посредством фотосинтеза в клетках фитопланктона, макроводорослей, морских трав и перенос его в придонные слои (De La Rocha, Passow, 2008). В этом процессе неорганическая форма углерода (СО2) извлекается из водной среды и превращается в органическую форму. Для глубоководных бассейнов (более 1000 м) 90% общей биомассы органического вещества, синтезированной в эвфотическом слое, подвергается аэробному окислению, и лишь небольшая его доля достигает дна, где происходит захоронение. Для шельфовых вод ситуация противоположная: 80–90% синтезированного в фотическом слое ОВ достигает дна и обогащает собой осадки (Emerson, Hedges, 2003). Предполагается, что захороненноеый автотрофный органический углерод в донных осадках, известный как “голубой углерод” (ГУ), представляет собой изъятый из атмосферы углекислый газ (Duarte et al., 2010; Duarte et al., 2013; Blue Carbon, 2009). Очевидно, что доля захороненного автотрофного органического углерода будет тем больше, чем меньше глубина бассейна (Serrano et al., 2014). Кроме того, были выделены три наиболее продуктивные экосистемы на шельфе: мангровые леса, солевые марши и морские травы. Именно этим экосистемам было уделено особое внимание (Blue Carbon, 2009) и разработана методика количественной оценки ГУ на морском шельфе (Fourqurean et al., 2014). Предложенная методика, в отношении морских трав, сводится к оценке депонированного органического углерода (${{{\text{C}}}_{{{\text{dep}}}}}$) – количество тонн углерода, содержащегося на площади в 1 га, в слое донных отложений равном 1 м.
Высокопродуктивные луга морских трав мелководных бассейнов залива Петра Великого представлены, главным образом, зостерой морской (Zostera Marina L.) – ЗM (Паймеева, 1984). Целью работы являются количественные оценки ${{{\text{C}}}_{{{\text{dep}}}}}$ в трех мелководных бассейнах – бухты Воевода, Новгородская и залив Угловой, скорости его аккумуляции и скорости кажущейся деградации. В этой работе использовались геохимические данные, полученные в период с 2014 по 2020 годы, которые включали в себя анализ проб донных осадков на содержание органического углерода (Сорг), концентрацию хлорофилла а, влажность и измерения радиоактивности техногенного радионуклида 137Cs.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бухта Воевода и залив Угловой являются мелководными бассейнами второго порядка Амурского залива, а бухта Новгородская – бассейн второго порядка залива Посьета (рис. 1). Площадь исследуемых бассейнов равна 4, 31 и 42 км2 для бухт Воевода, Новгородская и залива Угловой, соответственно. Глубины большей части акваторий бухт менее 5 м. Бухты Воевода и Новгородская частично покрыты зарослями ЗМ. В заливе Угловой в 80-е годы прошлого века присутствовали луга ЗМ (Раков, 2010), в настоящее время они исчезли (Тищенко и др., 2021). Основной тип грунта в исследуемых бассейнах – мелкоаливритовый ил, местами песок и ракушечник. Доминирующий цвет ила был черный, темно-серый и серый в б. Воевода, Новгородская и заливе Угловой, соответственно. Щелочность поровых вод исследуемых илов увеличивается с глубиной керна, а рН уменьшается (Тищенко и др., 2020). На все бассейны оказывается сильное антропогенное воздействие. Бухты являются местом развития марикультур (выращивание мидий, гребешка, трепанга) (Барабанщиков и др., 2018; Гаврилова, Кондратьева, 2018), а залив Угловой подвергается сбросу коммунальных стоков (Тищенко и др., 2021). Краткое географическое описание исследуемых бассейнов дано в Лоции (1996), а более подробное можно найти в работах (Вышкварцев, Пешеходько, 1982; Блиновская, 2001; Барабанщиков и др., 2018; Тищенко и др., 2021).
Рис. 1.
Географическое положение изучаемого района: а – залив Посьета; б – Амурский залив; в – Уссурийский залив. I – бухта Воевода; II – бухта Новгородская; III – залив Угловой.
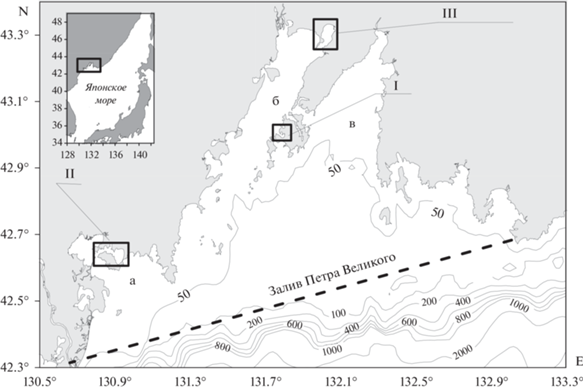
Для каждого из бассейнов, отбор донных осадков осуществляли прямоточной геологической трубкой (1 м) в двух местах – в зарослях травы и в ее отсутствии (для бухт). Точные координаты геохимических станций, дата отбора кернов, глубина места и длина керна приведены в табл. 1.
Таблица 1.
Дата, координаты, длина керна – h, см, глубина места – H, м, и наличие травы в местах отбора кернов
| Бассейн | № ст. | Дата | Широта | Долгота | h, см | H, м | Зостера |
|---|---|---|---|---|---|---|---|
| Воевода | 1 | 25/02/2014 | 42.9996° | 131.7943° | 55 | 4.1 | Да |
| Воевода | 2 | 28/05/2014 | 42.9996° | 131.7943° | 65 | 4.3 | Да |
| Воевода | 3 | 03/07/2014 | 42.9996° | 131.7943° | 75 | 4.2 | Да |
| Воевода | 4 | 02/10/2014 | 42.9996° | 131.7943° | 75 | 4.1 | Да |
| Воевода | 5 | 08/02/2018 | 43.0014° | 131.7953° | 55 | 2.2 | Да |
| Воевода | 6 | 16/09/2019 | 43.0072° | 131.7858° | 68 | 4.6 | Да |
| Воевода | 7 | 18/09/2019 | 42.9980° | 131.7926° | 73 | 5.5 | Нет |
| Угловой | 8 | 31/01/2018 | 43.3170° | 132.0515° | 78 | 0.8 | Нет |
| Угловой | 9 | 14/02/2018 | 43.3135° | 132.0264° | 86 | 1.3 | Нет |
| Угловой | 10 | 07/10/2019 | 43.3124° | 132.0150° | 80 | 1.7 | Нет |
| Угловой | 11 | 09/10/2019 | 43.2437° | 131.9775° | 86 | 2.0 | Нет |
| Угловой | 12 | 31/10/2020 | 43.2819° | 132.0360° | 84 | 3.3 | Нет |
| Новгородская | 13 | 25/09/2019 | 42.6554° | 130.8721° | 83 | 5.4 | Нет |
| Новгородская | 14 | 30/09/2019 | 42.6355° | 130.9222° | 87 | 4.4 | Да |
| Новгородская | 15 | 19/10/2020 | 42.6540° | 130.8209° | 78 | 8.0 | Нет |
На всех станциях перед взятием керна проводили гидрологическое зондирование толщи воды, осуществлялся отбор проб воды с поверхностного и придонного горизонтов на гидрохимические параметры, а также проводилось подводное фотографирование дна. После взятия керна, трубку с керном помещали в теплоизоляционный тубус и доставляли в лабораторию, где керн фотографировали, измеряли рН на разных горизонтах, с интервалом 10 см. После этого осадок каждого горизонта отбирали на измерение плотности, влажности и для получения поровой воды в пресс-форме.
Химический анализ поровой воды проводили сразу после ее получения. Сорг в твердой фазе осадков был измерен на анализаторе TOC-VCPN с приставкой для сжигания твердых проб SSM_5000А производства Shimadzu (Япония). Калибровку прибора проводили с помощью стандартов СДО-3 “известковый ил”, ГСО 1758-80, точность оценивали из параллельных измерений, она составляла ±3%. Результат дан как процентное содержание углерода в сухом осадке.
Содержание в пробах грунта хлорофилла а и феофитина измеряли спектрофотометрическим методом, используя вместо объема профильтрованной воды массу сухого грунта в анализируемой сырой навеске (Марьяш и др., 2015). Концентрацию хлорофилла а в сыром грунте определяли с учетом его влажности и объемной массы. Пробы грунта экстрагировали в 10 мл 90% раствора ацетона и помещали в холодильник. Через сутки на спектрофотометре фирмы Shimadzu, модель РС 3600, проводили измерение оптической плотности в экстракте. Перед измерением феофитина экстракт предварительно подкисляли 2–3 каплями приготовленного раствора соляной кислоты в ацетоне. Концентрации хлорофилла а и феофитина рассчитывались по известным формулам (Jeffrey, Humphrey, 1975).
Влажность проб определяли взвешиванием осадка (около 1 г.) до высушивания и после высушивания при температуре 100–105°С в течение 1–2 сут до постоянного веса, точность 2%. Поскольку депонированный углерод рассчитывается на площадь осадка с естественной влажностью (Fourqurean et al., 2014), то определяли плотность, ${{d}_{d}},$ сухого грунта в объеме осадка естественной влажности. Величину ${{d}_{d}}$ рассчитывали по соотношению:
(1)
${{d}_{d}} = {{d}_{w}}({{1 - W} \mathord{\left/ {\vphantom {{1 - W} {100}}} \right. \kern-0em} {100}}).$В соответствии с требованиями унификации данных (Fourqurean et al., 2014), профили ${{{\text{C}}}_{{{\text{орг}}}}}$ каждой колонки экстраполировали до глубины керна 1 м. Полученные профили были сгруппированы на пять групп: б. Воевода – 2 группы, б. Новгородская – 2 группы – наличие/отсутствие лугов ЗМ и зал. Угловой – 1 группа – ЗМ отсутствует. Для каждой группы были получены средние значения ${{{\text{C}}}_{{{\text{орг}}}}}$ на каждом горизонте. Расчет ${{{\text{C}}}_{{{\text{dep}}}}}$ в слое осадка толщиной в 1 м проводили по формуле:
(2)
${{{\text{С}}}_{{{\text{dep}}}}}{\text{,}}\,\,{{{\text{тC}}} \mathord{\left/ {\vphantom {{{\text{тC}}} {ha}}} \right. \kern-0em} {ha}} = {\text{10}}{{d}_{d}}\sum\limits_{i = 1}^{i = 10} {{{{\text{C}}}_{i}}} .$Скорость аккумуляции ${{{\text{C}}}_{{{\text{dep}}}}}$ (${{R}_{{{{{\text{C}}}_{{{\text{dep}}}}}}}}$) устанавливалась из произведения величины ${{{\text{C}}}_{{{\text{dep}}}}}$ на скорость осадконакопления (${{R}_{S}}$ – rate of sedimentation) отнесенной к общей толщине слоя осадка, L:
(3)
${{R}_{{{{{\text{C}}}_{{{\text{dep}}}}}}}} = {{{{R}_{S}}{{{\text{C}}}_{{{\text{dep}}}}}} \mathord{\left/ {\vphantom {{{{R}_{S}}{{{\text{C}}}_{{{\text{dep}}}}}} L}} \right. \kern-0em} L}.$Скорость осадконакопления в пробах донных осадков была оценена из измерений активности техногенного радионуклида 137Cs по глубине керна, максимальная активность соответствует времени наиболее интенсивных испытаний ядерного оружия, 1963 г. (Купцов, 1986; Tsabaris et al., 2012; Русаков и др., 2019). Измерение активности 137Cs в образцах донных осадков выполнены на гамма-спектрометре с детектором из сверхчистого германия GEM150 (диаметр кристалла 88.5 мм, высота 99.8 мм), с цифровым многоканальным анализатором DSPEC jr 2.0 (ORTEC, США). Энергетическое разрешение детектора на линии 1332 кэВ 1.9 кэВ. Для снижения фона детектор размещен в защите из свинца с толщиной стенок и крышки 10 см. Внутренние стенки покрыты слоем меди толщиной 1 мм. Интегральная скорость счета фона детектора в защите 6.6 имп/с в области энергий 50–2990 кэВ. Навески сухих растертых проб, около 30 г в полипропиленовых емкостях, диаметром 57 мм размещались на капсуле детектора. В такой геометрии за время измерения 1000 мин минимальная детектируемая активность 137Cs (МДА) – 0.0076 Бк.
Расчет кажущейся константы скорости деградации ОВ включает в себя два этапа применения уравнения, предложенного в работе (Sun et al., 1991):
(4)
$С = ({{С}_{o}} - {{С}_{\infty }})\exp \left( { - x\sqrt {{{k_{d}^{{Chl}}} \mathord{\left/ {\vphantom {{k_{d}^{{Chl}}} {{{D}_{B}}}}} \right. \kern-0em} {{{D}_{B}}}}} } \right) + {{C}_{\infty }}.$На первом этапе, используется профиль концентрации хлорофилла а в осадке. В этом случае в уравнении (4), $C,$ ${{C}_{{\text{o}}}},$ ${{C}_{\infty }}$ – концентрация хлорофилла a на заданном горизонте, на поверхности и при ”бесконечной” глубине осадка, соответственно; $k_{d}^{{Chl}}$ – кинетическая константа скорости разложения молекулы хлорофилла а, соответствующая реакции первого порядка (Sun et al., 1991); ${{D}_{B}}$ – коэффициент биотурбации; x – вертикальная координата в осадке. Из соотношения (4) следует, что угол наклона для зависимости $\ln (C - {{C}_{\infty }})$ от (–x) равен $\sqrt {{{k_{d}^{{Chl}}} \mathord{\left/ {\vphantom {{k_{d}^{{Chl}}} {{{D}_{B}}}}} \right. \kern-0em} {{{D}_{B}}}}} .$ Приняв значение $k_{d}^{{Chl}} = 0.03\,\,{\text{ден}}{{{\text{ь}}}^{{ - {\text{1}}}}}$ (Sun et al., 1991) и ${{C}_{\infty }} = 0,$ определяли коэффициент биотурбации, ${{D}_{B}}.$ На втором этапе, по уравнению (4) устанавливали кажущиеся константы скорости деградации ОВ $\left( {k_{d}^{C}} \right),$ в этом случае были использованы, найденные коэффициенты биотурбации и профили ${{{\text{C}}}_{{{\text{орг}}}}}.$ Количественную оценку скорости кажущейся деградации ОВ в толще осадка ${{L}_{i}}$ проводили с использованием соотношения (Sun et al., 1991):
Здесь $D_{C}^{i}$ – скорость кажущейся деградации органического углерода, гС/(м2 год) на заданном горизонте “i”; ${{C}_{i}},$ ${{C}_{\infty }}$ – процентное содержание органического углерода на заданном горизонте “i” и на “бесконечной” глубине осадка, соответственно. Нами используется термин “кажущаяся” деградация и “кажущаяся” константа деградации, т.к. мы предполагаем, что в уменьшении ${{{\text{C}}}_{{{\text{орг}}}}}$ в верхних горизонтах донных осадков принимают участие не только бактерии, но и фитофаги инфауны, использующие ОВ для накопления собственной биомассы. Отделить два разных процесса трудно.РЕЗУЛЬТАТЫ
Осредненные вертикальные профили ${{{\text{C}}}_{{{\text{орг}}}}}{\text{,}}\,{\text{\% }}$ в сухом осадке в бухтах Воевода, Новгородская и заливе Угловой представлены на рис. 2а. Области экстраполяций отмечены пунктирной линией. Из рисунка следует, что ${{{\text{C}}}_{{{\text{орг}}}}}$ выше в донных осадках, покрытых лугами ЗМ. В донных осадках свободных от ЗМ, в пределах верхних 40 см происходит уменьшение ${{{\text{C}}}_{{{\text{орг}}}}},$ далее содержание органического углерода с глубиной не меняется для всех исследуемых бассейнов. Концентрации ${{{\text{C}}}_{{{\text{орг}}}}}$ в бухтах Воевода и Новгородская в нижнем слое осадков примерно в 1.5 раз выше в сравнении с заливом Угловой. Более резкое уменьшение ${{{\text{C}}}_{{{\text{орг}}}}}$ наблюдается в верхних горизонтах для осадков, покрытых ЗМ, что, по-видимому, обусловлено более активной кажущейся деградацией ОВ в верхнем слое осадков. Значения ${{{\text{C}}}_{{{\text{dep}}}}}$ в толще осадка в 1 м (Fourqurean et al., 2014), в отсутствии морской травы для бухт Воевода, Новгородская и залива Угловой был 140, 99 и 55 тС/га, соответственно. Присутствие морской травы существенно повышает эту величину: 180, 126 тС/га для бухт Воевода и Новгородская, соответственно (табл. 2). Абсолютные значения депонированного органического углерода равны произведению площади бассейна на величину ${{{\text{C}}}_{{{\text{dep}}}}},$ рассчитываемую по уравнению (2). Площадь исследуемых бассейнов равна 400, 3100 и 4200 га для бухт Воевода, Новгородская и залива Угловой, соответственно (Лоция, 1996). Приняв, что 86 га площади б. Воевода покрыто ЗМ (Барабанщиков и др., 2018), половина площади б. Новгородская покрыта ЗМ (Блиновская, 2001; Вышкварцев, Пешеходько, 1982) были рассчитаны абсолютные значения депонированного углерода в осадках, толщиной в 1 м покрытых лугами ЗМ – 15 300 и 195 300 тС в бухтах Воевода и Новгородская, соответственно. Общее содержание депонированного углерода в слое 1 м равно 59 400, 349 000, 231 000 тС, для бухт Воевода, Новгородская и залив Угловой, соответственно.
Рис. 2.
Осредненные вертикальные профили органического углерода (% С) в сухом осадке (а) в бухтах Воевода (1, 2), Новгородская (3, 4), заливе Угловой (5) и содержание органического углерода в тоннах на площадь в 1 гектар по глубине осадка (б) в бухтах Воевода (1, 2), Новгородская (3, 4), залив Угловой (5). Профили 1, 3 соответствуют донным осадкам, на которых присутствует морская трава (зостера морская), профили 2, 4, 5 соответствуют донным осадкам, на которых отсутствует морская трава. Пунктирными линиями отмечена область экстраполяции.
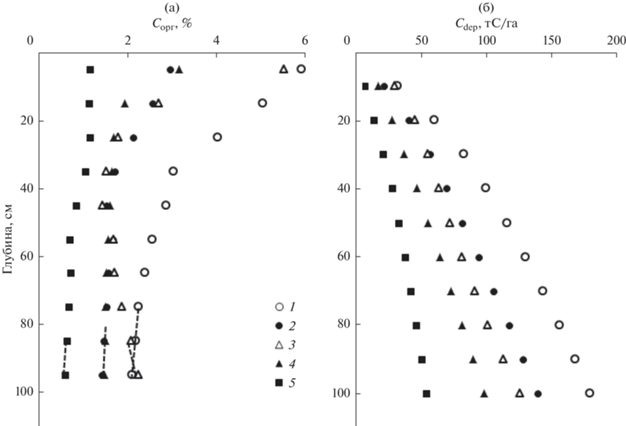
Таблица 2.
Результаты расчетов: депонированный углерод, ${{{\text{C}}}_{{{\text{dep}}}}}$ (тС/га); скорость аккумуляции депонированного углерода, ${{R}_{{{{{\text{C}}}_{{{\text{dep}}}}}}}},$ гС/(м2год); коэффициенты биотурбации Db, см2/сут; устойчивый к разложению органический углерод, ${{C}_{\infty }}$ (%, в сухом осадке); – углы наклона зависимости на рис. 4, ${{({{k}_{С}}{{D}_{b}})}^{{0.5}}};$ квадрат линейной корреляции на рис. 4, ${{R}^{2}};$ кажущиеся константы деградации органического углерода, $k_{d}^{C}$ (сут–1); кажущаяся скорость разложения органического вещества
| Бассейн | ${{{\text{C}}}_{{{\text{dep}}}}}$ | ${{R}_{{{{{\text{C}}}_{{{\text{dep}}}}}}}}$ | Db | ${{C}_{\infty }}$ | ${{({{k}_{С}}{{D}_{b}})}^{{0.5}}}$ | ${{R}^{2}}$ | $k_{d}^{C}$ |
|---|---|---|---|---|---|---|---|
| Воевода-1 | 180 | 144 | 62.7 | 1.90 | –0.030 | 0.99 | 0.068 |
| Воевода-2 | 140 | 98 | 6.6 | 1.39 | –0.037 | 0.92 | 0.009 |
| Новгородская-1 | 126 | 101 | 56.2 | – | – | – | – |
| Новгородская-2 | 99 | 69 | 13.0 | 1.45 | –0.036 | 0.91 | 0.017 |
| Угловой | 55 | 17 | 5.3 | 0.50 | –0.024 | 0.94 | 0.003 |
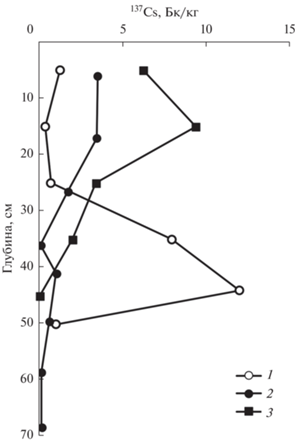
Результаты измерений активности 137Cs в донных осадках представлены на рис. 3. Для ст. 10 в заливе Угловой и ст. 6 в б. Воевода активности 137Cs имеют выраженные максимумы на горизонтах 15 и 44 см, соответственно. Для ст. 7 б. Воевода максимум активности 137Cs слабо выражен на глубине осадка 41 см. Нечеткость пика может быть связана с процессами биотурбации на момент формирования слоя с высокой активностью 137Cs, т.е. в 1963 г. (Walling, Qingping, 1992). Приняв, что максимальная активность цезия в атмосфере датируется 1963 г., а донные осадки на ст. 6, 7 и 10 были взяты в 2019 году (табл. 1), скорость осадконакопления составила 3 мм/год (ст. 10), 7 мм/год (ст. 7) и 8 мм/год (ст. 6). Ранее скорость осадконакопления в северной части Амурского залива была определена с помощью радиоизотопа 210Pb и оказалась равной 7.2 мм/год (Аникиев и др., 1996) и 3.6–5.2 мм/год (Астахов и др., 2015). Полученные ранее результаты, хорошо согласуются с нашими оценками. Приняв, что скорости осадконакопления в б. Воевода и б. Новгородская равны в присутствии ЗМ (${{R}_{S}}$(ст. 6) = ${{R}_{S}}$(ст. 14)) и в отсутствии ЗМ (${{R}_{S}}$(ст. 7) = ${{R}_{S}}$(ст. 13)), были рассчитаны скорости аккумуляции ${{{\text{C}}}_{{{\text{dep}}}}},$ ${{R}_{{{{{\text{C}}}_{{{\text{dep}}}}}}}},$ включая б. Новгородская, которые представлены в табл. 2.
Рис. 3.
Вертикальные профили активности 137Cs в бухте Воевода, (1) – ст. 6, (2) – ст. 7; в зал. Угловой (3) – ст. 10. Профиль 1 соответствуют донным осадкам, на которых присутствует морская трава (зостера морская); профили 2, 3 соответствуют донным осадкам, на которых отсутствует морская трава.
Из результатов измерений концентрации хлорофилла а в донных осадках бухты Воевода, покрытых лугами ЗМ, в 2018, 2019 гг. по уравнению (3) были получены коэффициенты биотурбации 107.6 и 17.7 см2/cут (среднее значение 62.7). В отсутствии ЗМ, коэффициент биотурбации в б. Воевода составил 6.6 см2/сут. Для бухты Новгородская были получены коэффициенты биотурбации в присутствии ЗМ и в отсутствии ЗМ 56.2 и 13.0, соответственно. Для залива Угловой, средняя величина коэффициента биотурбации, полученная из результатов измерений хлорофилла в донных осадках 2018 и 2019 гг. – 5.3 см2/сут. Константы кажущейся деградации ОВ, $k_{d}^{C},$ были получены из средних профилей ${{{\text{C}}}_{{{\text{орг}}}}}$ (рис. 2а) и уравнения (4). Необходимое значение ${{{\text{C}}}_{\infty }},$ входящее в уравнение (4), подбиралось таким образом, чтобы коэффициент линейной корреляции был максимальным. Примеры расчетов для бухты Воевода, дно которой покрыто ЗМ, и для залива Угловой показаны на рис. 4. Данный подход нельзя было использовать для случая бухты Новгородской, покрытой лугами ЗМ, поскольку профиль ${{{\text{C}}}_{{{\text{орг}}}}}$ на горизонте 45 см проявляла явный минимум (рис. 2а).
Рис. 4.
Зависимость $\ln (C - {{C}_{\infty }})$ от глубины осадка. 1 – бухта Воевода, донный осадок покрыт ZM, ${{{\text{C}}}_{\infty }}\,\,({\text{гС}}\,{\text{с}}{{{\text{м}}}^{{ - 3}}}) = 1.90;$ 2 – залив Угловой ${{{\text{C}}}_{\infty }}\,\,({\text{гС}}\,{\text{с}}{{{\text{м}}}^{{ - 3}}}) = $ $ = 0.50.$
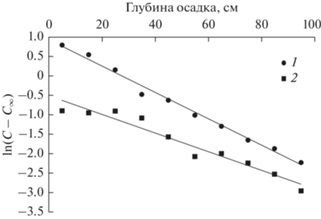
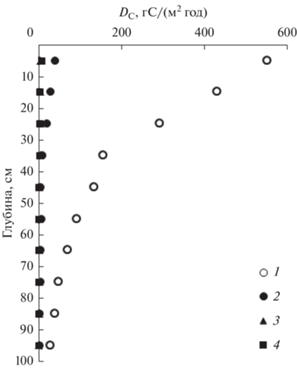
Используя соотношение (5), были рассчитаны скорости кажущейся деградации депонированного углерода в слоях донных отложений исследуемых бухт. Результаты представлены на рис. 5.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Донные осадки, покрытые лугами ЗM, содержат наиболее высокие ${{{\text{C}}}_{{{\text{орг}}}}}$ (рис. 2; табл. 2). Эти результаты подтверждают общую идею, что прибрежные экосистемы с лугами ЗM являются эффективными в отношении продукции ОВ с последующим его захоронением в донных осадках. Особенность лугов ЗM состоит в том, что, во-первых, они характеризуются высокой продукционной способностью, что отмечается многими исследователями (McRoy, 1974; Бергер, 2011). Во‑вторых, на поверхности листьев ЗM растет много организмов, представителей, как флоры, так и фауны (эпифитон). Годовая продукция эпифитона составляет, как правило, 20–70% от первичной продукции морских трав (Лысенко, 1985; Heijs, 1984; Mateo et al., 2006). В-третьих, ЗM создает условия, при которых усиливается седиментация взвешенных частиц и организмов в донные осадки (Agawin, Duarte, 2002; Hendriks et al., 2008). В-четвертых, луга ЗM ограничивают ре-суспензию тонкого пелитового материала в поверхностном слое донных отложений. Этими особенностями мы объясняем высокую скорость аккумуляции ${{{\text{C}}}_{{{\text{dep}}}}}$ в акваториях с лугами ЗM (табл. 2). Сравнительно низкая скорость осадконакопления и низкие значения Сорг донных осадков залива Угловой обусловлены, на наш взгляд, аэробной деструкцией ОВ на границе раздела вода/осадок, усиленной ре-суспензией верхнего слоя осадка. Этот вывод подтверждается чрезвычайно высокой мутностью вод, результатами подводного фотографирования и высоким парциальным давлением углекислого газа (Тищенко и др., 2021).
Значения ${{{\text{C}}}_{{{\text{dep}}}}},$ исследуемых бассейнов, получены в диапазоне от 55 (зал. Угловой) до 180 (б. Воевода) тС/га (табл. 2), которые находятся в диапазоне опубликованных величин для разных акваторий Мирового океана 24 (Indopacific) – 372 тС/га (Mediterranean) (Fourqurean et al., 2014). Абсолютные значения депонированного углерода бассейнами определяются произведением ${{{\text{C}}}_{{{\text{dep}}}}}$ на площадь бассейна. Из полученных данных следует, что абсолютные значения депонированного углерода в 1-метровом слое бухт Воевода, Новгородская и залива Угловой равны, соответственно 59 400, 349 000, 231 000 тС. Таким образом, решающее значение имеет площадь исследуемой акватории.
Скорость аккумуляции ОВ на морском шельфе изменяется в широких пределах от 4.3 до 198 гС/(м2 год) (Duarte et al., 2013; Röhr et al., 2016; Prentice et al., 2020). Результаты, полученные в данной работе, находятся в указанном диапазоне (табл. 2). В местах поселения ЗМ скорость аккумуляции ОВ была существенно выше: 101 и 144 гС/(м2 год) в бухтах Новгородская и Воевода, соответственно. Эти результаты также хорошо согласуются с опубликованной средней скоростью накопления ОВ в бассейнах покрытых лугами морских трав – 138 ± 38 гС/(м2 год) (Mcleod et al., 2011). Следует отметить, что аккумуляция ОВ происходит на фоне его деградации, что следует из профилей ${{{\text{C}}}_{{{\text{орг}}}}}{\text{,}}\,{\text{\% }}$ (рис. 2а). Представленные в табл. 2 кажущиеся константы деградации ОВ хорошо согласуются с опубликованными в литературе для прибрежных акваторий (0.009–0.022 сут–1, Mateo et al., 2006).
Рассчитанные для разных горизонтов скорости кажущейся деградации ОВ уменьшаются с глубиной осадка. Предельная величина ${{{\text{C}}}_{\infty }}$ соответствует концентрации трудно-разлагаемого ОВ. Из исследуемых бассейнов максимальная концентрация трудно-разлагаемого ${{{\text{C}}}_{{{\text{орг}}}}}$ (1.9%) соответствует донным осадкам б. Воевода, покрытым ЗM. Это не удивительно, т. к. ЗM содержит в себе клетчатку, лигнин и танины – устойчивые к разложению (Mateo et al., 2007). Максимальные скорости деградации ОВ соответствуют верхним горизонтам (рис. 5): 550, 39, 6 и 4 гС/(м2 год), соответственно, б. Воевода с лугами ЗМ, б. Воевода в отсутствии ЗМ, зал. Угловой, б. Новгородская в отсутствии ЗМ.
Наши оценки согласуются с результатами измерений скорости деградации ЗМ, которые находятся в диапазоне 55–1150 гС/(м2 год) (Mateo et al., 2007). Профили ${{{\text{C}}}_{{{\text{орг}}}}},$ полученные для донных осадков б. Воевода в разные сезоны и разные годы, мало отличаются друг от друга и от среднего профиля, представленного на рис. 2а. Таким образом, ежегодный поток ОВ должен быть равен сумме скоростей его аккумуляции и деградации, что по нашим оценкам равно 1983 гС/(м2 год) или 5.4 гС/(м2 день). Суточная продукция ОВ лугами ЗМ находится в диапазоне 0.1–18.7 гС/(м2 день), а средние значения 0.5–2.0 гС/(м2 день). Высокая скорость кажущейся деградации ${{{\text{C}}}_{{{\text{dep}}}}}$ для б. Воевода указывает на две неопределенности, связанные с оценкой депонированного углерода в местах заселения ЗМ. Во-первых, часть углерода в верхнем слое донных отложений, в пределах 40 см, не захоранивается, а превращается в биомассу живых морских организмов с неизвестным, но, очевидно, более коротким “временем жизни” углерода в них. Во-вторых, если по каким-либо причинам на дне б. Воевода исчезнут луга ЗМ, т.е. нарушится условие стационарности, то профиль ${{{\text{C}}}_{{{\text{орг}}}}}$ для б. Воевода станет похожим на тот, который мы наблюдаем сейчас для залива Угловой вне зависимости от места отбора керна. Возможность изменения профиля и абсолютного содержания ${{{\text{C}}}_{{{\text{орг}}}}}$ в донных осадках в связи с исчезновением морских трав является одной из ключевых проблем, которые требуют дальнейшего изучения (Macreadie et al., 2019).
ЗАКЛЮЧЕНИЕ
Полученные результаты доказывают, что, луга ZM формируют донные осадки с очень высоким содержанием ${{{\text{C}}}_{{{\text{dep}}}}}$ 180, 126 тС/га для бухт Воевода и Новгородская и высокой скоростью его аккумуляции, соответственно 144, 101 гС/(м2 год). Эти данные указывают на перспективность международных и национальных инициатив по восстановлению лугов ЗМ, площади которых в настоящее время уменьшаются. Расширение площадей заселяемых морскими травами рассматривается как технология сдерживания роста атмосферного углекислого газа, способная на 2.5 года предотвратить его рост в атмосфере (Gattuso et al., 2021).
В тоже время, для осадков, заселенных лугами ЗМ, характерна высокая скорость кажущейся деградации ОВ – 550 гС/(м2 год), для верхнего 10 см слоя б. Воевода. Этот результат указывает на неустойчивость высокой концентрации ${{{\text{C}}}_{{{\text{орг}}}}}$ в верхнем слое донных осадков. При изменении внешних условий, приводящих к уменьшению скорости поступления ОВ в донные осадки, по-видимому, произойдет сокращение запасов ${{{\text{C}}}_{{{\text{dep}}}}}$ в верхнем слое осадков. Несмотря на эту неопределенность луга ZM обеспечивают максимальную концентрацию трудно-разлагаемого ОВ (${{{\text{C}}}_{{{\text{орг}}}}} = {\text{1}}{\text{.9\% }}$ в донных осадках б. Воевода), что вновь поддерживает идею о восстановлении и расширении площадей лугов ЗМ.
Работа выполнена при финансовой поддержке гранта РФФИ, 20-05-00381 и программ фундаментальных научных исследований, темы 121-21500052-9, 121021700346-7.
Список литературы
Аникеев В.В., Дударев О.В., Касаткина А.П., Колесов Г.М. (1996) Влияние терригенных и биогенных факторов на формирование седиментационных потоков химических элементов в прибрежной зоне Японского моря. Геохимия. (1), 59-72.
Астахов А.С., Калугин И.А., Аксентов К.И., Дарьин А.В. (2015) Геохимические индикаторы палеотайфунов в шельфовых отложениях. Геохимия. (4), 387-392.
Astakhov A.S., Aksentov K.I., Kalugin I.A., Dar’ina A.V. (2015) Geochemical indicators of paleo-typhoon in shelf sediments. Geochem. Int. 53(4), 383-388.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю., Михайлик Т.А., Косьяненко А.А. (2018) Условия образования лечебных грязей в бухте Воевода (Амурский залив, Японское море). Известия ТИНРО. 192, 167-176.
Бергер В.Я. (2011) О продукции зестеры Zostera Marina Linnaeu, 1753 в Белом море. Биология моря. 37(5), 362-366.
Блиновская Я.Ю. (2001) Ландшафтная характеристика и оптимизация природопользования в прибрежно-морской зоне залива Посьета. Дис. … канд. геогр. наук: 25.00.36. Владивосток, 225 с.
Вышкварцев Д.И., Пешеходько В.М. (1982) Картирование доминирующих видов водной растительности и анализ их роли в экосистеме мелководных бухт залива Посьета Японского моря. Подводные гидробиологические исследования. Владивосток: ДВНЦ АН СССР, 120-129.
Гаврилова Г.С., Кондратьева Е.С. (2018) Результаты хозяйственной деятельности и проблемы развития марикультуры залива Посьета (Японское море) в 2000–2015 гг. Известия ТИНРО. 195, 229-243.
Купцов В.М. (1986) Абсолютная геохронология донных осадков и морей. М: Наука, 271 с.
Лоция северо-западного берега Японского моря (1996) СПб.: ГУНИО МО, 354 с.
Лысенко В.Н. (1985) Продукция макробентоса сообщества Zostera marina в северо-западной части Японского моря. Дис. … канд. биол. наук. Владивосток: АНСССР, ДВНЦ, 187 с.
Марьяш А.А., Ходоренко Н.Д., Звалинский В.И., Тищенко П.Я. (2015) Органический углерод в эстуарии реки Раздольная (Амурский залив, Японское море) в период ледостава. Геохимия. (8), 734-742.
Mar’yash A.A., Khodorenko N.D., Zvalinskii V.I., Tishchenko P.Ya. (2015) Organic Carbon in the Razdol’naya River Estuary (Amur Bay, Sea of Japan) during the Period of Ice Cover. Geochem. Int. 53(8), 726-734.
Паймеева Л.Г. (1984) Биология Zostera Marina L. и Zostera Asiatica Miki Приморья. Дис. … канд. биол. наук. Владивосток: Тихоокеанский научно-исследовательский институт рыбного хозяйства и океанографии, 183 с.
Раков В.А. (2010) Распространение и экология устричных рифов северной части Амурского залива. Экологический вестник. (4), 21-30.
Русаков В.Ю., Борисов А.П., Соловьева Г.Ю. (2019) Скорости седиментации (по данным изотопного анализа 210Pb и 137Cs) в разных фациально-генетических типах донных осадков Карского моря. Геохимия. 64(11), 1158-1174.
Rusakov V.Yu., Borisov A.P., Solovieva G.Yu. (2019) Sedimentation Rates in Different Facies–Genetic Types of Bottom Sediments in the Kara Sea: Evidence from the 210Pb and 137Cs Radionuclides. Geochem. Int. 57(11), 1185-1200.
Тищенко П.Я., Барабанщиков Ю.А., Павлова Г.Ю., Рюмина А.А., Сагалаев С.Г., Семкин П.Ю., Тищенко П.П., Уланова О.А., Швецова М.Г., Шкирникова Е.М., Тибенко Е.Ю. (2021) Гидрохимическое состояние залива Угловой (Амурский залив) в разные сезоны. Изв. ТИНРО. 201(1), 138-157.
Тищенко П.Я., Медведев Е.В., Барабанщиков Ю.А., Павлова Г.Ю., Сагалаев C.Г., Тищенко П.П., Швецова М.Г., Шкирникова Е.М., Уланова О.А., Тибенко Е.Ю., Орехова Н.А. (2020) Органический углерод и карбонатная система в донных отложениях мелководных бухт залива Петра Великого (Японское море). Геохимия. 65(6), 583-598.
Tishchenko P.Ya., Medvedev E.V., Barabanshchikov Yu.A., Pavlova G.Yu., Sagalaev S.G., Tishchenko P.P., Shvetsova M.G., Shkirnikova E.M., Ulanova O.A., Tibenko E.Yu., and Orekhova N.A. (2020) Organic Carbon and Carbonate System in the Bottom Sediments of Shallow Bights of the Peter the Great Bay (Sea of Japan). Geochem. Int. 58(6), 704-718.
Agawin N.S.R., Duarte C.M. (2002) Evidence of direct particle trapping by a tropical seagrass meadow. Estuaries. 25(6A), 1205-1209.
Blue Carbon. A Rapid Response Assessment. (2009). (Eds. Nellemann C., Corcoran E., Duarte C. M., Valdés L., De Young C., Fonseca L., Grimsditch G.). United Nations Environment Programme, GRID-Arendal, ISBN: 978-82-7701-060-1. Printed by Birkeland Trykkeri AS, Norway, 80p.
De La Rocha C.L. and Passow U. (2014) The biological pump. Treatise on Geochemistry, 2nd edition (Eds. Holland, H.D., Turekian, K.K.). Elsevier: Oxford, 8, 93-122.
Duarte C.M., Kennedy H., Marba N., and Hendriks I. (2013) Assessing the capacity of seagrass meadows for carbon burial: Current limitations and future strategies. Ocean Coast. Man. 83, 32-38.
Duarte C.M., Marbà N., Gacia E., Fourqurean J.W., Beggins J., Barrón C., Apostolaki E.T. (2010) Seagrass community metabolism: Assessing the carbon sink capacity of seagrass meadows. Global Biogeochem. Cycles. 24, GB4032, https://doi.org/10.1029/2010GB003793
Emerson S. and Hedges J. (2006) Sediment Diagenesis and Benthic Flux. Treatise on Geochemistry, Elsevier: Amsterdam, 6, 293-319.
Fourqurean J., Johnson B., Kauffman J.B., Kennedy H., Lovelock C., Megonigal J.P., Rahman A., Saintilan N., Simard M. (2014) Coastal Blue Carbon: Methods for assessing carbon stocks and emissions factors in mangroves, tidal salt marshes, and seagrasses. (Eds. Howard J., Hoyt S., Isensee K., Telszewski M., Pidgeon E.). Conservation International, Intergovernmental Oceanographic Commission of UNESCO, International Union for Conservation of Nature. Arlington, Virginia, USA, 181p.
Gattuso J.P., Williamson P., Duarte C.M. and Magnan A.K. (2021) The Potential for Ocean-Based Climate Action: Negative Emissions Technologies and Beyond. Front. Clim. 2, 575716. https://doi.org/10.3389/fclim.2020.575716
Heijs F.M.L. (1984) Annual biomass and production of epiphytes in three monospecific seagrass communities of thalassia hemprichii (ehrenb.) aschers. Aquatic Botany. 20, 195-218.
Hendriks I.E., Tomas Sintes T., Bouma T.J., Duarte C.M. (2008) Experimental assessment and modeling evaluation of the effects of the seagrass Posidonia oceanica on flow and particle trapping. Mar. Ecol. Prog. Ser. 356, 163-173.
Jeffrey S.W., Humphrey G.F. (1975) New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem. Physiol. Pflanz. 167(2), 191-194.
Macreadie P.I., Anton A., Raven J.A., Beaumont N., Connolly R.M., Friess D.A., Kelleway J.J., Kennedy H., Kuwae T., Lavery P.S., Lovelock C.E., Smale D.A., Apostolaki E.T., Atwood T.B., Baldock J., Bianchi T.S., Chmura G.L., Eyre B.D., Fourqurean J.W., Hall-Spencer J.M., Huxham M., Hendriks I.E., Krause-Jensen D., Laffoley D., Luisetti T., Marbà N., Masque P., McGlathery K.J., Megonigal J.P., Murdiyarso D., Russell B.D., Santos R., Serrano O., Brian R. Silliman B.R., Watanabe K., Duarte C.M. (2019) The future of Blue Carbon science. Nature Communications. https://doi.org/10.1038/s41467-019-11693-w
Mateo M.A., Cebrian J., Dunton K., Mutchler T. (2006) Carbon flux in seagrass ecosystems. In A.W.D. Larkum, R. J. Orth, C. M. Duarte [eds.]. Seagrasses: Biology, ecology and conservation. Springer, 159-192.
Mcleod E., Chmura GL., Bouillon S., Salm R., Björk M., Duarte C.M., Lovelock C.E., Schlesinger W.H., and Brian R Silliman B.R. (2011) A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2. Front Ecol Environ. 9(10), 552-560.
McRoy C.P. (1974) Seagrass productivity: carbon uptake experiments in eelgrass, Zostera Marina. Aquaculture. 4, 131-137.
Martens C.S., Berner R.A. (1977) Interstitial water chemistry of anoxic Long Island Sound sediments. 1. Dissolved gases. Limnol. Oceanogr. 22, 10-25.
Prentice C., Poppe K.L., Lutz M., Murray E., Stephens T.A., Spooner A., Hessing-Lewis M., Sanders-Smith R., Rybczyk J.M., Apple J., Short F.T., Gaeckle J., Helms A., Mattson C., Raymond W.W., Klinger T. (2020). A synthesis of blue carbon stocks, sources, and accumulation rates in eelgrass (Zostera marina) meadows in the Northeast Pacific. Global Biogeochemical Cycles. 34, e2019GB006345. https://doi.org/10.1029/2019GB006345
Röhr M.E., Boström C., Canal-Vergés P., Holmer M. (2016) Blue carbon stocks in Baltic Sea eelgrass (Zostera marina) meadows. Biogeosciences. 13, 6139-6153.
Serrano O., Lavery P.S., Rozaimi M., Mateo M.A.Â. (2014) Influence of water depth on the carbon sequestration capacity of seagrasses. Global Biogeochem. Cycles. 28, 950-961.
Sun M., Aller R.C., Lee C. (1991) Early diagenesis of chlorophyll-a in Long Island Sound sediments: A measure of carbon flux and particle reworking. J. Mar. Res. 49, 379-401.
Tsabaris C., Kapsimalis V., Eleftheriou G., Laubenstein M., Kaberi H., Plastino W. (2012) Determination of 137Cs activities in surface sediments and derived sediment accumulation rates in Thessaloniki Gulf, Greece. Environm. Earth Sci. 67, 833-843.
Walling D.E. and Qingping He. (1992) Interpretation of caesium-137 profiles in lacustrine and other sediments: the role of catchment-derived inputs. Hydrobiologia. 235/236, 219-230.
Дополнительные материалы отсутствуют.